Adaptación del algoritmo MARACAS para segmentación de la arteria carótida y cuantificación de estenosis en imágenes TAC
Palabras clave:
segmentación cardiovascular, estenosis, tomografía computarizada, arteria carótida. (es)ADAPTACIÓN DEL ALGORITMO MARACAS PARA SEGMENTACIÓN DE LA ARTERIA CARÓTIDA Y CUANTIFICACIÓN DE ESTENOSIS EN IMÁGENES TAC
Adaptation of the MARACAS Algorithm for Carotid Artery Segmentation and Stenosis Quantification on CT Images
MARIA A. ZULUAGA1,2, M.Sc.; MACIEJ ORKISZ2, Ph. D.; EDGAR J.F. DELGADO1, B.Sc.; VINCENT DORÉ1,3, Ph. D.; ALFREDO MORALES PINZÓN1, B.Sc.; MARCELA HERNÁNDEZ HOYOS1, Ph. D. 1Grupo IMAGINE, Grupo de Ingeniería Biomédica, Universidad de los Andes. Bogotá, D.C., Colombia. 2CREATIS; Université de Lyon; Université Lyon 1; INSA-Lyon; CNRS UMR5220; Inserm U630; F-69621 Villeurbanne, France. 3Synchromedia, École de Technologie Supérieure, University of Quebec, Montreal, QC, H3C 1K3, Canada. Correspondencia: Marcela Hernández Hoyos, Universidad de los Andes. Carrera 1 Este # 19A 40 - Of. ML769, AA 4976. Bogotá, D.C., Colombia. marc-her@uniandes.edu.co
Presentado 12 de marzo de 2010, aceptado 4 de junio de 2010, correcciones 21 de junio de 2010.
RESUMEN
En este artículo se describen las adaptaciones hechas al algoritmo MARACAS para segmentar y cuantificar estructuras vasculares en imágenes TAC de la arteria carótida. El algoritmo MARACAS, que está basado en un modelo elástico y en un análisis de los valores y vectores propios de la matriz de inercia, fue inicialmente diseñado para segmentar una sola arteria en imágenes ARM. Las modificaciones están principalmente enfocadas a tratar las especificidades de las imágenes TAC, así como la presencia de bifurcaciones. Los algoritmos implementados en esta nueva versión se clasifican en dos niveles. 1. Los procesamientos de bajo nivel (filtrado de ruido y de artificios direccionales, presegmentación y realce) destinados a mejorar la calidad de la imagen y presegmentarla. Estas técnicas están basadas en información a priori sobre el ruido, los artificios y los intervalos típicos de niveles de gris del lumen, del fondo y de las calcificaciones. 2. Los procesamientos de alto nivel para extraer la línea central de la arteria, segmentar el lumen y cuantificar la estenosis. A este nivel, se aplican conocimientos a priori sobre la forma y anatomía de las estructuras vasculares. El método fue evaluado en 31 imágenes suministradas en el concurso Carotid Lumen Segmentation and Stenosis Grading Grand Challenge 2009. Los resultados obtenidos en la segmentación arrojaron un coeficiente de similitud de Dice promedio de 80,4% comparado con la segmentación de referencia, y el error promedio de la cuantificación de estenosis fue 14,4%.
Palabras clave: segmentación cardiovascular, estenosis, tomografía computarizada, arteria carótida.
ABSTRACT
This paper describes the adaptations of MARACAS algorithm to the segmentation and quantification of vascular structures in CTA images of the carotid artery. The MARACAS algorithm, which is based on an elastic model and on a multi-scale eigen-analysis of the inertia matrix, was originally designed to segment a single artery in MRA images. The modifications are primarily aimed at addressing the specificities of CT images and the bifurcations. The algorithms implemented in this new version are classified into two levels. 1. The low-level processing (filtering of noise and directional artifacts, enhancement and pre-segmentation) to improve the quality of the image and to pre-segment it. These techniques are based on a priori information about noise, artifacts and typical gray levels ranges of lumen, background and calcifications. 2. The high-level processing to extract the centerline of the artery, to segment the lumen and to quantify the stenosis. At this level, we apply a priori knowledge of shape and anatomy of vascular structures. The method was evaluated on 31 datasets from the Carotid Lumen Segmentation and Stenosis Grading Grand Challenge 2009. The segmentation results obtained an average of 80:4% Dice similarity score, compared to reference segmentations, and the mean stenosis quantification error was 14.4%.
Key words: vascular segmentation, stenosis, Computed Tomography, carotid artery.
INTRODUCCIÓN
La arteriosclerosis es una enfermedad degenerativa caracterizada por el estrechamiento progresivo de las arterias. Su desarrollo se debe a la acumulación de lípidos, células fibrosas, células musculares, cristales de colesterol y calcificaciones en las paredes arteriales. Estos depósitos forman lo que se conoce como placas ateroscleróticas o de ateroma, las cuales, poco a poco obstruyen las arterias, dando origen a la estenosis arterial. La problemática médica asociada a esta patología es extremadamente importante. La mortalidad por enfermedades cardiovasculares es de aproximadamente 30% a nivel mundial. En Colombia, la cardiopatía isquémica es la primera causa de mortalidad por enfermedad en personas mayores de 45 años. La enfermedad coronaria representa el 12,3% de los años de vida saludables perdidos por enfermedad no transmisible y es la segunda causa de muerte después de los homicidios y de la violencia (Merlano, 2004). El infarto cerebral, por su parte, no es una entidad esencialmente mortal, pero consume recursos post-hospitalarios en magnitud inmensa y creciente (Muñoz, 1999). Aproximadamente 750.000 personas experimentan un evento cerebrovascular isquémico al año en Estados Unidos. El 25% de esos eventos están relacionados con enfermedad oclusiva de las arterias carótidas extracraneales (Hanel et al., 2003).
La angiografía por rayos X convencional, el ultrasonido doppler, la tomografía axial computarizada (TAC) y la angiografía por resonancia magnética (ARM) son las técnicas más comúnmente utilizadas en diagnóstico, planeación del tratamiento y seguimiento de esta patología. Entre este conjunto de modalidades, el TAC ofrece dos ventajas que la hacen particularmente atractiva en la evaluación de patologías arteriales: la alta resolución de las imágenes 3D y la posibilidad de visualizar tanto lumen como calcificaciones y algunos componentes de placa hipodensa. Sin embargo, el análisis de estas imágenes requiere herramientas computacionales especializadas en visualización y cuantificación de estructuras vasculares, las cuales suponen una extracción preliminar de las estructuras a examinar, con el objetivo de reproducir en 3D el lumen vascular y de obtener así una representación precisa de la geometría de cada segmento. Esta extracción hace referencia al difícil problema de segmentación 3D.
En la literatura han sido reportadas múltiples técnicas de segmentación vascular en imágenes TAC (síntesis bibliográficas completas en este tema se encuentran en (Kirbas y Quek, 2004) y (Lesage, 2009). A pesar del amplio conocimiento que se ha generado en el tema y de la continua emergencia de nuevos métodos, la mayoría de las soluciones no son públicamente disponibles y las rutinas clínicas continúan basándose en operaciones manuales. La extracción de arterias sigue siendo un desafío para la comunidad de investigadores en procesamiento de imágenes. Las dificultades se deben principalmente a la complejidad de las estructuras ramificadas, la heterogeneidad de las intensidades, las alteraciones patológicas de las formas vasculares, el ruido y la presencia de artificios de reconstrucción.
Con el propósito de proveer un marco de evaluación estándar para comparar objetivamente el desempeño de diferentes métodos de segmentación vascular y cuantificación de estenosis en imágenes TAC (Cuisinaire, 2009) (Freiman et al., 2009) (Gülsün y Tek, 2009) (Krissian y García, 2009) (Mille et al., 2009) (Flórez Valencia et al., 2009) (Wong et al., 2009), fue organizado el concurso internacional CLS09 (Carotid Lumen Segmentation and Stenosis Quantification) llevado a cabo junto con la conferencia MICCAI 2009 (Hameeteman et al., 2009). Dentro de este evento, se presentó un método basado en el algoritmo MARACAS, objeto de estudio del presente artículo.
Contrariamente a los métodos directamente diseñados para imágenes TAC, tales como (Flórez Valencia et al., 2006), MARACAS fue originalmente concebido para ser aplicado en imágenes ARM (Hernández Hoyos et al., 2005) (Hernández Hoyos et al., 2006a) (Hernández Hoyos et al., 2006b) (Orkisz et al., 2008). El algoritmo está basado en un modelo elástico y en un análisis multiescala de la matriz de inercia y requiere que los vasos tengan una intensidad superior a la del fondo. En las imágenes ARM, el lumen arterial es resaltado, mientras que los tejidos estacionarios que lo rodean y en particular las placas de ateroma son eliminados por medio de una sustracción digital de dos conjuntos del mismo volumen, adquiridos antes y después de la inyección de un medio de contraste. En este caso, la arteria puede ser modelada como un sólido homogéneo rodeado por un fondo negro (o al menos de densidad baja comparada con la densidad de la arteria) y los momentos de inercia pueden ser calculados sobre la imagen original. En el caso de las imágenes TAC, el lumen es igualmente resaltado por un medio de contraste, pero los tejidos que lo rodean no son suprimidos. Pueden entonces aparecer en la imagen estructuras con mayor intensidad que el lumen (calcificaciones de la placa, huesos) o con menor intensidad (tejido adiposo de la placa). El método original de MARACAS ha sido adaptado para tratar la especificidad de las imágenes TAC. Las modificaciones fueron efectuadas en función del protocolo del concurso CLS09 (un punto semilla en cada rama de la arteria a segmentar) y son detalladas en este documento.
El presente artículo está organizado de la siguiente manera. La siguiente sección describe los métodos propuestos para segmentar la arteria carótida y cuantificar el porcentaje de estenosis, así como la plataforma de implementación, las imágenes procesadas y la metodología de evaluación. Posteriormente se presentan los resultados obtenidos en el marco del concurso CLS09. Discusión y conclusión son finalmente tratados en la última sección.
MATERIALES Y MÉTODOS
PROCESAMIENTO DE IMÁGENES
Los algoritmos implementados en la versión inicial de MARACAS son resumidos en la Figura 1A. El método original extrae un solo eje vascular sin ningún tratamiento preliminar de la imagen. Esta extracción se lleva a cabo a partir de un único punto de inicialización. La extracción del eje es seguida de una detección de contornos en los planos perpendiculares a dicho eje, por medio de un algoritmo de isocontornos con un isovalor local adaptativo. Para adaptar MARACAS a las imágenes TAC, fue necesario añadir una fase de preprocesamiento de bajo nivel (Fig. 1B, parte izquierda): filtrado, presegmentación y realce de las estructuras vasculares, cuyo propósito es mejorar la calidad de la imagen para su posterior segmentación. Estas técnicas están basadas en información a priori sobre el ruido, los artefactos y los intervalos típicos de niveles de gris del lumen, del fondo y de las calcificaciones.

El algoritmo de extracción del eje arterial no fue modificado. Sin embargo, con el propósito de segmentar la bifurcación carotidea y realizar la cuantificación de estenosis según el protocolo del concurso CLS09, se utilizaron tres puntos de inicialización, para extraer tres ejes diferentes (carótida común, carótida interna y carótida externa), localizar posteriormente el punto de bifurcación y definir automáticamente la región a cuantificar. La cuantificación propiamente dicha se basa en el mismo principio de isocontornos del método original.
Los procesamientos de alto nivel incluidos en el método completo pueden ser resumidos así (Fig. 1B, parte derecha): extracción de la línea central de la arteria, segmentación final a lo largo de la misma, localización del punto de bifurcación y selección de las secciones sana y patológica para la cuantificación de estenosis. A este nivel, se aplican conocimientos a priori sobre la forma y anatomía de las estructuras vasculares. A continuación se describen cada uno de estos procesamientos.
FILTRADO DEL RUIDO Y DE ARTEFACTOS DIRECCIONALES
Los algoritmos de segmentación son sensibles a las degradaciones de la imagen. Desafortunadamente, las imágenes TAC son propensas al ruido y otros artefactos. En particular, la calidad de las imágenes de arterias carótidas es frecuentemente degradada por un artefacto direccional que se manifiesta bajo la forma de estrías. Los artefactos direccionales son principalmente visibles a la altura de los hombros, se deben a la alta absorción de fotones cuando la señal atraviesa una sección prolongada del cuerpo, y están orientados entre -20 y 20 grados (Fig. 2A).

Es difícil realizar simultáneamente tres operaciones: eliminar el ruido, suprimir las estrías y preservar los contornos de las estructuras de interés. Por tal razón, dos filtros diferentes son utilizados: uno, dedicado únicamente a la supresión del ruido; otro, menos eficaz para eliminar el ruido, pero capaz de descartar las estrías, es aplicado únicamente al nivel de los hombros (Fig. 2B).
El primer filtro combina el enfoque clásico Non-Local Means Filter (Buades y Morel, 2005) con su variante recientemente publicada Cp NL-Means Filter (Doré y Cheriet, 2009). Debido a que esta variante es más lenta, es sólo utilizada en algunos cortes de prueba para estimar el parámetro de regularización empleado posteriormente por el filtro clásico, aplicado a la imagen entera.
El segundo filtro utiliza la transformada Dual-Tree Complex Wavelet, la cual descompone cada imagen (corte 2D) mediante seis onditas direccionales. Dos de estas corresponden al intervalo de las orientaciones sobre la cuales se encuentran ubicadas las estrías. Los coeficientes de la imagen transformada son modificados, para atenuar las estrías y el ruido, de dos formas diferentes. Para las orientaciones sobre las cuales no se espera encontrar artificios, se procede al filtrado a través del bivariate shrinkage (atenuación por funciones bivariadas) de los coeficientes. Para hacer esto, se construye un estimador maximum a posteriori de los coeficientes de la señal, considerando que la función de densidad de probabilidad (pdf) del ruido es Gaussiana (verificada experimentalmente por medio del test chi cuadrado) y la pdf de la señal es la propuesta por (Sendur y Selesnick, 2002). Se estima la varianza del ruido globalmente, para una dirección dada, utilizando un estimador robusto y simple (mediano), mientras que la varianza de la señal es calculada localmente como la diferencia entre la varianza de la señal con ruido y la estimación de la varianza del ruido.
Para las orientaciones sobre las cuales están ubicadas las estrías, es necesario distinguir las diferentes escalas: las escalas grandes en las cuales las estrías no son perceptibles y por consiguiente se utiliza también el filtro bivariate shrinkage, y las escalas más pequeñas (<2), en las cuales se aplica una umbralización de los coeficientes utilizando un umbral adaptativo, cuyo cálculo implica la estimación de la varianza del ruido en los rectángulos alargados según la dirección de las estrías.
PRESEGMENTACIÓN Y REALCE DE ESTRUCTURAS VASCULARES
Inicialmente se realiza una segmen-tación aproximada usando umbrales globales, para crear las siguientes clases: hueso/ calcificación, lumen, posible lumen (voxeles que típicamente pertenecen a los bordes y no se pueden clasificar en una categoría) y otros tejidos (Fig. 3B). Los valores de los umbrales fueron determinados empíricamente y dependen de si las arterias tienen alto o bajo contraste (Tabla 1). La decisión se basa en la comparación de la densidad promedio de los puntos semilla (más 26 vecinos de cada uno) y un umbral empírico T = 330 HU.
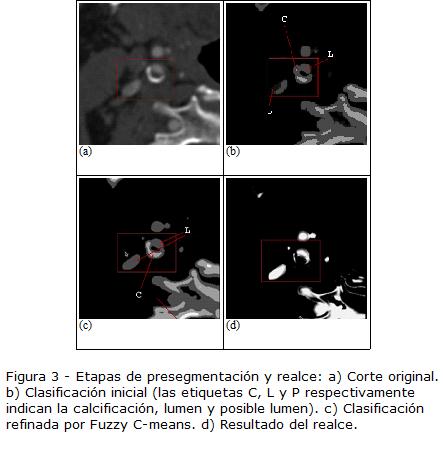

Después de esta etapa únicamente se elimina la clase -otros tejidos-. Las clases restantes se refinan mediante la técnica Fuzzy C-means para clasificar sólo las componentes que pertenecen a lumen (Fig. 3C). El resultado de la presegmentación se aplica como una máscara sobre la imagen original previamente al uso del clasificador. Cuatro clases iniciales diferentes (fondo, lumen, y dos clases para calcificaciones/huesos) demostraron ser suficientes para diferenciar el lumen de los otros tejidos. A partir del resultado de la clasificación, se crea una máscara M(x) que tiene el valor de 1 en los voxeles clasificados como lumen y 0 en el resto de la imagen.
La segmentación de imágenes basada en densidades no es a menudo lo suficientemente confiable, debido a la cercanía de estructuras con intensidades similares (i.e. la vena yugular). Para abordar este problema, se modifican los valores de las regiones presegmentadas y etiquetadas como lumen, haciendo uso de la magnitud del gradiente normalizado |∇I(x)|. Esto se realiza multiplicando M(x) por (1-|∇I(x)|). Se espera que esta operación genere valores cercanos a 1 cuando se encuentra cerca al centro de la arteria y valores bajos en los bordes. Para fortalecer la respuesta se utiliza la siguiente función exponencial:
V(x) = exp(k* M(x) *(1-|∇I(x)|)) (1)
Donde k es un parámetro de ajuste que controla la intensidad del filtro (k =0,3) y V(x) es la respuesta del filtro. La imagen original es finalmente multiplicada por V(x) (Fig. 3D). Extracción de las líneas centrales y corrección de la superficie. Debido a que las imágenes pueden contener regiones de bajo contraste donde es difícil segmentar usando sólo intensidades de la imagen, se incluye un modelo de arteria cilíndrico que se usa para la extracción del eje central de la arteria y posterior cuantificación de la estenosis. A continuación se explica brevemente el algoritmo. Más detalles pueden ser encontrados en publicaciones previas (Hernández Hoyos et al., 2005) (Hernández Hoyos et al., 2006) (Orkisz et al., 2008). El modelo representa la línea central con una curva que tiene elasticidad y flexibilidad limitadas, y que pasa por o cerca del centroide local. También caracteriza el radio del cilindro local por medio de los valores propios de la matriz de inercia. El algoritmo extrae la línea central de una arteria a partir de un punto dentro del lumen de la misma y contiene los siguientes pasos:
- Estimación (refinamiento) de la localización del punto actual, basado en información del centroide y restringido por la continuidad y condiciones de suavidad del eje.
- Estimación de la orientación local de la arteria, basada en el análisis de los valores propios de la matriz de inercia.
- Predicción del siguiente punto (candidato a pertenecer al eje) basado en la estimación de la orientación local.
Los momentos de primer y segundo orden que son usados en el algoritmo son calculados dentro de un sub-volumen esférico llamado celda de análisis. Se implementa un enfoque multi-escala para determinar el tamaño local más apropiado para la celda (el más cercano al diámetro local del vaso).
El proceso iterativo de extracción del eje se lleva a cabo en la imagen realzada, a partir del punto semilla, y se detiene cuando se encuentra con un límite del volumen de interés (VOI) o se encuentra con otro punto semilla.
Ya que la extracción del eje central comienza con un único punto, se generan tres líneas centrales diferentes: una por cada punto semilla (carótida común, carótida interna y carótida externa). Es posible que en el proceso de presegmentación se extraigan erróneamente algunas estructuras adyacentes. Para suprimirlas, se desliza a lo largo de cada uno de los ejes, una esfera de radio adaptativo. Este radio corresponde al radio local de la celda de análisis determinado en el enfoque multiescala. Los voxeles ubicados fuera de la esfera son rechazados.
IDENTIFICACIÓN DEL PUNTO DE BIFURCACIÓN Y CUANTIFICACIÓN DE LA ESTENOSIS
La detección de la bifurcación se basa en las tres líneas centrales extraídas previamente. Los tres ejes deben tener un segmento común y al menos uno de ellos diverge del resto en cierto punto. La detección de este punto identifica la bifurcación.
Ya que no es posible controlar hacia qué punto final se dirige la línea central durante su crecimiento, el primer paso consiste en detectar las dos líneas (de las tres) que divergen más (para garantizar que una de ellas va por la arteria carótida interna y la otra por la carótida externa). Cada par posible de ejes se comparan punto a punto, para determinar qué tan diferentes son. La suma de todas las diferencias genera una calificación. El par de líneas con la calificación más alta se selecciona para ser evaluado. Usando la distancia punto a punto, se detecta la región donde la distancia entre las líneas sobrepasa un umbral dado. Este punto se define como la bifurcación (Fig. 4). El análisis de la cuantificación se restringe a la zona que comienza en la bifurcación y termina en el punto que identifica la carótida interna. Usando la línea a lo largo de esta región y la imagen segmentada, se extraen los planos perpendiculares al eje. La cuantificación de la estenosis se lleva a cabo sobre dichos planos. En cada plano, se extrae la frontera del lumen por medio de iso-contornos y se determina el área del lumen y su diámetro mínimo. Una vez se han calculado las áreas y los diámetros mínimos del lumen en cada punto del eje, se procede a buscar la sección más patológica (la más angosta). El plano distal localizado 2 cm de la sección más patológica (en la dirección del punto de la carótida interna) se marca como la sección sana. Usando estas dos secciones, la cuantificación de estenosis se calcula siguiendo las definiciones del concurso (ver párrafo METODOLOGÍA DE EVALUACIÓN).

IMPLEMENTACIÓN CON CREATOOLS
A pesar de que el método presentado anteriormente es semi-automático, una interfaz gráfica de usuario (GUI) interactiva es necesaria tanto para la inicialización como para la evaluación visual de los resultados obtenidos. Tal GUI debe ser amigable y construida con componentes gráficos de alto nivel, de forma que pueda ser utilizada muy fácilmente por los usuarios médicos de la aplicación. Por otra parte, la fase de refinamiento del algoritmo requiere herramientas interactivas ad hoc adicionales para la definición de parámetros internos, para la selección del volumen de interés, etc. Estos aspectos de desarrollo, usualmente complejos, se simplifican haciendo uso de la plataforma de software CreaTools. Esta plataforma (http://www.creatis.insa-lyon.fr/site/en/CreaTools_home) incluye herramientas de programación (librerías, utilitarios...) desarrolladas específicamente para procesamiento y visualización de imágenes médicas. CreaTools es de código abierto y portable a diferentes sistemas operacionales (Windows, Linux, MacOSX). Se basa en el Black Box Toolkit (bbtk), el cual permite combinar fácilmente librerías heterogéneas existentes (itk, vtk, wxWidgets, KWWidgets ...) y las del usuario/desarrollador. Con este propósito, tanto algoritmos de procesamiento escritos en C/C++ como componentes gráficos interactivos son -envueltos- en una interfaz (black-box) genérica utilizable desde un programa C++ o vía un lenguaje script muy simple llamado bbs. De esta manera, varios métodos de procesamiento y componentes gráficos interactivos provenientes de diferentes librerías pueden ser interconectados para formar redes complejas de procesamiento. Numerosas cajas negras (black boxes) de gran utilidad están actualmente disponibles en paquetes estándar y nuevos paquetes pueden ser fácilmente adicionados por medio de un mecanismo de plug-in. En nuestra implementación, aprovechamos varios componentes existentes: GUI, escritores/lectores de datos, visualizadores de imágenes, módulos de interacción, y adicionamos nuestros propios algoritmos en nuevos paquetes.
DATOS
El método completo fue evaluado sobre la base de imágenes del concurso CLS09 actualmente disponibles al público1. 46 imágenes TAC fueron obtenidas de tres centros médicos diferentes: Erasmus Medical Center, Rotterdam, Holanda (EMC), Hadassah Hospital, Jerusalem, Israel (Hd), Hôpital Louis Pradel, Lyon, Francia (LP). De estas, 15 fueron utilizadas para la fase de entrenamiento del concurso y 31 para la evaluación propiamente dicha del método (fase de prueba). Las características de las imágenes son las siguientes (Tabla 2): 512x512 píxeles por plano, de 395 a 827 cortes en el volumen 3D, tamaño de píxel entre 0,26 y 0,55 mm2 y espesor de corte entre 0,45 y 0,6 mm. Las imágenes fueron adquiridas siguiendo los protocolos estándar de los hospitales mencionados anteriormente (Tabla 3), previendo un cubrimiento de la región comprendida entre la aorta ascendiente y la circulación intracraneana (2 cm arriba de la silla turca).


Vale la pena mencionar que las imágenes presentaban un amplio rango de grados de estenosis: desde lúmenes completamente sanos hasta estenosis severas (pre-oclusivas y oclusivas).
METODOLOGÍA DE EVALUACIÓN
Ambos métodos, segmentación de lumen y cuantificación de estenosis fueron evaluados sobre las 31 imágenes TAC suministradas por los organizadores del concurso en la fase de prueba. Los patrones de oro (lumen 3D y porcentaje de estenosis) fueron construidos a partir del trazado manual del eje y de los contornos de lumen, realizados por tres radiólogos expertos sobre todas las imágenes. En cada imagen, la evaluación se efectuó dentro de un volumen de interés, determinado de la siguiente manera: la arteria carótida común (ACC) fue delimitada en su extremo inferior por una distancia de 20 mm al punto de bifurcación; las arterias carótida interna (ACI) y externa (ACE) fueron delimitadas en su extremo superior por una distancia de 40 mm y 10 mm respectivamente, al punto de bifurcación.
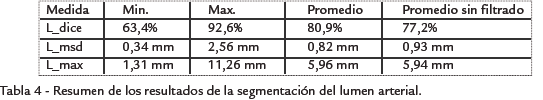
El lumen segmentado por el algoritmo fue comparado con el lumen de referencia, utilizando tres criterios: el coeficiente de similitud de Dice (L_dice) y las distancias máxima (L_max) y promedio (L_msd) de las superficies.
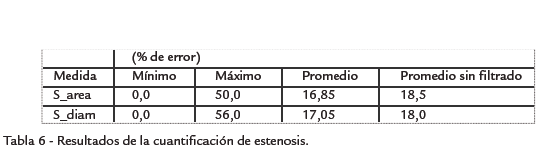
En cuanto a la evaluación de la precisión del porcentaje de estenosis, el error es calculado como la diferencia absoluta entre el valor de referencia y el valor determinado por el algoritmo, tanto en área (S_area) como en diámetro (S_diam). Detalles adicionales de la metodología de evaluación pueden ser encontrados en (Hameetman et al., 2009).
RESULTADOS Ejemplos de resultados cualitativos de la segmentación del lumen se muestran en la Fig. 5. La Tabla 4 presenta el resumen de los resultados cuantitativos de la segmentación del lumen. Los resultados detallados (Tabla 5) muestran que las imágenes más difíciles de procesar fueron las del hospital Louis Pradel, lo cual es conforme con la apreciación visual de la calidad de estas imágenes. Estos resultados muestran igualmente que la diferencia entre la superficie segmentada y la superficie de referencia fue en promedio inferior a dos píxeles, pero que localmente estas diferencias puedes ser mucho más importantes. Esto puede explicar por qué los resultados de la cuantificación, resumidos en la Tabla 6, fueron menos buenos. En efecto, si el error de segmentación es localmente grande al nivel de la estenosis, el error del porcentaje de estenosis estimado será igualmente grande. Ahora bien, las regiones con estenosis son las más difíciles de segmentar debido a las fuertes variaciones locales de contraste, provocadas sobre todo por la presencia de calcificaciones. Puede parecer sorprendente que los errores del grado de estenosis sean casi idénticos en términos de áreas y de diámetros. En efecto, para una sección circular, el error de la estimación del grado de estenosis en términos de diámetro es directamente proporcional al error de estimación del diámetro mismo (∇D), mientras que el error de estenosis en términos de área depende de ∇D al cuadrado, pero también del diámetro D. Sin embargo, para una sección de forma no circular y en particular fuertemente alargada, es posible que los errores en términos de área y de diámetro sean del mismo orden. Las Tabla 4 y Tabla 6 contienen igualmente los valores promedio de los resultados obtenidos sin la etapa preliminar de filtrado. Estos resultados muestran que el prefiltrado mejora la calidad de la segmentación. Sin embargo, es la etapa más costosa computacionalmente de toda la cadena de procesamiento.


En total, el tiempo promedio de ejecución del algoritmo es de 4 min., 15 seg. por arteria (ACI+ACE+ACC) aproximadamente en un computador PC estándar (procesador: Intel Core 2 Duo, velocidad del procesador: 2,4 GHz, memoria RAM: 3GB), el cual es descompuesto de la siguiente manera: - Segmentación: 3 min. 41 seg. - Cálculo de la estenosis: 35 seg.
Los otros métodos que participaron en la final del concurso CLS09 presentaron tiempos promedio de cálculo entre 1 y 15 minutos y los coeficientes de Dice entre 53,6 y 91,8%. MARACAS obtuvo el sexto puesto entre los ocho métodos capaces de entregar resultados en tiempo real en la fase final. Vale la pena anotar que alrededor de 100 grupos de investigación que publican en este dominio de investigación fueron invitados a participar y 31 de estos se registraron inicialmente en el concurso.
DISCUSIÓN Y CONCLUSIÓN
Presentamos en este artículo una técnica de segmentación del lumen de la arteria carótida y de cuantificación de estenosis en imágenes TAC. Esta técnica ocupó el sexto puesto en un concurso internacional cuyo propósito fue comparar objetivamente los métodos existentes y designar los de mejor desempeño. El método está basado en un modelo que fue inicialmente diseñado para segmentar vasos en imágenes ARM (MARACAS). Nuestros esfuerzos en el presente trabajo estuvieron principalmente enfocados en la adaptación de MARACAS para segmentar datos TAC y para tratar con bifurcaciones. Estas adaptaciones incluyen un realce de la imagen, llevado a cabo en diferentes etapas y basado principalmente en las intensidades y gradientes de la imagen. Este enfoque presenta dos limitaciones principales. Por un lado, los intervalos de densidades correspondientes a la sangre circulante presentan altas intersecciones con los intervalos de densidades de otros tejidos. Por otro lado, en presencia de estructuras vecinas de densidad similar, el módulo del gradiente es bajo y no contribuye a la detección del borde del lumen arterial. Como consecuencia, el eje central de la arteria, extraído por el algoritmo básico de MARACAS, no está siempre bien centrado en el lumen. Por consiguiente, los resultados de la etapa de corrección de la superficie, la cual se apoya en la localización espacial de este eje para determinar la superficie final del lumen, pueden verse afectados. Por otra parte, la segmentación del lumen es binaria: cada voxel es clasificado como perteneciente al lumen o al fondo, lo que limita la precisión. Las dos limitaciones mencionadas anteriormente podrían ser superadas teniendo en cuenta el efecto de volumen parcial. Los trabajos en esta dirección se encuentran en curso (Zuluaga et al., 2009). Adicionalmente, el filtro de realce, basado únicamente en las intensidades y magnitudes del gradiente, parece ser insuficiente en algunas configuraciones. Probablemente debería incluir también información sobre las orientaciones locales. Por último, MARACAS modela únicamente las propiedades de la línea central de la arteria. Cuando las fronteras del lumen son difíciles de localizar, es necesario acudir a un modelo de la superficie del vaso. Para la extracción de la superficie, nosotros utilizamos implícitamente, en la fase de corrección de la misma, un modelo cilíndrico que es, sin duda, demasiado simplista para representar correctamente las formas patológicas. Sin embargo, el método fue capaz de segmentar todas las imágenes de evaluación y los errores de cuantificación de estenosis, aunque superiores a la variabilidad interobservadores reportada en la literatura, fueron inferiores a los de los demás métodos que participaron en la competencia final. En cuanto al tiempo de procesamiento, este puede ser reducido significativamente si la etapa de filtrado de ruido no se ejecuta, pero la precisión de la segmentación también disminuye un poco (Tabla 4).
1http://cls2009.bigr.nl/index.php
AGRADECIMIENTOS
Este trabajo fue apoyado por Comité ECOS-Nord, proyecto C07M04, por Región Rhône-Alpes (Francia) a través del proyecto Simed del cluster de investigación ISLE, y por el proyecto CIFI-Uniandes N.º 54. El proyecto PhD de M.A. Zuluaga es apoyado por una beca de Colciencias.
BIBLIOGRAFÍA
BUADES A, COLL B, MOREL J-M. A non-local algorithm for image denoising. Proceedings of the 2005 IEEE Computer Society Conference on Computer Vision and Pattern Recognition (CVPR 05);2:60-65.
CUISINAIRE O. Fully automated segmentation of carotid and vertebral arteries from cta. The Midas Journal, 2009. Disponible en: URL: http://hdl.handle.net/ 10380/3100
DORÉ V, CHERIET M. Robust NL-means filter with optimal pixel-wise smoothing parameter for statistical image denoising. IEEE Transactions on Signal Processing. 2009;57(5):1703-1716.
FLÓREZ VALENCIA L, AZENCOT J, VINCENT F, ORKISZ M, MAGNIN IE. Segmentation and quantification of blood vessels in 3d images using a right generalized cylinder state model, Int. Conf. Image Processing, Atlanta, GA, USA, Oct. 8-11, 2006, 2441-2444 (DOI: 10.1109/ICIP.2006.312770).
FLÓREZ VALENCIA L, AZENCOT J, ORKISZ M. Carotid arteries segmentation in CT images with use of a right generalized cylinder model. The Midas Journal, 2009. Disponible en: URL: http://hdl.handle.net/10380/3106
FREIMAN M, FRANK J, WEIZMAN L, JOSKOWICZ L, SHILON O, SOSNA J. Nearly automatic vessels segmentation using graph-based energy minimization. The Midas Journal, 2009. Disponible en: URL: http://hdl.handle.net/10380/3090
GULSUN MA, TEK H. Segmentation of carotid arteries by graph-cuts using centerline models. The Midas Journal, 2009. Disponible en: URL: http://www.midasjournal.org/browse/publication/699
HAMEETEMAN K, FREIMAN M, ZULUAGA M, JOSKOWICZ L, ROZIE S, VAN GILS M, et al. Carotid lumen segmentation and stenosis grading challenge. The Midas Journal, 2009. Disponible en: URL: http://www.insight-journal.org/browse/journal/48
HANEL RA, XAVIER AR, KIRMANI JF, YAHIA AM, QURESHI AI. Management of carotid artery stenosis: comparing endarterectomy and stenting. Curr Cardiol Rep. 2003Mar;5(2):153-9.
HERNÁNDEZ M, ORKISZ M, MAGNIN IE, DOUEK PC. Assessment of carotid artery stenoses in 3D contrast-enhanced magnetic resonance angiography, based on improved generation of the centerline. Machine Graphics and Vision. 2005;14(4):349-378.
HERNÁNDEZ HOYOS M, SERFATY JM, MAGHIAR A, MANSARD C, ORKISZ M, MAGNIN IE, DOUEK PC. Evaluation of semi-automatic arterial stenosis quantification. International Journal of Computer Assisted Radiology and Surgery, 2006,1(3):167-175.
HERNÁNDEZ M, ORLOWSKI P, PIATKOWSKA-JANKO E, BOGORODZKI P, ORKISZ M. Vascular centerline extraction in 3D MR angiograms for phase contrast MRI blood flow measurement. International Journal of Computer Assisted Radiology and Surgery. 2006;1(1):51-61.
KIRBAS C, QUEK F. A review of vessel extraction techniques and algorithms. ACM Comput. Surv. 2004;36(2):81-121.
KRISSIAN K, GARCIA SA. A minimal cost path and level set evolution approach for carotid bifurcation segmentation. The Midas Journal, 2009. Disponible en: URL: http://hdl.handle.net/10380/3103
LESAGE D, ANGELINI ED, BLOCH I, FUNKA LEA G. A review of 3d vessel lumen segmentation techniques: Models, features and extraction schemes. Medical Image Analysis. 2009;13(6):819-845.
MERLANO S. Análisis de costo-utilidad de la perfusión miocárdica en reposo y las troponinas en el tamizaje de pacientes con dolor torácico y electrocardiograma normal o no diagnóstico en urgencias. Alasbimn Journal. 2004; 7(26). Article N° AJ26-2.
MILLE J, BENMANSOUR F, COHEN L. Carotid lumen segmentation based on tubular anisotropy and contours without edges. The Midas Journal, 2009. Disponible en: URL: http://hdl.handle.net/10380/3101.
MUÑÓZ M. Enfermedad Cerebrovascular. Guía Neurológica. Asociación Colombiana de Neurología. 1999.
ORKISZ M, FLÓREZ VALENCIA L, HERNÁNDEZ HOYOS M. -Models, algorithms and applications in vascular image segmentation-. Machine Graphics & Vision. 2008;17(1/2):5-33.
SENDUR L, SELESNICK IW. Bivariate shrinkage functions for wavelet-based denoising exploiting interscale dependency. IEEE Transactions on Signal Processing. 2002;50(11):2744-2756.
WONG W, SO R, CHUNG A. Principal Curves: a technique for preliminary carotid lumen segmentation and stenosis grading. The Midas Journal, 2009. Disponible en: URL: http://hdl.handle.net/10380/3096
ZULUAGA MA, HERNÁNDEZ HOYOS M, ORKISZ M. Evaluation of partial volume effects in computer tomography for the improvement of coronary artery segmentation. Int J Comp Assist Radiol Surg. 2009;4(suppl.1): S40.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2010 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).





















