Efecto de un quelante de zinc extracelular sobre el número de celulas ganglionares en retina de rata, y transportadores de taurina y de zinc en estas células
Effect of Extracellular Zinc Chelator on Rat Retinal Ganglion Cell Number, and Taurine and Zinc Transporters in These Cells
DOI:
https://doi.org/10.15446/abc.v22n2.59805Palabras clave:
retina, taurina, transportador de taurina, transportadores de zinc, zinc. (es)retina, taurine, taurine transporter, zinc transportes, zinc. (en)
Descargas
La deficiencia de zinc en humanos produce disminución de antioxidantes, asociados a taurina, en la retina y se relaciona con adaptación anormal a la oscuridad, cataratas, ceguera y degeneración macular. Existe escasa evidencia acerca del efecto del zinc sobre el sistema de taurina en retina de mamíferos, por lo cual estudiamos el efecto del zinc sobre el transportador de taurina (TAUT) y los transportadores de zinc (ZnT-1 y 3) usando el quelante de zinc extracelular, ácido dietileno-triamino-penta-acético (DTPA), mediante inmunocitoquímica e inmunohistoquímica fluorescentes en células ganglionares (CG) y en las capas de la retina de ratas. Tres días después de la administración de DTPA (10 µM) se utilizaron anticuerpos primarios y secundarios conjugados con rodamina o fluoresceína-5-isotiocianato (FITC) según fuera el caso. Para el marcaje inmunocitoquímico se contaron trescientas células por condición y la intensidad de fluorescencia se midió como densidad óptica integrada (DOI) en cuatro áreas por cada capa del tejido. El DTPA produjo una disminución en un 32 % y 29 % de las CG del total de células marcadas con los anticuerpos contra glicoproteína Thy 1.1 y γ-sinucleína, respectivamente. También produjo una disminución significativa de la distribución de TAUT en un 27 y 28 % respecto a los controles. DTPA disminuyó la localización de ZnT-1 y ZnT-3 en las capas de retina (células ganglionares, CCG) y en las plexiformes externa e interna, CPE y CPI). El estudio de estos transportadores en la retina resulta relevante para entender las interacciones de taurina y de zinc en esta estructura.
Zinc deficiency in humans causes decreased antioxidants in the retina and is related with abnormal darkness adaptation, cataracts, blindness, and macular degeneration. There is little information about the effects of zinc on the taurine system in mammalian retinal cells. Therefore, we studied the effect of zinc on the taurine transporter (TAUT) and zinc transporters (ZnT-1 and 3) using the extracellular zinc chelator, diethylenetriaminepentaacetic acid (DTPA) by fluorescence immunocytochemistry and immunohistochemistry in the ganglion cells (CG) and cell layers of the retina of rats. Three days after administration of DTPA (10µM) primary antibodies and secondary antibodies conjugated with rhodamine or fluorescein isothiocyanate (FITC) were used as required. For immunocytochemical labeling approximately three hundred cells per condition were counted. For immunohistochemical labeling, the fluorescence intensity was measured as integrated optical density (DOI) in four areas for each layer of tissue. DTPA produced a decrease of 32 % and 29 % in GC of the total cells labeled with antibody against glycoprotein Thy 1.1 and γ-synuclein, respectively. It also produced a significant decrease in TAUT localization in 27 and 28 % compared to controls. DTPA produced a decrease in the localization of ZnT-1 and ZnT-3 in the retina layers (ganglion cells, GCC and the outer and inner plexiform, CEP and CIP). The study of these molecules in the retina is relevant to understanding the interactions of taurine and zinc in this structure.
DOI: https://doi.org/10.15446/abc.v22n2.59805
EFECTO DE UN QUELANTE DE ZINC EXTRACELULAR SOBRE EL NÚMERO DE CÉLULAS GANGLIONARES EN RETINA DE RATA, Y TRANSPORTADORES DE TAURINA Y DE ZINC EN ESTAS CÉLULAS
Effect of Extracellular Zinc Chelator on Rat Retinal Ganglion Cell Number, and Taurine and Zinc Transporters in These Cells
Asarí MÁRQUEZ GARCÍA1, Víctor SALAZAR1, Lucimey LIMA1.
1 Instituto Venezolano de Investigaciones Científicas (IVIC). Apdo - 21827. Caracas 1020-A, Venezuela.
For correspondence. amarquez@ivic.gob.ve
Received: 30th August 2016, Returned for revision: 28th November 2016, Accepted: 213st March 2017.
Associate Editor: Juan F. González.
Citation/Citar este artículo como: Márquez García A, Salazar V, Lima L. Efecto de un quelante de zinc extracelular sobre el número de celulas ganglionares en retina de rata, y transportadores de taurina y de zinc en estas células. Acta biol. Colomb. 2017;22(2):137-148. DOI: https://doi.org/10.15446/abc.v22n2.59805
RESUMEN
La deficiencia de zinc en humanos produce disminución de antioxidantes, asociados a taurina, en la retina y se relaciona con adaptación anormal a la oscuridad, cataratas, ceguera y degeneración macular. Existe escasa evidencia acerca del efecto del zinc sobre el sistema de taurina en retina de mamíferos, por lo cual estudiamos el efecto del zinc sobre el transportador de taurina (TAUT) y los transportadores de zinc (ZnT-1 y 3) usando el quelante de zinc extracelular, ácido dietileno-triamino-penta-acético (DTPA), mediante inmunocitoquímica e inmunohistoquímica fluorescentes en células ganglionares (CG) y en las capas de la retina de ratas. Tres días después de la administración de DTPA (10μM) se utilizaron anticuerpos primarios y secundarios conjugados con rodamina o fluoresceína-5-isotiocianato (FITC) según fuera el caso. Para el marcaje inmunocitoquímico se contaron trescientas células por condición y la intensidad de fluorescencia se midió como densidad óptica integrada (DOI) en cuatro áreas por cada capa del tejido. El DTPA produjo una disminución en un 32 % y 29 % de las CG del total de células marcadas con los anticuerpos contra glicoproteína Thy 1.1 y γ-sinucleína, respectivamente. También produjo una disminución significativa de la distribución de TAUT en un 27 y 28 % respecto a los controles. DTPA disminuyó la localización de ZnT-1 y ZnT-3 en las capas de retina (células ganglionares, CCG y en las plexiformes externa e interna, CPE y CPI). El estudio de estos transportadores en la retina resulta relevante para entender las interacciones de taurina y de zinc en esta estructura.
Palabras clave: retina, taurina, transportador de taurina, transportadores de zinc, zinc.
ABSTRACT
Zinc deficiency in humans causes decreased antioxidants in the retina and is related with abnormal darkness adaptation, cataracts, blindness, and macular degeneration. There is little information about the effects of zinc on the taurine system in mammalian retinal cells. Therefore, we studied the effect of zinc on the taurine transporter (TAUT) and zinc transporters (ZnT-1 and 3) using the extracellular zinc chelator, diethylenetriaminepentaacetic acid (DTPA) by fluorescence immunocytochemistry and immunohistochemistry in the ganglion cells (CG) and cell layers of the retina of rats. Three days after administration ofDTPA (10μM) primary antibodies and secondary antibodies conjugated with rhodamine or fluorescein isothiocyanate (FITC) were used as required. For immunocytochemical labeling approximately three hundred cells per condition were counted. For immunohistochemical labeling, the fluorescence intensity was measured as integrated optical density (DOI) in four areas for each layer of tissue. DTPA produced a decrease of 32 % and 29 % in GC of the total cells labeled with antibody against glycoprotein Thy 1.1 and γ-synuclein, respectively. It also produced a significant decrease in TAUT localization in 27 and 28 % compared to controls. DTPA produced a decrease in the localization of ZnT-1 and ZnT-3 in the retina layers (ganglion cells, GCC and the outer and inner plexiform, CEP and CIP). The study of these molecules in the retina is relevant to understanding the interactions of taurine and zinc in this structure.
Keywords: retina, taurine, taurine transporter, zinc transportes, zinc.
INTRODUCCIÓN
La retina es un estructura altamente especializada, sensible a la luz y ubicada en la parte posterior del ojo, forma parte del sistema nervioso central (SNC) y participa en la percepción visual (Wurtz y Kandel, 2001). La retina está formada por seis familias de células que se interconectan mediante sinapsis, tales como: fotorreceptores (FOT, conos y bastones), células horizontales, bipolares, amacrinas, interplexiformes y ganglionares (CG), además de las células de Müller (CGli) (Fulton, 1950; Tessier-Lavigne, 2001).
Las CG son un tipo de neuronas localizadas en la superficie interna de la retina, varían en tamaño, conexiones y respuesta sensorial, pero todas comparten la característica de tener axones largos que constituyen el nervio óptico, con entrecruzamiento casi total en el quiasma óptico, y luego forman la vía óptica, transmitiendo la información hacia tálamo, hipotálamo, mesencéfalo y corteza occipital (Masland, 2012). Estas células reciben información de los FOT mediante neuronas intermediarias, como bipolares, amacrinas y horizontales (interneuronas de la retina) (Sung y Chuang, 2010; Masland, 2012). En la retina de mamíferos hay alrededor de 20 tipos morfológicos diferentes de CG (Vaney et al., 2001; Rockhill et al., 2002), que responden a las diferentes características de la imagen visual, como contraste local, color, velocidad y dirección del movimiento. Las CG han sido clasificadas según su tamaño y patrón de ramificación de las dendritas en diferentes mamíferos: mono (Dacey, 1994), gato (Boicot y Wássle, 1974; Berson et al., 1998; Berson et al., 1999), hurón (Vitek et al., 1985; Wingate et al., 1992), conejo (Levick, 1967; Caldwell y Daw, 1978; Vaney et al., 1981), rata (Peichl, 1989; Wong et al., 2012) y ratón (Doi et al., 1995; Badea y Nathans, 2004). Sin embargo, a menudo resulta difícil clasificar a las CG sólo por sus formas, ya que esto puede variar en la retina de las diferentes especies. Una de las maneras de definir y estudiar diferentes tipos de CG es mediante la aplicación de marcadores selectivos para una población determinada (ver Wássle, 2004), también se han aplicado ensayos de electrofisiología para su estudio (DeVries y Baylor, 1997).
La taurina y el zinc se encuentran en altas concentraciones en la retina y cumplen funciones similares en esta estructura, tales como neuroprotección, estabilización de membranas, regeneración y modulación del desarrollo, posiblemente por mecanismos paralelos o coadyuvantes (Nusetti et al., 2005). El efecto del quelante de zinc sobre la localización del transportador de taurina (TAUT) y los transportadores de zinc (ZnT) resulta ser novedoso y permite la contribución a una mejor compresión de la interacción de taurina y zinc y sus funciones en la retina, células y tejido. Los objetivos del presente trabajo son estudiar el efecto del quelante de zinc extracelular, el ácido dietilen-triamino-penta-acético (DTPA), sobre el TAUT en CG aisladas de retina de rata y evaluar el efecto del DTPA sobre el TAUT, ZnT-1 y 3 en las diferentes capas de la retina de rata por inmunohistoquímica.
MATERIALES Y MÉTODOS
Animales
Se emplearon ratas macho Sprague-Dawley con peso de 200 a 250 g, procedentes del Bioterio del IVIC, fueron mantenidas en condiciones de agua y alimentación ad libitum, ciclos de luz-oscuridad 12h/12h, individualmente en cajas metálicas con piso cerrado. Antes del inicio de los tratamientos, las ratas tuvieron un período de adaptación mínimo de 48 horas en el Bioterio Experimental del Laboratorio. El número de ratas por experimento se estableció de acuerdo a estimados estadísticos en base a la variabilidad de los datos y con observación de las normas éticas. La manipulación de los animales se realizó bajo las normas de bioética animal (Jayo y Cisneros, 1999) y fue aprobada (2010-actualmente) por la Comisión de Bioética para Investigación en Animales del Instituto Venezolano de Investigaciones Científicas.
Tratamiento con el quelante de zinc extracelular ácido dietilen-triamino-penta-acético in vivo
Se inyectaron 2 μl del quelante de zinc extracelular ácido (DTPA) (Sigma-Aldrich), 10 μM, por vía intraocular (io). A los tres días de la administración se aislaron las células o se fijaron los ojos según el ensayo experimental de inmunocitoquímica o inmunohistoquímica, respectivamente. Al grupo control se le administró el vehículo, 2 μl de dimetil sufóxido (DMSO) al 0,31 % concentración inicial (3,1 ml de DMSO al 100 % + 100 ml de H2O), concentración final al 0,001 % io. La dilución en el ojo es de aproximadamente 7,25 veces, tomando en cuenta el volumen acuoso del ojo es arededor de 12,5 μl (Márquez et al., 2016).
Aislamiento de las células de retina de rata
Las ratas fueron decapitadas, se extrajeron los ojos y se realizó la disección de las retinas inmediatamente. Las células fueron aisladas con tripsina 0,25 % en solución amortiguadora de Locke (NaCI 154 mM, KCl 2,7 mM, K2HPO4 2,1 mM, KH2PO4 0,95 mM, sacarosa 2,7 mM y HEPES 2,5 mM) pH 7,4 a 37 °C por 30 min, y por disgregación mecánica con pipeta Pasteur. Las células fueron lavadas dos veces con solución salina tamponizada con fosfato (PBS) 0,1 M, pH 7,4. Luego se centrifugaron por 10 min a 2000 rpm (300 g). El contaje de las células se efectuó en cámara de Neubauer, y la integridad de la membrana citoplasmática se determinó por exclusión de azul de Tripán al 50 % resuspendido en PBS a una concentración final de 0,4% (Fig. 1) (Lima et al., 1991; Márquez et al., 2014). Para todas las muestras usadas el porcentaje de viabilidad celular fue mayor de 90 %.
Marcaje inmunocitoquímico del transportador de taurina en células ganglionares
Se efectuó la adhesión celular sobre láminas recubiertas con poli-L-lisina (0,0025 mg/ml), 400 μl por lámina (aproximadamente 5x105 células), por 2 h a temperatura ambiente. Las células aisladas fueron fijadas con paraformaldehído 2 % en PBS (1000 μl) por 30 min y resuspendidas en PBS + sacarosa al 30 %. Para permeabilizar las células se les colocó Triton X-100 0,3 % en PBS por 20 min. Para el bloqueo de los sitios de unión inespecífica se añadió una solución de albúmina sérica de bovino (ASB) al 5 % en PBS por 40 min. Para marcar las CG se utilizó IgG de cabra anti-glicoproteína Thy 1.1 (Santa Cruz Biotechnology, sc-9163) IgG de ratón anti anti-proteína γ-sinucleína (Abcam, ab47966) durante 1 h a 37 °C, a una dilución de 1:100 en PBS, Triton X-100 al 0,3 % y ASB al 1 %. Luego de la incubación, fueron lavadas dos veces con PBS y se incubaron en la oscuridad con el anticuerpo secundario: IgG de conejo anti anti-IgG de cabra conjugado con rodamina, o IgG conejo anti-IgG de ratón, (Santa Cruz Biotechnology, sc-3945 y sc-358922) a una dilución 1:50 y 1:400 respectivamente, en PBS, por 45 min. Otro juego de láminas se incubaron por 1 h con el anticuerpo policlonal desarrollado en conejo anti-TAUT-1 (Alpha Diagnostic International, TAU11-A) (Pow et al., 2002) o anticuerpo monoclonal desarrollado en ratón anti-TAUT (Santa Cruz Biotechnology sc-166640) a una dilución de 1:500 en PBS, Triton X-100 al 0,3 % y ASB al 1 %, por 45 min. Se lavaron con PBS y se incubaron con un anticuerpo secundario: IgG de cabra anti-IgG de conejo o IgG de conejo anti-IgG de ratón según fuera el caso, conjugados con fluoresceína-5-isotiocianato (FITC) (Santa Cruz Biotechnology sc-2012 y sc-358916, respectivamente) a una dilución de 1:250 en PBS, por 45 min. Las láminas fueron lavadas con PBS. Para el control negativo las secciones fueron incubadas solamente con el anticuerpo secundario (Pow et al., 2002). Luego fueron observadas en un microscopio de epifluorescencia Nikon Eclipse E600 y el contaje celular se realizó en cuatro campos por muestra y en cada campo se contaron 300 células y se calcularon los porcentaje de células CG, positivas para la glicoproteína Thy 1.1 y para γ-sinucleína, y de las CG que presentaron al transportador TAUT-1.
Marcaje inmunohistoquímico del transportador de taurina y transportadores de zinc
Disección y fijación de los tejidos
Las ratas fueron anestesiadas con Equitesin (1 ml ip/kg) (0,08 g/ml pentobarbital Na+ en etanol 95 %, 0,09 g/ml de hidrato de cloral en propilenglicol y 0,04 g/ml de sulfato de magnesio en agua). Los animales fueron decapitados, se extrajeron los ojos y fueron fijados con formaldehido 4 % durante 24 h.
Inclusión en parafina
Después de la fijación los ojos fueron deshidratados mediante cuatro lavados con etanol al 70 % durante 4 h y posteriormente fueron aclarados en xileno, y se efectuaron tres cambios de diez minutos cada uno a temperatura ambiente, luego se incluyeron en cuatro cambios de parafina por 1 h en una estufa a 56-58 °C. Se prepararon bloques histológicos y se dejaron solidificar durante toda la noche a 4 °C y fueron cortados en micrótomo en secciones de 5 μm.
Inmunohistoquímica de los transportadores de zinc
Las secciones fueron montadas en láminas cubiertas con gelatina de cromo (gelatina 0,5 %, alumbre cromo 0,05 % en agua destilada). Se realizó la recuperación antigénica con tripsina 0,5 % durante 15 min y las láminas fueron lavadas con PBS. Para permeabilizar el tejido, las láminas fueron incubadas con el detergente Triton X-100 (0,1 %) diluido en PBS durante 10 min y lavadas con PBS. Para bloquear las uniones inespecíficas se agregó ASB 5 % diluida en PBS por 1 h. Luego dos secciones seriadas, por separado, fueron incubadas durante toda la noche a 4 °C con el anticuerpo IgG de cabra anti-ZnT-1 (Santa Cruz Biotechnology, sc-27502) y anti- con IgG de conejo anti-ZnT-3 (Synaptic Systems, 197 011) a una dilución de 1:500 en 5 % ASB en PBS. Después de la incubación las secciones fueron lavadas con PBS e incubadas en la oscuridad a temperatura ambiente por 1 h con el anticuerpo secundario IgG de conejo anti IgG de cabra (para marcar ZnT-1) o IgG de cabra anti IgG de conejo (para marcar ZnT-3) conjugados con FITC (Santa Cruz Biotechnology) a una dilución de 1:500 en 5 % PBS (Nusetti et al., 2009). Para la tinción de los núcleos de las células, las secciones fueron incubadas durante 5 min con 1 μg/ml de diclorhidrato de 4',6-diamidino-2-fenol-indol (DAPI), lavadas con PBS y montadas con immu-Mount® (Thermo-Scientific). En la Figura 4 se muestra una imagen representativa de la tinción de los núcleos con DAPI en células aisladas y tejido de retina. Para examinar la inmunofluorescencia de DAPI, FITC y rodamina se usó un microscopio Nikon (Eclipse E600) con cámara acoplada Coolpix 4300. Para el control negativo, las secciones fueron incubadas solamente con el anticuerpo secundario (Pow et al., 2002).
Análisis de las fotografías
Las fotografías fueron combinadas y analizadas con el programa ImageJ versión 1.47, el cual es un programa de procesamiento de imagen digital de dominio público programado en Java y desarrollado en el National Institutes of Health (Collins, 2007). La fluorescencia se midió como densidad óptica integrada (DOI). Para la determinación de la DOI se usó una región de interés (ROI) circular (se seleccionó la opción de herramienta "elíptico" en ImageJ) de 100 píxeles2 (= 60 μm2) en cuatro zonas por cada capa del tejido escogidas al azar para luego calcular la DOI promedio de cada capa (Joachim et al., 2012). En el caso de la capa de células ganglionares (CCG), las mediciones se realizaron por células, se escogieron diez células al azar y por cada célula se midió la DOI usando una ROI de 20 pixeles2 para luego calcular la media.
Análisis estadístico
Los valores fueron expresados como el media aritmética ± error estándar de la media (E.E.M). Para establecer las diferencias significativas entre cada transportador en las capas de la retina se utilizó análisis de varianza (ANOVA), seguido del post-test de Tukey del programa estadístico INSTAT (Tapia, 1994). Se consideraron estadísticamente significativas las diferencias entre las medias con un valor de p < 0,05.
RESULTADOS
Efecto del quelante de zinc extracelular, ácido dietilen-triamino-penta-acético sobre las células ganglionares, el transportador de taurina en las células retinianas y la localización del transportador en dichas células ganglionares
Tres días después de la administración io de 10 μM de DTPA, se observó una disminución, estadísticamente significativa, en un 32 % de las CG positivas para la glicoproteína Thy 1.1., (35 CG de 281-306 células retinianas totales) con respecto a los controles (55 CG de 200-346 células retinianas totales) (Fig. 2A). El tratamiento con el quelante también produjo una disminución de la distribución del TAUT en el total de células retinianas en un 28 % respecto a los controles cuando se usó el anticuerpo Thy 1.1. (Fig. 2A). Resultados similares se observaron al marcar las CG con el anticuerpo anti-γ-sinucleína. Se observó una disminución en un 29 % de las CG marcadas (41 CG de 255-322 células retinianas totales) respecto a los controles (55 CG de 274-341 células retinianas totales) (Fig. 2A). Hubo una disminución de la localización del TAUT en el total de células retinianas en un 27 % respecto a los controles (Fig. 2A) cuando se usó el anticuerpo primario anti-γ-sinucleína. No hubo diferencias significativas en la distribución del TAUT en las CG marcadas con Thy 1.1 o γ-sinucleína después del tratamiento con DTPA (Fig. 2B). La Figura 3 muestra imágenes representativas del inmunomarcaje de las CG con el anticuerpo Thy 1.1, en rojo (Fig. 3A y B) y γ-sinucleína, (en rojo, Fig. 3C y D) y del TAUT (en verde) indicadas por las flechas en especímenes controles (Fig. 3A y C) y tratados con DTPA (Fig. 3B y D).
Localización de los transportadores de zinc en las capas de retina de rata después de la inyección del quelante de zinc extracelular
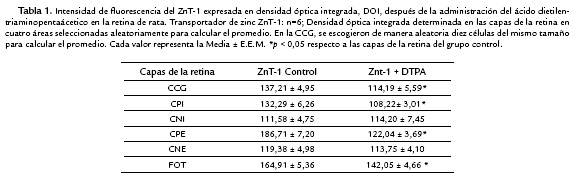
Los valores de DOI son presentados en la Tabla 1 y 2. El tratamiento con DTPA produjo diferencias significativas en la localización del ZnT-1 y ZnT-3 (Fig. 5A y 5B, Tabla 1 y 2). Fue observado una disminución significativa de la DOI del ZnT-1 en la capa de (CCG), capa plexiforme interna y externa (CPI y CPE) y fotoreceptores (FOT) comparado con el grupo ZnT-1 control (ver Fig. 5A, Tabla 1). El tratamiento con DTPA también produjo una disminución significativa de la localización de ZnT-3 en las mismas capas retinianas. La localización de ZnT-3 decrece significativamente en CCG, CPI y CPE respecto al grupo ZnT-3 control (Fig. 5B y Tabla 2).
DISCUSIÓN
Las CG en retina de rata, y en otros mamíferos, son las responsables de la codificación de la información visual en señales eléctricas y en transmitir estas señales al cerebro a través del nervio óptico (Hadjinicolaou et al., 2016). Estas células tienen una gran variedad de tipos morfológicos que se distinguen por el tamaño del soma, el tamaño del campo dendrítico, patrones de ramificación y estratificación (Masland, 2001; Wássle, 2004). Sus características morfológicas, junto con la distribución de los canales iónicos en la membrana celular, dan lugar a propiedades intrínsecas que influyen en la codificación de la información visual (O'Brien et al., 2002). En el trabajo previo Márquez et al. (2015), demostramos que las CG de retina de rata presentan el TAUT. Sin embargo, similar a los resultados del presente estudio, no todas las CG tienen el TAUT (~65 %) en los grupos control, lo cual indica la variabilidad en la distribución y la probable funcionalidad de estas células por la presencia de transportadores en la membrana plasmática, como en el caso de TAUT, posiblemente en relación con la diferenciación de las CG y la comunicación de estas células con regiones centrales inervadas por el nervio óptico (Márquez et al., 2015). La confirmación de la presencia diferencial del TAUT en las CG fue determinada por ensayos de inmunocitoquímica con el uso de dos anticuerpos distintos para marcar CG en la retina: anti glicoproteína Thy 1.1 (Barnstable y Dräger, 1984; Zhang et al., 2010) y anti proteína γ-sinucleína (Surgucheva et al., 2008), el cual se ha reportado ser un marcador específico de las CG y su expresión y localización son alteradas en enfermedades oculares (Surgucheva et al., 2008). El inmunomarcaje de CG resultó similar con ambos anticuerpos (ver Figs. 1 y 3). La variedad de estas células en la retina (CG) demuestra que algunas presentan TAUT y otras no. La presencia de taurina y de su transportador en las CG, podría estar relacionada con las funciones de estas células, como osmoregulador (Lima, 1999), estabilización de membranas (Lombardini, 1991), protección (Pasantes-Morales y Cruz, 1984), además de que este aminoácido actúa como un agente trófico en la retina y en el nervio óptico (Lombardini, 1991; Lima, 1999; Cubillán et al., 2012).
No hay muchos estudios de los efectos del zinc sobre la localización del TAUT en células específicas de la retina como las CG. En este estudio se observó que el quelante de zinc extracelular DTPA, a los tres días de ser administrado de manera io, produjo una disminución significativa de la cantidad de CG que expresan y- sinucleína y TAUT; y la cantidad de TAUT también disminuyó. Así TAUT requiere de taurina y zinc para su normal funcionamiento, CG requieren del TAUT para su integridad y necesitan de taurina y zinc como agentes tróficos y antioxidantes. El zinc modula el transporte de taurina en células aisladas de retina de rata de manera dependiente de la concentración, por acción directa sobre el transportador o por la formación de un complejo taurina-zinc en la membrana celular (Márquez et al., 2014). Es relevante, que en todos ensayos de inmunocitoquímica fue evaluada la viabilidad celular como se describió en materiales y métodos. La viabilidad fue mayor del 90 % tanto en las muestras controles como en las tratadas con DTPA io, lo cual nos indica que el DTPA no está afectando dicho patrón (Fig. 1). Probablemente la disminución del TAUT sea producto de la disminución del número de CG debido a la deficiencia de zinc causada por el DTPA. Las CG presentan a este transportador y al disminuir la cantidad de las mismas disminuye el TAUT, sin embargo, no hay reportes previos.
No se ha conocido si el TAUT presenta residuos de histidina (His) en alguno de sus dominios, lo cual podría ser algún sitio de reconocimiento del metal como se ha demostrado en el transportador de serotonina (White et al., 2006) y dopamina (Norgaard-Nielsen et al., 2002; Stockner et al., 2013). Los efectos genómicos del zinc mediados por factores de transcripción, también podrían ser de relevancia. Se han identificado genes en intestino, timo y monocitos, son regulados por el zinc. Estos, están implicados en la transducción de señales, influyen en la respuesta inmune, en las respuestas al estrés, y en crecimiento y utilización de energía (Cousins et al., 2003). Entre los genes identificados se encuentran: uroguanilina, hormona colecistoquinina, proteína tirosina quinasa específica de leucocitos (LCK), receptor de citoquinas de células T, proteínas de choque térmico y en la reparación de daños en el ADN (Cousins et al., 2003). Se ha sugerido que uno de los mecanismos de regulación del TAUT es por factores de transcripción, ya que se ha descrito al promotor del TAUT con varios sitios de unión a diferentes factores de transcripción entre los que encontramos a p53, c-myb, Ap1, WT1, Sp1 (Han et al., 2006; Chesney et al., 2012). La disminución de zinc causada por el quelante DTPA podría modificar la actividad del TAUT y las concentraciones de taurina debido a sus efectos sobre los factores de transcripción regulados por el zinc. Se ha demostrado la presencia de taurina, TAUT y de transportadores de zinc en diferentes capas de las retinas de pez dorado (Nusetti et al., 2009) y de rata (Márquez et al., 2015). TAUT está localizado en todas las capas de la retina de rata, con una localización significativamente mayor en la capa nuclear interna (CNI), en comparación con las (CPI) y (CPE) (Márquez et al., 2015). Los ZnT han sido los transportadores de zinc más estudiados en esta estructura. Sólo hay dos estudios que demuestran las presencia de la familia ZIP en la retina, en células del epitelio pigmentario (Leung et al., 2008; Leung et al., 2012). De los diez miembros de la familia de ZnT, sólo existe evidencia en la retina de cuatro, el ZnT-1 (Nolte et al., 2004; Sekler et al., 2007; Leung et al., 2008), el ZnT-3 (Redenti y Chappell, 2004; Redenti y Chappell, 2007), el ZnT-7 (Wang et al., 2006) y el ZnT-8 (DeNiro y Al-Mohanna, 2012). Nosotros hemos demostrado la localización del ZnT-1 en las diferentes capas de retina de rata con mayor intensidad en la (CCG) en comparación con la CNI, CPE y FOT; el ZnT-3 distribuido de manera homogénea en las capas retinianas, y el ZnT-7 localizado con mayor intensidad en FOT (Márquez et al., 2015). En este estudio observamos que el quelante de zinc DTPA produjo una disminución significativa de la localización de los transportadores de zinc en las capas de la retina: ZnT-1 de membrana plasmática principalmente en CCG, CPI, CPE y FOT y el ZnT-3 vesicular disminuyó de manera similar al ZnT-1 respecto a los grupos de control. Márquez et al. (2015) reportaron un intenso marcaje de los ZnT (1, 3 y 7) en los FOT, lo cual se relaciona con la función del zinc como neuromodulador de la neurotransmisión sináptica (Frederickson et al., 2005). El ZnT-1, transportador presente en la membrana plasmática, permite mantener los niveles de zinc por el eflujo de la célula (Lichten y Cousins, 2009). La capa FOT no es una región sináptica, sin embargo se concentran vesículas sinápticas (Redenti y Chappell, 2004). En el caso del ZnT-3, transportador vesicular, en los FOT parece estar involucrado en la respiración mitocondrial de los mismos, pues se ha demostrado la presencia de este transportador en la membrana limitante externa de la retina, región donde se encuentran los segmentos internos de los FOT, rica en mitocondrias (Redenti y Chappell, 2004; Redenti y Chappell, 2007). El DTPA podría afectar las funciones del ZnT-1 y 3 en FOT ya descritas.
La disminución de ZnT-1 y 3 en CCG podría estar relacionada con que las CG reciben información de los FOT mediante neuronas intermediarias (células bipolares, amacrinas y horizontales). Probablemente la disminución ZnT-1 y 3 sea producto de la disminución del número de CG en la CCG debido a la deficiencia de zinc causada por el DTPA. Las CG presentan estos transportadores de zinc similar al TAUT. El zinc es un elemento esencial en el SNC y en el proceso visual (Masland, 2012) y al disminuir su concentración por efecto del quelante influye el proceso visual integrado por la conexión sináptica entre las neuronas retinianas. Por otro lado, la distribución de estos transportadores disminuyeron significativamente en CPI y CPE después del tratamiento con DTPA. La presencia de las proteínas transportadoras de zinc en estas capas es importante ya que algunas regiones de conexión sináptica son cruciales, lo cual sugiere el secuestro de zinc y almacenamiento vesicular en el caso de ZnT-3 en ambas capas plexiformes. El ZnT-1 también podría estar involucrado en mantener los niveles de zinc adecuados pero por el eflujo de zinc de la célula. Nosotros hemos observado que la disminución de zinc produce una disminución en sus transportadores, lo que demuestra que estas proteínas ZnTs son relevantes para la homenostasis de zinc y responden a los cambios de las concentraciones del metal en las células. Los ZnTs facilitan la eliminación de zinc libre citosólico, ya sea exportando el zinc a través de la membrana plasmática o secuestrando el zinc en vesículas. Sería interesante evaluar a los transportadores ZIP, los cuales funcionan de manera opuesta como una vía para el flujo de zinc a través de la membrana plasmática o de vesículas. De hecho, se ha reportado que en eritrocitos, el zinc es esencial para su funcionamiento normal y la homeostasis intracelular de zinc durante la diferenciación de estas células se encuentra fuertemente regulada (Ryu et al., 2008). En eritrocitos de ratones con dieta deficiente de zinc por Wenstern Blot y ensayos densitométricos, se observó una disminución en la expresión las proteínas transportadoras ZnT-1 y ZnT-10 respecto a los grupos control. Por el contrario, bajo las mismas condiciones dietéticas el transportador ZIP-10 aumenta su expresión en estas mismas células (Ryu et al., 2008).
CONCLUSIONES
Los transportadores de zinc contribuyen a regular los niveles intracelulares de este micronutriente para mantener las funciones celulares. Nuestros resultados sugieren que la disminución de zinc repercute sobre el sistema de taurina en la retina, tanto los niveles como su transportador. El balance del zinc, de la taurina y las proteínas transportadoras contribuyen con el entendimiento de la interacción de ambas moléculas en la retina.
AGRADECIMIENTOS
Instituto Venezolano de Investigaciones Científicas (151-IVIC).
CONFLICT OF INTEREST
The authors declare that they have no conflict of interest.
REFERENCIAS
Badea TC, Nathans J. Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J Comp Neurol. 2004;480:331-351. Doi:10.1002/cne.20304.
Barnstable CJ, Dräger UC. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience. 1984;11(4):847-855. Doi:10.1016/0306-4522(84)90195-7.
Berson DM, Isayama T, Pu M. The eta ganglion cell type of the cat retina. J Comp Neurol. 1999;408:204-219. Doi:10.1002/(SICI)1096-9861(19990531)408:2<204::AID-CNE5>3.0.CO;2-J.
Berson DM, Pu M, Famiglietti EV. The zeta cell: a new ganglion cell type in cat retina. J Comp Neurol. 1998;399:269-288. Doi:10.1002/(SICI)1096-9861(19980921)399:2<269::AID-CNE9>3.0.CO;2-Z.
Boycott BB, Wássle H. The morphological types of ganglion cells of domestic cat's retina. J Physiol. 1974;240:397-419.
Caldwell JH, Daw NW. New properties of rabbit retinal ganglion cells. J Physiol. 1978;276:257-276.
Chesney R, Patters A, Han X. Taurine in the kidneys. In: El Idrissi A, L'Amoreaoux W, editors. Taurine in health and disease. Transworld Research Network: Kerala, India; 2012. p. 75-99.
Cousins R, Blanchard R, Moore J, Cui L, Green C, Liuzzi J, Cao J, Bobo J. Regulation of zinc metabolism and genomic outcomes. J Nutr. 2003;133:1521S-1526S.
Collins T. Image J for microscopy. Biotechniques. 2007;43:S25-S30.
Cubillán L, Obregón F, Lima L. Neurites outgrowth and amino acids levels in goldfish retina under hypo-ossmotic or hyper-osmotic conditions. Int J Dev Neurosci. 2012;30:55-61. Doi:10.1016/j.ijdevneu.2011.08.005.
Dacey DM. Physiology, morphology and spatial densities of identified ganglion cell types in the primate retina. Ciba Found Symp. 1994;184:12-34. Doi:10.1002/9780470514610.ch2.
DeNiro M, Al-Mohanna F. Zinc transporter 8 (ZnT8) Expression is reduced by ischemic insults: a potential therapeutic target to prevent ischemic retinopathy. PloS One. 2008;7:e50360. Doi:10.1371/journal.pone.0050360.
DeVries SH, Baylor DA. Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J Neurophysiol. 1997;78:2048-2060.
Doi M, Yamamura H. Morphological classification of retinal ganglion cells in mice. J Comp Neurol. 1995;356:368-386. Doi:10.1002/cne.903560305.
Fulton J. Physiology. 17 ed. Londres: Editorial W.B. Saunders Company; 1950. p. 408-457.
Frederickson C, Koh J, Bush A. The neurobiology of zinc in health and disease. Nat Rev Neurosci. 2005;6:449-462. Doi:10.1038/nrn1671.
Hadjinicolaou A, Cloherty S, Hung Y-S, Kameneva T, Ibbotson M. Frequency Responses of Rat Retinal Ganglion Cells. PLoS One. 2016;11(6): e0157676 Doi:10.1371/journal.pone.0157676.
Han X, Patters A, Jones D, Zellicovik I, Chesney R. The taurine transporter: mechanisms of regulation. Acta Physiol. 2006;187:61-73. Doi:10.1111/j.1748-1716.2006.01573.x.
Jayo M, Cisneros J. Guía para el cuidado y uso de los animales de laboratorio. 1999. Available in: http://www.uss.cl/wp-content/uploads/2014/12/Gui%CC%81a-para-el-Cuidado-y-Uso-de-los-Animales-de-Laboratorio.pdf.
Joachim SC, Gramlich OW, Laspas P, Schmid H, Beck S, Von Pein HD, et al. PloS One. 2012;7:e40616. Doi:10.1371/journal.pone.0040616.
Leung K, Gvritishvili A, Liu Y, Tombran-Tink J. ZIP2 and ZIP4 mediate age-related zinc fluxes across the retinal pigment epithelium. J Mol Neurosci. 2012;46:122-137. Doi:10.1007/s12031-011-9536-0.
Leung K, LiuM, Xu X, Seiler M, Barnstable C, Tombran-Tink J. Expression of ZnT and ZIP zinc transporters in the human RPE and their regulation by neurotrophic factors. Invest Ophthalmol Vis Sci. 2008;49:1221-1231. Doi:10.1167/iovs.07-0781.
Levick WR. Receptive fields and trigger features of ganglion cells in the visual streak of the rabbit's retina. J Physiol. 1967;188:285-307. Doi:10.1113/jphysiol.1967.sp008140.
Lichten L, Cousins R. Mammalian zinc transporters: nutritional and physiologic regulation. Annu Rev Nutr. 2009;29:153-176. Doi:10.1146/annurev-nutr-033009-083312.
Lima L. Taurine and its trophic effect in the retina. Neurochem Res. 1999;24:1333-1338. Doi:10.1023/A:1027376511473.
Lombardini J. Taurine: Retinal function. Brain Res Rev. 1991;16:151-169. Doi:10.1016/0165-0173(91)90003-Q.
Márquez A, Urbina1 M, Quintal M, Obregón F, Lima L. Effects of intracellular zinc chelator in vivo on taurine transport, taurine concentrations and taurine transporter in rat retina cells. J Memb Sci Technol. 2016;6:149. Doi:10.4172/2155-9589.1000149.
Márquez A, Salazar V, Lima L. Localization of taurine transporter and zinc transporters in rat retinal cells and tissue. Effect of intracelular zinc chelation. J Mol Pathophysiol. 2015;4(1):42-50. Doi:10.5455/jmp.20150325034642.
Márquez A, Urbina M, Lima L. Zinc and zinc chelators modify taurine transport in rat retinal cells. Neurochem Res. 2014;39(11):2234-2239. Doi:10.1007/s11064-014-1425-9.
Masland RH. The fundamental plan of the retina. Nat Neurosci. 2001;4:877-86. Doi:10.1038/nn0901-877.
Masland RH. The neuronal organization of the retina. Neuron. 2012;76:266-80. Doi: 10.1016/j.neuron.2012.10.002.
Norgaard-Nielsen K, Norregaard L, Hastrup H, Javitch J, Gether U. Zn2+ site engineering at the oligomeric interface of the dopamine transporter. FEBS Letters. 2002;524:87-91. Doi:10.1016/S0014-5793(02)03008-9.
Nusetti S, Obregón F, Quintal M, Benzo Z, Lima L. Taurine and zinc modulate outgrowth from goldfish retinal explants. Neurochem Res. 2005;30:1483-1492. Doi:10.1007/s11064-005-8825-9.
Nusetti S, Salazar V, Lima L. Localization of taurine transporter, taurine, and zinc in goldfish retina. Adv Exp Med Biol. 2009;643:233-242. Doi:10.1007/978-0-387-75681-3_24.
O'Brien B, Isayama T, Richardson R, Berson D. Intrinsic physiological properties of cat retinal ganglion cells. J Physiol. 2002;538:787-802. Doi:10.1113/jphysiol.2001.013009.
Pasantes-Morales H, Cruz C. Protective effect of taurine and zinc on peroxidation-induced damage in photoreceptor outer segments. J Neurosci Res. 1984;11:303-11. Doi:10.1002/jnr.490110310.
Peichl L. Alpha and delta ganglion cells in the rat retina. J Comp Neurol. 1989;286:120-139. Doi:10.1002/cne.902860108.
Pow D, Suvillan R, Reye P, Hermanussen S. Localization of taurina transporters, taurine, and 3H-taurine accumulation in the rat retina, pituitary, and brain. Glia. 2002;37:153-168. Doi:10.1002/glia.10026.
Redenti S, Chappell R. Localization of zinc transporter-3 (ZnT-3) in mouse retina. Vision Res. 2004;44:3317-3321. Doi:10.1016/j.visres.2004.07.038.
Redenti S, Chappell R. Müller cell zinc transporter-3 labeling suggests a role in outer retina zinc homeostasis. Mol Med. 2007;13:376-379. Doi:10.21 19/2007-00041.Redenti.
Rockhill RL, Daly FJ, MacNeil MA, Brown SP, Masland RH. The diversity of ganglion cells in a mammalian retina. J Neurosci. 2002;22:3831-3843.
Ryu MS, Lichten LA, Liuzzi JP, Cousins RJ. Zinc Transporters ZnT1 (Slc30a1), Zip8 (Slc39a8), and Zip10 (Slc39a10) in Mouse Red Blood Cells Are Differentially Regulated during Erythroid Development and by Dietary Zinc Deficiency. J Nutr. 2008;138(11):2076-2083. Doi:10.3945/jn.108.093575.
Stockner T, Montgomery TR, Kudlacek O, Weissensteiner R, Ecker GF, Freissmuth M, Sitte HH. Mutational analysis of the high-affinity zinc binding site validates a refined human dopamine transporter homology model. PLoS Comput Biol. 2013;9:e1002909. Doi:10.1371/journal.pcbi.1002909.
Sung CH, Chuang JZ. The cell biology of vision. J Cell Biol. 2010;190:953-63. Doi:10.1083/jcb.201006020.
Surgucheva I, Shestopalov VI, Surguchov A. Effect of gamma-synuclein silencing on apoptotic pathways in retinal ganglion cells. J Biol Chem. 2008;283:36377-36385. Doi:10.1074/jbc.M806660200.
Tapia F. GraphPad Instat [programa de ordenador]. Versión 2.05a. San Diego, CA, EUA): Softward GraphPad; 1994.
Tessier-Lavigne M. El procesamiento visual en la retina. 4 ed. In: Kandel E, Schawartz J, Jessell T, editor(s). Principios de Neurociencia. Capítulo 26. España: McGraw-Hill; 2001. p. 523-547.
Vaney DI, Levick WR, Thibos LN. Rabbit retinal ganglion cells. Exp Brain Res. 1981;44:27-33. Doi:10.1007/BF00238746.
Vaney D, He S, Taylor W, Levick W. Direction-selective ganglion cells in the retina. In: Motion vision. Computational, neural and ecological constraints. Zanker J, Zeil J, eds. 2001. Berlin: Springer. p. 13-56.
Vitek DJ, Schall JD, Leventhal AG. Morphology, central projections, and dendritic field orientation of retinal ganglion cells in the ferret. J Comp Neurol. 1985;241:1-11. Doi:10.1002/cne.902410102.
Wang X, Wang Z, Gao H, Danscher R, Huang L. Localization of ZnT-7 and zinc ions in mouse retina Immunohistochemistry and selenium autometallography. Brain Res Bull. 2006;71:9196. Doi:10.1016/j.brainresbull.2006.08.002.
Wässle H. Parallel processing in the mammalian retina. Nat Rev Neurosci. 2004;5:747-757. Doi:10.1038/nrn1497
White K, Kiser P, Nichols D, Barker E. Engineered zinc-binding sites confirm proximity and orientation of transmembrane helices I and III in the human serotonin transporter. Protein Sci. 2006;15:2411-2422. Doi:10.1110/ps.062386106.
Wingate RJ, Fitzgibbon T, Thompson ID. Lucifer yellow, retrograde tracers, and fractal analysis characterise adult ferret retinal ganglion cells. J Comp Neurol. 1992;323:449-474. Doi:10.1002/cne.903230402.
Wong RC, Cloherty SL, Ibbotson MR, O'Brien BJ. Intrinsic physiological properties of rat retinal ganglion cells with a comparative analysis. J Neurophysiol. 2012;108:2008-23. Doi:10.1152/jn.01091.2011.
Wurtz R, Kandel R. Vías visuales centrales. 4 ed. In: Kandel E, Schawartz J, Jessell T, editor(s). Principios de Neurociencia. Capítulo 27. España: McGraw-Hill.; 2001. p. 523-547.
Zhang XM, Li Liu DT, Chiang SW, Choy KW, Pang CP, Lam DS, Yam GH. Immunopanning purification and long-term culture of human retinal ganglion cells. Mol Vis. 2010;16:2867-2872.
Referencias
Badea TC, Nathans J. Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J Comp Neurol. 2004;480:331-351. Doi:10.1002/cne.20304
Barnstable CJ, Dräger UC. Thy-1 antigen: a ganglion cell specific marker in rodent retina. Neuroscience. 1984;11(4):847-855. Doi:10.1016/0306-4522(84)90195-7
Berson DM, Isayama T, Pu M. The eta ganglion cell type of the cat retina. J Comp Neurol. 1999;408:204-219. Doi:10.1002/(SICI)1096-9861(19990531)408:2<204::AID CNE5>3.0.CO;2-J
Berson DM, Pu M, Famiglietti EV. The zeta cell: a new ganglion cell type in cat retina. J Comp Neurol. 1998;399:269-288. Doi:10.1002/(SICI)1096-9861(19980921)399:2<269::AID-CNE9>3.0.CO;2-Z
Boycott BB, Wässle H. The morphological types of ganglion cells of domestic cat´s retina. J Physiol. 1974;240:397-419.
Caldwell JH, Daw NW. New properties of rabbit retinal ganglion cells. J Physiol. 1978;276:257-276.
Chesney R, Patters A, Han X. Taurine in the kidneys. In: El Idrissi A, L´Amoreaoux W, editors. Taurine in health and disease. Transworld Research Network: Kerala, India; 2012. p. 75–99.
Cousins R, Blanchard R, Moore J, Cui L, Green C, Liuzzi J, Cao J, Bobo J. Regulation of zinc metabolism and genomic outcomes. J Nutr. 2003;133:1521S-1526S.
Collins T. ImageJ for microscopy. Biotechniques. 2007;43:S25-S30.
Cubillán L, Obregón F, Lima L. Neurites outgrowth and amino acids levels in goldfish retina under hypo-ossmotic or hyper-osmotic conditions. Int J Dev Neurosci. 2012;30:55-61. Doi:10.1016/j.ijdevneu.2011.08.005
Dacey DM. Physiology, morphology and spatial densities of identified ganglion cell types in the primate retina. Ciba Found Symp. 1994;184:12-34. Doi:10.1002/9780470514610.ch2
DeNiro M, Al-Mohanna F. Zinc transporter 8 (ZnT8) Expression is reduced by ischemic insults: a potential therapeutic target to prevent ischemic retinopathy. PloS One. 2008;7:e50360. Doi:10.1371/journal.pone.0050360
DeVries SH, Baylor DA. Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J Neurophysiol. 1997;78:2048-2060.
Doi M, Yamamura H. Morphological classification of retinal ganglion cells in mice. J Comp Neurol. 1995;356:368-386. Doi:10.1002/cne.903560305
Fulton J. Physiology. 17 ed. Londres: Editorial W.B. Saunders Company; 1950. p. 408-457.
Frederickson C, Koh J, Bush A. The neurobiology of zinc in health and disease. Nat Rev Neurosci. 2005;6:449-462. Doi:10.1038/nrn1671
Hadjinicolaou A, Cloherty S, Hung Y-S, Kameneva T, Ibbotson M. Frequency Responses of Rat Retinal Ganglion Cells. PLoS One. 2016;11(6): e0157676 Doi:10.1371/journal.pone.0157676
Han X, Patters A, Jones D, Zellicovik I, Chesney R. The taurine transporter: mechanisms of regulation. Acta Physiol. 2006;187:61-73. Doi:10.1111/j.1748-1716.2006.01573.x
Jayo M, Cisneros J. Guía para el cuidado y uso de los animales de laboratorio. 1999. Available in: http://www.uss.cl/wp-content/uploads/2014/12/Gui%CC%81a-para-el-Cuidado-y-Uso-de-los-Animales-de-Laboratorio.pdf. Cited: 16 Jan 2015.
Joachim SC, Gramlich OW, Laspas P, Schmid H, Beck S, Von Pein HD, et al. PloS One. 2012;7:e40616. Doi:10.1371/journal.pone.0040616.
Leung K, Gvritishvili A, Liu Y, Tombran-Tink J. ZIP2 and ZIP4 mediate age-related zinc fluxes across the retinal pigment epithelium. J Mol Neurosci. 2012;46:122-137. Doi:10.1007/s12031-011-9536-0
Leung K, LiuM, Xu X, Seiler M, Barnstable C, Tombran-Tink J. Expression of ZnT and ZIP zinc transporters in the human RPE and their regulation by neurotrophic factors. Invest Ophthalmol Vis Sci. 2008;49:1221-1231. Doi:10.1167/iovs.07-0781
Levick WR. Receptive fields and trigger features of ganglion cells in the visual streak of the rabbit´s retina. J Physiol. 1967;188:285-307. Doi:10.1113/jphysiol.1967.sp008140
Lichten L, Cousins R. Mammalian zinc transporters: nutritional and physiologic regulation. Annu Rev Nutr. 2009;29:153-176. Doi:10.1146/annurev-nutr-033009-083312
Lima L. Taurine and its trophic effect in the retina. Neurochem Res. 1999;24:1333-1338. Doi:10.1023/A:1027376511473
Lombardini J. Taurine: Retinal function. Brain Res Rev. 1991;16:151-169. Doi:10.1016/0165-0173(91)90003-Q
Márquez A, Urbina1 M, Quintal M, Obregón F, Lima L. Effects of intracellular zinc chelator in vivo on taurine transport, taurine concentrations and taurine transporter in rat retina cells. J Memb Sci Technol. 2016;6:149. Doi:10.4172/2155-9589.1000149
Márquez A, Salazar V, Lima L. Localization of taurine transporter and zinc transporters in rat retinal cells and tissue. Effect of intracelular zinc chelation. J Mol Pathophysiol. 2015;4(1):42-50. Doi:10.5455/jmp.20150325034642
Márquez A, Urbina M, Lima L. Zinc and zinc chelators modify taurine transport in rat retinal cells. Neurochem Res. 2014;39(11):2234–2239. Doi:10.1007/s11064-014-1425-9
Masland RH. The fundamental plan of the retina. Nat Neurosci. 2001;4:877-86. Doi:10.1038/nn0901-877
Masland RH. The neuronal organization of the retina. Neuron. 2012;76:266-80. Doi:
1016/j.neuron.2012.10.002
Norgaard-Nielsen K, Norregaard L, Hastrup H, Javitch J, Gether U. Zn2÷ site engineering at the oligomeric interface of the dopamine transporter. FEBS Letters. 2002;524:87-91. Doi:10.1016/S0014-5793(02)03008-9
Nusetti S, Obregón F, Quintal M, Benzo Z, Lima L. Taurine and zinc modulate outgrowth from goldfish retinal explants. Neurochem Res. 2005;30:1483-1492. Doi:10.1007/s11064-005-8825-9
Nusetti S, Salazar V, Lima L. Localization of taurine transporter, taurine, and zinc in goldfish retina. Adv Exp Med Biol. 2009;643:233-242. Doi:10.1007/978-0-387-75681-3_24
O’Brien B, Isayama T, Richardson R, Berson D. Intrinsic physiological properties of cat retinal ganglion cells. J Physiol. 2002;538:787–802. Doi:10.1113/jphysiol.2001.013009
Pasantes-Morales H, Cruz C. Protective effect of taurine and zinc on peroxidation-induced damage in photoreceptor outer segments. J Neurosci Res. 1984;11:303-11. Doi:10.1002/jnr.490110310
Peichl L. Alpha and delta ganglion cells in the rat retina. J Comp Neurol. 1989;286:120-139. Doi:10.1002/cne.902860108
Pow D, Suvillan R, Reye P, Hermanussen S. Localization of taurina transporters, taurine, and 3H-taurine accumulation in the rat retina, pituitary, and brain. Glia. 2002;37:153-168. Doi:10.1002/glia.10026
Redenti S, Chappell R. Localization of zinc transporter-3 (ZnT-3) in mouse retina. Vision Res. 2004;44:3317–3321. Doi:10.1016/j.visres.2004.07.038
Redenti S, Chappell R. Müller cell zinc transporter-3 labeling suggests a role in outer retina zinc homeostasis. Mol Med. 2007;13:376-379. Doi:10.2119/2007-00041.Redenti
Rockhill RL, Daly FJ, MacNeil MA, Brown SP, Masland RH. The diversity of ganglion cells in a mammalian retina. J Neurosci. 2002;22:3831-3843.
Ryu MS, Lichten LA, Liuzzi JP, Cousins RJ. Zinc Transporters ZnT1 (Slc30a1), Zip8 (Slc39a8), and Zip10 (Slc39a10) in Mouse Red Blood Cells Are Differentially Regulated during Erythroid Development and by Dietary Zinc Deficiency. J Nutr. 2008;138(11):2076–2083. Doi:10.3945/jn.108.093575
Stockner T, Montgomery TR, Kudlacek O, Weissensteiner R, Ecker GF, Freissmuth M, Sitte HH. Mutational analysis of the high-affinity zinc binding site validates a refined human dopamine transporter homology model. PLoS Comput Biol. 2013;9:e1002909. Doi:10.1371/journal.pcbi.1002909
Sung CH, Chuang JZ. The cell biology of vision. J Cell Biol. 2010;190:953-63. Doi:10.1083/jcb.201006020
Surgucheva I, Shestopalov VI, Surguchov A. Effect of gamma-synuclein silencing on apoptotic pathways in retinal ganglion cells. J Biol Chem. 2008;283:36377-36385. Doi:10.1074/jbc.M806660200
Tapia F. GraphPad Instat [programa de ordenador]. Versión 2.05a. San Diego, CA, EUA): Softward GraphPad; 1994.
Tessier-Lavigne M. El procesamiento visual en la retina. 4 ed. In: Kandel E, Schawartz J, Jessell T, editor(s). Principios de Neurociencia. Capítulo 26. España: McGraw-Hill;; 2001. p. 523-547.
Vaney DI, Levick WR, Thibos LN. Rabbit retinal ganglion cells. Exp Brain Res. 1981;44:27-33. Doi:10.1007/BF00238746
Vaney D, He S, Taylor W, Levick W. Direction-selective ganglion cells in the retina. In: Motion vision. Computational, neural and ecological constraints. Zanker J, Zeil J, eds. 2001. Berlin: Springer. p. 13–56.
Vitek DJ, Schall JD, Leventhal AG. Morphology, central projections, and dendritic field orientation of retinal ganglion cells in the ferret. J Comp Neurol. 1985;241:1-11. Doi:10.1002/cne.902410102
Wang X, Wang Z, Gao H, Danscher R, Huang L. Localization of ZnT-7 and zinc ions in mouse retina Immunohistochemistry and selenium autometallography. Brain Res Bull. 2006;71:9196. Doi:10.1016/j.brainresbull.2006.08.002
Wässle H. Parallel processing in the mammalian retina. Nat Rev Neurosci. 2004;5:747-757. Doi:10.1038/nrn1497
White K, Kiser P, Nichols D, Barker E. Engineered zinc-binding sites confirm proximity and orientation of transmembrane helices I and III in the human serotonin transporter. Protein Sci. 2006;15:2411-2422. Doi:10.1110/ps.062386106
Wingate RJ, Fitzgibbon T, Thompson ID. Lucifer yellow, retrograde tracers, and fractal analysis characterise adult ferret retinal ganglion cells. J Comp Neurol. 1992;323:449-474. Doi:10.1002/cne.903230402
Wong RC, Cloherty SL, Ibbotson MR, O'Brien BJ. Intrinsic physiological properties of rat retinal ganglion cells with a comparative analysis. J Neurophysiol. 2012;108:2008-23. Doi:10.1152/jn.01091.2011
Wurtz R, Kandel R. Vías visuales centrales. 4 ed. In: Kandel E, Schawartz J, Jessell T, editor(s). Principios de Neurociencia. Capítulo 27. España: McGraw-Hill.; 2001. p. 523-547.
Zhang XM, Li Liu DT, Chiang SW, Choy KW, Pang CP, Lam DS, Yam GH. Immunopanning purification and long-term culture of human retinal ganglion cells. Mol Vis. 2010;16:2867-2872.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Asarí Márquez García, Víctor Salazar, Lucimey Lima Pérez. (2022). Consequences of zinc deficiency on zinc localization, taurine transport, and zinc transporters in rat retina. Microscopy Research and Technique, 85(10), p.3382. https://doi.org/10.1002/jemt.24193.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).