Efecto del quitosano en el desarrollo in vitro de Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. en dos medios de cultivo
Palabras clave:
pudriciones poscosecha, quitosano, hongos fitopatógenos, Postharvest rots, chitosan, phytopathogen fungi (es)Efecto del quitosano en el desarrollo in vitro deRhizopus stolonifer (Ehrenb.:Fr.) Vuill. en dos medios de cultivo
Effect of chitosan on the in vitro developtment of Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. on two culture medium
María Guadalupe Guerra-Sánchez1 , Luis Armando Sandoval-Escobar1 , Enriqueta Amora-Lazcano1 , Luis Vásquez-Méndez1 , Miguel Gerardo Velázquez-del Valle2 , Ana Niurka Hernández-Lauzardo3
1 Profesor-Investigador, Departamento de Microbiología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, México D.F.
2 Estudiante de Licenciatura, Departamento de Microbiología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Naciona, México, D.F.
3 Profesor-Investigador, Instituto Politécnico Nacional, Centro de Desarrollo de Productos Bióticos, México D.F.anhernandez@ipn.mx
Recibido: marzo 2 de 2010 Aprobado: noviembre 3 de 2010
Resumen
En este trabajo se evaluó el efecto antifúngico del quitosano (0; 0,5; 1,0; 1,5; 2,0 mg mL-1) en el desarrollo in vitro (crecimiento micelial, formación de cuerpos fructíferos, esporulación, germinación y liberación de proteínas) de Rhizopus stolonifer en dos medios de cultivo (papa dextrosa agar y medio mínimo). Los resultados obtenidos demostraron que el quitosano inhibió el crecimiento micelial de R. stolonifer en ambos medios de cultivo. El mayor índice antifúngico se observó en el medio papa dextrosa agar. El quitosano no afectó la formación de los cuerpos fructíferos de R. stolonifer en los medios estudiados. La esporulación y la germinación de las esporas se afectaron en ambos medios de cultivo por efecto de quitosano, siendo más notable en el medio medio mínimo. Se demostró la liberación de proteínas por efecto del quitosano en medio mínimo y caldo papa dextrosa. En general, en este estudio se evidenció el efecto antifúngico del quitosano en el desarrollo in vitro de Rhizopus stolonifer con independencia del medio de cultivo empleado. Sin embargo, en medio medio mínimo podrían observarse mejor los efectos antifúngicos del quitosano.
Palabras clave: pudriciones poscosecha, quitosano, hongos fitopatógenos.
Abstract
In this work the antifungal effect of chitosan (0, 0.5, 1.0, 1.5, 2.0 mg mL-1) on the in vitro development (mycelial growth, fruit bodies formation, sporulation, germination and proteins release) of Rhizopus stolonifer on two culture medium (Potato Dextrose Agar and Minimal medium) was evaluated. The obtained results demonstrated that chitosan inhibited the mycelial growth of R. stolonifer in both culture medium. The highest antifungal effect was observed on potato dextrose agar medium. Chitosan was not affected the fruit bodies formation of R. stoloniferon the studied medium. Sporulation and spore germination were affected in both culture mediun by effect of chitosan, it was more noticeable in minimal medium. It was demonstrated proteins release by effect of chitosan in minimal medium and potato dextrose broth medium. In general, in this study it was showed the antifungal effect of chitosan on in vitro development of Rhizopus stolonifer regardless of the culture medium used. However, in minimal medium could be observed best the antifungal effects of chitosan.
Key words: Postharvest rots, chitosan, phytopathogen fungi.
Introducción
Las pudriciones de frutas y hortalizas causadas por microorganismos son comunes durante los procesos de almacenamiento y transporte de los productos agrícolas en la etapa poscosecha. Rhizopus stolonifer es considerado uno de los principales fitopatógenos que provocan enfermedades como la pudrición blanda que conlleva la maceración celular de los tejidos y causa importantes pérdidas económicas. Recientemente, se ha buscado implementar alternativas naturales como el uso del quitosano para controlar diversas enfermedades poscosecha (Liu et al., 2007; Badawy y Rabea, 2009). El quitosano está constituido fundamentalmente por unidades de glucosamina con uniones ß (1-4), se obtiene a partir de los residuos de crustáceos entre los que se destacan el camarón, el cangrejo y la langosta (Du et al., 2009; Al Sagheer et al., 2009; Falcón et al., 2008) y tiene la ventaja de ser biodegradable, no tóxico y con amplias propiedades antifúngicas.
Algunos autores han encontrado que el quitosano afecta el crecimiento micelial y causa severos daños en las hifas provocando afectaciones morfológicas en las mismas (Xu et al., 2007; Singh et al., 2008). De forma similar, otras etapas importantes del desarrollo fúngico han resultado afectadas por la aplicación de este polímero; recientemente se demostró que el quitosano, mediante un proceso dependiente de energía, permeabilizó y penetró la membrana plasmática de diferentes células fúngicas (hifas, esporas y tubos germinales) sugiriéndose que el polímero interactuó con componentes externos de la membrana provocando cambios conformacionales que implicaron la formación de poros (Palma-Guerrero et al., 2008, 2009). Otras investigaciones demostraron la salida de proteínas y otros constituyentes intracelulares (Guo et al., 2008).
Los efectos antifúngicos del quitosano sobre diferentes fitopatógenos se han relacionado con el nivel de desacetilación de la molécula, la concentración aplicada y la masa molecular del compuesto, entre otros factores (Falcón et al., 2008; Bautista-Baños et al., 2006; Hernández-Lauzardo et al., 2008). Por otra parte, se conoce que las características del polímero pueden influir en las propiedades funcionales de los sistemas donde se adicione, interviniendo de manera significativa en el efecto fisiológico de los microorganismos (Rabea et al., 2003). Sin embargo, es importante seleccionar adecuadamente un medio de cultivo in vitro que permita obtener mayor información acerca del efecto antifúngico del quitosano sobre el microorganismo estudiado, y conocer si dicho efecto se mantiene con independencia del medio empleado. El objetivo de este trabajo fue evaluar el efecto antifúngico del quitosano en el crecimiento micelial, la formación de cuerpos fructíferos, la esporulación, la germinación y la liberación de proteínas en R. stolonifer cultivado en un medio rico en nutrientes y en un medio mínimo.
Materiales y métodos
Material biológico. Se empleó la cepa R3 de Rhizopus stolonifer obtenida de frutos de jitomate en Yautepec, Morelos, México (Hernández-Lauzardo et al., 2006).
Soluciones de quitosano. Para elaborar la solución patrón de quitosano (PM=17,4 KDa; 75-85% grado de desacetilación, Sigma-Aldrich) con una concentración de 10 mg mL-1 se pesaron 2 g de quitosano en una balanza analítica, se disolvieron en 100 mL de agua destilada con 2 mL de ácido acético y se agitaron durante 24 h. Posteriormente, se ajustó el pH a 5,6 adicionando NaOH 1 N, y se aforó a 200 mL con agua destilada (El Ghaouth et al., 1991). Se esterilizó en autoclave a 121 oC durante 15 min. Se tomaron las alícuotas correspondientes para obtener las concentraciones de quitosano estudiadas (0; 0,5; 1,0; 1,5; 2,0 mg mL-1).
Determinación del índice antifúngico del quitosano sobre el crecimiento micelial. Se colocaron discos de micelio de la cepa R3 (5 mm) en el centro de cajas de Petri con medio papa dextrosa agar (PDA) (Bioxon) o medio mínimo agar (MMA) (Guerra-Sánchez et al., 2009) (Glucosa 1%, NH4NO3 0,3%, solución de sales y elementos trazas 62,5 mL L-1, Agar 1,5%) conteniendo las concentraciones de quitosano referidas anteriormente (pH 5,6). Se incubaron durante 48 h a 25 oC. El diámetro del crecimiento micelial se midió con un vernier digital cuando el micelio del tratamiento sin quitosano alcanzó el borde de la caja de Petri (48 h). Se calculó el promedio de tres repeticiones y se expresó como diámetro de crecimiento en mm. A partir de esos valores se calculó el índice antifúngico de acuerdo con la siguiente fórmula (Guo et al., 2006):
Índice antifúngico (%)= 1-(Da/Db) x100
Donde:
Da = diámetro de la zona de crecimiento en las cajas con quitosano.
Db = diámetro de la zona de crecimiento en las cajas testigo.
Establecimiento del microcultivo para la descripción morfológica de R. stolonifer. Se adicionó medio de cultivo (MMA y PDA con 0; 0,5; 1,0; 1,5; 2,0 mg mL-1 de quitosano) aún sin solidificar sobre la superficie de un portaobjetos estéril, se agregaron 50 µL de una suspensión de esporas de R. stolonifer sobre este medio. Los tratamientos se incubaron durante 72 horas a 25 oC en cámara húmeda y en condiciones asépticas. Posteriormente, se realizaron tinciones con azul de lactofenol (0,1% p/v). Las muestras se observaron al microscopio óptico y se describieron de acuerdo con Schipper (1984).
Efecto antifúngico del quitosano en la esporulación. Se adicionaron 10 mL de agua destilada estéril a las cajas de Petri con los medios MMA y PDA (48 h) que contenían las concentraciones de quitosano evaluadas (0; 0,5; 1,0; 1,5; 2,0 mg mL-1). Se raspó el micelio con una varilla de vidrio y se añadieron otros 10 mL de agua, se colectaron las esporas y se procedió a contarlas en cámara de Neubauer en un microscopio óptico (40 X). Los datos se expresaron como número de esporas mL-1.
Germinación. Se tomaron alícuotas de 50 µL de la suspensión de esporas previamente mencionada, y se agregaron en tubos con 500 µL de los medios CPD y medio mínimo (MM) (Glucosa 1%, NH4NO3 0,3%, solución de sales y elementos trazas 62,5 mL L-1). El conteo del número de esporas germinadas se realizó a las 6 h de incubación a 25 oC (100 esporas por muestra) en un microscopio óptico (40 x) con un contador manual. Las esporas se consideraron germinadas cuando el largo del tubo germinal fue igual o excedió la longitud de la espora (El Ghaouth et al., 1992).
Cuantificación de proteínas en el sobrenadante del medio de cultivo. Para obtener los sobrenadantes se preparó una suspensión de esporas de la cepa R3 (1x106 esporas mL-1) y se inoculó en matraces con 100 mL de CPD y MM con las concentraciones de quitosano de 0; 0,5; 1,0; 1,5; 2,0 mg mL-1. Se incubaron a 25 oC en agitación (100 rpm) durante 24 h. Las muestras se centrifugaron a 5000 rpm durante 5 min (4 oC), los sobrenadantes se colectaron en tubos Falcon y se congelaron a -70 oC hasta su posterior uso. Las proteínas se cuantificaron por el método de Lowry siguiendo las especificaciones del Kit comercial 500-0114 (BioRad) (Lowry et al., 1951) utilizando albúmina sérica bovina (BSA) como proteína estándar; se elaboró una curva tipo con el patrón de BSA (0,5 mg mL-1). Las lecturas se realizaron en un espectrofotómetro a 655 nm. La concentración de proteínas se expresó en µg mL-1.
Diseño de experimentos y análisis estadísticos. Los experimentos se realizaron empleando un diseño completamente al azar en arreglo simple. Los datos se procesaron mediante un análisis de varianza de una vía y la diferencia de las medias de tres repeticiones se determinó con la prueba de Tukey. Se utilizó el paquete estadístico Sigma Stat versión 2.0.
Resultados
Efecto antifúngico del quitosano sobre el crecimiento micelial de R. stolonifer. El índice antifúngico del quitosano en los medios de cultivo PDA y MMA se muestra en el cuadro 1. En el medio PDA se observa que el quitosano causó un efecto inhibitorio sobre el crecimiento micelial cuando se aplicó a las concentraciones de 1,0; 1,5; 2,0 mg mL-1 (41,21; 46,86 y 56,06%, respectivamente) se observaron diferencias significativas entre las concentraciones evaluadas. La concentración de 0,5 mg mL-1 (4,14%) no causó inhibición significativa del crecimiento micelial de R. stolonifer cultivado en medio PDA con respecto al testigo. Los resultados obtenidos al crecer la cepa de R. stolonifer en MMA se muestran en el cuadro 1. Para el caso del MMA se observa que sólo la concentración de 2,0 mg mL-1 produjo una inhibición significativa del crecimiento micelial, presentándose un índice antifúngico de 49,55%. Las concentraciones de 0,5; 1,0 y 1,5 mg mL-1, aunque causaron inhibición del crecimiento micelial, no fueron estadísticamente significativas con relación al testigo durante el tiempo de incubación en las condiciones empleadas.
Descripción morfológica de los cuerpos fructíferos de R. stolonifer cultivado en dos medios de cultivo. En los medios PDA y MMA se observó que R. stolonifer formó hifas cenocíticas aéreas y también se apreció la formación de los cuerpos fructíferos típicos de esta especie fúngica caracterizados por la formación de esporangióforos y esporangios en el interior de los cuales se observó una coloración oscura típica de las esporangiosporas (imágenes no mostradas). La aplicación de quitosano a los medios referidos anteriormente no afectó la formación de los cuerpos fructíferos ni implicó variaciones en los mismos, por lo que en las condiciones en las que se desarrollaron los experimentos no se demostró que el polímero causara algún efecto sobre los cuerpos fructíferos de R. stolonifer.
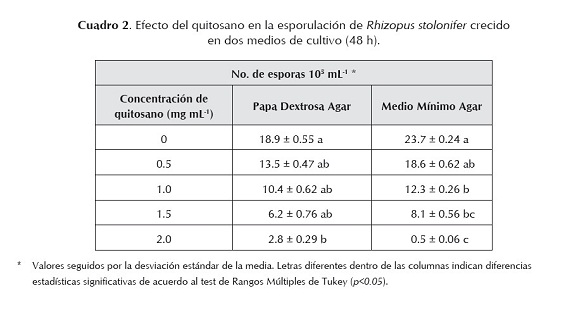
Efecto del quitosano sobre la esporulación de Rhizopus stolonifer. En el cuadro 2 se observan los resultados del efecto del quitosano sobre la esporulación de R. stolonifer. El tratamiento testigo presentó 18,9 x105 esporas mL-1 en el medio PDA. El efecto del quitosano en la disminución de la esporulación se manifestó solamente en la concentración de 2,0 mg mL-1, observándose un valor de 2,8 x105 esporas mL-1, encontrándose diferencias significativas. En el medio MMA se pone en evidencia la disminución de la esporulación en presencia del polímero. En este medio, con las concentraciones de 1,0; 1,5; 2,0 mg mL-1 se observó una disminución significativa en el número de esporas obtenidas (12,3; 8,1 y 0,5 x105 esporas mL-1 respectivamente). El mayor efecto inhibitorio del quitosano sobre la esporulación de R. stolonifer se obtuvo con las concentraciones de 1,5 y 2,0 mg mL-1.
Efecto del quitosano sobre la germinación de Rhizopus stolonifer. En el cuadro 3 se presentan los valores del porcentaje de germinación obtenidos al final del periodo de incubación (6 h) de las muestras en medio CPD y MM en presencia de diferentes concentraciones de quitosano (0; 0,5; 1,0; 1,5; 2,0 mg mL-1). En los dos medios de cultivo se observa que el porcentaje de germinación de las esporas de R. stolonifer presenta diferencias significativas entre el testigo y los tratamientos con quitosano. En el medio CPD los valores obtenidos en las concentraciones de 1,0; 1,5; 2,0 mg mL-1 no presentan diferencias significativas entre ellos. En el caso del MM, las concentraciones de 1,5 y 2,0 mg mL-1 causan una inhibición de la germinación de las esporas que no difiere significativamente entre ellas.
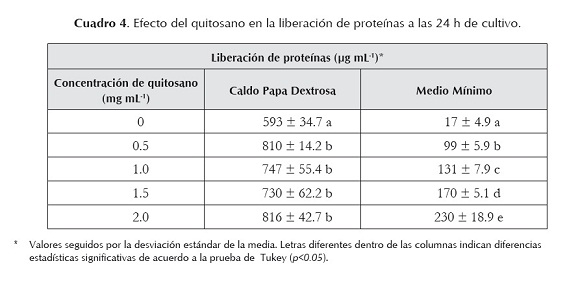
Liberación de proteínas por efecto de quitosano. En el cuadro 4 se muestran los resultados de la cuantificación de proteínas en los sobrenadantes de los cultivos de R. stolonifer crecidos durante 24 h en los medios CPD y MM en presencia de diferentes concentraciones de quitosano (0; 0,5; 1,0; 1,5; 2,0 mg mL-1). Se observa que en los dos medios, por efecto del quitosano, se liberan proteínas al exterior celular. En el caso del medio CPD se presentan diferencias significativas entre el testigo y los tratamientos con quitosano. Sin embargo, no se manifiesta un efecto diferencial entre las diferentes concentraciones del polímero. Por otra parte, en MM también se observan diferencias significativas cuando se cultivó R. stolonifer en presencia de concentraciones diferentes de quitosano. En este caso es evidente que a medida que se incrementa la concentración se obtiene una mayor liberación de proteínas, presentándose valores que difieren significativamente entre sí.
Discusión
En este trabajo, el efecto antifúngico del quitosano en el crecimiento micelial de R. stolonifer quedó demostrado en los dos medios de cultivo estudiados. En el medio PDA se destacan las concentraciones de 1,0; 1,5; 2,0 mg mL-1 por causar el mayor efecto en la inhibición del crecimiento micelial, y en el medio MMA la concentración de 2,0 mg mL-1 resultó la más efectiva para inhibir el desarrollo del micelio. Este hecho podría atribuirse a que el medio PDA contiene mayor cantidad de nutrientes que permiten que el hongo desarrolle mayor actividad metabólica, y probablemente el polímero cause mayor afectación celular que se refleja desde concentraciones menores de quitosano. No obstante, la concentración no tuvo un efecto significativo en ninguno de los medios analizados. Estos resultados coinciden con los obtenidos previamente en Aspergillus niger tratado con diferentes concentraciones de quitosano (0,5-10 mg mL-1), donde no se pudo establecer una correlación proporcional entre la concentración del polímero y la inhibición del crecimiento micelial (Xiao-Fang et al., 2008). Sin embargo, otras investigaciones revelaron que al incrementarse la concentración de quitosano se observó una disminución del crecimiento micelial de Botrytis cinerea y Penicillium expansum (Liu et al., 2007). Considerando los resultados previos y los obtenidos en este trabajo, se podría afirmar que las respuestas son variables y dependen no sólo de la concentración del polímero sino también de la especie fúngica y del medio de cultivo empleado en el estudio. La formación de micelio cenocítico y de los cuerpos fructíferos constituidos por esporangióforos, esporangios y esporangiosporas, característicos de R. stolonifer, se apreció en medio PDA y MMA en presencia y ausencia de quitosano. La aplicación del polímero no afectó que se produjeran estas estructuras básicas que, de acuerdo con la clave de identificación, permiten distinguir las especies fúngicas que se encuentran dentro de R. stolonifer, demostrándose que estas estructuras distintivas concuerdan con las reportadas por Schipper (1984). La esporulación constituye otra fase importante del desarrollo fúngico, en este trabajo se afectó en los medios PDA y MMA por efecto del quitosano, no obstante el comportamiento fue variable. En el medio PDA sólo la concentración de 2 mg mL1 causó una disminución en el número de esporas obtenidas; de forma diferente, en el medio MMA se obtuvieron resultados inhibitorios con concentraciones desde 1,0 hasta 2,0 mg mL-1. En ninguno de los medios estudiados se encontró que la disminución de la esporulación se relacione con un incremento en la concentración. En el medio PDA, que contiene mayor cantidad de nutrientes, la esporulación se manifestó normalmente sin diferencias significativas entre el testigo y los tratamientos con quitosano hasta la concentración de 1,5 mg mL-1, sólo una concentración más elevada de quitosano logró afectar este proceso biológico. Por el contrario, en medio MMA la respuesta al quitosano fue mayor. Recientemente, se reportó que el fenómeno de la esporulación está mediado por señales, específicamente, la vía de la proteína cinasa A participó en la regulación de la esporulación asexual del hongo Mucor circinelloides, proceso que se afectó en mutantes carentes de la subunidad regulatoria de esta proteína (Ocampo et al., 2009). Al respecto, proponemos que el quitosano afecta el desarrollo de la cepa deteriorando tanto la estructura del hongo como sus funciones fisiológicas y reproductivas y, en el caso particular de la esporulación, las vías de señales podrían activarse o no de forma diferencial por la presencia del quitosano y dependiendo del medio de cultivo empleado. Por otra parte, la germinación es un proceso del desarrollo natural del hongo que se ve disminuida por efecto del polímero utilizado. De forma general, se observa que en todas las concentraciones de quitosano utilizadas se presenta una inhibición en el fenómeno de germinación independientemente del medio de cultivo donde se desarrolle el bioensayo. No obstante, en el MM se observa el fenómeno de inhibición de manera más notoria, mostrándose el menor porcentaje de germinación (6,0%). Este trabajo refleja que la germinación de las esporas es un proceso muy sensible a la aplicación del quitosano, lo que coincide con lo reportado por Palma-Guerrero et al. (2008), estos autores encontraron que las esporas de Neurospora crassa fueron más sensibles que las hifas ante la aplicación de quitosano. Este fenómeno también se ha demostrado en otros trabajos utilizando diferentes hongos fitopatógenos como modelo de estudio, como es el caso de Botrytis cinerea (Xu et al., 2007). En investigaciones previas se señaló que la naturaleza policatiónica del quitosano favorece su interacción con las superficies microbianas, en particular con la membrana celular de los hongos, aspecto que podría afectar la integridad de la misma y causar la salida de material intracelular (Zakrzewska et al., 2005; Guo et al., 2008). En este estudio se demostró la liberación de proteínas por efecto del quitosano en los dos medios de cultivo estudiados. La concentración influyó de forma significativa en el medio MM donde fue posible observar un efecto más claro de la salida de material proteico. La propia constitución nutritiva del CPD podría interferir en la adecuada medición de las proteínas. Sin embargo, en medio MM se facilitó la liberación de proteínas por efecto del quitosano; son escasos los trabajos que demuestran salida de material proteico por efecto del mismo. Considerando los resultados obtenidos en este trabajo, es evidente que el quitosano afecta el desarrollo in vitro de R. stolonifer en los dos medios de cultivo estudiados. No obstante, la utilización del medio MM facilitará identificar con mayor precisión los efectos antifúngicos del quitosano, obteniéndose mejores resultados que podrían contribuir a mejorar las estrategias de control de hongos fitopatógenos para disminuir las pudriciones poscosecha.
Conclusiones
En este estudio se evidenció el efecto antifúngico del quitosano en el desarrollo in vitro de Rhizopus stolonifercon independencia del medio de cultivo empleado. Sin embargo, en medio mínimo se demostraron mejor los efectos antifúngicos del quitosano.
Agradecimientos
Los autores agradecen el apoyo financiero del Instituto Politécnico Nacional brindado a través de la Secretaría de Investigación y Posgrado.
Referencias bibliográficas
1 Al Sagheer, F. A., Al-Sughayer, M. A., Muslim, S., Elsabee, M. Z. 2009. Extraction and characterization of chiton and chitosan from marine sources in Arabian Gulf. Carbohydrate Polymers 77:410-419.
2 Badawy, M. E. I. and Rabea, E. I. 2009. Potential of the biopolymer chitosan with different molecular weights to control postharvest gray mold of tomato fruit. Postharvest Biology and Technology 51 (1):110-117.
3 Bautista-Baños, S., Hernández-Lauzardo, A. N., Velázquez-del Valle, M. G., Hernández-López, M., Ait Barka, E., Bósquez-Molina, E., and Wilson, C. L. 2006. Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities. Crop Protection 25: 108-118.
4 Du, J. Zhao, Y., Dai, S., Yang, B. 2009. Preparation of water-soluble chitosan from shirmp shell and its antibacterial activity. Innovative Food Science & Emerging Technologies 10:103-107.
5 El Ghaouth, A., Arul, J. and Ponnampalam, R. 1991. Use of chitosan coating to reduce water loss and maintain quality of cucumbers and bell pepper fruits. Journal of Food Processing and Preservation 15:359-368.
6 El Ghaouth, A., Arul, J., Grenier, J., and Asselin, A. 1992. Antifungal activity of chitosan on two postharvest pathogens of Strawberry fruits. Phytopathology 82: 398-402.
7 Falcón, A. B., Cabrera, J. C., Costales, D., Ramírez, M. A., Cabrera, G., Toledo, V. and Martínez-Téllez, M. A. 2008. The effect of size and acetylation negree of chitosan derivatives on tobacco plant protection against Phytophthora parasitica nicotianae. World Journal of Microbiology and Biotechnology 24:103-112.
8 Guerra-Sánchez, M. G., Vega-Pérez, J., Velázquez-del Valle, M. G. and Hernández-Lauzardo, A. N. 2009. Antifungal activity and release of compounds on Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. by effect of chitosan with different molecular weights. Pesticide Biochemistry and Physiology 93:18-22.
9 Guo, Z., Chen, R., Xing, R., Liu, S., Yu, H., Wang, P., Li, C., Li, P. 2006. Novel derivatives of chitosan and their antifungal activities in vitro. Carbohydrate Research 341: 351-354.
10 Guo, Z., Xing, R., Liu, S., Zhong, Z., Ji, X., Wang, L. and Li, P. 2008. The influence of molecular weight of quaternized chitosan on antifungal activity. Carbohydrate Polymers 71: 694-697.
11 Hernández-Lauzardo, A. N. Bautista-Baños, S., Velázquez-del Valle, M. G., Méndez-Montealvo, M. G., Sánchez-Rivera, M. M., and Bello-Pérez, L. A. 2008. Antifungal effects of chitosan with different molecular weights on in vitro development of Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. Carbohydrate Polymers 73: 541-547.
12 Hernández-Lauzardo, A. N., Bautista-Baños, S., Velázquez-del Valle, M. G. y Trejo-Espino, J. L. 2006. Identification of Rhizopus stolonifer (Ehrenb.: Fr.) Vuill., causal agent of Rhizopus rot disease of fruits and vegetables. Revista Mexicana de Fitopatología 24:65-69.
13 Liu, J., Tian, S., Meng, X. and Xu, Y. 2007. Effects of chitosan on control of postharvest diseases and physiological responses of tomato fruit. Postharvest Biology and Technology 44: 300-306.
14 Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. 1951. Protein measurement with the Folin phenol reagent. Journal of Biological Chemistry 193: 265-275.
15 Ocampo, J., Fernández-Núñez, L., Silva, F., Pereyra, E., Moreno, S., Garre, V. and Rossi, S. 2009. A subunit of protein kinase A regulates growth and differentiation in the fungus Mucor circinelloides. Eukaryotic Cell 8:933-944.
16 Palma-Guerrero, J. Jansson, H., Salinas, J. and Lopez-Llorca, J. V. 2008. Effect of chitosan on hyphal growth and spore germination of plant pathogenic and biocontrol fungi. Journal of Applied Microbiology 104: 541-553.
17 Palma-Guerrero, J., Huang, I.-C., Jansson, H.-B., Salinas, J., Llorca-López, L. V. and Read, N. D. 2009. Chitosan permeabilizes the plasma membrane and kills cells of Neurospora crassa in an energy dependent manner. Fungal Genetics and Biology 46: 585-594.
18 Rabea, E. I., Badawy, M. E. I., Stevens, C. V., Smagghe and G., Steurbaut, E. 2003. Chitosan as an Antimicrobial Agent: Applications and Mode of Actions. Biomacromolecules 4: 1457-1465.
19 Schipper, M. A. 1984. A revision of the genus Rhizopus. Studies in Mycology Serie No. 25. Baarn: Centraalbureau voor Schimmelcultures (eds). p. 34.
20 Singh, T. Vesentini, D., Singh, A. P. and G. Daniel. 2008. Effect of chitosan on physiological, morphological, and ultrastructural characteristics of wood-degrading fungi. International Biodeterioration and Biodegradation 62:116-124.
21 Xiao-Fang, L., Xiao-Qiang, F., Sheng, Y., Ting-Pu, W. and Zhong-Xing, S. 2008. Effects of Molecular Weight and Concentration of Chitosan on Antifungal Activity against Aspergillus Niger. Iranian Polymer Journal 17: 843-852.
22 Xu, J., Zhao, X., Han, X. and Du, Y and 2007a. Antifungal activity of oligochitosan against Phytophtora capsici and other pathogenic fungi in vitro. Pesticide Biochemistry and Physiology 87: 220-228.
23 Zakrzewska, A., Boorsma, A., Brul, S., Hellingwerf, K. J. and Klis, F. M. 2005. Transcriptional response of Saccharomyces cerivisiae to the plasma membrane-perturbing compound chitosan. Eukaryotic Cell 4: 703-715.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2010 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).