Dinámica del ciclo del nitrógeno y fósforo en suelos
Palabras clave:
dinámica de N y P, disponibilidad de nutrientes en suelo, fracciones orgánicas e inorgánicas y actividad microbiana, N and P dynamics, soil nutrients availability, organic and inorganic fractions and microbial activity (es)Título en ingles: Nitrogen and phosphorus cycles dynamics in Soils
Resumen: Los ciclos biogeoquímicos del fósforo (P) y del nitrógeno (N) son sistemas dinámicos que suceden a través de la biosfera, de cuyos mecanismos de transformación depende la disponibilidad de estos elementos para diferentes formas de vida. Se acepta que la diversidad y actividad de las poblaciones microbianas posee un papel crucial en la dinámica de los nutrientes y por tanto el desafío está en comprender, como responden a las condiciones ambientales. La actividad microbiana en los suelos depende tanto de la condición del recurso y como de sus propiedades químicas, físicas y biológicas. En este documento se describen conceptos que se han empleado para entender la dinámica del nitrógeno y el fósforo, con el propósito de discutir cómo las características de las diferentes fracciones orgánicas y minerales seleccionan el potencial biológico encargado del recambio de dichos elementos, panorama que actualmente se aborda a través de técnicas independientes del cultivo para estudiar las poblaciones microbianas in situ.
Palabras clave: dinámica de N y P; disponibilidad de nutrientes en suelo; fracciones orgánicas e inorgánicas y actividad microbiana.
Abstract: Biogeochemical cycle’s phosphorus (P) and nitrogen (N) are dynamic systems taking place through the biosphere, whose mechanisms of transformation depends on the availability of these elements for different forms of life. It is accepted that the diversity and activity of microbial populations plays a crucial role in nutrient dynamics and therefore the challenge is to understand how they respond to environmental conditions. Microbial activity in soils depends on both the resource condition and its chemical, physical and biological properties. Concepts described herein have been used to understand the nitrogen and phosphorus dynamics, with the aim to discuss how the characteristics of the different organic and mineral fractions select the biological potential responsible for the turnover of these elements, scenario currently addressed through cultivation-independent techniques to study microbial populations in situ.
Key words: N and P dynamics; soil nutrients availability; organic and inorganic fractions and microbial activityARTÍCULO DE REVISIÓN
Dinámica del ciclo del nitrógeno y fósforo en suelos
Nitrogen and phosphorus cycles dynamics in Soils
Laura Emilia Cerón Rincón1, Fabio Ancízar Aristizábal Gutiérrez1.
1 Instituto de Biotecnología Universidad Nacional de Colombia (IBUN), sede Bogotá leceronr@unal.edu.co, faaristizabalg@unal.edu.co.
Recibido: enero 18 de 2012 Aprobado: junio 25 de 2012
Resumen
Los ciclos biogeoquímicos del fósforo (P) y del nitrógeno (N) son sistemas dinámicos que suceden a través de la biosfera, de cuyos mecanismos de transformación depende la disponibilidad de estos elementos para diferentes formas de vida. Se acepta que la diversidad y actividad de las poblaciones microbianas posee un papel crucial en la dinámica de los nutrientes y por tanto el desafío está en comprender, como responden a las condiciones ambientales. La actividad microbiana en los suelos depende tanto de la condición del recurso y como de sus propiedades químicas, físicas y biológicas. En este documento se describen conceptos que se han empleado para entender la dinámica del nitrógeno y el fósforo, con el propósito de discutir cómo las características de las diferentes fracciones orgánicas y minerales seleccionan el potencial biológico encargado del recambio de dichos elementos, panorama que actualmente se aborda a través de técnicas independientes del cultivo para estudiar las poblaciones microbianas in situ.
Palabras clave: dinámica de N y P, disponibilidad de nutrientes en suelo, fracciones orgánicas e inorgánicas y actividad microbiana.
Abstract
Biogeochemical cycle's phosphorus (P) and nitrogen (N) are dynamic systems taking place through the biosphere, whose mechanisms of transformation depends on the availability of these elements for different forms of life. It is accepted that the diversity and activity of microbial populations plays a crucial role in nutrient dynamics and therefore the challenge is to understand how they respond to environmental conditions. Microbial activity in soils depends on both the resource condition and its chemical, physical and biological properties. Concepts described herein have been used to understand the nitrogen and phosphorus dynamics, with the aim to discuss how the characteristics of the different organic and mineral fractions select the biological potential responsible for the turnover of these elements, scenario currently addressed through cultivation-independent techniques to study microbial populations in situ.
Key words: N and P dynamics, soil nutrients availability, organic and inorganic fractions and microbial activity.
Introducción
La productividad y dinámica de los ecosistemas terrestres está limitada a la disponibilidad de nutrientes. Para las plantas la disponibilidad de nitrógeno (N) es el principal limitante en la productividad de los cultivos, que junto con del fósforo (P) determinan el crecimiento vegetal. Para incrementar la disponibilidad de estos nutrientes y mejorar la productividad de los cultivos, se introducen al suelo fertilizantes químicos, aunque su utilización es crítica para la producción de alimentos, hoy en día se ha convertido en una práctica costosa y que acarrea serias consecuencias ambientales (Vitousek et al., 1997; Fiedls, 2004). La introducción de carbono orgánico, cambios en las especies vegetales, microambientes (coberturas) e interacciones específicas entre plantas y microorganismos, tienen un fuerte impacto sobre el funcionamiento de los ecosistemas y por tanto, en los procesos biogeoquímicos que gobiernan la transformación de los nutrientes. El desarrollo de prácticas de manejo racionales y eficientes, que incrementen y/o mantengan la fertilidad, a través del uso óptimo de los nutrientes, requiere conocimiento acerca de los mecanismos responsables de la dinámica de dichos elementos. La disponibilidad de elementos en los suelos, se debe considerar desde los diferentes compartimientos orgánicos y minerales (Delgado y Salas 2006) y su interacción con la biomasa microbiana (Nannipieri y Eldor, 2009). Diferentes formas de vida participan en los procesos que se llevan a cabo en el suelo, pero las comunidades microbianas poseen un papel principal (Madsen, 2011), ya que de ellas dependen funciones como hacer disponibles los nutrientes para ellas mismas y para otras formas de vida como las plantas, dinámica esencial para el mantenimiento de los ciclos biogeoquímicos. Varios factores tienen influencia en la actividad microbiana de los suelos: los factores naturales: cambios climáticos, condiciones geográficas, profundidad, propiedades físicas, químicas y biológicas y los factores antropogénicos: contaminación y manejo agrícola. Entre las principales metas de la ecología microbiana se plantea entender cómo los factores abióticos influyen en la abundancia, distribución de microorganismos y en los procesos que llevan a cabo. La diversidad funcional microbiana puede ser más relevante que su misma diversidad taxonómica (Cadwell, 2005). La biomasa y actividad microbiana son cruciales para el funcionamiento de los ecosistemas, indicando la calidad del recurso (Cerón y Melgarejo, 2005; Doran y Safley, 1997), además de ser sensibles a los cambios ambientales y a las prácticas de manejo.
Los microorganismos (solubilizadores de fosfatos y diazótrofos, entre otros) poseen el papel principal en muchos procesos que involucran la transformación del N y del P, asociados a efectos de estimulación vegetal (fitoestimulación y biofertilización), que a su vez están influenciados por la combinación de factores como las especies vegetales, el tipo de suelos y las condiciones ambientales (Tilak et al., 2005). Las plantas seleccionan y estimulan comunidades microbianas a través de la secreción de exudados radiculares, el desarrollo de dichas comunidades es determinante en la productividad vegetal (Tilak et al., 2005). Sin embargo, para conocer los vínculos entre las estructura de las comunidades microbianas y la dinámica del N y del P se requiere de más investigación (Chen et al., 2008). Se han empleado diversas técnicas para estimar la actividad microbiana, las tasas de mineralización, respiración, actividades enzimáticas, recuentos microbianos en placa, entre otras. Sin embargo, su implementación es dispendiosa, sólo estima una parte de la comunidad (1%) produciendo información limitada y que no da cuenta de la diversidad funcional (número y distribución de funciones) potencial y actividad de las comunidades. A través de los ácidos nucleicos obtenidos a partir de poblaciones microbianas presentes en el suelo, actualmente se pueden estudiar diferentes marcadores, que proporciona mayor fiabilidad y cantidad de información, acerca de los procesos que suceden en los ambientes naturales (Sharma et al., 2006). Este documento describe conceptos que se han empleado para entender la dinámica del nitrógeno y el fósforo, con el propósito de discutir cómo las características de las diferentes fracciones orgánicas y minerales, seleccionan el potencial biológico (diversidad y actividad de las poblaciones microbianas) encargado de la dinámica de dichos elementos.
Dinámica del Nitrógeno.
La dinámica de este elemento (figura 1) en la biosfera comprende principalmente la fijación de nitrógeno (N2), la mineralización, la nitrificación, la desnitrificación (Hayatsu et al., 2008) y la oxidación anaeróbica del amonio Annamox (Hu et al., 2011), procesos mediados principalmente por microorganismos presentes en el suelo (Klotz y Stain, 2008). El nitrógeno entra en la biosfera por fijación química y biológica del nitrógeno molecular (N2) y se remueve de la misma por desnitrificación. Delgado y Salas (2006) proponen que la determinación cuantitativa de los diferentes compartimientos orgánicos y minerales, está relacionada con la disponibilidad de nutrientes y su susceptibilidad de alteración debido al manejo, sistemas de producción y procesos del suelo, donde estos compartimientos estén involucrados. Recientemente se ha propuesto (Nannipieri y Eldor, 2009) que para interpretar los mecanismos y proponer modelos de la dinámica del nitrógeno, es necesario tener en cuenta las diferentes fracciones orgánicas o compartimentos, considerando que la temperatura, el tamaño de partícula de los residuos, la agregación, el tipo de suelo, la humedad, el secado y molido, el anegamiento y la anaerobiosis y los efectos vegetales, también tienen efectos sobre la dinámica del nitrógeno. Para entender qué direcciona la dinámica del N, es necesario comprender la intrincada red de procesos que dependen de la actividad microbiana (McGrath et al., 2010). Sin embargo, es poco lo que se sabe acerca de la causalidad de dichos procesos y de la diversidad microbiana edáfica.
Antes del descubrimiento de proceso de Haber-Bosch (síntesis química de amoniaco) a principios del siglo XX, se consideraba que la fijación biológica de nitrógeno proporcionaba casi exclusivamente la entrada de este elemento en la biósfera(Fields, 2004). Se estima que la fijación biológica contribuye globalmente con 180 millones de toneladas métricas de amonio por año y que el aporte actual de nitrógeno antropogénico es comparable con el aporte biológico (Tilak et al., 2005). Desde su descubrimiento, se ha reconocido la importancia de la fijación biológica para la productividad y sostenibilidad de los cultivos (Rees et al., 2005), y a pesar de décadas de estudio, el entendimiento de los mecanismos implicados en tal proceso, aún constituye un reto científico. Los procesos de fijación los llevan a cabo gran variedad de bacterias que poseen nitrogenasas, enzimas que rompen el triple enlace del nitrógeno molecular y producen amonio. Para estudiar los microorganismos implicados en dicho proceso en ambientes naturales, se utiliza como biomarcador el gen nifH que codifica la sub unidad hierro-proteína de la nitrogenasa, este biomarcador proporciona evidencias del potencial de proceso. Las bacterias diazótrofas puede ser simbióticas (obligadas, asociativas o endófitas) y de vida libre, representadas en Rhizobium y Frankiapara las obligadas y por Cyanobacteria, Azospirillum, Azotobacter, Acetobacter diazotrophicus, Azoarcus entre las asociativas o endófitas; Achromobacter, Acetobacter, Alcaligenes, Arthrobacter, Azospirillum, Azotobacter, Azomonas, Bacillus, Beijerinckia, Clostridium, Corynebacterium, Derxia, Enterobacter, Herbaspirillum, Klebsiella, Pseudomonas, Rhodospirillum, Rhodopseudomonas y Xanthobacter, entre las no simbióticas.
Para los sistemas agrícolas la incorporación de nitrógeno es esencial para la fertilidad del suelo y por tanto para la productividad vegetal. No existe un consenso sobre los efectos de la fertilización orgánica o mineral a largo plazo sobre la diversidad diazótrofa en suelos negros (Tang, et al., 2012). Para estudiar dichos efectos, se realizaron análisis de polimorfismo de longitud de fragmentos de restricción RFLP (Restriction fragment length polymorphisms), se construyeron cuatro librerías a partir de los amplímeros de genes nifH de comunidades microbianas, bajo diferentes tratamientos de fertilización a largo plazo: (1) orgánica, (2) química, (3) la combinación de las dos anteriores y (4) un tratamiento control. Se puede decir que los tipos de fertilización evaluados, ejercieron alguna selectividad sobre las comunidad fijadora del suelo (Tang, et al., 2012). La fertilización orgánica proporcionó condiciones ambientales favorables para el incrementó la diversidad de filotipos, se presentó una distribución y composición mas amplia del "pool" de genes nifH, en contraste se observó el efecto contrario con la fertilización química, dado que decrece la diversidad de genes nifH, al parecer la combinación de fertilización orgánica y química neutralizó la influencias observadas en cada uno por separado. En la rizósfera de plantas de sorgo cultivadas en ecosistemas semiáridos y bajo tratamientos de fertilización a largo plazo (Hai et al., 2009), se evaluó la presencia de comunidades microbianas funcionales involucradas en procesos claves del ciclo del nitrógeno, a partir de ADN extraído de muestras de suelo y utilizando técnicas de PCR cuantitativa. Los resultados indican que el tratamiento con fertilizantes, el estado fenológico, combinado con factores ambientales afectan la abundancia los grupos funcionales, cada régimen de fertilización resulta en un patrón de abundancia típico de las poblaciones funcionales. Se observó un gran efecto de la fertilización orgánica (estiércol) sobre la abundancia del genes nifH particularmente en la floración (Hai et al., 2009), donde se encontraron las mayores concentraciones de carbono, nitrógeno y fósforo totales, así como plantas más vigorosas y con mayor crecimiento; se puede decir que el contenido de materia orgánica y la estructura del suelo reducen los efectos deletéreos de los periodos secos. En contraste, se encontraron bajas concentraciones de C y P totales en los tratamientos con fertilización química (urea), con bajos rendimientos en el número de copias de genes nifH, lo que indica que la falta de macro nutrientes no solo limita la efectividad de la fijación biológica de nitrógeno, sino también reduce el tamaño de las poblaciones diazótrofas en ecosistemas semiáridos. Sin embargo, no se puede establecer desde los anteriores estudios (análisis de ADN) la expresión génica de los grupos funcionales y por tanto su contribución a los procesos en los suelos. Existen pocos estudios que analicen dicha expresión a través de la caracterización de mARN y proteínas. Se han estudiado comunidades diazotróficas en cultivos de arroz (Wartiainen et al., 2008), utilizando técnicas de PCR-DGGE (Denaturant Gradient Gel Electrophoresis) para analizar genes nifH transcritos (mARNs), obtenidos de muestras de suelos con y sin fertilización química de nitrógeno, en dos tiempos a medio día y a media noche. La técnica de PCR-DGGE se utilizó como "huella digital" de la comunidad y se realizó el análisis filogenético. Los perfiles generados para la población activa (mARN) fueron únicos para cada tratamiento y de estos perfiles se obtuvieron secuencias con alta identidad con Azoarcus. Mientras que los diferentes perfiles para el potencial de la población (ADN) fueron homogéneos; se concluyó que hubo un bajo número de diazótrofos activos (mARN) en las muestras y una marcada estabilidad en la estructura de la comunidad diazótrofa (ADN) a pesar de la gran diferencia en la disponibilidad de nitrógeno, entre los suelos con y sin fertilización. La alta variación de la comunidad activa, responde a la disponibilidad de recursos y escalas espacio temporales. Para monitorear la presencia (ADN) y actividad (mARN) de la comunidad diazotrófica presente en raíces de plantas de arroz silvestre, se diseñó un microarreglo (Zhang et al., 2007) que abarca (90% de las secuencias de bases de datos) la diversidad conocida de diazótrofos procariotes basándose en secuencias de genes nifH. A pesar de la gran diversidad de diazótrofos detectados con esta técnica, se demostró que únicamente un pequeño subconjunto está activo, los transcritos recobrados del ambiente estaban dominados por nitrogenasas del tipo Azoarcus, enfoque que permitió la identificación de especies claves para una función particular.
Los procesos de mineralización del nitrógeno son determinantes para la disponibilidad del elemento en los ecosistemas terrestres (Nourbakhsh y Alinejadian, 2006), dados principalmente por la deaminación y degradación de materia orgánica, de modo que responden a la cantidad y tipo de enmiendas orgánicas. Se ha demostrado (Forana et al., 2011) que existen efectos vegetales sobre la composición de las múltiples fracciones de materia orgánica, que pueden tener una importante influencia sobre la biodegradabilidad y biodisponiblidad del carbono y nitrógeno, dichos efectos están relacionados con la dinámica del N de los detritos radiculares y la composición funcional vegetal, que a su vez tienen influencia sobre las tasas netas de mineralización. Se conoce que la asimilación microbiana (inmovilización) es un proceso critico que controla la disponibilidad de N para las plantas (Forana et al., 2011), que junto con la relación C:N en plantas y suelo, son variables claves que afectan la tasas de mineralización. Se ha observado (Okano et al., 2004) relación entre las tasas de mineralización encontradas y los contenidos de materia orgánica, y recientemente se ha propuesto (Kader et al., 2010) que la evaluación de las diferentes fracciones de materia orgánica, se puede utilizar para predecir el comportamiento de las tasas netas de mineralización de nitrógeno.
Los péptidos y proteínas son los compuestos más abundantes de la fracción de N orgánica, se ha demostrado (Nannipieri y Eldor, 2009) que una gran porción de estos se encuentra asociada con compuestos húmicos. El principal mecanismo de movilización del nitrógeno orgánico es la proteólisis, la hidrólisis de proteínas puede liberar aminoácidos y péptidos que son metabolizados por la mayoría de los organismos, por esto se considera crucial para mantener la calidad del suelo, la productividad y sostenibilidad de la agricultura (Fuka et al., 2008). Dicha actividad está dada principalmente por las serina-proteasas (SUB) y las metaloproteasas neutras (NPR), ambas son proteasas extracelulares (Kamimura y Hayano, 2000). Se ha propuesto (Fuka et al., 2009) que las proteasas de origen bacteriano (Vibrio ssp., Bacillus ssp., Thermoactinomyces ssp., Paenibacillus ssp., Clostridium ssp., yAlicylobacillus ssp.) son las principales responsables de la degradación proteica en los suelos. Utilizando PCR cuantitativa se evaluó la presencia los genes (sub y npr) y sus actividades relacionadas, en distintos terrenos con cultivos de papa (Solanum tuberosum), en función de la adición de fertilizantes químicos y la profundidad. Se propuso (Fuka et al., 2008) que la disponibilidad de carbono y nitrógeno, así como la cantidad y calidad de materia orgánica, son los principales factores que tienen influencia sobre la presencia de genes y actividad proteolítica. Se requieren más estudios sobre los factores que tienen influencia en la expresión, actividad y tiempo de vida de las proteasas en los suelos.
Los procesos de nitrificación (Figura 1) consisten en la oxidación secuencial del amonio a nitrito, y hasta hace poco se le atribuía principalmente, a las bacterias quimiolitoautotróficas oxidantes del amonio (BOA) caracterizadas en numerosos ecosistemas terrestres. Las BOA se clasifican dentro de tres géneros (Freitag et al., 2005) Nitrosomonas (Β-protoebacteria), Nitrosospira (Β-protoebacteria), y Nitrosococcus (Γ-protoebacteria) con base en las secuencias de genes 16S rARN y del gen amoA. Este último codifica la subunidad A de la enzima amonio monoxigenasa (AMO), la cual cataliza el primer paso de la oxidación del amonio y es una herramienta molecular capaz de distinguir poblaciones muy cercanas. Estudios recientes (Leininger et al., 2006; Urich et al., 2008) de expresión de la comunidad microbiana en suelos (metatranscriptómica), reportan altos niveles de expresión de los genes de amoA de arqueas, demostrando la actividad y la dominancia numérica de las arqueas oxidantes de amonio (AOA) sobre las bacterias, lo que mostró un importante metabolismo energético quimiolitoautotrófico que no había sido considerado y por lo tanto un estilo de vida edáfico pobremente caracterizado; a través de la detección de genes 16S rARN se ha determinado (Francis et al., 2007) una amplia distribución de Crenarchaeota en suelos y se ha estudiado su papel en la nitrificación (Nicol y Schleper, 2006).
Los cambios en las condiciones de pH y fertilización nitrogenada del suelo afectan la estructura de las comunidades de BOA, así como de arqueas oxidantes de amonio (Leininger et al., 2006; Hansel et al., 2008; Nicolet al., 2008), ya que estas dependen del NH4+ y NO2- como fuentes de energía específicas. Se ha observado que la adición de fertilizantes de amonio estimula el crecimiento de comunidades de BOA, utilizando como marcadores los genes amoA y 16S rARN cuantificados por PCR en tiempo real se reporta un incremento significativo de las comunidades de BOA (Okano et al., 2004), en suelos agrícolas que se fertilizaron anualmente (manejo convencional) con respecto a suelo sin fertilización (manejo orgánico). En este último se observó un mayor consumo de amonio y la acumulación de nitrato, sugiriendo un efecto de la adición de amonio a largo plazo. Se han encontraron (Nakaya et al., 2009) incrementos de genes amoA de arqueas y en la concentración de nitrato tras la adición de amonio, el número de copias de genes amoA de arqueas fue diez veces mayor al de genesamoA de betaproteobacterias. A pesar de esto, se considera (Jia et al., 2009) que en suelos agrícolas es más importante el papel de las BOA en la oxidación de amonio, a pesar de la dominancia de las AOA, dado que no se ha encontrado relación entre la abundancia de AOA y las tasas de nitrificación (Bernhard et al., 2010). Las AOA se pueden adaptar a pH bajos (Nicol et al., 2008) donde predominan especies no ionizadas (NH3) y a bajas concentraciones de amonio (Stopnisek et al., 2010; Zhalnina et al., 2012) por ejemplo, cuando este se libera paulatinamente a partir de compuestos orgánicos. Aún se requiere de mayor conocimiento para entender el papel que poseen los organismos conocidos en los procesos de nitrificación y para encontrar a otros actores de dicho proceso.
A la oxidación del amonio a nitrito le sigue la oxidación de nitrito a nitrato, proceso mediado por bacterias oxidantes de nitrito (BON). Las BON se han clasificado en cuatro géneros Nitrobacter (α-proteobacteria),Nitrospina (δ-proteobacteria), Nitrococcus (Γ-proteobacteria) y Nitrospira (clase Nitrospira, phylum Nitrospirae), se conoce que las arqueas también contribuyen a este proceso en el suelo. Las prácticas de fertilización de nitrógeno tienen influencia en la diversidad de los grupos funcionales de BON (Freitag et al., 2005). La oxidación biológica del amonio en condiciones anaeróbicas se lleva a cabo por las bacterias denominadas ANAMMOX, que se han detectado por técnicas moleculares en muestras ambientales (Hayatsu et al., 2008; Francis et al., 2007). Estas bacterias pertenecen a los géneros Brocadia, Scalindua y Kuenenia del phylum Planctomycetes, ampliamente distribuido, se encuentra en diversos ambientes que incluyen océanos, lagos y suelos. Su estudio se ha centrado (Jin et al., 2012) como proceso ideal en el tratamiento de efluentes residuales ricos en nitrógeno, pero este proceso se puede inhibir por diversos factores como concentraciones elevadas de amonio, nitritos, materia orgánica, sales, metales pesados, fosfatos y sulfitos.
La desnitrificación es el proceso más importante para el ciclo del nitrógeno, éste devuelve el nitrógeno fijado a la atmósfera por procesos de respiración microbiana, a través de la reducción desasimilatoria de nitratos (NO3-) y nitritos (NO2-) a N2O y N2, respectivamente; también involucra la reducción asimilatoria del nitrito (Simon, 2002) para convertirlo en amonio e incorporarlo al metabolismo celular. Las plantas y diferentes microorganismos - arqueas, bacterias y hongos (Gorfer et al., 2011) poseen la capacidad de incorporar nitratos en su biomasa, lo que reduce su perdida por lixiviación y desnitrificación. Se conocen alrededor de 50 géneros de bacterias desnitrificantes (Zumft, 1997). La actividad desnitrificante en bacterias se induce en presencia de nitratos y nitritos y bajo condiciones limitantes de oxigeno (O2) y se inhibe por exceso de oxígeno. Algunos hongos son capaces de producir N2O y N2 a través de dos rutas de desnitrificación fúngica, contribuyendo bajo condiciones aerobias y anaerobias (Hayatsu et al., 2008) al potencial de desnitrificación y a la producción de N2O. La actividad desnitrificante fúngica se induce en presencia de nitratos y nitritos y cantidades significativas de O2 pero, no se ha observado (Zhou et al., 2001) su inducción por exceso de oxígeno, y algunas arqueas también median dichos procesos.
Para entender la estructura y la diversidad de las comunidades que contribuyen en los procesos de desnitrificación (NO3- → NO2- → NO → N2O → N2) se han utilizado como marcadores moleculares los genes nitrato (narG y napA) y nitrito (nirS y nrfA) reductasas presentes en la cadena respiratoria, principalmente (Klotz y Stain, 2008) en cuatro reacciones catalizadas por las enzimas: nitrato reductasa (Nar), nitrito reductasa (Nir), oxido nítrico reductasa (Nor), oxido nitroso reductasa (Nos), provenientes de muestras ambientales han mostrado (Smith et al., 2007) gran diversidad. La composición y actividad de las comunidades bacterianas desnitrificantes en suelos agrícolas se pueden ver afectadas por la adición y el tipo de fertilización nitrogenada: utilizando como marcadores los genes narG (nitrato reductasa) y nosZ (oxido nitroso reductasa) se encontraron incrementos en las comunidades (Enwall et al., 2005; Drambeville et al., 2006; Kandeler et al., 2006; Chèneby et al., 2010), en respuesta a la adición de fuentes orgánicas de nitrógeno, frente a los encontrados tras la adición de fertilización mineral, así como mayores potenciales de desnitrificación presentes en los terrenos con adición de fuentes orgánicas de nitrógeno. La adición de fertilizantes orgánicos también tiene influencia sobre las propiedades químicas y físicas del suelo, resultando en una mayor cantidad de biomasa microbiana (Cmicro), que a su vez incrementa los contenidos de materia orgánica y de nutrientes, frente a la fertilización con nitrato de amonio que disminuye el pH del suelo. Se sugiere (Chèneby et al., 2010) que la disponibilidad de carbono y la temperatura regulan la actividad del potencial biológico encargado de la reducción de nitrato. La adición de residuos vegetales con una relación C:N baja, induce (Huang et al., 2004) la producción de N2O, mientras que por adicción de residuos vegetales que contienen una relación C:N alta la especie gaseosa predominante es N2; sin embargo, niveles de transcriptos de nosZ (oxido nitroso reductasa) respondieron de manera similar, a la adición de residuos vegetales con diferente contenido de C disponible (Henderson, et al., 2010). En sedimentos costeros, la distribución de las secuencias encontradas para los genes nirS y nirK (nitrito reductasas) y sus relaciones filogenéticas, pueden responder a adaptaciones a gradientes de salinidad y nitratos (Santoro et al., 2006).
Para estudiar de manera más comprehensiva la influencia que tienen los factores ambientales sobre procesos claves para el ciclo del nitrógeno y carbono, y que llevan a cabo las comunidades microbianas, a partir de ADN de la comunidad y utilizando tecnología de microarreglos (GeoChip):, se encontró (Berthrong et al., 2009) una disminución de genes de nitrificación y de fijación de nitrógeno, en plantaciones de forestales (Eucalyptus) frente a praderas endémicas. Lo anterior mostró correlaciones con el descenso en el nitrógeno microbiano (Nmic) y el aumento en el amonio, sugiriendo que la comunidad microbiana en el plantación es menos capaz de degradar el mantillo derivado del eucalipto mas ácido y recalcitrante, frente a la comunidad de las praderas. De la misma forma, se analizaron genes funcionales en ecosistemas de la Antártida, donde se detectó mayor presencia de genes para fijación de nitrógeno (nifH) en los terrenos cubiertos por vegetación a frente terrenos desnudos (Yergeau et al., 2007), mientras que la alta presencia de genes de desnitrificación (nirK y narG) se relacionó con el aumento de temperatura. Los genes de ureasas y de amonio monooxigenasas se encontraron entre los genes dominantes a través de diferentes lugares estudiados, pero en cada lugar particular se asocian a diferentes organismos, lo que sugiere diferentes estructuras responsables de las mismas funciones.
Dinámica del fósforo
Este elemento proviene de las apatitas y depósitos de fosfato natural de donde es liberado a través de procesos de meteorización, lixiviación, erosión y extracción industrial como fertilizante. El fosfato liberado paulatinamente de las apatitas lo absorben las plantas y la biomasa microbiana, luego se incorpora en la materia orgánica de los suelos y sedimentos, y nuevamente se deposita en formas minerales poco solubles. El fósforo inorgánico (Pi) se presenta generalmente fuertemente fijado en forma de fosfatos de Ca2+, Fe2+, Mg2+ y Al3+, especialmente en arcillas del grupo de las caolinitas y ocluido en los óxidos de hierro y aluminio. Incluso el P, aplicado como fertilizante en forma de superfosfato, puede fácilmente constituir compuestos inorgánicos inutilizables, debido a su inmovilización sobre la materia orgánica y arcillas.
La mayoría del fósforo de los ecosistemas terrestres se encuentra localizado en el suelo, generalmente su contenido varia entre 100 a 3000 mg de P/kg; entre un 15 y un 80% de dicho contenido está en formas orgánicas (Po), dependiendo de la naturaleza del material parental, el grado de precipitación, las pérdidas del mismo, entre otros. La principal fuente de compuestos orgánicos de fósforo (Po) la constituyen residuos de plantas, animales y microorganismos, que liberan compuestos como ácidos nucleicos, fosfolípidos y ésteres, lo que representa entre un 30 y un 60% del P total. La mineralización de éstos, retornándolos a fosfatos HP042- y de H2PO4- inorgánicos (Pi), permite el reciclaje del elemento para que regrese a la biota. Los fosfatos (Pi) son utilizados por autótrofos y heterótrofos, incluidos los descomponedores, en la cadena trófica, para ser devueltos por estos últimos. La disponibilidad de estos iones está fuertemente influenciada por el pH del suelo y por la adición de fertilizantes (Barancíková et al., 2007). La disponibilidad del P también está dada por el uso del suelo; cambios en la vegetación de pastizales a bosques de coníferas aumentan la mineralización del P (Chen et al., 2008), sin embargo, dichos cambios se asociaron a la disminución de la fertilidad en términos de disminución de actividad fosfatasa, biomasa microbiana y aumento en la tasa metabólica.
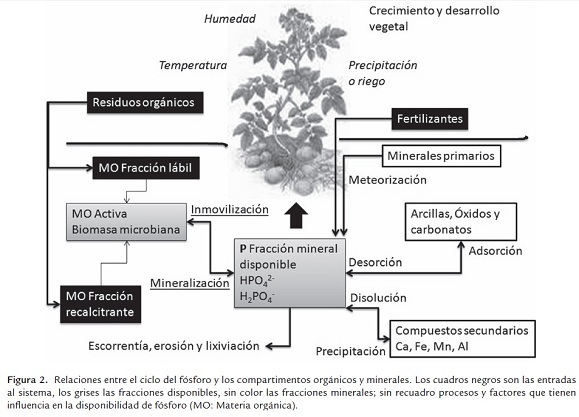
Las fuentes de fósforo y su distribución son críticas para la sostenibilidad de las prácticas agrícolas (Chen et al., 2008), ya que dicho elemento se requiere para favorecer la formación de semillas, el desarrollo radicular, la fuerza de las pajas en los cereales y la maduración de los cultivos. Las plantas han desarrollado varias estrategias para la adquisición de fósforo bajo limitación de este nutriente (Bûnemann, 2008; Turner et al., 2003), que incluyen modificaciones morfológicas de la raíz, adaptaciones fisiológicas, alteraciones bioquímicas que promueven asociación con microorganismos micorrízicos y no simbiontes. El ciclo del P (figura 2), a diferencia del ciclo del nitrógeno, no incluye cambios en la valencia. Los principales procesos en el suelo involucran, toma por las plantas y su retorno a través de los residuos vegetales y animales, reacciones de fijación a las superficies de arcillas y óxidos y el recambio biológico dado por procesos de mineralización-inmovilización y solubilización dependientes de la actividad microbiana (Stevenson y Cole, 1999).
La principal contribución a la dinámica del fósforo en los suelos está dada por el recambio de los procesos de mineralización-inmovilización microbianos (Richardson y Simpson, 2011), que poseen un papel esencial especialmente en la rizósfera. Estos procesos están influenciados por una combinación de factores como las especies vegetales, el tipo de suelos y los factores ambientales. Los microorganismos que colonizan la rizósfera pueden excretar ácidos orgánicos que incrementan la solubilidad del P y enzimas con actividad fosfatasa que hidrolizan mono, di y tri ésteres de fosfato, junto con las asociaciones micorrízicas que son críticas en la disponibilidad para muchas plantas (Graham y Miller, 2005), estas últimas utilizan una combinación eficiente de translocación del P acompañada de actividades fosfatasa y fitasa.
La fracción orgánica (Po) está conformada por diversas moléculas, lo que hace que su velocidad de mineralización sea diferente. Los ácidos nucléicos y fosfolípidos se mineralizan rápidamente (Lim et al., 2007), ya que los diésteres de fosfato se adsorben débilmente en los materiales del suelo, siendo más vulnerables a la degradación microbiana, mientras que los monoésteres, como los fosfatos de inositol, no son fácilmente mineralizables y llegan a acumularse en grandes cantidades. Los fosfatos de inositol (IPx, donde x=1,2,...6) se encuentran en diversos ambientes naturales, son sintetizados por las plantas (Turner et al., 2002) y son la forma dominante de la fracción orgánica (Po). El más importante es el fitato (myo-inositol hexakisfosfato) que puede llegar a ser el 80% del Po. Por otra parte, el ácido fítico está fuertemente adsorbido a las superficies de los óxidos férricos y también tiene fuertes interacciones con los ácidos húmicos y fúlvicos; se han encontrado correlaciones entre las fracciones de nonoésteres de fosfatos y el grado de humificación (Barancíková et al., 2007). Para liberar los grupos fosfatos del inositol se requiere de fosfatasas especificas llamadas fitasas, que se han detectado en aguas marinas, de lagos y en sedimentos y suelos (Lim et al., 2007); el fitato en los ambientes acuáticos es rápidamente mineralizado mientras que en los ecosistemas terrestres se acumula. Se conocen (Idriss et al., 2002) microorganismos (Bacillus, Enterobacter ssp., hongos como Aspergillus, Emmericella, Penicillium y hogos micorrizicos) que producen actividad fitasa extracelular y estimulan el crecimiento vegetal por aumento en la disponibilidad de fosfatos. La desfosforilación del myo- IP6 es catalizada por la actividad 3-fitasa de origen bacteriano y la 6-fitasa de origen vegetal, sin embargo la actividad puede ser inhibida por la presencia de montmorillonita (Turner et al., 2002); el tipo de arcillas y el número de grupos fosfato presentes tiene influencia en la adsorción. Las poblaciones microbianas rizosféricas poseen actividad para degradar el fitato y se cree (Limet al., 2007) que las fitasas tipo Β-helice (BBP: Β-propeller phytase) tienen el principal papel en la hidrólisis de dicho sustrato, tanto en comunidades acuáticas como en comunidades de suelo. Sin embargo, en las bases de datos ambientales para suelo y sedimentos (AAFX, AAGA) existe un cubrimiento muy bajo de secuencias para estos genes. Recientemente (Damon et al., 2012) se han detectado transcriptos de fitasas en estudios de metatranscriptómica en mantillo de bosques y se ha sugerido (Vincent et al, 2010) que la mineralización del Po en dichos ecosistemas contribuye a la disponibilidad del elemento, más que las fracciones inorgánicas. Sin embargo, se desconocen aún los mecanismos que le dan estabilidad a las fracciones de Po, lo que permitiría el entendimiento de la dinámica de este elemento.
Las fosfatasas extracelulares que se requieren para la mineralización/hidrólisis de los ésteres orgánicos de P, las producen microorganismos (Bacillus subtilis, Nostoc sp., Caulobacter crescentus, Pseudomonas aeruginosa, Sinorhizobium meliloti, Mesorhizobium loti, Corynebacterium glutamicum) y plantas. La determinación de su actividad en el suelo se utiliza como indicador del potencial de mineralización de fósforo orgánico y de actividad biológica (Acosta y Tabatabai, 2000). La aplicación de materia orgánica incrementa tanto la actividad fosfatasa como el contenido de fósforo microbiano (Pmic), que a su vez contribuye al incremento de P disponible. Se encontró (Sakurai et al., 2008) una mayor actividad de fosfatasa alcalina y diversidad de genes que codifican esta actividad, en comunidades bacterianas de suelos agrícolas, utilizando técnicas PCR cuantitativa y DGGE, así como un mayor contenido de fósforo microbiano (Pmic) y de P disponible, en respuesta a la adición de enmiendas orgánicas frente a una fertilización química; resultados que indican que la actividad y biomasa microbiana poseen un papel fundamental en la mineralización de este elemento, especialmente en la rizosfera. Se puede decir que bajo un esquema que favorezca las asociaciones microbianas para incrementar la eficiencia en la disponibilidad del P para las plantas, éstas son beneficiosas desde el punto de vista económico y ambiental para el desarrollo de sistemas agrícolas.
Conclusiones
Aunque desde hace varias décadas se conoce que la transformación de nitrógeno y la mineralización de fósforo son procesos inherentes al suelo, así como la pérdida de N y la inmovilización del P, la implementación de técnicas independientes del cultivo en los ecosistemas terrestres han permitido ampliar la visión acerca de los procesos edáficos, en términos del conocimiento de la estructura de las comunidades microbianas y su respuesta a los cambios ambientales, visión que incluso ha reevaluando paradigmas acerca de los organismos responsables de dichos procesos; aun más el uso técnicas de alto rendimiento para el análisis de ácidos nucleicos y proteínas de comunidades microbianas, ha cambiando el marco de referencia que se tenía acerca de los responsables y de procesos que se dan en los suelos. Aunque la mayoría de las investigaciones se han abordado desde la información genómica de la comunidad, a través de la cual se puede establecer un potencial, más no atribuir a un proceso activo, la estructura de las comunidades responde de manera positiva a los contenidos de materia orgánica; las respuestas del potencial funcional microbiano a los cambios en las fracciones orgánicas y minerales de los suelos, han tenido correlación con una mayor actividad en los suelos, con la disponibilidad de los elementos e incluso, en algunos casos, con la productividad de los cultivos.
Los compuestos de nitrógeno y fósforo son nutrientes críticos para los organismos que dependen directamente del suelo y en últimas para la cadena trófica. Dichos nutrientes determinan el desarrollo cultivos y productividad de los ecosistemas. Se requiere del entendimiento de los factores que afectan los procesos naturales y los mecanismos bióticos y abióticos involucrados con las pérdidas y disponibilidad del N y P, para el desarrollo de prácticas de manejo tendientes a su uso eficiente en la nutrición vegetal, como también para reducir los efectos adversos de algunas prácticas agrícolas sobre la calidad del suelo y el agua. La dilucidación de los mecanismos que median la interacción de comunidades microbianas edáficas y los procesos del ecosistema, debe ser abordada desde las redes o vínculos que existen entre la disponibilidad de recursos, estructura y función de la comunidad microbiana, y la búsqueda de información de procesos metabólicos microbianos activos.
Referencias bibliográficas
1 Acosta-Martínez V., Tabatabai. M.A. 2000. Enzyme activities in a limed agricultural soil. Biology and Fertility of soils. 31(1): 85-91.
2 Barancíková G., Liptaj T., Prónayová N. 2007. Phosphorus fractions in arable and mountain soils and their humic acids. Soil and Water Research. 2(4): 141-148.
3 Bernhard A.E., Landry Z.C., Blevins A., de la Torre J.R., Giblin A.E., Stahl D.A. 2010. Abundance of ammonia-oxidizing Archaea and Bacteria along an estuarine salinity gradient in relation to potential nitrification rates.Applied and Environmental Microbiology. 76(4): 1285-1289.
4 Berthrong S.T., Schadt C.W., Piñeiro G., Jackson R.B. 2009. Afforestation alters the composition of functional genes in soil and biogeochemical processes in South American Grasslands. Applied and Environmental Microbiology. 75(19): 6240-6248.
5 Bûnemann E.K. 2008. Enzyme additions as a tool to assess the potential bioavailability of organically bound nutrients. Soil Biology and Biochemistry. 40: 2116-2129.
6 Braker G., Fesefeldt A., Witzel K.P. 1998. Development of PCR primer systems for amplification of nitrite reductase genes (nirK and NirS) to detect denitrifying bacteria in environmental samples. Applied and Environmental Microbiology. 64: 3769-3775.
7 Caldwell B.A. 2005. Enzyme activities as a component of soil biodiversity: A review. Pedobiologia. 49(5): 637-644.
8 Cerón Rincón L.E., Melgarejo L.M. 2005. Enzimas de suelo: indicadores de salud y calidad. Acta Biológica Colombiana. 10(1): 5-18.
9 Chen C.R., Condron L.M., Xu Z.H. 2008. Impacts of grassland afforestation with coniferous trees on soil phosphorus dynamics and associated microbial processes: A review. Ecology and Management. 255: 396-409.
10 Chèneby D., Bru D., Pascault N., Maron P., Ranjard L., Philippot L. 2010. Role of plant residues in determining temporal patterns of the activity, size, and structure of nitrate reducer communities in soil. Applied and Environmental Microbiology. 76(21): 7136-7143. doi:10.1128/AEM.01497-10
11 Dambreville C., Hallet S., Nguyen C., Morvan T., Germin J.C., Philippot L. 2006. Structure and activity of the denitrifying community in a maize cropped field fertilized with pig manure or ammonium nitrate. FEMS Microbiology Ecology. 56(1): 119-131.
12 Damon C., Lehembre F., Oger-Desfeux C., Luis P., Ranger J., Fraissinet-Tachet L., Marmeisse R. 2012. Metatranscriptomics reveals the diversity of genes expressed by eukaryotes in forest soils. PLoS ONE. 7(1): e28967. doi:10.1371/journal.pone.0028967
13 Delgado R., Salas A.M 2006. Consideraciones para el desarrollo de un sistema integral de evaluación y manejo de la fertilidad del suelo y aplicación de fertilizantes para una agricultura sustentable en Venezuela. Agronomía Tropical. 56(3): 289-323.
14 Doran J.W., Safley M. 1997. Defining and assessing soil health and sustainable productivity. En: Biological Indicators of Soil Health. CAB INTERNATIONAL, New York. Pag.1-22.
15 Enwall K., Philippot L., Hallin S. 2005. Activity and composition of the denitrifying bacterial community respond differently to long-term fertilization. Applied and Environmental Microbiology. 71(12): 8335-8343.
16 Fiedls, S. 2004. Global Nitrogen: Cycling out of Control. Environmental Health Perspectives. 112: A556 -A563.
17 Francis C.A., Beman J.M., Kuypers M.M. 2007. New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation. The ISME Journal. 1: 19-27.
18 Freitag T.E., Chang L., Clegg C.D., Prosser J.I. 2005. Influence of inorganic nitrogen management regime on the diversity if nitrite-oxidizing bacteria in agricultural grassland soils. Applied and Environmental Microbiology. 71: 8323-8334.
19 Fuka M.M., Engel M., Gattinger A., Bausenwein U., Sommer M., Munch J.C., Schloter M. 2008. Factors influencing variability of proteolytic genes and activities in arable soils. Soil Biology and Biochemistry. 40: 1646-1653.
20 Fuka M.M., Engel M., Hagn A., Munch J.C., Sommer M., Schloter M. 2009. Changes of diversity pattern of proteolytic bacteria over time and space in an agricultural soil. Microbial Ecology. 57:391-401.
21 Gorfer M., Blumhoff M., Klaubauf S., Urban A., Inselsbacher E., Bandian D., Mitter B., Sessitsch A., Wanek W., Strauss J. 2011. Community profiling and gene expression of fungal assimilatory nitrate reductases in agricultural soil. The ISME Journal. 5(11): 1771-1783.. doi:10.1038/ismej.2011.53
22 Graham J., Miller R. 2005. Mycorrhizas: gene to function. Plant and Soil. 274: 79-100.
23 Griffiths B.S., Bonkowski M., Roy J., Ritz K.. 2001. Functional stability substrate, utilization and biological indicators of soil following environmental impacts. Applied Soil Ecology. 16(1): 49-61.
24 Hai B., Diallo N.H., Sall S., Haesler F., Schauss K., Bonzi M., Assigbetse K., Bonzi M., Assigbetse K., Chotte J.L., Munch J.C., Schloter M. 2009. Quantification of key genes steering the microbial nitrogen cycle in the rhizosphere of sorghum cultivars in tropical agroecosystems. Applied and environmental microbiology. 75(15): 4993-5000. doi:10.1128/AEM.02917-08
25 Hansel C.M., Fendorf S., Jardine P.M., Francis C.A. 2008. Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile. Applied and Environmental Microbiology. 74(51): 1620-1633.
26 Hayatsu M., Tago K., Saito M. 2008. Various players in the nitrogen cycle: Diversity and functions of the microorganisms involved in nitrification and denitrification. Soil Science and Plant Nutrition. 54: 33-45.
27 Henderson S.L., Dandie C.E., Patten C.L., Zebarth B.J., Burton D.L., Trevors J.T., Goyer C. 2010. Changes in denitrifier abundance, denitrification gene mRNA levels, nitrous oxide emissions, and denitrification in anoxic soil microcosms amended with glucose and plant residues. Applied and environmental microbiology. 76(7): 2155-2164. doi:10.1128/AEM.02993-09
28 Hu B., Shen L., Xu X., Zheng P. 2011. Anaerobic ammonium oxidation (anammox) in different natural ecosystems. Biochemical Society transactions. 39(6): 1811-6. doi:10.1042/BST20110711
29 Huang Y., Zou J., Zheng X., Wang Y., Xu X. 2004. Nitrous oxide emissions as influenced by amendment of plant residues with different C:N ratios. Soil Biol. Biochem. 36:973-981.
30 Idriss E.E., Makarewicz O., Farouk A., Rosner K., Greiner R., Bochow H., Richer T., Borriss R.. 2002. Extracellular phytase activity of Bacillus amyloliquefaciens FZB45 contributes to its plant growth promoting effect.Microbiology. 148: 2097-2109.
31 Jia Z., Conrrad R. 2009. Bacteria rather than Archaea dominate microbial oxidation in an agricultural soil.Environmental Microbiology. 11: 1658-1671.
32 Jin R.C., Yang G.F., Yu J.J., Zheng P. 2012. The inhibition of the Anammox process: A review. Chemical Engineering Journal. 197: 67-69.
33 Kamimura Y., Hayano K. 2000. Properties of protease extracted from tea-field soil. Biology and Fertility of Soils. 30: 351-355.
34 Kader M., Sleutel S., Begum S., D'Haene K., Jegajeevagan K., De Neve S. 2010. Soil organic matter fractionation as a tool for predicting nitrogen mineralization in silty arable soils. Soil use and management. 26(4): 494-507. doi:10.1111/j.1475-2743.2010.00303.x
35 Kandeler E., Deiglmayr K., Tscherko D., Bru D., Philippot L. 2006. Abundance of narG, nirS, nirK, and nosZ genes of denitrifying bacteria during primary successions of a Glacier Foreland. Applied and Environmental Microbiology. 72(9): 5957-5962.
36 Klotz M.G., Stain L.Y. 2008. Nitrifier genomics and evolution of the nitrogen cycle. FEMS Microbiological Letters. 278: 146-156.
37 Leininger S., Urich T., Schloter M., Schwark L., Qi J., Nicol G.W., Prosser J.I., Schuster S.C., Schleper C. 2006. Archaea predominate among ammonia-oxidizing prokaryotes in soils. Nature. 442 (7104): 806-809.
38 Lim B.L., Yeung P., Cheng C., Hill J.E. 2007. Distribution and diversity of phytate-mineralizing bacteria. The ISME Journal. 1: 321-330.
39 Madsen E.L. 2011. Microorganisms and their roles in fundamental biogeochemical cycles. Current opinion in biotechnology. 22(3): 456-464. doi:10.1016/j.copbio.2011.01.008
40 McGrath K.C., Mondav R., Sintrajaya R., Slattery B., Schmidt S., Schenk P.M.. 2010. Development of an environmental functional gene microarray for soil microbial communities. Applied and Environmental Microbiology. 76(21): 7161-7170.
41 Nannipieri P., Eldor P. 2009. The chemical and functional characterization of soil N and its biotic components.Soil Biology and Biochemistry. 41(12): 2357-2369. doi:10.1016/j.soilbio.2009.07.013
42 Nakaya A., Onodera Y., Nakagawa T., Satoh K., Takahashi R., Sasaki S., Tokuyama T.. 2009. Analysis of ammonia monooxygenase and archaeal 16S rRNA gene fragments in nitrifying acid-sulfate soil microcosms.Microbes and Environments. 24(2): 168-174.
43 Nicol G.W., Schleper C. 2006. Ammonia-oxidising crenarchaeota: important players in the nitrogen cycle?Trends in Microbiology. 14(5): 207-212.
44 Nicol G.W., Leininger S., Schleper C., Prosser J.I. 2008. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria. Environmental microbiology. 10(11): 2966-2978. doi:10.1111/j.1462-2920.2008.01701.x
45 Okano Y., Hristova K.R., Leutenegger C.M. 2004. Application of real-time PCR to study effects of ammonium on population size of ammonia-oxidizing bacteria in soil. Applied and Environmental Microbiology. 70: 1008-1016.
46 Rees D.C., Tezcan A., Haynes C.A., Walton M.Y., Andrade S., Einsle O., Howard J.B. 2005. Structural basis of biological nitrogen fixation. Philos Transact A Math Phys Eng Sci.363 (1829): 971-984.
47 Richardson A. E., Simpson R.J. 2011. Soil microorganisms mediating phosphorus availability update on microbial phosphorus. Plant physiology. 156(3): 989-996. doi:10.1104/pp.111.175448
48 Rotthauwe J.H., Witzel K.P., Liesack W. 1997. The ammonia monooxigenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations. Applied and Environmental Microbiology. 63: 4704-4712.
49 Santoro A.E., Boehm A.B., Francis C.A. 2006. Denitrifier community composition along a nitrate and salinity gradient in a coastal aquifer. Applied and Environmental Microbiology. 72(3): 2102-2109.
50 Sakurai M., Wasaki J., Tomizawa Y., Shinano T., Osaki M. 2008. Analysis of bacterial communities on alkaline phosphatase genes in soil supplied with organic matter. Soil Science and Plant Nutrition. 54: 62-71.
51 Sharma S., Karl H., Schloter M. 2006. Genomic analyses of microbial processes in biogeochemical cycles. En: Molecular Approaches to Soil, Rhizosphere and Plant Microorganism Analysis. CAB International. London, UK. p 1-18.
52 Simon J. 2002. Enzymology and bioenergetics of respiratory nitrite ammonification. FEMS Microbiology Reviews. 26 (3): 285-309.
53 Smith C.J., Nedwell D.B., Dong L., Osborn A.M. 2007. Diversity and abundance of nitrate reductase genes (narG and napA), nitrite reductase genes (nirS and nrfA), and their transcripts in estuarine sediments. Applied and Environmental Microbiology. 73(11): 3612-3622.
54 Stevenson F.J., Cole M.A. 1999. Phosphorous. En: Cycles of Soil: Carbon, Nitrogen, Phosphorous, Sulfur, Microbutrients. John Wiley & Sons, Inc. New York. p 279-329.
55 Stopnisek N., Gubry-Rangin C., Höfferle S., Nicol G.W., Mandic-Mulec I., Prosser J.I. 2010. Thaumarchaeal ammonia oxidation in an acidic forest peat soil is not influenced by ammonium amendment. Applied and environmental microbiology. 76(22): 7626-7634. doi:10.1128/AEM.00595-10
56 Tang H., Yu M., Wang Y., Han X., Wang X., Jin W., Chi F., Wei D. 2012. Effects of long-term fertilization onnifH gene diversity in agricultural black soil. African Journal of Microbiology Research. 6(11): 2659-2666. doi:10.5897/AJMR11.1074
57 Tilak K.V.B.R., Ranganayaki N., Pal K.K., De R.,, Saxena A.K., Shekhar Nautiyal C., Shilpi Mittal, Tripathi A.K., Johri B.N. 2005. Diversity of plant growth and soil health supporting bacteria. Current Science. 89(1): 136-150.
58 Turner B.L., Papházy M.J., Haygarth P.M., McKelvie I.D. 2002. Inositol phosphates in the environment. Philos Trans R Soc Lond B Biol Sci. 357(1420): 449-469.
59 Turner B.L., Mahieu N., Condron L.M. 2003. Phosphorus-31 nuclear magnetic resonance spectral assignments of phosphorus compounds in soil NaOH-EDTA extracts. Soil Science Society of America Journal. 67: 497-510.
60 Urich T., Lanzén A., Qi J., Huson D.H., Schleper C., Schuster S.C. 2008. Simultaneous assessment of soil microbial community structure and function through analysis of the meta-transcriptome. PLoS ONE. 3(6):e2527. doi:10.1371/journal.pone.0002527.
61 Vincent A.G., Turner B.L., Tanner E.V.J. 2010. Soil organic phosphorus dynamics following perturbation of litter cycling in a tropical moist forest. European Journal of Soil Science. 61(1): 48-57. doi:10.1111/j.1365-2389.2009.01200.x
62 Vitousek P.M., Aber J.D., Howarth R.W., Likens G.E., Matson P.A., Schindler D.W., Tilman D.G. 1997. Human alteration of the global nitrogen cycle: sources and consequences. Ecological Applications. 7: 737-750.
63 Wallensteina M.D., Vilgalys R.J. 2005. Quantitative analyses of nitrogen cycling genes in soils. Pedobiologia. 49: 665-672.
64 Wartiainen I., Eriksson T., Zheng W., Rasmussen U. 2008. Variation in the active diazotrophic community in rice paddy-nifH PCR-DGGE analysis of rhizosphere and bulk soil. Applied Soil Ecology. 39(1): 65-75.
65 Yergeau E., Kang S., He Z., Zhou J., Kowalchuk G.A. 2007. Functional microarray analysis of nitrogen and carbon cycling genes across an Antarctic latitudinal transect. The ISME Journal. 1(2): 163-179.
66 Zhalnina K., de Quadros P.D., Camargo F.A., Triplett E.W. 2012. Drivers of archaeal ammonia-oxidizing communities in soil. Frontiers in Microbiology. 3: 210.
67 Zhang L., Hurek T., Reinhold-Hurek B. 2007. A nifH-based oligonucleotide microarray for functional diagnostics of nitrogen-fixing microorganisms. Microbial Ecology. 53(3): 456-470.
68 Zhou Z., Takaya N., Sakairi M.A., Shoun H. 2001. Oxygen requirement for denitrification by the fungus Fusarium oxysporum. Archives of Microbiology. 175: 19-25.
69 Zumft W.G. 1997. Cell biology and molecular basis of denitrification. Microbiology and Molecular Biology Reviews. 61(4): 533-616.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2012 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).