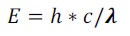PERSISTENCIA DE PLAGUICIDAS EN EL AMBIENTE Y SU ECOTOXICIDAD: UNA REVISIÓN DE LOS PROCESOS DE DEGRADACIÓN NATURAL
Palabras clave:
Plaguicidas, fotodegradación, biodegradación, persistencia, metabolitos, técnicas avanzadas de oxidación, ecotoxicidad. (es)Persistencia de plaguicidas en el ambiente y su ecotoxicidad: Una revisión de los procesos de degradación natural
Environmental persistence of pesticides and their ecotoxicity: A review of natural degradation processes
Jhon Fredy Narváez Valderrama1
Jaime Alberto Palacio Baena2
Francisco José Molina Pérez3
1. (Autor principal), Químico Farmacéutico, Estudiante de doctorado en Ingeniería (Énfasis ambiental), Grupo de Investigación en Gestión y Modelación Ambiental-GAIA- Universidad de Antioquia. Correo: jhon.narvaez@udea.com.co
2. Doctor en Recursos Naturales, Docente investigador, Grupo de Investigación en Gestión y Modelación Ambiental-GAIA- Universidad de Antioquia. Correo: jpalaci@udea.edu.co
3. Doctor en ingeniería química y ambiental, Coordinador Grupo de Investigación en Gestión y Modelación Ambiental-GAIA- Universidad de Antioquia. Correo: fmolina@udea.edu.co
Recibido para evaluación: 22 de Agosto de 2011
Aceptación: 25 de Octubre de 2012
Recibido versión final: 02 de Noviembre de 2012
RESUMEN
Los plaguicidas son los contaminantes de origen antrópico con mayor frecuencia de aplicación en los ambientes naturales. Una vez en el ambiente, factores naturales como la biodegradación, la fotodegradación y la hidrólisis química disminuyen su persistencia y por lo tanto su ecotoxicidad. Sin embargo, algunos productos de transformación pueden tener mayor potencial de bioacumulación y de toxicidad que los compuestos parentales. Por lo anterior, el conocimiento de los procesos de degradación en el ambiente es determinante en los estudios de la dinámica de los plaguicidas en la fase ambiental y su impacto sobre los ecosistemas acuáticos y terrestres. Esta revisión pretende mostrar la influencia de los procesos de degradación natural sobre la persistencia de los plaguicidas, su ecotoxicidad y su dinámica. Además, pretende complementar el conocimiento de la aplicación de los procesos de degradación de plaguicidas, en el tratamiento de las aguas contaminadas. Mientras algunas metodologías en los procesos de biodegradación han aplicado la manipulación genética de microorganismos, en la fotodegradación se han aplicado tecnologías avanzadas de oxidación (TAOs) en el tratamiento de aguas contaminadas con plaguicidas.
Palabras claves: Plaguicidas, fotodegradación, biodegradación, persistencia, metabolitos, técnicas avanzadas de oxidación, ecotoxicidad.
ABSTRACT
Pesticides are allochthonous pollutants discharged in natural environments. Once in the environment, natural factors such as biodegradation, photodegradation and chemical hydrolysis trigger partial or total pesticide transformation and reduce their environmental persistence. However, some degraded compounds have a greater ecotoxicological effect on the biota that the parent compounds and the change in the physicochemical properties increase the bioaccumulation, toxicity and transference processes. Therefore, knowledge about degradation processes in the environment is crucial in studies related to the dynamics and behavior of these substances in the environment and the impact on aquatic and terrestrial ecosystems. This review aims to show the influence of natural degradation processes on the persistence of pesticides, their ecotoxicity and dynamics. Also discuss the application of the degradation processes in water treatment and pesticides removal. While biodegradation processes have been improved by using genetically engineered microorganisms, in the photodegradation has been applied advanced oxidation technologies (TAOS) in the treatment of water contaminated with pesticides.
Keywords: Pesticides, photodegradation, biodegradation, persistence, metabolites, advanced oxidation technology, ecotoxicity.
1. INTRODUCCION
Los plaguicidas son uno de los mayores contaminantes de origen antrópico en los ambientes naturales, los cuales se aplican frecuentemente en la actividad agrícola (Konstantinou et al., 2006). En Colombia se usan anualmente más de 17 millones de kg de plaguicidas, cifra que ubica a nuestro país como el tercer consumidor en Latinoamérica después de países como Brasil y México (Domínguez et al., 2009). En Antioquia, el cultivo de flores, café, fríjol, papa, maíz, tomate y hortalizas, así como de pasto en la actividad ganadera, requiere la aplicación de plaguicidas organofosforados, carbamatos, piretroides entre otros, los cuales pueden constituir un gran problema ambiental, dado que pueden transportarse hasta los ecosistemas acuáticos, distribuirse entre los diferentes compartimientos y representar un riesgo potencial para la biota y la salud humana (Martínez et al., 2009).
El proceso de transporte esta relacionado con el coeficiente de partición octanol /agua (log Kow), las constantes de disociación ácida y básica (Ka y Kb), el coeficiente de partición carbono orgánico/agua (log Koc), el índice potencial de lixiviación y la presión de vapor de los plaguicidas. Estas propiedades, determinan el destino final de estas sustancias en el suelo, en el agua o en el sedimento (Jekel y Reemtsma, 2006).
De otro lado, la persistencia de los plaguicidas en un compartimiento ambiental depende de la eficiencia de los procesos de degradación natural, los cuales inducen en algunos casos la transformación de estas sustancias en metabolitos con mayor toxicidad (Cavoski et al., 2008; Belfroid et al., 1998). Los procesos de degradación natural, como la biodegradación, la fotodegradación y la hidrólisis química, se efectúan mediante reacciones de oxidación, reducción, hidrólisis, ruptura y reorganización de enlaces moleculares. Estas reacciones, involucran la actividad enzimática de microorganismos, la luz ultravioleta (UV) y el pH del medio (Lu et al., 2006; Van der Linden et al., 2009). Un amplio conocimiento de estas variables fisicoquímicas es de gran utilidad en la identificación de los procesos de degradación dominantes en un ecosistema. Un gran número de publicaciones, consideran que los procesos de degradación, son determinantes en la persistencia y toxicidad de plaguicidas en la fase ambiental (Andreu y Pico, 2004). El conocimiento de tales procesos, ha sido aplicado en el tratamiento de aguas residuales y en la eliminación de plaguicidas durante los procesos de potabilización, y disminución de la exposición crónica a estas sustancias (Smalling y Aelion, 2006; Ballesteros et al., 2009). Sin embargo, el conocimiento de las reacciones de transformación y el impacto de los metabolitos sobre la biota y seres humanos son aún incipientes.
Esta revisión pretende generar un marco conceptual que permita la identificación de los procesos de degradación dominantes en el ambiente. Además, presenta una síntesis sobre la aplicación de los procesos de degradación de los compuestos parentales y metabolitos en aguas para consumo humano y residual. La manipulación genética de microorganismos para aumentar la eficiencia de los procesos de biodegradación y la aplicación de las TAOs en procesos fotolíticos para el tratamiento de agua, empiezan a tomar un papel importante en las plantas de aguas residuales y de potabilización de agua (Lafi y Al-Qodah, 2006).
2. PROPIEDADES FISICOQUÍMICAS DE LOS PLAGUICIDAS Y SU DINAMICA AMBIENTAL
La persistencia de los plaguicidas está relacionada con la eficiencia de los procesos de transformación en condiciones naturales, mientras que el proceso de transporte esta relacionado con las propiedades fisicoquímicas de estas sustancias (Jekel y Reemtsma, 2006). El log Kow es una propiedad fisicoquímica, relacionada con la afinidad lipídica de los plaguicidas; así, altos valores de log Kow indican alta afinidad por la fracción lipídica, fácil transporte a través de las membranas biológicas y por lo tanto alto potencial de bioacumulación. Algunos plaguicidas como los organoclorados tienen altos valores de log Kow y por lo tanto se acumulan en la biota.
Por otro lado el log Koc es una propiedad fisicoquímica relacionada con el potencial de acumulación de plaguicidas en sedimentos acuáticos; así, un valor alto de log Koc indica gran afinidad por este compartimento. Sin embargo, algunas propiedades del sistema, como la estabilidad térmica, el pH, la conductividad y el potencial redox, alteran la interacción de los plaguicidas con el sedimento y por lo tanto favorecen su liberación hacia la columna de agua. Por ejemplo, el pH altera el carácter iónico de numerosos compuestos orgánicos y por lo tanto, su solubilidad; mientras que el potencial redox, afecta la estabilidad química de las sustancias, lo que conduce a cambios en la afinidad por el sedimento. Estos procesos de liberación de plaguicidas ocurren de igual forma como la liberación de P, Fe y Mn desde el sedimento, debido a cambios en la concentración de oxígeno y en el potencial redox del sistema. Los valores del log Kow y del log Koc de algunos plaguicidas se sintetizan en la tabla 1.
Los valores altos de log Kow y log Koc para la cipermetrina, el clorpirifos y el diazinón encontrados en la tabla 1, indican que estas sustancias tienen un considerable potencial de acumulación en el suelo y en la biota. En contraste, el glifosato y el mancozeb, los cuales presentan valores bajos, pueden lixiviarse e ingresar a los cuerpos de agua.
De igual forma, el contenido de materia orgánica, la porosidad, la capacidad de intercambio iónico del suelo y la transformación de plaguicidas, influyen en la movilidad y transferencia entre compartimientos. Una interacción débil suelo-plaguicida, permite la migración de sustancias con altos valores del log Kow y del log Koc hacia cuerpos de agua a pesar de su carácter lipófilo. Por otro lado, la transformación de los plaguicidas puede favorecer la migración de metabolitos hacia la columna de agua, debido al cambio de polaridad y afinidad por el suelo. Así, la transformación es un factor determinante en la dispersión, tiempo de contacto biota-plaguicida y en la cantidad de especies acuáticas potencialmente afectadas (Arias et al., 2008).3. IMPLICACIONES AMBIENTALES DEL USO DE PLAGUICIDAS
La aplicación de plaguicidas ha sido un mecanismo eficiente para la protección de algunos cultivos. Sin embargo, el ingreso de estas sustancias al ambiente, puede representar un alto riesgo para los sistemas biológicos (Van der Werf, 1996; Palacio 2007). Algunos problemas como la bioacumulación en zooplancton, en ictiofauna y en aves, han sido ampliamente documentados en el mundo (Cid et al., 2007; Kalyoncu et al., 2009). A continuación se abordarán algunas implicaciones ambientales de algunos plaguicidas.
Plaguicidas Organoclorados
En la década de los 70, los organoclorados fueron los plaguicidas con mayor aplicación agrícola. En la figura 1, se presenta la estructura química algunos como el Dicloro Difenil Tricloroetano (DDT), aldrín, endrín y lindano.
Las evidencias sobre los efectos teratogénicos, carcinogénicos, inmunológicos, disruptores endocrinos y de bioacumulación de los plaguicidas organoclorados, llevaron a su prohibición en el mundo. Sin embargo, en los algunos países se siguen aplicando sin ningún control. Aunque los plaguicidas organoclorados, tienen alta persistencia en el ambiente y alto potencial de biomagnificación, los productos de transformación incrementan la complejidad de los efectos tóxicos en el ambiente (Darko et al., 2008; Guruge et al., 2001). La información disponible, muestra que en la fase ambiental, estas sustancias alcanzan entre el 75 y el 100 % de su degradación en un tiempo de 4 a 30 años (Sankararamakrishnan et al., 2005).
En los últimos años, se ha reportado la presencia de los plaguicidas organoclorados y algunos de sus metabolitos. Por ejemplo, en el río Grande del Sur en Brasil, en el 2008, fueron reportadas concentraciones de 7,38 ng/g de los metabolitos Dicloro Difenil Dicloroetano (DDD) y 11,9 ng/g de Dicloro Difenil Dicloroetileno (DDE) en leche, lo que muestra un gran riesgo para la población como resultado de la exposición crónica a productos de degradación del DDT (Heck et al., 2007). De otro lado, en el río Pearl en el 2008, se encontraron niveles de DDT en peces entre 1,7 y 462 ng/g, lo que indica, un alto potencial de bioacumulación de esta sustancia en ictiofauna (Guo et al., 2008).
Organofosforados
Los organofosforados representan la tercera parte de los plaguicidas aplicados en la agricultura (Chambers et al., 1992). El mecanismo de acción de estas sustancias, se atribuye a la inhibición de la enzima acetilcolinesterasa la cual se encarga de la reducción de los niveles de acetilcolina; uno de los principales neurotransmisores del sistema central. En consecuencia, los niveles altos de acetilcolina, conducen a una exacerbación de las respuestas parasimpáticas en el sistema nervioso de los organismos expuestos (Zamy et al., 2004). Se ha encontrado, que estos plaguicidas atraviesan con facilidad la mucosa, la piel y otras barreras biológicas, no solo de los organismos target, sino también de los agricultores.
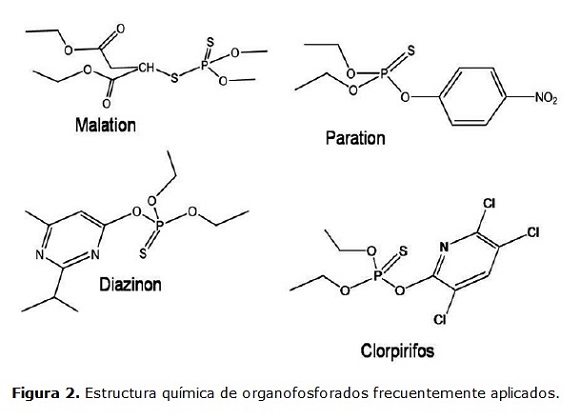
Por lo general la estructura química de los organofosforados, consiste en esteres fosfato fácilmente hidrolizables. Ver figura 2.
El uso masivo y frecuente de organofosforados, favorece su amplia distribución en el ambiente. Un estudio realizado en el río Ganges en Kanpur en el 2005, encontró una concentración de malatión de 2.61 ug/L, la cual superó al valor máximo permisible para el agua potable de 1 ug/L, según la Comisión Económica Europea (Sankararamakrishnan et al., 2005).
Los organofosforados, tienen una menor persistencia que los organoclorados, debido a que los procesos de transformación ambiental se efectúan con mayor eficiencia sobre sus enlaces fosfoester de estas moléculas. Sin embargo, en numerosas ocasiones la degradación parcial genera subproductos de mayor toxicidad que los compuestos parentales (Vittozzi et al., 2001).
Carbamatos y ditiocarbamatos
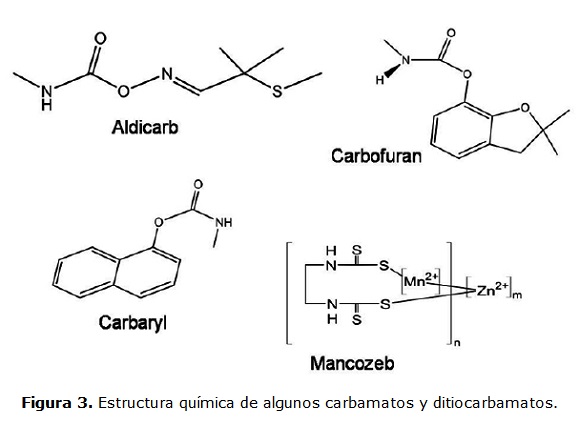
Los carbamatos y ditiocarbamatos son actualmente los plaguicidas de mayor aplicación en la actividad agrícola, debido a que estas sustancias tienen una menor persistencia y toxicidad. Esto se debe a que son rápidamente hidrolizados en el ambiente. La estructura química de algunos carbamatos y ditiocarbamatos se muestra en la figura 3.
Los carbamatos son plaguicidas de gran inestabilidad química y tensión molecular y, por tanto, lábiles a los procesos fotolíticos y de hidrólisis química. Por lo anterior, los productos de transformación son considerados marcadores de su aplicación y son de gran importancia en el análisis de los efectos tóxicos sobre el ambiente. La etilentiourea (ETU), un metabolito con efectos carcinogénicos, es un marcador ambiental de la aplicación de mancozeb y otros ditiocarbamatos (Colosio et al., 2002). De igual forma, la presencia del metabolito 1-Naftol evidencia el ingreso a aguas superficiales de plaguicidas como el aldicarb y el carbaryl. Ambos plaguicidas, tienen alto potencial cardiotóxico sobre algunas especies ícticas y son incluidos en el análisis de calidad de agua para consumo humano (García de Llasera y Bernal, 2001; Lin, Hui et al., 2007).
4. DEGRADACIÓN NATURAL DE PLAGUICIDAS
La degradación de plaguicidas en ambientes naturales, ocurre bajo reacciones fotolíticas, de oxido-reducción, hidrólisis química y de biodegradación. Estos procesos favorecen la excitación, ruptura y/o reacomodación de enlaces químicos, que llevan a la transformación parcial de los compuestos parentales. Cerca del 50% de los productos de transformación de los plaguicidas, tienen toxicidad similar a la de los compuestos parentales (Belfroid et al., 1998). Solo su mineralización, en la que se produce H2O, CO2 y otros minerales, asegura la reducción o eliminación de los efectos tóxicos de los plaguicidas en el agua (Raymond et al., 2001).
La degradación parcial produce un gran número de estructuras químicas con diversas propiedades fisicoquímicas. Esto se debe a que diversos procesos de degradación actúan en simultáneo sobre los compuestos parentales y a su vez sobre diferentes puntos de la estructura molecular. Esta situación dificulta el análisis de metabolitos en diferentes matrices ambientales, debido a la complejidad del tratamiento de las muestras, la falta de especificidad de los métodos y el problema de la identificación de cada uno de los productos de degradación. En ambientes naturales, el mancozeb se transforma en ETU, mientras que el clorpirifos, se transforma en 3,5,6-trichloro-2-pyridinol (TCP), un metabolito con alto riesgo tóxico (Cáceres, et al., 2007). Estos metabolitos tienen mayor polaridad que los compuestos parentales y por tanto, la extracción, la detección y la cuantificación por cromatografía de gases acoplada a espectrometría de masas (GC/MS) involucran métodos complejos de derivatización y de separación. Sin embargo, la cromatografía liquida de alta eficiencia (HPLC), acoplada a espectrometría de masas, es una técnica que brinda mayor facilidad en el análisis de metabolitos como ETU y TCP, pero con mayores costos. A continuación, se abordan los principales procesos de degradación en ambientes naturales.
Biodegradación de plaguicidas
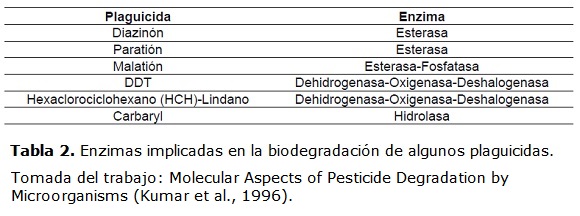
En muchos ecosistemas acuáticos, la persistencia y la toxicidad de plaguicidas, está relacionada con la eficiencia de los procesos de biodegradación (Raymond et al., 2001). En estos procesos, es de suma importancia las reacciones enzimáticas que ocurren en los microorganismos, los cuales juegan un papel importante en la transformación de plaguicidas. En la tabla 2, se enumeran algunas enzimas involucradas en la transformación de plaguicidas específicos.
La biodegradación puede ocurrir bajo condiciones aerobias o anaerobias, dependiendo del aceptor final de electrones utilizado por el microorganismo. Así, mientras los nitratos, los sulfatos, el hierro y el manganeso son aceptores de electrones en condiciones anaerobias, el oxígeno es el aceptor final en condiciones aerobias. Se ha reportado que algunos organoclorados, son usados como aceptores de electrones después del hierro y los nitratos en condiciones anaerobias, en un proceso denominado deshalogenación reductiva (Häggblom y Bossert, 2003). Por ejemplo, los microorganismos del género Pseudomona y algunas enterobacterias, favorecen la degradación de compuestos aromáticos y el rompimiento de enlaces carbono-halógeno. Estas reacciones son de suma importancia en la degradación de plaguicidas halogenados, debido a que estos enlaces son de alta energía, químicamente estables y tienen gran impedimento estérico (Häggblom y Bossert, 2003).
Los niveles de oxígeno en el agua, son determinantes en la ruta de degradación de los plaguicidas. En condiciones aerobias se favorecen mecanismos de deshalogenación y de formación de catecoles, los cuales determinan los rompimientos moleculares por vía orto o por vía meta en el anillo aromático. Estos últimos rompimientos, generan metabolitos con mayor toxicidad para los organismos acuáticos. Por otro lado, en ausencia de oxígeno los mecanismos de biodegradación conducen a la deshalogenación reductiva de organoclorados, es decir, bajo estas condiciones disminuye la persistencia de estas sustancias (Häggblom y Bossert, 2003). En lagos con condiciones aerobias en superficie y anaerobias en fondo, pueden darse los dos procesos simultáneamente.
La vía metabólica y la vida media de los plaguicidas por biodegradación, está relacionada con la concentración de oxígeno en el sistema. Mientras la biodegradación de fipronil ocurre entre 5 y 19 días en sedimentos anóxicos, los organismos facultativos tardan entre 25 y 91 días en degradarlo (Lin et al., 2008). Esto demuestra que las condiciones ambientales, conjuntamente con la presencia y tipo de microorganismos, determinan parcialmente el potencial de biodegradación. Se ha encontrado que la deshalogenación del DDT ocurre en condiciones anaeróbicas con la participación de microorganismos como Enterobacter aerogenes y Klebsiella pneumoniae (Lal y Saxena, 1982; Nadeau et al., 1994).
Fotodegradación de plaguicidas
La luz UV-C (100-280nm) se absorbe casi en su totalidad en la capa de ozono. Sin embargo, la luz UV-B y UV-A (280-400 nm), de gran valor energético, alcanzan la superficie terrestre y producen la excitación molecular y la transformación de algunos xenobióticos (Burrow y Canle, 2002). En la zona intertropical, donde la radiación solar incide casi de forma perpendicular sobre la superficie terrestre, los procesos fotolíticos son importantes en la degradación de plaguicidas. El índice de UV, es un buen marcador de los procesos fotolíticos, valores superiores a 8 indican un buen potencial de fotodegradación y un alto riesgo de cáncer de piel en humanos (EPA 2011). Por ejemplo en Colombia, donde los valores de índice de UV oscilan entre 9 y 15, podría encontrarse un alto potencial de fotodegradación de plaguicidas en los ecosistemas acuáticos.
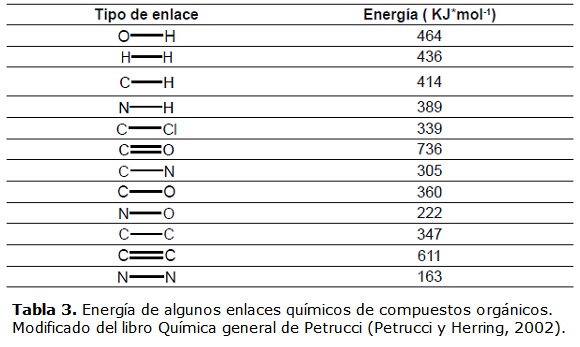
Sin embargo, el contenido de materia orgánica y otros filtros naturales atenúan la luz UV en los cuerpos de agua y limitan la eficiencia de los procesos fotolíticos. Por esta razón, en los lagos con alto contenido de materia orgánica natural (MON), la fotodegradación no es un proceso dominante. La MON, se compone en su mayoría de una fracción fúlvica y una fracción húmica, las cuales cumplen un papel fundamental en la absorción de la luz UV en cuerpos de agua. Por ejemplo, en lagos con contenidos de materia orgánica de 3 mg/L, la luz UV puede atenuarse hasta el 1% entre 2 y 1,5 metros de profundidad. Esta radiación solar es suficiente para catalizar la transformación de carbamatos y compuestos fenólicos en el agua (Kumar et al., 1975). En la tabla 3 se presenta la energía de algunos enlaces químicos, la cual determina la estabilidad de los compuestos orgánicos.
Los valores que aparecen en la tabla 3, se pueden aplicar en la ecuación de Max Planck (1901):
Donde:
E: Energía de un fotón (Julios).
h: Constante de Plank (6.6254 x 10-34 Julios segundo).
c: Velocidad de la luz (m/s).
λ: Longitudes de onda (m).
De esta forma, se puede calcular la longitud de onda mínima necesaria para alcanzar la excitación y posterior ruptura de un enlace en un plaguicida. La ruptura de un enlace Carbono–Oxígeno puede requerir de una exposición a longitudes de onda entre 280 a 320 nm durante tiempos diversos dependiendo de la molécula irradiada. En condiciones de laboratorio, la radiación UV directa sobre plaguicidas no es suficiente para producir una fotólisis eficiente. Algunas moléculas como el clorpirifos, solo se degradan en un 100 % cuando se irradia directamente con luz UV a 285 nm y en presencia de un catalizador como el TiO2 en un proceso conocido como TAOs (Muhamad 2009).La aplicación de estas técnicas, bajo condiciones de laboratorio, busca aumentar la eficiencia de los procesos de fotodegradación para la eliminación de plaguicidas. Así, El DDT, siendo un plaguicida altamente resistente a la fotodegradación natural, puede ser removido hasta en un 85 % con luz UV y TiO2. Por ultimo, en ambientes naturales, el pH, los ácidos orgánicos y algunos minerales como el hierro, actúan como catalizadores en los procesos fotoquímicos (Jang et al., 2005).
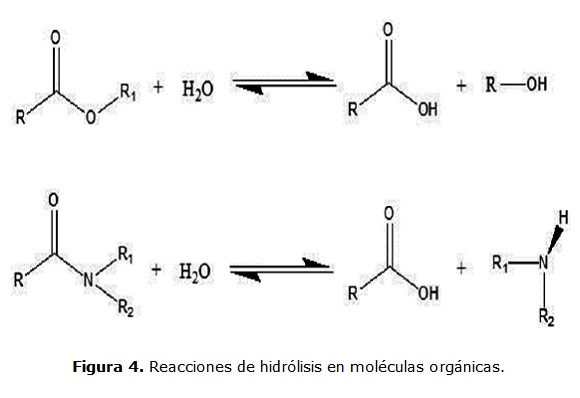
Hidrólisis química
La hidrólisis química de los plaguicidas está relacionada con el pH y ocurre mediante ataques nucleofílicos o electrofílicos (Lui et al., 2001). Ver figura 4.
Los ácidos y bases actúan como catalizadores al activar grupos funcionales para un ataque de nucleófilos y de electrófilos del entorno. Es indiscutible que el pH del medio es un factor determinante de la vida media de muchas sustancias hidrolizables. Por ejemplo, el clorpirifos tiene una vida media de 53 días a pH 5,90, 141,6 días a pH 6,11 y 10 días a pH 9,77 a 25 ° C (Macalady y Wolfe, 1983).
El pH en la superficie del agua de algunos embalses colombianos (8 a 10 unidades de pH), favorece la hidrólisis de enlaces éster en plaguicidas como clorpirifos y mancozeb, para su transformación en TCP y ETU, respectivamente. Además, la presencia de cobre en el agua, favorece la hidrólisis química de clorpirifos bajo estas condiciones de pH (Lui et al., 2001).
La hidrólisis química de plaguicidas, potencia el efecto de otros procesos de transformación, debido a que los metabolitos de la hidrólisis pueden ser más fotosensibles o menos tóxicos para los microorganismos que los compuestos parentales. En el caso de los algunos organofosforados, una hidrólisis inicial conduce a la formación de p-nitrofenoles, los cuales son fácilmente degradados a hidroquinonas por bacterias como Pseudomona putida (Rani y Lalithakumari, 1994). Consecuentemente, estos productos de degradación, representan una menor toxicidad para los organismos acuáticos.
5. APLICACIÓN DE LOS PROCESOS DE DEGRADACIÓN NATURAL EN LA REMOCIÓN DE PLAGUICIDAS DEL AMBIENTE
Debido a la gran cantidad de recursos hídricos contaminados con plaguicidas y otras sustancias de origen antrópico, han surgido diversas metodologías para el tratamiento avanzado del agua. Aunque el uso racional de plaguicidas disminuye el riesgo tóxico de estas sustancias en el ambiente, estas metodologías han permitido reducir la concentración de metabolitos y compuestos parentales presentes en el agua.
La manipulación genética de microorganismos busca el aumento de la actividad catalítica de enzimas relacionadas con la transformación de plaguicidas. Ver tabla 2. Este es uno de los avances en los procesos de biodegradación. La manipulación genética de Streptomyces lividans y Escherichia coli ha mejorado la actividad catalítica de hidrolasas, encargadas de la hidrólisis de paratión, paraxón y metil-paratión a p-nitrofenoles (Kumar et al., 1996). En la actualidad, algunas plantas de tratamiento incluyen lodos activados enriquecidos con microorganismos modificados que aumentan la eficiencia del proceso de biodegradación en el tratamiento secundario del agua.
La radiación UV junto con el uso de catalizadores constituyen las herramientas fundamentales en los procesos de fotodegradación, los cuales disminuyen la concentración de xenobióticos no biodegradables (Fatta et al., 2007; Shawaqfeh y Momani, 2010; Navarro et al., 2009). El lindano, es eliminado en un 90% cuando se somete a la fotodegradación con longitudes de onda de 254 nm en presencia de H2O2 a un pH de 7 (Nienow et al., 2008). Por otro lado, algunos procesos fotolumínicos que utilizan Fe2+ y H2O2, son conocidos como Fotofenton; algunos que incluyen O3 se denominan ozonólisis, mientras que los procedimientos que incluyen TiO2 como catalizador, se denominan catálisis heterogénea (Klavarioti et al., 2009; Navarro et al., 2011). Todos estos procesos han sido aplicados en la degradación de plaguicidas.
Aunque la biodegradación y los procesos fotolíticos han sido aplicados en plantas de tratamiento de agua potable y residual con el objetivo de reducir la presencia de xenobióticos en el recurso hídrico, estos procesos, no son suficientes para remover la gran cantidad de contaminantes que ingresan a los cuerpos de agua (Cheng et al., 2002). Esto conduce a la necesidad de diseñar mejores esquemas relacionados con el uso racional de plaguicidas persistentes, y modificar las normas existentes en cuanto a los límites máximos permisibles. Esto, contribuye a un gran avance en el aseguramiento de la calidad y la disminución de los riesgos para los organismos acuáticos y los humanos por exposición crónica a metabolitos y plaguicidas.
8. CONCLUSIONES
La estabilidad química de plaguicidas en el ambiente y por tanto su vida media, está relacionada con la eficiencia de procesos de degradación natural como biodegradación, fotodegradación e hidrólisis química. Sin embargo, la degradación parcial de plaguicidas puede conducir a la formación de metabolitos con gran impacto ambiental.
La difícil detección y cuantificación de metabolitos de plaguicidas no ha permitido establecer el efecto ambiental de muchas de estas sustancias.
Solo la degradación total hasta CO2, H2O y minerales, asegura una reducción del 100 % de los efectos tóxicos de un plaguicida en el ambiente.
Los plaguicidas persistentes, representan un alto riesgo para los ecosistemas debido al tiempo de exposición de los organismos.
Los procesos de degradación natural, han sido mejorados y aplicados en plantas de tratamiento de agua. Algunos procesos como la manipulación genética y las TAOs, son complementos en la soluciones de los problemas relacionados con la contaminación por plaguicidas.
Es necesario enfatizar que la aplicación de técnicas de depuración de plaguicidas es insuficiente y el aprovechamiento racional de los recursos naturales exige la aplicación de estrategias preventivas para evitar el ingreso de agroquímicos a los ambientes naturales.
BIBLIOGRAFIA
Arias-Estévez, M., et al., 2008. The mobility and degradation of pesticides in soils and the pollution of groundwater resources. Agriculture, Ecosystems & Environment. 123(4): p. 247-260.
Andreu, V and Picó, Y., 2004. Determination of pesticides and their degradation products in soil: critical review and comparison of methods. TrAC Trends in Analytical Chemistry. 23(10-11): p. 772-789.
Ballesteros, M., et al., 2009. Effect of pesticide concentration on the degradation process by combined solar photo-Fenton and biological treatment. Water Research. 43(15): p. 3838-3848.
Belfroid, A.C., et al., 1998. Relative risks of transformation products of pesticides for aquatic ecosystems. The Science of The Total Environment. 222(3): p. 167-183.
Burrows, H and Canle L., 2002. Reaction pathways and mechanisms of photodegradation of pesticides. Journal of Photochemistry and Photobiology B: Biology. 67(2): p. 71-108.
Cáceres, T, He W., Naidu R., 2007. Megharaj M. Toxicity of chlorpyrifos and TCP alone and in combination to Daphnia carinata: The influence of microbial degradation in natural water. Water research. 41(19):4497-503.
Cavoski, I., et al., 2008. Degradation and Persistence of Rotenone in Soils and Influence of Temperature Variations. J. Agric. Food Chem. 56(17): p. 8066-8073.
Cid, FD., Antón R and Caviedes-Vidal, E., 2007. Organochlorine pesticide contamination in three bird species of the Embalse La Florida water reservoir in the semiarid midwest of Argentina. Science of the Total Environment. 385(1-3): p. 86-96.
Colosio, C., et al., 2002. Ethylenethiourea in urine as an indicator of exposure to mancozeb in vineyard workers. Toxicology letters. 134(1-3):133-40.
Chambers, J., Levi, P., Churchill, S., 1992: Organophosphates: chemistry, fate, and effects. Academic Press San Diego.
Cheng, S., Vidakovic-Cifrek Z., et al., 2002. Xenobiotics removal from polluted water by a multifunctional constructed wetland. Chemosphere. 48(4):415-8.
Darko, G., Akoto, O and Oppong, C., 2008. Persistent organochlorine pesticide residues in fish, sediments and water from Lake Bosomtwi, Ghana. Chemosphere. 72(1): p. 21-4.
Domínguez, M.C., Peñuela, G., Flórez M.T., 2009. Método analítico para la determinación de etilentiourea (ETU) subproducto del Mancozeb en un Andisol del Oriente Antioqueño. Rev. Fac. Ing. Univ. Antioquia, 49:p. 41-48.
Environmental Protection Agency (EPA). http://www.epa.gov/sunwise/uviscale.html Consultado en Mayo de 2011.
Fatta, D., et al., 2007. Analytical methods for tracing pharmaceutical residues in water and wastewater. TrAC Trends in Analytical Chemistry. 26(6): p. 515-533.
Garcia de Llasera, M.P and Bernal-Gonzalez M., 2001. Presence of carbamate pesticides in environmental waters from the northwest of Mexico: determination by liquid chromatography. Water Res. 35(8): p. 1933-40.
Guo, L., et al., 2008. Levels and bioaccumulation of organochlorine pesticides (OCPs) and polybrominated diphenyl ethers (PBDEs) in fishes from the Pearl River estuary and Daya Bay, South China. Environ Pollut. 152(3): p. 604-11.
Guruge, K.S., et al., 2001. Accumulation status of persistent organochlorines in albatrosses from the North Pacific and the Southern Ocean. Environmental Pollution. 114(3): p. 389-398.
Häggblom, MM., Bossert, ID., 2003. Dehalogenation: microbial processes and environmental applications: Springer Netherlands.
Heck, M.C., et al., 2007. Estimation of children exposure to organochlorine compounds through milk in Rio Grande do Sul, Brazil. Food Chemistry. 102(1): p. 288-294.
Jang, S.J., Kim, M.S and Kim B.W., 2005. Photodegradation of DDT with the photodeposited ferric ion on the TiO2 film. Water Research. 39(10): p. 2178-2188.
Jekel, M., Reemtsma, T., 2006. Organic Pollutants in the Water Cycle, in Properties, Occurrence, Analysis and Environmental Relevance of Polar Compounds. ed. W.C. Society.: Berlin.
Kalyoncu, L., Agca, I and Aktumsek, A., 2009. Some organochlorine pesticide residues in fish species in Konya, Turkey. Chemosphere. 74(7): p. 885-889.
Klavarioti, M., Mantzavinos, D and D. Kassinos., 2009. Removal of residual pharmaceuticals from aqueous systems by advanced oxidation processes. Environment International. 35(2): p. 402-417.
Konstantinou, I., et al., 2006. The status of pesticide pollution in surface waters (rivers and lakes) of Greece. Part I. Review on occurrence and levels. Environmental Pollution 141(3): p. 555-570.
Kumar, Y., et al., 1975. The photochemistry of carbamates. IV. The phototransformation of Azak (2, 6-di-t-butyl-4-methylphenyl-N-methylcarbamate). Environmental quality and safety. Supplement, 3: p. 302.
Kumar, S., Mukerji, K.G and Lal, R.,1996. Molecular aspects of pesticide degradation by microorganisms. Crit Rev Microbiol. 22(1): p. 1-26.
Lafi, W.K and Al-Qodah Z., 2006. Combined advanced oxidation and biological treatment processes for the removal of pesticides from aqueous solutions. Journal of Hazardous Materials. 137(1): p. 489-497.
Lal, R and Saxena, D., 1982. Accumulation, metabolism, and effects of organochlorine insecticides on microorganisms. Microbiology and Molecular Biology Reviews. 46(1): p. 95.
Lin, C.C., Hui, M.N.Y and Cheng, S.H., 2007.Toxicity and cardiac effects of carbaryl in early developing zebrafish (Danio rerio) embryos. Toxicology and Applied Pharmacology. 222(2): p. 159-168.
Lin, K., et al., 2008. Transformation and sorption of fipronil in urban stream sediments. J Agric Food Chem. 56(18): p. 8594-600.
Liu, B., et al., 2001. Hydrolysis of chlorpyrifos in natural waters of the Chesapeake Bay. Chemosphere. 44(6): p. 1315-323.
Lu, J., et al., 2006. Degradation of pesticides in nursery recycling pond waters. Journal of agricultural and food chemistry. 54(7): p. 2658-2663.
Macalady, D and Wolfe, N., 1983. New perspectives on the hydrolytic degradation of the organophorothioate insecticide chlorpyrifos. Journal of agricultural and food chemistry. 31(6): p. 1139-47.
Martinez, J.L., et al., 2009. Determination of pesticide transformation products: A review of extraction and detection methods. Journal of Chromatography A, 1216(40): p. 6767-6788.
Muhamad, S.G., 2009. Kinetic studies of catalytic photodegradation of chlorpyrifos insecticide in various natural waters. Arabian Journal of Chemistry. 3(2): p. 127-133.
Nadeau, L., et al., 1994.Aerobic degradation of 1, 1, 1-trichloro-2, 2-bis (4-chlorophenyl) ethane (DDT) by Alcaligenes eutrophus A5. Applied and environmental microbiology. 60(1): p. 51.
Navarro, S., Fenoll, J., et al., 2011. Removal of ten pesticides from leaching water at pilot plant scale by photo-Fenton treatment. Chemical Engineering Journal; 167(1):42-9.
Navarro, S., Fenoll J., et al., 2009. Photocatalytic degradation of eight pesticides in leaching water by use of ZnO under natural sunlight. Journal of hazardous materials. 172(2-3):1303-10.
Nienow, A.M., et al., 2008.Hydrogen peroxide-assisted UV photodegradation of Lindane. Chemosphere. 72(11): p. 1700-1705.
Palacio, J.A., ed. 2007: Ecotoxicología acuática. ed. I.U.d. Antioquia. Medellín.
Petrucci RH. W. Herring F. 2002. Química General. Vol. I y II. Octava edición. Ed. Prentice Hall.
Rani, N and Lalithakumari D., 1994. Degradation of methyl parathion by Pseudomonas putida. Canadian Journal of Microbiology. 40(12): p. 1000-1006.
Raymond, J.W., et al., 2001. A review of structure-based biodegradation estimation methods. Journal of Hazardous Materials. 84(2-3): p. 189-215.
Sankararamakrishnan, N., et al., 2005. Organochlorine and organophosphorous pesticide residues in ground water and surface waters of Kanpur, Uttar Pradesh, India. Environ Int, 31(1): p. 113-20.
Shawaqfeh, AT., Momani, FA., 2010. Photocatalytic treatment of water soluble pesticide by advanced oxidation technologies using UV light and solar energy. Solar Energy. 84(7):1157-65.
Smalling, K.L and Aelion CM., 2006. Biological and chemical transformation of atrazine in coastal aquatic sediments. Chemosphere, 62(2): p. 188-196.
Van der Linden, A.M.A., et al., 2009. Influence of pH-dependent sorption and transformation on simulated pesticide leaching. Science of the Total Environment. 407(10): p. 3415-3420.
Van der Werf, H.M.G., 1996. Assessing the impact of pesticides on the environment. Agriculture, Ecosystems & Environment. 60(2-3): p. 81-96.
Vittozzi, L., et al., 2001. Mechanistic aspects of organophosphorothionate toxicity in fish and humans. Environment International. 26(3): p. 125-129.
Zamy, C., Mazellier P., Legube B., 2004. Phototransformation of selected organophosphoruspesticides in dilute aqueous solutions. Water Research. 38(9): p. 2305-2314.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2012 Gestión y Ambiente

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
Los artículos que sean publicados en la revista Gestión y Ambiente, también serán publicados en el sitio web http://www.revistas.unal.edu.co/index.php/gestion/index y en formatos electrónicos como PDF, HTML, XML, entre otros. Además, en diferentes redes sociales de difusión del conocimiento. Gestión y Ambiente adopta directrices de ética por Committee on Publication Ethics (COPE) sobre buenas prácticas de conducta (evitar conductas como plagio, falsificación, autoría ficticia, entre otros), describe conflictos de interés o en competencia, contribuciones de autoría y fuentes de financiación. Todo lo publicado se considerará propiedad de la revista Gestión y Ambiente, pero pueden usarse bajo la licencia Creative Commons “Reconocimiento-No Comercial-Compartir Igual International (BY-NC-SA) 4.0”