REACTIVIDAD QUÍMICA EN LA ALQUILACIÓN INTRAMOLECULAR DE FRIEDEL-CRAFTS DE ORTO-ALILANILINAS N-BENCILO SUSTITUIDAS
Palabras clave:
alquilación intramolecular de Friedel-Crafts, dihidrodibenzo [b, e]azepinas, tetrahidrodibenzo[b, f]azocinas, orto-alilanilinas, MMRC- MCA. (es)REACTIVIDAD QUÍMICA EN LA ALQUILACIÓN INTRAMOLECULAR DE FRIEDEL-CRAFTS DE ORTO-ALILANILLNAS TV-BENCILO SUSTITUIDAS
CHEMICAL REACTIVITY IN THE INTRAMOLECULAR FRIEDEL-CRAFTS ALKYLATION OF TV-BENZYL SUBSTITUTED ORTHO -ALLYLANILFNES
REATIVIDADE QUÍMICA NA ALQUILAÇÃO INTRAMOLECULAR DO FRIEDEL-CRAFTS DE ORTO-ALILANILINES V-BENCIL SUBSTITUÍDAS
Geovanna Tafurt1, Jairo R. Martínez1, Elena E. Stashenko1, Sandra L. Gomez2, Alirio Palma2
1 Centro de Investigación en Biomoléculas, Cibimol, Escuela de Química, Universidad Industrial de Santander, Cra. 27 Calle 9, Bucaramanga, Colombia. Tel.: (577) 6456737, Fax: (577) 6358210. gtafurtg@gmail.com
2 Escuela de Química, Universidad Industrial de Santander, Cra. 27 Calle 9, Bucaramanga, Colombia. Tel.: (577) 6344000, Ext.: 2794.
Recibido: 12/11/09 - Aceptado: 15/12/09
RESUMEN
En este trabajo se reporta el estudio experimental de la alquilación intramolecular de Friedel-Crafts de orto-alilanilinas N-bencilo sustituidas, que explica desde los puntos de vista cinético y termodinâmico la formación de dihidrodibenzo [b,e]azepinas y tetrahidrodibenzo[b, ƒ] azocinas. El seguimiento de los cambios en concentración resultantes del tratamiento en condiciones heterogéneas se llevó a cabo por Cromatografía de Gases-Detector de Ionización en Llama (CG-DILL), mientras que la espectroscopia Ultravioleta-Visible (UV-Vis) y el análisis quimiométrico con el Método Multivariante de Resolución de Curvas-Mínimos Cuadrados Alternados (MMRC-MCA) se usaron para examinar los efectos de las condiciones de reacción en fase homogénea e in situ. Con los resultados obtenidos se puede concluir que la supervisión de parámetros, tales como constantes de velocidad y energías de activación, hizo posible evidenciar los efectos de sustituyen-te, temperatura, velocidad de agitación y concentración, sobre la velocidad y re-gioselectividad de la reacción.
Palabras clave: alquilación intramolecular de Friedel-Crafts, dihidrodibenzo [b,e]azepinas, tetrahidrodibenzo[b,ƒ] azocinas, orto-alilanilinas, MMRC- MCA.
SUMMARY
In this work, experimental studies of intramolecular Friedel-Crafts alkylation of N-benzyl sustituted ortho-allylanilines are reported; the results explain the formation of both dihydrodibenz[b,e]azepine and tetrahydrodibenz[b,ƒ]azocine isomers from kinetic and thermodynamic points of view. The concentration changes resulting from treatment under heterogeneous conditions were followed by Gas Chromatography-Flame Ionization Detector (GC-FID), while Ultraviolet-Visible (UV-Vis) spectroscopy with Multivariate Curve Resolution-Alternating Least Squares (MCR-ALS) chemometric analysis were used for analysis of the effects of reaction conditions in homogeneous phase and in-situ. With the obtained results could be conclude that the supervision of parameters such as rate constants and activation energies proved the effects of substituent, temperature, agitation speed and concentration on reaction velocity and regioselectivity.
Key words: Intramolecular Friedel-Crafts Alkylation, dihydrodibenz[b,e]azepines, tetrahydrodibenz[b,ƒ]azocines,ortho-allylanilines, MCR-ALS.
RESUMO
No trabalho reporta-se o estudo experimental da alquilação intramolecular de Friedel-Crafts de orto-alil-anilinesN-bencil substituídas o quais explicam desde a cinética e a termodinâmica, a produção de dihidrodibenzo[b,e]azepinas e tetrahidrodibenzo[b,ƒ]azocinas. O procedimento experimental nas condições erogén foi estabelecida mediante GC-FID e a espectroscopia UV-Vis com análise quimiométrico MCR-ALS foi usada para estabelecer as condições da reação na fase homogênea e in situ. Baseados nos resultados obtidos pode-se concluir como variação dos parâmetros constate de velocidade e energia de ativação fize possível evidenciar os efeitos do substituinte, temperatura, velocidade de agitação e concentração, sobra a velocidade e seletividade da reação.
Palavras-chave: alquilação intramolecular da Friedel-Crafts, dihidrodibenzo [b,e]azepinas, tetrahidrodibenzo[b,ƒ]azocinas, orto-alilanilines, MCR-ALS.
INTRODUCCION
Las dibenzazepinas son moléculas tricíclicas nitrogenadas que pueden ser saturadas e insaturadas. Las saturadas corresponden a las dihidrodibenzazepinas, siendo la imipramina un ejemplo clásico de este tipo de moléculas. Las dibenzazepinas pueden actuar como agentes depresivos del sistema nervioso central, causando diversos efectos, entre los que se encuentran: anestésico, sedativo, hipnótico, ansiolítico, anticonvulsante y an-tisicótico (1-6). Recientemente, Palma et al. obtuvieron dihidrodibenzo[b,e]azepinas a través de una ruta sintética que involucra las siguientes etapas consecutivas (7):
1. Preparación de N-bencilanilinas a partir de anilinas sustituidas y cloruro de bencilo;
2. Obtención de N-alil-N-bencilanilinas, partiendo de N-bencilanilinas sustituidas y bromuro de alilo;
3. Transposición amino-Claisen de N-alil-N-bencilanilinas, promovida por ácidos de Lewis; y
4. Alquilación electrofílica intramolecular de las orto-alilanilinas en condiciones de catálisis ácida. Sin embargo, en esta última etapa también se obtuvieron tetrahidrodibenzo[b,ƒ]azocinas (7, 8).
Tal como se muestra en el Esquema 1, la obtención de las dihidrodibenzo [b,e]azepinas 1 se puede explicar con base en la existencia temporal de un carbocatión bencílico que se forma por transposición de un carbocatión alquílico secundario, producto de la adición Markovnikov de un protón al fragmento alílico de las orto-alilanilinas, en tanto que la producción de 2 resulta del ataque electrofílico de este carbocatión alquílico secundario al benceno bencílico antes de que se produzca su transposición al carbocatión bencílico más estable. En general, la producción de 1 es referida como un proceso de control termodinâmico y corresponde al producto de ciclación 7-exo-trig, mientras que la formación de 2 es representada como un proceso de control cinético y corresponde al producto de ciclación 8-exo-trig (7-9).
Teniendo en cuenta que la distribución de productos en una reacción se explica con base en los conceptos de controles cinético y termodinámico, y que en muchos casos las medidas experimentales no permiten obtener información sobre algunas especies involucradas en la reacción ni explicar los factores estéricos o electrónicos relacionados con los sustituyentes, en esta investigación se obtuvieron parámetros cinéticos y termodinámicos de la al-quilación electrofílica intramolecular de las orto-alilanilinas 3 (2-alil-Af-bencilani-lina) y 4 (2-alil-N-(3-metilbencil)anilina), (Esquema 1), a partir del estudio cinético mediante CG-DILL, y espectroscopía UV-Vis con análisis quimiométrico MMRC-MCA.
MATERIALES Y MÉTODOS
Reactivos y materiales
Los reactivos empleados en las diferentes reacciones fueron de grado analítico J.T. Baker, Mallinckrodt, Aldrich, Merck, Fluka y Riedel-de Haén, y usados sin purificación adicional.
Cinética medíante GC-DILL
La orto-alilanilina 3 disuelta en cloroformo (1 mL) se adicionó sobre H2SO4 (1 mL), mantenido previamente en un reactor de vidrio borosilicato de 1 cm de diámetro interno, con control de agitación y de temperatura. Los ensayos se realizaron por triplicado, para relaciones molares [H2SO4]/[orto-alil-anilina] de 43, 64, 86 y 107; velocidades de agitación de 1000, 1250 y 1600 rpm y temperaturas de 0, 10, 20 y 30 oC. El seguimiento de la reacción se realizó a partir de la extracción de alícuotas (10 µL) de la fase de H2SO4, a intervalos de tiempo predeterminados. Las alícuotas fueron neutralizadas con solución de Na2CO3 (1 mL, 4% p/v), lavadas con agua (10 mL) y extraidas con cloroformo (1 mL). Una alícuota del extracto en cloroformo (400 µL) se adicionó sobre una solución del estándar interno difenilamina (SI, 100 µL, 5 ± 1 E-03 M). La solución final se analizó por CG-DILL y Cromatografía de Gases-Detector Selectivo de Masas (CG-DSM).
Para la orto-alilanilina 4 no se obtuvieron datos preliminares mediante CG-DILL debido a que la alta velocidad de reacción requería una velocidad de muestreo proporcional.
Análisis CG-DILL
Para el análisis de los productos de la reacción de ciclación, se utilizó un cromatógrafo de gases modelo HP-5890ASeries II (Hewlett-Packard, Palo Alto, California, EE.UU.), acoplado a un DILL (Hewlett-Packard, Palo Alto, California, EE.UU.), dotado con un puerto de inyección split/splitless (split 5:1), sistema de inyección automática HP 6890 Series (Hewlett-Packard, Palo Alto, California, EE.UU.) y un sistema computa-rizado de datos MSChemStation Rev. A.06.03 [509]. Se empleó una columna HP-5 (Hewlett-Packard, Palo Alto, California, EE.UU.), con fase estacionaria de 5% fenil poli(metilsiloxano) de 30 m x 0,32 mm (d.i.) x 0,25 µm(df) y helio (99.995%, Aga Fano S.A., Bucaramanga, Colombia) como gas de arrastre (1 mL/min, 50 oC), con una presión de entrada en la cabeza de la columna de 105 kPa. La temperatura del horno se programó desde 100 oC (5 min), luego a 10
oC/min hasta 250 oC (20 min). El reconocimiento de los productos de la reacción de ciclación se realizó en un cromatógra-fo de gases modelo HP-5890A Series II (Hewlett-Packard, Palo Alto, California, EE.UU.), acoplado a un detector selectivo de masas HP 5972 (Hewlett-Packard, Palo Alto, California, EE.UU.).
Se realizó seguimiento in situ de la alquilación intramolecular de Friedel-Crafts mediante UV-Vis.
Adquisición de datos
La orto-alilanilina (0,20 mg) se adicionó sobre H2SO4 (2 mL), mantenido en una cubeta de cuarzo para UV-Vis (1 cm x 1 cm x 4 cm), con control de temperatura. Los ensayos se realizaron por triplicado, para temperaturas de 20, 30, 40, 50 y 60 oC. La detección se llevó a cabo en un espectrofotómetro UV-Vis Cary 500 de doble haz, versión 8.01, software 02.00 (25). Los espectros de absorción se registraron desde 200 hasta 500 nm, cada 1 nm. Para cada experimento, los datos fueron adquiridos a intervalos de 10 min hasta el final de la reacción.
Procesamiento de las matrices de datos
Los datos experimentales UV-Vis se ordenaron en matrices, cuyas filas se asignaron a los valores de absorbancia de los espectros registrados en diferentes tiempos de reacción y las columnas fueron asignadas para las longitudes de onda. Las siguientes matrices fueron obtenidas: A1 (99x96, 92x96; orto-alilanilinas 3 y4, respectivamente), A2 (93x96, 25x96), A3 (24x96, 17x96), A4 (17x96, 10x96) y A5 (10x96, 9x96), correspondientes a experimentos con temperaturas de 20, 30, 40, 50 y 60 OC, respectivamente. El mismo número de columnas para todas las matrices se relaciona con 96 longitudes de onda desde 205 hasta 300 nm. Las matrices de datos aumentadas con columnas discretas (M1) se construyeron a partir de las matrices A1-A5, con las siguientes dimensiones: 243x96 para la orto-alilanilina 3,y 153x96 para la orto-alilanilina 4.
Análisis de componentes principales (ACP)
El número de componentes químicos presentes en la mezcla que aportaron variación a la señal UV-Vis se estimó con base en la inspección de la varianza de los valores singulares (eigenvalues), extraidos a partir del ACP sobre las matrices A1-A5 yM1.El programa STATISTICA 6.0 (Stat Soft, Tulsa OK, EE.UU.) se usó para el ACP.
Análisis quimiométrico (MMRC-MCA)
Los tratamientos quimiométricos se llevaron a cabo empleando el programa MATLAB en su versión 7.0.0.19920
(MathWorks, Natick, MA, EE.UU.). Las subrutinas utilizadas para aplicar PURE (algoritmo basado en SIMPLIS-MA,SIMPLe-to-use Interactive Self-modeling Mixture Analysis) y MCA se adquirieron en forma gratuita de la página web del Grupo de Quimiometríay Equilibrio en Solución de la Universidad de Barcelona (10).
Estimados de los espectros de los compuestos puros
El algoritmo PURE se aplicó sobre la matriz A1 para extraer los estimados iniciales de los espectros de los componentes puros. Luego, con el algoritmo MCA se optimizaron los espectros y perfiles de concentración para cada uno de los componentes.
RESULTADOS Y DISCUSIÓN Cinética mediante CG-DILL
Los productos obtenidos en la alquilación intramolecular de las orto-alilanilinas 3 y 4, que se detectaron mediante CG-DILL después de un tiempo en el cual la reacción alcanza el equilibrio se indican en el Esquema 2.
Los productos de la alquilación intramolecular de la orto-alilanilina 3, detectados por CG-DILL y CG-DSM fueron:5-7 (11-etil-11/Mibenzo[b,e]azepina; 11-metil-5,6,11,12-tetrahidrodibenzo[b,ƒ]azocina y 11-etil-6,11-dihidro-5H-dibenzo [b,e]-azepina, respectivamente). El producto de reacción mayoritario fue 7, con un rendimiento de 73,9 ± 0,6%, seguido por 6 y5 (16,2 ± 0,9 y 8 ± 1%, respectivamente).
Los productos principales de la alquilación intramolecular de la orto-alilanilina 4 fueron los compuestos: 8-12(10,11-dimetil-5,6,11,12-tetrahidrodibenzo [b,ƒ]-azocina; 8,11-dimetil-5,6,11,12- te-trahidrodibenzo[b,ƒ]azocina;11-etil-8-metil-11ff-dibenzo[b,e]azepina; 11- etil-10-metil-6,11-dihidro-5H-dibenzo [b,e]azepinay 11-etil-8-metil-6, 11-dihi-dro-5H-dibenzo[b,e]azepina, respectivamente). Los compuestos 8 y 11, con rendimientos de 4 y 1%, resultaron de la sustitución en la posición orto con respecto al radical metilo, mientras que 9 y12, con 24 y 52% de rendimiento, fueron los productos de la sustitución en la posición para. El producto deshidrogenado 10 presentó un rendimiento del 19%.
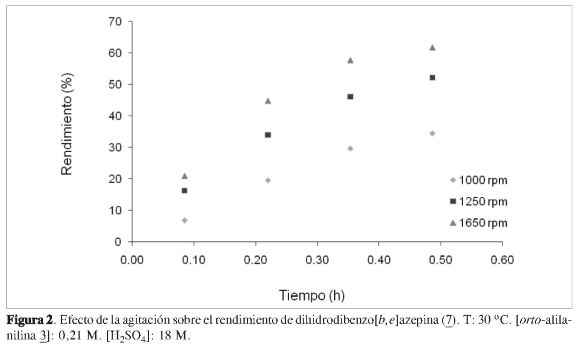
En las Figuras 1-3 se pueden observar los efectos de la concentración, la velocidad de agitación y la temperatura sobre el rendimiento de dihidrodibenzo[b,e]azepina en la alquilación electrofílica intramolecular de la orto-alilanilina3.
La disminución en el rendimiento de la dihidrodibenzo[b,e]azepina 7 a medida que aumentó la concentración de 3y el incremento de la velocidad de reacción con la agitación, permitieron deducir que: (i) a 1250 rpm la resistencia a la transferencia de masa se elimina sólo para concentraciones menores o iguales a 0,17 M (ver Figura 1); y (ii) para una concentración de 3 de 0,21 M, la velocidad de reacción es controlada cinéticamente sólo con velocidades de agitación mayores o iguales a 1650 rpm (véase Figura 2). En la Figura 3 es posible notar el efecto directamente proporcional de la temperatura sobre la velocidad de reacción (11).
Las constantes de velocidad aparentes (kap) calculadas para cada temperatura con base en el ajuste de las gráficas de ln [(Ce)/(Ce-Ct)] vs. tiempo de la dihidrodi-benzo[b,e]azepina 7, se indican en la Tabla 1. Ce yCt son las concentraciones de dihidrodibenzo[b,e]azepina 7 en el equilibrio y en el tiempo t, respectivamente.
Las kap mostradas en la Tabla 1 cumplen con la regla general que indica que el incremento de la temperatura en 10 oC causa un aumento en la velocidad de reacción que varía entre 2 y 3 veces (12, 13). Los órdenes determinados para las kap entre 10-5 y10-4 s-1 se encuentran entre los valores intermedios reportados en la literatura para la alquilación electrofílica intramolecular de diarilhomobenzoquinonas (10-6-10-2, k1 M-1 s-1), entre otras reacciones (14, 15).
Los parámetros, energía de activación (Ea), logaritmo del factor de frecuencia o frecuencia de colisión (log A), entalpia de activación (ΔH≠) y entropía de activación (ΔS≠), que se muestran en la Tabla 2, se obtuvieron a partir de la ecuación de Arrhenius al graficar ln kap vs. 1/T (12).
Los datos de la Tabla 2 sugieren que en el estado de transición no hay rompimiento sustancial de algún enlace, ya que los valores de Ea y ΔH≠ son relativamente bajos al compararlos con las energías de enlace C-C o C-H (81 y 98 kcal/mol (16)); o por el contrario, que la energía necesaria para la ruptura del enlace se compensa por la formación de otro. Adicionalmente, como se esperaba, la alquilación intramolecular conduce a una pérdida de entropía (-ΔS≠), puesto que requiere un estado de transición con una estructura altamente ordenada, de una entropía más baja que la de los reactivos (12). Además, el factor de frecuencia (A) presenta un orden entre 105y106 (s-1),por debajo de los valores encontrados para reacciones bimoleculares (1011-107 M-1 min-1), en donde la etapa limitante de la velocidad de reacción depende en un grado alto de la frecuencia de colisión intermolecular (13).
Seguimiento in situ de la alquilación intramolecular de Friedel-Crafts mediante UV-Vis
En la Tabla 3 se indican los valores propios obtenidos a partir del ACP sobre las matrices de datos A1-A5 yM1. Se encontró que hasta el tercer y el cuarto valor propio aportaron contribuciones significativas a la varianza total. Dado que el número de especies presentes en la reacción es mayor o igual a 4 (teniendo en cuenta los intermediarios probables, según el mecanismo de reacción, véase Esquema 1), se dice entonces que la información contenida en las matrices de datos A1-A5 es deficiente (deficiencia de rango o de orden) para realizar el análisis quimiométrico. Para tratar de eliminar esta deficiencia se recurrió a lo propuesto por M. Amrhein et al.,y se construyeron las matrices aumentadas con columnas discretas M1, con lo que se logró un incremento hasta el cuarto valor singular (17).
La optimización de M1 mediante MMRC-MCA con restricciones (concentración inicial y no negatividad para espectros y perfiles de concentración), permitió la extracción de las matrices C (243x4; 153x96; para 3 y4, respectivamente) y ST (4x96), las cuales contenían los perfiles de concentración y los espectros de cuatro compuestos que intervenían en las reacciones de alquilación intramolecular de 3 y4, para cada una de las temperaturas evaluadas. En cuanto a la calidad del ajuste ofrecida por la optimización MMRC-MCA, se encontró que el producto CST expresó el 99,80% y el 99,87% de la varianza relacionada con M1 lo que indicó que la mayoría de la variabilidad asociada con los datos experimentales pudo ser representada mediante el producto CST.
Los espectros UV-Vis extraídos al optimizar las matrices M1 mediante MMRC -MCA, se muestran en la Figura 4. La asignación de cada espectro al compuesto respectivo se hizo por correspondencia con los perfiles de concentración. Las bandas entre 205-245 y 245-285 nm corresponden a transiciones entre orbitales Π→Π* yn→Π*. Las diferencias en absorción (ε, absortividad) están relacionadas con la mayor probabilidad de transición entre los orbitales Π→Πen relación con las transiciones entre n→Π*, ya que los orbitales n poseen una orientación espacial desfavorable con respecto a los orbitales Π(18, 19).
En la Figura 5 se indican los perfiles de concentración obtenidos a 30 oC para la alquilación intramolecular de 3 y4. Los perfiles extraidos sin postulación previa de un modelo químico reprodujeron satisfactoriamente la relación molar y la temperatura que se usó para cada experimento. Para la reacción con 3, se extrajeron de forma adecuada los perfiles de 3,5 y7. Con respecto a la alquilación de 4,se obtuvieron satisfactoriamente las concentraciones de 4,9,10 y 12, y al igual que por CG-DILL, no se detectó intermediario alguno.
Las kap calculadas para cada temperatura con base en el ajuste de las gráficas de ln [(Ce)/(Ce-Ct)] vs. tiempo para la formación de dihidrodibenzo[b,e]azepinas, se indican en la Tabla 4. El uso de la ecuación de Arrhenius o gráficas de Eyring se recomienda como una validación química de la calidad de la información cinética extraida, de tal forma que la buena linealidad obtenida es una prueba de la consistencia del parámetro kap y, por ende, del proceso empleado en su estimación (20).
Las constantes de velocidad mostradas en la Tabla 4, al igual que los parámetros cinéticos extraidos por GC-FID para 3,se duplicaron por el incremento de la temperatura en 10 °C (12, 13). La alquilación intramolecular de 4 es aproximadamente 5 veces más rápida (kap;10-3), que la de 3 (kap;104). Esto último puede ser debido a una disminución en la energía de activación para la alquilación intramolecular de 4 de aproximadamente 1-2 kcal/mol. Comparado con 3, la alquilación intramolecular de 4 requiere una menor energía (Ea, ΔH≠) y frecuencia de colisión (log A), pero conduce a una pérdida de entropía mayor (ΔS&ne).
CONCLUSIONES
La alquilación intramolecular de la orto-alilanilina 3 en fase heterogénea permitió determinar la influencia de condiciones tales como la velocidad de agitación, la concentración y la temperatura sobre la velocidad o el rendimiento de la reacción.
La optimización mediante el algoritmo MMRC-MCA de los datos obtenidos en la alquilación intramolecular de 3y4,enfase homogénea e in situ, condujo a la estimación de espectros y perfiles de concentración imposibles de obtener mediante análisis tradicional UV-Vis, debido a la poca selectividad en las características espectrales.
La linealidad de los parámetros cinéticos y la adecuada correlación con respecto a los datos extraídos mediante CG-DILL, permitieron determinar la consistencia de la optimización mediante MMRC-MCA en la obtención de los perfiles de concentración.
AGRADECIMIENTOS
Geovanna Tafurt agradece a Colciencias (Instituto Colombiano para el Desarrollo de la Ciencia y la Tecnología) por la beca de sostenimiento del Programa de Apoyo a Doctorados Nacionales 2003, y Alirio Palma agradece por el financiamiento del proyecto de investigación No 1102-40820563 de Colciencias.
REFERENCIAS BIBLIOGRÁFICAS
1. Martin, A. R.; Paradkar, V. M.; Peng, G. W.; Speth, R. C.; Yamamura, H. I.; Horn, A. S. Conformationally restricted tricyclic antidepressants. 1. Octahydrodibenzazepinonaphthyridines as rigid imipramine analogues. J. Med. Chem. 1980. 23 (8): 865-873.-
2. Eberlein, W. G.; Trummlitz, G.; Engel, W. W.; Schmidt, G.; Pelzer, H.; Mayer, N. Tricyclic compounds as selective antimuscarinics. 1. Structural requirements for selectivity toward the muscarinic acetyl- choline receptor in a series of pirenzepine and imipramine analogues. J. Med. Chem. 1987. 30 (8): 1378- 1382.
3. Hino, K.; Nagai, Y.; Uno, H.; Masuda, Y.; Oka, M.; Karasawa, T. A novel class of potential central nervous system agents. 3-phenyl-2- (1-piperazinyl)-5H-1-benzazepines. J. Med. Chem. 1988. 31 (1): 107-117.
4. Massa, S.; Artico, M.; Mai, A.; Corelli, F.; Botta, M.; Tafir, A.; Pantaleoni, G. C.; Giorgi, R.; Coppolino, M. F.; Cagnotto, A.; Skorupska, M. Pyrrolobenzodiazepines and related system. 2. Synthesis and biological properties of isonoraptazepine derivatives. J. Med. Chem. 1992. 35 (24): 4533-4541.
5. Ter Laak, A.M.; Venhorst, J.; Donné-Op den kelder, G. M.; Timmerman, H. The histamine H1-receptor antagonist binding site. A stereo selective pharmacophoric model based upon (semi-)rigid H1-antagonists and including a known interaction site on the receptor. J. Med. Chem. 1995. 38 (17): 3351-3360.
6. Wikstrõm, H. V.; Mensonides-har-sema, M. M.; Cremers, T. I. F. H.; Moltzen, E. K.; Arnt, J. Synthesis and pharmacological testing of 1,2,3,4,10,14b-hexahydro-6-methoxy-2-methyldibenzo[c,/pyrazi-no[1,2-a]azepin and its enantiomers in comparison with the two antidepressants mianserin and mirtazapine. J. Med. Chem. 2002. 45(15): 3280-3285.
7. Palma, A.; Barajas, J.; Kouznetsov, V.; Stashenko, E.; Bahsas, A.; Amaro-Luis, J. New and efficient synthesis of 6,11-dihydro-11-ethyl-5H-dibenz[b,e]azepine derivatives starting from N-benzylanilines via amino-Claisen and Friedel-Crafts methodologies. Synlett. 2004. 15: 2721-2724.
8. Jaimes, J. Extensión de la transposición amino-Claisen a la preparación de derivados de la 6,11-dihidrodibenzo[b,e]azepina. Trabajo de grado (Maestría en Química). Universidad Industrial de Santander. Bucaramanga. 2004.
9. Stashenko, E. E.; Martínez, J. R.; Tafurt-García, G.; Palma, A.; Bofill, J. M. A computational study and valence bond approach to the intramolecular electrophilic aromatic substitution mechanism of ortho-allyl-N-benzylanilines.Tetrahedron. 2008. 64(30-31): 7407-7418.
10. http://www.ub.edu/mcr/welcome.html Fecha de consulta: agosto de 2007.
11. Doraiswamy,L.K.;Sharma,M.M. Heterogeneous reaction: analysis, examples, and reactor design. Volume 2: Fluid-fluid-solid reactions. Wiley-interscience publication. New York, John Wiley & sons. 1984, 374 p.
12. Pross, A. Theoretical and physical principles of organic reactivity. New York, John Wiley & Sons, 1995, 294 p.
13. Connors, K. A. Chemical kinetics. The study or reactions rates in solution. New York, VCH Publishers, 1990, 480 p.
14. Koizumi, T.; Harada, K.; Mochizuki, E.; Kokubo, K.; Oshima, T. Kinetic evidence for remote p-aryl participation in the BF3-catalyzed rearrangement of [2 + 2] photocycloadducts of diarylhomobenzoqui-nones with diphenylacetylene. Org. Lett. 2004. 6 (22): 4081-4084.
15. Wang, M. L.; Huang, T. H.; WU, W. T. Kinetics of the oxidation of 5-vinyl-2-norbornene under two-phase-transfer catalysis conditions. Ind. Eng. Chem. Res. 2002. 41 (3): 518-523.
16. Carey, F. A.; Sundberg, R. J. Advanced organic chemistry. Part A: structure and mechanisms (3rd. ed.). New York, Plenum Press, 1990, 802 p.
17. Amrhein, M.; Srinivasan, B.; Bonvin, D.; Schumacher, M. M. On the rank deficiency and rank augmentation of the spectral measurement matrix. Chemom. Intell. Lab. Syst. 1996. 33 (1): 17-33.
18. Crews P.; Rodríguez, J.; Jaspars, M. Organic structure analysis. New York, Oxford University Press, 1998, p. 349.
19. Banwell, C. N. Fundamentos de espectroscopia molecular. Madrid, Ediciones del Castillo S.A., 1977, p. 216.
20. De Juan, A.; Maeder, M.; Martínez, M.; Tauler, R. Application of a novel resolution approach combining soft- and hard- modelling features to investigate temperature-dependent kinetic processes. Anal. Chim. Acta. 2001.442 (2): 337-350.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).