Diversidad de hongos micorrizógenos arbusculares de una crono secuencia de suelos aluviales degradados por actividad minera en el bajo cauca antioqueño, Colombia.
Keywords:
HMA, Pueraria phaseoloides, Zea mays, PCR, Suelos degradados. (es)Downloads
DIVERSIDAD DE HONGOS MICORRIZÓGENOS ARBUSCULARES DE UNA CRONO-SECUENCIA DE SUELOS ALUVIALES DEGRADADOS POR ACTIVIDAD MINERA EN EL BAJO CAUCA ANTIOQUEÑO, COLOMBIA
DIVERSITY OF ARBUSCULAR MYCORRHIZAL FUNGI IN A CHRONO-SEQUENCE OF ALLUVIAL AND DEGRADED SOILS DUE TO MINING PROCESSES IN BAJO CAUCA ANTIOQUEÑO, COLOMBIA
Marisol Medina Sierra1; Francisco Hernando Orozco Patiño2 y María Elena Márquez Fernández3
1 Profesora. Universidad de Antioquia. Facultad de Ciencias Agrarias. A.A. 1226, Medellín, Colombia. <solmedina@agronica.udea.edu.co>
2 Profesor Jubilado. Universidad Nacional de Colombia Sede Medellín. Facultad de Ciencias. A.A. 3840 Medellín, Colombia. <horozco@une.net.co>
3 Profesora Asociada. Universidad Nacional de Colombia Sede Medellín. Facultad de Ciencias. A.A. 3840 Medellín, Colombia. <memarque@unalmed.edu.co>
Recibido: Octubre 7 de 2007; Aceptado: Abril 15 de 2009
Resumen. Se evaluó la presencia de hongos micorrizógenos arbusculares (HMA) en suelos de zonas alteradas y no alteradas por minería de aluvión de los subgrupos Tropic Fluvaquent, Typic Dystropept y Typic Paleudult de terrazas Baja, Media, y Alta, respectivamente, del río Cauca a la altura del municipio de Tarazá (Antioquia, Colombia). La multiplicación de propágulos de HMA se realizó en jarras de Leonard en invernadero, utilizando sustrato estéril, solución Hoagland's modificada y como inóculo diferentes fracciones de suelo correspondientes al tamaño de las esporas. Se realizó un primer ensayo en maíz (Zea mays) en el cual se logró colonización de las raíces pero no esporulación; en un segundo ensayo en kudzú (Pueraria phaseoloides) se logró colonización y esporulación en los tratamientos provenientes de suelo de terraza alta y suelo disturbado y efecto significativo en el rendimiento del kudzú (P≤0,001) respecto a los demás tratamientos. Las esporas de suelos disturbados y no disturbados por minería de aluvión en el Bajo Cauca antioqueño (Colombia) mostraron baja capacidad infectiva; sin embargo, en cultivos trampa fue posible multiplicar HMA que produjeron esporas de cuatro morfotipos diferentes, uno de los cuales se identificó como G. microagregatum. El polimorfismo de los morfotipos obtenidos mediante la técnica de RAPD's permitió diferenciarlos con el cebador OPA2 y el agrupamiento por UPGMA con todos los cebadores mostró similitud mayor al 38% entre ellos. Los resultados moleculares y morfológicos, permitieron ubicar los cuatro morfotipos en el género Glomus pero posiblemente pertenecen a especies diferentes. Los resultados obtenidos son promisorios en la diferenciación de cepas nativas con bajo número de esporas colectadas a partir de muestras de suelos en proceso de rehabilitación, de los cuales no se conoce su composición de HMA.
Palabras claves: HMA, Pueraria phaseoloides, Zea mays, PCR, suelos degradados.
Abstract. Arbuscular mycorrhizal fungi (AMF) presence and diversity were evaluated in undisturbed and disturbed soils form alluvial mining processes. The soils belong to the Tropic Fluvaquent, Typic Dystropept, and Typic Paleudult sub-groups which corresponded to Low, Middle and High terraces, respectively, of the Cauca river at Taraza town. AMF propagules were multiplied in Leonard jars under glasshouse conditions using sterile substrate, modified Hoagland's solution and different fractions of soil used as sources of inoculum, which corresponded to the size of the spores. A first assay was made in maize (Zea mays) which allowed mycorrhizal colonization in roots but not spore production. In a second assay, in kudzú (Pueraria phaseoloides) AMF spores and colonized roots were obtained with the treatments corresponding to propagules obtained from high terrace and disturbed soil. These treatments presented a significant effect on kudzu yield (P≤0,001) respect to the other treatments. The AMF spores of undisturbed and disturbed soils showed low infective capacity. Nevertheless, propagules of AMF were multiplied in trap cultures, which produced spores of four morphotypes. One of these was identified as G. microagregatum. The polymorphism obtained by RAPD's made possible the differentiation of these morphotypes with the primer OPA2. Similitude above 38% was achieved using UPGMA system. The results indicated that four morphotypes belong to the genus Glomus, but they possibly belong to different species. Our results are promissory in the differentiation of native strains of AMF with low number of spores collected from soil samples in rehabilitation processes, which normally is unknown.
Key words: AMF, Pueraria phaseoloides, Zea mays, PCR, degraded soils
El Bajo Cauca Antioqueño desde los tiempos de la colonia ha sido afectado por actividad minera de aluvión. Dicha acción ha generado un cambio obligado del uso del suelo con fuertes impactos ambientales que incluyen la deforestación, la erosión, el deterioro de las fuentes de agua, entre otros (López, 2002). Como alternativa para la zona, algunas instituciones gubernamentales, han propuesto la rehabilitación de los suelos mediante el empleo de algunas especies vegetales introducidas (CORANTIOQUIA, 2002) o mediante la recolonización con especies vegetales y microorganismos adaptados a las condiciones y relacionados con el flujo de nutrientes al sistema (Orozco y Gómez, 1994), dentro de los que se encuentran los hongos micorrizógenos (HMA).
Los HMA presentan grandes beneficios como permitir una mejor exploración del sistema radical, compensar la infertilidad, incrementar el nivel de tolerancia frente a situaciones de estrés como la sequía, las alteraciones del suelo, y la presencia de otros organismos (Smith et al., 1997);contribuir a la creación de unidades estructurales del suelo (Jastrow et al., 1998), ejercer un efecto directo en la captación de amonio, intervenir en la captación de nutrientes poco móviles como P, Zn, Cu y otros (Smith et al., 2001) y ayudar a la absorción de nutrientes a partir de fuentes poco solubles (Orozco, 1978). En este sentido, el conocimiento de la diversidad de hongos micorrizógenos en esos suelos, contribuye con el establecimiento posterior de programas de rehabilitación que inicien con el análisis de las especies nativas o por lo menos de aquellas adaptadas a esas condiciones.
El estudio de la diversidad de hongos micorrizógenos mediante criterios morfológicos, presentan la dificultad de encontrar caracteres morfológicos apropiados para la diferenciación entre especies (Walker et al., 2007). Aunque los criterios morfológicos siguen siendo válidos, se ha impulsado el empleo de otras técnicas como el análisis de marcadores genéticos de ADN menos influenciados por el ambiente (Wiss y Bonfante, 1993) basados en PCR que permitan la detección de polimorfismo como los RAPDs (Williams et al., 1990), entre otros. Este tipo de análisis ha permitido diferenciar aislados de HMA de regiones geográficas similares (Wyss y Bonfante, 1993), diseñar cebadores específicos para diferenciar HMA a partir de esporas individuales (Gadkar y Rillig, 2005) y obtener sondas (Yokoyama et al., 2002); lo que facilita el estudio de los aspectos ecológicos, fisiológicos y taxonómicos de estos hongos (Bentivenga et al., 1997; Yokoyama et al., 2002). Por lo anterior, en este trabajo se pretende probar que en suelos alterados por minería de aluvión persisten hongos endomicorrizógenos útiles para un proceso posterior de recolonización vegetal; para esto, se estudió la abundancia y diversidad de hongos micorrizógenos arbusculares de una cronosecuencia de suelos aluviales degradados por actividad minera en el Bajo Cauca Antioqueño, mediante el muestreo y análisis de los suelos degradados y no degradados, la multiplicación de los HMA en cultivos trampa, la caracterización morfológica en forma directa y el análisis del polimorfismo mediante RAPD's de algunos morfotipos obtenidos.
MATERIALES Y MÉTODOS
Zonas de muestreo. La región está ubicada en las coordenadas LN8º8' LS7º17' LE74º28' y LW76º8', correspondiente a una zona de vida bosque húmedo tropical (bh-T), con temperatura media anual de 28 ºC, precipitación media de 3.500 mm y con materiales litológicos influenciados por rocas sedimentarias terciarias (IGAC, 1990). Para el muestreo de cada zona, se tomaron 20 submuestras a una profundidad de 20 cm, según metodología del ICA (ICA, 1992) sobre un transecto de la margen izquierda del río Cauca (Bajo Cauca Antioqueño) entre altitudes de 80 y 130 m. En estos sitios se zonificaron áreas de suelos aluviales sin disturbar, con diferente grado de desarrollo de una cronosecuencia evaluada (Orozco y Gómez, 1999) y suelos disturbados, con diferente tiempo de abandono. Los suelos sin disturbar comprendieron la terraza baja (Tb), terraza media (Tm), terraza alta (Ta) y bosque secundario (B) y los suelos disturbados correspondieron a dos tipos de material de alteración por minería, uno con presencia de hierro más oxidado que se denominó "carguero rojo" (R) y el otro con hierro reducido al cual se denominó "carguero pardo" (P) (Tabla 1).
Tabla 1. Taxonomía y caracterización de los suelos analizados en la región del Bajo Cauca Antioqueño, Colombia.
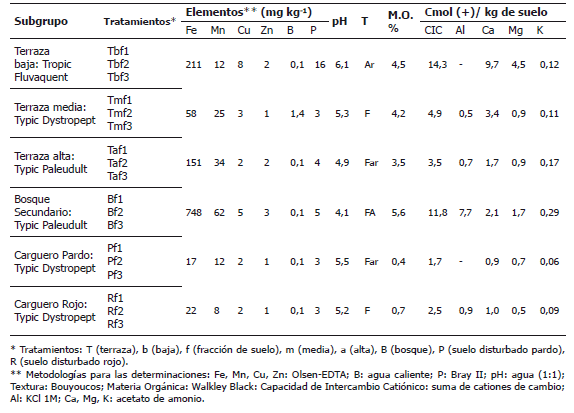
Criterios para la selección de los tratamientos y evaluación morfológica de las esporas de HMA. Se seleccionaron como tratamientos aquellas fracciones de suelo para cada sitio correspondientes al tamaño donde se tenía mayor probabilidad de encontrar propágulos de hongos HMA, para lo cual los tratamientos se codificaron de acuerdo a las fracciones de suelo. La fracción uno (f1) comprendió el material de suelo que contenía las esporas entre 38 y 75 mm, la fracción 2 (f2) de 75 a 147 mm y la fracción 3 (f3) de 147 a 500 mm (Tabla 1). Las esporas se extrajeron mediante el procedimiento propuesto por Sieverding (1991) y se identificaron por características morfológicas (Schenck y Pérez, 1990) como la forma, la superficie, el tamaño relativo y el color (según nomenclatura INVAM International Vesicular Arbuscular Mycorrhizal).
Ensayos para la obtención de propágalos de HMA. Para la multiplicación, se seleccionaron dos especies de plantas tropicales ampliamente conocidas y contrastantes.
- Multiplicación en maíz (Zea mays ICA-V-303). Se emplearon jarras Leonard (1943) de un litro de capacidad con un sustrato una mezcla de carbón molido, cisco de arroz, vermiculita y cuarzo (en relación 1:1:1:1/2) suplementado con fosforita Huila (P a razón de 50 kg ha-1); las jarras con el sustrato se esterilizaron a 15 PSI por 40 min. Las semillas de maíz se trataron con etanol al 96% e hipoclorito de sodio comercial al 1,3% y se sembraron 3 semillas por jarra con inóculo de las respectivas fracciones a razón de 60 esporas por jarra. El ensayo se mantuvo con solución de Hoagland's (Millner y Kitt, 1992) sin KNO3, para causar un poco de estrés a la asociación, 10 mM de KH2PO4, sin adición de HCl y se ajustó el pH a 5,7-5,8 con KOH. Para la evaluación se empleó un diseño completamente aleatorizado con 19 tratamientos y 5 repeticiones por tratamiento. La colonización por las diferentes estructuras se determinó mediante tinción con azul de tripano modificada de Phillips y Hayman (1970), se realizó extracción y conteo de esporas en el sustrato y con base en los resultados, se realizó un nuevo ensayo de esporulación.
- Evaluación y selección en kudzú (Pueraria phaseoloides). Los tratamientos seleccionados del ensayo anterior que presentaron arbúsculos representativos de la colonización por HMA, se evaluaron en kudzú con las mismas condiciones y parámetros del ensayo anterior; en un diseño completamente aleatorizado con 12 tratamientos y 4 repeticiones por tratamiento. Las semillas de kudzú se escarificaron con H2SO4 al 96% por 1 min., se lavaron cinco veces con agua destilada estéril, se pregerminaron en agar PDA y luego se transplantaron tres plántulas por jarra de Leonard. Como inóculo se emplearon trozos de raíz de maíz colonizadas de 1-2 cm y además se evaluaron nuevamente los tratamientos Tmf1, Tmf2, Tmf3 de la terraza media (Tabla 1) que no presentaron colonización en maíz.
Evaluación por RAPDs de los aislados de hongos micorrizógenos. Se ha encontrado que el cebador OPA9 diferencia entre especies de HMA del género Glomus (Wyss y Bonfante, 1993), por esa razón en este trabajo se exploraron cebadores de la Operon Technologies de las Series A (OPA1 a OPA20) y M (OP261 a OP2626) para evaluar los morfotipos de HMA de la región del Bajo Cauca Antioqueño.
- Extracción de ADN. Se realizó a partir de esporas mediante los protocolos CTAB (cetil trimetil amonio bromuro) (Weising et al., 1995) y el protocolo modificado Chelex-100 con congelamiento/descongelamiento posterior en nitrógeno líquido para ambos protocolos (Wyss y Bonfante, 1993).
- Condiciones de amplificación y de separación. Cada tubo de reacción contenía un volumen total de 25 ml distribuidos así: 2,5 ml Tris-HCl 10 mM; 2,5 ml KCl 50mM; 2,5 ml dNTPs 0,25 mM; 2,5 ml MgCl2 2,5 mM; 1,2 ml cebador 0,48 mM (de stock 20 mM); 0,2 ml Taq polimerasa (CIAT) 0,1 U; 9,6 ml agua; 4 ml muestra de ADN y 15 ml de aceite mineral. La amplificación se realizó con las siguientes condiciones: 1 min 94 ºC; 4 ciclos: 1 min 94 ºC, 1 min 35 ºC, 2 min 72 ºC; 33 ciclos: 15 seg. 94 ºC, 30 seg 35 ºC, 1 min 72 ºC; 5 min 72 ºC, en termociclador Perkin Elmer 9000. Las condiciones de corrido electroforético fueron: gel de agarosa al 1,2% en buffer TBE 0,5X a 75 voltios y 120 watios durante tres horas, se empleó un marcador de peso molecular de 1 kb (Promega) y bromuro de etidio (0,5 mg/ml) para visualizar el ADN.
- Análisis estadístico de las bandas. A cada banda se le asignó uno (1) si estaba presente y cero (0) si estaba ausente. Se analizaron mediante el método de Ward's del programa Statgraphics plus y el nivel de similitud se determinó según Nie y Li (1979) así:

Además, se empleó el método de agrupamiento UPGMA utilizando el índice de similitud de Jaccard mediante el programa NTSYS.
RESULTADOS
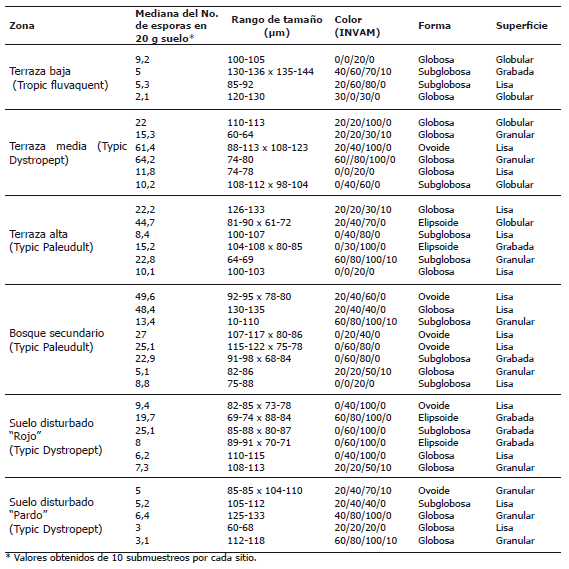
Evaluación de los hongos HMA en suelos degradados del Bajo Cauca Antioqueño. En la Tabla 2 se muestran los principales tipos de esporas (1-10 esporas g-1) obtenidos en las muestras de suelos colectadas en el campo. La más baja cantidad de esporas se encontró en los suelos de la terraza baja (Tb) y el lote pardo (P), mientras que la mayor cantidad se presentó en el suelo bajo cobertura de bosque (B) y en la terraza media (Tm). El mayor número y la mayor diversidad de esporas se presentaron en el suelo del bosque, caracterizado por su acidez, mayor contenido de materia orgánica, Fe, Mn y una concentración muy alta de Al, limitante para la mayoría de las plantas cultivadas (Tabla 1).
Tabla 2. Descripción morfológica y conteo de los diferentes tipos de esporas de hongos micorrizógenos obtenidas de suelos no disturbados y disturbados por minería en el Bajo Cauca Antioqueño, Colombia.
Obtención de propágulos de hmA.
- Evaluación en maíz (Zea mays). El ensayo se cosechó a los cuatro meses y en todos los tratamientos se detectó la presencia de micelio en raíces, no obstante la presencia de arbúsculos es la que garantiza que el micelio es micorrizal (Figura1). La adición de esporas del suelo provenientes de la terraza alta mostró una colonización micorrizal mayor del 70% con los tratamientos de terraza alta (Taf2 y Taf3) (Tabla 1), mientras que con la adición del suelo de bosque no se presentó colonización con ninguna de las tres fracciones. Por otro lado, al inocular con las fracciones 2 y 3 (75-147 y 147-500 mm) provenientes de la terraza alta y suelo disturbado pardo (carguero pardo) (Tabla 1) generaron una colonización micorrizal mayor del 40% en la cual se detectaron micelio y arbúsculos, pero no esporas, mientras que con la fracción 2 del lote pardo (Pf2) se produjo un morfotipo de espora que fue posteriormente usada para la caracterización por RAPDs. Debido a la poca esporulación encontrada en maíz, se seleccionó kudzú como segundo hospedero y se emplearon como inóculo las raíces colonizadas de maíz; que a pesar de no presentar esporulación, si se encontró colonización diferencial por los HMA presentes en esos suelos.

Figura 1. Estimación de la colonización por HMA en maíz (ICA-V-303) bajo condiciones de invernadero, en suelos degradados del Bajo Cauca Antioqueño, Colombia.
- Evaluación y selección en kudzú (Pueraria phaseoloides). Los resultados de colonización micorrizal obtenidos con kudzú fueron muy similares a la colonización obtenida en maíz. Esta evaluación permitió establecer la presencia de diferencias significativas en el peso seco de la planta con los diferentes tratamientos (Figura 2). Los resultados con la inoculación proveniente de los tratamientos Pf2 y Pf3 de suelos de carguero pardo y Taf3 de la terraza alta, mostraron una diferencia en peso seco altamente significativa (P≤0,0001) con respecto a los demás tratamientos evaluados. El peso seco correspondiente a la inoculación con el tratamiento Pf3 del suelo disturbado pardo presentó la mejor respuesta, con un incremento del 65% en el peso seco de kudzú con respecto a los otros dos tratamientos superiores. Al comparar con el otro suelo disturbado rojo (Rf3), se encontró un incremento del 300%.
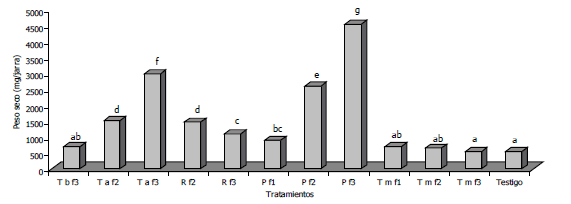
Figura 2. Evaluación la colonización por HMA en kudzú bajo condiciones de invernadero, en suelos degradados del Bajo Cauca Antioqueño, Colombia. Letras diferentes sobre las barras indican diferencia entre tratamientos, según la prueba de Duncan (P≤0,05).
A pesar de la baja producción de esporas encontradas en el sustrato, la inoculación con los tratamientosTaF3, PF2 y PF3 produjeron un rendimiento superior en kudzú y presentaron además las estructuras de HMA (Tabla 3), lo que permitió su selección para la evaluación por RAPDs. Por otro lado, los demás tratamientos correspondientes a TbF3, RF2, RF3, PF1, TmF1, TmF2 y TmF3 no mostraron colonización ni producción de esporas.
Tabla 3. Evaluación de la colonización y morfología de las esporas obtenidas por HMA en Pueraria phaseoloides sembrado bajo condiciones de invernadero en suelos degradados del Bajo Cauca Antioqueño, Colombia.

Caracterización morfológica y por RAPDs de los morfotipos de HMA. Mediante la reacción de Melzer's sólo se detectaron carbohidratos tipo dextrinoide a los morfotipos MICUNMS32 y 33 (MICUNMS corresponde al código de la colección de Micorrizas Universidad Nacional Microbiología de Suelos) (Tabla 4), mientras que los otros morfotipos no mostraron carbohidratos detectables con Melzer's. Estos morfotipos se enviaron para identificación, de los cuales por criterios morfológicos se identificó el morfotipo MICUNMS33 como Glomus microagregatum (identificado por Dr. Jhon Dodd del Banco Europeo de Glomales).
Tabla 4. Morfotipos estudiados de hongos micorrizógenos de suelos degradados por minería de aluvión del Bajo Cauca Antioqueño, Colombia.

A pesar de haber estandarizado los dos protocolos propuestos para la extracción de ADN; en este trabajo, se empleó el protocolo Chelex-100 por ser más corto y menos costoso y se amplificó el ADN con cada uno de los cebadores de la Serie A. De estos, los cebadores OPA1 y OPA6 no amplificaron, se encontraron bandas similares con los cebadores OPA4, OPA9, OPA17, OPA18, OPA19 y OPA20 y se diferenciaron claramente los cuatro morfotipos con el OPA2 (Figura 3).

Figura 3. Discriminación con OPA2 de los morfotipos de HMA de suelos degradados y no degradados del Bajo Cauca Antioqueño, Colombia (método de Ward's).
Por otro lado, la evaluación con la Serie M, bajo las mismas condiciones de amplificación y corrido electroforético, mostró amplificación leve con los cebadores OP26-1, OP26-2, OP26-12 y OP26-13. Por esta razón se evaluó la amplificación a diferentes temperaturas (32, 33, 35, 37 y 39ºC). Sin embargo, tampoco fue posible obtener un patrón de bandas que diferencie los morfotipos como el OPA2.
El análisis de los productos de amplificación de los morfotipos con los cebadores OPA1 al OPA20 mediante el índice de Nei y Li (1979) proporcionó un porcentaje de similitud entre ellos, así: MICUNMS31-MICUNMS32 (48,5%), MICUNMS32-MICUNMS33 (41,6%), MICUNMS33-MICUNMS34 (47,5%), MICUNMS31-MICUNMS33 (42,6%), MICUNMS31-MICUNMS34 (44,6%) y MICUNMS32-MICUNMS34 (38,4%) y el agrupamiento por UPGMA mostró que todos los cebadores muestran similitud mayor al 38% entre los morfotipos estudiados (Figura 4).

Figura 4. Dendogramas de cuatro morfotipos de HMA de suelos degradados y no degradados del Bajo Cauca Antioqueño, Colombia. (A) Nivel de similitud de Nei y Li (1979). (B) Índice de similitud de Jaccard.
DISCUSIÓN
Hongos HMA en suelos degradados del Bajo Cauca Antioqueño. El número de esporas encontrados en estos suelos fue bajo si se compara con suelos agrícolas (Sieverding, 1991). Sin embargo, en las zonas evaluadas de los suelos Typic Paleudult (ultisoles) se encontraron alrededor de 7 esporas g-1 (Tabla 2), similar a lo encontrado (6 esporas g-1) para suelos Typic Hapludult (ultisoles) de una zona de bosque intervenido de la región del Caguán (Caquetá) (Martínez y Montenegro, 1990). Uhlmann et al. (2006) hallaron aún más baja cantidad de esporas (alrededor de 2 esporas g-1) en suelos de zonas áridas degradadas del sur de Namibia (África), otros investigadores encontraron también, HMA del género Glomus en suelos degradados (Tian et al., 2009). Esto indica que es normal encontrar baja cantidad de esporas de HMA para las condiciones de degradación en las que se encuentran los suelos como consecuencia de la actividad minera que influyó significativamente en la pérdida de biodiversidad (López, 2002).
Los resultados muestran que los suelos aluviales de terraza baja (Tb) presentaron un bajo número de esporas viables, contrario a lo esperado. Esto podría explicarse por las condiciones de reducción química durante períodos prolongados, lo cual es característico en este tipo de suelo (Fluvaquent). Este resultado es similar a lo encontrado en un suelo aluvial de Caquetá (Fluvaquent), con un máximo de 3 esporas g-1, el cual es el valor más bajo de los suelos analizados por Martínez y Montenegro (1990). En este estudio las pocas esporas de HMA encontradas no mostraron conexión hifal y estaban vacías, que es característico de zonas degradadas en donde la vegetación es dispersa y escasa. Otro estudio realizado en la misma zona, mostró buena producción de esporas del género Glomus (13 esporas g-1) en la rizosfera de balso. Si se compara con suelos aledaños sin ningún tipo de cobertura (1 espora g-1) se puede apreciar el efecto benéfico de las plantas pioneras (Arango, 1996) en la presencia de HMA en suelos degradados.
Multiplicación de HMA
- Evaluación en maíz (Zea mays). Al evaluar la infectividad de los propágulos de los diferentes tratamientos, se encontró que las fracciones provenientes del bosque no presentaron colonización en maíz. Esto se puede atribuir a que el componente arbóreo posee más afinidad con hongos de tipo ectomicorrizógeno (Anderson y Cairney, 2007), o posiblemente los HMA posean una condición de latencia o mortalidad debido al parasitismo (Lee y Koske, 1994).
Sin embargo, en la terraza alta (Ta), que estaba ubicada en el mismo tipo de suelo que el bosque (Typic Paleudult) si se obtuvo colonización en la planta hospedera. Esto podría explicarse, como ya se indicó, por el tipo de vegetación, que en la terraza alta es de tipo herbáceo, o por la acidez del suelo de bosque, que como ha sido ampliamente informado, afecta la comunidad microbial del suelo (Leake et al., 2006). Los resultados de este primer ensayo, condujeron a una segunda evaluación en otro hospedero con el fin de buscar esporulación para realizar la caracterización molecular y garantizar una planta hospedera útil para conservar los organismos encontrados en esos suelos para posteriores estudios.
- Evaluación y selección en kudzú (Pueraria phaseoloides). Así como en maíz, la mayoría de propágulos infectivos se obtuvieron en los suelos de "carguero pardo", la zona más alterada por la actividad minera. Algunos autores sugieren que la colonización puede ser similar a partir de suelos disturbados y no disturbados y plantean que a pesar de la destrucción del micelio extrarradical de las micorrizas por la disturbancia ejercida en un suelo, este micelio puede servir como propágalo (McGonigle y Miller, 2000; Enkhtuya et al., 2000). No obstante, aunque se obtuvo la mayor cantidad de esporas en las muestras de bosque (10 esporas g-1) (Tabla 2) y en terraza media (9 esporas g-1), no fueron infectivas bajo estas condiciones. Esto posiblemente se debe a la alta concentración de boro (1,4 mg kg-1) presente en el suelo de terraza media (Tabla 1) que podría ser responsable de la pérdida de la infectividad. Se ha mencionado que concentraciones superiores a 0,7 mg kg-1 puede afectar el desempeño de los HMA (Enkhtuya et al., 2000).
Caracterización morfológica y por RAPDs de los morfotipos de HMA. En este trabajo se confirma la baja diversidad de los suelos afectados por actividad minera ya que se encontraron pocos morfotipos de HMA susceptibles de multiplicarse en hospederos conocidos. La caracterización morfológica fue útil; sin embargo, a nivel de especie solamente se logró identificar el morfotipo MICUNMS33 como G. microagregatum. La caracterización por RAPDs con la serie OPA de cebadores (Figura 3) permitió encontrar un patrón de bandas con el cebador OPA2; mientras que los polimorfismos encontrados con OPA8, OPA11 y OPA13 no permitieron diferenciarlos. Esta misma serie fue empleada por Wiss y Bonfante (1993) quienes informaron sobre polimorfismo entre aislados de Glomus mosseae de dos regiones geográficas con OPA9; lo que indica la utilidad de esta serie en la caracterización de hongos HMA; a diferencia de la serie M que no mostró amplificación clara ni aún cuando se variaron las condiciones de corrido.
El análisis mediante el índice de Nei y Li entre los morfotipos de HMA evaluados, proporcionó porcentajes de similitud entre el 38-49%; Wiss y Bonfante (1993) encontraron similitud entre el 46-64% para aislados de G. mosseae; otros autores describen índices de similitud mayor al 95% para morfotipos del género Glomus mediante el empleo de técnicas moleculares más específicas (Calvente et al., 2004). Estos resultados moleculares y morfológicos, permitieron ubicar los cuatro morfotipos en el género Glomus pero posiblemente pertenecen a especies diferentes. El dendograma mostrado en la Figura 4A, sugiere cuatro poblaciones diferentes y el agrupamiento por UPGMA reveló que todos los cebadores muestran similitud mayor al 38% entre los morfotipos estudiados (Figura 4); se recomienda hacer estudios moleculares posteriores con el empleo de técnicas más específicas para la diferenciación entre especies. Los resultados obtenidos son promisorios en la diferenciación de cepas nativas con bajo número de esporas colectadas a partir de muestras de suelos en proceso de rehabilitación, de los cuales no se conoce la composición de HMA, lo cual los convierte en una herramienta útil en la sostenibilidad de suelos, como también lo comentan otros autores (Jeffries y Barea, 2001).
CONCLUSIONES
Las pocas esporas de HMA obtenidas de suelos disturbados y no disturbados por minería de aluvión en el Bajo Cauca Antioqueño mostraron baja capacidad infectiva. Mediante el empleo de diferentes fracciones de suelo de tamaño similar al de esporas de HMA, se logró multiplicar en condiciones asépticas morfotipos de suelos disturbados.
El uso de inóculo contenidos en las fracciones gruesas de la terraza alta no disturbada y del suelo disturbado pardo produjeron la mayor colonización de HMA en maíz y en kudzú. Así como la esporulación extra e intra radical del kudzú, la fracción gruesa de los suelos disturbado pardo y terraza alta no disturbada favorecieron el rendimiento en kudzú.
El morfotipo de mayor frecuencia en los suelos pardos, sobre todo en la fracción gruesa, se identificó como Glomus microagregatun.
Los morfotipos de HMA mostraron baja diversidad cuando se analizaron por RAPDs y sólo el cebador OPA2 diferencia los cuatro morfotipos estudiados.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos a los profesores Edna Márquez Fernández y Álvaro Lema Tapias y a las entidades COLCIENCIAS y CIB (Corporación de Investigaciones Biológicas).
BIBLIOGRAFÍA
Anderson, I.C., J.W. Cairney. 2007. Ectomycorrhizal fungi: exploring the mycelial frontier. FEMS Microbiol. Review. 31: 388-406.
Arango, R. 1996. Métodos y sustratos de propagación de balso (Ochroma lagopus) y quiebrabarrigo (Trichanthera gigantea) para la rehabilitación de suelos degradados por minería de aluvión. Trabajo de grado. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 94 p.
Bentivenga, S.T., J.D. Bever and J.B. Morton. 1997. Genetic variation of morphological characters within a single isolates of the endomycorrhizal fungus Glomus clarum (Glomaceae). American Journal of Botany 84(9): 1211-1216.
Calvente, R., C. Cano, N. Ferrol, C. Azcón-Aguilar and J.M. Barea. 2004. Analyzing natural diversity of arbuscular mycorrhizal fungi in olive tree (Olea europaea L.) plantations and assessment of the effectiveness of native fungal isolates as inoculants for commercial cultivars of olive plantlets. Applied Soil Ecology 26(1): 11-19.
Corporación Autónoma Regional del Centro de Antioquia (CORANTIOQUIA). 2002. Rehabilitación de zonas mineras en la región de Bajo Cauca Antioqueño. En: http://www.gobant.gov.co/organismos/smedioamb/codeam/forobajocauca/Cor_areasdegradadaspormineria.ppt. 28 p.; consulta: junio 2007.
Enkhtuya, B., J. Rydlová and M. Vosátka. 2000. Effectiveness of indigenous and non-indigenous isolates of arbuscular mycorrhizal fungi in soils from degraded ecosystems and man-made habitats. Applied Soil Ecology 14(3): 201-211.
Gadkar, V. and M. Rillig. 2005. Application of Phi29 DNA polymerase mediated whole genome amplification on single spores of arbuscular mycorrhizal (AM) fungi. FEMS Microbiology Letters 242(1): 65-71.
Instituto Colombiano Agropecuario (ICA). 1992. Fertilización en diversos cultivos. Quinta aproximación. Produmendios, Santafé de Bogotá. 64 p.
Instituto Geográfico Agustín Codazzi (IGAC). 1990. Antioquia: Características geográficas. IGAG, Bogotá. 184 p.
Jastrow, J.D., R.M. Miller and J. Lussenhop. 1998. Contributions of interacting biological mechanisms to soil aggregate stabilization in restored prairie. Soil Biology and Biochemistry 30(7): 905-916.
Jeffries, P. and J.M. Barea. 2001. Arbuscular mycorrhiza a key component of sustainable plant soil ecosystems. pp. 95-113. In: Hock, B. (ed.). The Mycota IX Fungal Associations. Springer, Berlin.
Leake, J., N. Ostle, J. Rangel and D. Johnson. 2006. Carbon fluxes from plants through soil organisms determined by field 13CO2 pulse-labelling in an upland grassland. Applied Soil Ecology 33(2): 152-175.
Lee, P.J. and R.E. Koske. 1994. Gigaspora gigantea: Parasitism of spores by fungi and actinomycetes. Mycological Research 98(4): 458-466.
López, P. 2002. Programa de desarrollo sostenible de la región de la Mojana, Colombia. Informe Final de Consultoría. Organización de las Naciones Unidad para la Agricultura y la Alimentación (FAO) y Departamento Nacional de Planeación, República de Colombia, Bogotá. En: http://gobersucre.gov.co/Informe%20Final%20Programa%20Mojana.pdf. 62 p.; consulta: junio 2007.
Martínez, J.E. y Montenegro J.E. 1990. Reconocimiento y cuantificación de hongos micorrizógenos vesículo-arbuscular (MVA) en suelos y especies florísticas de un bosque poco intervenido, en la región del Caguán, Departamento del Caquetá. Trabajo de grado Biología. Facultad de Ciencias. Universidad Nacional de Colombia. Bogotá. 102 p.
McGonigle, T. and M. Miller. 2000. The inconsistent effect of soil disturbance on colonization of roots by arbuscular mycorrhizal fungi: a test of the inoculum density hypothesis. Applied Soil Ecology 14(2): 147-155.
Millner, P.D. and D.G. Kitt. 1992. The Beltsville method for soilless production of vesicular-arbuscular mycorrhizal fungi. Mycorrhiza 2: 9-15.
Nei, M. and W.H. Li. 1979. Mathematical model for study genetic variation in terms of restriction endonucleases. USA: Proceedings of the National Academy of Sciences76 (10): 5269-5273.
Orozco, F.H. y F.E. Gómez. 1994. "Recuperación" biológica de suelos. Suelos Ecuatoriales 7(1): 48-59.
Orozco, F.H. y E. Gómez. 1999. Estudios básicos para un manejo biótico de suelos. Universidad Nacional-Colciencias-BID, Medellín. 150 p.
Orozco, F.H. 1978. Alteration des mineraux dans la rhizosphere du mais. Centre de pedologie biologique. Universite Nancy I, Francia. 21 p.
Phillips, J.M. and D.S. Hayman. 1970. Improved procedures for cleaning roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. pp. 158-161. En: Schenck, N.C. and Y. Pérez. 1990.Transactions of the British Mycological Society. Manual for the identification of VA mycorrhizal fungi. Vol. 55. Third edition. Synergistic Publications, Gainesville. 286 p.
Sieverding, E. 1991. Vesicular-arbuscular mycorrhiza management in tropical agrosystems. Germany: Technical Cooperation. Federal Republic of Germany. 371 p.
Smith, S.E., S. Dickson and F.A. Smith. 2001. Nutrient transfer in arbuscular mycorrhizas: how are fungal and plant process integrated?. Australian Journal Plant Physiology 28(7): 683-694.
Smith, S.E., D.J. Read and J.L. Harley. 1997. Mycorrhizal symbiosis. Second edition. Academic Press, Cambridge. 605 p.
Tian, H., J.P. Gai, J.L. Zhang, P. Christie, and X.L. Li. 2009. Arbuscular mycorrhizal fungi in degraded typical steppe of inner Mongolia. Land Degradation and Development 20(1): 41-54.
Uhlmann, E., C. Gorke, A. Petersen and F. Oberwinkler. 2006. Arbuscular mycorrhizae from arid parts of Namibia. Journal of Arid Environments 64(2): 221-237.
Walker, C., M. Vestberg, F. Demircik, H. Stockinger, M. Saito, H. Sawaki, I. Nishmura and A. Schubler. 2007. Molecular phylogeny and new taxa in the Archaeosporales (Glomeromycota): Ambispora fennica gen. sp. nov., Ambisporaceae fam. nov., and emendation of Archaeospora and Archaeosporaceae. Mycological Research 111(2): 137-153.
Weising, K., H. Nybom, K. Wolff and W. Meyer. 1995. DNA Fingerprinting in plants and fungi. pp. 51-56. CRC Press, Florida. 322 p.
Williams, J.G., A.R. Kubelik, J. Livak, J.A. Rafalski and S.V. Tingey. 1990. DNA polymorphisms amplified by arbitrary are useful as genetic markers. Nucleic Acids Research 18(22): 6531-6535.
Wyss, P. and P. Bonfante. 1993. Amplification of genomic DNA of arbuscular-mycorrhizal (AM) fungi by PCR using short arbitrary primers. Mycological Research 97(11): 1351-1357.
Yokoyama, K., T. Tateishi, T. Marumoto and M. Saito. 2002. A molecular marker diagnostic of a specific isolate of an arbuscular mycorrhizal fungus, Gigaspora margarita. FEMS Microbiology Letters 212(2): 171-175.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Copyright (c) 2015 Revista Facultad Nacional de Agronomía

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The journal allows the author(s) to maintain the exploitation rights (copyright) of their articles without restrictions. The author(s) accept the distribution of their articles on the web and in paper support (25 copies per issue) under open access at local, regional, and international levels. The full paper will be included and disseminated through the Portal of Journals and Institutional Repository of the Universidad Nacional de Colombia, and in all the specialized databases that the journal considers pertinent for its indexation, to provide visibility and positioning to the article. All articles must comply with Colombian and international legislation, related to copyright.
Author Commitments
The author(s) undertake to assign the rights of printing and reprinting of the material published to the journal Revista Facultad Nacional de Agronomía Medellín. Any quotation of the articles published in the journal should be made given the respective credits to the journal and its content. In case content duplication of the journal or its partial or total publication in another language, there must be written permission of the Director.
Content Responsibility
The Faculty of Agricultural Sciences and the journal are not necessarily responsible or in solidarity with the concepts issued in the published articles, whose responsibility will be entirely the author or the authors.






















