Micropropagación de caña de flecha (Gynerium sagitatum Aubl.).
Keywords:
Caña flecha, Gynerium sagitatum, Micropropagación, Enraizamiento, Aclimatación. (es)Downloads
MICROPROPAGACIÓN DE CAÑA FLECHA (Gynerium sagitatum Aubl.)
MICROPROPAGATION OF WILD CANE (Gynerium sagitatum Aubl.)
Isidro Elías Suárez Padrón1; Hermes Araméndiz Tatis2 y Iván Javier Pastrana Vargas3
1 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <isuarez@sinu.unicordoba.edu.co>
2 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <haramendiz@hotmail.com>
3 Ingeniero Agrónomo. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <ijpv0710@hotmail.com>
Recibido: Septiembre 29 de 2007; Aceptado: Septiembre 14 de 2009.
Resumen. Un protocolo para la multiplicación in vitro de Gynerium sagitatum, a partir de explantes con meristemos pre-existentes ha sido desarrollado. Utilizando un diseño completamente al azar (DCA) con 15 repeticiones por cada tratamiento, segmentos nodales de aproximadamente 2 cm de longitud con una yema axilar, fueron establecidos independientemente en tres medios de cultivo (1/2 MS, MS Completo y MS con 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP) para evaluar su adaptación in vitro. Posteriormente, los explantes establecidos fueron cultivados en MS con cinco niveles (0,0; 0,5; 1,0; 2,0 o 4,0 mg•L-1) de BAP y un tratamiento con 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP con el fin de evaluar su efecto sobre la multiplicación de brotes. Los brotes micropropagados se establecieron en un medio MS suplementado con seis niveles (0,0; 0,5; 1,0; 2,0; 3,0 o 4,0 mg•L-1 ANA) y un tratamiento con 100 mg•L-1 de carbón activado. Finalmente, brotes micropropagados, con y sin enraizamiento in vitro, fueron transferidos ex vitro para evaluar la adaptación final. Los datos mostraron que los mejores resultados para establecimiento y multiplicación de los brotes ocurrió en MS con 0,1mg•L-1 ANA + 0,3 mg•L-1 BAP, mientras que la presencia de ANA tuvo efectos significativos en el enraizamiento. No obstante, las plantas transplantadas a condiciones ex vitro tuvieron una adaptación del 100% independientemente de si fueron o no enraizadas in vitro.
Palabras claves: Caña flecha, Gynerium sagitatum, micropropagación, enraizamiento, aclimatación.
Abstract. A micropropagation protocol for Gynerium sagitatum has been developed. Using a complete randomized design (CRD) with 15 replicates per treatment, explants with an axilllary bud were independently established in three different media (MS, ½ M and MS with 0.1 mg•L-1 NAA + 0.3 mg•L-1 BAP) to evaluate in vitro establishment. Established shoots were cultured in five (0,0; 0,5; 1,0; 2,0 or 4,0 mg•L-1) BAP levels and a treatment consisting of MS with 0,1 mg•L-1 NAA + 0,3 mg•L-1 BAP. Proliferated shoots were independently transferred onto MS with six (0.0, 0.5, 1.0, 2.0, 3.0 o 4.0 mg L-1) NAA concentrations and a treatment with 100 mg•L-1 activated charcoal. Micropropagated shoots with or without roots were transferred ex vitro to evaluate survival rate. The results showed that MS with 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP induced the best establishment and the highest multiplication rate, while an exogenous NAA supply induced a significant increase in explant rooting. However, in vitro rooting is not necessary for ex vitro acclimatization since unrooted micropropagated shoots showed a complete survival to ex vitro conditions.
Key words: Brave cane, Gynerium sagitatum, micropropagation, rooting, acclimatization.
La caña flecha (Gynerium sagitatum Aubl.) es una especie vegetal originaria del continente Americano, donde sus plantas crecen en territorios comprendidos desde México hasta Paraguay e incluso en las islas del Caribe con excepción de las Bahamas (Howard, 1979). La especie perteneciente a la familia Poaceae, produce hojas que forman la apariencia de un abanico cerca del ápice del tallo, las láminas foliares que se desprenden de la vaina son linear lanceoladas de 2 a 3 m de longitud con márgenes serrulados y filosos. La planta crece hasta alcanzar 5 a 6 m de altura, los tallos, de 2–4 cm de diámetro, se originan en rizomas localizados debajo de la superficie del suelo, el sistema radical esta compuesto por raíces flexibles, con poca resistencia y por su hábito de crecimiento actúan como protectoras de las riberas de los ríos y pantanos, y como refugio de varias especies animales (Pohl, 1983).
La caña flecha es un elemento que ha estado asociado desde tiempos antiguos con las culturas indígenas Zenúes de las sábanas de la Costa Norte Colombiana. Las nervaduras centrales constituyen la materia prima para la elaboración de mas de 30 clases de artesanía entre las que se incluye el sombrero vueltiao, símbolo representativo de la cultura colombiana; igualmente, el tallo aéreo se emplea en la construcción de viviendas de bahareque y elaboración de instrumentos musicales como la guacharaca, la espiga es convertida en un objeto ornamental al ser teñida de diferentes colores, y de su ráquis central los indígenas construyen flechas que son utilizadas para la caza y la pesca (SNE, 2004).
La propagación natural ocurre principalmente de forma vegetativa a partir de brotes emergentes de los rizomas, mientras que la reproducción sexual es difícil debido a la poca o nula producción de semilla viable (Francis, 1983). Como resultado de la sobre explotación para la elaboración de artesanías, el uso del tallo en construcciones y la expansión de la frontera agropecuaria, las áreas silvestres de caña flecha han sufrido severas reducciones, lo cual está ocasionando problemas de erosión en las riberas de los cuerpos de agua y un incremento en el costo de la fibra para la elaboración de las artesanías (González, 1997; Araméndiz et al., 2005; Croat, 1978). La propagación a partir de estacas suplementadas con reguladores de crecimiento ha sido implementada. Sin embargo, su aplicación en la producción de grandes cantidades de plantas puede ser limitada (Hernández et al., 2005) La micropropagación ha sido utilizada en el pasado para propagar masivamente plantas de especies del tipo bambú (Subramanlam, 1994; Gielis et al., 2002; Sanjaya y Ravishankar, 2005; Das y Pal, 2005; Marulanda et al., 2005), mientras que los desarrollos de protocolos para la producción masiva de plantas de Gynerium sagittatum in vitro no han sido encontrados. El presente trabajo tuvo como objetivo desarrollar un protocolo para micropropagación de plantas de caña flecha, a partir de explantes con meristemos pre-existentes, con el fin de permitir la producción clonal masiva de material para siembra.
MATERIALES Y MÉTODOS
Material vegetal. Segmentos nodales de aproximadamente 5 cm de longitud fueron aislados a partir de brotes basales (hijuelos) desarrollados de plantas adultas establecidas en la colección de plantas de caña flecha de la Granja Experimental de la Facultad de Ciencias Agrícolas de la Universidad de Córdoba. Las hojas y las vainas fueron removidas y los segmentos nodales colocados en remojo con agua potable por un período de 30 min. Posteriormente, porciones de aproximadamente 2,5 cm de longitud conteniendo una yema axilar fueron seccionadas y desinfectadas superficialmente en una solución al 1,25% de hipoclorito de sodio mezclado con 5 ml•L-1 de Tween 20® por un período de 20 min. Transcurrido el tiempo de desinfección superficial, los explantes fueron enjuagados con tres cambios de agua destilada estéril en condiciones asépticas en el interior de una cámara de flujo laminar y los extremos blandos de los explantes por el efecto de la solución desinfectante, fueron removidos con la ayuda de un bisturí estéril.
Establecimiento in vitro. Explantes de aproximadamente 2 cm de longitud con una yema axilar fueron establecidos en medios de cultivos semi sólido. Tres tratamientos basados en el medio Murashige y Skoog (1962) así: MS completo (MS), MS diluido a la mitad (1/2 MS) y MS suplementado con 0,1 mg•L-1 ANA + 0,3 mg•L-1 de benzilaminopurina (BAP) (MSAB) fueron evaluados para determinar su efecto sobre el establecimiento de los explantes en condiciones in vitro. Los tratamientos fueron distribuidos utilizando un diseño completamente al azar (DCA) con 60 repeticiones (cada repetición consistió de un explante en un frasco) por cada tratamiento. Al final de la cuarta semana se evaluó el número de explantes que sobrevivieron y se calculó el porcentaje de supervivencia, el número de explantes que desarrollaron órganos (yemas y raíces), la longitud de los nuevos brotes caulinares producidos y el porcentaje de fenolización.
Multiplicación del propágulo. Con el fin de determinar el mejor tratamiento para la proliferación de yemas axilares a partir de los explantes en condiciones in vitro, los tallos establecidos en la etapa anterior, fueron transferidos a un medio de cultivo MS semisólido suplementado independientemente con cuatro concentraciones (0,5; 1,0; 2,0 o 4,0 mg•L-1) de BAP, un tratamiento control absoluto (sin suplemento de BAP) y un tratamiento consistente de la formulación seleccionada como medio de cultivo de establecimiento con base en los resultados obtenidos en el estado anterior, para un total de seis tratamientos. Los tratamientos fueron distribuidos con un DCA con 15 repeticiones por cada tratamiento. Al final de la cuarta semana, para cada tratamiento se registró el número de nuevos tallos producidos por cada explante y el tamaño promedio de los nuevos tallos originados.
Enraizamiento in vitro. Con el fin de determinar las mejores condiciones para la producción de raíces adventicias en condiciones in vitro, se evaluó el efecto de siete tratamientos consistentes de un control absoluto, un tratamiento con un suplemento de 100 mg•L-1 de carbón activado y cinco tratamientos suplementados independientemente con diferentes concentraciones (0,5; 1,0; 2,0; 3,0 ó 4,0 mg•L-1) de ácido naftalenacético (ANA). Cada experimento fue repetido 15 veces y las repeticiones distribuidas con un DCA. Después de cuatro semanas de cultivo, se registró el número de explantes que produjeron raíces, se calculó el porcentaje de enraizamiento por cada tratamiento, el número promedio de raíces producidas por cada explante y la longitud promedio de las raíces producidas en cada uno de los tratamientos evaluados.
Adaptación ex vitro. Con el fin de determinar el efecto de la necesidad del enraizamiento in vitro para la recuperación y adaptación de las plantas micropropagadas de caña flecha a condiciones normales ex vitro, se tomaron plantas enraizadas con 0,5 mg•L-1 de ANA y se transplantaron en un sustrato de propagación compuesto por una mezcla estéril de arena, arcilla y cascarilla de arroz en una proporción en volumen 1:1:1, contenidas en bandejas con 24 alvéolos, en cada uno de los cuales se estableció un explante con aproximadamente 3-4 tallos enraizados por cada alvéolo. De forma alterna, explantes con igual número de tallos micropropagados, tomados directamente del estado de multiplicación de propágulo, fueron transplantados ex vitro en condiciones similares a los tallos enraizados. Todos los propágulos transplantados, un total de 140 por cada tratamiento, fueron colocados dentro de un umbráculo cubierto con una polisombra del 70% de cobertura y una frecuencia de riego por aspersión de 30 seg cada 12 min. Al final de la primera semana todas las plantas fueron trasladadas dentro del mismo umbráculo a un sitio con una cobertura del 50% y una frecuencia de riego de 12 segundos cada hora, y al final de la cuarta semana las plantas fueron colocadas definitivamente bajo una cubierta con 70% de luminosidad y cuatro riegos diarios de 30 seg cada uno. Al final de la octava semana, se registró el número de plantas que sobrevivieron.
Aspectos metodológicos. Todos los medios de cultivo fueron suplementados con (en mg•L-1) myo inositol (100), sacarosa (30.000), tiamina HCl (0,4) y TC agar (8.000) (Sigma Co®.). El pH fue ajustado a un valor de 5,7 – 5,8 con KOH o HCl previo a la adición de agar; posteriormente, el agar fue diluido a 100 °C y, en cada recipiente con capacidad de 125 cc, vertido en porciones de 30 ml de medio formulado de acuerdo con los requerimientos de cada experimento. Los frascos fueron cubiertos con una doble capa de papel aluminio y esterilizados en una autoclave a una temperatura de 121 °C y una presión de 1,1 kg•cm-2 por un período de 15 min. Los cultivos fueron sellados con una capa de Parafilm® y mantenidos a una temperatura de 25 ºC con una intensidad lumínica de 40 µ mol•m-2•s-1 por un período de 12 horas diarias suministradas con lámparas de luz fría fluorescente. Los experimentos de multiplicación y enraizamiento fueron analizados con un análisis de varianza con base en el modelo estadístico Yj = µ + i + ei; donde µ fue el promedio general, i correspondió al efecto del tratamiento para inducir la multiplicación caulinar o el efecto del tratamiento de enraizamiento y e correspondió al efecto del error experimental. Una vez realizado el análisis de varianza, los promedios de los tratamientos fueron separados mediante la prueba de Tukey con α = 0,05.
RESULTADOS
Establecimiento y multiplicación in vitro. Aproximadamente dos semanas después del establecimiento, se observaron los primeros órganos desarrollados a partir de los explantes establecidos (Figura 1).

Figura 1. Crecimiento de nuevos tallos a partir de yemas axilares presentes en un explante de caña flecha (Gynerium sagitatum Aubl.) establecido en condiciones in vitro.
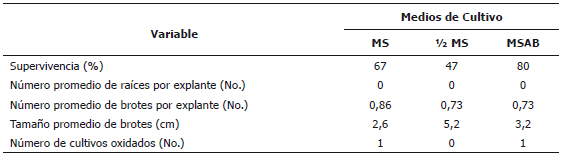
La Tabla 1 muestra que el mayor número de explantes sobrevivientes se obtuvo cuando éstos fueron establecidos en el medio MSAB seguidos por aquellos cultivados en el medio ½ MS, mientras que el menor porcentaje de sobrevivencia fue observado cuando los explantes se cultivaron en medio MS. El desarrollo de nuevos órganos fue muy limitado en todos los tratamientos y los índices de oxidación del medio reducidos.
Tabla 1. Establecimiento de explantes de caña flecha (Gynerium sagitatum Aubl.) en diferentes formulaciones de medios de cultivo.
La proliferación de nuevos tallos, ocurrió a partir de las yemas axilares presentes en la base del explante formando crecimientos de nuevos tallos que se desarrollaron a partir del explante original como se puede apreciar en la Figura 2.

Figura 2. Proliferación de nuevos tallos a partir de yemas axilares de caña flecha (Gynerium sagitatum Aubl.).
El análisis de varianza permitió detectar diferencias significativas (P<0,0001) como resultado del efecto de los diferentes tratamientos aplicados para inducir la proliferación de nuevos brotes a partir de yemas axilares. El mayor número de nuevos tallos axilares se produjo cuando los explantes fueron cultivados en presencia de un suplemento de 0,1 mg•L-1 ANA + 0,3 mg•L-1 de ANA, mientras que la menor tasa de multiplicación se registró cuando los explantes fueron cultivados en presencia del tratamiento con la concentración mas alta de BAP (4,0 mg•L-1) (Figura 3). La misma Figura muestra que la mayor longitud promedio de los nuevos brotes producidos ocurrió cuando los explantes establecidos fueron cultivados en presencia del tratamiento control absoluto; sin embargo, éstos no alcanzaron una longitud significativamente mayor, a la de los producidos en el tratamiento con 0,1 mg•L-1 ANA + 0,3 mg•L-1 de ANA. Igualmente, se observó que en la medida que aumentó la cantidad de BAP en el medio de cultivo se redujo el tamaño de los nuevos tallos producidos.

Figura 3. Promedios y errores estándares del número de nuevos tallos producidos y la longitud de los mismos, como efecto de diferentes tratamientos (1=control; 2=0,5 mg•L-1 BAP, 3=1,0 mg•L-1 BAP, 4=2,0 mg•L-1 BAP, 5=4,0 mg•L-1 BAP y 6=0,1 mg•L-1 ANA) aplicados en el estado II (Multiplicación) de la micropropagación de caña flecha (Gynerium sagitatum Aubl.). Los promedios con las mismas letras no son diferentes de acuerdo con la prueba de separación de medias de Tukey (0,05).
Enraizamiento in vitro. La formación de raíces adventicias ocurrió en la base de los clústeres de tallos transferidos del medio de multiplicación a los medios con los tratamientos de enraizamiento, apreciándose enraizamiento en todos los tratamientos evaluados, es decir el porcentaje de enraizamiento fue del 100% para todas las evaluaciones; no obstante, los resultados del ANAVA permitieron concluir que se presentaron diferencias significativas con respecto al efecto de los diferentes tratamientos sobre las variables número de raíces producidas por explante (P< 0,0001) y tamaño promedio de raíces producidas en cada tratamiento (P< 0,0001). La prueba de separación de medias de Tukey (Figura 4) muestra que el mayor número de raíces por explante ocurrió cuando los clústeres fueron cultivados en el tratamiento suplementado con 21,48 µM de ANA, mientras que el menor número de raíces adventicias se formaron en los explantes cultivados en el tratamiento del control absoluto.

Figura 4. Promedios y errores estándares del efecto de diferentes tratamientos (1=Control absoluto, 2=100 mg•L-1 carbón activado, 3=0,5 mg•L-1 ANA; 4= 1,0 mg•L-1 ANA; 5=2,0 mg•L-1 ANA, 6=3,0 mg•L-1 ANA y 7=7,0 mg•L-1 ANA) sobre el enraizamiento in vitro de tallos micropropagados de caña flecha (Gynerium sagitatum Aubl.) en condiciones in vitro. Promedios con la misma letra no son diferentes estadísticamente de acuerdo con la prueba de separación de medias de Tukey (0,05).
El mayor tamaño de raíces ocurrió cuando los tallos micropropagados fueron cultivados en el medio suplementado con 100 mg•L-1 de carbón activado, seguido por el tratamiento sin ningún tipo de suplemento para inducir el enraizamiento (control absoluto) (Figura 5).

Figura 5. Promedio y errores estándares del efecto de diferentes tratamientos (1=Control absoluto; 2=100 mg•L-1 carbón activado; 3=0,5 mg•L-1 ANA; 4= 1,0 mg•L-1 ANA; 5=2,0 mg•L-1 ANA; 6=3,0 mg•L-1 ANA y 7=7,0 mg•L-1 ANA) sobre la longitud de las raíces producidas por tallos micropropagados de caña flecha (Gynerium sagitatum Aubl.) en condiciones in vitro. Promedios con la misma letra no son diferentes estadísticamente de acuerdo con la prueba de separación de medias de Tukey (0,05).
Transferencia a condiciones ex vitro. Los brotes transplantados con un enraizamiento previo en condiciones in vitro y aquellos transplantados directamente del estado de multiplicación (sin enraizar), sobrevivieron en un 100% a la etapa de aclimatización. Es decir, bajo las condiciones específicas en las cuales se desarrolló la adaptación a condiciones ex vitro en el presente trabajo, el enraizamiento en condiciones in vitro no fue necesario para alcanzar una recuperación completa de plantas micropropagadas de caña flecha en condiciones ex vitro (Figura 6).

Figura 6. Plantas micropropagadas de caña flecha (Gynerium sagitatum Aubl.) después de tres meses de ser transplantadas a condiciones ex vitro.
DISCUSIÓN
La producción masiva de plantas de especies del tipo bambú ha sido uno de los grandes retos para los métodos tradicionales de propagación de plantas, y probablemente la limitante mas poderosa para un mayor aprovechamiento y desarrollo comercial del cultivo de estas especies, siendo la micropropagación la mejor herramienta cuando se requiere de la producción masiva de este tipo de plantas (Banik, 1994; Subramanlam, 1994; Banik, 1995; Gielis, 1999).
Con el objetivo de utilizar la micropropagación en la producción clonal masiva de plantas de Gynerium sagitatum Aubl., se evaluó experimentalmente el efecto de diferentes tratamientos en las etapas de establecimiento in vitro, multiplicación, enraizamiento y recuperación de plantas micropropagadas. Los resultados obtenidos permitieron observar que el medio MS suplementado con una combinación de ácido naftalenacético (ANA) y benzilaminopurina (BAP), proporcionó las mejores condiciones para el establecimiento in vitro, y condujo a obtener la mayor tasa de multiplicación por explante, estimándose la posibilidad de alcanzar una producción superior a 10 x 106 nuevas plantas al año, partiendo de un sólo explante. El suplemento combinado de auxinas y citocininas ha sido utilizado previamente en la multiplicación in vitro en especies del tipo bambú. Beltrán y Sehuanes (2004) alcanzaron la mayor tasa de multiplicación en un cultivar no determinado de caña flecha con un suplemento de 2,0 a 4,0 mg•L-1 de BAP combinado con suministros de ANA correspondientes a un cuarto de la concentración de BAP. Kalia et al. (2004) obtuvieron una tasa de 10,3 nuevos brotes cuando explantes con meristemos pre-existentes de Bambusa nutans fueron cultivados en un medio semisólido suplementado con 1,1 mg•L-1 de BAP y 0,25 mg•L-1 de ANA. Sanjaya y Ravishankar (2005) lograron tasas de hasta 125 nuevos brotes por explante cada 50 días al cultivar segmentos nodales de Pseudoxytenanthera stocksii con al menos una yema axilar en un medio de cultivo líquido de MS suplementado con 1,0 mg•L-1 de ANA y 1,0 mg•L-1 de BAP. Kapoor y Rao (2006) utilizaron 0,55 a 1,1 mg•L-1 de BAP combinados con 10 mg•L-1 de ANA y 0,1 mg•L-1 de ácido giberélico (GA3) en la inducción de rizomas in vitro que luego desarrollaron brotes. Otras especies pertenecientes a familias diferentes a la gramineae han sido igualmente multiplicadas in vitro utilizando dosis combinadas de auxinas y citocininas. Pruski et al. (2005) lograron las mejores tasas de multiplicación en dos especies del género Prunus (P. fruticosa L. y P. tormentosa L.) cuando fueron multiplicadas en un medio MS orgánico con 0,1 mg•L-1 de ácido indolbutírico (AIB) combinado con 2,0 ó 4,0 mg•L-1 de BAP.
Los resultados obtenidos en el estado de enraizamiento indican que Gynerium sagitatum es una especie que responde favorablemente a las aplicaciones de auxinas en condiciones in vitro. Resultados similares han sido observados en plantas del tipo bambú y otras especies. Jiménez et al. (2006) observaron un enraizamiento completo (100%) en brotes axilares de Guadua angustifolia en un medio sin suministro de auxinas. Ndiaye et al. (2006) encontraron un enraizamiento máximo de 45,83% de brotes de Bambusa vulgaris cuando fueron cultivados con dosis iguales o mayores a 20 mg•L-1 de AIB. Saxena y Dhawan (1994) observaron el enraizamiento de tallos provenientes de embriones somáticos de Dendrocalamus strictus al ser cultivados en un medio MS suplementado con 0,3 mg•L-1 de ANA y 0,25 mg•L-1 de IBA. Das y Pal (2005) indujeron el enraizamiento de brotes de Bambusa balcooa en un medio de cultivo MS suplementado con 0,25 mg•L-1 de AIB. Sanjaya y Ravishankar (2005) registraron enraizamiento de tallos de Pseudoxytenanthera stocksii en medio de cultivo ½ MS líquido con 1,0 mg L-1 de AIB. Similarmente, Kalia et al. (2004) avistaron la producción de raíces adventicias en tallos micropropagados de Bambusa nutans cultivados en un medio con 0,25 mg•L-1 de ANA y 1,2 mg•L-1 de BAP. De forma alterna, el enraizamiento espontáneo sin necesidad de aplicar auxinas en el medio de cultivo ha sido evidente en otras especies; Ran y Simpson (2005) lograron la inducción y crecimiento de raíces a partir de tallos micropropagados de plantas de Clivia sp. en un medio MS suplementado con carbón activado.
La evaluación realizada en el presente estudio permitió observar que la ausencia de enraizamiento in vitro no fue un impedimento para adaptar las plantas micropropagadas a las condiciones ambientales ex vitro. Esta condición puede convertirse en una ventaja adicional ya que aumenta la eficiencia del proceso general de micropropagación al reducir el tiempo de producción de nuevas plantas y ahorrar significativamente en recursos de mano de obra, insumos y riesgos de contaminación por la manipulación inherente al estado de enraizamiento. La transferencia inmediata de propágulos multiplicados directamente al estado de aclimatación, sin un enraizamiento previo, ha sido lograda en varios protocolos de micropropagación de ciertas especies; Lara et al. (2003) consiguieron una recuperación de 80% de plantas de Psycotria acuminata después de transferir los tallos multiplicados directamente a condiciones ex vitro sin enraizamiento previo.
CONCLUSIONES
- Los explantes de Gynerium sagittatum lograron los mejores niveles de adaptación a las condiciones in vitro y la mayor tasa de multiplicación cuando fueron cultivados en un medio de cultivo semisólido de MS suplementado con ANA y BAP.
- Los mejores resultados en producción y crecimiento de raíces a partir de los brotes micropropagados, ocurrió en presencia de ANA; sin embargo, el suplemento de este regulador fue suficiente pero no necesario para producir el enraizamiento.
- El enraizamiento in vitro no es un evento necesario para lograr una adecuada adaptación de las plantas micropropagadas a condiciones ex vitro reduciendo en un período mínimo de cuatro semanas, el ciclo de producción de plantas y disminuyendo los costos de operación.
- Los datos colectados permiten estimar que siguiendo la metodología desarrollada se pueden alcanzar producciones superiores a 10 x 106 nuevas plantas de Gynerium sagittatum, partiendo de un sólo explante original.
BIBLIOGRAFÍA
Araméndiz, H., M. Espitia y J. Robles. 2005. Colección, conservación, caracterización morfoagronómica y producción de semilla de caña flecha (Gynerium sagitatum Aubl.) del Caribe Colombiano. CIUC. Universidad de Córdoba, Montería. 118 p.
Banik, R.L. 1994. Review of conventional propagation research in bamboos and future strategy. INBAR 5:115-142
Banik, R.L. 1995. Selection criteria and population enhancement of priority bamboos, INBAR 7: 99-110
Beltrán, J. y I. Barrios. 2004. Micropropagación in vitro de la caña flecha (Gynerium sagittatum) (Aubl) Beauv. c.v. “Criolla” mediante el uso de segmentos nodales. Memorias XXXIX Congreso de la Asociación Colombiana de Ciencias Biológicas, Ibagué.
Croat, T.B. 1978. Flora of Barro Colorado Island. Stanford University Press, Stanford. 943 p.
Das, M. and A. Pal. 2005. In vitro regeneration of Bambusa balcooa Roxb.: Factors affecting changes of morphogenic competence in the axillary buds. Plant Cell, Tissue and Organ Culture 81(1): 109-112.
Francis, J. 1983. Gynerium sagittatum Aubl. Poaceae. En: Jardin Botánico Sur, International Institute of Tropical Forestry, USDA, Rio Piedras (PR). http://www.fs.fed.us/global/iitf/pdf/shrubs/Gynerium%20sagittatum.pdf. 2 p.; consulta: enero 2006.
Gielis, J., H. Peeters, K. Gillis and P. Debergh. 2002. Tissue culture strategies for genetic improvement of bamboo. Acta Horticulturae 552:195-203
Gielis, J. 1999. Micropropagation and in vitro flowering of temperate and tropical woody bamboos. pp. 13-38. In: Ryachaudhuri, S. and K. Maramorosch (Eds.). Biotechnology and plant protection in forestry science. Science Publisher, NY.
González, O. 1997. Situación de dos métodos de siembra por estacas de caña flecha (Gynerium sagittatum Aubl.) de la variedad Martinera en la región de Montelibano, Córdoba. Trabajo de Grado Ingeniería Agronómica. Facultad de Ciencias Agrícolas Universidad de Córdoba. Montería. 74 p.
Hernández, J., H. Araméndiz y C. Cardona. 2005. Influencia del ácido indolbutírico sobre el enraizamiento de esquejes de caña flecha (Gynerium sagittatum Aubl.). Revista Temas Agrarios 10(1): 5-13
Howard, R.A. 1979. Flora of the Lesser Antilles; Leeward and Windward Islands. Harvard University, Boston. 586 p.
Jiménez, V.M., J. Castillo, E. Tavares, E. Guevara and M. Montiel. 2006. In vitro propagation of the neotropical giant bamboo, Guadua angustifolia Kunth, through axillary shoot proliferation. Plant Cell, Tissue and Organ Culture 86(3): 389-395.
Kalia, S., R. Kalia and S. Sharma. 2004. In vitro regeneration of and indigenous bamboo (Bambusa nutans) from internode and leaf explant. Journal of bamboo and rattan 3(3): 217-228.
Kapoor, P. and U. Rao. 2006. In vitro rhizome induction and plantlet formation from multiple shoots in Bambusa bamboos var. gigantea Bennet and Gaur by using growth regulators and sucrose. Plant Cell, Tissue and Organ Culture 85(2): 211-217.
Lara, A., R. Valverde, L. Gómez y N. Hidalgo. 2003. Micropropagación de la planta medicinal Psycotria acuminata. Agronomía Costarricense 27(2): 7-20.
Marulanda, M., L. Gutierrez y M.P. Marquez. 2005. Micropropagación de Guadua angustifolia Kunth. Actualidades Biológicas 27(82): 5-15.
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15(43): 473-497
Ndiaye, A., M.S. Diallo, D. Niang and Y.K. Gassama-Dia. 2006. In vitro regeneration of adult trees of Bambusa vulgaris. African Journal of Biotechnology 5(13): 1245-1248.
Pohl, R. 1983. Gynerium sagittatum (Caña brava, cane). pp. 248-249. In: Janzen, D. (Ed.) Costa Rican Natural History. University of Chicago Press, Chicago. 816 p.
Pruski, K., T. Astatkie and J. Nowak. 2005. Tissue culture propagation of Mongolian cherry (Prunus fruticosa) and Nankin cherry (Prunus tormentosa). Plant Cell, Tissue and Organ Culture 82(2): 207-211.
Ran, Y. and S. Simpson. 2005. In vitro propagation of the genus Clivia. Plant Cell, Tissue and Organ Culture 81(2): 239-242.
Sanjaya, R.T. and R. Ravishankar. 2005. Micropropagation of Pseudoxytenanthera stocksii Munro. In vitro Cellular and Developmental Biology Plant 41(3): 333-337.
Saxena, S. and V. Dhawan. 1994. Micropropagation research in south Asia. Constraints to production of bamboo and rattan. INBAR 5: 101-113.
SNE-Servicio de Noticias del Estado-. 2004. El sombrero vueltiao ahora es símbolo cultural de la Nación. En: Casa de Nariño, Presidencia de la República, http://www.presidencia.gov.co/sne/2004/septiembre/10/02102004.htm; consulta: Abril 2006.
Subramanlam, K. 1994. Bamboos–Demand and supply of planting stocks. INBAR 5:24-25
MICROPROPAGACIÓN DE CAÑA FLECHA (Gynerium sagitatum Aubl.)
MICROPROPAGATION OF WILD CANE (Gynerium sagitatum Aubl.)
Isidro Elías Suárez Padrón1; Hermes Araméndiz Tatis2 y Iván Javier Pastrana Vargas3
1 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <isuarez@sinu.unicordoba.edu.co>
2 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <haramendiz@hotmail.com>
3 Ingeniero Agrónomo. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <ijpv0710@hotmail.com>
Recibido: Septiembre 29 de 2007; Aceptado: Septiembre 14 de 2009.
Resumen. Un protocolo para la multiplicación in vitro de Gynerium sagitatum, a partir de explantes con meristemos pre-existentes ha sido desarrollado. Utilizando un diseño completamente al azar (DCA) con 15 repeticiones por cada tratamiento, segmentos nodales de aproximadamente 2 cm de longitud con una yema axilar, fueron establecidos independientemente en tres medios de cultivo (1/2 MS, MS Completo y MS con 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP) para evaluar su adaptación in vitro. Posteriormente, los explantes establecidos fueron cultivados en MS con cinco niveles (0,0; 0,5; 1,0; 2,0 o 4,0 mg•L-1) de BAP y un tratamiento con 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP con el fin de evaluar su efecto sobre la multiplicación de brotes. Los brotes micropropagados se establecieron en un medio MS suplementado con seis niveles (0,0; 0,5; 1,0; 2,0; 3,0 o 4,0 mg•L-1 ANA) y un tratamiento con 100 mg•L-1 de carbón activado. Finalmente, brotes micropropagados, con y sin enraizamiento in vitro, fueron transferidos ex vitro para evaluar la adaptación final. Los datos mostraron que los mejores resultados para establecimiento y multiplicación de los brotes ocurrió en MS con 0,1mg•L-1 ANA + 0,3 mg•L-1 BAP, mientras que la presencia de ANA tuvo efectos significativos en el enraizamiento. No obstante, las plantas transplantadas a condiciones ex vitro tuvieron una adaptación del 100% independientemente de si fueron o no enraizadas in vitro.
Palabras claves: Caña flecha, Gynerium sagitatum, micropropagación, enraizamiento, aclimatación.
Abstract. A micropropagation protocol for Gynerium sagitatum has been developed. Using a complete randomized design (CRD) with 15 replicates per treatment, explants with an axilllary bud were independently established in three different media (MS, ½ M and MS with 0.1 mg•L-1 NAA + 0.3 mg•L-1 BAP) to evaluate in vitro establishment. Established shoots were cultured in five (0,0; 0,5; 1,0; 2,0 or 4,0 mg•L-1) BAP levels and a treatment consisting of MS with 0,1 mg•L-1 NAA + 0,3 mg•L-1 BAP. Proliferated shoots were independently transferred onto MS with six (0.0, 0.5, 1.0, 2.0, 3.0 o 4.0 mg L-1) NAA concentrations and a treatment with 100 mg•L-1 activated charcoal. Micropropagated shoots with or without roots were transferred ex vitro to evaluate survival rate. The results showed that MS with 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP induced the best establishment and the highest multiplication rate, while an exogenous NAA supply induced a significant increase in explant rooting. However, in vitro rooting is not necessary for ex vitro acclimatization since unrooted micropropagated shoots showed a complete survival to ex vitro conditions.
Key words: Brave cane, Gynerium sagitatum, micropropagation, rooting, acclimatization.
La caña flecha (Gynerium sagitatum Aubl.) es una especie vegetal originaria del continente Americano, donde sus plantas crecen en territorios comprendidos desde México hasta Paraguay e incluso en las islas del Caribe con excepción de las Bahamas (Howard, 1979). La especie perteneciente a la familia Poaceae, produce hojas que forman la apariencia de un abanico cerca del ápice del tallo, las láminas foliares que se desprenden de la vaina son linear lanceoladas de 2 a 3 m de longitud con márgenes serrulados y filosos. La planta crece hasta alcanzar 5 a 6 m de altura, los tallos, de 2–4 cm de diámetro, se originan en rizomas localizados debajo de la superficie del suelo, el sistema radical esta compuesto por raíces flexibles, con poca resistencia y por su hábito de crecimiento actúan como protectoras de las riberas de los ríos y pantanos, y como refugio de varias especies animales (Pohl, 1983).
La caña flecha es un elemento que ha estado asociado desde tiempos antiguos con las culturas indígenas Zenúes de las sábanas de la Costa Norte Colombiana. Las nervaduras centrales constituyen la materia prima para la elaboración de mas de 30 clases de artesanía entre las que se incluye el sombrero vueltiao, símbolo representativo de la cultura colombiana; igualmente, el tallo aéreo se emplea en la construcción de viviendas de bahareque y elaboración de instrumentos musicales como la guacharaca, la espiga es convertida en un objeto ornamental al ser teñida de diferentes colores, y de su ráquis central los indígenas construyen flechas que son utilizadas para la caza y la pesca (SNE, 2004).
La propagación natural ocurre principalmente de forma vegetativa a partir de brotes emergentes de los rizomas, mientras que la reproducción sexual es difícil debido a la poca o nula producción de semilla viable (Francis, 1983). Como resultado de la sobre explotación para la elaboración de artesanías, el uso del tallo en construcciones y la expansión de la frontera agropecuaria, las áreas silvestres de caña flecha han sufrido severas reducciones, lo cual está ocasionando problemas de erosión en las riberas de los cuerpos de agua y un incremento en el costo de la fibra para la elaboración de las artesanías (González, 1997; Araméndiz et al., 2005; Croat, 1978). La propagación a partir de estacas suplementadas con reguladores de crecimiento ha sido implementada. Sin embargo, su aplicación en la producción de grandes cantidades de plantas puede ser limitada (Hernández et al., 2005) La micropropagación ha sido utilizada en el pasado para propagar masivamente plantas de especies del tipo bambú (Subramanlam, 1994; Gielis et al., 2002; Sanjaya y Ravishankar, 2005; Das y Pal, 2005; Marulanda et al., 2005), mientras que los desarrollos de protocolos para la producción masiva de plantas de Gynerium sagittatum in vitro no han sido encontrados. El presente trabajo tuvo como objetivo desarrollar un protocolo para micropropagación de plantas de caña flecha, a partir de explantes con meristemos pre-existentes, con el fin de permitir la producción clonal masiva de material para siembra.
MATERIALES Y MÉTODOS
Material vegetal. Segmentos nodales de aproximadamente 5 cm de longitud fueron aislados a partir de brotes basales (hijuelos) desarrollados de plantas adultas establecidas en la colección de plantas de caña flecha de la Granja Experimental de la Facultad de Ciencias Agrícolas de la Universidad de Córdoba. Las hojas y las vainas fueron removidas y los segmentos nodales colocados en remojo con agua potable por un período de 30 min. Posteriormente, porciones de aproximadamente 2,5 cm de longitud conteniendo una yema axilar fueron seccionadas y desinfectadas superficialmente en una solución al 1,25% de hipoclorito de sodio mezclado con 5 ml•L-1 de Tween 20® por un período de 20 min. Transcurrido el tiempo de desinfección superficial, los explantes fueron enjuagados con tres cambios de agua destilada estéril en condiciones asépticas en el interior de una cámara de flujo laminar y los extremos blandos de los explantes por el efecto de la solución desinfectante, fueron removidos con la ayuda de un bisturí estéril.
Establecimiento in vitro. Explantes de aproximadamente 2 cm de longitud con una yema axilar fueron establecidos en medios de cultivos semi sólido. Tres tratamientos basados en el medio Murashige y Skoog (1962) así: MS completo (MS), MS diluido a la mitad (1/2 MS) y MS suplementado con 0,1 mg•L-1 ANA + 0,3 mg•L-1 de benzilaminopurina (BAP) (MSAB) fueron evaluados para determinar su efecto sobre el establecimiento de los explantes en condiciones in vitro. Los tratamientos fueron distribuidos utilizando un diseño completamente al azar (DCA) con 60 repeticiones (cada repetición consistió de un explante en un frasco) por cada tratamiento. Al final de la cuarta semana se evaluó el número de explantes que sobrevivieron y se calculó el porcentaje de supervivencia, el número de explantes que desarrollaron órganos (yemas y raíces), la longitud de los nuevos brotes caulinares producidos y el porcentaje de fenolización.
Multiplicación del propágulo. Con el fin de determinar el mejor tratamiento para la proliferación de yemas axilares a partir de los explantes en condiciones in vitro, los tallos establecidos en la etapa anterior, fueron transferidos a un medio de cultivo MS semisólido suplementado independientemente con cuatro concentraciones (0,5; 1,0; 2,0 o 4,0 mg•L-1) de BAP, un tratamiento control absoluto (sin suplemento de BAP) y un tratamiento consistente de la formulación seleccionada como medio de cultivo de establecimiento con base en los resultados obtenidos en el estado anterior, para un total de seis tratamientos. Los tratamientos fueron distribuidos con un DCA con 15 repeticiones por cada tratamiento. Al final de la cuarta semana, para cada tratamiento se registró el número de nuevos tallos producidos por cada explante y el tamaño promedio de los nuevos tallos originados.
Enraizamiento in vitro. Con el fin de determinar las mejores condiciones para la producción de raíces adventicias en condiciones in vitro, se evaluó el efecto de siete tratamientos consistentes de un control absoluto, un tratamiento con un suplemento de 100 mg•L-1 de carbón activado y cinco tratamientos suplementados independientemente con diferentes concentraciones (0,5; 1,0; 2,0; 3,0 ó 4,0 mg•L-1) de ácido naftalenacético (ANA). Cada experimento fue repetido 15 veces y las repeticiones distribuidas con un DCA. Después de cuatro semanas de cultivo, se registró el número de explantes que produjeron raíces, se calculó el porcentaje de enraizamiento por cada tratamiento, el número promedio de raíces producidas por cada explante y la longitud promedio de las raíces producidas en cada uno de los tratamientos evaluados.
Adaptación ex vitro. Con el fin de determinar el efecto de la necesidad del enraizamiento in vitro para la recuperación y adaptación de las plantas micropropagadas de caña flecha a condiciones normales ex vitro, se tomaron plantas enraizadas con 0,5 mg•L-1 de ANA y se transplantaron en un sustrato de propagación compuesto por una mezcla estéril de arena, arcilla y cascarilla de arroz en una proporción en volumen 1:1:1, contenidas en bandejas con 24 alvéolos, en cada uno de los cuales se estableció un explante con aproximadamente 3-4 tallos enraizados por cada alvéolo. De forma alterna, explantes con igual número de tallos micropropagados, tomados directamente del estado de multiplicación de propágulo, fueron transplantados ex vitro en condiciones similares a los tallos enraizados. Todos los propágulos transplantados, un total de 140 por cada tratamiento, fueron colocados dentro de un umbráculo cubierto con una polisombra del 70% de cobertura y una frecuencia de riego por aspersión de 30 seg cada 12 min. Al final de la primera semana todas las plantas fueron trasladadas dentro del mismo umbráculo a un sitio con una cobertura del 50% y una frecuencia de riego de 12 segundos cada hora, y al final de la cuarta semana las plantas fueron colocadas definitivamente bajo una cubierta con 70% de luminosidad y cuatro riegos diarios de 30 seg cada uno. Al final de la octava semana, se registró el número de plantas que sobrevivieron.
Aspectos metodológicos. Todos los medios de cultivo fueron suplementados con (en mg•L-1) myo inositol (100), sacarosa (30.000), tiamina HCl (0,4) y TC agar (8.000) (Sigma Co®.). El pH fue ajustado a un valor de 5,7 – 5,8 con KOH o HCl previo a la adición de agar; posteriormente, el agar fue diluido a 100 °C y, en cada recipiente con capacidad de 125 cc, vertido en porciones de 30 ml de medio formulado de acuerdo con los requerimientos de cada experimento. Los frascos fueron cubiertos con una doble capa de papel aluminio y esterilizados en una autoclave a una temperatura de 121 °C y una presión de 1,1 kg•cm-2 por un período de 15 min. Los cultivos fueron sellados con una capa de Parafilm® y mantenidos a una temperatura de 25 ºC con una intensidad lumínica de 40 µ mol•m-2•s-1 por un período de 12 horas diarias suministradas con lámparas de luz fría fluorescente. Los experimentos de multiplicación y enraizamiento fueron analizados con un análisis de varianza con base en el modelo estadístico Yj = µ + i + ei; donde µ fue el promedio general, i correspondió al efecto del tratamiento para inducir la multiplicación caulinar o el efecto del tratamiento de enraizamiento y e correspondió al efecto del error experimental. Una vez realizado el análisis de varianza, los promedios de los tratamientos fueron separados mediante la prueba de Tukey con α = 0,05.
RESULTADOS
Establecimiento y multiplicación in vitro. Aproximadamente dos semanas después del establecimiento, se observaron los primeros órganos desarrollados a partir de los explantes establecidos (Figura 1).

Figura 1. Crecimiento de nuevos tallos a partir de yemas axilares presentes en un explante de caña flecha (Gynerium sagitatum Aubl.) establecido en condiciones in vitro.
La Tabla 1 muestra que el mayor número de explantes sobrevivientes se obtuvo cuando éstos fueron establecidos en el medio MSAB seguidos por aquellos cultivados en el medio ½ MS, mientras que el menor porcentaje de sobrevivencia fue observado cuando los explantes se cultivaron en medio MS. El desarrollo de nuevos órganos fue muy limitado en todos los tratamientos y los índices de oxidación del medio reducidos.
Tabla 1. Establecimiento de explantes de caña flecha (Gynerium sagitatum Aubl.) en diferentes formulaciones de medios de cultivo.

La proliferación de nuevos tallos, ocurrió a partir de las yemas axilares presentes en la base del explante formando crecimientos de nuevos tallos que se desarrollaron a partir del explante original como se puede apreciar en la Figura 2.

Figura 2. Proliferación de nuevos tallos a partir de yemas axilares de caña flecha (Gynerium sagitatum Aubl.).
El análisis de varianza permitió detectar diferencias significativas (P<0,0001) como resultado del efecto de los diferentes tratamientos aplicados para inducir la proliferación de nuevos brotes a partir de yemas axilares. El mayor número de nuevos tallos axilares se produjo cuando los explantes fueron cultivados en presencia de un suplemento de 0,1 mg•L-1 ANA + 0,3 mg•L-1 de ANA, mientras que la menor tasa de multiplicación se registró cuando los explantes fueron cultivados en presencia del tratamiento con la concentración mas alta de BAP (4,0 mg•L-1) (Figura 3). La misma Figura muestra que la mayor longitud promedio de los nuevos brotes producidos ocurrió cuando los explantes establecidos fueron cultivados en presencia del tratamiento control absoluto; sin embargo, éstos no alcanzaron una longitud significativamente mayor, a la de los producidos en el tratamiento con 0,1 mg•L-1 ANA + 0,3 mg•L-1 de ANA. Igualmente, se observó que en la medida que aumentó la cantidad de BAP en el medio de cultivo se redujo el tamaño de los nuevos tallos producidos.

Figura 3. Promedios y errores estándares del número de nuevos tallos producidos y la longitud de los mismos, como efecto de diferentes tratamientos (1=control; 2=0,5 mg•L-1 BAP, 3=1,0 mg•L-1 BAP, 4=2,0 mg•L-1 BAP, 5=4,0 mg•L-1 BAP y 6=0,1 mg•L-1 ANA) aplicados en el estado II (Multiplicación) de la micropropagación de caña flecha (Gynerium sagitatum Aubl.). Los promedios con las mismas letras no son diferentes de acuerdo con la prueba de separación de medias de Tukey (0,05).
Enraizamiento in vitro. La formación de raíces adventicias ocurrió en la base de los clústeres de tallos transferidos del medio de multiplicación a los medios con los tratamientos de enraizamiento, apreciándose enraizamiento en todos los tratamientos evaluados, es decir el porcentaje de enraizamiento fue del 100% para todas las evaluaciones; no obstante, los resultados del ANAVA permitieron concluir que se presentaron diferencias significativas con respecto al efecto de los diferentes tratamientos sobre las variables número de raíces producidas por explante (P< 0,0001) y tamaño promedio de raíces producidas en cada tratamiento (P< 0,0001). La prueba de separación de medias de Tukey (Figura 4) muestra que el mayor número de raíces por explante ocurrió cuando los clústeres fueron cultivados en el tratamiento suplementado con 21,48 µM de ANA, mientras que el menor número de raíces adventicias se formaron en los explantes cultivados en el tratamiento del control absoluto.

Figura 4. Promedios y errores estándares del efecto de diferentes tratamientos (1=Control absoluto, 2=100 mg•L-1 carbón activado, 3=0,5 mg•L-1 ANA; 4= 1,0 mg•L-1 ANA; 5=2,0 mg•L-1 ANA, 6=3,0 mg•L-1 ANA y 7=7,0 mg•L-1 ANA) sobre el enraizamiento in vitro de tallos micropropagados de caña flecha (Gynerium sagitatum Aubl.) en condiciones in vitro. Promedios con la misma letra no son diferentes estadísticamente de acuerdo con la prueba de separación de medias de Tukey (0,05).
El mayor tamaño de raíces ocurrió cuando los tallos micropropagados fueron cultivados en el medio suplementado con 100 mg•L-1 de carbón activado, seguido por el tratamiento sin ningún tipo de suplemento para inducir el enraizamiento (control absoluto) (Figura 5).

Figura 5. Promedio y errores estándares del efecto de diferentes tratamientos (1=Control absoluto; 2=100 mg•L-1 carbón activado; 3=0,5 mg•L-1 ANA; 4= 1,0 mg•L-1 ANA; 5=2,0 mg•L-1 ANA; 6=3,0 mg•L-1 ANA y 7=7,0 mg•L-1 ANA) sobre la longitud de las raíces producidas por tallos micropropagados de caña flecha (Gynerium sagitatum Aubl.) en condiciones in vitro. Promedios con la misma letra no son diferentes estadísticamente de acuerdo con la prueba de separación de medias de Tukey (0,05).
Transferencia a condiciones ex vitro. Los brotes transplantados con un enraizamiento previo en condiciones in vitro y aquellos transplantados directamente del estado de multiplicación (sin enraizar), sobrevivieron en un 100% a la etapa de aclimatización. Es decir, bajo las condiciones específicas en las cuales se desarrolló la adaptación a condiciones ex vitro en el presente trabajo, el enraizamiento en condiciones in vitro no fue necesario para alcanzar una recuperación completa de plantas micropropagadas de caña flecha en condiciones ex vitro (Figura 6).

Figura 6. Plantas micropropagadas de caña flecha (Gynerium sagitatum Aubl.) después de tres meses de ser transplantadas a condiciones ex vitro.
DISCUSIÓN
La producción masiva de plantas de especies del tipo bambú ha sido uno de los grandes retos para los métodos tradicionales de propagación de plantas, y probablemente la limitante mas poderosa para un mayor aprovechamiento y desarrollo comercial del cultivo de estas especies, siendo la micropropagación la mejor herramienta cuando se requiere de la producción masiva de este tipo de plantas (Banik, 1994; Subramanlam, 1994; Banik, 1995; Gielis, 1999).
Con el objetivo de utilizar la micropropagación en la producción clonal masiva de plantas de Gynerium sagitatum Aubl., se evaluó experimentalmente el efecto de diferentes tratamientos en las etapas de establecimiento in vitro, multiplicación, enraizamiento y recuperación de plantas micropropagadas. Los resultados obtenidos permitieron observar que el medio MS suplementado con una combinación de ácido naftalenacético (ANA) y benzilaminopurina (BAP), proporcionó las mejores condiciones para el establecimiento in vitro, y condujo a obtener la mayor tasa de multiplicación por explante, estimándose la posibilidad de alcanzar una producción superior a 10 x 106 nuevas plantas al año, partiendo de un sólo explante. El suplemento combinado de auxinas y citocininas ha sido utilizado previamente en la multiplicación in vitro en especies del tipo bambú. Beltrán y Sehuanes (2004) alcanzaron la mayor tasa de multiplicación en un cultivar no determinado de caña flecha con un suplemento de 2,0 a 4,0 mg•L-1 de BAP combinado con suministros de ANA correspondientes a un cuarto de la concentración de BAP. Kalia et al. (2004) obtuvieron una tasa de 10,3 nuevos brotes cuando explantes con meristemos pre-existentes de Bambusa nutans fueron cultivados en un medio semisólido suplementado con 1,1 mg•L-1 de BAP y 0,25 mg•L-1 de ANA. Sanjaya y Ravishankar (2005) lograron tasas de hasta 125 nuevos brotes por explante cada 50 días al cultivar segmentos nodales de Pseudoxytenanthera stocksii con al menos una yema axilar en un medio de cultivo líquido de MS suplementado con 1,0 mg•L-1 de ANA y 1,0 mg•L-1 de BAP. Kapoor y Rao (2006) utilizaron 0,55 a 1,1 mg•L-1 de BAP combinados con 10 mg•L-1 de ANA y 0,1 mg•L-1 de ácido giberélico (GA3) en la inducción de rizomas in vitro que luego desarrollaron brotes. Otras especies pertenecientes a familias diferentes a la gramineae han sido igualmente multiplicadas in vitro utilizando dosis combinadas de auxinas y citocininas. Pruski et al. (2005) lograron las mejores tasas de multiplicación en dos especies del género Prunus (P. fruticosa L. y P. tormentosa L.) cuando fueron multiplicadas en un medio MS orgánico con 0,1 mg•L-1 de ácido indolbutírico (AIB) combinado con 2,0 ó 4,0 mg•L-1 de BAP.
Los resultados obtenidos en el estado de enraizamiento indican que Gynerium sagitatum es una especie que responde favorablemente a las aplicaciones de auxinas en condiciones in vitro. Resultados similares han sido observados en plantas del tipo bambú y otras especies. Jiménez et al. (2006) observaron un enraizamiento completo (100%) en brotes axilares de Guadua angustifolia en un medio sin suministro de auxinas. Ndiaye et al. (2006) encontraron un enraizamiento máximo de 45,83% de brotes de Bambusa vulgaris cuando fueron cultivados con dosis iguales o mayores a 20 mg•L-1 de AIB. Saxena y Dhawan (1994) observaron el enraizamiento de tallos provenientes de embriones somáticos de Dendrocalamus strictus al ser cultivados en un medio MS suplementado con 0,3 mg•L-1 de ANA y 0,25 mg•L-1 de IBA. Das y Pal (2005) indujeron el enraizamiento de brotes de Bambusa balcooa en un medio de cultivo MS suplementado con 0,25 mg•L-1 de AIB. Sanjaya y Ravishankar (2005) registraron enraizamiento de tallos de Pseudoxytenanthera stocksii en medio de cultivo ½ MS líquido con 1,0 mg L-1 de AIB. Similarmente, Kalia et al. (2004) avistaron la producción de raíces adventicias en tallos micropropagados de Bambusa nutans cultivados en un medio con 0,25 mg•L-1 de ANA y 1,2 mg•L-1 de BAP. De forma alterna, el enraizamiento espontáneo sin necesidad de aplicar auxinas en el medio de cultivo ha sido evidente en otras especies; Ran y Simpson (2005) lograron la inducción y crecimiento de raíces a partir de tallos micropropagados de plantas de Clivia sp. en un medio MS suplementado con carbón activado.
La evaluación realizada en el presente estudio permitió observar que la ausencia de enraizamiento in vitro no fue un impedimento para adaptar las plantas micropropagadas a las condiciones ambientales ex vitro. Esta condición puede convertirse en una ventaja adicional ya que aumenta la eficiencia del proceso general de micropropagación al reducir el tiempo de producción de nuevas plantas y ahorrar significativamente en recursos de mano de obra, insumos y riesgos de contaminación por la manipulación inherente al estado de enraizamiento. La transferencia inmediata de propágulos multiplicados directamente al estado de aclimatación, sin un enraizamiento previo, ha sido lograda en varios protocolos de micropropagación de ciertas especies; Lara et al. (2003) consiguieron una recuperación de 80% de plantas de Psycotria acuminata después de transferir los tallos multiplicados directamente a condiciones ex vitro sin enraizamiento previo.
CONCLUSIONES
- Los explantes de Gynerium sagittatum lograron los mejores niveles de adaptación a las condiciones in vitro y la mayor tasa de multiplicación cuando fueron cultivados en un medio de cultivo semisólido de MS suplementado con ANA y BAP.
- Los mejores resultados en producción y crecimiento de raíces a partir de los brotes micropropagados, ocurrió en presencia de ANA; sin embargo, el suplemento de este regulador fue suficiente pero no necesario para producir el enraizamiento.
- El enraizamiento in vitro no es un evento necesario para lograr una adecuada adaptación de las plantas micropropagadas a condiciones ex vitro reduciendo en un período mínimo de cuatro semanas, el ciclo de producción de plantas y disminuyendo los costos de operación.
- Los datos colectados permiten estimar que siguiendo la metodología desarrollada se pueden alcanzar producciones superiores a 10 x 106 nuevas plantas de Gynerium sagittatum, partiendo de un sólo explante original.
BIBLIOGRAFÍA
Araméndiz, H., M. Espitia y J. Robles. 2005. Colección, conservación, caracterización morfoagronómica y producción de semilla de caña flecha (Gynerium sagitatum Aubl.) del Caribe Colombiano. CIUC. Universidad de Córdoba, Montería. 118 p.
Banik, R.L. 1994. Review of conventional propagation research in bamboos and future strategy. INBAR 5:115-142
Banik, R.L. 1995. Selection criteria and population enhancement of priority bamboos, INBAR 7: 99-110
Beltrán, J. y I. Barrios. 2004. Micropropagación in vitro de la caña flecha (Gynerium sagittatum) (Aubl) Beauv. c.v. “Criolla” mediante el uso de segmentos nodales. Memorias XXXIX Congreso de la Asociación Colombiana de Ciencias Biológicas, Ibagué.
Croat, T.B. 1978. Flora of Barro Colorado Island. Stanford University Press, Stanford. 943 p.
Das, M. and A. Pal. 2005. In vitro regeneration of Bambusa balcooa Roxb.: Factors affecting changes of morphogenic competence in the axillary buds. Plant Cell, Tissue and Organ Culture 81(1): 109-112.
Francis, J. 1983. Gynerium sagittatum Aubl. Poaceae. En: Jardin Botánico Sur, International Institute of Tropical Forestry, USDA, Rio Piedras (PR). http://www.fs.fed.us/global/iitf/pdf/shrubs/Gynerium%20sagittatum.pdf. 2 p.; consulta: enero 2006.
Gielis, J., H. Peeters, K. Gillis and P. Debergh. 2002. Tissue culture strategies for genetic improvement of bamboo. Acta Horticulturae 552:195-203
Gielis, J. 1999. Micropropagation and in vitro flowering of temperate and tropical woody bamboos. pp. 13-38. In: Ryachaudhuri, S. and K. Maramorosch (Eds.). Biotechnology and plant protection in forestry science. Science Publisher, NY.
González, O. 1997. Situación de dos métodos de siembra por estacas de caña flecha (Gynerium sagittatum Aubl.) de la variedad Martinera en la región de Montelibano, Córdoba. Trabajo de Grado Ingeniería Agronómica. Facultad de Ciencias Agrícolas Universidad de Córdoba. Montería. 74 p.
Hernández, J., H. Araméndiz y C. Cardona. 2005. Influencia del ácido indolbutírico sobre el enraizamiento de esquejes de caña flecha (Gynerium sagittatum Aubl.). Revista Temas Agrarios 10(1): 5-13
Howard, R.A. 1979. Flora of the Lesser Antilles; Leeward and Windward Islands. Harvard University, Boston. 586 p.
Jiménez, V.M., J. Castillo, E. Tavares, E. Guevara and M. Montiel. 2006. In vitro propagation of the neotropical giant bamboo, Guadua angustifolia Kunth, through axillary shoot proliferation. Plant Cell, Tissue and Organ Culture 86(3): 389-395.
Kalia, S., R. Kalia and S. Sharma. 2004. In vitro regeneration of and indigenous bamboo (Bambusa nutans) from internode and leaf explant. Journal of bamboo and rattan 3(3): 217-228.
Kapoor, P. and U. Rao. 2006. In vitro rhizome induction and plantlet formation from multiple shoots in Bambusa bamboos var. gigantea Bennet and Gaur by using growth regulators and sucrose. Plant Cell, Tissue and Organ Culture 85(2): 211-217.
Lara, A., R. Valverde, L. Gómez y N. Hidalgo. 2003. Micropropagación de la planta medicinal Psycotria acuminata. Agronomía Costarricense 27(2): 7-20.
Marulanda, M., L. Gutierrez y M.P. Marquez. 2005. Micropropagación de Guadua angustifolia Kunth. Actualidades Biológicas 27(82): 5-15.
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15(43): 473-497
Ndiaye, A., M.S. Diallo, D. Niang and Y.K. Gassama-Dia. 2006. In vitro regeneration of adult trees of Bambusa vulgaris. African Journal of Biotechnology 5(13): 1245-1248.
Pohl, R. 1983. Gynerium sagittatum (Caña brava, cane). pp. 248-249. In: Janzen, D. (Ed.) Costa Rican Natural History. University of Chicago Press, Chicago. 816 p.
Pruski, K., T. Astatkie and J. Nowak. 2005. Tissue culture propagation of Mongolian cherry (Prunus fruticosa) and Nankin cherry (Prunus tormentosa). Plant Cell, Tissue and Organ Culture 82(2): 207-211.
Ran, Y. and S. Simpson. 2005. In vitro propagation of the genus Clivia. Plant Cell, Tissue and Organ Culture 81(2): 239-242.
Sanjaya, R.T. and R. Ravishankar. 2005. Micropropagation of Pseudoxytenanthera stocksii Munro. In vitro Cellular and Developmental Biology Plant 41(3): 333-337.
Saxena, S. and V. Dhawan. 1994. Micropropagation research in south Asia. Constraints to production of bamboo and rattan. INBAR 5: 101-113.
SNE-Servicio de Noticias del Estado-. 2004. El sombrero vueltiao ahora es símbolo cultural de la Nación. En: Casa de Nariño, Presidencia de la República, http://www.presidencia.gov.co/sne/2004/septiembre/10/02102004.htm; consulta: Abril 2006.
Subramanlam, K. 1994. Bamboos–Demand and supply of planting stocks. INBAR 5:24-25
MICROPROPAGACIÓN DE CAÑA FLECHA (Gynerium sagitatum Aubl.)
MICROPROPAGATION OF WILD CANE (Gynerium sagitatum Aubl.)
Isidro Elías Suárez Padrón1; Hermes Araméndiz Tatis2 y Iván Javier Pastrana Vargas3
1 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <isuarez@sinu.unicordoba.edu.co>
2 Profesor Titular. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <haramendiz@hotmail.com>
3 Ingeniero Agrónomo. Universidad de Córdoba. Departamento de Ingeniería Agronómica y Desarrollo Rural. Carrera 6 No 76-103, km 3 vía Cereté. Montería, Colombia. <ijpv0710@hotmail.com>
Recibido: Septiembre 29 de 2007; Aceptado: Septiembre 14 de 2009.
Resumen. Un protocolo para la multiplicación in vitro de Gynerium sagitatum, a partir de explantes con meristemos pre-existentes ha sido desarrollado. Utilizando un diseño completamente al azar (DCA) con 15 repeticiones por cada tratamiento, segmentos nodales de aproximadamente 2 cm de longitud con una yema axilar, fueron establecidos independientemente en tres medios de cultivo (1/2 MS, MS Completo y MS con 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP) para evaluar su adaptación in vitro. Posteriormente, los explantes establecidos fueron cultivados en MS con cinco niveles (0,0; 0,5; 1,0; 2,0 o 4,0 mg•L-1) de BAP y un tratamiento con 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP con el fin de evaluar su efecto sobre la multiplicación de brotes. Los brotes micropropagados se establecieron en un medio MS suplementado con seis niveles (0,0; 0,5; 1,0; 2,0; 3,0 o 4,0 mg•L-1 ANA) y un tratamiento con 100 mg•L-1 de carbón activado. Finalmente, brotes micropropagados, con y sin enraizamiento in vitro, fueron transferidos ex vitro para evaluar la adaptación final. Los datos mostraron que los mejores resultados para establecimiento y multiplicación de los brotes ocurrió en MS con 0,1mg•L-1 ANA + 0,3 mg•L-1 BAP, mientras que la presencia de ANA tuvo efectos significativos en el enraizamiento. No obstante, las plantas transplantadas a condiciones ex vitro tuvieron una adaptación del 100% independientemente de si fueron o no enraizadas in vitro.
Palabras claves: Caña flecha, Gynerium sagitatum, micropropagación, enraizamiento, aclimatación.
Abstract. A micropropagation protocol for Gynerium sagitatum has been developed. Using a complete randomized design (CRD) with 15 replicates per treatment, explants with an axilllary bud were independently established in three different media (MS, ½ M and MS with 0.1 mg•L-1 NAA + 0.3 mg•L-1 BAP) to evaluate in vitro establishment. Established shoots were cultured in five (0,0; 0,5; 1,0; 2,0 or 4,0 mg•L-1) BAP levels and a treatment consisting of MS with 0,1 mg•L-1 NAA + 0,3 mg•L-1 BAP. Proliferated shoots were independently transferred onto MS with six (0.0, 0.5, 1.0, 2.0, 3.0 o 4.0 mg L-1) NAA concentrations and a treatment with 100 mg•L-1 activated charcoal. Micropropagated shoots with or without roots were transferred ex vitro to evaluate survival rate. The results showed that MS with 0,1 mg•L-1 ANA + 0,3 mg•L-1 BAP induced the best establishment and the highest multiplication rate, while an exogenous NAA supply induced a significant increase in explant rooting. However, in vitro rooting is not necessary for ex vitro acclimatization since unrooted micropropagated shoots showed a complete survival to ex vitro conditions.
Key words: Brave cane, Gynerium sagitatum, micropropagation, rooting, acclimatization.
La caña flecha (Gynerium sagitatum Aubl.) es una especie vegetal originaria del continente Americano, donde sus plantas crecen en territorios comprendidos desde México hasta Paraguay e incluso en las islas del Caribe con excepción de las Bahamas (Howard, 1979). La especie perteneciente a la familia Poaceae, produce hojas que forman la apariencia de un abanico cerca del ápice del tallo, las láminas foliares que se desprenden de la vaina son linear lanceoladas de 2 a 3 m de longitud con márgenes serrulados y filosos. La planta crece hasta alcanzar 5 a 6 m de altura, los tallos, de 2–4 cm de diámetro, se originan en rizomas localizados debajo de la superficie del suelo, el sistema radical esta compuesto por raíces flexibles, con poca resistencia y por su hábito de crecimiento actúan como protectoras de las riberas de los ríos y pantanos, y como refugio de varias especies animales (Pohl, 1983).
La caña flecha es un elemento que ha estado asociado desde tiempos antiguos con las culturas indígenas Zenúes de las sábanas de la Costa Norte Colombiana. Las nervaduras centrales constituyen la materia prima para la elaboración de mas de 30 clases de artesanía entre las que se incluye el sombrero vueltiao, símbolo representativo de la cultura colombiana; igualmente, el tallo aéreo se emplea en la construcción de viviendas de bahareque y elaboración de instrumentos musicales como la guacharaca, la espiga es convertida en un objeto ornamental al ser teñida de diferentes colores, y de su ráquis central los indígenas construyen flechas que son utilizadas para la caza y la pesca (SNE, 2004).
La propagación natural ocurre principalmente de forma vegetativa a partir de brotes emergentes de los rizomas, mientras que la reproducción sexual es difícil debido a la poca o nula producción de semilla viable (Francis, 1983). Como resultado de la sobre explotación para la elaboración de artesanías, el uso del tallo en construcciones y la expansión de la frontera agropecuaria, las áreas silvestres de caña flecha han sufrido severas reducciones, lo cual está ocasionando problemas de erosión en las riberas de los cuerpos de agua y un incremento en el costo de la fibra para la elaboración de las artesanías (González, 1997; Araméndiz et al., 2005; Croat, 1978). La propagación a partir de estacas suplementadas con reguladores de crecimiento ha sido implementada. Sin embargo, su aplicación en la producción de grandes cantidades de plantas puede ser limitada (Hernández et al., 2005) La micropropagación ha sido utilizada en el pasado para propagar masivamente plantas de especies del tipo bambú (Subramanlam, 1994; Gielis et al., 2002; Sanjaya y Ravishankar, 2005; Das y Pal, 2005; Marulanda et al., 2005), mientras que los desarrollos de protocolos para la producción masiva de plantas de Gynerium sagittatum in vitro no han sido encontrados. El presente trabajo tuvo como objetivo desarrollar un protocolo para micropropagación de plantas de caña flecha, a partir de explantes con meristemos pre-existentes, con el fin de permitir la producción clonal masiva de material para siembra.
MATERIALES Y MÉTODOS
Material vegetal. Segmentos nodales de aproximadamente 5 cm de longitud fueron aislados a partir de brotes basales (hijuelos) desarrollados de plantas adultas establecidas en la colección de plantas de caña flecha de la Granja Experimental de la Facultad de Ciencias Agrícolas de la Universidad de Córdoba. Las hojas y las vainas fueron removidas y los segmentos nodales colocados en remojo con agua potable por un período de 30 min. Posteriormente, porciones de aproximadamente 2,5 cm de longitud conteniendo una yema axilar fueron seccionadas y desinfectadas superficialmente en una solución al 1,25% de hipoclorito de sodio mezclado con 5 ml•L-1 de Tween 20® por un período de 20 min. Transcurrido el tiempo de desinfección superficial, los explantes fueron enjuagados con tres cambios de agua destilada estéril en condiciones asépticas en el interior de una cámara de flujo laminar y los extremos blandos de los explantes por el efecto de la solución desinfectante, fueron removidos con la ayuda de un bisturí estéril.
Establecimiento in vitro. Explantes de aproximadamente 2 cm de longitud con una yema axilar fueron establecidos en medios de cultivos semi sólido. Tres tratamientos basados en el medio Murashige y Skoog (1962) así: MS completo (MS), MS diluido a la mitad (1/2 MS) y MS suplementado con 0,1 mg•L-1 ANA + 0,3 mg•L-1 de benzilaminopurina (BAP) (MSAB) fueron evaluados para determinar su efecto sobre el establecimiento de los explantes en condiciones in vitro. Los tratamientos fueron distribuidos utilizando un diseño completamente al azar (DCA) con 60 repeticiones (cada repetición consistió de un explante en un frasco) por cada tratamiento. Al final de la cuarta semana se evaluó el número de explantes que sobrevivieron y se calculó el porcentaje de supervivencia, el número de explantes que desarrollaron órganos (yemas y raíces), la longitud de los nuevos brotes caulinares producidos y el porcentaje de fenolización.
Multiplicación del propágulo. Con el fin de determinar el mejor tratamiento para la proliferación de yemas axilares a partir de los explantes en condiciones in vitro, los tallos establecidos en la etapa anterior, fueron transferidos a un medio de cultivo MS semisólido suplementado independientemente con cuatro concentraciones (0,5; 1,0; 2,0 o 4,0 mg•L-1) de BAP, un tratamiento control absoluto (sin suplemento de BAP) y un tratamiento consistente de la formulación seleccionada como medio de cultivo de establecimiento con base en los resultados obtenidos en el estado anterior, para un total de seis tratamientos. Los tratamientos fueron distribuidos con un DCA con 15 repeticiones por cada tratamiento. Al final de la cuarta semana, para cada tratamiento se registró el número de nuevos tallos producidos por cada explante y el tamaño promedio de los nuevos tallos originados.
Enraizamiento in vitro. Con el fin de determinar las mejores condiciones para la producción de raíces adventicias en condiciones in vitro, se evaluó el efecto de siete tratamientos consistentes de un control absoluto, un tratamiento con un suplemento de 100 mg•L-1 de carbón activado y cinco tratamientos suplementados independientemente con diferentes concentraciones (0,5; 1,0; 2,0; 3,0 ó 4,0 mg•L-1) de ácido naftalenacético (ANA). Cada experimento fue repetido 15 veces y las repeticiones distribuidas con un DCA. Después de cuatro semanas de cultivo, se registró el número de explantes que produjeron raíces, se calculó el porcentaje de enraizamiento por cada tratamiento, el número promedio de raíces producidas por cada explante y la longitud promedio de las raíces producidas en cada uno de los tratamientos evaluados.
Adaptación ex vitro. Con el fin de determinar el efecto de la necesidad del enraizamiento in vitro para la recuperación y adaptación de las plantas micropropagadas de caña flecha a condiciones normales ex vitro, se tomaron plantas enraizadas con 0,5 mg•L-1 de ANA y se transplantaron en un sustrato de propagación compuesto por una mezcla estéril de arena, arcilla y cascarilla de arroz en una proporción en volumen 1:1:1, contenidas en bandejas con 24 alvéolos, en cada uno de los cuales se estableció un explante con aproximadamente 3-4 tallos enraizados por cada alvéolo. De forma alterna, explantes con igual número de tallos micropropagados, tomados directamente del estado de multiplicación de propágulo, fueron transplantados ex vitro en condiciones similares a los tallos enraizados. Todos los propágulos transplantados, un total de 140 por cada tratamiento, fueron colocados dentro de un umbráculo cubierto con una polisombra del 70% de cobertura y una frecuencia de riego por aspersión de 30 seg cada 12 min. Al final de la primera semana todas las plantas fueron trasladadas dentro del mismo umbráculo a un sitio con una cobertura del 50% y una frecuencia de riego de 12 segundos cada hora, y al final de la cuarta semana las plantas fueron colocadas definitivamente bajo una cubierta con 70% de luminosidad y cuatro riegos diarios de 30 seg cada uno. Al final de la octava semana, se registró el número de plantas que sobrevivieron.
Aspectos metodológicos. Todos los medios de cultivo fueron suplementados con (en mg•L-1) myo inositol (100), sacarosa (30.000), tiamina HCl (0,4) y TC agar (8.000) (Sigma Co®.). El pH fue ajustado a un valor de 5,7 – 5,8 con KOH o HCl previo a la adición de agar; posteriormente, el agar fue diluido a 100 °C y, en cada recipiente con capacidad de 125 cc, vertido en porciones de 30 ml de medio formulado de acuerdo con los requerimientos de cada experimento. Los frascos fueron cubiertos con una doble capa de papel aluminio y esterilizados en una autoclave a una temperatura de 121 °C y una presión de 1,1 kg•cm-2 por un período de 15 min. Los cultivos fueron sellados con una capa de Parafilm® y mantenidos a una temperatura de 25 ºC con una intensidad lumínica de 40 µ mol•m-2•s-1 por un período de 12 horas diarias suministradas con lámparas de luz fría fluorescente. Los experimentos de multiplicación y enraizamiento fueron analizados con un análisis de varianza con base en el modelo estadístico Yj = µ + i + ei; donde µ fue el promedio general, i correspondió al efecto del tratamiento para inducir la multiplicación caulinar o el efecto del tratamiento de enraizamiento y e correspondió al efecto del error experimental. Una vez realizado el análisis de varianza, los promedios de los tratamientos fueron separados mediante la prueba de Tukey con α = 0,05.
RESULTADOS
Establecimiento y multiplicación in vitro. Aproximadamente dos semanas después del establecimiento, se observaron los primeros órganos desarrollados a partir de los explantes establecidos (Figura 1).

Figura 1. Crecimiento de nuevos tallos a partir de yemas axilares presentes en un explante de caña flecha (Gynerium sagitatum Aubl.) establecido en condiciones in vitro.
La Tabla 1 muestra que el mayor número de explantes sobrevivientes se obtuvo cuando éstos fueron establecidos en el medio MSAB seguidos por aquellos cultivados en el medio ½ MS, mientras que el menor porcentaje de sobrevivencia fue observado cuando los explantes se cultivaron en medio MS. El desarrollo de nuevos órganos fue muy limitado en todos los tratamientos y los índices de oxidación del medio reducidos.
Tabla 1. Establecimiento de explantes de caña flecha (Gynerium sagitatum Aubl.) en diferentes formulaciones de medios de cultivo.

La proliferación de nuevos tallos, ocurrió a partir de las yemas axilares presentes en la base del explante formando crecimientos de nuevos tallos que se desarrollaron a partir del explante original como se puede apreciar en la Figura 2.

Figura 2. Proliferación de nuevos tallos a partir de yemas axilares de caña flecha (Gynerium sagitatum Aubl.).
El análisis de varianza permitió detectar diferencias significativas (P<0,0001) como resultado del efecto de los diferentes tratamientos aplicados para inducir la proliferación de nuevos brotes a partir de yemas axilares. El mayor número de nuevos tallos axilares se produjo cuando los explantes fueron cultivados en presencia de un suplemento de 0,1 mg•L-1 ANA + 0,3 mg•L-1 de ANA, mientras que la menor tasa de multiplicación se registró cuando los explantes fueron cultivados en presencia del tratamiento con la concentración mas alta de BAP (4,0 mg•L-1) (Figura 3). La misma Figura muestra que la mayor longitud promedio de los nuevos brotes producidos ocurrió cuando los explantes establecidos fueron cultivados en presencia del tratamiento control absoluto; sin embargo, éstos no alcanzaron una longitud significativamente mayor, a la de los producidos en el tratamiento con 0,1 mg•L-1 ANA + 0,3 mg•L-1 de ANA. Igualmente, se observó que en la medida que aumentó la cantidad de BAP en el medio de cultivo se redujo el tamaño de los nuevos tallos producidos.

Figura 3. Promedios y errores estándares del número de nuevos tallos producidos y la longitud de los mismos, como efecto de diferentes tratamientos (1=control; 2=0,5 mg•L-1 BAP, 3=1,0 mg•L-1 BAP, 4=2,0 mg•L-1 BAP, 5=4,0 mg•L-1 BAP y 6=0,1 mg•L-1 ANA) aplicados en el estado II (Multiplicación) de la micropropagación de caña flecha (Gynerium sagitatum Aubl.). Los promedios con las mismas letras no son diferentes de acuerdo con la prueba de separación de medias de Tukey (0,05).
Enraizamiento in vitro. La formación de raíces adventicias ocurrió en la base de los clústeres de tallos transferidos del medio de multiplicación a los medios con los tratamientos de enraizamiento, apreciándose enraizamiento en todos los tratamientos evaluados, es decir el porcentaje de enraizamiento fue del 100% para todas las evaluaciones; no obstante, los resultados del ANAVA permitieron concluir que se presentaron diferencias significativas con respecto al efecto de los diferentes tratamientos sobre las variables número de raíces producidas por explante (P< 0,0001) y tamaño promedio de raíces producidas en cada tratamiento (P< 0,0001). La prueba de separación de medias de Tukey (Figura 4) muestra que el mayor número de raíces por explante ocurrió cuando los clústeres fueron cultivados en el tratamiento suplementado con 21,48 µM de ANA, mientras que el menor número de raíces adventicias se formaron en los explantes cultivados en el tratamiento del control absoluto.

Figura 4. Promedios y errores estándares del efecto de diferentes tratamientos (1=Control absoluto, 2=100 mg•L-1 carbón activado, 3=0,5 mg•L-1 ANA; 4= 1,0 mg•L-1 ANA; 5=2,0 mg•L-1 ANA, 6=3,0 mg•L-1 ANA y 7=7,0 mg•L-1 ANA) sobre el enraizamiento in vitro de tallos micropropagados de caña flecha (Gynerium sagitatum Aubl.) en condiciones in vitro. Promedios con la misma letra no son diferentes estadísticamente de acuerdo con la prueba de separación de medias de Tukey (0,05).
El mayor tamaño de raíces ocurrió cuando los tallos micropropagados fueron cultivados en el medio suplementado con 100 mg•L-1 de carbón activado, seguido por el tratamiento sin ningún tipo de suplemento para inducir el enraizamiento (control absoluto) (Figura 5).

Figura 5. Promedio y errores estándares del efecto de diferentes tratamientos (1=Control absoluto; 2=100 mg•L-1 carbón activado; 3=0,5 mg•L-1 ANA; 4= 1,0 mg•L-1 ANA; 5=2,0 mg•L-1 ANA; 6=3,0 mg•L-1 ANA y 7=7,0 mg•L-1 ANA) sobre la longitud de las raíces producidas por tallos micropropagados de caña flecha (Gynerium sagitatum Aubl.) en condiciones in vitro. Promedios con la misma letra no son diferentes estadísticamente de acuerdo con la prueba de separación de medias de Tukey (0,05).
Transferencia a condiciones ex vitro. Los brotes transplantados con un enraizamiento previo en condiciones in vitro y aquellos transplantados directamente del estado de multiplicación (sin enraizar), sobrevivieron en un 100% a la etapa de aclimatización. Es decir, bajo las condiciones específicas en las cuales se desarrolló la adaptación a condiciones ex vitro en el presente trabajo, el enraizamiento en condiciones in vitro no fue necesario para alcanzar una recuperación completa de plantas micropropagadas de caña flecha en condiciones ex vitro (Figura 6).

Figura 6. Plantas micropropagadas de caña flecha (Gynerium sagitatum Aubl.) después de tres meses de ser transplantadas a condiciones ex vitro.
DISCUSIÓN
La producción masiva de plantas de especies del tipo bambú ha sido uno de los grandes retos para los métodos tradicionales de propagación de plantas, y probablemente la limitante mas poderosa para un mayor aprovechamiento y desarrollo comercial del cultivo de estas especies, siendo la micropropagación la mejor herramienta cuando se requiere de la producción masiva de este tipo de plantas (Banik, 1994; Subramanlam, 1994; Banik, 1995; Gielis, 1999).
Con el objetivo de utilizar la micropropagación en la producción clonal masiva de plantas de Gynerium sagitatum Aubl., se evaluó experimentalmente el efecto de diferentes tratamientos en las etapas de establecimiento in vitro, multiplicación, enraizamiento y recuperación de plantas micropropagadas. Los resultados obtenidos permitieron observar que el medio MS suplementado con una combinación de ácido naftalenacético (ANA) y benzilaminopurina (BAP), proporcionó las mejores condiciones para el establecimiento in vitro, y condujo a obtener la mayor tasa de multiplicación por explante, estimándose la posibilidad de alcanzar una producción superior a 10 x 106 nuevas plantas al año, partiendo de un sólo explante. El suplemento combinado de auxinas y citocininas ha sido utilizado previamente en la multiplicación in vitro en especies del tipo bambú. Beltrán y Sehuanes (2004) alcanzaron la mayor tasa de multiplicación en un cultivar no determinado de caña flecha con un suplemento de 2,0 a 4,0 mg•L-1 de BAP combinado con suministros de ANA correspondientes a un cuarto de la concentración de BAP. Kalia et al. (2004) obtuvieron una tasa de 10,3 nuevos brotes cuando explantes con meristemos pre-existentes de Bambusa nutans fueron cultivados en un medio semisólido suplementado con 1,1 mg•L-1 de BAP y 0,25 mg•L-1 de ANA. Sanjaya y Ravishankar (2005) lograron tasas de hasta 125 nuevos brotes por explante cada 50 días al cultivar segmentos nodales de Pseudoxytenanthera stocksii con al menos una yema axilar en un medio de cultivo líquido de MS suplementado con 1,0 mg•L-1 de ANA y 1,0 mg•L-1 de BAP. Kapoor y Rao (2006) utilizaron 0,55 a 1,1 mg•L-1 de BAP combinados con 10 mg•L-1 de ANA y 0,1 mg•L-1 de ácido giberélico (GA3) en la inducción de rizomas in vitro que luego desarrollaron brotes. Otras especies pertenecientes a familias diferentes a la gramineae han sido igualmente multiplicadas in vitro utilizando dosis combinadas de auxinas y citocininas. Pruski et al. (2005) lograron las mejores tasas de multiplicación en dos especies del género Prunus (P. fruticosa L. y P. tormentosa L.) cuando fueron multiplicadas en un medio MS orgánico con 0,1 mg•L-1 de ácido indolbutírico (AIB) combinado con 2,0 ó 4,0 mg•L-1 de BAP.
Los resultados obtenidos en el estado de enraizamiento indican que Gynerium sagitatum es una especie que responde favorablemente a las aplicaciones de auxinas en condiciones in vitro. Resultados similares han sido observados en plantas del tipo bambú y otras especies. Jiménez et al. (2006) observaron un enraizamiento completo (100%) en brotes axilares de Guadua angustifolia en un medio sin suministro de auxinas. Ndiaye et al. (2006) encontraron un enraizamiento máximo de 45,83% de brotes de Bambusa vulgaris cuando fueron cultivados con dosis iguales o mayores a 20 mg•L-1 de AIB. Saxena y Dhawan (1994) observaron el enraizamiento de tallos provenientes de embriones somáticos de Dendrocalamus strictus al ser cultivados en un medio MS suplementado con 0,3 mg•L-1 de ANA y 0,25 mg•L-1 de IBA. Das y Pal (2005) indujeron el enraizamiento de brotes de Bambusa balcooa en un medio de cultivo MS suplementado con 0,25 mg•L-1 de AIB. Sanjaya y Ravishankar (2005) registraron enraizamiento de tallos de Pseudoxytenanthera stocksii en medio de cultivo ½ MS líquido con 1,0 mg L-1 de AIB. Similarmente, Kalia et al. (2004) avistaron la producción de raíces adventicias en tallos micropropagados de Bambusa nutans cultivados en un medio con 0,25 mg•L-1 de ANA y 1,2 mg•L-1 de BAP. De forma alterna, el enraizamiento espontáneo sin necesidad de aplicar auxinas en el medio de cultivo ha sido evidente en otras especies; Ran y Simpson (2005) lograron la inducción y crecimiento de raíces a partir de tallos micropropagados de plantas de Clivia sp. en un medio MS suplementado con carbón activado.
La evaluación realizada en el presente estudio permitió observar que la ausencia de enraizamiento in vitro no fue un impedimento para adaptar las plantas micropropagadas a las condiciones ambientales ex vitro. Esta condición puede convertirse en una ventaja adicional ya que aumenta la eficiencia del proceso general de micropropagación al reducir el tiempo de producción de nuevas plantas y ahorrar significativamente en recursos de mano de obra, insumos y riesgos de contaminación por la manipulación inherente al estado de enraizamiento. La transferencia inmediata de propágulos multiplicados directamente al estado de aclimatación, sin un enraizamiento previo, ha sido lograda en varios protocolos de micropropagación de ciertas especies; Lara et al. (2003) consiguieron una recuperación de 80% de plantas de Psycotria acuminata después de transferir los tallos multiplicados directamente a condiciones ex vitro sin enraizamiento previo.
CONCLUSIONES
- Los explantes de Gynerium sagittatum lograron los mejores niveles de adaptación a las condiciones in vitro y la mayor tasa de multiplicación cuando fueron cultivados en un medio de cultivo semisólido de MS suplementado con ANA y BAP.
- Los mejores resultados en producción y crecimiento de raíces a partir de los brotes micropropagados, ocurrió en presencia de ANA; sin embargo, el suplemento de este regulador fue suficiente pero no necesario para producir el enraizamiento.
- El enraizamiento in vitro no es un evento necesario para lograr una adecuada adaptación de las plantas micropropagadas a condiciones ex vitro reduciendo en un período mínimo de cuatro semanas, el ciclo de producción de plantas y disminuyendo los costos de operación.
- Los datos colectados permiten estimar que siguiendo la metodología desarrollada se pueden alcanzar producciones superiores a 10 x 106 nuevas plantas de Gynerium sagittatum, partiendo de un sólo explante original.
BIBLIOGRAFÍA
Araméndiz, H., M. Espitia y J. Robles. 2005. Colección, conservación, caracterización morfoagronómica y producción de semilla de caña flecha (Gynerium sagitatum Aubl.) del Caribe Colombiano. CIUC. Universidad de Córdoba, Montería. 118 p.
Banik, R.L. 1994. Review of conventional propagation research in bamboos and future strategy. INBAR 5:115-142
Banik, R.L. 1995. Selection criteria and population enhancement of priority bamboos, INBAR 7: 99-110
Beltrán, J. y I. Barrios. 2004. Micropropagación in vitro de la caña flecha (Gynerium sagittatum) (Aubl) Beauv. c.v. “Criolla” mediante el uso de segmentos nodales. Memorias XXXIX Congreso de la Asociación Colombiana de Ciencias Biológicas, Ibagué.
Croat, T.B. 1978. Flora of Barro Colorado Island. Stanford University Press, Stanford. 943 p.
Das, M. and A. Pal. 2005. In vitro regeneration of Bambusa balcooa Roxb.: Factors affecting changes of morphogenic competence in the axillary buds. Plant Cell, Tissue and Organ Culture 81(1): 109-112.
Francis, J. 1983. Gynerium sagittatum Aubl. Poaceae. En: Jardin Botánico Sur, International Institute of Tropical Forestry, USDA, Rio Piedras (PR). http://www.fs.fed.us/global/iitf/pdf/shrubs/Gynerium%20sagittatum.pdf. 2 p.; consulta: enero 2006.
Gielis, J., H. Peeters, K. Gillis and P. Debergh. 2002. Tissue culture strategies for genetic improvement of bamboo. Acta Horticulturae 552:195-203
Gielis, J. 1999. Micropropagation and in vitro flowering of temperate and tropical woody bamboos. pp. 13-38. In: Ryachaudhuri, S. and K. Maramorosch (Eds.). Biotechnology and plant protection in forestry science. Science Publisher, NY.
González, O. 1997. Situación de dos métodos de siembra por estacas de caña flecha (Gynerium sagittatum Aubl.) de la variedad Martinera en la región de Montelibano, Córdoba. Trabajo de Grado Ingeniería Agronómica. Facultad de Ciencias Agrícolas Universidad de Córdoba. Montería. 74 p.
Hernández, J., H. Araméndiz y C. Cardona. 2005. Influencia del ácido indolbutírico sobre el enraizamiento de esquejes de caña flecha (Gynerium sagittatum Aubl.). Revista Temas Agrarios 10(1): 5-13
Howard, R.A. 1979. Flora of the Lesser Antilles; Leeward and Windward Islands. Harvard University, Boston. 586 p.
Jiménez, V.M., J. Castillo, E. Tavares, E. Guevara and M. Montiel. 2006. In vitro propagation of the neotropical giant bamboo, Guadua angustifolia Kunth, through axillary shoot proliferation. Plant Cell, Tissue and Organ Culture 86(3): 389-395.
Kalia, S., R. Kalia and S. Sharma. 2004. In vitro regeneration of and indigenous bamboo (Bambusa nutans) from internode and leaf explant. Journal of bamboo and rattan 3(3): 217-228.
Kapoor, P. and U. Rao. 2006. In vitro rhizome induction and plantlet formation from multiple shoots in Bambusa bamboos var. gigantea Bennet and Gaur by using growth regulators and sucrose. Plant Cell, Tissue and Organ Culture 85(2): 211-217.
Lara, A., R. Valverde, L. Gómez y N. Hidalgo. 2003. Micropropagación de la planta medicinal Psycotria acuminata. Agronomía Costarricense 27(2): 7-20.
Marulanda, M., L. Gutierrez y M.P. Marquez. 2005. Micropropagación de Guadua angustifolia Kunth. Actualidades Biológicas 27(82): 5-15.
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum 15(43): 473-497
Ndiaye, A., M.S. Diallo, D. Niang and Y.K. Gassama-Dia. 2006. In vitro regeneration of adult trees of Bambusa vulgaris. African Journal of Biotechnology 5(13): 1245-1248.
Pohl, R. 1983. Gynerium sagittatum (Caña brava, cane). pp. 248-249. In: Janzen, D. (Ed.) Costa Rican Natural History. University of Chicago Press, Chicago. 816 p.
Pruski, K., T. Astatkie and J. Nowak. 2005. Tissue culture propagation of Mongolian cherry (Prunus fruticosa) and Nankin cherry (Prunus tormentosa). Plant Cell, Tissue and Organ Culture 82(2): 207-211.
Ran, Y. and S. Simpson. 2005. In vitro propagation of the genus Clivia. Plant Cell, Tissue and Organ Culture 81(2): 239-242.
Sanjaya, R.T. and R. Ravishankar. 2005. Micropropagation of Pseudoxytenanthera stocksii Munro. In vitro Cellular and Developmental Biology Plant 41(3): 333-337.
Saxena, S. and V. Dhawan. 1994. Micropropagation research in south Asia. Constraints to production of bamboo and rattan. INBAR 5: 101-113.
SNE-Servicio de Noticias del Estado-. 2004. El sombrero vueltiao ahora es símbolo cultural de la Nación. En: Casa de Nariño, Presidencia de la República, http://www.presidencia.gov.co/sne/2004/septiembre/10/02102004.htm; consulta: Abril 2006.
Subramanlam, K. 1994. Bamboos–Demand and supply of planting stocks. INBAR 5:24-25
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Copyright (c) 2015 Revista Facultad Nacional de Agronomía

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The journal allows the author(s) to maintain the exploitation rights (copyright) of their articles without restrictions. The author(s) accept the distribution of their articles on the web and in paper support (25 copies per issue) under open access at local, regional, and international levels. The full paper will be included and disseminated through the Portal of Journals and Institutional Repository of the Universidad Nacional de Colombia, and in all the specialized databases that the journal considers pertinent for its indexation, to provide visibility and positioning to the article. All articles must comply with Colombian and international legislation, related to copyright.
Author Commitments
The author(s) undertake to assign the rights of printing and reprinting of the material published to the journal Revista Facultad Nacional de Agronomía Medellín. Any quotation of the articles published in the journal should be made given the respective credits to the journal and its content. In case content duplication of the journal or its partial or total publication in another language, there must be written permission of the Director.
Content Responsibility
The Faculty of Agricultural Sciences and the journal are not necessarily responsible or in solidarity with the concepts issued in the published articles, whose responsibility will be entirely the author or the authors.






















