Sobrepeso y expresión de receptores de adiponectina en monocitos de sangre periférica
Overweight and adiponectin receptors expression in peripheral blood monocytes
Palabras clave:
adiponectina, sobrepeso, monocitos, reacción en cadena de la polimerasa de transcriptasa reversa (RT-PCR), expresión génica. (es)adiponectin, overweight, monocytes, reverse transcriptase polymerase chain reaction, gene expression, receptors. (en)
Objetivo. Determinar la expresión relativa de los receptores 1 y 2 de adiponectina (AdipoR1 y AdipoR2) en monocitos circulantes de sujetos con sobrepeso y con peso normal.
Material y métodos. Mediante reacción en cadena de la polimerasa en tiempo real se determinó la expresión relativa (mRNA) de AdipoR1 y AdipoR2 en monocitos de sangre periférica aislados con técnica de inmunoafinidad, en un grupo de estudiantes de 18 a 25 años (n=48); además se midieron parámetros antropométricos y bioquímicos (resistencia a la insulina con modelo homeostático, colesterol total, colesterol-HDL y triglicéridos).
Resultados. Se encontró que los niveles de expresión de AdipoR1 en monocitos eran mayores que los de AdipoR2 (p < 0,001). No se observaron diferencias en la expresión de AdipoR1 o AdipoR2 en monocitos de acuerdo al género, índice de masa corporal, porcentaje de masa grasa, resistencia a la insulina o perfil lipídico.
Conclusión. El hallazgo de una mayor expresión de AdipoR1 en comparación a AdipoR2 en monocitos circulantes corrobora los resultados de otros autores. Los datos obtenidos sugieren que la expresión de AdipoR1 y AdipoR2 en monocitos de sujetos normales y con sobrepeso no se relaciona con la sensibilidad a la insulina. Se recomienda realizar otros estudios, que además de involucrar población con índice de masa corporal superior a 30 kg/m2 e individuos con obesidad abdominal, determinen posibles efectos de factores relacionados con el estilo de vida sobre la regulación de la expresión de estos receptores en monocitos circulantes.
Aims. To determine AdipoR1 and AdipoR2 relative expression in peripheral blood monocytes from overweight and normal subjects.
Materials and methods. AdipoR1 and AdipoR2 relative expression was determined in peripheral blood monocytes by using real-time polymerase chain reaction. Peripheral blood monocytes were isolated by means of immunoaffinity technique from a group of students aged 18 to 25 years (n=48). Anthropometric and biochemical parameters (total and HDL-cholesterol, triglycerides and insulin resistance estimated by the homeostasis model assessment ratio) were measured.
Results. AdipoR1 expression in peripheral blood monocytes was higher than that of AdipoR2 (p < 0.001). According to sex, body mass index, percentage body fat, insulin resistance or lipid profile, there were no differences in AdipoR1 or AdipoR2 expression.
Conclusions. Our results about a greater AdipoR1 expression in comparison to AdipoR2 corroborate previous findings. Our data suggest no relation between the expression of AdipoR1 and AdipoR2 in monocytes of normal and overweighted subjects and insulin sensibility. Further studies are recommended which involve population with body mass index superior to 30 kg/m2 and individuals with abdominal obesity, and in addition establish possible effects of style-life related factors on the regulation of the expression of these receptors in peripheral monocytes.
INVESTIGACIÓN ORIGINAL
SOBREPESO Y EXPRESIÓN DE RECEPTORES DE ADIPONECTINA EN MONOCITOS DE SANGRE PERIFÉRICA
Overweight and adiponectin receptors expression in peripheral blood monocytes
Ismena Mockus1,Jorge Eduardo Caminos1, Luz Helena Aranzález1
, Doris Ramírez2
1. Profesor, Departamento de Ciencias Fisiológicas, Facultad de Medicina,
Universidad Nacional de Colombia, Bogotá.
Correspondencia: ivmockuss@unal.edu.co
2. Profesora, Departamento de Nutrición y Dietética, Facultad
de Medicina, Universidad Nacional de Colombia, Bogotá.
Resumen
Antecedentes. Estudios anteriores han demostrado la asociación
entre aumento del tejido adiposo e incremento de ateroesclerosis y han evidenciado
la expresión de receptores de adiponectina en la placa ateroesclerótica.
A su vez, trabajos previos han permitido concluir que los macrófagos
del ateroma provienen de los monocitos circulantes.
Objetivo. Determinar la expresión relativa de los receptores 1
y 2 de adiponectina (AdipoR1 y AdipoR2) en monocitos circulantes de sujetos
con sobrepeso y con peso normal.
Material y métodos. Mediante reacción en cadena de la polimerasa
en tiempo real se determinó la expresión relativa (mRNA) de AdipoR1
y AdipoR2 en monocitos de sangre periférica aislados con técnica
de inmunoafinidad, en un grupo de estudiantes de 18 a 25 años (n=48);
además se midieron parámetros antropométricos y bioquímicos
(resistencia a la insulina con modelo homeostático, colesterol total,
colesterol-HDL y triglicéridos).
Resultados. Se encontró que los niveles de expresión de
AdipoR1 en monocitos eran mayores que los de AdipoR2 (p < 0,001). No se observaron
diferencias en la expresión de AdipoR1 o AdipoR2 en monocitos de acuerdo
al género, índice de masa corporal, porcentaje de masa grasa,
resistencia a la insulina o perfil lipídico.
Conclusión. El hallazgo de una mayor expresión de AdipoR1
en comparación a AdipoR2 en monocitos circulantes corrobora los resultados
de otros autores. Los datos obtenidos sugieren que la expresión de AdipoR1
y AdipoR2 en monocitos de sujetos normales y con sobrepeso no se relaciona con
la sensibilidad a la insulina. Se recomienda realizar otros estudios, que además
de involucrar población con índice de masa corporal superior a
30 kg/m2 e individuos con obesidad abdominal, determinen posibles efectos de
factores relacionados con el estilo de vida sobre la regulación de la
expresión de estos receptores en monocitos circulantes.
Palabras clave: adiponectina, sobrepeso, monocitos, reacción en cadena de la polimerasa de transcriptasa reversa (RT-PCR), expresión génica.
Summary
Background. Previous research had shown that adipose tissue increase
is associated to greater atherosclerosis and have also demonstrated adiponectin
receptors (AdipoR1 and AdipoR2) expression in atherosclerotic plaque. In addition,
previous research have allowed to conclude that atheroma´s macrophage
arise from circulating monocytes.
Aims. To determine AdipoR1 and AdipoR2 relative expression in peripheral
blood monocytes from overweight and normal subjects.
Materials and methods. AdipoR1 and AdipoR2 relative expression was determined
in peripheral blood monocytes by using real-time polymerase chain reaction.
Peripheral blood monocytes were isolated by means of immunoaffinity technique
from a group of students aged 18 to 25 years (n=48). Anthropometric and biochemical
parameters (total and HDL-cholesterol, triglycerides and insulin resistance
estimated by the homeostasis model assessment ratio) were measured.
Results. AdipoR1 expression in peripheral blood monocytes was higher
than that of AdipoR2 (p < 0.001). According to sex, body mass index, percentage
body fat, insulin resistance or lipid profile, there were no differences in
AdipoR1 or AdipoR2 expression.
Conclusions. Our results about a greater AdipoR1 expression in comparison
to AdipoR2 corroborate previous findings. Our data suggest no relation between
the expression of AdipoR1 and AdipoR2 in monocytes of normal and overweighted
subjects and insulin sensibility. Further studies are recommended which involve
population with body mass index superior to 30 kg/m2 and individuals with abdominal
obesity, and in addition establish possible effects of style-life related factors
on the regulation of the expression of these receptors in peripheral monocytes.
KeyWords: adiponectin, overweight, monocytes, reverse transcriptase polymerase chain reaction, gene expression, receptors.
Introducción
Estudios epidemiológicos han asociado la obesidad con la ateroesclerosis
(1). Se ha demostrado que el adipocito, a través de la producción
de adipocitocinas, está involucrado en la inflamación vascular
(2). Se ha establecido que los monocitos, expresan receptores para hormonas
y factores sintetizados por los adipocitos (3-5). Se ha comprobado la expresión
en los monocitos de receptores de adiponectina. Los niveles circulantes de adipocitocina
se correlacionan negativamente con el índice de masa corporal (IMC) (6,7).
Se ha observado que la adiponectina desempeña un papel protector contra
el daño vascular (8,9).
La conversión de los monocitos circulantes en macrófagos espumosos
de la placa ateroes¬clerótica está asociada a múltiples
factores entre los cuales están el aumento del tejido adiposo visceral,
la disminución de la sensibilidad a la insulina, incremento de los niveles
plasmáticos de colesterol-LDL, la reducción de colesterol-HDL
y la elevación de triglicéridos (10,11). Los efectos de los factores
anteriores podrían estar mediados por acciones sobre la expresión
de los receptores de adiponectina (AdipoR) en los monocitos circulantes. Aunque
se ha establecido que los monocitos expresan predominantemente AdipoR1, no se
conoce la relación de esta expresión con la cantidad de tejido
adiposo. Por lo tanto, resulta de interés determinar la expresión
génica de los receptores AdipoR1 y AdipoR2 en los monocitos de adultos
jóvenes con sobrepeso y compararla con la de sujetos de peso normal.
Además se considera importante establecer posibles correlaciones de la
expresión génica de estos receptores con parámetros antropomé¬tricos
y bioquímicos relacionados con sensibilidad a la insulina y ateroesclerosis.
Materiales y métodos
Población, determinaciones antropométricas, bioimpedancia eléctrica
El presente es un estudio de corte transversal llevado a cabo con estudiantes
que ingresaron por primera vez a la Universidad Nacional de Colombia
en el segundo semestre de 2004. Todos los estudiantes que presentaron el examen
médico de ingreso un IMC igual o mayor de 25 kg/m2 fueron convocados
por la División de Bienestar Estudiantil para participar en el presente
trabajo y además se invitó a un número doble de hombres
y mujeres de la misma población, seleccionados mediante muestreo aleatorio
simple, con IMC entre 18,5 kg/m2 y 24,9 kg/m2 (12). Se excluyeron los sujetos
con estados infecciosos o ingesta de medicamentos durante los 15 días
anteriores al examen. La dislipidemia, la diabetes mellitus tipo 2, la hiperuricemia
o tratamientos previos para reducir peso no fueron criterios de exclusión.
Asistieron a la convocatoria 62 sujetos, de los cuales 11 fueron descartados
por presentar alguno de los criterios de exclusión. Según el género
y el índice de masa corporal se conformaron cuatro grupos finales de
estudio: Grupo 1: mujeres con IMC menor a 25 kg/m2 (n=12), Grupo 2: mujeres
con IMC mayor o igual a 25 kg/m2 (n=12), Grupo 3: hombres con IMC menor a 25
kg/m2 (n=12) y Grupo 4: hombres con IMC mayor o igual a 25 kg/m2 (n=12).
Para realizar el presente trabajo se solicitó y obtuvo la aprobación
del Comité de Ética de la Facultad de Medicina de la Universidad
Nacional de Colombia; los estudiantes firmaron un consentimiento informado.
El estudio se efectuó acorde con la declaración de Helsinki.
Se realizaron las siguientes medidas antropo¬métricas: talla, peso, perímetro de cintura y perímetro de cadera. Se calculó el IMC, la relación cintura/cadera y cintura/talla (13-15). Se determinó el porcentaje de masa grasa utilizando un impedanciómetro RJL Systems Inc® según metodología previamente descrita (16).
Determinaciones bioquímicas
Después de 12 horas de ayuno y previo al examen antropométrico (salvo el IMC) se tomaron muestras de 20 mL de sangre venosa en tubos secos y con heparina. El tubo sin anticoagulante se centrifugó a 2500 revoluciones por 10 minutos y se obtuvo el suero que se almacenó a -80oC para la determinación de colesterol total, colesterol-HDL, triglicéridos, glucosa e insulina. Las concentraciones plasmáticas de triglicéridos, colesterol total, colesterol-HDL y glucosa se determinaron al mes de haber obtenido la muestra mediante métodos enzimáticos-colorimétricos utilizando el producto Sera-Pak® Plus en un equipo automatizado Vitalab Selectra 2 de Merck. Las concentraciones de colesterol-LDL se calcularon utilizando la fórmula de Friedewald (17,18):
colesterol total-(colesterol HDL+triglicéridos/5)
Las concentraciones de insulina se determinaron mediante inmunoanálisis de electroquimio¬luminiscencia (ECLIA-Insulin Cat Set de Roche®) en un equipo automatizado Elecsys® 1010 y se calculó el índice de resistencia a la insulina con modelo homeostático (HOMA-R) (19-20).
Aislamiento de monocitos de sangre periférica, extracción de RNA y análisis de la expresión génica mediante RT-PCR en tiempo real
Las células mononucleares de la sangre venosa fueron separadas de las células rojas y de los granulocitos mediante un gradiente de densidad empleando Ficoll-Hypaque (densidad 1,078 g/mL, ICN Biomedicals, Inc). Una vez obtenidas las células mononucleares se procedió a la separación de los monocitos mediante un método de inmunoafinidad (Dynal® Monocyte Negative Isolation Kit - Biotech ASA, Oslo, Norway) (21). Los monocitos aislados fueron almacenados a -80oC para el estudio de la expresión de AdipoR1 y AdipoR2.
El RNA total de los monocitos de 28 estudiantes (n=7 por grupo) se aisló con trizol (GibcoBRL) como se ha descrito previamente (22). La concentración del RNA se determinó a una λ de 260 nm (UV) con un espectrofotómetro (Termo Electron Corporation Bionate 3®). El RNA se retrotranscribió (RT) y posteriormente se realizó el análisis por PCR en tiempo real mediante el uso de los siguientes primers (23,24):
La expresión de los AdipoR1 y AdipoR2 se reportó en relación a la del gen constitutivo de la ß-actina (23,24). La PCR en tiempo real se efectuó en un equipo LightCycler® 2.0 con el reactivo LightCycler DNA Master SYBR Green I (Cat. No. 2 015 099, Roche) (25,26).
Análisis estadístico
Los programas utilizados fueron Epi-Info 2002 y SPSS versión 11.5 (27). En la comparación de los grupos (normal y sobrepeso) para cada grupo independiente, hombres y mujeres, en las variables continuas, se evaluó previamente la normalidad, usando las pruebas de Kolmogorov Smirnov y Shapiro Wilks y la homogeneidad de las varianzas con la prueba de Levene. En caso de normalidad, se utilizó prueba t-student para dos grupos independientes, con varianzas homogéneas o hetereogéneas. Cuando las distribuciones fueron diferentes a la normal se usó la prueba no-paramétrica para dos grupos independientes de Mann Whitney. Las correlaciones entre la expresión de AdipoR1 y AdipoR2 y las variables antropométricas y bioquímicas se evaluaron mediante el coeficiente de correlación de Pearson (r) o de Spearman (rs) cuando las distribuciones fueron diferentes a normal. Para la comparación entre las medianas de expresión de AdipoR1 y AdipoR2, se utilizó la prueba de Wilcoxon para medidas relacionadas o repetidas. En el ajuste de variables de confusión con AdipoR1 y AdipoR2 entre los cuatro grupos, se utilizó análisis multivariado por medio análisis de varianza. Las pruebas se evaluaron a un nivel de significancia del 5 por ciento (p<0.05).
Resultados
Parámetros antropométricos y bioquímicos
Las características antropométricos de la muestra en estudio aparecen en las tablas 1 y 2.
Si bien el grupo de mujeres con sobrepeso (Grupo 2) presentó niveles mayores de colesterol total y de colesterol-LDL y concentraciones menores de colesterol-HDL en comparación al grupo de mujeres de peso normal (Grupo 1), las diferencias no fueron significativas. Las glicemias fueron similares en los dos grupos. Los niveles de triglicéridos estuvieron cerca de mostrar diferencias significativas y la insulina y el índice HOMA-R fueron significativamente mayores en el grupo 2 en relación al grupo 1 (Tabla 1).

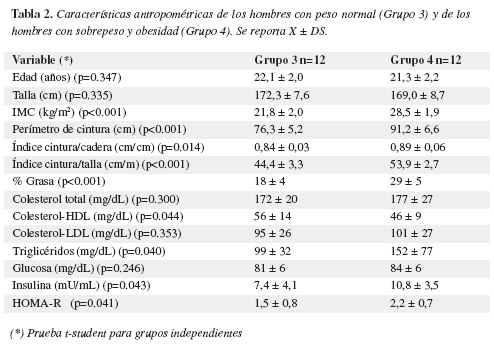
El grupo de hombres con sobrepeso (Grupo 4) presentó niveles elevados de colesterol total y colesterol-LDL en comparación al grupo de hombres con peso normal (Grupo 3) pero sin significancia estadística. Las concentraciones de colesterol-HDL fueron significativamente menores en el grupo 4 en comparación al grupo 3. Las glicemias fueron similares en los dos grupos. Los niveles de triglicéridos, insulina y el índice HOMA-R fueron significativamente mayores en el grupo 4 en relación al grupo 3 (Tabla 2).
Análisis de la expresión génica
La ß-actina amplificó adecuadamente en los monocitos de cada uno de los sujetos estudiados. Se encontró expresión de AdipoR1 y AdipoR2 en los monocitos de todos los sujetos estudiados. Al comparar la expresión de AdipoR1 y AdipoR2 en los 28 sujetos, se observó que la expresión relativa de AdipoR1 (5,67±0,86, med=5,67) fue significativamente mayor en comparación a la de AdipoR2 (4.90±0.71, med=4.71) (p<0.001, Test no-paramétrico de Wilcoxon).
La expresión relativa de AdipoR1 fue similar en los grupos 1 y 2 (5,75 ± 1,32, med=5,31 versus 5.62 ± 0.89, med=5,23, p=0.402, Mann Whithey exacto) y en los grupos 3 y 4 (5,59±0,41, med=5,41 versus 5,73 ± 0,69, med=5,53, p=0.469, Mann Whitney exacto). La expresión relativa de AdipoR2 fue similar en los grupos 1 y 2 (5,02 ± 1,18, med=4,64 versus 4,73 ± 0,60, med=4,44, p=0.267, Mann Whitney exacto) y en los grupos 3 y 4 (4,85 ± 0,20, med=4,85 versus 4,99 ± 0,59, med=4,88, p=0.531, Mann Whitney exacto).
Al comparar los grupos con sobrepeso y los grupos de peso normal, después de ajustar con las variables antropométricas y bioquímicas, no se encontró diferencias entre ellos en la expresión relativa de AdipoR1 (p=0,467) ni en la de AdipoR2 (p=0,282).
No se encontró correlaciones de la expresión relativa de AdipoR1 y AdipoR2 con los parámetros antropométricos, el porcentaje de grasa corporal, el colesterol total, el colesterol-HDL, el colesterol-LDL, los triglicéridos, la glicemia, la insulina o el índice HOMA-R (no se muestran datos). En el análisis de la significancia estadística de estas relaciones se encontró p>0,05.
Discusión
Estudios previos han demostrado, mediante PCR en tiempo real la expresión de mRNA de AdipoR1 y AdipoR2 en placas de ateroma de carótidas humanas obtenidas durante procedimientos de endarterectomía (28). Resulta de interés estudiar en los monocitos, que son células que participan en los procesos de inflamación de la pared arterial y en la formación del ateroma y que pueden ser recolectadas en sangre periférica, la expresión de AdipoR1 y AdipoR2. En el presente trabajo, realizado en un grupo de adultos jóvenes, se evidenció en monocitos de sangre periférica aislados mediante técnica de inmunoafinidad, la expresión de AdipoR1 y AdipoR2. Se observó que los monocitos de sangre periférica de todos los sujetos expresaron AdipoR1 y AdipoR2, siendo mayor la expresión relativa de AdipoR1, lo cual está de acuerdo con publicaciones anteriores (28).
En el presente trabajo efectuado en monocitos aislados de sangre periférica no se encontraron diferencias en la expresión relativa de AdipoR1, ni de AdipoR2 cuando se compararon sujetos con sobrepeso y sujetos de peso normal agrupados según el género. Otros autores han observado una menor expresión de AdipoR1 y AdipoR2 en linfocitos de humanos obesos en comparación a los de sujetos con anorexia (29).
Se ha reportado que en la obesidad disminuye la expresión de AdipoR1 y AdipoR2 en el tejido adiposo dando lugar a una disminución del efecto de la adiponectina y a un aumento de la resistencia a la insulina (30). Estudios previos han demostrado que en tejido adiposo y en adipocitos aislados, la expresión de AdipoR1 es mayor que la de AdipoR2 y, a su vez, AdipoR1 presenta una menor expresión en el tejido omental en comparación al subcutáneo (31). Investigaciones anteriores han evidenciado, además, un efecto inhibidor de la obesidad y de la resistencia a la insulina sobre la expresión de AdipoR1 y AdipoR2 en el músculo e hígado de rata (32). También se ha demostrado una correlación entre la expresión de receptores de adiponectina en el músculo esquelético y sensibilidad a la insulina en humanos (23).
Por otra parte, se ha descrito en miotubos humanos una asociación de la expresión de mRNA de AdipoR2 con los niveles de triglicéridos plasmáticos y una correlación positiva entre la expresión de mRNA de AdipoR1 y las concentraciones circulantes de insulina, triglicéridos y colesterol (33). En el presente estudio no se observaron correlaciones de las expresiones relativas de AdipoR1 y de AdipoR2 con el índice de masa corporal, con el perímetro de cintura, con el porcentaje de grasa corporal, con los niveles de triglicéridos, o con la sensibilidad a la insulina determinada por el índice HOMA-R. Es posible que los mecanismos que regulan la expresión de estos receptores en monocitos sean diferentes a los que tienen lugar en tejido adiposo y músculo esquelético.
En el presente trabajo no determinamos los niveles circulantes de adiponectina; otros autores han descrito una correlación positiva entre los niveles séricos de adiponectina y la expresión de AdipoR1 en linfocitos circulantes (29).
Conclusión
Se corroboró en los monocitos de sangre periférica de adultos jóvenes una mayor expresión de AdipoR1 en comparación a AdipoR2. No se observaron diferencias en la expresión relativa de estos receptores cuando se compararon sujetos con sobrepeso y con peso normal de acuerdo al género. No se encontraron correlaciones de la expresión relativa de estos receptores y parámetros antropométricos y bioquímicos relacionados con resistencia a la insulina y ateroesclerosis. Se considera necesario seguir avanzando en la comprensión de los mecanismos que controlan la expresión de los receptores de adiponectina en los monocitos circulantes. Se recomienda realizar otros estudios que involucren población con índice de masa corporal superior a 30 kg/m2 e individuos con obesidad abdominal. Queda por establecer la variación de la expresión de estos receptores a lo largo de la vida, su regulación por factores medioambientales (tipo de dieta y actividad física) y su valor predictivo en la enfermedad vascular ateroesclerótica.
Agradecimientos
A los estudiantes que participaron en el estudio y a Nohora Cifuentes (Salud Estudiantil, Dirección Nacional de Bienestar, Universidad Nacional de Colombia).
Referencias
1. Hall JE, Crook ED, Jones DW, Wofford MR, Dubbert PM. Mechanisms of obesity-associated cardiovascular and renal disease. AM J Med Sci 2002; 324:127-137.
2. Lau DCW, Dhillon B, Yan H, Szmitko PE, Verma S. Adipokines: molecular links between obesity and atherosclerosis Am J Physiol Heart Circ Physiol 2005; 288:H2031-H2041.
3. Osterud B, Bjørklid E. Role of monocytes in atherogenesis. Physiol Rev 2003; 83:1069-1112.
4. Hansson GK. Mechanisms of disease: inflammation, atherosclerosis, and coronary artery disease. N Engl J Med 2005; 352:1685-1695.
5. Charrière G, Cousin B, Arnaud E, André M, Bacou F, Pénicaud L, et al. Preadipocyte conversion to macrophage. Evidence of plasticity. J Biol Chem 2003; 278:9850-9855.
6. Diez JJ, Iglesias P. The role of the novel adipocyte-derived hormone adiponectin in human disease. Eur J Endocrinol 2003;148:293-300.
7. Ryan AS, Berman DM, Nicklas BJ, Sinha M, Gingerich RL, Meneilly GS, et al. Plasma adiponectin and leptin levels, body composition, and glucose utilization in adult women with wide ranges of age and obesity. Diabetes Care 2003;26:2383-2388.
8. Kojima S, Funahashi T, Maruyoshi H, Honda O, Sugiyama S, Kawano H, et al. Levels of the adipocyte-derived plasma protein, adiponectin, have a close relationship with atheroma. Thromb Res 2005;115:483-490.
9. Ukkola O, Santaniemi M. Adiponectin: a link between excess adiposity and associated comorbities? J Mol Med 2002;87:2764-2769.
10. Caballero AE. Endothelial dysfunction in obesity and insulin resistance: a road to diabetes and heart disease. Obes Res 2003;11:1278-1289.
11. Han J, Hajjar DP, Zhou X, Gotto AM Jr, Nicholson AC. Regulation of peroxisome proliferator-activated receptor-gamma-mediated gene expression. A new mechanism of action for high density lipoprotein. J Biol Chem 2002;277:23582-23586.
12. Gallagher D, Heymsfield SB, Heo M, Jebb SA, Murgatroyd PR, Sakamoto Y. Healthy percentage body fat ranges: an approach for developing guidelines based on body mass index. Am J Clin Nutr 2000;72:694-701.
13. Mockus I, Franco F, Montoya M, Alfonso LM, Alzate A. Anthropometric variables of students at a Colombian state university. Acta Med Auxol 1995;27:139-144.
14. Berber A , Gómez-Santos R, Fanghanel G, Sanchez-Reyes L. Anthropometric indexes in the prediction of type 2 diabetes mellitus, hypertension and dyslipidemia in a Mexican population. Int J Obes Relat Metab Disord 2001;25:1794-1799.
15. Lopatynski J, Mardarowicz G, Szczesniak G. A comparative evaluation of waist circumference, waist-to-hip ratio, waist-to-height ratio and body mass index as indicators of impaired glucose tolerance and as risk factors for type-2 diabetes mellitus. Ann Univ Mariae Curie Sklodowska 2003;58:413-419.
16. Kyle UG, Bosaeus I, De Lorenzo AD, Deurenberg P, Elia M, Gómez JM, et al. Bioelectrical impedance analisis-part I: review of principles and methods. Clinical Nutrition 2004;23:1226-1243.
17. Naito HK. Colesterol en Pesce AJ, Kaplan LA, eds. Química Clínica Métodos. Buenos Aires. Editorial Médica Panamericana S.A. 1990 p.1149-1235.
18. Friedewald W, Levy R, Fredrickson D. Estimation of the concentration of low density lipoprotein cholesterol in plasma, without the use of the preparative ultracentrifuge. Clin Chem 1972;18:499-502.
19. Pacini G, Mari A. Methods for clinical assessment of insulin sensitivity and b-cell function. Best Pract Res Clin Endocrinol Metab 2003;17:305-322.
20. Cabezas-Cerrato J, Araújo D. Resistencia a la acción de la insulina. Evolución histórica del concepto. Técnicas para el estudio in vivo en humanos. Endocrinol Nutr 2003;50:396-406.
21. Dörffel Y, Wallukat G, Bochnig N, Homuth V, Herberg M, Dörfell W, et al. Agonistic AT(1) receptor autoantibodies and monocyte stimulation in hypertensive patients. Am J Hypertens 2003;16:827-833.
22. Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Anal Biochem 1987;162:156-159.
23. Civitarese AE, Jenkinson CP, Richardson D, Bajaj M, Cusi K, Kashyap S, et al. Adiponectin receptors gene expression and insulin sensitivity in non-diabetic Mexican Americans with or without a family history of Type 2 diabetes. Diabetologia 2004;47:816-820.
24. Shimada T, Koitabashi A, Fujii Y, Hashimoto T, Hosaka K, Tabei K, et al. PPARgamma mediates NSAIDs-induced upregulation of TFF2 expression in gastric epithelial cells. FEBS Lett 2004;558:33-38.
25. Mavrodieva V. Levy L. Gabriel DW. Improved sampling methods for real-time polymerase chain reaction diagnosis of citrus canker from field samples. Phytopathology 2004;94:61-68.
26. Arya M, Shergill IS, Williamson M, Gommersall L, Arya N, Patel HR. Basic principles of real-time quantitative PCR. Expert Rev Mol Diagn 2005;5:209-219.
27. Epi info. Disponible en: http://www.cica.es/epiinfo/ (consultado noviembre 2005).
28. Chinetti G, Zawadzki C, Fruchart JC, Staels B. Expression of adiponectin receptors in human macrophages and regulation by agonists of the nuclear receptors PPARalpha, PPARgamma, and LXR. Biochem Biophys Res Commun 2004;314:151-158.
29. Alberti L, Gilardini L, Girola A, Moro M, Cavagnini F, Invitti C. Adiponectin receptors gene expression in lymphocytes of obese and anorexic patients. Diabetes, Obes Metab 2007;9:344-349.
30. Kadowaki T, Yamauchi T, Kubota N, Hara K, Ueki K, Tobe K. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J Clin Invest 2006; 116:1784-1792.
31. Rasmussen MS, Lihn AS, Pedersen SB, Bruun JM, Rasmussen M, Richelsen B. Adiponectin receptors in human adipose tissue: effects of obesity, weight loss, and fat depots. Obesity 2006;14:28-35.
32. Beylot M, Pinteur C, Peroni O. Expression of the adiponectin receptors AdipoR1 and AdipoR2 in lean rats and in obese Zucker rats. Metabolism 2006;55:396-401.
33. Staiger H, Kaltenbach S, Staiger K, Stefan N, Fritsche A, Guirguis A, et al. Expression of adiponectin receptor mRNA in human skeletal muscle cells is related to in vivo parameters of glucose and lipid metabolism. Diabetes 2004;53:2195-2201.
Referencias
Hall JE, Crook ED, Jones DW, Wofford MR, Dubbert PM. Mechanisms of obesity-associated cardiovascular and renal disease. AM J Med Sci 2002; 324:127-137.
Lau DCW, Dhillon B, Yan H, Szmitko PE, Verma S. Adipokines: molecular links between obesity and atherosclerosis Am J Physiol Heart Circ Physiol 2005; 288:H2031-H2041.
Osterud B, Bjørklid E. Role of monocytes in atherogenesis. Physiol Rev 2003; 83:1069-1112.
Hansson GK. Mechanisms of disease: inflammation, atherosclerosis, and coronary artery disease. N Engl J Med 2005; 352:1685-1695.
Charrière G, Cousin B, Arnaud E, André M, Bacou F, Pénicaud L, et al. Preadipocyte conversion to macrophage. Evidence of plasticity. J Biol Chem 2003; 278:9850-9855.
Diez JJ, Iglesias P. The role of the novel adipocyte-derived hormone adiponectin in human disease. Eur J Endocrinol 2003;148:293-300.
Ryan AS, Berman DM, Nicklas BJ, Sinha M, Gingerich RL, Meneilly GS, et al. Plasma adiponectin and leptin levels, body composition, and glucose utilization in adult women with wide ranges of age and obesity. Diabetes Care 2003;26:2383-2388.
Kojima S, Funahashi T, Maruyoshi H, Honda O, Sugiyama S, Kawano H, et al. Levels of the adipocyte-derived plasma protein, adiponectin, have a close relationship with atheroma. Thromb Res 2005;115:483-490.
Ukkola O, Santaniemi M. Adiponectin: a link between excess adiposity and associated comorbities? J Mol Med 2002;87:2764-2769.
Caballero AE. Endothelial dysfunction in obesity and insulin resistance: a road to diabetes and heart disease. Obes Res 2003;11:1278-1289.
Han J, Hajjar DP, Zhou X, Gotto AM Jr, Nicholson AC. Regulation of peroxisome proliferator-activated receptor-gamma-mediated gene expression. A new mechanism of action for high density lipoprotein. J Biol Chem 2002;277:23582-23586.
Gallagher D, Heymsfield SB, Heo M, Jebb SA, Murgatroyd PR, Sakamoto Y. Healthy percentage body fat ranges: an approach for developing guidelines based on body mass index. Am J Clin Nutr 2000;72:694-701.
Mockus I, Franco F, Montoya M, Alfonso LM, Alzate A. Anthropometric variables of students at a Colombian state university. Acta Med Auxol 1995;27:139-144.
Berber A , Gómez-Santos R, Fanghanel G, Sanchez-Reyes L. Anthropometric indexes in the prediction of type 2 diabetes mellitus, hypertension and dyslipidemia in a Mexican population. Int J Obes Relat Metab Disord 2001;25:1794-1799.
Lopatynski J, Mardarowicz G, Szczesniak G. A comparative evaluation of waist circumference, waist-to-hip ratio, waist-to-height ratio and body mass index as indicators of impaired glucose tolerance and as risk factors for type-2 diabetes mellitus. Ann Univ Mariae Curie Sklodowska 2003;58:413-419.
Kyle UG, Bosaeus I, De Lorenzo AD, Deurenberg P, Elia M, Gómez JM, et al. Bioelectrical impedance analisis-part I: review of principles and methods. Clinical Nutrition 2004;23:1226-1243.
Naito HK. Colesterol en Pesce AJ, Kaplan LA, eds. Química Clínica Métodos. Buenos Aires. Editorial Médica Panamericana S.A. 1990 p.1149-1235.
Friedewald W, Levy R, Fredrickson D. Estimation of the concentration of low density lipoprotein cholesterol in plasma, without the use of the preparative ultracentrifuge. Clin Chem 1972;18:499-502.
Pacini G, Mari A. Methods for clinical assessment of insulin sensitivity and b-cell function. Best Pract Res Clin Endocrinol Metab 2003;17:305-322.
Cabezas-Cerrato J, Araújo D. Resistencia a la acción de la insulina. Evolución histórica del concepto. Técnicas para el estudio in vivo en humanos. Endocrinol Nutr 2003;50:396-406.
Dörffel Y, Wallukat G, Bochnig N, Homuth V, Herberg M, Dörfell W, et al. Agonistic AT(1) receptor autoantibodies and monocyte stimulation in hypertensive patients. Am J Hypertens 2003;16:827-833.
Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction. Anal Biochem 1987;162:156-159.
Civitarese AE, Jenkinson CP, Richardson D, Bajaj M, Cusi K, Kashyap S, et al. Adiponectin receptors gene expression and insulin sensitivity in non-diabetic Mexican Americans with or without a family history of Type 2 diabetes. Diabetologia 2004;47:816-820.
Shimada T, Koitabashi A, Fujii Y, Hashimoto T, Hosaka K, Tabei K, et al. PPARgamma mediates NSAIDs-induced upregulation of TFF2 expression in gastric epithelial cells. FEBS Lett 2004;558:33-38.
Mavrodieva V. Levy L. Gabriel DW. Improved sampling methods for real-time polymerase chain reaction diagnosis of citrus canker from field samples. Phytopathology 2004;94:61-68.
Arya M, Shergill IS, Williamson M, Gommersall L, Arya N, Patel HR. Basic principles of real-time quantitative PCR. Expert Rev Mol Diagn 2005;5:209-219.
Epi info. Disponible en: http://www.cica.es/epiinfo/ (consultado noviembre 2005).
Chinetti G, Zawadzki C, Fruchart JC, Staels B. Expression of adiponectin receptors in human macrophages and regulation by agonists of the nuclear receptors PPARalpha, PPARgamma, and LXR. Biochem Biophys Res Commun 2004;314:151-158.
Alberti L, Gilardini L, Girola A, Moro M, Cavagnini F, Invitti C. Adiponectin receptors gene expression in lymphocytes of obese and anorexic patients. Diabetes, Obes Metab 2007;9:344-349.
Kadowaki T, Yamauchi T, Kubota N, Hara K, Ueki K, Tobe K. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J Clin Invest 2006; 116:1784-1792.
Rasmussen MS, Lihn AS, Pedersen SB, Bruun JM, Rasmussen M, Richelsen B. Adiponectin receptors in human adipose tissue: effects of obesity, weight loss, and fat depots. Obesity 2006;14:28-35.
Beylot M, Pinteur C, Peroni O. Expression of the adiponectin receptors AdipoR1 and AdipoR2 in lean rats and in obese Zucker rats. Metabolism 2006;55:396-401.
Staiger H, Kaltenbach S, Staiger K, Stefan N, Fritsche A, Guirguis A, et al. Expression of adiponectin receptor mRNA in human skeletal muscle cells is related to in vivo parameters of glucose and lipid metabolism. Diabetes 2004;53:2195-2201.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2007 Revista de la Facultad de Medicina

Esta obra está bajo una licencia Creative Commons Reconocimiento 3.0 Unported.
Derechos de autor
Los autores deben aceptar transferir a la Revista de la Facultad de Medicina los derechos de autor de los artículos publicados. La editorial tiene el derecho del uso, reproducción, transmisión, distribución y publicación en cualquier forma o medio. Los autores no podrán permitir o autorizar el uso de la contribución sin el consentimiento escrito de la revista. Estos archivos están disponibles en https://goo.gl/EfWPdX y https://goo.gl/6zztk4 y deben cargarse en el paso 4 del envío OJS (archivos complementarios).
La carta de cesión de derechos de autor y la de responsabilidad de autoría deben ser entregadas junto con el original.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).





















