Conceptos actuales sobre mecanismos reguladores de la pubertad
Current concepts regarding mechanisms regulating puberty
Palabras clave:
pubertad, fenómenos metabólicos, hipotálamo, receptores LHRH (es)puberty, metablic phenomena, hypothalamus, recptors, LHRH (en)
Actualización
CONCEPTOS ACTUALES SOBRE MECANISMOS REGULADORES DE LA PUBERTAD
Current concepts regarding mechanisms regulating puberty
Alba Fernanda Ruíz-Mejía1, Ismena Mockus-Sivickas2
1 Estudiante Internado, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá.
2 Profesora Titular, Departamento Ciencias Fisiológicas, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá.
Correspondencia: afruizm@unal.edu.co
Recibido:01/02/12/ Enviado a pares: 05/02/12/ Aceptado publicación: 15/02/12/
Resumen
El inicio de la pubertad depende de la activación del eje hipotálamo-hipofisiario-gonadal. Existe una red glial y neuronal que interactúa por medio de moléculas de adhesión, factores de crecimiento, aminoácidos, péptidos y derivados lipídicos, que permiten integrar en el hipotálamo la información del estado metabólico del individuo con la que proviene del medio ambiente determinando el comienzo y mantenimiento de la etapa reproductiva. En los últimos años se ha ampliado la comprensión de los factores que intervienen en la pubertad, aunque no se han dilucido todos los mecanismos participantes. Este artículo revisa algunos de los procesos celulares y moleculares más importantes en la regulación de la secreción pulsátil de GnRH, con mayor énfasis en los conocimientos más recientes.
Palabra clave: pubertad, fenómenos metabólicos, hipotálamo, receptores LHRH (GnRH) (DeCS).
Summary
The onset of puberty depends on activating the hypothalamic-pituitary-gonadal axis. A glial and neuronal network interacts by means of adhesion molecules, growth factors, amino acids, peptides and lipid derivates, leading to information about an individual's metabolic state becoming integrated with that from the environment in the hypothalamus and thereby determining the start of the reproductive stage and its maintenance. Understanding about the factors intervening in puberty has become greater during the last few years, even though all the participating mechanisms have not yet been elucidated. This article reviews some of the most important cellular and molecular processes in regulating pulsatile gonadotropin-releasing hormone (GnRH) secretion, placing greater emphasis on the most recent knowledge.
Key words: puberty, metablic phenomena, hypothalamus, recptors, LHRH (MeSH).
Introducción
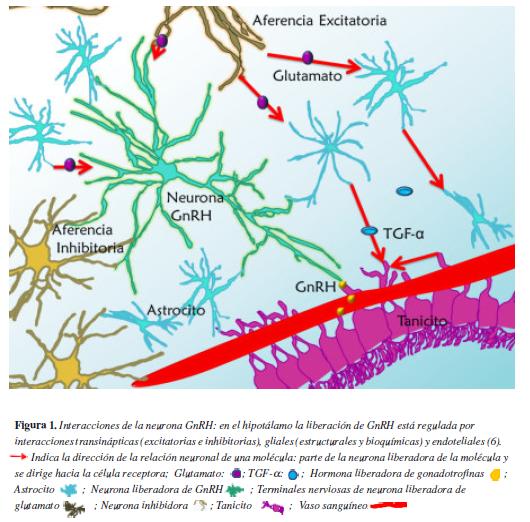
El inicio de la pubertad se caracteriza por un incremento de la secreción pulsátil de gonadoliberina (GnRH) con la consecuente respuesta en la liberación de gonadotropinas. Los eventos que preceden al aumento de la secreción pulsátil de GnRH no han sido totalmente elucidados, pero incluyen en las neuronas que sintetizan este péptido pérdida de inhibición y activación de estímulos aferentes (1). Las neuronas GnRH no sólo están bajo la influencia de señales provenientes de otras neuronas sino también de moléculas originadas en las células gliales (2) (Figura 1). Se ha postulado que variaciones en la secreción y metabolismo de varios neurotransmisores, entre ellos el ácido γ -aminobutírico (GABA) y el glutamato, son desencadenantes del inicio de la pubertad; además, en los últimos años se ha evidenciado que productos de genes supresores de metástasis, como la metastina, conocida también con el nombre de neuropéptido kisspeptina o péptido KiSS-1, desempeñan un papel importante en el control de la secreción pulsátil de GnRH (3,4).
Regulación transináptica
Existen dos tipos de aferencias en las neuronas GnRH, por un lado están las estimuladoras que secretan aminoácidos excitatorios y el péptido Kiss, por el otro las aferencias inhibidoras de neuronas GABAérgicas y las liberadoras de péptidos opiodes (5, 6).
Al inicio de la pubertad, aumenta el tono del glutamato y disminuye la secreción de GABA en el hipotálamo, sin haber un consenso sobre cual evento es el primero en ocurrir (7). Estudios realizados en rata hembra al inicio de la pubertad, han demostrado un aumento de los niveles de la glutamato deshidrogenasa (enzima que cataliza la síntesis de glutamato) y una disminución de la glutamina sintasa (que convierte el glutamato en glutamina). Estas modificaciones se acompañan de un aumento de la capacidad del hipotálamo de liberar glutamato (8). A su vez hay un incremento de expresión de receptores de kainato en las neuronas GnRH (9).
En primates se ha observado que las neuronas GABAérgicas inhiben la secreción de GnRH durante el desarrollo prepuberal (10). No se han detectado cambios en la expresión hipotalámica de mRNA de la glutamato descarboxilasa-65 (GAD-65) y GAD-67 (las enzimas responsables de la síntesis de GABA) durante el desarrollo sexual del primate (11).
En los roedores, la reducción en el control inhibitorio GABAérgico se acompaña de la disminución del tono inhibidor de los péptidos opiodes sobre las neuronas GnRH. Los opiodes forman parte de un control homeostático adicional de la cascada de eventos que llevan al aumento puberal de la secreción de GnRH (12).
Regulación mediana por GLÍA
La secreción de GnRH ocurre en la eminencia media; en este órgano los axones de las neuronas GnRH se dirigen hacia el endotelio fenestrado, presentando interacciones estructurales y funcionales con las células astrocitarias y ependimogliales, estas últimas conocidas como tanicitos (13).
Los astrocitos y tanicitos envían prolongaciones que sostienen al axón y secretan múltiples moléculas que controlan la liberación de GnRH. En la capa intermedia de la eminencia media, las células ependimogliales forman estructuras similares a canalículos que contribuyen a dirigir la prolongación axonal hacia el sistema porta hipotálamo-hipofisiario (14). A nivel de la terminal nerviosa, los tanicitos envían prolongaciones que funcionan como una barrera entre la neurona y el endotelio fenestrado. Antes del pico GnRH, el tanicito sufre cambios morfológicos que permiten un contacto directo entre la terminal nerviosa y el endotelio (15) (Figura 2).
Entre las moléculas implicadas en la interacción glía-neurona, están los factores de crecimiento como el factor de crecimiento similar a la insulina tipo I (IGF-I) -que estimula la secreción de GnRH-, el factor de crecimiento fibroblástico básico (bFGF) -asociado a la diferenciación y supervivencia neuronal-, y los miembros de la familia del factor de crecimiento epidérmico (EGF) -como el factor de crecimiento transformante α (TGF-α) y la neuregulina (NRG)- (16). Estos factores actúan sobre receptores pertenecientes a la familia de los receptores EGF, los erbB, de los cuales hay 4 tipos (erbB1 al erbB4) (17).
El TGF-α es un péptido anclado a la membrana, sintetizado en los astrocitos hipotalámicos y en los tanicitos. Es escindido por la enzima convertidora del factor de necrosis tumoral (TACE), la cual es activada por la unión del glutamato a receptores ionotrópicos y metabotrópicos de la glía. El receptor de TGFα, erbB1, presente en los astrocitos y tanicitos, es una tirosina kinasa, que recluta al correceptor erbB2 formando un heterodímero. Antes del pico de GnRH, la activación de erbB1 promueve la síntesis de TGF-α y de la prostaglandina E2 (PGE2), y estimula la formación de prolongaciones en el tanicito (13, 18).
Las neuregulinas son péptidos anclados a la membrana sintetizados por los astrocitos hipotalámicos. Su receptor erbB4, presente sólo en los astrocitos, recluta al correceptor erbB2 y desencadena la producción de PGE2 (19).
Los astrocitos secretan glutamato en respuesta al estímulo de las neuronas glutamatérgicas. Este neurotransmisor es reconocido por receptores de glutamato ionotrópicos (AMPA/kainato) y metabotrópicos (mGluR5) (19). Su activación es seguida por la translocación de los receptores erbB hacia la superficie celular y la fosforilación dependiente de la unión TGF-α/NRG. Así en los astrocitos hipotalámicos el glutamato favorece la interacción de los ligandos TGF-α/NRG con sus receptores (20).
El desarrollo sexual ocurre más temprano en el ratón transgénico que sobreexpresa el gen TGFα (21). La interrupción de la síntesis del receptor erbB-2 hipotalámico provoca pubertad retardada. También se observa retardo en el desarrollo sexual en el ratón transgénico que sobreexpresa una proteína erbB-4 truncada (DNerb4) a la cual le falta el dominio intracelular, lo que hace que actúe como un receptor dominante negativo impidiendo la activación de la vía de señalización (22). Una mutación puntual de los receptores erbB1 en el ratón DNerbB-4 acentúa el efecto de una sola deficiencia, sugiriendo que ambos sistemas son activados de una manera coordinada al comienzo de la pubertad femenina (23).
El factor de crecimiento transformante β1 (TGFβ1), producido por los tanicitos, no hace parte de la familia del EGF, pero ejerce una acción sobre la morfología de la glía por medio de la activación de diversas metaloproteinasas relacionadas con los procesos de retracción de las prolongaciones (18,24). Su síntesis es promovida por la PGE2, molécula liberada por los astrocitos y los tanicitos (25).
La acción de PGE2, una de las moléculas más importantes en la liberación de GnRH, es mediada por el receptor presente en las células ependimogliales, y neuronas GnRH (16).
En la relación estructural entre glía y neuronas GnRH intervienen moléculas de adhesión celular (26). Existen al menos 3 familias, entre ellas las moléculas de adhesión celular neuronal -expresadas en las células gliales y las terminales nerviosas GnRH-, la contactina -presente en las neuronas GnRH, donde se encuentra anclada al glicosilfosfatidilinositol y se une al receptor similar a la tirosina fosfatasa β de los astrocitos (27)-, y la molécula de adhesión celular sináptica o SynCAM1 -expresada tanto en neuronas como en glía y que se une a receptores erbB4 presentes en los astrocitos- (28).
Regulación neuroendocrina: leptina, kisspeptina y hormonas esteroides
Leptina. La maduración sexual sólo ocurre cuando hay suficiente energía almacenada para permitir la reproducción. La leptina, un importante indicador del estado metabólico, desencadena mecanismos centrales relacionados con la pubertad (28). Los humanos con mutaciones en el gen de leptina o de sus receptores presentan hipogonadismos hipogonadotrópicos (29,30).
No se ha encontrado expresión de receptores de leptina en las neuronas GnRH sugiriendo que otras vías de señalización intervienen en la relación energía acumulada y pubertad (31). En ratas púberes, el ayuno (de corta duración) se acompaña de niveles circulantes bajos de gonadotropinas y disminución del mRNA de KiSS-1 en el hipotálamo (32); a su vez la administración intracerebral de KiSS-1 en estos animales incrementa las concentraciones sanguíneas de LH y evita el hipogonadismo (33). Se ha observado en el ratón que el 40% de las células del núcleo arcuato coexpresan mRNA del KiSS-1 y el mRNA del receptor de leptina. Además en el ratón deficiente de leptina (ob/ ob) los niveles del mRNA de KiSS-1 en el núcleo arcuato son menores que en el ratón silvestre y aumentan con la administración de leptina (34).
Kisspeptina. El vínculo entre el estado metabólico y el comienzo de la pubertad fue durante años motivo de estudio en la regulación del eje hipotálamo hipofisiario (35). La búsqueda de la relación entre el aumento de los niveles de leptina y la liberación pulsátil de GnRH en la pubertad llevó al descubrimiento de la kisspeptina o KiSS1 (36).
La kisspeptina es una proteína de 145 aminoácidos, codificada por el gen KISS1 (Kiss1 en animales). Su clivaje proteolítico origina péptidos de 54, 14, 13 o 10 aminoácidos (Kp54, Kp-14, Kp-13 o Kp-10). La Kp-54 se encontró por primera vez en una línea celular de melanoma y recibió el nombre de metastina por sus propiedades inhibitorias del crecimiento metastático (37). Posteriormente, las kisspeptinas fueron identificadas en placenta, páncreas, sistema cardiovascular e hipotálamo donde se observó su importancia en la regulación del eje gonadotropo (38,39).
En los primates, los cuerpos celulares de las neuronas kisspeptina se encuentran principalmente en el núcleo arcuato o infundibular (40). En ratas hembras jóvenes, la inyección central de kisspeptina adelanta la pubertad (41). En monos de ambos géneros la administración de kisspeptina provoca la liberación de GnRH (42).
A su vez, la Kp-10 administrada de manera central o periférica en monos machos jóvenes castrados, aumenta los niveles circulantes de LH y este incremento desaparece cuando se realiza un tratamiento previo con un antagonista del receptor de GnRH (43). Se ha demostrado que la kisspeptina es estimuladora de la liberación de gonadotropinas en otros mamíferos, incluyendo al hombre, siendo considerada en la actualidad la estimuladora más potente del eje GnRH gonadotropinas (44,45,46).
La mayoría de las neuronas GnRH expresan el receptor de kisspeptina (KISS1R) (47). Este receptor se conoce también con los nombres de GPR54, AXOR12, hOT7TI75 y receptor de metastina (48). Para la nomenclatura de receptores en humanos y no humanos se recomienda utilizar respectivamente KISS1R y Kiss1r para los genes y KISS1R y kiss1R para la proteína receptora (49).
KISS1R es un receptor de 398 aminoácidos; se expresa en hipotálamo, hipófisis, placenta y páncreas (50). Es un receptor acoplado a proteína G con vías de señalización en las que participan la fosfolipasa C, el inositol (1,4,5)trifosfato, el ácido araquidónico y las proteínas activadoras de la mitosis (MAP kinasas) (51).
La cantidad de mRNA de KiSS1 y de GPR54 aumenta en el hipotálamo del humano en el momento de la pubertad sugiriendo que el incremento de la señalización mediada por GPR54 contribuye a la activación puberal de la secreción de GnRH. También un mayor número de contactos entre las neuronas KiSS-1 y las GnRH podría intervenir en el desencadenamiento de la pubertad (52,53). A su vez, se ha observado que las neuronas KiSS-1 expresan receptores GnRH y que la GnRH inhibe la secreción de KiSS1, sugiriendo un retrocontrol negativo de GnRH sobre KiSS1 (54).
Los ratones de ambos sexos con alteración en la expresión de Kiss1 o GPR54 presentan hipogonadismo hipogonadotropo (55,56). En humanos, las mutaciones del receptor de kisspeptina provocan pérdida de la función del receptor que se manifiesta en la clínica con niveles plasmáticos bajos de gonadotropinas y de hormonas sexuales, gónadas no desarrollas, in-fertilidad y en el caso de los hombres criptorquidia y micropene (57,58). Se han descrito varios casos en pubertad precoz central con mutaciones activantes de KISS1 y se ha registrado un solo caso de mutación activante de GPR54 (59, 60,61).
Esteroides sexuales. Las hormonas esteroides cumplen una función reguladora al estimular la síntesis de diversos receptores, neurohormonas y otras sustancias en hipotálamo e hipófisis.
Se ha demostrado en el cerebro de ratón adulto que las neuronas KiSS-1 presentan receptores de estrógenos y que los niveles de mRNA de KiSS-1 pueden ser modulados mediante la administración de estos esteroides sexuales (62, 63). Además, los anticuerpos que bloquean la señal kisspeptina-GPR54 en ratas adultas hembras inhiben el pico ovulatorio de LH (64).
En modelos de neuronas GnRH inmortalizadas que se estimulan con esteroides, se observa un incremento de la expresión de dos tipos de receptores para la PGE2, mediado por TGF-β1 proveniente de astrocitos de la eminencia media (65,66).
Las hormonas esteroides desempeñan una función reguladora en la relación endotelio hipotalámico y tanicitos al estimular la expresión y actividad de la óxido nítrico sintasa. Su producto, el óxido nítrico, activa la enzima ciclooxigenasa presente en los tanicitos, con la consecuente producción de PGE2 (67).
Conclusiones
El inicio de la pubertad es el resultado de un proceso de activación de las neuronas GnRH que implica la interacción bioquímica y morfológica con subpoblaciones neuronales y glía, a través de estímulos inhibitorios y excitatorios transinápticos, moléculas de adhesión, factores de transcripción, derivados lipídicos y factores de crecimiento.
La kisspeptina parece ser el estímulo más potente de la síntesis de GnRH descubierto hasta la fecha. Las neuronas kisspeptina participan en las vías hipotalámicas que median las influencias del desarrollo, la nutrición, el metabolismo y el medio ambiente sobre el eje hipotálamohipófisis-gonadal (68).
El mecanismo involucrado en el inicio de la liberación pulsátil de GnRH sigue sin ser comprendido en su totalidad, asimismo se desconocen los determinantes para el comienzo más temprano de la pubertad en las mujeres en comparación con los hombres.
De gran importancia son los descubrimientos del efecto de las mutaciones en la compleja red de modulación de las neuronas GnRH. La alteración de ligandos o receptores que median la interacción interglial o glía-neurona están asociados al retardo o comienzo precoz de la pubertad. Las alteraciones en la síntesis, expresión o interacción de kisspeptina y su receptor provocan hipogonadismo hipogonadotrópico.
Referencias
1. Sisk CL, Foster DL. The neural basis of puberty and adolescence. Nature Neurosci. 2004;7:1040-7.
2. Ojeda S, Roth C, Mungenast A, Heger S, Mastronardi C, Parent Anne, Lomniczi A, Jung H. Neuroendocrine mechanism controlling female puberty: new approaches, new concepts. Int J Androl. 2006; 29:256-63.
3. Dungan HM, Clifton DK, Steiner RA. Minireview: kisspeptin neurons as central processors in the regulation of gonadotropin-releasing hormone secretion. Endocrinology. 2006; 147:1154-8.
4. Krsmanovic LZ, Hu L, Leung PK, Feng H, Catt KJ. The hypothalamic GnRH pulse generator: multiple regulatory mechanisms. Trends Endocrinol Metab. 2009; 20:402-8.
5. Bouligand J, Ghervan C, Trabado S, Brailly Tabard S, Guichon Mantel A, Young J. Genetics defects in GNRH1: A paradigm of hypothalamic congenital gonadotropin deficiency. Brain Research. 2010; 1364:3-9.
6. Genazzani AR, Bernardi F, Monteleone P, Luisi S, Luisi M. Neuropeptides, neurotransmitters, neurosteroids, and the onset of puberty. Ann N Y Acad Sci. 2000; 900:1-9.
7. Clarkson J, Herbison AE. Development of GABA and glutamate signaling at the GnRH neuron in relation to puberty. Mol Cell Endocrinol. 2006; 254-255:32-8.
8. Roth CL, McCormackb AL, Lomniczi A, Mungenast AE, Ojeda SR. Quantitative proteomics identifies a change in glial glutamate metabolism at the time of female puberty. Mol Cell Endocrinol. 2006;254-255:51-59.
9. Eyigor O, Jennes L. Expression of glutamate receptor subunit mRNAs in gonadotropin-releasing hormone neurons during the sexual maturation of the female rat. Neuroendocrinology. 1997; 66:122-9.
10. Terasawa, E., and Fernandez, D.L. Neurobiological mechanisms of the onset of puberty in primates. Endocr Rev. 2001; 22:111-51.
11. El Majdoubi M, Sahu A, Plant TM. Changes in hypothalamic gene expression associated with the arrest of pulsatile gonadotropin-releasing hormone release during infancy in the agonadal male rhesus monkey. Endocrinology. 2000; 141:3273-77.
12. Becú-Villalobos D, Libertun C. Development of gonadotropin-releasing hormone (GnRH) neuron regulation in the female rat. Cell Mol Neurobiol. 1995;15:165-176.
13. Ojeda SR, Lomniczi A, Sandau US. Glial-gonadotrophin hormone (GNRH) neurone interactions in the median eminence and the control of gnrh secretion. J Neuroendocrinol. 2008; 20:732-42.
14. Kozlowski, Coates PW. Ependymoneuronal specialization between LHRH fiber and cells of the cerebro-ventricular system. Cell Tissue Res. 1985; 242:301 -11.
15. Prevot V, Croix D, Bouret S, Dutoit S, Tramu G, Stefano GB, Beauvillain JC. Definitive evidence for the existence of morphological plasticity in the external zone of the median eminence during the rat estrous cycle: implication of neuro-glio-endothelial interactions in gonadotropin-releasing hormone release. Neuroscience. 1999; 94:809-19.
16. Ojeda SR, Ma YJ. Epidermal growth factor tyrosine kinase receptors and the neuroendocrine control of mammalian puberty. Mol Cell Endocrinol. 1998; 140:101-6.
17. Prevot V, Rio C, Cho G, Lomniczi A, Heger S, Neville C, Ojeda S. Normal female sexual development requires neuregulin-erbB receptor signaling in hypothalamic astrocytes. J Neurosci. 2003; 23:230-9.
18. Lomniczi A, Cornea A, Costa ME, Ojeda SR. Hypothalamic tumor necrosis factor-a converting enzyme (TACE) mediates excitatory aminoacid dependent neuron-to-glia signaling in the neuroendocrine Brain. J Neuroscience. 2006; 26:51-62.
19. Ojeda S, Ma Y. Epidermal growth factor tyrosine kinase receptors and the neuroendocrine control of mammalian puberty. Mol Cell Endocrinol. 1998; 140:101-6.
20. Dziedzic B, Prevot V, Lomniczi A, Cornea A, Ojeda S. Neuron-to-glia signaling mediated by excitatory amino acid receptors regulates erbB receptor function in astroglial cell of the neuroendocrine brain. J Neurosci. 2003; 23:915-26.
21. Rage F, Hill DF, Sena-Esteves M, Breakefield XO, Coffey RJ, Costa ME, et ál. Targeting transforming growth factor alpha expression to discrete loci of the neuroendocrine brain induces female sexual precocity. Proc Natl Acad Sci USA. 1997; 94:2735-40.
22. Prevot V, Rio C, Cho Gyeong, Lomniczi A, Heger S, Neville C, et ál. Normal female sexual development requires neuregulin-erbB receptor signaling in hypothalamic astrocytes. J Neurosci. 2003; 23:230-9.
23. Prevot V, Lomniczi A, Corfas G, Ojeda S. ErbB-1 and erbB-4 receptors act in concert to facilitate female sexual development and mature reproductive function. Endocrinology. 2005; 146:1465-72.
24. Prevot V, Cornea A, Mungenast A, Smiley , Ojeda SR. Activation of erbB-1 signaling in tanycytes of the median eminence stimulates transforming growth factor beta 1 release via prostaglandin E2 production and induces cell plasticity. J Neurosci. 2003;23:10622-10632.
25. Ma Y, Emde K, Rage F, Wetsel W, Ojeda S. Hypothalamic astrocytes respond to transforming growth factor- á with the secretion of neuroactive substances that stimulate the release of luteinizing hormone-releasing hormone. Endocrinology. 1997;138:19-25.
26. Ojeda S, Lomniczi A, Sandau U. Contribution of glial-neuronal interaction to the neuroendocrine control of female puberty. Eur J Neurosci. 2010; 32:2003-10.
27. Parent AS, Mungenast AE, Lomniczi A, Sandau US, Peles E, Bosch MA, Ronnekleiv OK, Ojeda SR. A contactin-receptor-like protein tyrosine phosphatase beta complex mediates adhesive communication between astroglial cells and gonadotrophin-releasing hormone neurones. J Neuroendocrinol. 2007; 19:847-859.
28. Casanueva FF, Dieguez C. Neuroendocrine regulation and actions of leptin. Neuroendocrinol. 1999; 20:317-63.
29. Strobel A, Issad T, Camoin L, Ozata M, Strosberg AD. A leptin mis sense mutation associated with hypogonadism and morbid obesity. Nat Genet. 1998; 18:213-15.
30. Clément K, Vaisse C, Lahlou N, Cabrol S, Pelloux V, Cassuto D, Gourmelen M, et ál. A mutation in the human leptin receptor gene causes obesity and pituitary dysfunction. Nature. 1998; 392:398-401.
31. Terasawa E, Fernandez DL. Neurobiological mechanisms of the onset of puberty in primates. Endocr Rev. 2001; 22:111-51.
32. Castellano JM, Bentsen AH, Mikkelsen JD, Tena-Sempere M. Kisspeptins: bridging energy homeostasis and reproduction. Brain Res. 2010; 1364:129-138.
33. Gottscgh ML, Cunningham MJ, Smith JT, Popa SM, Acohido BV, Croqley WF, et ál. A role for kisspeptins in the regulation of gonadotropin secretion in the mouse. Endocrinology. 2004; 145:4073-77.
34. Smith JT, Acohido BV, Clifton DK, Steiner RA. Kiss-1 neurones are direct targets for leptin in the ob/ ob mouse. J Neuroendocrinol. 2006; 18:298-303.
35. Quennell JH, Mulligan AC, Tups A, Liu X, Phipps SJ, Kemp CJ, Herbison AE, et ál. Leptin indirectly regulates gonadotropin-releasing hormone neuronal function. Endocrinology. 2009; 150:2805-12.
36. Fernandez-Fernandez R, Martini AC, Navarro VM, Castellano JM, Diequez C, Aguilar E, et ál. Novel signals for the integration of energy balance and reproduction. Moll Cell Endocrinol. 2006; 254:127-32.
37. Lee JH, Miele ME, Hicks DJ, Philips KK, Trent JM, Weissman BE, Welch DR. KiSS-1, a novel malignant melanoma metastasis-suppressor gene. J Natl Cancer Inst. 1996; 88:1731-37.
38. Ohtaki T, Shintani Y, Honda S, Matsumoto H, Hori A, Kanehashi K, et ál. Metastasis suppressor gene KiSS-1 encodes peptide ligand of a G-proteincoupled receptor. Nature. 2001; 411:613-17.
39. Mead EJ, Maguire JJ, Kuc RE, Davenport AP. Kisspeptins are novel potent vasoconstrictors in humans, with a discrete localization of their receptor, g proteincoupled receptor 54, to atherosclerosis-prone vessels. Endocrinology. 2007; 148:140-7.
40. Iijima N, Takumi K, Sawai N, Ozawa H. An immunohistochemical study on the expressional dynamics of kisspeptin neurons relevant to GnRH neurons using a newly developed anti-kisspeptin antibody. J Mol Neurosci. 2011;43146-54.
41. Navarro VM, Castellano JM, Fernández-Fernández R, Barreiro ML, Roa J, Sanchez-Criado JE, et ál. Developmental and hormonally regulated messenger ribonucleic acid expression of KiSS-1 and its putative receptor, GPR54, in rat hypothalamus and potent luteinizing hormone-releasing activity of KiSS-1 peptide. Endocrinology. 2004; 145:4565-74.
42. Plant TM, Ramaswamy S, Diprieto MJ. Repetitive activation of hypothalamic G protein- coupled receptor 54 with intravenous pulses of kisspeptin in the juvenile monkey (Macaca mulatta) elicits a sustained train of gonadotropin-releasing hormone discharges. Endocrinology. 2006; 147:1007-13.
43. Shahab M, Mastronardi C, Seminara S, Crowley W, et ál. Increased hypothalamic GPR54 signaling: A potential mechanism for initiation of puberty in primates. Proc Natl Acad Sci USA. 2005;102:2129-2134.
44. Kaiser UB, Kuohung W. KiSS-1 and GPR54 as new players in gonadotropin regulation and puberty. Endocrine. 2005; 26:277-84.
45. Roseweir AK, Millar RP. The role of kisspeptin in the control of gonadotrophin secretion. Hum Reprod Update. 2009;15:203-12.
46. Tena-Sempere M. The roles of kisspeptins and Gprotein coupled receptor-54 in pubertal development. Curr Opin Pediatr. 2006; 18:442-7.
47. Seminara SB. Metastin and its G protein -coupled receptor, GPR54: critical pathway modulating GnRH secretion. Front Neuroendocrinol. 2005; 26:131-8.
48. MuirAI, Chamberlain L, Elshourbagy NA, Michalocih D, Moore DJ, Calamari A, et ál. AXOR 12, a novel human G protein-coupled receptor, activated by the peptide KiSS-1. J Biol Chem. 2001; 276:28969-75.
49. Kirby HR, Maguire JJ, Colledge WH, Davenport AP. International Union of Basic and Clinical Pharmacology. LXXVII. Kisspeptin receptor nomenclature, distribution, and function. Pharmacol Rev. 2010;62:565-78.
50. Martinez-Fuentes AJ, Molina M, Vázquez-Martínez R, Gahete MD. Expression of functional KISS1 and KISS1R system is altered in human pituitary adenomas: evidence for apoptotic action ok kisspeptin 10. Eur J Endocrinol. 2011; 164:355-62.
51. Castaño JP, Martínez-Fuentes AJ, Gutiérrez-Pascual E, Vaudry H, Tena-Sempere M, Malagón MM. Intracellular signaling pathways activated by kisspeptins through GPR54: do multiple signals underlie function diversity?. Peptides. 2009;30:10-15.
52. Clarkson J, Han SK, Liu X, Herbison AE. Neurobiological mechanisms underlying kisspepin activation of gonadotropin-releasing hormone (GnRH) neurons at puberty. Mol Cell Endocrinol. 2010; 324:45-50.
53. Ramaswamy S, Guerriero KA, Gibbs RB, Plant TM. Structural interactions between kisspeptin and GnRH neurons in the mediobasal hypothalamus of the male rhesus monkey (Macaca mulata) as revealed by double immunofluorescence and confocal microscopy. Endocrinology. 2008;149:4387-95.
54. Quaynor S, Hu L, Leung PK, Feng H, Mores N, Krsmanovic LZ, et ál. Expression of a functional g protein-coupled receptor 54-kisspeptin autoregulatory system in hypothalamic gonadotropin-releasing hormone neurons. Mol Endocrinol. 2007; 21:3062-70.
55. Funes S, Hedrick JA, Vassileva G, Markowitz L, Abbondanzo S, Golovko A, et ál. The KiSS-1 receptor GPR54 is essential for the development of the murine reproductive system. Biochem Biophys Res Commun. 2003;312:1357-63.
56. Lapatto R, Pallais JC, Zhang D, Chan YM, Mahan A, Cerrato F, et ál. Kiss 1-/- mice exhibit more variable hypogonadism than Gpr54-/- mice. Endocrinology. 2007; 148:4927-36.
57. Iovane A, Aumas C, De Roux N. New insights in the genetics of isolated hypoginadotropic hypogonadism. Eur J Endocrinol. 2004;151:83-8.
58. Semple R, Topaloglu K. The recent genetics of hypogonadotrophic hypogonadism-novel insights and new questions. Clin Endocrinol. 2010;72:427-35.
59. Silveira L.G, Noel S. D, Silveira-Neto A.P, Abreu A. P, Brito V. N, Santos M. G, et ál. Mutations of the KISS1 gene disorders of puberty. J Clinic Endocrinol Metab. 2010;95:2276-2280.
60. Gontijo S, Tusset C, Latronico A. Impact of mutations in kisspeptin and neurokinin B signaling pathways on human reproduction. Brain Research. 2010;1364:72-80
61. Teles MG, Bianco SD, Brito VN, Trarbach EB, Kuohung W, S Xu, et ál. A GPR54- activating mutation in a patient with central precocious puberty. N Engl J Med. 2008; 358:709-15.
62. Smith JT, Dungan HM, Stoll EA, Gottsch ML, Braun Rem Eacker SM, et ál. Differential regulation of KiSS-1 m RNA expression by sex steroids in the brain of the male mouse. Endocrinology. 2005;146:2976-84.
63. Smith JT, Cunningham MJ, Rissman EF, Clifton DK, Steiner RA. Regulation of Kiss 1 gene expression in the brain of the female mouse. Endocrinology. 2005; 146:3686-92.
64. Adachi S, Yamada S, Takatsu Y, Matsui H, Kinoshita M, Takase K, et al. Involvement of anteroventral periventricular metastin/kisspeptin neurons in estrogen positive feedback action on luteinizing hormone release in female rats. J Reprod Dev. 2007; 53:367-78.
65. Rage F, Ju B, Ma Y, Ojeda S. Estradiol enhances prostaglandin E2 receptor gene expression in luteinizing hormone-releasing hormone neurons and facilitates the LHRH response to PGE2 by activating a glia-to-neuron signaling pathway. J Neurosci. 1997; 17:9145-56.
66. Buchanan C, Mahesh V, Brann D. Estrogen-astrocyte-luteinizing hormone-releasing hormone signaling: a role for transforming growth factor-â1. Biol reprod. 2000; 62:1710-21.
67. Seranno S, d´Angemont de Tassigny X, Estrella C, Loyens A, Kasparov S, Leroy D, et ál. Role of estradiol in the dynamic control of tanycyte plasticity mediated by vascular endothelial cells in the median eminence. Endocrinology. 2010; 151:1760-72.
68. Castellano JM, Bentsen AH, Sánchez-Garrido MA, Ruiz-Pino F, Romero M, Garcia-Galiano D, et ál. Early metabolic programming of puberty onset: impact of changes in postnatal feeding and rearing conditions on the timing of puberty and development of the hypothalamic kisspeptin system. Endocrinology. 2011;152:3396-3408.
Referencias
Sisk CL, Foster DL. The neural basis of puberty and adolescence. Nature Neurosci. 2004;7:1040-7.
Ojeda S, Roth C, Mungenast A, Heger S, Mastronardi C, Parent Anne, Lomniczi A, Jung H. Neuroendocrine mechanism controlling female puberty: new approaches, new concepts. Int J Androl. 2006; 29:256-63.
Dungan HM, Clifton DK, Steiner RA. Minireview: kisspeptin neurons as central processors in the regulation of gonadotropin-releasing hormone secretion. Endocrinology. 2006; 147:1154-8.
Krsmanovic LZ, Hu L, Leung PK, Feng H, Catt KJ. The hypothalamic GnRH pulse generator: multiple regulatory mechanisms. Trends Endocrinol Metab. 2009; 20:402-8.
Bouligand J, Ghervan C, Trabado S, Brailly Tabard S, Guichon Mantel A, Young J. Genetics defects in GNRH1: A paradigm of hypothalamic congenital gonadotropin deficiency. Brain Research. 2010; 1364:3-9.
Genazzani AR, Bernardi F, Monteleone P, Luisi S, Luisi M. Neuropeptides, neurotransmitters, neurosteroids, and the onset of puberty. Ann N Y Acad Sci. 2000; 900:1-9.
Clarkson J, Herbison AE. Development of GABA and glutamate signaling at the GnRH neuron in relation to puberty. Mol Cell Endocrinol. 2006; 254-255:32-8.
Roth CL, McCormackb AL, Lomniczi A, Mungenast AE, Ojeda SR. Quantitative proteomics identifies a change in glial glutamate metabolism at the time of female puberty. Mol Cell Endocrinol. 2006;254-255:51-59.
Eyigor O, Jennes L. Expression of glutamate receptor subunit mRNAs in gonadotropin-releasing hormone neurons during the sexual maturation of the female rat. Neuroendocrinology. 1997; 66:122-9.
Terasawa, E., and Fernandez, D.L. Neurobiological mechanisms of the onset of puberty in primates. Endocr Rev. 2001; 22:111-51.
El Majdoubi M, Sahu A, Plant TM. Changes in hypothalamic gene expression associated with the arrest of pulsatile gonadotropin-releasing hormone release during infancy in the agonadal male rhesus monkey. Endocrinology. 2000; 141:3273-77.
Becú-Villalobos D, Libertun C. Development of gonadotropin-releasing hormone (GnRH) neuron regulation in the female rat. Cell Mol Neurobiol. 1995;15:165-176.
Ojeda SR, Lomniczi A, Sandau US. Glial-gonadotrophin hormone (GNRH) neurone interactions in the median eminence and the control of gnrh secretion. J Neuroendocrinol. 2008; 20:732-42.
Kozlowski, Coates PW. Ependymoneuronal specialization between LHRH fiber and cells of the cerebro-ventricular system. Cell Tissue Res. 1985; 242:301 -11.
Prevot V, Croix D, Bouret S, Dutoit S, Tramu G, Stefano GB, Beauvillain JC. Definitive evidence for the existence of morphological plasticity in the external zone of the median eminence during the rat estrous cycle: implication of neuro-glio-endothelial interactions in gonadotropin-releasing hormone release. Neuroscience. 1999; 94:809-19.
Ojeda SR, Ma YJ. Epidermal growth factor tyrosine kinase receptors and the neuroendocrine control of mammalian puberty. Mol Cell Endocrinol. 1998; 140:101-6.
Prevot V, Rio C, Cho G, Lomniczi A, Heger S, Neville C, Ojeda S. Normal female sexual development requires neuregulin-erbB receptor signaling in hypothalamic astrocytes. J Neurosci. 2003; 23:230-9.
Lomniczi A, Cornea A, Costa ME, Ojeda SR. Hypothalamic tumor necrosis factor-a converting enzyme (TACE) mediates excitatory aminoacid dependent neuron-to-glia signaling in the neuroendocrine Brain. J Neuroscience. 2006; 26:51-62.
Ojeda S, Ma Y. Epidermal growth factor tyrosine kinase receptors and the neuroendocrine control of mammalian puberty. Mol Cell Endocrinol. 1998; 140:101-6.
Dziedzic B, Prevot V, Lomniczi A, Cornea A, Ojeda S. Neuron-to-glia signaling mediated by excitatory amino acid receptors regulates erbB receptor function in astroglial cell of the neuroendocrine brain. J Neurosci. 2003; 23:915-26.
Rage F, Hill DF, Sena-Esteves M, Breakefield XO, Coffey RJ, Costa ME, et ál. Targeting transforming growth factor alpha expression to discrete loci of the neuroendocrine brain induces female sexual precocity. Proc Natl Acad Sci USA. 1997; 94:2735-40.
Prevot V, Rio C, Cho Gyeong, Lomniczi A, Heger S, Neville C, et ál. Normal female sexual development requires neuregulin-erbB receptor signaling in hypothalamic astrocytes. J Neurosci. 2003; 23:230-9.
Prevot V, Lomniczi A, Corfas G, Ojeda S. ErbB-1 and erbB-4 receptors act in concert to facilitate female sexual development and mature reproductive function. Endocrinology. 2005; 146:1465-72.
Prevot V, Cornea A, Mungenast A, Smiley , Ojeda SR. Activation of erbB-1 signaling in tanycytes of the median eminence stimulates transforming growth factor beta 1 release via prostaglandin E2 production and induces cell plasticity. J Neurosci. 2003;23:10622-10632.
Ma Y, Emde K, Rage F, Wetsel W, Ojeda S. Hypothalamic astrocytes respond to transforming growth factor- á with the secretion of neuroactive substances that stimulate the release of luteinizing hormone-releasing hormone. Endocrinology. 1997;138:19-25.
Ojeda S, Lomniczi A, Sandau U. Contribution of glial-neuronal interaction to the neuroendocrine control of female puberty. Eur J Neurosci. 2010; 32:2003-10.
Parent AS, Mungenast AE, Lomniczi A, Sandau US, Peles E, Bosch MA, Ronnekleiv OK, Ojeda SR. A contactin-receptor-like protein tyrosine phosphatase beta complex mediates adhesive communication between astroglial cells and gonadotrophin-releasing hormone neurones. J Neuroendocrinol. 2007; 19:847-859.
Casanueva FF, Dieguez C. Neuroendocrine regulation and actions of leptin. Neuroendocrinol. 1999; 20:317-63.
Strobel A, Issad T, Camoin L, Ozata M, Strosberg AD. A leptin mis sense mutation associated with hypogonadism and morbid obesity. Nat Genet. 1998; 18:213-15.
Clément K, Vaisse C, Lahlou N, Cabrol S, Pelloux V, Cassuto D, Gourmelen M, et ál. A mutation in the human leptin receptor gene causes obesity and pituitary dysfunction. Nature. 1998; 392:398-401.
Terasawa E, Fernandez DL. Neurobiological mechanisms of the onset of puberty in primates. Endocr Rev. 2001; 22:111-51.
Castellano JM, Bentsen AH, Mikkelsen JD, Tena-Sempere M. Kisspeptins: bridging energy homeostasis and reproduction. Brain Res. 2010; 1364:129-138.
Gottscgh ML, Cunningham MJ, Smith JT, Popa SM, Acohido BV, Croqley WF, et ál. A role for kisspeptins in the regulation of gonadotropin secretion in the mouse. Endocrinology. 2004; 145:4073-77.
Smith JT, Acohido BV, Clifton DK, Steiner RA. Kiss-1 neurones are direct targets for leptin in the ob/ ob mouse. J Neuroendocrinol. 2006; 18:298-303.
Quennell JH, Mulligan AC, Tups A, Liu X, Phipps SJ, Kemp CJ, Herbison AE, et ál. Leptin indirectly regulates gonadotropin-releasing hormone neuronal function. Endocrinology. 2009; 150:2805-12.
Fernandez-Fernandez R, Martini AC, Navarro VM, Castellano JM, Diequez C, Aguilar E, et ál. Novel signals for the integration of energy balance and reproduction. Moll Cell Endocrinol. 2006; 254:127-32.
Lee JH, Miele ME, Hicks DJ, Philips KK, Trent JM, Weissman BE, Welch DR. KiSS-1, a novel malignant melanoma metastasis-suppressor gene. J Natl Cancer Inst. 1996; 88:1731-37.
Ohtaki T, Shintani Y, Honda S, Matsumoto H, Hori A, Kanehashi K, et ál. Metastasis suppressor gene KiSS-1 encodes peptide ligand of a G-proteincoupled receptor. Nature. 2001; 411:613-17.
Mead EJ, Maguire JJ, Kuc RE, Davenport AP. Kisspeptins are novel potent vasoconstrictors in humans, with a discrete localization of their receptor, g proteincoupled receptor 54, to atherosclerosis-prone vessels. Endocrinology. 2007; 148:140-7.
Iijima N, Takumi K, Sawai N, Ozawa H. An immunohistochemical study on the expressional dynamics of kisspeptin neurons relevant to GnRH neurons using a newly developed anti-kisspeptin antibody. J Mol Neurosci. 2011;43146-54.
Navarro VM, Castellano JM, Fernández-Fernández R, Barreiro ML, Roa J, Sanchez-Criado JE, et ál. Developmental and hormonally regulated messenger ribonucleic acid expression of KiSS-1 and its putative receptor, GPR54, in rat hypothalamus and potent luteinizing hormone-releasing activity of KiSS-1 peptide. Endocrinology. 2004; 145:4565-74.
Plant TM, Ramaswamy S, Diprieto MJ. Repetitive activation of hypothalamic G protein- coupled receptor 54 with intravenous pulses of kisspeptin in the juvenile monkey (Macaca mulatta) elicits a sustained train of gonadotropin-releasing hormone discharges. Endocrinology. 2006; 147:1007-13.
Shahab M, Mastronardi C, Seminara S, Crowley W, et ál. Increased hypothalamic GPR54 signaling: A potential mechanism for initiation of puberty in primates. Proc Natl Acad Sci USA. 2005;102:2129-2134.
Kaiser UB, Kuohung W. KiSS-1 and GPR54 as new players in gonadotropin regulation and puberty. Endocrine. 2005; 26:277-84.
Roseweir AK, Millar RP. The role of kisspeptin in the control of gonadotrophin secretion. Hum Reprod Update. 2009;15:203-12.
Tena-Sempere M. The roles of kisspeptins and Gprotein coupled receptor-54 in pubertal development. Curr Opin Pediatr. 2006; 18:442-7.
Seminara SB. Metastin and its G protein -coupled receptor, GPR54: critical pathway modulating GnRH secretion. Front Neuroendocrinol. 2005; 26:131-8.
MuirAI, Chamberlain L, Elshourbagy NA, Michalocih D, Moore DJ, Calamari A, et ál. AXOR 12, a novel human G protein-coupled receptor, activated by the peptide KiSS-1. J Biol Chem. 2001; 276:28969-75.
Kirby HR, Maguire JJ, Colledge WH, Davenport AP. International Union of Basic and Clinical Pharmacology. LXXVII. Kisspeptin receptor nomenclature, distribution, and function. Pharmacol Rev. 2010;62:565-78.
Martinez-Fuentes AJ, Molina M, Vázquez-Martínez R, Gahete MD. Expression of functional KISS1 and KISS1R system is altered in human pituitary adenomas: evidence for apoptotic action ok kisspeptin 10. Eur J Endocrinol. 2011; 164:355-62.
Castaño JP, Martínez-Fuentes AJ, Gutiérrez-Pascual E, Vaudry H, Tena-Sempere M, Malagón MM. Intracellular signaling pathways activated by kisspeptins through GPR54: do multiple signals underlie function diversity?. Peptides. 2009;30:10-15.
Clarkson J, Han SK, Liu X, Herbison AE. Neurobiological mechanisms underlying kisspepin activation of gonadotropin-releasing hormone (GnRH) neurons at puberty. Mol Cell Endocrinol. 2010; 324:45-50.
Ramaswamy S, Guerriero KA, Gibbs RB, Plant TM. Structural interactions between kisspeptin and GnRH neurons in the mediobasal hypothalamus of the male rhesus monkey (Macaca mulata) as revealed by double immunofluorescence and confocal microscopy. Endocrinology. 2008;149:4387-95.
Quaynor S, Hu L, Leung PK, Feng H, Mores N, Krsmanovic LZ, et ál. Expression of a functional g protein-coupled receptor 54-kisspeptin autoregulatory system in hypothalamic gonadotropin-releasing hormone neurons. Mol Endocrinol. 2007; 21:3062-70.
Funes S, Hedrick JA, Vassileva G, Markowitz L, Abbondanzo S, Golovko A, et ál. The KiSS-1 receptor GPR54 is essential for the development of the murine reproductive system. Biochem Biophys Res Commun. 2003;312:1357-63.
Lapatto R, Pallais JC, Zhang D, Chan YM, Mahan A, Cerrato F, et ál. Kiss 1-/- mice exhibit more variable hypogonadism than Gpr54-/- mice. Endocrinology. 2007; 148:4927-36.
Iovane A, Aumas C, De Roux N. New insights in the genetics of isolated hypoginadotropic hypogonadism. Eur J Endocrinol. 2004;151:83-8.
Semple R, Topaloglu K. The recent genetics of hypogonadotrophic hypogonadism-novel insights and new questions. Clin Endocrinol. 2010;72:427-35.
Silveira L.G, Noel S. D, Silveira-Neto A.P, Abreu A. P, Brito V. N, Santos M. G, et ál. Mutations of the KISS1 gene disorders of puberty. J Clinic Endocrinol Metab. 2010;95:2276-2280.
Gontijo S, Tusset C, Latronico A. Impact of mutations in kisspeptin and neurokinin B signaling pathways on human reproduction. Brain Research. 2010;1364:72-80
Teles MG, Bianco SD, Brito VN, Trarbach EB, Kuohung W, S Xu, et ál. A GPR54- activating mutation in a patient with central precocious puberty. N Engl J Med. 2008; 358:709-15.
Smith JT, Dungan HM, Stoll EA, Gottsch ML, Braun Rem Eacker SM, et ál. Differential regulation of KiSS-1 m RNA expression by sex steroids in the brain of the male mouse. Endocrinology. 2005;146:2976-84.
Smith JT, Cunningham MJ, Rissman EF, Clifton DK, Steiner RA. Regulation of Kiss 1 gene expression in the brain of the female mouse. Endocrinology. 2005; 146:3686-92.
Adachi S, Yamada S, Takatsu Y, Matsui H, Kinoshita M, Takase K, et al. Involvement of anteroventral periventricular metastin/kisspeptin neurons in estrogen positive feedback action on luteinizing hormone release in female rats. J Reprod Dev. 2007; 53:367-78.
Rage F, Ju B, Ma Y, Ojeda S. Estradiol enhances prostaglandin E2 receptor gene expression in luteinizing hormone-releasing hormone neurons and facilitates the LHRH response to PGE2 by activating a glia-to-neuron signaling pathway. J Neurosci. 1997; 17:9145-56.
Buchanan C, Mahesh V, Brann D. Estrogen-astrocyte-luteinizing hormone-releasing hormone signaling: a role for transforming growth factor-â1. Biol reprod. 2000; 62:1710-21.
Seranno S, d´Angemont de Tassigny X, Estrella C, Loyens A, Kasparov S, Leroy D, et ál. Role of estradiol in the dynamic control of tanycyte plasticity mediated by vascular endothelial cells in the median eminence. Endocrinology. 2010; 151:1760-72.
Castellano JM, Bentsen AH, Sánchez-Garrido MA, Ruiz-Pino F, Romero M, Garcia-Galiano D, et ál. Early metabolic programming of puberty onset: impact of changes in postnatal feeding and rearing conditions on the timing of puberty and development of the hypothalamic kisspeptin system. Endocrinology. 2011;152:3396-3408.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2012 Revista de la Facultad de Medicina

Esta obra está bajo una licencia Creative Commons Reconocimiento 3.0 Unported.
Derechos de autor
Los autores deben aceptar transferir a la Revista de la Facultad de Medicina los derechos de autor de los artículos publicados. La editorial tiene el derecho del uso, reproducción, transmisión, distribución y publicación en cualquier forma o medio. Los autores no podrán permitir o autorizar el uso de la contribución sin el consentimiento escrito de la revista. Estos archivos están disponibles en https://goo.gl/EfWPdX y https://goo.gl/6zztk4 y deben cargarse en el paso 4 del envío OJS (archivos complementarios).
La carta de cesión de derechos de autor y la de responsabilidad de autoría deben ser entregadas junto con el original.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).