Bases moleculares de la inmunotoxicología experimental de la marihuana
Molecular bases of experimental immunotoxicology of marijuana
Palabras clave:
cannabis, abuso de marihuana, toxicología, fenómenos bioquímicos, canabinoides, sistema inmunológico. (es)cannabis, marijuana abuse, toxicology, biochemical phenomena, cannabinoids, immune system (en)
La marihuana es una de las drogas de abuso más antiguas conocidas por la humanidad. Sin embargo, sólo recientemente se han comenzado a comprender los mecanismos bioquímicos que están detrás de los efectos toxicos de la droga en el sistema inmune. Los modelos experimentales in vitro e in vivo , tanto en animales como en humanos, muestran un claro patrón de alteración inmunológica, apuntando hacia la supresión de la respesta inmune de tipo celular Th1-dependiente. En estos eventos la participación de los receptores para canabinoides expresados en la superficie de los inmunocitos es muy importante.
ACTUALIZACIÓN
Guillermo Orlando Narváez Quintero 1 , Carlos Arturo Guerrero Fonseca 2
1. Químico Farmacéutico, MSc en Bioquímica. Universidad Nacional de Colombia, Bogotá
2. Médico MSc en Farmacología, MSc en Genética, PhD, Profesor Asociado, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá.
Correspondencia: guerra039@yahoo.com
Resumen
La marihuana es una de las drogas de abuso más antiguas conocidas por la humanidad. Sin embargo, sólo recientemente se han comenzado a comprender los mecanismos bioquímicos que están detrás de los efectos toxicos de la droga en el sistema inmune. Los modelos experimentales in vitro e in vivo , tanto en animales como en humanos, muestran un claro patrón de alteración inmunológica, apuntando hacia la supresión de la respesta inmune de tipo celular Th1-dependiente. En estos eventos la participación de los receptores para canabinoides expresados en la superficie de los inmunocitos es muy importante.
Palabras clave: cannabis, abuso de marihuana, toxicología, fenómenos bioquímicos, canabinoides, sistema inmunológico.
Narváez GO, Guerrero CA. Bases moleculares de la inmunotoxicología experimental de la marihuana. Rev Fac Med Univ Nac Colomb. 2006; 54: 290-300.
Summary
Marijuana is one of the oldest drugs known by humankind; however, only recently the biochemical mechanism behind the toxicodinamics effects have begun becoming clear. The experimental models, in vitro and in vivo, both in animals and humans, show a clear tendency of immune alteration, pointing out suppression of the Th1-dependent immune response. In these events the involvement of cannabinoid receptors on the surface of immunocites are remarkable.
Key words: cannabis, marijuana abuse, toxicology, biochemical phenomena, cannabinoids, immune system.
Narváez GO, Guerrero CA. Molecular bases of experimental immunotoxicology of marijuana. Rev Fac Med Univ Nac Colomb. 2006; 54: 290-300.
Introducción
La marihuana ( Cannabis sativa) es una de las drogas más antiguas conocida por la humanidad, con un valor terapéutico ampliamente reconocido a través de la historia. Si bien los medicamentos manufacturados con base en marihuana fueron utilizados extensamente hasta los años 30 del siglo pasado para el tratamiento de desórdenes convulsivos y como analgésicos. A partir de la década del 40 comenzaron a caer en desuso, a medida que se fueron introduciendo nuevas sustancias con marcadas ventajas farmacológicas (1), especialmente en lo que respecta a los efectos secundarios sobre el sistema nervioso central. No obstante, el empleo de la marihuana como droga de abuso "recreacional" se incrementó en la sociedad occidental, fue entonces retirada de la farmacopea y se crearon leyes que prohibían su uso (2).
Desde el punto de vista científico hubo un nuevo auge en el interés por los canabinoides cuando se identificó (3) y clonó (4) un receptor para estas sustancias presente en el sistema nervioso central. Este receptor se denominó CB1. Posteriormente en 1993, Munro y colaboradores (5) identificaron un receptor periférico para canabinoides denominado CB2, el cual se expresa principalmente en las células del sistema inmune. Todos estos hallazgos se enriquecieron cuando se identificaron los ligandos endógenos para los receptores de canabinoides. Se produjo entonces bastante inquietud acerca del papel de los "endocanabinoides" en el mantenimiento de la homeostasis neuronal e inmunológica y sobre las consecuencias fisiológicas que se presentarían al alterar estos equilibrios por el consumo de canabinoides exógenos.
De esta forma, es posible comenzar a analizar desde el punto de vista bioquímico la correlación observada desde años atrás entre el consumo de marihuana y la alteración de la respuesta inmune (6-9).
Estructura, distribución y ligandos de los receptores para canabinoides
Los receptores de canabinoides CB1 y CB2 están constituidos por una sola cadena polipeptídica con siete alfa-hélices transmembranares, con 473 y 360 residuos aminoacídicos respectivamente (10).
En humanos, el receptor CB1 se expresa principalmente en el sistema nervioso central y en las neuronas periféricas. En el sistema inmune, este receptor se expresa en forma modesta en linfocitos B, T y monocitos (1). Por otra parte, el receptor de canabinoides CB2, se expresa en las células del sistema inmune, donde es particularmente abundante. Las diversas subpoblaciones de inmunocitos difieren en la cantidad de expresión de este receptor así: células B más que las células NK más que los monocitos más que los neutrófilos más que los linfocitos T CD8+ más que los linfocitos T CD4 + (11-14). En el año 2002, se descubrió la presencia de los receptores CB1 y CB2 en células dendríticas humanas (10-15).
Con respecto a los ligandos que se unen a los mencionados receptores se tienen los canabinoides clásicos encontrados en la marihuana . En esta planta se han identificado más de 60 canabinoides pertenecientes a derivados tricíclicos del dibenzopirano (16). Adicionalmente a los canabinoides clásicos, se tienen los denominados canabinoides endógenos o endocanabinoides , cuyo miembro prototipo es la anandamida, la cual es un derivado amídico del ácido araquidónico (17).
Bases moleculares de la inmunotoxicología de la marihuana: aproximaciones experimentales
Tanto el receptor de canabinoides CB1 como el receptor CB2 regulan negativamente la actividad de la enzima adenilato ciclasa, lo cual es llevado a cabo a través de una proteína G inhibidora que está acoplada con estos receptores (18-20). En el sistema inmune, la inhibición de la actividad de la adenilato ciclasa a través de este mecanismo se ha comprobado específicamente en células T, B y macrófagos, surgiendo entonces la pregunta de cuáles son los efectos en la regulación de la respuesta inmune al disminuirse las concentraciones intracelulares del cAMP, producto de la reacción que cataliza la mencionada enzima.
Diversas investigaciones han demostrado que la inhibición de la adenilato ciclasa puede alterar la transcripción de determinadas citocinas, siendo uno de los principales ejemplos la alteración en la síntesis de la interleucina-2 (IL-2)(21-23). Esta citocina, crítica en la inmunidad mediada por células, tiene como principal función inducir la expansión clonal y la proliferación de las células T estimuladas por un antígeno y por otras señales accesorias; también está involucrada en la activación de las células asesinas naturales, de las células T citotóxicas y de los macrófagos (24).
En 1999, Herring y colaboradores (23), investigaron el probable mecanismo bioquímico a través del cual el canabinol inhibía significativamente la secreción de IL- 2 a partir de timocitos de ratón activados en condiciones in vitro . Su trabajo señaló que el tratamiento de los timocitos con el canabinol inhibía la unión al DNA de los factores de transcripción CREB (Proteína de unión al elemento de respuesta de cAMP) y NF- k B (Factor nuclear para la cadena k de inmunoglobulina), los cuales son reguladores importantes de la transcripción del gen de la IL-2 en estas células.
Se confirmó adicionalmente que la inhibición en la unión al DNA se debe a alteraciones en la fosforilación de CREB, necesaria para su activación como factor de transcripción positivo y a alteraciones en la fosforilación de la proteína inhibidora I k B, evento también crítico para la liberación del NF-kB y su posterior translocación al núcleo. Estos hallazgos se correlacionan con el efecto que tienen los canabinoides de inhibir la actividad de la adenilato ciclasa, pues la disminución en las concentraciones intracelulares de cAMP altera la actividad de determinadas cinasas, las cuales son responsables de la fosforilación y consecuente activación de los factores de transcripción mencionados (21,25,26).
Igualmente, experimentos in vitro sugerieron que la activación de las células T de bazo, así como de células pertenecientes a la línea EL4 (linfoma de células T de ratón), en presencia de canabinol, conduce a una significativa inhibición en la unión al DNA de los factores nucleares de transcripción NF-AT y AP-1, proteínas también críticas para la regulación transcripcional de la IL-2 (27, 28)
En el año 2000, Klein y colaboradores (29), empleando modelos murinos in vivo evaluaron la influencia del -9-tetrahidrocanabinol (THC) sobre la respuesta de dos citocinas involucradas en la activación de la inmunidad mediada por células, Th1 dependiente: interferón gamma (IFN- ) e interleucina-12 (IL-12). Para ello administraron a los ratones una dosis de 8 mg/kg del THC y 18 horas después hicieron un reto con la administración intravenosa de 5x10 7 células de la bacteria Legionella pneumophila , un patógeno intracelular oportunista causante de neumonías y evaluaron si la droga alteraba el patrón de respuesta de citocinas Th1 ó Th2.
Los ratones infectados con Legionella mostraron movilización preferencial de citocinas de tipo Th1 durante su respuesta inmune (30) y los humanos que se recuperaron de una neumonía por esta bacteria también mostraron una predominancia sérica de citocinas inductoras de respuesta Th1 tales como IL-12 e IFN- g , y no de citocinas inductoras de respuesta Th2 como IL-4 (31). La investigación mostró que la administración de THC a los animales de experimentación conducía a una disminución aproximada del 53 por ciento y del 67 por ciento en la concentración sérica de IL-12 e IFN- g respectivamente a las ocho horas post-infección, con relación al grupo control retado con la bacteria pero no tratado con la droga. Adicionalmente se observó un incremento bastante drástico (171%) en la IL-4 , una citocina preferencial de respuesta tipo Th2.
Otro hallazgo bastante importante de la investigación fue la reversión de los efectos observados cuando se administraron antagonistas CB1 y CB2 selectivos 30 minutos antes del tratamiento con el THC, aportando así evidencia de que ambos receptores están involucrados en los efectos observados con la droga. Este trabajo sugiere que el THC atenúa significativamente el ambiente bioquímico que promueve una respuesta Th1, alterando por consiguiente la respuesta inmune celular, crítica contra los microorganismos intracelulares.
Zhu y colaboradores (32) estudiaron en un modelo in vivo de experimentación murino la alteración en la respuesta inmune ocasionada por THC frente a un reto con células tumorales, evaluando si la droga, a parte de inhibir la secreción de IFN- g e IL-2 observada en otros trabajos, favorece adicionalmente la secreción de interleucinas inmunosupresoras Th3, tal como TGF- b (Factor de crecimiento tumoral beta) e IL-10. Los ratones fueron sometidos a un tratamiento con THC (5mg/kg intraperitoneal, cuatro veces por semana, durante dos semanas) y posteriormente se les implantaron subcutáneamente un total de 5x10 5 células de carcinoma de pulmón de Lewis, continuándose con el tratamiento con la droga cuatro veces por semana hasta finalizar el experimento. A otro grupo de animales con un tratamiento farmacológico igual se les administraron 10 5 células de carcinoma alveolar, evaluándose en ambos grupos el desarrollo del tumor durante los 50 días luego de la implantación. Como control se utilizaron animales inmunodeficientes (SCID).
Se observó que en los ratones a los que se les administraron las células de carcinoma de pulmón de Lewis y que no fueron tratados con el THC, el volumen del tumor fue en promedio de 5200 mm 3 ; mientras que en los animales tratados con el THC el volumen promedio del tumor desarrollado fue de 11600 mm 3 . En forma similar, los ratones a los que se les administró células de carcinoma alveolar y que no fueron tratados con el THC desarrollaron tumores con un volumen promedio de 3000 mm 3 ; en tanto que los tratados con el canabinoide, el volumen promedio alcanzado fue de 13000 mm 3 . Para los ratones inmunodeficientes (SCID) no hubo ninguna diferencia en los volumenes tumorales desarrollados entre el grupo tratado con el THC y el no tratado farmacológicamente, sugiriendo ello que el efecto observado con el THC requiere de un sistema inmune funcional.
Adicionalmente se determinaron las concentraciones de TGF- b , IL-10 e IFN- g en homogenizados de los tumores extraídos de los animales y en los sobrenadantes de cultivos de esplenocitos obtenidos a partir del bazo de los mismos. En el sitio del tumor los animales tratados con el THC presentaron concentraciones incrementadas en un 89 y 82 por ciento de TGF- b e IL-10, respectivamente, con respecto a los animales no tratados con el THC. Además, los animales tratados con la droga mostraron una disminución en la concentración de IFN- g del 61 por ciento. En los cultivos de esplenocitos se observa el mismo patrón, con un incremento de TGF- b del 50 por ciento y de IL-10 del 116 por ciento. Así mismo hubo una disminución en las concentraciones de IFN- g del 43 por ciento. Estos hallazgos sugieren que la inhibición en el efecto antitumoral causado por el THC se debe a un aumento en la secreción de citocinas inmunosupresoras Th3, lo cual se confirmó al realizar un tratamiento con THC y con anticuerpos contra IL-10 y TGF- b observándose la reversión de los efectos inhibidores causados por la droga en la respuesta antitumoral. La reversión de los efectos también se logró con la administración de un antagonista CB2. Hallazgos semejantes fueron obtenidos por McKallip utilizando modelos murinos y células de carcinoma mamario murino, encontrándose que el tratamiento con el THC inducía la sobre-expresión de genes involucrados en la respuesta inmune de tipo Th2 y de genes que codifican para las proteínas SOCS (supresoras de la señalización mediada por citoquinas), e induce paralelamente la represión de genes involucrados en la respuesta inmune de tipo Th1. Estos resultados fueron obtenidos mediante técnicas de microarreglos de DNA empleando el cDNA de los esplenocitos aislados a partir de animales retados con las células cancerosas y tratados con la droga (33).
Investigaciones con inmunocitos humanos han mostrado resultados similares a los observados en los modelos in vitro e in vivo con animales. Por ejemplo, en el año 2002 el grupo de investigación dirigido por Dubinett (34) confirmó que el THC, actuando a través del receptor CB2 estimulaba la secreción de TGF- b en los linfocitos humanos. Además se descubrió que esta citocina inhibía la expresión del receptor CB2 en estas células a través de un mecanismo de regulación autocrino/paracrino.
Igualmente Roth y colaboradores (11) con el objetivo de determinar los efectos del THC sobre la activación de células T humanas, cultivaron células dendríticas extraídas de donantes sanos no drogadictos y las incubaron junto con células T alogénicas, en presencia y ausencia de THC (5 m g/ml). La droga inhibió significativamente la proliferación de las células T antígeno-específicas en un 53 por ciento comparado con un control de células T expuestas solamente al solvente en el cual estaba disuelto el THC. Mediante técnicas de ELISA se determinó que la concentración de IFN- g en los sobrenadantes de los cultivos se redujo en promedio un 50 por ciento, mientras que los niveles de IL-4 se incrementaron un 110 por ciento, conduciendo ello a un drástico cambio en el balance de citocinas Th1/Th2, siendo estos resultados similares a los obtenidos en los estudios in vivo antes mencionados.
También se hizo otro experimento utilizando células T humanas activadas mediante anticuerpos anti-CD3 y anti-CD28, los cuales simulan una estimulación antigénica a través del receptor de célula T, en presencia y ausencia de THC (5 m g/ml). Cuatro días después, las células fueron lavadas y activadas nuevamente en ausencia de THC para determinar si ellas habían madurado hacia un fenotipo Th1, capaz de producir IFN- g , ó hacia un fenotipo Th2, productoras de IL-4. Se evidenció que la exposición a la droga inhibió la capacidad de producir IFN- g en el 60 por ciento del total de las células, observándose un incremento significativo en la producción de IL-4. Consistente con los resultados obtenidos por ELISA, el mRNA para IFN- g e IL-2 se redujo entre un 21-48 por ciento en las células tratadas con 5 m g/ml de THC; mientras que el mRNA de IL-4 e IL-5 se incrementó entre 1.5 y 11,2 veces. Adicionalmente, el tratamiento previo con un antagonista selectivo CB2 impidió los efectos del THC, mientras que un antagonista selectivo CB1 no tuvo mayor incidencia sobre éstos. El trabajo sugiere una fuerte correlación entre los modelos murinos y los estudios con células humanas, confirmándose que el THC actúa a través de receptor, induciendo a las células T hacia una respuesta inmune de tipo Th2, la cual es ineficiente para combatir patógenos intracelulares (35).
Trabajos recientes como el de Yuan y colaboradores (36) realizados con linfocitos humanos apoyan que los canabinoides tienden a suprimir la inmunidad mediada por células fundamentalmente a través de la interferencia con la red de citocinas. Si bien se sabe que este efecto depende principalmente del receptor CB2, no se descarta el hecho de que estos compuestos también ejerzan sus efectos inmunosupresores mediante mecanismos independientes de receptores a través de la modulación de las concentraciones intracelulares de calcio, como lo reportó en el 2003 el grupo de Kaminski (37) utilizando canabidiol y canabinol.
Ahora bien, se conoce que la vía de administración de la marihuana es fundamentalmente a través de las vías respiratorias, mediante la inhalación del humo generado por la combustión parcial de cigarrillos fabricados con las partes secas de la planta. La elevada concentración de canabinoides presentes en la fase alquitránica del humo, hasta cinco veces más que lo contenido en la planta original y sumado a ello el hecho de que el humo es inhalado profundamente y retenido en los pulmones hasta por un tiempo cuatro veces mayor que cuando se fuma tabaco (38), conlleva a que un sólo cigarrillo deposite varios miligramos de canabinoides directamente en el microambiente pulmonar. Teniendo esto en mente, surge automáticamente la pregunta de ¿cuáles pueden ser los efectos del consumo de la droga sobre los macrófagos alveolares, células fagocíticas que constituyen la primera línea de defensa contra patógenos inhalados?
Al respecto, Roth y colaboradores (39) evaluaron la alteración en las funciones efectoras de los macrófagos alveolares aislados a partir de individuos adictos a la marihuana. Se encontró que la droga disminuía en un 27 por ciento la actividad fagocítica hacia Staphylococcus aureus y la actividad bactericida hacia la misma bacteria en un 46 por ciento con relación a un control de macrófagos alveolares obtenidos a partir de sujetos no consumidores de la droga. Simultáneamente se evaluó la capacidad de secreción de citocinas de los macrófagos alveolares aislados de estos individuos consumidores de la droga al ser estimulados con 1 m g/ml de lipopolisacárido, encontrándose que estas células presentaban una inhibición significativa en la secreción de TNF- a , IL-6 y GM-CSF, proteínas importantes en la activación de las funciones efectoras y en el crecimiento y desarrollo de los macrófagos. En forma similar a los hallazgos encontrados con linfocitos T, la marihuana no altera la secreción de la citocina inmunosupresora TGF- b , creándose por consiguiente un desequilibrio entre los estímulos inmunoactivadores y los inmunosupresores provenientes de citocinas.
Una investigación complementaria publicada por el mismo grupo (40), reportó datos similares con respecto a la alteración en la capacidad bactericida de los macrófagos alveolares aislados a partir de individuos consumidores de marihuana. Adicionalmente, este grupo de investigación evaluó si la exposición de los macrófagos a la droga alteraba su capacidad de producción de óxido nítrico, el cual actúa como una importante molécula efectora en macrófagos activados y la inhibición en su síntesis reduciría la respuesta de estas células contra hongos, bacterias, parásitos y células tumorales (41). Adicionalmente a su papel en la inmunidad innata, el óxido nítrico es una molécula señalizadora y reguladora de la inmunidad adaptativa. La síntesis de concentraciones elevadas de óxido nítrico requiere la expresión del gen de la denominada óxido nítrico sintetasa inducible (iNOS), siendo necesario para ello ciertos estímulos tales como la infección por patógenos intracelulares y una estimulación dual por lipopolisacárido (LPS) y ciertas citocinas (IFN- g , TNF- a , ó GM-CSF) (42).
Las observaciones experimentales mostraron que los macrófagos alveolares provenientes de individuos saludables no fumadores tenían potentes actividades antibacteriales contra Staphylococcus aureus , característica que significativamente disminuyó al tratar las células con un inhibidor de la enzima iNOS. Cuando se realizaron experimentos similares con macrófagos obtenidos de fumadores de marihuana, se apreció que la producción de óxido nítrico estaba significativamente disminuida con relación a los macrófagos de los sujetos no fumadores; sugiriendo ello que ésta deficiencia es la responsable de la baja actividad antibacterial observada. Es interesante el hecho de que la adición de citocinas al medio restaura significativa y paralelamente la actividad bactericida y la producción de óxido nítrico en los macrófagos cultivados provenientes de los individuos fumadores. El papel del óxido nítrico en los efectos observados al adicionar las citocinas fue confirmado mediante la adición de un inhibidor de la iNOS, descendiendo nuevamente la actividad antibacteriana.
Adicionalmente a los anteriores resultados, los análisis mediante RT-PCR confirmaron una importante disminución en la expresión del gen de la iNOS en los co-cultivos de los macrófagos obtenidos a partir de consumidores de la droga y Staphylococcus aureus , hecho que se relaciona con la alteración en la síntesis de óxido nítrico observada. La expresión de este gen fue restaurada al adicionar citocinas a los co-cultivos.
Un hecho interesante de mencionar es que el promotor del gen de la iNOS tiene factores en cis específicos para los factores de transcripción CREB y NF-kB (43), cuya activación se sabe es inhibida por los canabinoides (21,23). Este prodría ser el mecanismo molecular involucrado en la inhibición de la expresión del gen de esta enzima en los macrófagos de individuos consumidores de marihuana.
Finalmente, queda la duda de si, por ejemplo, los leucocitos de sangre periférica de individuos consumidores alcanzan a tener la suficiente exposición a la droga como para inducir en ellos los efectos observados en los modelos de experimentación. A este respecto el trabajo publicado en el año 2002 por Nong y colaboradores (44) aportó la primera evidencia de que el consumo de marihuana está asociado con cambios en los patrones de expresión de los receptores CB1 y CB2 en leucocitos mononucleares de sangre periférica. En esta investigación se recolectó sangre tanto de individuos saludables no consumidores de la droga, como de individuos consumidores, observándose mediante técnicas de RT-PCR cuantitativas que el nivel de mRNA de CB1 y CB2 era tres veces mayor en los consumidores de marihuana. Estas observaciones sugieren que las concentraciones plasmáticas de canabinoides alcanzadas en los individuos fumadores de marihuana son suficientes para influir sobre la función de células inmunes circulantes.
Si bien la biodisponibilidad del tetrahidrocanabinol (THC) depende, entre otros factores, del contenido de canabinoides presentes en la planta y de la técnica empleada por el fumador, la absorción por vía inhalatoria es muy rápida y un cigarrillo de un gramo que contiene un 2 por ciento de THC podría aportar entre 0.4 y 10 mg de la droga a la circulación (45). Normalmente se encuentran concentraciones plasmáticas pico entre 100 y 200 ng/ml; y una sola inhalación puede conducir a concentraciones plasmáticas de THC entre 7-18 ng/ml (46-49).
Es de anotar que el contenido de canabinoides presentes en los cigarrillos actuales se ha incrementado como resultado de los sofisticados métodos de cultivo y de las técnicas para el desarrollo de las plantas, por lo tanto, si bien en la década de los 60 y de los 70 del siglo pasado un cigarrillo podía contener aproximadamente 10 mg de THC, un cigarrillo "moderno" puede contener entre 60 y 150 mg (50).
Conclusiones
Los modelos experimentales in vitro e in vivo en animales y ex vivo con células humanas muestran un claro patrón de alteración inmunológica en respuesta a los canabinoides exógenos, apuntando hacia la supresión de la respuesta inmune celular Th1 dependiente, evento mediado a través de la alteración de la red de citocinas que regulan la homeostasis Th1/Th2/Th3, (Figura 1).
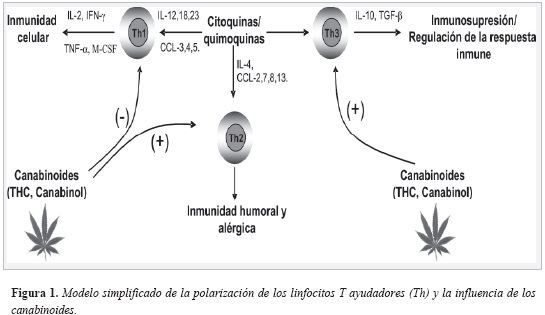
Aunque no se descarta que estos efectos deletéreos puedan estar mediados por mecanismos bioquímicos independientes del receptor, es evidente que la participación de los receptores CB2 es fundamental, más aún, no solamente de aquellos receptores expresados directamente sobre los inmunocitos, sino que también puede estar jugando un papel importante el receptor CB1 expresado en el sistema nervioso central. No obstante, pese a la evidencia bioquímica experimental aquí presentada, hay que ser cuidadoso al inferir la significancia clínica de los efectos inmunotoxicodinámicos observados en los modelos experimentales expuestos, pues no hay la suficiente evidencia que demuestre que en un individuo consumidor de la droga las concentraciones sanguíneas de canabinoides libres, no unidos a proteínas plasmáticas, sean suficientes para ejercer los efectos observados bajo las condiciones experimentales ilustradas. Sin embargo, se han realizado investigaciones con humanos que se correlacionan claramente con los estudios experimentales mencionados, encontrándose que en individuos consumidores de la droga la respuesta proliferativa de linfocitos y su producción de IL-2 se encuentra significativamente disminuida, mostrando paralelamente un incremento en las concentraciones séricas de IL-10 y TGF- b (51). Adicionalmente, los estudios bioquímicos realizados ex vivo con macrófagos alveolares humanos son elocuentes con respecto a la significancia clínica del consumo de marihuana en las vías respiratorias, pues se observó una alteración significativa en la producción de citocinas, similar a la de otros estudios presentados, con la diferencia de que en estas investigaciones los macrófagos empleados eran aquellos aislados a partir del tracto respiratorio de los individuos consumidores de la droga, células que, para evaluar su perfil de secreción de citoquinas, no fueron sometidas a estímulos adicionales con canabinoides.
Todos estos hechos aportan importante evidencia molecular que apoya los hallazgos epidemiológicos, los cuales asocian el uso de la marihuana con un incremento en las infecciones oportunistas, la susceptibilidad a VIH y la posible progresión hacia SIDA (7,9,52,53). Se debe tener en cuenta que en todo proceso infeccioso siempre están implicados tres aspectos: los genes del agente infeccioso, los genes del hospedero y el medio ambiente donde cohabitan los dos. Estudiar un solo aspecto no explica las epidemias. La obligación de todos los profesionales involucrados en el área de la salud es analizar cuándo uno de los tres aspectos es el que se relaciona más con la enfermedad, cuándo se interrelacionan y cuándo es una mezcla conjunta. En este caso, la marihuana y las condiciones en que el individuo drogadicto se desenvuelve juegan un papel importante a tener en cuenta respecto al desplome inmunológico antes, durante y después de la infección por cualquier agente inmunosupresor.
Referencias
1. Berdyshev EV. Cannabinoid receptors and the regulation of immune response. Chem Phys Lipids 2000;108:169-90.
2. Straus SE. Immunoactive cannabinoids: therapeutic prospects for marijuana constituents. Proc Natl Acad Sci USA . 2000; 97: 9363-4.
3. Devane WA, Dysarz FA, 3rd, Johnson MR, Melvin LS, Howlett AC. Determination and characterization of a cannabinoid receptor in rat brain. Mol Pharmacol. 1988; 34: 605-13.
4. Matsuda LA, Lolait SJ, Brownstein MJ, Young AC, Bonner TI. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Nature 1990;346:561-4.
5. Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature. 1993;365:61-5.
6. Nahas GG, Suciu-Foca N, Armand JP, Morishima A. Inhibition of cellular mediated immunity in marihuana smokers. Science . 1974;183:419-20.
7. Tindall B, Cooper DA, Donovan B, Barnes T, Philpot CR, Gold J, et al. The Sydney AIDS Project: development of acquired immunodeficiency syndrome in a group of HIV seropositive homosexual men. Aust N Z J Med. 1988;18:8-15.
8. Cabral GA, Dove Pettit DA. Drugs and immunity: cannabinoids and their role in decreased resistance to infectious disease. J Neuroimmunol . 1998;83:116-23.
9. Friedman H, Newton C, Klein TW. Microbial infections, immunomodulation, and drugs of abuse. Clin Microbiol Rev . 2003;16:209-19.
10. Lutz B. Molecular biology of cannabinoid receptors. Prostaglandins Leukot Essent Fatty Acids . 2002;66:123-42.
11. Roth MD, Baldwin GC, Tashkin DP. Effects of delta- 9 -tetrahydrocannabinol on human immune function and host defense. Chem Phys Lipids . 2002;121:229-39.
12. Bouaboula M, Rinaldi M, Carayon P, Carillon C, Delpech B, Shire D, et al. Cannabinoid-receptor expression in human leukocytes. Eur J Biochem. 1993;214:173-80.
13. Galiegue S, Mary S, Marchand J, Dussossoy D, Carriere D, Carayon P, et al. Expression of central and peripheral cannabinoid receptors in human immune tissues and leukocyte subpopulations. Eur J Biochem. 1995; 232: 54-61.
14. Marchand J, Bord A, Penarier G, Laure F, Carayon P, Casellas P. Quantitative method to determine mRNA levels by reverse transcriptase-polymerase chain reaction from leukocyte subsets purified by fluorescence-activated cell sorting: application to peripheral cannabinoid receptors. Cytometry. 1999;35:227-34.
15. Matias I, Pochard P, Orlando P, Salzet M, Pestel J, Di Marzo V. Presence and regulation of the endocannabinoid system in human dendritic cells. Eur J Biochem . 2002;269:3771-8.
16. Klein TW, Newton C, Larsen K, Lu L, Perkins I, Nong L, et al. The cannabinoid system and immune modulation. J Leukoc Biol. 2003;74:486-96.
17. Howlett AC, Barth F, Bonner TI, Cabral G, Casellas P, Devane WA, et al. International Union of Pharmacology. XXVII. Classification of cannabinoid receptors. Pharmacol Rev. 2002;54:161-202.
18. Kaminski NE. Regulation of the cAMP cascade, gene expression and immune function by cannabinoid receptors. J Neuroimmunol. 1998;83:124-32.
19. Howlett AC, Qualy JM, Khachatrian LL. Involvement of Gi in the inhibition of adenylate cyclase by cannabimimetic drugs. Mol Pharmacol. 1986;29:307-13.
20. Kaminski NE, Koh WS, Yang KH, Lee M, Kessler FK. Suppression of the humoral immune response by cannabinoids is partially mediated through inhibition of adenylate cyclase by a pertussis toxin-sensitive G-protein coupled mechanism. Biochem Pharmacol 1994;48:1899-908.
21. Herring AC, Faubert Kaplan BL, Kaminski NE. Modulation of CREB and NF-kappaB signal transduction by cannabinol in activated thymocytes. Cell Signal 2001;13:241-50.
22. Condie R, Herring A, Koh WS, Lee M, Kaminski NE. Cannabinoid inhibition of adenylate cyclase-mediated signal transduction and interleukin 2 (IL-2) expression in the murine T-cell line, EL4.IL-2. J Biol Chem . 1996;271:13175-83.
23. Herring AC, Kaminski NE. Cannabinol-mediated inhibition of nuclear factor-kappaB, cAMP response element-binding protein, and interleukin-2 secretion by activated thymocytes. J Pharmacol Exp Ther. 1999;291:1156-63.
24. Borish LC, Steinke JW. 2. Cytokines and chemokines. J Allergy Clin Immunol. 2003;111:S460-75.
25. Kaminski NE. Inhibition of the cAMP signaling cascade via cannabinoid receptors: a putative mechanism of immune modulation by cannabinoid compounds. Toxicol Lett. 1998;102-103:59-63.
26. Kaminski NE. Immune regulation by cannabinoid compounds through the inhibition of the cyclic AMP signaling cascade and altered gene expression. Biochem Pharmacol. 1996;52:1133-40.
27. Faubert BL, Kaminski NE. AP-1 activity is negatively regulated by cannabinol through inhibition of its protein components, c-fos and c-jun. J Leukoc Biol. 2000;67:259-66.
28. Yea SS, Yang KH, Kaminski NE. Role of nuclear factor of activated T-cells and activator protein- 1 in the inhibition of interleukin-2 gene transcription by cannabinol in EL4 T-cells. J Pharmacol Exp Ther. 2000;292:597-605.
29. Klein TW, Newton CA, Nakachi N, Friedman H. Delta 9-tetrahydrocannabinol treatment suppresses immunity and early IFN-gamma, IL-12, and IL-12 receptor beta 2 responses to Legionella pneumophila infection. J Immunol. 2000;164:6461-6.
30. Newton CA , Klein TW, Friedman H. Secondary immunity to Legionella pneumophila and Th1 activity are suppressed by delta-9-tetrahydrocannabinol injection. Infect Immun. 1994;62:4015-20.
31. Tateda K, Matsumoto T, Ishii Y, Furuya N, Ohno A, Miyazaki S, et al. Serum cytokines in patients with Legionella pneumonia: relative predominance of Th1-type cytokines. Clin Diagn Lab Immunol. 1998;5:401-3.
32. Zhu LX, Sharma S, Stolina M, Gardner B, Roth MD, Tashkin DP, et al. Delta-9-tetrahydrocannabinol inhibits antitumor immunity by a CB2 receptor-mediated, cytokine-dependent pathway. J Immunol. 2000;165:373-80.
33. McKallip RJ, Nagarkatti M, Nagarkatti PS. Delta-9-tetrahydrocannabinol enhances breast cancer growth and metastasis by suppression of the antitumor immune response. J Immunol. 2005;174:3281-9.
34. Gardner B, Zu LX, Sharma S, Liu Q, Makriyannis A, Tashkin DP, et al. Autocrine and paracrine regulation of lymphocyte CB2 receptor expression by TGF-beta. Biochem Biophys Res Commun. 2002;290:91-6.
35. Farrar JD, Asnagli H, Murphy KM. T helper subset development: roles of instruction, selection, and transcription. J Clin Invest. 2002;109:431-5.
36. Yuan M, Kiertscher SM, Cheng Q, Zoumalan R, Tashkin DP, Roth MD. Delta 9-Tetrahydrocannabinol regulates Th1/Th2 cytokine balance in activated human T cells. J Neuroimmunol. 2002;133:124-31.
37. Kaplan BL, Rockwell CE, Kaminski NE. Evidence for cannabinoid receptor-dependent and -independent mechanisms of action in leukocytes. J Pharmacol Exp Ther. 2003;306:1077-85.
38. Wu TC, Tashkin DP, Djahed B, Rose JE. Pulmonary hazards of smoking marijuana as compared with tobacco. N Engl J Med. 1988;318:347-51.
39. Baldwin GC, Tashkin DP, Buckley DM, Park AN, Dubinett SM, Roth MD. Marijuana and cocaine impair alveolar macrophage function and cytokine production. Am J Respir Crit Care Med. 1997;156:1606-13.
40. Shay AH, Choi R, Whittaker K, Salehi K, Kitchen CM, Tashkin DP, et al. Impairment of antimicrobial activity and nitric oxide production in alveolar macrophages from smokers of marijuana and cocaine. J Infect Dis. 2003;187:700-4.
41. MacMicking J, Xie QW, Nathan C. Nitric oxide and macrophage function. Annu Rev Immunol. 1997;15:323-50.
42. Bogdan C. Nitric oxide and the immune response. Nat Immunol. 2001;2:907-16.
43. Galea E, Feinstein DL. Regulation of the expression of the inflammatory nitric oxide synthase (NOS2) by cyclic AMP. Faseb J. 1999;13:2125-37.
44. Nong L, Newton C, Cheng Q, Friedman H, Roth MD, Klein TW. Altered cannabinoid receptor mRNA expression in peripheral blood mononuclear cells from marijuana smokers. J Neuroimmunol. 2002;127:169-76.
45. Córdoba D. Toxicologia. El Manual Moderno Ltda; 2001:401.
46. National Highway Traffic Safety Administration. http://www.nhtsa.dot.gov/People/injury/research/job185drugs/cannabis.htm
47. Huestis MA, Henningfield JE, Cone EJ. Blood cannabinoids. I. Absorption of THC and formation of 11-OH-THC and THCCOOH during and after smoking marijuana. J Anal Toxicol. 1992;16:276-82.
48. Huestis MA, Henningfield JE, Cone EJ. Blood cannabinoids. II. Models for the prediction of time of marijuana exposure from plasma concentrations of delta 9-tetrahydrocannabinol (THC) and 11-nor-9-carboxy-delta 9-tetrahydrocannabinol (THCCOOH). J Anal Toxicol. 1992;16:283-90.
49. Azorlosa J, Heishman S, Stitzer M, Mahaffey J. Marijuana smoking: effect of varying delta 9-tetrahydrocannabinol content and number of puffs. J Pharmacol Exp Ther. 1992;261:114-122.
50. Ashton CH. Adverse effects of cannabis and cannabinoids. Br J Anaesth. 1999;83:637-49.
51. Pacifici R, Zuccaro P, Pichini S, Roset PN, Poudevida S, Farre M, et al. Modulation of the Immune System in Cannabis Users. JAMA. 2003;289:1929-a-1931.
52. Khalsa J, Genser S, Francis H, Martin B. Clinical consequences of marijuana. J Clin Pharmacol. 2002;42:7S-10.
53. Sidney S, Beck J, Tekawa I, Quesenberry C, Friedman G. Marijuana use and mortality. Am J Public Health. 1997;87:585-590.
Referencias
Berdyshev EV. Cannabinoid receptors and the regulation of immune response. Chem Phys Lipids 2000;108:169-90.
Straus SE. Immunoactive cannabinoids: therapeutic prospects for marijuana constituents. Proc Natl Acad Sci USA . 2000; 97: 9363-4.
Devane WA, Dysarz FA, 3rd, Johnson MR, Melvin LS, Howlett AC. Determination and characterization of a cannabinoid receptor in rat brain. Mol Pharmacol. 1988; 34: 605-13.
Matsuda LA, Lolait SJ, Brownstein MJ, Young AC, Bonner TI. Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Nature 1990;346:561-4.
Munro S, Thomas KL, Abu-Shaar M. Molecular characterization of a peripheral receptor for cannabinoids. Nature. 1993;365:61-5.
Nahas GG, Suciu-Foca N, Armand JP, Morishima A. Inhibition of cellular mediated immunity in marihuana smokers. Science . 1974;183:419-20.
Tindall B, Cooper DA, Donovan B, Barnes T, Philpot CR, Gold J, et al. The Sydney AIDS Project: development of acquired immunodeficiency syndrome in a group of HIV seropositive homosexual men. Aust N Z J Med. 1988;18:8-15.
Cabral GA, Dove Pettit DA. Drugs and immunity: cannabinoids and their role in decreased resistance to infectious disease. J Neuroimmunol . 1998;83:116-23.
Friedman H, Newton C, Klein TW. Microbial infections, immunomodulation, and drugs of abuse. Clin Microbiol Rev . 2003;16:209-19.
Lutz B. Molecular biology of cannabinoid receptors. Prostaglandins Leukot Essent Fatty Acids . 2002;66:123-42.
Roth MD, Baldwin GC, Tashkin DP. Effects of delta- 9 -tetrahydrocannabinol on human immune function and host defense. Chem Phys Lipids . 2002;121:229-39.
Bouaboula M, Rinaldi M, Carayon P, Carillon C, Delpech B, Shire D, et al. Cannabinoid-receptor expression in human leukocytes. Eur J Biochem. 1993;214:173-80.
Galiegue S, Mary S, Marchand J, Dussossoy D, Carriere D, Carayon P, et al. Expression of central and peripheral cannabinoid receptors in human immune tissues and leukocyte subpopulations. Eur J Biochem. 1995; 232: 54-61.
Marchand J, Bord A, Penarier G, Laure F, Carayon P, Casellas P. Quantitative method to determine mRNA levels by reverse transcriptase-polymerase chain reaction from leukocyte subsets purified by fluorescence-activated cell sorting: application to peripheral cannabinoid receptors. Cytometry. 1999;35:227-34.
Matias I, Pochard P, Orlando P, Salzet M, Pestel J, Di Marzo V. Presence and regulation of the endocannabinoid system in human dendritic cells. Eur J Biochem . 2002;269:3771-8.
Klein TW, Newton C, Larsen K, Lu L, Perkins I, Nong L, et al. The cannabinoid system and immune modulation. J Leukoc Biol. 2003;74:486-96.
Howlett AC, Barth F, Bonner TI, Cabral G, Casellas P, Devane WA, et al. International Union of Pharmacology. XXVII. Classification of cannabinoid receptors. Pharmacol Rev. 2002;54:161-202.
Kaminski NE. Regulation of the cAMP cascade, gene expression and immune function by cannabinoid receptors. J Neuroimmunol. 1998;83:124-32.
Howlett AC, Qualy JM, Khachatrian LL. Involvement of Gi in the inhibition of adenylate cyclase by cannabimimetic drugs. Mol Pharmacol. 1986;29:307-13.
Kaminski NE, Koh WS, Yang KH, Lee M, Kessler FK. Suppression of the humoral immune response by cannabinoids is partially mediated through inhibition of adenylate cyclase by a pertussis toxin-sensitive G-protein coupled mechanism. Biochem Pharmacol 1994;48:1899-908.
Herring AC, Faubert Kaplan BL, Kaminski NE. Modulation of CREB and NF-kappaB signal transduction by cannabinol in activated thymocytes. Cell Signal 2001;13:241-50.
Condie R, Herring A, Koh WS, Lee M, Kaminski NE. Cannabinoid inhibition of adenylate cyclase-mediated signal transduction and interleukin 2 (IL-2) expression in the murine T-cell line, EL4.IL-2. J Biol Chem . 1996;271:13175-83.
Herring AC, Kaminski NE. Cannabinol-mediated inhibition of nuclear factor-kappaB, cAMP response element-binding protein, and interleukin-2 secretion by activated thymocytes. J Pharmacol Exp Ther. 1999;291:1156-63.
Borish LC, Steinke JW. 2. Cytokines and chemokines. J Allergy Clin Immunol. 2003;111:S460-75.
Kaminski NE. Inhibition of the cAMP signaling cascade via cannabinoid receptors: a putative mechanism of immune modulation by cannabinoid compounds. Toxicol Lett. 1998;102-103:59-63.
Kaminski NE. Immune regulation by cannabinoid compounds through the inhibition of the cyclic AMP signaling cascade and altered gene expression. Biochem Pharmacol. 1996;52:1133-40.
Faubert BL, Kaminski NE. AP-1 activity is negatively regulated by cannabinol through inhibition of its protein components, c-fos and c-jun. J Leukoc Biol. 2000;67:259-66.
Yea SS, Yang KH, Kaminski NE. Role of nuclear factor of activated T-cells and activator protein- 1 in the inhibition of interleukin-2 gene transcription by cannabinol in EL4 T-cells. J Pharmacol Exp Ther. 2000;292:597-605.
Klein TW, Newton CA, Nakachi N, Friedman H. Delta 9-tetrahydrocannabinol treatment suppresses immunity and early IFN-gamma, IL-12, and IL-12 receptor beta 2 responses to Legionella pneumophila infection. J Immunol. 2000;164:6461-6.
Newton CA , Klein TW, Friedman H. Secondary immunity to Legionella pneumophila and Th1 activity are suppressed by delta-9-tetrahydrocannabinol injection. Infect Immun. 1994;62:4015-20.
Tateda K, Matsumoto T, Ishii Y, Furuya N, Ohno A, Miyazaki S, et al. Serum cytokines in patients with Legionella pneumonia: relative predominance of Th1-type cytokines. Clin Diagn Lab Immunol. 1998;5:401-3.
Zhu LX, Sharma S, Stolina M, Gardner B, Roth MD, Tashkin DP, et al. Delta-9-tetrahydrocannabinol inhibits antitumor immunity by a CB2 receptor-mediated, cytokine-dependent pathway. J Immunol. 2000;165:373-80.
McKallip RJ, Nagarkatti M, Nagarkatti PS. Delta-9-tetrahydrocannabinol enhances breast cancer growth and metastasis by suppression of the antitumor immune response. J Immunol. 2005;174:3281-9.
Gardner B, Zu LX, Sharma S, Liu Q, Makriyannis A, Tashkin DP, et al. Autocrine and paracrine regulation of lymphocyte CB2 receptor expression by TGF-beta. Biochem Biophys Res Commun. 2002;290:91-6.
Farrar JD, Asnagli H, Murphy KM. T helper subset development: roles of instruction, selection, and transcription. J Clin Invest. 2002;109:431-5.
Yuan M, Kiertscher SM, Cheng Q, Zoumalan R, Tashkin DP, Roth MD. Delta 9-Tetrahydrocannabinol regulates Th1/Th2 cytokine balance in activated human T cells. J Neuroimmunol. 2002;133:124-31.
Kaplan BL, Rockwell CE, Kaminski NE. Evidence for cannabinoid receptor-dependent and -independent mechanisms of action in leukocytes. J Pharmacol Exp Ther. 2003;306:1077-85.
Wu TC, Tashkin DP, Djahed B, Rose JE. Pulmonary hazards of smoking marijuana as compared with tobacco. N Engl J Med. 1988;318:347-51.
Baldwin GC, Tashkin DP, Buckley DM, Park AN, Dubinett SM, Roth MD. Marijuana and cocaine impair alveolar macrophage function and cytokine production. Am J Respir Crit Care Med. 1997;156:1606-13.
Shay AH, Choi R, Whittaker K, Salehi K, Kitchen CM, Tashkin DP, et al. Impairment of antimicrobial activity and nitric oxide production in alveolar macrophages from smokers of marijuana and cocaine. J Infect Dis. 2003;187:700-4.
MacMicking J, Xie QW, Nathan C. Nitric oxide and macrophage function. Annu Rev Immunol. 1997;15:323-50.
Bogdan C. Nitric oxide and the immune response. Nat Immunol. 2001;2:907-16.
Galea E, Feinstein DL. Regulation of the expression of the inflammatory nitric oxide synthase (NOS2) by cyclic AMP. Faseb J. 1999;13:2125-37.
Nong L, Newton C, Cheng Q, Friedman H, Roth MD, Klein TW. Altered cannabinoid receptor mRNA expression in peripheral blood mononuclear cells from marijuana smokers. J Neuroimmunol. 2002;127:169-76.
Córdoba D. Toxicologia. El Manual Moderno Ltda; 2001:401.
National Highway Traffic Safety Administration. http://www.nhtsa.dot.gov/People/injury/research/job185drugs/cannabis.htm
Huestis MA, Henningfield JE, Cone EJ. Blood cannabinoids. I. Absorption of THC and formation of 11-OH-THC and THCCOOH during and after smoking marijuana. J Anal Toxicol. 1992;16:276-82.
Huestis MA, Henningfield JE, Cone EJ. Blood cannabinoids. II. Models for the prediction of time of marijuana exposure from plasma concentrations of delta 9-tetrahydrocannabinol (THC) and 11-nor-9-carboxy-delta 9-tetrahydrocannabinol (THCCOOH). J Anal Toxicol. 1992;16:283-90.
Azorlosa J, Heishman S, Stitzer M, Mahaffey J. Marijuana smoking: effect of varying delta 9-tetrahydrocannabinol content and number of puffs. J Pharmacol Exp Ther. 1992;261:114-122.
Ashton CH. Adverse effects of cannabis and cannabinoids. Br J Anaesth. 1999;83:637-49.
Pacifici R, Zuccaro P, Pichini S, Roset PN, Poudevida S, Farre M, et al. Modulation of the Immune System in Cannabis Users. JAMA. 2003;289:1929-a-1931.
Khalsa J, Genser S, Francis H, Martin B. Clinical consequences of marijuana. J Clin Pharmacol. 2002;42:7S-10.
Sidney S, Beck J, Tekawa I, Quesenberry C, Friedman G. Marijuana use and mortality. Am J Public Health. 1997;87:585-590.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2006 Revista de la Facultad de Medicina

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Derechos de autor
Los autores deben aceptar transferir a la Revista de la Facultad de Medicina los derechos de autor de los artículos publicados. La editorial tiene el derecho del uso, reproducción, transmisión, distribución y publicación en cualquier forma o medio. Los autores no podrán permitir o autorizar el uso de la contribución sin el consentimiento escrito de la revista. Estos archivos están disponibles en https://goo.gl/EfWPdX y https://goo.gl/6zztk4 y deben cargarse en el paso 4 del envío OJS (archivos complementarios).
La carta de cesión de derechos de autor y la de responsabilidad de autoría deben ser entregadas junto con el original.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).





















