Integración, carga viral y niveles de ARN mensajero de E2 de VPH 16 en la progresión de lesiones intraepiteliales cervicales
Integration, viral charge and E2 mRNA levels in the progresion of intraepitelial cervical lesions
DOI:
https://doi.org/10.15446/abc.v23n1.63487Palabras clave:
carga viral, integración viral, lesión intraepitelial escamosa de alto grado, lesión intraepitelial escamosa de bajo grado, reacción en cadena de la polimerasa en tiempo real, virus del Papiloma Humano tipo 16. (es)human Papillomavirus 16, HSIL, LSIL, real time polymerase chain reaction, virus integration, viral load. (en)
Descargas
Entre las lesiones intraepiteliales escamosas cervicales (LIE) es importante distinguir aquellas asociadas con mayor riesgo de cáncer de cuello uterino. El objetivo de este trabajo fue evaluar si los niveles de expresión de E2 del VPH16 en mujeres con LIE y con evidencia de integración viral se asocian con el grado de la lesión. Se analizaron 109 cepillados cervicales positivos para VPH 16 provenientes de 19 mujeres sin LIE, 45 mujeres con LIE de bajo grado (LIEBG) y 45 mujeres con LIE de alto grado (LIEAG). Se cuantificó el número de copias de ARNm de E2 y de los genes E2 y E6 mediante PCR en tiempo real para determinar la carga viral (E6) y la proporción E2/E6 para evaluar la integración viral. Se encontraron frecuencias similares de expresión de E2 en LEIBG y LEIAG 15/45 (33 %), la frecuencia en mujeres sin lesión fue menor 3/19 (15,8 %), todos los casos en los que se observó expresión del gen E2 tenían mezcla de ADN viral episomal e integrado. La carga viral aumentó significativamente a mayor grado de la lesión (p=0,049), mientras que la proporción E2/E6 disminuyó (p=0,049). El análisis ROC mostró una baja capacidad de los tres parámetros virales para distinguir entre lesiones de bajo y alto grado. En conclusión, aunque las lesiones con presencia de ADN viral mixto e integrado y expresión de E2 podrían estar en menor riesgo de progresión, y la carga viral y la integración se relacionaron con mayor gravedad de la lesión, su valor clínico como biomarcadores de LEIAG es limitado.
It is important to distinguish among squamous intraepithelial lesions (SIL) those associated with increased risk cervical cancer. Our aim was to evaluate if the expression level of gen E2 in women with SIL and evidence of viral integration is associated to the grade of lesion. Cervical scrapes HPV16 positive from 19 women with normal histology, 45 women with low-grade SIL (LSIL) and 45 women with high-grade SIL (HSIL) were analyzed. Real-time PCR was used to quantify the mRNA of E2 and E2 and E6 genes to calculate viral load (E6) and the ratio E2/E6 to assess viral integration. Similar frequencies of E2 expression were found in LSIL and HSIL15/45 (33 %), the frequency in women without SIL was lower 3/19 (15.8 %), and all cases with E2 gene expression had mixed episomal and integrated viral DNA. The viral load increased significantly with the grade of SIL (p= 0.049), while E2/E6 ratio decreased (p=0.049). The ROC analysis showed low capacity of the three viral parameters analyzed to distinguish between low and high grade SIL. In conclusion although SIL with mixed and integrated viral DNA with E2 expression could be at lower risk of progression, and viral load and integration were associated with higher severity of the lesion, its clinical value as biomarkers of HSIL is limited.
Recibido: 31 de marzo de 2017; Revisión recibida: 12 de octubre de 2017; Aceptado: 21 de noviembre de 2017
RESUMEN
Entre las lesiones intraepiteliales escamosas cervicales (LIE) es importante distinguir aquellas asociadas con mayor riesgo de cáncer de cuello uterino. El objetivo de este trabajo fue evaluar si los niveles de expresión de E2 del VPH16 en mujeres con LIE y con evidencia de integración viral se asocian con el grado de la lesión. Se analizaron 109 cepillados cervicales positivos para VPH 16 provenientes de 19 mujeres sin LIE, 45 mujeres con LIE de bajo grado (LIEBG) y 45 mujeres con LIE de alto grado (LIEAG). Se cuantificó el número de copias de ARNm de E2 y de los genes E2 y E6 mediante PCR en tiempo real para determinar la carga viral (E6) y la proporción E2/E6 para evaluar la integración viral. Se encontraron frecuencias similares de expresión de E2 en LEIBG y LEIAG 15/45 (33 %), la frecuencia en mujeres sin lesión fue menor 3/19 (15,8 %), todos los casos en los que se observó expresión del gen E2 tenían mezcla de ADN viral episomal e integrado. La carga viral aumentó significativamente a mayor grado de la lesión (ρ =0,049), mientras que la proporción E2/E6 disminuyó (ρ=0,049). El análisis ROC mostró una baja capacidad de los tres parámetros virales para distinguir entre lesiones de bajo y alto grado. En conclusión, aunque las lesiones con presencia de ADN viral mixto e integrado y expresión de E2 podrían estar en menor riesgo de progresión, y la carga viral y la integración se relacionaron con mayor gravedad de la lesión, su valor clínico como biomarcadores de LEIAG es limitado.
Palabras clave:
carga viral, integración viral, lesión intraepitelial escamosa de alto grado, lesión intraepitelial escamosa de bajo grado, reacción en cadena de la polimerasa en tiempo real, virus del Papiloma Humano tipo 16.ABSTRACT
It is important to distinguish among squamous intraepithelial lesions (SIL) those associated with increased risk cervical cancer. Our aim was to evaluate if the expression level of gen E2 in women with SIL and evidence of viral integration is associated to the grade of lesion. Cervical scrapes HPV16 positive from 19 women with normal histology, 45 women with low-grade SIL (LSIL) and 45 women with high-grade SIL (HSIL) were analyzed. Real-time PCR was used to quantify the mRNA of E2 and E2 and E6 genes to calculate viral load (E6) and the ratio E2/E6 to assess viral integration. Similar frequencies of E2 expression were found in LSIL and HSIL15/45 (33 %), the frequency in women without SIL was lower 3/19 (15.8 %), and all cases with E2 gene expression had mixed episomal and integrated viral DNA. The viral load increased significantly with the grade of SIL (ρ= 0.049), while E2/E6 ratio decreased (ρ=0.049). The ROC analysis showed low capacity of the three viral parameters analyzed to distinguish between low and high grade SIL. In conclusion although SIL with mixed and integrated viral DNA with E2 expression could be at lower risk of progression, and viral load and integration were associated with higher severity of the lesion, its clinical value as biomarkers of HSIL is limited.
Keywords:
human Papillomavirus 16, HSIL, LSIL, real time polymerase chain reaction, virus integration, viral load.INTRODUCCIÓN
El cáncer de cuello uterino (CCU) es el cuarto cáncer más frecuente en mujeres en el mundo, con una incidencia de 528.000 casos nuevos en el 2012 y una mortalidad de alrededor del 50 %, en especial en países en desarrollo donde ocurre aproximadamente el 85 % de las muertes (Forman et al., 2012; Ferlay et al., 2015; Ginsburg et al., 2016).
Las lesiones premalignas en cuello uterino denominadas lesiones intraepiteliales escamosas de bajo y alto grado (LIEBG y LIEAG) son frecuentes en mujeres jóvenes, con una mayor incidencia entre los 25 y 40 años (Castle et al., 2005; Franceschi et al., 2006; Kalof et al., 2007). La tamización de lesiones precancerosas basada en la citología cervical ha permitido una reducción en la incidencia y mortalidad por cáncer de cuello uterino en países desarrollados, sin embargo en países en desarrollo esta neoplasia permanece como causa importante de mortalidad en las mujeres, debido a programas de tamización inexistentes o poco eficientes (Parkin et al., 2006; Choconta-Piraquive et al., 2010).
Los virus del papiloma humano de alto riesgo (VPH-AR) han sido identificados como agentes causales de cáncer de cuello uterino (Bosch et al., 1995; Walboomers et al., 1999; Zur Hausen, 2002; Schiffman etal., 2016), la detección de VPH-AR aunque es más sensible que la citología para detectar lesiones pre malignas tiene un valor predictivo bajo dado que la mayoría de infecciones son transitorias y solo una fracción pequeña de las mujeres positivas para ADN de virus oncogénicos desarrolla cáncer de cuello uterino (Liaw et al., 2001; Arbyn et al., 2006; Cuzick et al., 2006; Bansal et al., 2008; Choi et al., 2016). Se requiere un test que permita distinguir objetivamente las infecciones transitorias que no van más allá de causar una lesión de bajo grado de las asociadas a transformación oncogénica y mayor riesgo de desarrollar lesiones de alto grado y cáncer cervical. La medición carga viral de los VPH-AR ha sido propuesta como un marcador de riesgo de LIEAG y de CCU (Swan et al., 1999; Andersson et al., 2005; Moberg et al., 2005; Gravitt et al., 2007). De otro lado, dado que la integración del genoma de los VPH de alto riesgo al genoma de la célula infectada es un evento importante en la progresión neoplásica del cérvix (Jeon y Lambert, 1995; Melsheimer et al., 2004; Yu et al., 2005), la medición de la integración también se ha propuesto como marcador de riesgo. El genoma viral integrado, del cual son transcritos los genes tempranos E6 y E7, ha sido detectado en aproximadamente 90 % de los cánceres cervicales (Klaes et al., 1999). En varios estudios se ha demostrado que mediante PCR en tiempo real dirigida a los genes E2 y E6 es posible evaluar el estado físico del ADN de VPH 16 de manera confiable (Peitsaro et al., 2002; Andersson et al., 2005; Fujii et al., 2005; Briolat et al., 2007; Saunier et al., 2008). Estos estudios en general muestran que a mayor grado de lesión hay una mayor proporción de lesiones con el genoma del VPH 16 integrado.
La integración causa la pérdida o ruptura del gen E2 mientras se retiene un fragmento variable del genoma viral que incluye los genes E6 y E7 y la región corriente arriba, esto conlleva a una mayor expresión de los oncogenes virales E6 y E7 por lo que estas células adquieren una ventaja de crecimiento sobre aquellas que sólo tienen ADN viral en estado episomal, y tienen una mayor inestabilidad genómica (Jeon et al., 1995a; Jeon et al., 1995b).
En líneas celulares de queratinocitos cervicales establecidas a partir de lesiones precursoras de bajo grado se ha observado que los genomas de VPH se mantienen en aproximadamente 100 copias en la capa basal, en esas células probablemente ocurre la integración (Stanley et al., 1989; Alazawi et al., 2002; Pett et al., 2007). En la línea celular W12 derivada de una lesión de bajo grado que en pases tempranos tiene 100 copias de episomas y que en pases tardíos presenta el genoma de VPH integrado, se ha demostrado que bajos niveles de E2 expresados desde el promotor homólogo de los episomas de VPH16 pueden inhibir parcialmente la expresión desde el ADN integrado, lo que indica que la pérdida de episomas no sólo está asociada a la selección de células con ADN viral integrado sino que es un evento pre requisito para que esta ocurra (Pett et al., 2006). En este modelo también se ha demostrado que pueden existir, por periodos prolongados, células con ADN de VPH16 integrado seleccionables sin ejercer una ventaja selectiva de crecimiento dentro de una población policlonal hasta que se inicia la pérdida episomal (Pett et al., 2007). Se ha propuesto que la identificación de formas integradas de VPH podría ser un marcador útil de enfermedad progresiva, sin embargo si los genomas integrados son silenciosos a nivel transcripcional su detección sería poco útil (Woodman et al., 2007). La detección de transcritos derivados del integrante puede proveer información de pronóstico relevante, puesto que se ha propuesto que los queratinocitos que contienen formas integradas sólo emergerán una vez se reduzca el número de episomas que expresan E2 (Pett et al., 2006; Saunier et al., 2008). En este contexto el propósito de este trabajo fue evaluar si los niveles de expresión de ARN mensajero (ARNm) de E2 del VPH16 en mujeres con lesión intraepitelial escamosa positiva para VPH16 y con evidencia de integración viral se asocian con el grado de la lesión. Se evaluó también la asociación entre carga viral e integración con el grado de la lesión.
MATERIALES Y MÉTODOS
Población
En total 547 mujeres, que asistieron a la Liga de Lucha contra el cáncer a practicarse una colposcopia luego de un resultado anormal en la citología, fueron enroladas de manera consecutiva entre Octubre de 2010 y Diciembre de 2012. Todas las mujeres consintieron su participación por escrito, el protocolo de investigación fue aprobado por el comité de ética de la institución donde se realizó el estudio.
De estas 547 muestras se seleccionaron para el estudio 109 muestras positivas para VPH tipo 16, provenientes de mujeres a las que se les tomó biopsia durante la colposcopia, el diagnóstico histológico fue obtenido de la historia clínica.
Recolección de datos y de especímenes
A cada participante se le hizo una encuesta sobre factores demográficos y epidemiológicos. Antes de realizar la colposcopia se colectaron dos cepillados cervicales para el análisis de ADN de VPH y ARNm usando un cepillo endocervical, la muestra para ADN se preservó en 5 mL de solución amortiguada de fosfato salino (PBS) con 0,05 % de timerosal y posteriormente se centrifugó a 3000 g por 10 min, el botón celular se homogenizó en 1 mL de tampón TRIS-HCl 10 mM, pH 7,4, y se almacenó a -20 °C hasta su uso. La muestra para los ensayos de ARN se preservó en 500 μL de solución de lisis del estuche comercial SV-RNA (Promega) y se almacenó a -80 °C hasta su uso.
Extracción de ácidos nucleicos de las células cervicales
Para la extracción del ADN de los cepillados cervicales se empleó el estuche comercial genomic DNA pure-link (Invitrogen), el ADN extraído se almacenó a - 80 °C. El ARNm total se extrajo con el estuche comercial SV-RNA (Promega), y luego se realizó retrotranscripción con el estuche comercial Reverse Transcription System (Promega) para obtener el ADN copia (ADNc) que se almacenó a -20 °C.
Evaluación del estado de integración y de la carga viral deVPH16
Se realizó PCR en tiempo real para cuantificar los genes E2 y E6 de VPH16 según las condiciones publicadas previamente (Peitsaro et al., 2002). Las sondas empleadas para E6 y E2 se marcaron en 3' con FAM y MAX respectivamente, y en 5' con BHQ. La PCR cuantitativa se realizó en un equipo Light Cycler 480 de Roche. Con cada grupo de muestras analizadas se construyeron curvas estándar para los genes E6 y E2 de VPH16 mediante amplificación del plásmido PBRHPV16, se hicieron diluciones seriadas 1/10 en un rango entre 3,5 x 107 copias y 35 copias/μL. Todas las curvas fueron generadas en triplicado y se graficaron los Cp (Crossing Point) vs. el ln del número de copias para extrapolar el número de copias de los genes de interés. Para determinar el estado físico del ADN se calculó la proporción E2/E6. La carga viral se definió como el número de copias del gen E6 en 50 ng de ADN genómico de cepillados cervicales positivos para VPH16.
Cuantificación de ARNm de E2
Se empleó la metodología descrita por Pett (Pett et al., 2006) con modificaciones. Se empleó una cantidad similar de ADNc de cada una de las muestras (20ng) de manera que se pudiera hacer una comparación adecuada de la cantidad del ARNm de E2 de VPH 16 independiente da la cantidad de muestra recolectada. Se realizó una PCR cuantitativa absoluta usando el colorante intercalante fluorescente SYBR Green. Para hacer la cuantificación absoluta se construyó una curva estándar con diluciones seriadas 1/10 del plásmido PBR-HPV16 en un rango entre 10 y 107 copias / μL. Cada estándar se analizó en triplicado y las muestras se analizaron en duplicado.
Análisis estadístico
El análisis estadístico se realizó con el programa Stata 12®. Se emplearon pruebas no paramétricas (Mann-Whitney y Kruskal-Wallis) para comparar las medidas de tendencia central de la carga viral, la proporción E2/E6 y los niveles de ARNm de E2 entre grupos. Para efectuar comparaciones múltiples entre parejas de medianas en los casos en los que se rechazaron hipótesis nulas de pruebas de Kruskal-Wallis, se utilizó la prueba de Dunn (Dunn, 1964). Se hicieron transformaciones logarítmicas para presentar gráficamente las distribuciones. Esta transformación muestra las distribuciones de manera más simétrica sin afectar los resultados de las pruebas no paramétricas. Un valor de p menor a 0,05 se consideró estadísticamente significativo. Se evaluó la capacidad de la carga viral, la proporción E2/E6 y los niveles de ARNm de E2 para discriminar entre diferentes tipos de lesión cervical, utilizando modelos ROC estimados mediante métodos de máxima verosimilitud (Pepe et al., 2009). Adicionalmente se compararon curvas ROC calculando intervalos de confianza y valores p para la diferencia entre índices de resumen ROC mediante métodos de bootstraping (Pepe et al., 2005).
RESULTADOS
En este estudio se analizaron 109 mujeres positivas para VPH16: 19 mujeres sin lesiones intraepiteliales cervicales, 45 mujeres con LIEBG y 45 mujeres con LIEAG. Las características demográficas de los sujetos de estudio se presentan en la tabla 1. Las mujeres sin lesión eran mayores (edad promedio 41 años), y de nivel socioeconómico bajo en comparación con los grupos de LIEBG y LIEAG. Las mujeres con LIEAG y LIEBG tuvieron promedios de edad similares, 34 y 37 años respectivamente. Las diferencias en escolaridad y estrato socioeconómico no fueron estadísticamente significativas.
Tabla 1: Características demográficas de la población de estudio según grado de la lesión.
Característica
Total
No lesión
LSIL
HSIL
P
n=109
n=19
n=45
n=45
Edad [promedio (DS)]
36 (10,8)
41(12,0)
34 (10,6)
37 (9,7)
0,025
Escolaridad
NS
Primaria
17 (15,6%)
2 (19,5%)
4 (8,9%)
11 (24,4%)
Secundaria
36 (33%)
8 (42,1%)
17 (37,8%)
11 (24,4%)
Superior
56 (51,4%)
9 (47,4%)
24 (53,3%)
23 (51,1%)
Nivel Socioeconómico
NS
Bajo
49 (45,0%)
11 (57,9)
17 (37,8%)
21 (46,7%)
Medio
60 (55,0%)
8 (42,1)
28 (62,2%)
24 (53,3%)
Distribución de la carga viral según el grado de la lesión
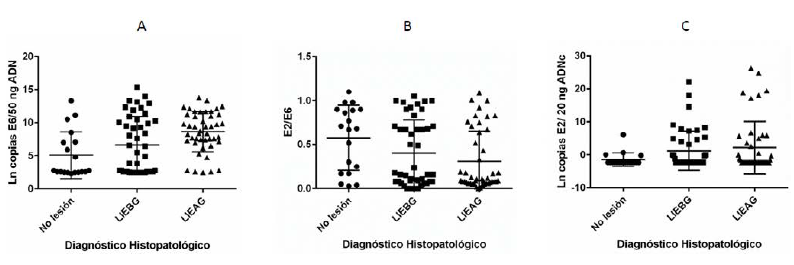
El número de copias de genoma viral de VPH 16 (carga viral) por 50 ng de ADN genómico de cepillados cervicales positivos para VPH16 se evaluó en las 109 mujeres. La carga viral se calculó a partir de una curva estándar construida con diferentes concentraciones del plásmido pBRHPV16 luego de amplificación de una región de E6 mediante PCR cuantitativa en tiempo real. En la figura 1A se presenta la distribución de la carga viral de VPH 16 en las 109 muestras analizadas agrupadas de acuerdo al diagnóstico histopatológico. Se encontró diferencia estadísticamente significativa entre las medianas de los tres grupos (8,78 Ln copias E6/50 ng ADN en mujeres con lesiones de alto grado, 5,47 Ln copias E6/50 ng ADN en mujeres con lesiones de bajo gado y 2,75 Ln copias E6/50 ng ADN en mujeres sin lesión) (prueba de Kruskall-Wallis, p =0,049); el rechazo de la hipótesis nula se dio a expensas del grupo LIEAG que resultó diferente de las otras categorías (test de Dunn, LIEAG vs. no lesión: p=0,0004; LIEAG vs. LIEBG: p =0,0072).
Figura 1: Distribución de la carga viral de VPH 16 (A), la proporción E2/E6 (B) y la expresión de ARN mensajero de E2 de VPH 16 (C) en las 109 muestras analizadas agrupadas de acuerdo al diagnóstico histopatológico. La línea vertical en cada grupo representa el rango inter cuartil, la línea horizontal superior representa el percentil 75, la línea horizontal inferior el percentil 25 y la línea horizontal intermedia el valor de la mediana.
Proporción E2/E6
El estado físico del ADN se calculó como la proporción entre el número de copias del gen E2 y el número de copias del gen E6. En la figura 1B se presenta la distribución de la proporción E2/E6 en las 109 muestras analizadas agrupadas de acuerdo al diagnóstico histopatológico. Se encontró diferencia estadísticamente significativa entre las medianas de los tres grupos (0,11 en mujeres con lesiones de alto grado, 0,16 en mujeres con lesiones de bajo gado y 0,68 en mujeres sin lesión) (prueba de Kruskall-Wallis, p =0,049); el rechazo de la hipótesis nula se dio a expensas de la pareja HSIL vs No lesión (test de Dunn, p =0,02). La mediana en lesiones de bajo grado también fue más baja que en mujeres sin lesión, sin embargo la diferencia no fue estadísticamente significativa.
Estado físico del ADN de VPH 16 según el grado de la lesión
Con base en la proporción E2/E6 se consideró como estado episomal puro valores mayores a 0,8, como formas mixtas episomales e integradas un valor mayor a 0 y menor a 0,8 y como ADN viral integrado un valor de 0 (Saunier et al., 2008). En la tabla 2 se presenta la distribución del estado físico del ADN de VPH 16 en los diferentes grupos histológicos. Si bien las formas episomales puras se observaron con mayor frecuencia en mujeres con lesión y disminuyeron a medida que avanzaba la lesión, en los tres grupos analizados predominó una mezcla de ADN viral integrado y episomal, la frecuencia de formas mixtas fue mayor en lesiones de alto grado. Los integrantes puros fueron poco frecuentes y sólo se observaron en mujeres con LEIBG y LEIAG (11,1 y 2,2 % respectivamente).
Tabla 2: Estado físico del ADN de VPH16 según el diagnóstico histológico.
Episomal
Mixto
Integrado
n (%)
n (%)
n (%)
No lesión
7 (36,8)
12 (63,2)
0
LIEBG
10 (22,2)
30 (66,7)
5 (11,1)
LIEAG
7 (15,6)
37 (82,2)
1 (2,2)
Total
24 (22,0)
79 (72,5)
6 (5,5)
Niveles de expresión de ARN mensajero de E6 de VPH 16
Los resultados de este análisis se presentan en la figura 1C. De 109 pacientes en los que se cuantificó el ARNm de E2 se obtuvo un resultado positivo en 33 (30 %). En las pacientes sin lesión se encontró la menor prevalencia de expresión de E2 3/19 (15,8 %), en LIEBG y LIEAG las prevalencias fueron similares, 15/45 (33,3 %). Los niveles promedio de ARN mensajero de E2 fueron menores en las mujeres sin lesión y similares en LIEBG y LIEAG.
En la mayoría de casos en los que el ADN viral estaba en estado integrado puro no se detectó ARNm de E2, sólo un caso fue positivo. La media de expresión de ARNm de E2 en los casos en los que ADN viral estaba en estado episomal puro fue mayor que la observada en los casos mixtos (episomal e integrado) (11,04 y 8,4 respectivamente) sin embargo esta diferencia no fue estadísticamente significativa. En relación con la carga viral, en los casos en los que los niveles de ARNm de E2 fueron detectables se observó una media más alta del ln del número de copias copias de ADN de E6 (carga viral) en comparación con la observada en los casos negativos (8,6 vs. 6,82), esta diferencia no fue estadísticamente significativa.
Características operativas de los parámetros virales evaluados
Se evaluó la utilidad de la carga viral, la proporción E2/E6 y los niveles de RNAm de E2 para discriminar entre LIEAG y LIEBG o ausencia de lesión. Para la carga viral el punto de corte óptimo fue 7,11 Ln copias E6/50 ng ADN, este umbral de carga viral permitió identificar a las mujeres con LIEAG con una sensibilidad de 78 %, especificidad de 63 %, valor predictivo positivo de 59,3 % y valor predictivo negativo de 80 %. Para la proporción E2/E6 el punto de corte óptimo fue 0,175, con sensibilidad de 0 %, especificidad de 44 %, valor predictivo positivo de 33,3 % y valor predictivo negativo de 51 %. Para el número de copias de ARN de E2 el punto de corte fue de -1,955 con una sensibilidad de 42 %, especificidad de 65 %, valor predictivo positivo de 51,4 % y valor predictivo negativo de 50 %. Este análisis mostró una baja precisión diagnóstica para los tres parámetros virales evaluados. Ni la carga viral, ni la proporción E2/E6 o los niveles de ARNm de E2 permitieron discriminar adecuadamente entre LIEAG y LIEBG o ausencia de lesión.
DISCUSIÓN
El estado físico del ADN y la carga viral son considerados importantes determinantes de la transformación oncogénica del epitelio cervical infectado, sin embargo la gran variabilidad en resultados de estos parámetros ha dificultado su uso clínico para detectar aquellas lesiones cervicales con mayor riesgo de progresar hacia cáncer cervical (Shukla et al., 2014). El propósito de este trabajo fue evaluar los niveles de expresión del gen E2 en células cervicales exfoliadas provenientes de lesiones intraepiteliales escamocelulares, entendiendo su ausencia o diminución como un posible biomarcador de progresión de la enfermedad en mujeres con lesiones positivas para VPH16. Se evaluó en 109 muestras cervicales el estado físico del ADN viral, la carga viral y los niveles de expresión de ARN mensajero del gen E2 de VPH16.
El análisis de la carga viral se realizó mediante PCR cuantitativa, se observó un amplio rango de valores en LIEBG y LIEAG, inclusive en el grupo sin lesión se observaron valores altos en ocho casos, estos valores altos en mujeres sin lesión son probablemente el reflejo de una infección productiva con mayor riesgo de progresar a LEIBG, dada la asociación observada en este y otros estudios (Carcopino et al., 2006; Flores et al., 2006; Cricca et al., 2007; Saunier et al., 2008; Shukla et al., 2014) entre mayor valor de carga viral y progresión de la enfermedad. Al comparar las medias de carga viral en cada grupo histológico se observó una diferencia estadísticamente significativa, con un incremento a mayor severidad de la enfermedad. Los estudios en los que se ha empleado la PCR cuantitativa para evaluar la carga viral han mostrado de manera consistente que a mayor grado de la lesión es significativamente mayor la carga viral (Carcopino et al., 2006; Flores et al., 2006; Cricca et al., 2007; Saunier et al., 2008; Shukla et al., 2014), aunque en algunos estudios no se ha encontrado esta diferencia (Andersson et al., 2005; Briolat et al., 2007; Boulet et al., 2009). Cabe señalar que una comparación directa entre nuestros resultados y los obtenidos previamente por otros grupos es difícil dadas las diferencias en las técnicas de tiempo real empleadas (Taqman, SYBR Green), y las múltiples formas de presentación de los resultados (copias/ célula, copias/ng de ADN, copias/muestra).
El extremo 3' terminal de E2, que comprende la región de la bisagra y el dominio de unión al ADN, es la zona que más frecuentemente se pierde o se interrumpe luego de la integración del genoma de VPH 16 en el genoma de la célula infectada (Kalantari et al., 2001; Pett et al., 2007). Se empleó PCR en tiempo real para establecer el número absoluto de copias de E2 y de E6, calcular la proporción E2/E6 y determinar el estado físico del ADN viral. Los iniciadores y la sonda empleados para cuantificar E2 se ubicaron en la zona de la bisagra (Peitsaro et al., 2002). Observamos que la mediana de E2/E6 disminuyó a medida que aumentó el grado de la lesión. Esto indica que la proporción de episomas disminuye a medida que aumenta el número de formas integradas en las lesiones de alto grado, aunque dada la metodología empleada no es posible saber si coexisten en una misma célula formas episomales e integradas o si estas están en células independientes.
En este estudio observamos que, independiente de la lesión, la mayoría de muestras presentó un cociente E2/ E6 mayor a 0 y menor a 0,8, es decir que la mayoría de las muestras portaba una mezcla de episomas y formas integradas de genomas de VPH 16. Al igual que otros investigadores (Kulmala et al., 2006; Saunier et al., 2008; Boulet et al., 2009;) encontramos que la integración es un evento que aparece tempranamente pues un número significativo de muestras provenientes de mujeres sin lesión presentó integración, aunque siempre en presencia de episomas. En algunos estudios, por lo general realizados con otras metodologías no se han encontrado altos niveles de integración en citología normal o en lesiones de bajo grado (Tonon et al., 2001; Hudelist et al., 2004), esto en parte se explica por las diferencias técnicas empleadas para detectar VPH integrado. En general las metodologías diseñadas para detectar transcritos de la fusión virus-hospedero sólo identifican integrantes transcripcionalmente activos, mientras que los métodos que detectan ADN, como la PCR en tiempo real empleada en este estudio, detectan todos los genomas virales integrados independientemente de su actividad transcripcional (Groves et al., 2015).
La ruptura del gen E2, como consecuencia de la integración viral en el genoma de la célula hospedera, es considerada como un evento clave en la transformación maligna del epitelio cervical puesto que interrumpe la regulación negativa sobre la expresión de los oncogenes virales E6 y E7 (Schwarz et al., 1985; Jeon et al., 1995a). En varios estudios incluyendo el presente se reporta la presencia del gen E2 intacto en un alto porcentaje de lesiones de alto grado y cáncer (Andersson et al., 2005; Saunier et al., 2008; Vinokurova et al., 2008; Gray et al., 2010), aunque en su mayoría en presencia de formas integradas. En nuestro estudio, en lesiones de alto grado observamos un 15 % de formas episomales puras y un 82 % de formas mixtas, en estudios con el modelo celular W12 se ha descrito que la integración generalmente se acompaña de una proporción residual de episomas que deben ser eliminados para remover E2 que reprime la transcripción de los oncogenes E6 y E7 desde los integrantes (Pett et al., 2007). La presencia del gen E2 en la mayoría de lesiones de alto grado sugiere que deben existir mecanismos adicionales de pérdida de la represión mediada por E2 que permitan la expresión sostenida de E6 y E7 aun cuando el gen E2 esté intacto. En este estudio medimos los niveles de ARNm de E2 con el fin de evaluar si la ausencia de expresión de E2, se asocia con mayor riesgo de progresión, sólo detectamos niveles de ARNm de E2 en un 33,3 % de los casos analizados. En ausencia de lesión sólo se detectó ARNm de E2 en tres casos, esta baja detección de transcritos de E2 en mujeres infectadas pero sin lesión histológica pudo deberse a una baja carga viral. En todos los casos de LEIBG y LEIAG en los que se detectó expresión de ARNm de E2 el estado físico del ADN viral fue mezcla de integrado y episomal, dada la expresión detectable de ARNm de E2 desde los episomas, en estos casos aún no habría ocurrido la selección de los integrantes y estas lesiones estarían en menor riesgo de progresión. El análisis ROC mostró una baja capacidad de los tres parámetros virales analizados para distinguir entre HSIL y LSIL o ausencia de lesión esto debido en gran medida a las superposición de los datos observada en lesiones de bajo y alto grado que impide definir puntos de corte adecuados para predecir el riesgo y limita su utilidad clínica.
CONCLUSIONES
Si bien las lesiones con presencia de ADN viral mixto e integrado y expresión de E2 podrían estar en menor riesgo de progresión, y la carga viral y la integración se relacionaron con mayor severidad de la lesión, su valor clínico como biomarcadores de lesiones cervicales de alto grado es limitado dadas sus características operativas.
AGRADECIMIENTOS
A los ginecólogos, patólogos, enfermeras y personal administrativo de la Liga Contra el Cáncer-Bogotá por su gran apoyo en la recolección de los especímenes. Este trabajo fue financiado por el Instituto Nacional de Cancerología a través de recursos de inversión de la nación código 410303100-36.
REFERENCIAS
Referencias
Alazawi W, Pett M, Arch B, Scott L, Freeman T, Stanley MA, et al. Changes in cervical keratinocyte gene expression associated with integration of human papillomavirus 16. Cancer Res. 2002;62(23):6959-6965.
Andersson S, Safari H, Mints M, Lewensohn-Fuchs I, Gyllensten U, Johansson B. Type distribution, viral load and integration status of high-risk human papillomaviruses in pre-stages of cervical cancer (CIN). Br J Cancer. 2005;92(12):2195-2200. Doi:10.1038/sj.bjc.6602648
Arbyn M, Sasieni P, Meijer CJ, Clavel C, Koliopoulos G, Dillner J. Chapter 9: Clinical applications of HPV testing: a summary of meta-analyses. Vaccine. 2006;24(Suppl 3):78-89. Doi:10.1016/j.vaccine.2006.05.117
Bansal N, Wright JD, Cohen CJ, Herzog TJ. Natural history of established low grade cervical intraepithelial (CIN 1) lesions. Anticancer Res. 2008;28(3B):1763-1766.
Bosch FX, Manos MM, Munoz N, Sherman M, Jansen AM, Peto J, et al. Prevalence of human papillomavirus in cervical cancer: a worldwide perspective. International biological study on cervical cancer (IBSCC) Study Group. J Natl Cancer Inst. 1985;87(11):796-802.
Boulet GA, Benoy IH, Depuydt CE, Horvath CA, Aerts M, Hens N, et al. Human papillomavirus 16 load and E2/E6 ratio in HPV16-positive women: biomarkers for cervical intraepithelial neoplasia >or=2 in a liquid-based cytology setting? Cancer Epidemiol Biomarkers Prev. 2009;18(11):2992-2999. Doi:10.1158/1055-9965.EPI-09-0025
Briolat J, Dalstein V, Saunier M, Joseph K, Caudroy S, Pretet JL, et al. HPV prevalence, viral load and physical state of HPV-16 in cervical smears of patients with different grades of CIN. Int J Cancer. 2007;121(10):2198-2204. Doi:10.1002/ijc.22959
Carcopino X, Henry M, Benmoura D, Fallabregues AS, Richet H, Boubli L, et al. Determination of HPV type 16 and 18 viral load in cervical smears of women referred to colposcopy. J Med Virol. 2006;78(8):1131-1140. Doi:10.1002/jmv.20673
Castle PE, Schiffman M, Herrero R, Hildesheim A, Rodriguez AC, Bratti MC, et al. A prospective study of age trends in cervical human papillomavirus acquisition and persistence in Guanacaste, Costa Rica. J Infect Dis. 2005;191(11):1808-1816. Doi:10.1086/428779
Choconta-Piraquive LA, Alvis-Guzman N, Hoz-Restrepo F. How protective is cervical cancer screening against cervical cancer mortality in developing countries? The Colombian case. BMC Health Serv Res. 2010;(10):270. Doi:10.1186/1472-6963-10-270
Choi YJ, Park JS Clinical significance of human papillomavirus genotyping. J Gynecol Oncol. 2016;27(2):e21. Doi:10.3802/jgo.2016.27.e21
Cricca M, Morselli-Labate AM, Venturoli S, Ambretti S, Gentilomi GA, Gallinella G, et al. Viral DNA load, physical status and E2/E6 ratio as markers to grade HPV16 positive women for high-grade cervical lesions. Gynecol Oncol. 2007;106(3):549-557. Doi:10.1016/j.ygyno.2007.05.004
Cuzick J, Clavel C, Petry KU, Meijer CJ, Hoyer H, Ratnam S, et al. Overview of the European and North American studies on HPV testing in primary cervical cancer screening. Int J Cancer. 2006;119(5):1095-1101. Doi:10.1002/ijc.21955
Dunn O. J. Multiple comparisons using rank sums. Technometrics. 1964:293:241-252.
Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136(5):E359-E386. Doi:10.1002/ijc.29210
Flores R, Papenfuss M, Klimecki WT, Giuliano AR Cross-sectional analysis of oncogenic HPV viral load and cervical intraepithelial neoplasia. Int J Cancer. 2006;118(5):1187-1193. Doi:10.1002/ijc.21477
Forman D, de MC, Lacey CJ, Soerjomataram I, Lortet-Tieulent J, Bruni L, et al. Global burden of human papillomavirus and related diseases. Vaccine. 2012;30(Suppl 5):F12-F23. Doi:10.1016/j.vaccine.2012.07.055
Franceschi S, Herrero R, Clifford GM, Snijders PJ, Arslan A, Anh PT, et al. Variations in the age-specific curves of human papillomavirus prevalence in women worldwide. Int J Cancer. 2006;119(11):2677-2684.
Fujii T, Masumoto N, Saito M, Hirao N, Niimi S, Mukai M, et al. Comparison between in situ hybridization and real-time PCR technique as a means of detecting the integrated form of human papillomavirus 16 in cervical neoplasia. Diagn Mol Pathol. 2005;14(2):103-108. Doi:10.1097/01.pas.0000162755.84026.9f
Ginsburg O, Bray F, Coleman MP, Vanderpuye V, Eniu A, Kotha SR, et al.The global burden of women's cancers: a grand challenge in global health. Lancet. 2016. Doi:10.1016/S0140-6736(16)31392-7
Gravitt PE, Kovacic MB, Herrero R, Schiffman M, Bratti C, Hildesheim A, et al. High load for most high risk human papillomavirus genotypes is associated with prevalent cervical cancer precursors but only HPV16 load predicts the development of incident disease. Int J Cancer. 2007;121(12):2787-2793. Doi:10.1002/ijc.23012
Gray E, Pett MR, Ward D, Winder DM, Stanley MA, Roberts I, et al. In vitro progression of human papillomavirus 16 episome-associated cervical neoplasia displays fundamental similarities to integrant-associated carcinogenesis. Cancer Res. 2010;70(10):4081-4091. Doi:0008-5472.CAN-09-3335
Groves IJ, Coleman N. Pathogenesis of human papillomavirus-associated mucosal disease. J Pathol. 2015;235(4):527-538. Doi:10.1002/path.4496
Hudelist G, Manavi M, Pischinger KI, Watkins-Riedel T, Singer CF, Kubista E, et al. Physical state and expression of HPV DNA in benign and dysplastic cervical tissue: different levels of viral integration are correlated with lesion grade. Gynecol Oncol. 2004;92(3):873-880. Doi:10.1016/j.ygyno.2003.11.035
Jeon S, Lambert PF.Integration of human papillomavirus type 16 DNA into the human genome leads to increased stability of E6 and E7 mRNAs: implications for cervical carcinogenesis. Proc Natl Acad Sci USA. 1995a;92(5):1654-1658. Doi:10.1073/pnas.92.5.1654
Jeon S, Len-Hoffmann BL, Lambert PF. Integration of human papillomavirus type 16 into the human genome correlates with a selective growth advantage of cells. J Virol. 1995b;69(5):2989-2997.
Kalantari M, Blennow E, Hagmar B, Johansson BPhysical state of HPV16 and chromosomal mapping of the integrated form in cervical carcinomas. Diagn Mol Pathol. 2001;10(1):46-54. Doi:10.1097/00019606-200103000-00008
Kalof AN, Cooper K. Our approach to squamous intraepithelial lesions of the uterine cervix. J Clin Pathol. 2007;60(5):449-455. Doi:10.1136/jcp.2005.036426
Klaes R, Woerner SM, Ridder R, Wentzensen N, Duerst M, Schneider A, et al. Detection of high-risk cervical intraepithelial neoplasia and cervical cancer by amplification of transcripts derived from integrated papillomavirus oncogenes. Cancer Res. 1999;59(24):6132-6136
Kulmala SM, Syrjanen SM, Gyllensten UB, Shabalova IP, Petrovichev N, Tosi P, et al. Early integration of high copy HPV16 detectable in women with normal and low grade cervical cytology and histology. J Clin Pathol. 2006;59(5):513-517. Doi:10.1136/jcp.2004.024570
Liaw KL, Hildesheim A, Burk RD, Gravitt P, Wacholder S, Manos MM, et al. A prospective study of human papillomavirus et al. (HPV) type 16 DNA detection by polymerase chain reaction and its association with acquisition and persistence of other HPV types. J Infect Dis. 2001;183(1):8-15. Doi:10.1086/317638
Melsheimer P, Vinokurova S, Wentzensen N, Bastert G, von Knebel DM. DNA aneuploidy and integration of human papillomavirus type 16 e6/e7 oncogenes in intraepithelial neoplasia and invasive squamous cell carcinoma of the cervix uteri. Clin Cancer Res. 2004;10(9):3059-3063. Doi:10.1158/1078-0432.CCR-03-0565
Moberg M, Gustavsson I, Wilander E, Gyllensten U. High viral loads of human papillomavirus predict risk of invasive cervical carcinoma. Br J Cancer. 2005;92(5):891-894. Doi:10.1038/sj.bjc.6602436
Parkin DM, Bray F Chapter 2: The burden of HPV-related cancers. Vaccine. 2006;24(Suppl 3):11-25. Doi:10.1016/j.vaccine.2006.05.111
Peitsaro P, Johansson B, Syrjanen S. Integrated human papillomavirus type 16 is frequently found in cervical cancer precursors as demonstrated by a novel quantitative real-time PCR technique. J Clin Microbiol. 2002;40(3):886-891. Doi:10.1128/JCM.40.3.886-891.2002
Pepe M.S, Longton G., Janes H. Estimation and comparison ofe receiver operating characteristic curves. Stata Journal. 2009;9:1-16.
Pepe MS, Longton G. Standardizing diagnostic markers to evaluate and compare their performance. Epidemiology. 2005;16(5):598-603, Doi: 10.1097/01.ede.0000173041.03470.8b
Pett M, Coleman N Integration of high-risk human papillomavirus: a key event in cervical carcinogenesis?. J Pathol. 2007;212(4):356-367. Doi:10.1002/path.2192
Pett MR, Herdman MT, Palmer RD, Yeo GS, Shivji MK, Stanley MA, et al. Selection of cervical keratinocytes containing integrated HPV16 associates with episome loss and an endogenous antiviral response. Proc Natl Acad Sci USA. 2006;103(10):3822-3827. Doi: 10.1073/pnas.0600078103
Saunier M, Monnier-Benoit S, Mauny F, Dalstein V, Briolat J, Riethmuller D, et al. Analysis of human papillomavirus type 16 (HPV16) DNA load and physical state for identification of HPV16-infected women with high-grade lesions or cervical carcinoma. J Clin Microbiol. 2008;46(11):3678-3685. Doi:10.1128/JCM.01212-08.
Schiffman M, Doorbar J, Wentzensen N, de SS, Fakhry C, Monk BJ, et al. Carcinogenic human papillomavirus infection. Nat Rev Dis Primers. 2016;2:16086. Doi:10.1038/nrdp.2016.86
Schwarz E, Freese UK, Gissmann L, Mayer W, Roggenbuck B, Stremlau A, et al. Structure and transcription of human papillomavirus sequences in cervical carcinoma cells. Nature. 1985;314(6006):111-114.
Shukla S, Mahata S, Shishodia G, Pande S, Verma G, Hedau S, et al. Physical state & copy number of high risk human papillomavirus type 16 DNA in progression of cervical cancer. Indian J Med Res. 2014;139(4):531-543.
Stanley MA, Browne HM, Appleby M, Minson AC Properties of a non-tumorigenic human cervical keratinocyte cell line. Int J Cancer. 1989;43(4):672-676.
Swan DC, Tucker RA, Tortolero-Luna G, Mitchell MF, Wideroff L, Unger ER, et al. Human papillomavirus (HPV) DNA copy number is dependent on grade of cervical disease and HPV type. J Clin Microbiol. 1999;37(4):1030-1034.
Tonon SA, Picconi MA, Bos PD, Zinovich JB, Galuppo J, Alonio LV, et al. Physical status of the E2 human papilloma virus 16 viral gene in cervical preneoplastic and neoplastic lesions. J Clin Virol. 2001;21(2):129-134. Doi:10.1016/S1386-6532(01)00155-X
Vinokurova S, Wentzensen N, Kraus I, Klaes R, Driesch C, Melsheimer P, et al. Type-dependent integration frequency of human papillomavirus genomes in cervical lesions. Cancer Res. 2008;68(1):307-313. Doi:10.1158/0008-5472.CAN-07-2754
Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. 1999;189(1):12-19. Doi:10.1002/(SICI)1096-9896(199909)189:1<12::AID-PATH431>3.0.CO;2-F
Woodman CB, Collins SI, Young LS The natural history of cervical HPV infection: unresolved issues. Nat Rev Cancer. 2007;7(1):11-22. Doi:10.1038/nrc2050
Yu T, Ferber MJ, Cheung TH, Chung TK, Wong YF, Smith DI The role of viral integration in the development of cervical cancer. Cancer Genet Cytogenet. 2005;158(1):27-34. Doi:10.1016/j.cancergencyto.2004.08.021
Zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application. Nat Rev Cancer. 2002;2(5):342-350. Doi:10.1038/nrc798
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2017 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).