Manifestaciones orales y maxilofaciales asociadas a la COVID-19. Revisión de la literatura
Oral and maxillofacial manifestations associated with COVID-19. Literature review
DOI:
https://doi.org/10.15446/aoc.v10n3.89447Palabras clave:
COVID-19, manifestacion, oral, maxilofacial, síntomas (es)COVID-19, manifestation, oral, maxillofacial, symptoms (en)
Objetivo: realizar una revisión, descripción y análisis de los estudios y reportes de casos con información sobre la posible relación existente entre las manifestaciones orales y maxilofaciales reportadas y la COVID-19. Métodos: se revisaron 16 publicaciones realizadas en bases de datos de Pubmed, SciencedDirect, Google Académico, ProQuest, Medline Complete y Nature. Los términos de búsqueda empleados fueron COVID-19 y oral manifestations, relacionados en la ecuación de búsqueda con el conector booleano “AND”. Resultados: 22 casos de pacientes que presentaron manifestaciones orofaciales asociadas a la COVID-19. La distribución entre mujeres y hombres fue similar con porcentajes de 45,5% y 54,5%, respectivamente. Diagnóstico de la COVID-19 positivo en un 86,4% y sospechoso de infección en un 13,6%. La ubicación más frecuente de lesiones fue en mucosa masticatoria (31,3%), mucosa de revestimiento (28,1%) y lengua (15,6%). A nivel facial, 25% de los reportes evaluados informaron lesiones. El edema retromandibular, en el 23,8 % de los casos evaluados, y las úlceras en mucosa oral, en el 28,6%, fueron el tipo más frecuente de lesiones. Conclusiones: las manifestaciones orales y maxilofaciales en pacientes con COVID-19 han sido reportadas en algunas publicaciones; las más frecuentes han sido las relacionadas con edema retromandibular (parotiditis) y úlceras. Se sugiere una posible asociación de dichas manifestaciones con la infección por SARS-CoV-2 o con coinfecciones o comorbilidades del paciente, administración de medicamentos, estancia hospitalaria en UCI o ventilación mecánica. Aunque los reportes son pocos, estos pueden servir como pauta para futuros estudios que permitan esclarecer esta relación.
Objective: to carry out a review, description and analysis of the studies and case reports with information on the possible relationship between reported oral and maxillofacial manifestations and COVID-19. Methods: 16 publications made in databases of Pubmed, SciencedDirect, Google Scholar, ProQuest, Medline Complete and Nature were reviewed. The search terms used were COVID-19 and oral manifestations, related in the search equation with the Boolean connector “AND”. Results: 22 cases of patients who presented orofacial manifestations associated with COVID-19. The distribution between women and men was similar with percentages of 45.5% and 54.5%, respectively. COVID-19 diagnosis positive in 86.4% and suspected of infection in 13.6%. The most frequent location of lesions was masticatory mucosa (31.3%), lining mucosa (28.1%) and tongue (15.6%). At the facial level, 25% of the evaluated reports reported injuries. Retromandibular edema in 23.8% of the cases evaluated and ulcers in the oral mucosa in 28.6% were the most frequent type of lesions. Conclusions: oral and maxillofacial manifestations in patients with COVID-19 have been reported in some publications; the most frequent have been those related to retromandibular edema (parotitis) and ulcers. A possible association of these manifestations with SARS-CoV-2 infection or with co-infections or comorbidities of the patient, administration of medications, hospital stay in ICU or mechanical ventilation is suggested. Although the reports are few, they can serve as a guideline for future studies to clarify this relationship.
Manifestaciones orales y maxilofaciales asociadas a la COVID-19. Revisión de la literatura
Oral and maxillofacial manifestations associated with COVID-19. Literature review
Erika Alexandra Parra–Sanabria, Melisa Bermúdez–Bermúdez, Claudia Patricia Peña–Vega, Andrés Rueda–Jiménez
|
Recibido |
Aprobado |
Publicado |
|
27/07/2020 |
02/10/2020 |
30/10/2020 |
Citación sugerida:
Parra–Sanabria EA, Bermúdez–Bermúdez M, Peña–Vega CP, Rueda–Jiménez A. Manifestaciones orales y maxilofaciales asociadas a la COVID-19. Revisión de la literatura. Acta Odont Col. 2020; 10(Supl. COVID-19): -1. Disponible en: https://revistas.unal.edu.co/index.php/actaodontocol/article/view/89447
Resumen
Objetivo: realizar una revisión, descripción y análisis de los estudios y reportes de casos con información sobre la posible relación existente entre las manifestaciones orales y maxilofaciales reportadas y la COVID-19. Métodos: se revisaron 16 publicaciones realizadas en bases de datos de Pubmed, SciencedDirect, Google Académico, ProQuest, Medline Complete y Nature. Los términos de búsqueda empleados fueron COVID-19 y oral manifestations, relacionados en la ecuación de búsqueda con el conector booleano “AND”. Resultados: 22 casos de pacientes que presentaron manifestaciones orofaciales asociadas a la COVID-19. La distribución entre mujeres y hombres fue similar con porcentajes de 45,5% y 54,5%, respectivamente. Diagnóstico de la COVID-19 positivo en un 86,4% y sospechoso de infección en un 13,6%. La ubicación más frecuente de lesiones fue en mucosa masticatoria (31,3%), mucosa de revestimiento (28,1%) y lengua (15,6%). A nivel facial, 25% de los reportes evaluados informaron lesiones. El edema retromandibular, en el 23,8 % de los casos evaluados, y las úlceras en mucosa oral, en el 28,6%, fueron el tipo más frecuente de lesiones. Conclusiones: las manifestaciones orales y maxilofaciales en pacientes con COVID-19 han sido reportadas en algunas publicaciones; las más frecuentes han sido las relacionadas con edema retromandibular (parotiditis) y úlceras. Se sugiere una posible asociación de dichas manifestaciones con la infección por SARS-CoV-2 o con coinfecciones o comorbilidades del paciente, administración de medicamentos, estancia hospitalaria en UCI o ventilación mecánica. Aunque los reportes son pocos, estos pueden servir como pauta para futuros estudios que permitan esclarecer esta relación.
Palabras clave: COVID-19; manifestacion; oral; maxilofacial; síntomas.
Abstract
Objective: to carry out a review, description and analysis of the studies and case reports with information on the possible relationship between reported oral and maxillofacial manifestations and COVID-19. Methods: 16 publications made in databases of Pubmed, SciencedDirect, Google Scholar, ProQuest, Medline Complete and Nature were reviewed. The search terms used were COVID-19 and oral manifestations, related in the search equation with the Boolean connector “AND”. Results: 22 cases of patients who presented orofacial manifestations associated with COVID-19. The distribution between women and men was similar with percentages of 45.5% and 54.5%, respectively. COVID-19 diagnosis positive in 86.4% and suspected of infection in 13.6%. The most frequent location of lesions was masticatory mucosa (31.3%), lining mucosa (28.1%) and tongue (15.6%). At the facial level, 25% of the evaluated reports reported injuries. Retromandibular edema in 23.8% of the cases evaluated and ulcers in the oral mucosa in 28.6% were the most frequent type of lesions. Conclusions: oral and maxillofacial manifestations in patients with COVID-19 have been reported in some publications; the most frequent have been those related to retromandibular edema (parotitis) and ulcers. A possible association of these manifestations with SARS-CoV-2 infection or with co-infections or comorbidities of the patient, administration of medications, hospital stay in ICU or mechanical ventilation is suggested. Although the reports are few, they can serve as a guideline for future studies to clarify this relationship.
Key words: COVID-19; manifestation; oral; maxillofacial; symptoms.
Introducción
En diciembre de 2019 en la ciudad de Wuhan, Hubei, China, surge un coronavirus denominado SARS-CoV-2 por la Organización Mundial de la Salud (OMS), cuyas manifestaciones clínicas son similares a la neumonía viral. La OMS, en colaboración con la Organización Mundial de Sanidad Animal y la Organización de las Nacional Unidas para la Alimentación y la Agricultura, denominaron a la enfermedad COVID-19 (1). Estudios indican que la COVID-19 presenta diversas rutas de transmisión, que pueden ser por el contacto con las membranas mucosas nasales, oculares y orales. Por otro lado, están las rutas de transmisión directa que se dan por tos, estornudos o inhalación de gotas gruesas o pequeñas (2). Es importante destacar que la transmisión se puede dar a través del contacto con personas que no presentan ninguna sintomatología (3).
Con respecto a la patogénesis, el SARS-CoV-2 invade las células huésped como las epiteliales, nasales, bronquiales, neumocitos, etc, por medio de la glucoproteína estructural Spike (proteína S) presente en la superficie viral, que consta de dos subunidades. La primera es S1, encargada de la unión al receptor de la célula huésped, en este caso la Enzima Convertidora de Angiotensina 2 (ECA-2) que es el receptor funcional para el SARS-CoV-2 y que tiene una alta expresión en pulmón, corazón, riñón, vejiga, íleon (4), así como en el epitelio de papilas gustativas y glándulas salivales (5). La segunda, subunidad S2, es responsable de la fusión de las membranas viral y celular (6,7). La subunidad S1 se divide en las porciones N-terminal (NTD) y C-terminal (Dominio C). La mayoría de los CoV utilizan el dominio C para la unión al receptor (8–12). En la superficie de la célula huésped se expresa Serina Proteasa de Membrana del tipo 2 (TMPRSS), la cual promueve la absorción viral y media la entrada del SARS-CoV-2 a la célula huésped al activar la proteína S y escindir la ECA-2 (7,13).
Una vez el virus ha infectado la célula huésped, la replicación viral se acelera, lo cual afecta la barrera epitelial endotelial, cuyos efectos generan la infección en células endoteliales y capilares pulmonares y aumentan la respuesta inflamatoria. En estadios severos de la enfermedad se puede producir una tormenta de citoquinas y respuesta sistémica no controlada, debido a la liberación de citocinas pro-inflamatorias y quimiocinas, con lo que se produce el síndrome de dificultad respiratoria aguda (SDRA), la principal causa de muerte por la COVID-19 (14,15) (Figura 1).
En referencia a la COVID-19, varios estudios han mencionado las características clínicas principales que se presentan en dicha enfermedad. Este es el caso de un metaanálisis que incluyó un total de 38 estudios con 3062 pacientes diagnosticados con la COVID-19 realizado por Zhu et al. (16) quienes encontraron que fiebre (80,4%), fatiga (46%), tos (63,1%) y expectoración (41,8%) fueron las manifestaciones clínicas más comunes. Otros síntomas incluyen dolor muscular (33%), anorexia (38,8%), opresión en el pecho (35,7%), dificultad respiratoria (35%), disnea (33,9%). Los síntomas de menor incidencia incluyeron náuseas y vómitos (10,2%), diarrea (12,9%), cefalea (15,4%), dolor faríngeo (13,1%), escalofríos (10,9%) y dolor abdominal (4,4%). El mayor porcentaje de pacientes infectados fueron hombres (56,9%); los pacientes asintomáticos correspondieron al (11,9%). En la mayor parte de los pacientes se observaron recuentos leucocitarios normales (69,7%), linfopenia (56,5%), niveles elevados de proteína C reactiva (73,6%) y disminución del índice de oxigenación (63,6%). Cabe resaltar que la tasa de incidencia de insuficiencia respiratoria o síndrome de dificultad respiratoria aguda fue del 19,5% y la tasa de mortalidad fue del 5,5% (16).
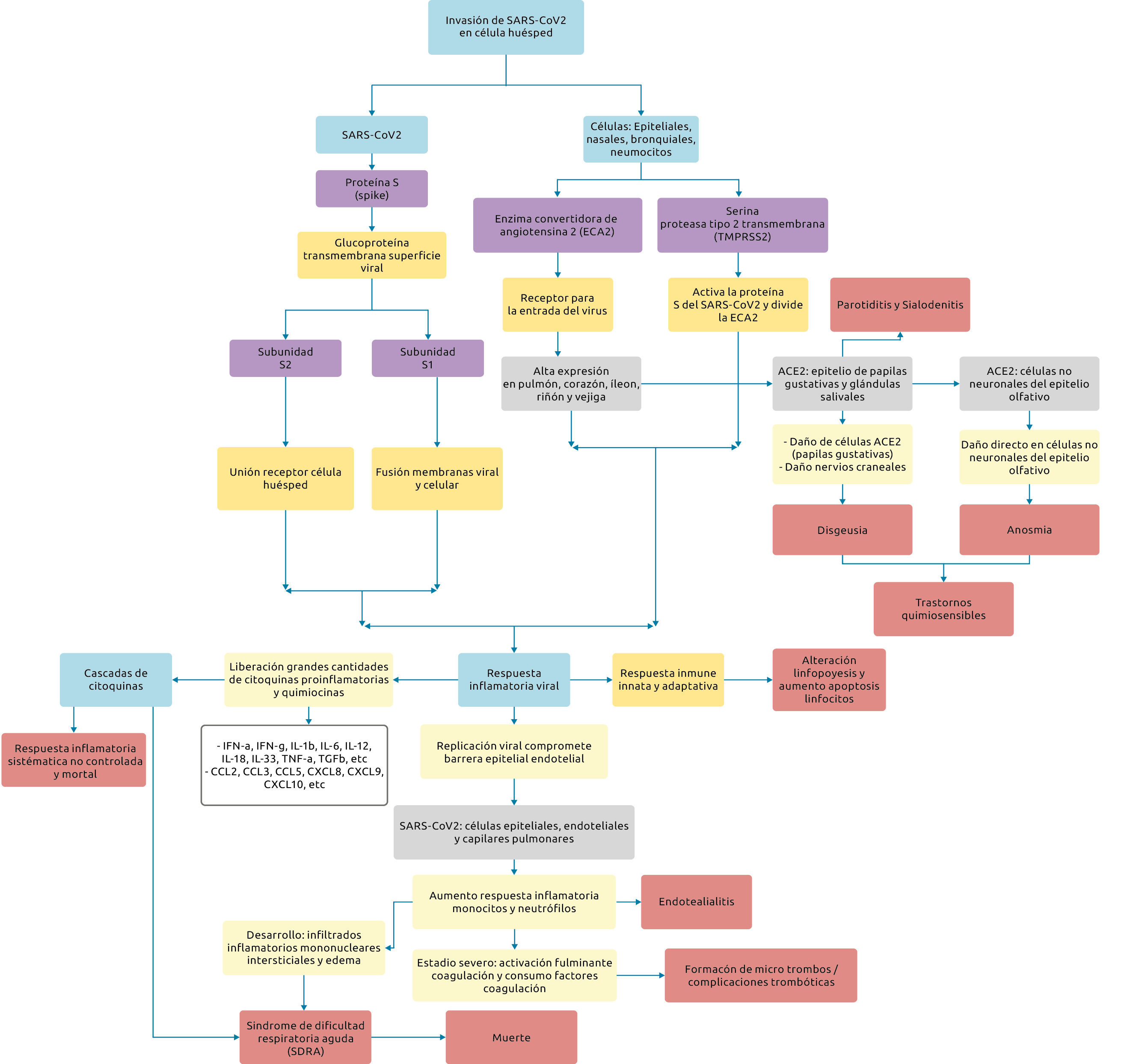
Figura 1. Patogénesis del SARS-coV-2
Fuente: elaboración propia.
En la literatura se han reportado algunos casos de manifestaciones orofaciales que pueden estar relacionados con la infección por la COVID-19. Dentro de los estudios se han descrito alteraciones a nivel del sistema nervioso central con disgeusia y anosmia (17,18), infecciones de las glándulas salivales como Parotiditis, alteraciones en la mucosa oral, presentación de lesiones eritematosas, úlceras, ampollas, petequias (19,20). También, posibles reacciones en cavidad oral por efectos de los medicamentos utilizados durante el tratamiento de la COVID-19, tales como: enantema viral, y exantemas, gingivitis ulcero necrotizante (21), boca seca, papilas linguales prominentes, labios agrietados, úlceras faciales por presión, ampollas en la mucosa labial y gingivitis descamativa (22). Aunque existe consenso de que la cavidad oral muestra signos de varias enfermedades sistémicas, el nivel de evidencia con respecto a la relación de las manifestaciones orales por la COVID-19 es insuficiente para poderlo afirmar, se necesitan, por lo tanto, más estudios al respecto. Algunos autores refieren, incluso, que estas podrían deberse a factores externos a la COVID-19 como estrés, reacciones a medicamentos y enfermedades sistémicas de base (23–25).
Con base en lo anterior, el objetivo y principal aporte del presente artículo es brindar una revisión, descripción y análisis de los estudios y reportes de casos publicados sobre la posible relación existente entre las manifestaciones orales y maxilofaciales reportadas y la COVID-19.
Métodos
Hasta el 14 de julio de 2020, se realizó una revisión de la literatura, por medio de la búsqueda en bases de datos de Pubmed, ScienceDirect, Google Académico, ProQuest, Medline Complete y Nature, donde se incluyeron artículos publicados sobre la posible asociación entre manifestaciones orales – maxilofaciales y la COVID-19. Los términos de búsqueda empleados fueron COVID-19, oral y manifestations, los cuales fueron relacionados en la ecuación de búsqueda con el conector booleano “AND”.
Inicialmente, todas aquellas publicaciones que no estaban relacionadas con el objetivo de la búsqueda fueron excluidas, es decir, que no hacían referencia a las asociaciones posibles entre la COVID-19 y manifestaciones orales y maxilofaciales. Luego, se llevó a cabo la lectura basada en títulos, resúmenes y discusiones. Finalmente, se incluyeron artículos de reportes de caso, cartas al editor y comunicaciones breves donde se describían pacientes con manifestaciones oro faciales asociadas a la COVID-19 (ver Figura 2).
Los resultados iniciales de la búsqueda en las 6 bases de datos arrojaron un total de 6691 artículos publicados con texto completo en el año 2020; se excluyeron 6537 publicaciones que no cumplían con el objetivo de la búsqueda. Después de aplicar otros criterios de exclusión, se rechazaron 138 artículos, los cuales no relataban casos clínicos relacionados con manifestaciones orales y maxilofaciales en pacientes con la COVID-19. Por último, en la presente revisión fueron seleccionadas e incluidas 16 publicaciones.

Figura 2. Diagrama de flujo de búsqueda y selección de artículos
Fuente: elaboración propia.
El contenido de los artículos seleccionados fue analizado y evaluado teniendo en cuenta la información a nivel clínico que proporcionaban. Dentro de los datos analizados se incluyeron: la localización geográfica del estudio, sexo de los pacientes, edad, antecedentes médicos, diagnóstico confirmado o sospechoso de la COVID-19, manifestaciones generales, manifestaciones orales – maxilofaciales, su posible etiología y el periodo de inicio de estas en los casos que fueron reportados.
Resultados
La importancia de la asociación entre manifestaciones orales y maxilofaciales y la COVID-19 toma relevancia debido a la evidencia emergente publicada en algunos artículos, la mayoría reportes de caso (ver Tabla 1). Los síntomas que se presentan con mayor frecuencia en pacientes con la enfermedad, generalmente, incluyen fiebre, tos seca, fatiga, expectoración y cefalea. Sin embargo, se han encontrado casos de pacientes asintomáticos con presentaciones atípicas, tales como, complicaciones neurológicas, gastrointestinales y dermatológicas, entre otras (26).
Con relación a las características de los pacientes reportados con lesiones orofaciales asociadas a la COVID-19, se observa que la distribución en hombres y mujeres fue de 45,5% y 54,5%, respectivamente. En cuanto a la edad de los pacientes en los que se evidenciaron lesiones orofaciales, la media fue de 41 años.
De otra parte, respecto a la relación de las lesiones con una infección establecida por la COVID-19 se encuentra que el 86,4% de los casos fueron confirmados positivos, mientras que el 13,6% (en 3 de los casos) de los pacientes fueron catalogados como sospechosos (ver Tabla 1). En cuanto a la ubicación de estas lesiones, la mucosa masticatoria se encuentra afectada en el 31,3% de los casos (4 en mucosa gingival y 6 en paladar), las lesiones en la mucosa de revestimiento representan el 28,1% de los casos (7 en mucosa labial, 2 en carrillos) y las lesiones en la mucosa especializada se presentaron en lengua en el 15,6% (5 casos). A nivel facial se informaron manifestaciones en el 25% de los reportes evaluados así: 5 casos de inflamación a causa de parotiditis, 1 caso de herpes orofacial y 2 casos de úlceras faciales por sesiones de intubación en posición prono. Es importante destacar la presentación de edema retromandibular en el 23,8% de los casos evaluados; manifestación que se da a causa de la parotiditis. Adicionalmente, cabe resaltar que el 28,6% de los pacientes mencionados en los artículos presentaron úlceras en la mucosa oral (ver Tabla 1).
|
Tabla 1. Resumen de estudios relacionados con la asociación entre manifestaciones orales – maxilofaciales y la COVID-19 |
|||||||||
|
Autores |
País |
Sexo |
Edad |
Antecedentes médicos |
COVID-19 |
Manifestaciones generales |
Manifestaciones orofaciales |
Inicio de manifestaciones |
Posible etiología |
|
Fisher et al. (26) |
Estados Unidos |
Femenino. |
21 |
N/A. |
Confirmado |
Fiebre, tos y disnea. |
Inflamación moderada mejilla pre auricular y submandibular. Parotiditis infecciosa. |
Ocho (8) días después de confirmado el diagnóstico de la COVID-19. |
Mixta, bacteriana unilateral y viral por leucopenia. |
|
Lechien et al.(27) |
Francia |
3 pacientes femeninas. |
23 31 27 |
N/A |
Confirmado |
Anorexia, artralgia, mialgia, fatiga, cefalea, dolor abdominal, urticaria y disnea. |
Disgeusia, dolor facial, otalgia y parotiditis. |
Parotiditis al inicio de la enfermedad. |
Linfadenitis intraparotídea, propagación directa del SARS-CoV-2 en tejido parotídeo. |
|
Capaccio et al. (28) |
Italia |
Masculino. |
26 |
N/A. |
Confirmado |
Fiebre, mialgia. |
Inflamación, parotiditis aguda no supurativa. |
Antes de ser diagnosticado con la COVID-19. |
Consideran posible manifestación de la COVID-19. |
|
Patel et al. (21) |
Reino Unido |
Femenino. |
35 |
N/A. |
Sospechoso |
Fiebre, linfadenopatía submandibular bilateral. |
Gingivitis ulcerativa necrotizante. |
Fiebre y posteriores manifestaciones orales. |
Posible coinfección bacteriana asociada con la COVID-19. |
|
Carreras Presas et al. (22) |
España |
-1 paciente femenina. -2 pacientes masculinos. |
65 56 58 |
-Hipertensión controlada, obesidad. -N/A. -Diabetes e hipertensión. |
– Confirmada – Sospechosos – Sospechoso |
-Fiebre alta, diarrea, neumonía, erupciones cutáneas debajo de los senos, espalda y área genital. – Fiebre, astenia, hiposmia, disgeusia, adenopatía cervical. – N/A. |
– Dolor en lengua, ampollas en mucosa labial, gingivitis descamativa. – Posible estomatitis herpética recurrente. – Múltiples úlceras dolorosas en paladar unilaterales. |
– Once (11) días después de confirmado como positivo para la COVID-19. – N/A. – N/A. |
Exantema viral. |
|
Chaux – Bodard et al. (29) |
Francia |
Femenino. |
45 |
N/A. |
Confirmado |
Astenia leve, lesión plana eritematosa en primer dedo del pie. |
Inflamación dolorosa en papila de lengua, seguida de mácula eritematosa y úlcera irregular en dorso de lengua asintomática. |
Ocho (8) días antes de prueba de la COVID-19. |
Vasculitis, sugiere asociación con la COVID-19 y reacción inflamatoria, que puede inducir inflamación vascular. |
|
Ciccarese et al. (19) |
Italia |
Femenino. |
19 |
N/A. |
Confirmado |
Fiebre, odinofagia, fatiga, hiposmia, máculas pápulas y petequias eritematosas en extremidades inferiores. |
Erosiones, ulceraciones, costras en superficie interna de labios, petequias palatales y gingivales. |
N/A. |
Posible asociación de manifestaciones a trombocitopenia grave; empeoramiento por ingesta de cefixima. Daño viral, posible etiología para las erosiones. |
|
Jones et al. (30) |
Inglaterra |
Masculino. |
21 |
N/A. |
Confirmado |
Enfermedad similar a Kawasaki en el espectro PIMS-TS. |
Labios agrietados y papilas linguales prominentes. |
Cuatro (4) días después del inicio de la enfermedad. |
Asociación de la enfermedad de Kawasaki, descrita en adultos y niños, con infección viral. |
|
Ansari et al. (23) |
Irán |
-Femenino. -Masculino. |
56 75 |
-Diabetes mellitus. – Hipertensión. |
Confirmado |
-Fiebre y disnea. -Hipoxia y disfagia una semana después de la hospitalización. |
Múltiples úlceras dolorosas. |
-Cinco (5) días después del inicio. -Siete (7) días después de la hospitalización. |
Estrés y exantema viral. |
|
Perrillat et al. (31) |
Francia |
Masculino. |
27 50 |
-Obesidad mórbida. -N/A. |
Confirmado |
-Síndrome de dificultad respiratoria (SDRA). Queratitis y úlcera corneal en ojo derecho. – (SDRA). |
Úlceras faciales por presión en lado derecho del rostro, zona malar, mejilla, al lado del masetero y comisura labial. |
Tratamiento; ventilación mecánica, protocolo de 6 sesiones, posición prona. |
Presión prolongada de la piel y complicaciones asociadas a ventilación mecánica, hipoxemia, lesión microvascular, trombosis. |
|
Andorinho de Ferreira et al. (32) |
Brasil |
Masculino. |
39 |
Antecedentes de varicela. No infecciones recurrentes, ni uso de fármacos inmunosupresores. |
Confirmado |
Fatiga, diarrea ocasional, neuralgia trigeminal, y episodios de fiebre baja. |
Virus herpes zóster oro facial izquierdo, con lesiones de la mucosa bucal. |
Manifestaciones de virus herpes aparecieron días antes de diagnóstico de la enfermedad. |
Presencia viral y potencial inflamatorio de la COVID-19 fueron posibles causas de reactivación del virus de la varicela. |
|
Sakaida et al. (33) |
Japón |
Femenino. |
52 |
Medicación antibiótica, previamente formulada. |
Confirmado |
Lesiones eritematosas en extremidades. |
Erosiones en labios y mucosa bucal. |
Lesiones aparecieron 2 días después de inicio de tratamiento antibiótico |
Hipersensibilidad medicamentosa por respuesta a infección del virus. |
|
Putra et al. (34) |
Indonesia |
Masculino. |
19 |
Se administró Azitromicina, 2 días antes de la aparición de las lesiones cutáneas. |
Confirmado |
Fiebre, mialgia, dolor de espalda, tos seca, exantema viral, anosmia, rinorea, sensación de alfileres en dedos de manos y pies. |
Estomatitis aftosa, odinofagía. |
A partir del día 7 del inicio de los síntomas. |
Exantema viral. |
|
J. Amorim dos Santos et al. (35) |
Brasil |
Masculino. |
67 |
Enfermedad coronaria, hipertensión, enfermedad renal y trasplante. Tratamiento con inmunosu-presores, tromboembolismo venoso pulmonar; enoxaparina sódica. |
Confirmado |
Disnea, fiebre y diarrea. |
Placa blanca persistente y múltiples úlceras amarillentas puntiformes en dorso de lengua. Nódulo en el labio inferior (fibroma). Dos semanas después, aparecen lesiones blancas en el dorso de la lengua. (Lengua geográfica severa). |
Vigésimo cuarto día de hospitalización. |
Sugieren que manifestaciones pueden ser secundarias, debido al deterioro sistémico, general o por el tratamiento de la COVID-19. |
|
Soares et al. (36) |
Brasil |
Masculino. |
42 |
Diabetes e hipertensión. |
Confirmado |
Fiebre, tos, disnea y lesiones vesiculobulosas, petequias. |
Úlcera dolorosa en mucosa bucal, múltiples máculas en paladar duro, lengua y labios. |
Presentaba lesiones al momento del diagnóstico. |
Exantema viral. |
|
Cebeci Kahraman et al. (37) |
Turquía |
Masculino. |
51 |
N/A. |
Confirmado |
Fiebre, fatiga, tos seca severa, disgeusia, anosmia. |
Zona eritematosa en orofaringe y paladar duro, petequias en línea media, enantemas pustulosos en límite con paladar blando. |
Diez (10) días después del inicio de síntomas. |
Exantema viral. |
|
Fuente: elaboración propia. |
|||||||||
Discusión
Lesiones producidas por el proceso inflamatorio debido a la acción viral
Algunos casos presentan como probable etiología el proceso inflamatorio asociado a la acción viral. La explicación radica en el hecho que existe una reacción inflamatoria que desencadena inflamación vascular y provoca un desequilibrio que puede llegar a comprometer algunos órganos del cuerpo (23,26,29). Chaux Bodard et al. (29) reportan el caso de una paciente confirmada con la COVID-19 que presenta ulceración en dorso lingual debido a una posible vasculitis, posibilidad que podría confirmarse histopatológicamente. Es importante añadir la publicación de reportes de manifestaciones en cavidad oral como el caso de los enantemas orales que están relacionados a varias enfermedades virales, tal como lo exponen Scully y Samaranayake (38), Drago et al. (39), Castro y Ramos e Silva (40) y Carreras Presas et al. (22). Ciccares et al. (19) refieren, además, que lesiones como úlceras y erosiones en pacientes con infección confirmada por la COVID-19 se deben al daño viral por expresión en la mucosa oral de los receptores ECA-2.
De tal manera, la acción viral, también, se pone de manifiesto como posible agente etiológico en casos reportados de parotiditis en pacientes con infección por SARS-CoV-2. Fisher et al. (26) reportan el caso de una mujer diagnosticada con la COVID-19 que presenta parotiditis infecciosa aguda no complicada al poco tiempo de resolución de los síntomas respiratorios; en los exámenes de laboratorio se evidenció leucopenia, por lo cual, consideran que la parotiditis fue inducida por el virus. A pesar de ello, dada su presentación unilateral, ponen en consideración una posible coinfección bacteriana. Lechien et al. (27) informan el caso clínico de tres pacientes femeninas que consultan por otalgia unilateral y edema retromandibular, con síntomas de anorexia, fatiga y rinorrea, entre otros; en los tres casos se confirmó el diagnóstico de la COVID-19 y parotiditis. La resonancia magnética indicó linfadenitis intraparotídea como factor causal, aun así, no descartan la propagación del SARS-CoV-2 en el tejido parotídeo, debido a la presencia del receptor del virus dentro de la glándula parótida y a la excreción de viriones por medio de la saliva. Adicionalmente, Capaccio et al. (28) describen el caso de un paciente con la enfermedad, cuya primera manifestación fue una parotiditis aguda no supurativa.
Es posible que las glándulas salivales puedan verse afectadas en estadios tempranos de la infección por SARS-CoV-2 (5,41), debido a la expresión de ECA-2 en las glándulas. La ECA-2 actúa como receptor para que el virus pueda entrar a las células y se replique (42). Empero, la expresión de este marcador/molécula en las glándulas es menor en relación a otros órganos como los riñones y los músculos del corazón (43–46).
También, se ha encontrado que el SARS-CoV-2 parece depender de proteínas ricas en ácido siálico y gangliósidos GM1, que se encuentran en los tejidos de mamíferos, principalmente en el cerebro; estas proteínas juegan un papel importante en la replicación del patógeno a nivel celular. Las glándulas salivales mayores y menores secretan saliva que tiene un contenido alto de ácido siálico y ECA-2, por lo que diversos autores sugieren que pueden ser un objetivo potencial para el SARS-CoV-2 (44). Además, el ARN del virus presente en saliva, incluso en pacientes que no han manifestado lesiones pulmonares, indica una posible infección asintomática de las glándulas salivales (45). Este hallazgo pone de manifiesto el papel de la saliva como transmisora de la infección, aunque los autores refieren que se requieren más estudios para confirmar dicho mecanismo (46).
Tomando como base lo anterior, es preciso añadir que el SARS-CoV-2 podría utilizar los receptores ECA-2 presentes en la mucosa oral y desencadenar la respuesta inflamatoria induciendo cambios a nivel celular, lo cual resultaría, además, en el desarrollo de trastornos quimiosensibles, como es el caso de la disgeusia (45,47,48). Es así como el virus podría actuar en la trayectoria neuronal periférica del tracto gustativo ocasionando daño directo en las células que expresan ECA-2, o generando daño en los nervios craneales encargados de la función gustativa (5). Los trastornos quimiosensibles han tenido una alta frecuencia en Europa y Estados Unidos. En una publicación realizada por The New York Times se reportaron datos de Corea del Sur, donde el 30% de 2000 pacientes evaluados reportaron síntomas de anosmia o disgeusia (49). Por otro lado, en China, Mao et al. (50) informaron una muy baja frecuencia de dichos trastornos. Estas diferencias podrían radicar en un nivel distinto de expresión de los receptores de ECA-2 en los órganos de las primeras vías digestivas que podrían variar dependiendo del grupo étnico (51). Esto puede ser considerado como un riesgo potencial de infección, en tanto puede representar una puerta de entrada para el virus en las células que expresan este receptor, haciéndolas más susceptibles (47,48).
En el estudio de Vaira et al. (52) en el que se evaluaron 345 pacientes con la COVID-19, sin discriminación por el estadio de gravedad, se detectó disgeusia en 36 casos (10,4%), 119 con hipogeusia leve, moderada o severa (34,5%), mientras que en 190 casos (55,1%) la función del gusto era normal. Los trastornos quimiosensibles fueron el primer síntoma de la enfermedad en el 29,2% de los pacientes y el único en el 9,5% de los casos. En el estudio multicéntrico realizado por Lechien Jerome R. et al. (41) se evaluaron 417 pacientes, de ellos 342 pacientes (88,8%) informaron trastornos gustativos que se caracterizaron por el deterioro de las modalidades de sabor: salado, dulce, amargo y agrio.
Otros estudios han encontrado mayor contenido viral en saliva en etapas tardías de la COVID-19 (45,46); la enfermedad es más grave en personas mayores de 50 años y se ha descrito que el flujo salival disminuye con la edad, el uso de algunos medicamentos y procesos inflamatorios e infecciosos. Asimismo, se ha propuesto que debido a la hiposalivación puede existir un mayor riesgo de contraer SARS-CoV-2, debido a una reducción de proteínas antivirales en la saliva. Esta disminución en el flujo salival, también, se asocia con pérdida de la función gustativa, como consecuencia de la interrupción de la transducción neurológica inducida por alteraciones en la composición de la saliva y alteraciones en el gusto, que pueden deberse a un efecto directo de la infección por SARS-CoV-2 en el sistema gustativo periférico (44,45).
La disminución en las funciones gustativas pueden ser síntomas de detección primaria para la COVID-19, por ende, la identificación de estos puede ser crucial para minimizar la transmisión del virus. No obstante, se hace indispensable la realización de más estudios con una cuantificación objetiva de esta manifestación, ya que la mayoría de los casos reportados con disminución en las funciones gustativas se basan en datos anamnésicos subjetivos (52).
Lesiones producidas por coinfecciones o condiciones previas del paciente y complicación del cuadro viral
Ciertas manifestaciones en pacientes con la COVID-19 se pueden producir como efectos de condiciones previas del paciente que lo hacen más susceptible a complicaciones del cuadro viral. Andoriño et al. (32) reportaron un paciente con una posible reactivación retrograda del virus Varicela Zóster, debido a la presencia del SARS-CoV-2, su potencial inflamatorio y la cascada de citoquinas que este desencadena, donde el factor de estrés para dicha reactivación estaría dado por la infección que provocada el virus. A esto se suma el hecho de la relación creciente entre síndrome multisistémico inflamatorio pediátrico y el SARS-CoV-2, y la asociación entre la enfermedad de Kawasaki, en adultos, con infección viral (30,53).
Por otra parte, Rubio et al (54). consideran que la enfermedad periodontal podría tener implicaciones sistémicas y estar asociada con la enfermedad severa de la COVID-19, en tanto comparten factores de riesgo y comorbilidades. Se puede evidenciar que los hombres son más propensos a sufrir estas dos enfermedades, por lo cual el sexo también sería un factor adicional. En pacientes diabéticos la expresión de ECA-2 se puede alterar debido al tratamiento con insulina e inhibidores de la ECA. Es así como la diabetes puede ser considerada predictora de síntomas graves para la COVID-19 y enfermedad periodontal (55,56). Cabe añadir que una de las principales comorbilidades en la infección por la COVID-19 es la hipertensión arterial. La presencia de periodontitis e hipertensión arterial puede representar un factor de riesgo para la infección por SARS-CoV-2 (54). Adicionalmente, Badrana et al. (56) plantean que las bolsas periodontales pueden servir como reservorio para el virus, ya que en estas se han aislado otras especies virales de la familia del herpes simple, por lo que pueden ser un nicho favorable para distintos tipos de coronavirus.
En relación con la enfermedad periodontal Patel y Woolley (21) reportaron el caso de una mujer de 35 años, sin antecedentes médicos importantes, sospechosa de la COVID-19, que, además, presentó gingivitis ulcerativa necrotizante. El autor refiere que esta alteración puede estar asociada a coinfecciones bacterianas por Estreptococos, Fusobacterium, Treponema, Veillonella y P. Intermedia que han sido encontrados en cantidades anormalmente altas en pacientes con SARS-CoV-2 (57) y que son conocidos como los principales causantes de lesiones periodontales agudas (58).
Lesiones producidas por acción viral en correlación con administración de medicamentos
En la cavidad oral pueden hacerse evidentes tanto signos de enfermedades sistémicas como reacciones a otros factores, dentro de los cuales se encuentran los efectos asociados con tratamientos farmacológicos en pacientes hospitalizados. Este es el caso de los antirretrovirales (Lopinavir y Ritonavir) que pueden causar efectos secundarios que perjudican la cavidad oral y el tracto gastrointestinal (. estomatitis, úlceras bucales y boca seca) o el interferón que puede causar xerostomía, la cual puede llevar a una sobreinfección por microorganismos oportunistas (59).
Ciccarese et al. (19) reportaron un caso de petequias palatales y gingivales en paciente confirmado con la COVID-19. Los autores atribuyen estas manifestaciones a la trombocitopenia severa presentada por la paciente, en combinación con la ingesta de Cefixima (antibiótico de la familia de las cefalosporinas), que pudo haber empeorado el cuadro clínico por la trombocitopenia inducida por cefalosporinas, tal como han descrito Nham E y Piedra Abusharar (59–61).
Lesiones producidas por estancia en UCI, e intubación y ventilación mecánica
En el contexto de la COVID-19, las úlceras faciales por presión también se han hecho evidentes. La posición prono se ha utilizado como parte del tratamiento en pacientes que presentan síndrome de dificultad respiratoria aguda (SDRA) para proporcionar una mejor oxigenación y mecánica pulmonar, pero, debe ser mantenida por 12 horas para que tenga un efecto eficiente, debido a que se pueden presentar puntos de presión en la cara por tiempo prolongado. Por tal motivo, se generan úlceras, que pueden desencadenarse, también, por hipoxemia, lesión microvascular y trombosis. Por ello, este tipo de lesiones deben considerarse importantes, ya que requieren que los tratamientos para tratarlas sean conducidos por personal altamente capacitado que tome las precauciones a fin de evitar la aparición de las mismas (31).
A manera de conclusión, las manifestaciones orales y maxilofaciales en pacientes con la COVID-19 han sido reportadas en algunas publicaciones, siendo las más frecuentes las relacionadas con edema retromandibular (parotiditis) y úlceras. Se sugiere una posible asociación de dichas manifestaciones con la infección por SARS-CoV-2 o con coinfecciones o comorbilidades del paciente, administración de medicamentos, estancia hospitalaria en UCI o ventilación mecánica. Aunque los reportes son pocos, estos pueden servir como pauta para futuros estudios que permitan esclarecer esta correlación.
Contribuciones de los autores
Todos los autores contribuyeron de la misma manera en la búsqueda, análisis de la literatura y elaboración del artículo. Todos los autores aprueban el artículo final y su envío para publicación.
Conflictos de interés
Los autores manifiestan no tener ningún conflicto de interés.
Referencias
- Organización Mundial de la salud. Los nombres de la enfermedad por coronavirus (COVID-19) y del virus que la causa [Internet]. 2020. [Fecha de consulta: 15 de julio de 2020] Disponible en: https://www.who.int/es/emergencies/diseases/novel-coronavirus-2019/technical-guidance/naming-the-coronavirus-disease-(covid-2019)-and-the-virus-that-causes-it
- Belser JA, Rota PA, Tumpey TM. Ocular Tropism of Respiratory Viruses. Microbiol Mol Biol Rev. 2013; 77(1): 144–156. https://doi.org/10.1128/mmbr.00058-12
- Rothe C, Schunk M, Sothmann P, Bretzel G, Froeschl G, Wallrauch C, et al. Transmission of 2019-NCOV infection from an asymptomatic contact in Germany. N Engl J Med. 2020; 382(10): 970–971. https://doi.org/10.1056/nejmc2001468
- Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med. 2020; 14(2): 185–192. https://doi.org/10.1007/s11684-020-0754-0
- Lozada–Nur F, Chainani–Wu N, Fortuna G, Sroussi H. Dysgeusia in COVID-19: Possible mechanisms and implications. Oral Surg Oral Med Oral Pathol Oral Radiol. 2020; 130(3): 344–346. https://dx.doi.org/10.1016%2Fj.oooo.2020.06.016
- Yuki K, Fujiogi M, Koutsogiannaki S. COVID-19 pathophysiology: A review. Clin Immunol. 2020; 215: 108427. https://dx.doi.org/10.1016%2Fj.clim.2020.108427
- Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review [Internet]. JAMA. 2020; 324(8): 782–793. https://doi.org/10.1001/jama.2020.12839
- Li F, Li W, Farzan M, Harrison SC. Structure of SARS Coronavirus Spike Receptor-Binding Domain Complexed with Receptor. Science. 2005; 309(5742): 1864–1868. https://doi.org/10.1126/science.1116480
- Lu G, Hu Y, Wang Q, Qi J, Gao F, Li Y, et al. Molecular basis of binding between novel human coronavirus MERS-CoV and its receptor CD26. Nature. 2013; 500(7461): 227–231. https://doi.org/10.1038/nature12328
- Wang N, Shi X, Jiang L, Zhang S, Wang D, Tong P, et al. Structure of MERS-CoV spike receptor-binding domain complexed with human receptor DPP4. Cell Res. 2013; 23(8): 986–993. https://doi.org/10.1038/cr.2013.92
- Ou X, Guan H, Qin B, Mu Z, Wojdyla JA, Wang M, et al. Crystal structure of the receptor binding domain of the spike glycoprotein of human betacoronavirus HKU1. Nature Communications. 2017; 8: 15216. https://doi.org/10.1038/ncomms15216
- Qian Z, Ou X, Góes LGB, Osborne C, Castano A, Holmes KV, et al. Identification of the Receptor-Binding Domain of the Spike Glycoprotein of Human Betacoronavirus HKU1. J Virol. 2015; 89(17): 8816–8827. https://dx.doi.org/10.1128%2FJVI.03737-14
- Ou X, Liu Y, Lei X, Li P, Mi D, Ren L, et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nature Communications. 2020; 11: 1620. https://doi.org/10.1038/s41467-020-15562-9
- Li X, Geng M, Peng Y, Meng L, Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal. 2020; 10(2): 102–108. https://dx.doi.org/10.1016%2Fj.jpha.2020.03.001
- Cao W, Li T. COVID-19: towards understanding of pathogenesis. Cell Res. 2020; 30(5): 367–369. https://doi.org/10.1038/s41422-020-0327-4
- Zhu J, Ji P, Pang J, Zhong Z, Li H, He C, et al. Clinical characteristics of 3,062 COVID-19 patients: A meta-analysis. J Med Virol. 2020; 92(10): 1902–1914. https://doi.org/10.1002/jmv.25884
- Vinayachandran D, Balasubramanian S. Letter to the editor. Is Gustatory Impairment the First Report of an Oral Manifestation in COVID-19? Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13371
- Biadsee A, Biadsee A, Kassem F, Dagan O, Masarwa S, Ormianer Z. Olfactory and Oral Manifestations of COVID-19: Sex-Related Symptoms—A Potential Pathway to Early Diagnosis. Otolaryngol Neck Surg. 2020; 163(4): 722–728. https://dx.doi.org/10.1177%2F0194599820934380
- Ciccarese G, Drago F, Boatti M, Porro A, Muzic SI, Parodi A. Letter to the editor. Oral erosions and petechiae during SARS-CoV-2 infection. J Med Virol. 2020; 1–4. https://doi.org/10.1002/jmv.26221
- Sinadinos A, Shelswell J. Oral ulceration and blistering in patients with COVID-19. Evid Based Dent. 2020; 21: 49. https://doi.org/10.1038/s41432-020-0100-z
- Patel J, Woolley J. Letter to the editor. Necrotizing periodontal disease: Oral manifestation of COVID-19. Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13462
- Carreras–Presas MC, Amaro–Sánchez J, López–Sánchez AF, Jané–Salas E, Somacarrera–Pérez ML. Oral vesiculobullous lesions associated with SARS-CoV-2 infection. Oral Dis. 2020; 00: 1–3. https://doi.org/10.1111/odi.13382
- Ansari R, Gheitani M, Heidari F, Heidari F. Letter to the editor. Oral cavity lesions as a manifestation of the novel virus (COVID-19). Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13465
- Al-Khatib A. Letter to the editor. Oral manifestations in COVID-19 patients. Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13477
- Carvalho CSLF, Kitakawa D, Cabral LAG. Letter to the editor. Oral lesions of herpes zoster in COVID-19 patients or truly associated to the disease? Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13472
- Fisher J, Monette DL, Patel KR, Kelley BP, Kennedy M. COVID-19 associated parotitis: A case report. Am J Emerg Med. 2020; 1–3. https://doi.org/10.1016/j.ajem.2020.06.059
- Lechien JR, Chetrit A, Chekkoury–Idrissi Y, Distinguin L, Circiu M, Saussez S, et al. Parotitis-like symptoms associated with COVID-19. Emerg Infect Dis. 2020; 26(9): 2270–2271. https://doi.org/10.3201/eid2609.202059
- Capaccio P, Pignataro L, Corbellino M, Popescu–Dutruit, Torretta S. Acute Parotitis: A Possible Precocious Clinical Manifestation of SARS-CoV-2 Infection? Otolaryngol - Head Neck Surg. 2020; 163(1): 182–183. https://doi.org/10.1177/0194599820926992
- Chaux–Bodard A–G, Deneuve S, Desoutter A. Letter to the Editor. Oral manifestation of COVID-19 as an inaugural symptom? J Oral Med Oral Surg. 2020; 26(18): 1. https://doi.org/10.1051/mbcb/2020011
- Jones I, Bell LCK, Manson JJ, Last A. An adult presentation consistent with PIMS-TS. Lancet Rheumatol. 2020; 2(9): e520–e521. https://doi.org/10.1016/S2665-9913(20)30234-4
- Perrillat A, Foletti J–M, Lacagne A–S, Guyot L, Graillon N. Facial pressure ulcers in COVID-19 patients undergoing prone positioning: How to prevent an underestimated epidemic? J Stomatol oral Maxillofac Surg. 2020; 121(4): 442–444. https://doi.org/10.1016/j.jormas.2020.06.008
- Ferreira ACA de F, Romão TT, Macedo YS, Pupe C, Nascimento OJM. COVID-19 and herpes zoster co-infection presenting with trigeminal neuropathy. Eur J Neurol. 2020; 27: 1748–1750. https://doi.org/10.1111/ene.14361
- Sakaida T, Tanimoto I, Matsubara A, Nakamura M, Morita A. Unique skin manifestations of COVID-19: Is drug eruption specific to COVID-19? J Dermatol Sci. 2020; 99(1): 62–64. https://doi.org/10.1016/j.jdermsci.2020.05.002
- Putra BE, Adiarto S, Dewayanti SR, Juzar DA. Viral exanthem with “Spins and needles sensation” on extremities of a COVID-19 patient: A self-reported case from an Indonesian medical frontliner. Int J Infect Dis. 2020; 96: 355–358. https://doi.org/10.1016/j.ijid.2020.05.020
- Santos JA, Normando AGC, Silva RLC, Paula RM, Cembranel AC, Santos–Silva AR, et al. Oral mucosal lesions in a COVID-19 patient: New signs or secondary manifestations? Int J Infect Dis. 2020; 97: 326–328. https://doi.org/10.1016/j.ijid.2020.06.012
- Soares C, Carvalho RA, Carvalho KA, Carvalho MGF, Almeida O. Letter to Editor. Oral lesions in a patient with COVID-19. Med Oral Patol Oral y Cir Bucal. 2020; 25(4): 563–564. https://dx.doi.org/10.4317%2Fmedoral.24044
- Cebeci Kahraman F, ÇaŞkurlu H. Mucosal involvement in a COVID -19-positive patient: a case report. Dermatol Ther. 2020; 33(4): e13797. https://dx.doi.org/10.1111%2Fdth.13797
- Scully C, Samaranayake LP. Emerging and changing viral diseases in the new millennium. Oral Dis. 2016; 22(3): 171–179. https://dx.doi.org/10.1111/odi.12356
- Drago F, Ciccarese G, Gasparini G, Cogorno L, Javor S, Toniolo A, et al. Contemporary infectious exanthems: an update. Future Microbiol. 2016; 12(2): 171–193. https://doi.org/10.2217/fmb-2016-0147
- Castro MCR, Ramos–e–Silva M. The rash with mucosal ulceration. Clin Dermatol. 2020; 38(1): 35–41. https://doi.org/10.1016/j.clindermatol.2019.10.019
- Lechien JR, Chiesa–Estomba CM, De Siati DR, Horoi M, Le Bon SD, Rodríguez A, et al. Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Oto-Rhino-Laryngology. 2020; 277(8): 2251–2261. https://doi.org/10.1007/s00405-020-05965-1
- Xu X, Chen P, Wang J, Feng J, Zhou H, Li X, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci China Life Sci. 2020; 63(3): 457–460. https://doi.org/10.1007/s11427-020-1637-5
- Liu L, Wei Q, Alvarez X, Wang H, Du Y, Zhu H, et al. Epithelial Cells Lining Salivary Gland Ducts Are Early Target Cells of Severe Acute Respiratory Syndrome Coronavirus Infection in the Upper Respiratory Tracts of Rhesus Macaques. J Virol. 2011; 85(8): 4025–4030. https://doi.org/10.1128/jvi.02292-10
- Pedrosa MS, Sipert CR, Nogueira FN. Salivary Glands, Saliva and Oral Presentations in COVID-19 infection. Pesquisa Brasileira em Odontopediatria e Clínica Integrada. 2020; 20(Supp1): e0104. https://doi.org/10.1590/pboci.2020.112
- Xu J, Li Y, Gan F, Du Y, Yao Y. Salivary Glands: Potential Reservoirs for COVID-19 Asymptomatic Infection. J Dent Res. 2020; 98(8): 989. https://doi.org/10.1177/0022034520918518
- Chen L, Zhao J, Peng J, Li X, Deng X, Geng Z, et al. Detection of 2019-nCoV in Saliva and Characterization of Oral Symptoms in COVID-19 Patients. SSRN Electron J. 2020. https://dx.doi.org/10.2139/ssrn.3557140
- Giacomelli A, Pezzati L, Conti F, Bernacchia D, Siano M, Oreni L, et al. Self-reported Olfactory and Taste Disorders in Patients with Severe Acute Respiratory Coronavirus 2 Infection: A Cross-sectional Study. Clin Infect Dis. 2020; 71(15): 889–890. https://doi.org/10.1093/cid/ciaa330
- Lin B, Zhong M, Gao H, Wu K, Liu M, Liu C, et al. Significant expression of FURIN and ACE2 on oral epithelial cells may facilitate the efficiency of SARS-CoV-2 entry. bioRxiv. 2020; (Preprint): 1–15. https://doi.org/10.1101/2020.04.18.047951
- Rabin RC. Lost sense of smell may be peculiar clue to coronavirus infection [Internet]. The New York Times. 2020. Disponible en: https://www.nytimes.com/2020/03/22/health/coronavirus-symptoms-smell-taste.html
- Vaira L, Salzano G, Deiana G, De Riu G. Letter to the Editor. In Response to Isolated Anosmia and Ageusia in COVID-19 With Spontaneous Recovery. J Laryngol Otol. 2020; 130(9): E503. https://doi.org/10.1002/lary.28836
- Vaira LA, Deiana G, Fois AG, Pirina P, Madeddu G, De Vito A, et al. Objective evaluation of anosmia and ageusia in COVID-19 patients: Single-center experience on 72 cases. Head & Neck. 2020; 42(6): 1252–1258. https://doi.org/10.1002/hed.26204
- Chiotos K, Bassiri H, Behrens EM, Blatz AM, Chang J, Diorio C, et al. Multisystem Inflammatory Syndrome in Children during the COVID-19 pandemic: a case series. J Pediatr Infect Dis Soc. 2020; 9(3): 393–398. https://doi.org/10.1093/jpids/piaa069
- Pitones–Rubio V, Chávez–Cortez EG, Hurtado–Camarena A, González–Rascón A, Serafín–Higuera N. Is periodontal disease a risk factor for severe COVID-19 illness? Med Hypotheses. 2020; 144: 109969. https://doi.org/10.1016/j.mehy.2020.109969
- Muniyappa R, Gubbi S. COVID-19 pandemic, coronaviruses, and diabetes mellitus. Am J Physiol Endocrinol Metab. 2020; 318(5): 736–741. https://doi.org/10.1152/ajpendo.00124.2020
- Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020; 8(5): 475–481. https://doi.org/10.1016/S2213-2600(20)30079-5
- Badran Z, Gaudin A, Struillou X, Amador G, Soueidan A. Periodontal pockets: A potential reservoir for SARS-CoV-2? Med Hypotheses. 2020; 143: 109907. https://doi.org/10.1016/j.mehy.2020.109907
- Chakraborty S. Letter to the Editor. Metagenome of SARS-Cov2 patients in Shenzhen with travel to Wuhan shows a wide range of species - Lautropia, Cutibacterium, Haemophilus being most abundant - and Campylobacter explaining diarrhea. OSF Prepr. 2020; (Preprint): 1–3. https://doi.org/10.31219/osf.io/jegwq
- Herrera D, Retamal-Valdes B, Alonso B, Feres M. Acute periodontal lesions (periodontal abscesses and necrotizing periodontal diseases) and endo-periodontal lesions. J Periodontol. 2018; 45(S20): 78–94. https://doi.org/10.1111/jcpe.12941
- Dziedzic A, Wojtyczka R. The impact of coronavirus infectious disease 19 (COVID-19) on oral health. Oral Dis. 2020: 00: 1–4. https://doi.org/10.1111/odi.13359
- Nham E, Ko JH, Jeong BH, Huh K, Cho SY, Kang CI, et al. Severe Thrombocytopenia in a Patient with COVID-19. Infect Chemother. 2020; 52(3): 410–414. https://doi.org/10.3947/ic.2020.52.3.410
- Piedra Abusharar S, Shah N, Patel R, Jain R, Polimera H V. A Case of Confirmed Ceftriaxone-induced Immune Thrombocytopenia. Cureus. 2019; 11(5): e4688. https://doi.org/10.7759/cureus.4688
Referencias
Organización Mundial de la salud. Los nombres de la enfermedad por coronavirus (COVID-19) y del virus que la causa [Internet]. 2020. [Fecha de consulta: 15 de julio de 2020] Disponible en: https://www.who.int/es/emergencies/diseases/novel-coronavirus-2019/technical-guidance/naming-the-coronavirus-disease-(covid-2019)-and-the-virus-that-causes-it
Belser JA, Rota PA, Tumpey TM. Ocular Tropism of Respiratory Viruses. Microbiol Mol Biol Rev. 2013; 77(1): 144–156. https://doi.org/10.1128/mmbr.00058-12
Rothe C, Schunk M, Sothmann P, Bretzel G, Froeschl G, Wallrauch C, et al. Transmission of 2019-NCOV infection from an asymptomatic contact in Germany. N Engl J Med. 2020; 382(10): 970–971. https://doi.org/10.1056/nejmc2001468
Zou X, Chen K, Zou J, Han P, Hao J, Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med. 2020; 14(2): 185–192. https://doi.org/10.1007/s11684-020-0754-0
Lozada–Nur F, Chainani–Wu N, Fortuna G, Sroussi H. Dysgeusia in COVID-19: Possible mechanisms and implications. Oral Surg Oral Med Oral Pathol Oral Radiol. 2020; 130(3): 344–346. https://dx.doi.org/10.1016%2Fj.oooo.2020.06.016
Yuki K, Fujiogi M, Koutsogiannaki S. COVID-19 pathophysiology: A review. Clin Immunol. 2020; 215: 108427. https://dx.doi.org/10.1016%2Fj.clim.2020.108427
Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (COVID-19): A Review [Internet]. JAMA. 2020; 324(8): 782–793. https://doi.org/10.1001/jama.2020.12839
Li F, Li W, Farzan M, Harrison SC. Structure of SARS Coronavirus Spike Receptor-Binding Domain Complexed with Receptor. Science. 2005; 309(5742): 1864–1868. https://doi.org/10.1126/science.1116480
Lu G, Hu Y, Wang Q, Qi J, Gao F, Li Y, et al. Molecular basis of binding between novel human coronavirus MERS-CoV and its receptor CD26. Nature. 2013; 500(7461): 227–231. https://doi.org/10.1038/nature12328
Wang N, Shi X, Jiang L, Zhang S, Wang D, Tong P, et al. Structure of MERS-CoV spike receptor-binding domain complexed with human receptor DPP4. Cell Res. 2013; 23(8): 986–993. https://doi.org/10.1038/cr.2013.92
Ou X, Guan H, Qin B, Mu Z, Wojdyla JA, Wang M, et al. Crystal structure of the receptor binding domain of the spike glycoprotein of human betacoronavirus HKU1. Nature Communications. 2017; 8: 15216. https://doi.org/10.1038/ncomms15216
Qian Z, Ou X, Góes LGB, Osborne C, Castano A, Holmes KV, et al. Identification of the Receptor-Binding Domain of the Spike Glycoprotein of Human Betacoronavirus HKU1. J Virol. 2015; 89(17): 8816–8827. https://dx.doi.org/10.1128%2FJVI.03737-14
Ou X, Liu Y, Lei X, Li P, Mi D, Ren L, et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nature Communications. 2020; 11: 1620. http://dx.doi.org/10.1038/s41467-020-15562-9
Li X, Geng M, Peng Y, Meng L, Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal. 2020; 10(2): 102–108. https://dx.doi.org/10.1016%2Fj.jpha.2020.03.001
Cao W, Li T. COVID-19: towards understanding of pathogenesis. Cell Res. 2020; 30(5): 367–369. https://doi.org/10.1038/s41422-020-0327-4
Zhu J, Ji P, Pang J, Zhong Z, Li H, He C, et al. Clinical characteristics of 3,062 COVID-19 patients: A meta-analysis. J Med Virol. 2020; 92(10): 1902–1914. https://doi.org/10.1002/jmv.25884
Vinayachandran D, Balasubramanian S. Letter to the editor. Is Gustatory Impairment the First Report of an Oral Manifestation in COVID-19? Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13371
Biadsee A, Biadsee A, Kassem F, Dagan O, Masarwa S, Ormianer Z. Olfactory and Oral Manifestations of COVID-19: Sex-Related Symptoms—A Potential Pathway to Early Diagnosis. Otolaryngol Neck Surg. 2020; 163(4): 722–728. https://dx.doi.org/10.1177%2F0194599820934380
Ciccarese G, Drago F, Boatti M, Porro A, Muzic SI, Parodi A. Letter to the editor. Oral erosions and petechiae during SARS-CoV-2 infection. J Med Virol. 2020; 1–4. https://doi.org/10.1002/jmv.26221
Sinadinos A, Shelswell J. Oral ulceration and blistering in patients with COVID-19. Evid Based Dent. 2020; 21: 49. https://doi.org/10.1038/s41432-020-0100-z
Patel J, Woolley J. Letter to the editor. Necrotizing periodontal disease: Oral manifestation of COVID‐19. Oral Dis. 2020; 00: 1–2. http://dx.doi.org/10.1111/odi.13462
Carreras–Presas MC, Amaro–Sánchez J, López–Sánchez AF, Jané–Salas E, Somacarrera–Pérez ML. Oral vesiculobullous lesions associated with SARS-CoV-2 infection. Oral Dis. 2020; 00: 1–3. https://doi.org/10.1111/odi.13382
Ansari R, Gheitani M, Heidari F, Heidari F. Letter to the editor. Oral cavity lesions as a manifestation of the novel virus (COVID‐19). Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13465
Al‐Khatib A. Letter to the editor. Oral manifestations in COVID‐19 patients. Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13477
Carvalho CSLF, Kitakawa D, Cabral LAG. Letter to the editor. Oral lesions of herpes zoster in COVID‐19 patients or truly associated to the disease? Oral Dis. 2020; 00: 1–2. https://doi.org/10.1111/odi.13472
Fisher J, Monette DL, Patel KR, Kelley BP, Kennedy M. COVID-19 associated parotitis: A case report. Am J Emerg Med. 2020; 1–3. https://doi.org/10.1016/j.ajem.2020.06.059
Lechien JR, Chetrit A, Chekkoury–Idrissi Y, Distinguin L, Circiu M, Saussez S, et al. Parotitis-like symptoms associated with COVID-19. Emerg Infect Dis. 2020; 26(9): 2270–2271. https://doi.org/10.3201/eid2609.202059
Capaccio P, Pignataro L, Corbellino M, Popescu–Dutruit, Torretta S. Acute Parotitis: A Possible Precocious Clinical Manifestation of SARS-CoV-2 Infection? Otolaryngol - Head Neck Surg. 2020; 163(1): 182–183. https://doi.org/10.1177/0194599820926992
Chaux–Bodard A–G, Deneuve S, Desoutter A. Letter to the Editor. Oral manifestation of Covid-19 as an inaugural symptom? J Oral Med Oral Surg. 2020; 26(18): 1. https://doi.org/10.1051/mbcb/2020011
Jones I, Bell LCK, Manson JJ, Last A. An adult presentation consistent with PIMS-TS. Lancet Rheumatol. 2020; 2(9): e520–e521. https://doi.org/10.1016/S2665-9913(20)30234-4
Perrillat A, Foletti J–M, Lacagne A–S, Guyot L, Graillon N. Facial pressure ulcers in COVID-19 patients undergoing prone positioning: How to prevent an underestimated epidemic? J Stomatol oral Maxillofac Surg. 2020; 121(4): 442–444. https://doi.org/10.1016/j.jormas.2020.06.008
Ferreira ACA de F, Romão TT, Macedo YS, Pupe C, Nascimento OJM. COVID-19 and herpes zoster co-infection presenting with trigeminal neuropathy. Eur J Neurol. 2020; 27: 1748–1750. https://doi.org/10.1111/ene.14361
Sakaida T, Tanimoto I, Matsubara A, Nakamura M, Morita A. Unique skin manifestations of COVID-19: Is drug eruption specific to COVID-19? J Dermatol Sci. 2020; 99(1): 62–64. https://doi.org/10.1016/j.jdermsci.2020.05.002
Putra BE, Adiarto S, Dewayanti SR, Juzar DA. Viral exanthem with “Spins and needles sensation” on extremities of a COVID-19 patient: A self-reported case from an Indonesian medical frontliner. Int J Infect Dis. 2020; 96: 355–358. https://doi.org/10.1016/j.ijid.2020.05.020
Santos JA, Normando AGC, Silva RLC, Paula RM, Cembranel AC, Santos–Silva AR, et al. Oral mucosal lesions in a COVID-19 patient: New signs or secondary manifestations? Int J Infect Dis. 2020; 97: 326–328. https://doi.org/10.1016/j.ijid.2020.06.012
Soares C, Carvalho RA, Carvalho KA, Carvalho MGF, Almeida O. Letter to Editor. Oral lesions in a patient with Covid-19. Med Oral Patol Oral y Cir Bucal. 2020; 25(4): 563–564. https://dx.doi.org/10.4317%2Fmedoral.24044
Cebeci Kahraman F, ÇaŞkurlu H. Mucosal involvement in a COVID ‐19‐positive patient: a case report. Dermatol Ther. 2020; 33(4): e13797. https://dx.doi.org/10.1111%2Fdth.13797
Scully C, Samaranayake LP. Emerging and changing viral diseases in the new millennium. Oral Dis. 2016; 22(3): 171–179. https://dx.doi.org/10.1111/odi.12356
Drago F, Ciccarese G, Gasparini G, Cogorno L, Javor S, Toniolo A, et al. Contemporary infectious exanthems: an update. Future Microbiol. 2016; 12(2): 171–193. https://doi.org/10.2217/fmb-2016-0147
Castro MCR, Ramos–e–Silva M. The rash with mucosal ulceration. Clin Dermatol. 2020; 38(1): 35–41. https://doi.org/10.1016/j.clindermatol.2019.10.019
Lechien JR, Chiesa–Estomba CM, De Siati DR, Horoi M, Le Bon SD, Rodríguez A, et al. Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Oto-Rhino-Laryngology. 2020; 277(8): 2251–2261. https://doi.org/10.1007/s00405-020-05965-1
Xu X, Chen P, Wang J, Feng J, Zhou H, Li X, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission. Sci China Life Sci. 2020; 63(3): 457–460. https://doi.org/10.1007/s11427-020-1637-5
Liu L, Wei Q, Alvarez X, Wang H, Du Y, Zhu H, et al. Epithelial Cells Lining Salivary Gland Ducts Are Early Target Cells of Severe Acute Respiratory Syndrome Coronavirus Infection in the Upper Respiratory Tracts of Rhesus Macaques. J Virol. 2011; 85(8): 4025–4030. https://doi.org/10.1128/jvi.02292-10
Pedrosa MS, Sipert CR, Nogueira FN. Salivary Glands, Saliva and Oral Presentations in COVID-19 infection. Pesquisa Brasileira em Odontopediatria e Clínica Integrada. 2020; 20(Supp1): e0104. https://doi.org/10.1590/pboci.2020.112
Xu J, Li Y, Gan F, Du Y, Yao Y. Salivary Glands: Potential Reservoirs for COVID-19 Asymptomatic Infection. J Dent Res. 2020; 98(8): 989. https://doi.org/10.1177/0022034520918518
Chen L, Zhao J, Peng J, Li X, Deng X, Geng Z, et al. Detection of 2019-nCoV in Saliva and Characterization of Oral Symptoms in COVID-19 Patients. SSRN Electron J. 2020. https://dx.doi.org/10.2139/ssrn.3557140
Giacomelli A, Pezzati L, Conti F, Bernacchia D, Siano M, Oreni L, et al. Self-reported Olfactory and Taste Disorders in Patients with Severe Acute Respiratory Coronavirus 2 Infection: A Cross-sectional Study. Clin Infect Dis. 2020; 71(15): 889–890. https://doi.org/10.1093/cid/ciaa330
Lin B, Zhong M, Gao H, Wu K, Liu M, Liu C, et al. Significant expression of FURIN and ACE2 on oral epithelial cells may facilitate the efficiency of SARS-CoV-2 entry. bioRxiv. 2020; (Preprint): 1–15. https://doi.org/10.1101/2020.04.18.047951
Rabin RC. Lost sense of smell may be peculiar clue to coronavirus infection [Internet]. The New York Times. 2020. Disponible en: https://www.nytimes.com/2020/03/22/health/coronavirus-symptoms-smell-taste.html
Vaira L, Salzano G, Deiana G, De Riu G. Letter to the Editor. In Response to Isolated Anosmia and Ageusia in COVID-19 With Spontaneous Recovery. J Laryngol Otol. 2020; 130(9): E503. https://doi.org/10.1002/lary.28836
Vaira LA, Deiana G, Fois AG, Pirina P, Madeddu G, De Vito A, et al. Objective evaluation of anosmia and ageusia in COVID-19 patients: Single-center experience on 72 cases. Head & Neck. 2020; 42(6): 1252–1258. https://doi.org/10.1002/hed.26204
Chiotos K, Bassiri H, Behrens EM, Blatz AM, Chang J, Diorio C, et al. Multisystem Inflammatory Syndrome in Children during the COVID-19 pandemic: a case series. J Pediatr Infect Dis Soc. 2020; 9(3): 393–398. https://doi.org/10.1093/jpids/piaa069
Pitones–Rubio V, Chávez–Cortez EG, Hurtado–Camarena A, González–Rascón A, Serafín–Higuera N. Is periodontal disease a risk factor for severe COVID-19 illness? Med Hypotheses. 2020; 144: 109969. https://doi.org/10.1016/j.mehy.2020.109969
Muniyappa R, Gubbi S. COVID-19 pandemic, coronaviruses, and diabetes mellitus. Am J Physiol Endocrinol Metab. 2020; 318(5): 736–741. https://doi.org/10.1152/ajpendo.00124.2020
Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020; 8(5): 475–481. https://doi.org/10.1016/S2213-2600(20)30079-5
Badran Z, Gaudin A, Struillou X, Amador G, Soueidan A. Periodontal pockets: A potential reservoir for SARS-CoV-2? Med Hypotheses. 2020; 143: 109907. https://doi.org/10.1016/j.mehy.2020.109907
Chakraborty S. Letter to the Editor. Metagenome of SARS-Cov2 patients in Shenzhen with travel to Wuhan shows a wide range of species - Lautropia, Cutibacterium, Haemophilus being most abundant - and Campylobacter explaining diarrhea. OSF Prepr. 2020; (Preprint): 1–3. https://doi.org/10.31219/osf.io/jegwq
Herrera D, Retamal-Valdes B, Alonso B, Feres M. Acute periodontal lesions (periodontal abscesses and necrotizing periodontal diseases) and endo-periodontal lesions. J Periodontol. 2018; 45(S20): 78–94. https://doi.org/10.1111/jcpe.12941
Dziedzic A, Wojtyczka R. The impact of coronavirus infectious disease 19 (COVID-19) on oral health. Oral Dis. 2020: 00: 1–4. https://doi.org/10.1111/odi.13359
Nham E, Ko JH, Jeong BH, Huh K, Cho SY, Kang CI, et al. Severe Thrombocytopenia in a Patient with COVID-19. Infect Chemother. 2020; 52(3): 410–414. https://doi.org/10.3947/ic.2020.52.3.410
Piedra Abusharar S, Shah N, Patel R, Jain R, Polimera H V. A Case of Confirmed Ceftriaxone-induced Immune Thrombocytopenia. Cureus. 2019; 11(5): e4688. https://doi.org/10.7759/cureus.4688
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Yaquelin Lázaro Mayoriano, Evaristo Beltrán Ricardo, Ledmar Jovanny Vargas Rodriguez. (2024). Gingivoestomatitis en paciente pediátrico con infección por SARS-CoV-2.. Revista Repertorio de Medicina y Cirugía, 33(1), p.101. https://doi.org/10.31260/RepertMedCir.01217372.1443.
2. Paola Andrea Escobar Villegas, Brayan Daniel Cordoba-Melo, Juan Pablo Arango-Ibanez, Maria Camila Naranjo-Ramirez, Mario Miguel Barbosa, Andrés Felipe Casanova Rojas, Andrés Fernando Mina Sánchez, Cesar José Herrera, Miguel Ángel Quintana Da Silva, Andrés Felipe Buitrago Sandoval, María Lorena Coronel Gilio, Freddy Pow Chon Long, Liliana Cárdenas Aldaz, Juan Esteban Gomez-Mesa. (2025). Xerostomia in survivors of severe COVID-19: findings from a Latin American cohort. Frontiers in Oral Health, 6 https://doi.org/10.3389/froh.2025.1633542.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2020 Erika Alexandra Parra Sanabria, Melisa Bermúdez Bermúdez, Claudia Patricia Peña Vega, Andres Rueda Jimenez

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la licencia Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
- Una vez sometido el artículo no se aceptaran cambios respecto a la incorporación o retiro de autores.






















