Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 10-18
fresco, mientras que los que fueron inducidos ini-cialmente como proembriones se tornaron más pequeños a medida que proliferaron y finalmente quedaron compuestos por MPEs después de varios subcultivos (figura 1B); los tejidos que iniciaron como embriones somáticos globulares se tornaron hiperhídricos y se deterioraron. A pesar que los datos de inducción y las características de los cultivos en el medio de mantenimiento no permiten realizar ninguna correlación con su origen a partir de plantas infectadas con ASBVd, al comparar los resultados obtenidos con los reportados para cultivos inducidos a partir de plantas sanas (Witjakso-noy Linz, 1999; Pliego-Alfaroy Murashige, 1988), se observa claramente que la infección de ASBVd en la planta que provee los explantes no es una limitante para la inducción y multiplicación de cultivos embriogénicos a partir de esta.
Mantenimiento de cultivos nucelares en medio líquido
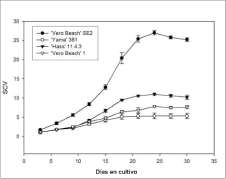
Las masas proembriogénicas establecidas en el medio de cultivo líquido mantuvieron esta característica después de varios subcultivos (figura 1C). La figura 2 muestra el comportamiento de los cultivos en medio líquido y la prueba de Duncan (tabla 1) muestra que el cultivar 'Vero Beach' SE2 obtuvo el mayor volumen de precipitado de células desde el tercer día después de la inoculación y mantuvo esta tendencia. Al final del período de cultivo, 'Vero Beach' SE2 alcanzó el mayor volumen, seguido por el cultivar "Hass" 11.4.3 y los cultivares 'Vero Beach' 1 y 'Ya-ma' 381, en su orden. Todos los cultivares alcanzaron el mayor volumen a los 24 días después de inoculados y la mayor tasa de crecimiento ocurrió entre los 15 y los 18 días para 'Vero Beach' SE2, "Hass" 11.4.3 y 'Vero Beach' 1, mientras que para 'Yama' 381 esta se dio entre los días 9 y 12 después de la inoculación.
El análisis del incremento de volumen a través del tiempo demostró que todos los cultivos presentaron un crecimiento típico de una suspensión celular observado en estudios realizados con material sano (Witjaksono y Litz, 1999), con una fase inicial de bajo crecimiento durante la primera semana, seguida por una de crecimiento más activo en la segunda semana, decreciendo un poco hacia el final de la tercera semana y terminando con una fase de cese del crecimiento al finalizar la cuarta semana de cultivo (figura 2). Este comportamiento de los tejidos indica que, independientemente de la condición patológica de la
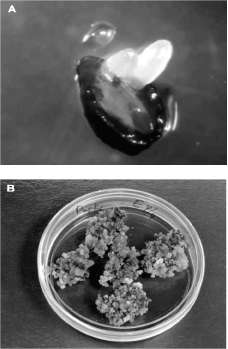
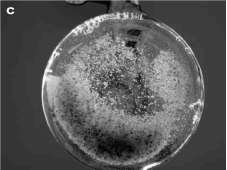
Figura 1. Cultivos embriogénicos de aguacate; A: inducción a partir del nucelo, B: mantenimiento en medio semisólido y C: mantenimiento en medio líquido.
14