MODELO COMPUTACIONAL PARA CARACTERIZACIÓN DE CÉLULAS ESCAMOSAS
perficiales; luego se digitalizó cada una de las imágenes con el propósito de identificar los parámetros.
El número de imágenes que se utilizaron para la caracterización celular es el resultado de un proceso de selección en el que se adquirió un total de 225 fotografías digitales; luego de someterlas a una evaluación para eliminar las que presentaran ambigüedades, se llegó a un total de 183 imágenes disponibles para la caracterización.
Metodología
La metodología para el desarrollo de la herramienta fue el Proceso Unificado de Desarrollo de Software. Se utilizó el Lenguaje Unificado de Modelado, con el cual se prepararon todos los componentes de un sistema de software. La construcción de la herramienta se hizo por medio de casos de uso, centrándose en la arquitectura, de una manera iterativa e incremental. Caso de uso es toda acción que proporcione al usuario un resultado importante. La figura 1 presenta los casos de uso más relevantes (Jacobson et ál., 2001).
Con esta metodología fue importante definir claramente los requisitos del usuario, es decir, lo que se quería que el sistema hiciera, que se planteó como la construcción de una herramienta que permitiera clasificar las células de una citología cérvi-co-uterina. Con este caso de uso se logró diseñar la arquitectura del sistema a medida que evolucionaba el proceso. El trabajo se dividió en partes más pequeñas llamadas iteraciones, que permitieron diferenciar el crecimiento del producto.
El desarrollo de la herramienta y la implementa-ción de los algoritmos se realizó con la plataforma Matlab®, gracias a que esta contaba con la posibilidad de utilizar varias funciones de tratamiento digital de imágenes (The Mathworks Inc., 2003).
Adquisición de las imágenes
Con el propósito de obtener una imagen con las mejores condiciones de iluminación (lograr diferenciar el fondo, el núcleo y el citoplasma) y aumento (visua-lización adecuada de las estructuras celulares), la resolución dependió de la capacidad de la cámara utilizada; se construyeron diversos modelos de adquisición de acuerdo con la disponibilidad de las instituciones y se varió cada uno de los dispositivos para realizarla. Para el modelo definitivo se utilizó:
• Microscopio trinocular Carl Zeiss®.
• Cámara de video Panasonic® con resolución 640x480.
• Tarjeta de adquisición de video MPEG TV Station/USBTM.
• Computador portátil Sony Vaio®.
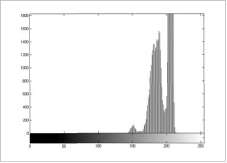
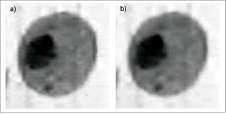
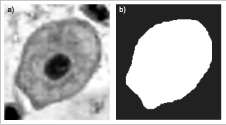
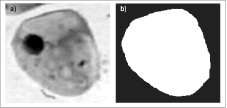
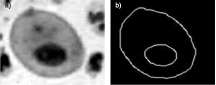
Para la adquisición de las imágenes se buscaron células individuales que mostraron un alto contraste con el fondo, el cual se evaluó en el histogra-ma por medio de la diferenciación de las regiones (núcleo, citoplasma, fondo), como se observa en la figura 2.
Filtrado de la imagen
Una vez adquirida la imagen, se procedió a la construcción de los algoritmos para la etapa de preprocesamiento o filtrado, se utilizaron filtros
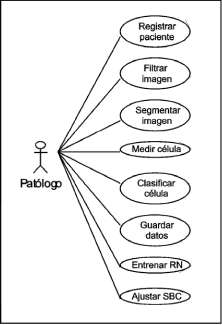
Figura 1. Casos de uso generales.
37