JUGO DE CAÑA VERDE EN LA PRODUCCIÓN DE ÁCIDO LÁCTICO

indica que este sustrato puede emplearse como materia prima barata en la producción fermentativa de ácido láctico, pero se requiere de investigación que permita conocer el comportamiento de este sustrato en fermentaciones en continuo y su posterior separación mediante tecnologías de membranas. La adición de extracto de levadura en un 3 y un 5% p/v al jugo de caña provee un contenido de nitrógeno total de 0,21 y 0,32% respectivamente; el hecho de que esta diferencia en adición de nitrógeno no hubiera mostrado en el análisis estadístico diferencias significativas, sugiere que es suficiente la adición de una mínima cantidad de sustancias nitrogenadas para una buena producción en ácido láctico, pero en investigaciones futuras se podrían estudiar fuentes más baratas de nitrógeno para ser adicionadas al JCV, y de igual forma el comportamiento en jugos de caña verde de otras bacterias ácido lácticas comercialmente disponibles.
BIBLIOGRAFÍA
Akerberg, C.; Hofvendahl, K.; Zacchi, G.; Hahn-Hagerdal, B. 1998 Modelling the influenceof pH, temperature, gluco-se and lactic acid concentration on the kinetics of lactic acid production by Lactococcus lactis ssp. Lactis ATCC 19435 in whole wheat flour. Appl Microbiol Biotechnol. 49: 682-690.
Akerberg, C.; Zacchi, G. 2000. An economic evaluation of the fermentative production of lactic acid from wheat flour. Bioresource Technology. 75: 119-126.
Amrane, A. 2000. Effect of inorganic phosphate on lactate production by Lactobacillus helveticus grown on supple-mented whey permeate. J. ofChem Techonol and Biotechnol. 75(3):223-228.
Boonmee, M.; Leksawasdi, N.; Bridge, W.; Rogers, P. 2003. Batch and continuous culture of Lactococcus lactis NZ133: experimental data and model development. Biochemical Engineering Journal. 14: 127-135.
Chang, D.; Jung, H.; Rhee, J.; Pan, J. 1999. "Homofermentati-ve production of D- or L-lactate in metabolically
JCV180-3N
250,00
60
- Ác. Láctico Azúcar total
- Biomasa (g/L)
20 40
Tiempo (horas)
|
250,00 -t 5 200,00 -2 j- 150,00 -| 3 100,00 -§ 50,00 j
|
JCV180-5N
|
|
|
|
||
|
£™^—-—r-.
|
|
|
||||
|
-3 g
"2 8
-i I
|
■ Ac. Láctico —A— Azúcar total —♦— Biomasa
|
|
||||
|
CQ
|
|
|
||||
|
0 10 20 30 40 50 60 Tiempo (horas)
|
|
|||||
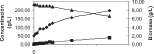
Figuras 1, 2 y 3. Cinéticas de producción de ácido láctico, formación de biomasa y consumo de sustrato para JCV-0N, JCV-3N y JCV-5N respectivamente (promedio de tres ensayos).
microorganismo así como el de otras bacterias ácido lácticas adaptadas a sustratos ricos en sacarosa y a otros sustratos diferentes a lactosa.
De otro lado, si bien la producción comercial de ácido láctico se ha llevado a cabo a partir de sustratos puros como glucosa, sacarosa y lactosa, la tendencia actual es utilizar residuos o
materias primas más baratas y emplear tecnologías de separación de metabolitos que pueden no requerir filtración ni centrifugación previa como es el caso de la elec-trodiálisis (Nomura et al., 1989 y 1991; Ishizaki, 1990; Yao y Toda, 1990 Vonkta-veesuket al., 1994); el hecho de que el JCV pueda ser fermentado sin centrifugación
|
|
Tabla 1. Parámetros cinéticos calculados a partir de tres réplicas de datos experimentales para JCV-0N, JCV-3N y JCV-5N
|
|
|||||
|
|
|
JCV-0N
|
JCV-3N
|
JCV-5N
|
|
||
|
Tiempo de fermentación hasta, Pmax (h) Glucosa inicial So (g/L) Glucosa final S (g/L) al tiempo en que P es max Glucosa consumida So-S (g/L) Conversión de glucosa 100*(So-S)/So (%) Concentración máx. de ácido láctico Pmax (g/L) Rendimiento de producto Yp/s (P/(So-S)) g/g
|
48 233,98 174,66 59,32 25,35 10,2 0,17
|
48 233,07 165,10 67,97 29,16 39,57 0,58
|
48 232,45 155,68 76,77 33,03 40,78 0,53
|
||||
41