REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 90-100
obtenidos demuestran que el tiosulfato fue reducido en las diferentes series de cultivo donde éste se adicionó, y las especies dominantes (en términos de abundancia), aisladas de las últimas diluciones positivas del NMP fueron organismos fermentadores tiosulfato reductores. Otros estudios (Fardeau et al., 1994; Fardeau et al., 1996) demostraron que la presencia de tiosulfato sí aumenta la velocidad de crecimiento y la tasa de degradación de sustratos (pépti-dos, aminoácidos y azúcares) de organismos anaerobios termofílicos fermentadores del género Thermoanaerobacter aislados de yacimientos petroleros y MTM.
Se han identificado miembros del dominio Archaea reductores de tiosulfato y azufre elemental (Thermoproteus, Pyrodictium y Pyrobaculum spp) y del dominio Bacteria (familia Thermoanaerobiaceae y orden Thermotogales) (Lee et al., 1993; Stetter et al., 1990; Subbotina et al., 2003; Ravot et al., 1995), pero incapaces de reducir el sulfato. Este tipo de organismos reductores de tiosulfato, no sulfato-reductores se han reportado en los MTM y en reservorios de petroleo (Fardeau et al., 2000) y están involucrados en el ciclo del azufre y del carbono en sus respectivos hábitat.
Los compuestos de azufre oxidado como el tiosulfato o el sulfato son usados por diferentes organismos heterótrofos miembros de los dominios Archaea y Bacteria como aceptores de electrones para la degradación de la materia orgánica (Sievertet al., 1999). Aunque la concentración de tiosulfato no fue medida en este ecosistema, se conoce la concentración de sulfato de sodio (19.250 mg/L) (Alfaro, 2002). Este sulfato puede ser reducido a H2S por la actividad biológica de las bacterias sulfato-reductoras, presentes en este ecosistema (Thevenieau, 2003). En la interfa-se óxica-anóxica del MTM, el H2S puede ser oxidado biológicamente a sulfato o tiosulfato o puede ser igualmente oxidado químicamente a tiosulfato en condiciones microaerofílicas. Cabe anotar que durante el periodo de estudio no fue evidente la presencia de H2S, que genera olores característicos, es probable entonces que éste se oxidara continuamente a medida que se generaba. Por tanto, la presencia de tiosulfato y/o sulfato en este ecosistema puede ser producto del ciclo del azufre y su formación y utilización dependen de la acción e interacción de diferentes microorganismos (organismos azufre-reductores y organismos sulfato y tiosulfato-reductores).
Aislamiento y caracterización preliminar de microorganismos dominantes. Durante el recuento por NMP se observaron al microscopio diferentes morfologías microbianas destacándose principalmente formas bacilares. A partir de las últimas diluciones positivas de las diferentes series de cultivo se realizaron medios sólidos para el aislamiento microbiano y se obtuvieron numerosas colonias redondas, pequeñas y blancas de centro café, después de 5 a 7 días de incubación. Se aislaron diferentes cepas y finalmente se seleccionaron 8 cepas anaerobias estrictas denominadas P4-6, P4-7, P4-8, P4-9, P4-10, P4-11, P4-12 y P4-13 para su posterior estudio.
Morfología. Las cepas aisladas presentaron morfologías similares, siendo bacilos finos entre 2 y 5 ìm de largo, que forman cadenas de 2 a 4 células (figura 1). Todas las cepas presentaron coloración Gram positiva y no se encuentran variaciones en su morfología que permitan establecer diferencias entre ellas. Se observó movilidad y presencia de esporas en posición terminal.
Características fisiológicas. Las 8 cepas aisladas son anaerobias estrictas y quimioorganótrofas. La temperatura óptima de crecimiento osciló entre 60 y 65 °C con un rango de temperatura de crecimiento entre 55 y 75 °C. Estas cepas exhibieron una mayor afinidad por los azúcares y fermentaron glucosa, galactosa, lactosa, mannosa, maltosa, xilosa, mani-tol, pero no utilizaron arabinosa. El principal meta-bolito final producido fue etanol, seguido por bajas concentraciones de acetato, hidrógeno y CO2.
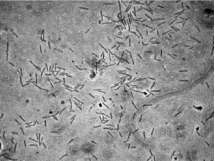
Figura 1. Fotomicrografía de contraste de fase de la cepa P4-9 en fase exponencial de crecimiento. Barra = 5 \im
94