CARACTERIZACIÓN DE RIZOBACTERIAS ASOCIADAS AL CULTIVO DEL MAÍZ
desempeñan los sideróforos en el control de patógenos de plantas, la búsqueda de nuevas cepas productoras y medios donde la producción de los mismos sea óptima, resulta de gran interés.
Producción de ácido salicílico (AS)
Diversos autores han señalado el papel que desempeña el ácido salicílico en la inducción de resistencias en las plantas contra el ataque de diferentes patógenos, constituyendo uno de los principales determinantes involucrados en la inducción de resistencia sistémica (ISR) por rizobacterias (Van Loon et al., 1998; Maurhofer et al., 1998; Grill y Himmelbanch, 1998).
La producción de AS in vitro por las cepas de Pseudomonas fluorescens, Burkholderia cepacia y Pseudomonas aeruginosa (controles) fue analizada cuantitativamente por espectrofotómetro mediante la detección del complejo púrpura formado por la unión del hierro y el AS (tabla 2). Los resultados demostraron diferentes niveles en la producción de AS para las cepas estudiadas con diferencias significativas entre ellas para un p<0.05. La cepa de Pseudomonas aeruginosa KMPCH, utilizada como control positivo, mostró niveles altos de producción de este metabolito, lo que corrobora los buenos resultados obtenidos con esta cepa en la inducción de resistencia en frijol ante el ataque de Botrytis cinerea y Colletotrichum lindemuthianum (De Meyer y Hofte, 1997).
No se detectó producción de AS por la cepa de Pseudomonas aeruginosa 7NSK2-562 utilizada como control negativo. Esto confirma que esta cepa no tiene la capacidad de producir AS y corrobora los resultados obtenidos por De Meyer y Hofte (1997) quienes demuestran que es un mutante en la producción de ácido salicílico y piochelin. Tampoco se detectó la producción de este metabolito en la cepa de Pseudomonas fluorescens MPf13 y en las cepas de Burkholderia cepacia MBf6, MBf9 y MBf 19. Las cepas de referencia 0057 y J-143 también mostraron altos niveles en la producción de AS. Se han encontrado efectos beneficiosos en la estimulación del crecimiento vegetal y biocontrol de patógenos al inocular estas cepas en diferentes cultivos de interés agrícola (Hernández et al., 1995).
En comparación con la cepa KMPCH, utilizada como control positivo en este estudio, las cepas de B. cepacia MPBp1 y MBf 15 producen altos niveles de este metabolito, mientras que las otras cepas producen niveles intermedios o bajos. Es importante señalar que las cepas que se destacan por las mayores producciones de este metabolito están identificadas como B. cepacia. Este comportamiento podría estar relacionado con los tipos de sideróforos que producen estas bacterias. Se han encontrado altos niveles en la producción de AS de cepas pioverdines negativos que indican que el AS compensa la ausencia del pioverdin. Este fenómeno ha sido observado en la cepa de Pseudomonas fluorescens CHAO y la cepa de Pseudomonas aeruginosa KMPCH, ambas deficientes en la producción de este tipo de sideróforo (Meyer et al., 1992).
El análisis de Conglomerado Jerárquico y de Ligamiento Completo, sobre la base de la distancia euclidiana, permitió agrupar las cepas por su capacidad de producir los metabolitos en estudio (distancia de unión de 25) en dos grupos (Figura 1), dentro de los cuales se encontraban los patrones creados.
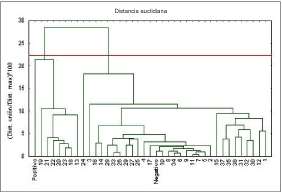
Figura 1. Dendrograma para el agrupamiento de las cepas de acuerdo con la producción de AIA, sideróforos y AS. Dendrograma calculado a partir del análisis de las concentraciones de los metabolitos en estudio. El control positivo está formado por las concentraciones más altas de metabolitos del tipo AIA, sideróforos y AS producidas por las cepas, y el control negativo por las concentraciones más bajas.
11
