|
|
|
|
|
|
|
|
|
|
Screening para el aislamiento y caracterización de
microorganismos y enzimas potencialmente útiles para la
degradación de celulosas y hemicelulosas
Screening for isolation and characterisation of
microorganisms and enzymes with usefull potential for
degradation of celullose and hemicelluose
José Fernando Mikán Venegas*, Diana Edith Castellanos Suárez**
|
|
|
|
|
|
|
|
RESUMEN
Se presenta un modelo práctico de microbiología aplicada y biotecnología para aislar y caracterizar microorganismos, como una minúscula muestra de la extensa biodiversidad de nuestros suelos. Se analiza su capacidad para producir depolimerasas e hidrolasas accesorias para la degradación de xiloglucanos-pectatos o glucoarabinoxilanos, con el fin de evaluar su potencial como degradadores de material vegetal. Se propone el uso del cultivo en paredes celulares vegetales como única fuente de carbono, como inductores de las actividades hidrolíticas, y el uso de las mismas paredes celulares y de xilano entrecruzado para purificar en forma rápida y económica enzimas degradadoras de celulosas y hemicelulosas. Con estos soportes de afinidad se logró un redimiento de purificación de xilanasas del 500% en un solo paso. Partiendo de 65 aislamientos se seleccionaron cinco, a los cuales se les hizo caracterización isoenzimática para celulasas y xilanasas. Se les sugiere como potencialmente útiles en compostaje y otros procesos industriales.
Palabras clave: celulasas, hemicelulasas, cromatografía de afinidad, sustratos entrecruzados, diversidad microbiológica, compostaje.
ABSTRACT
A practical, applied microbiology and biotechnology model is presented for isolating and characterising micro-organisms, this being a tiny part of the immense biodiversity of tropical soils. These microbes' ability to produce depolymerases and accessory hydrolases degrading xyloglucans-pectates or glucoarabinoxylans is analysed to evaluate their potential for degrading plant material. We propose culturing micro-organisms on the cell wall as main carbon source and as hydrolitic activity inducer. The same cell walls can be used for cross-linking xylan and for rapid, low cost purification of cellulose and hemicellose degrading enzymes. A 500% xylanase purification yield was obtained in a single step with these affinity supports. Out of the 65 isolates obtained were finally selected for characterising isoenzymes for cellulase and xylanase activities. The five strains are suggested as being potentially useful in different industrial processes regarding degrading cellulose and hemicellulose.
Key words: Cellulase, hemicellulase, affinity chromatography, cross-linked substrate, microbiological diversity, composting.
INTRODUCCIÓN des para hacer uso del recurso. El desarrollo de nuevos productos y procesos -claves en el desarrollo
La biotecnología pretende hacer uso de la biodiversidad futuro de la biotecnología- depende del hallazgo de del planeta para producir o modificar sustancias útiles. nuevas fuentes de materiales biológicos, así como Por ello, la relación entre biodiversidad y biotecnología de la creatividad y de la capacidad de los investigado-es bastante estrecha. A mayor conservación y conoci- res para descubrir, evaluar y desarrollar dichas fuen-miento de la biodiversidad, existirán más oportunida- tes. Por tanto, métodos acertados de estudio de la
|
|
|
|
|
|
|
|
Ph. D. Facultad de Medicina, Universidad Militar Nueva Granada. Transversal 5 No. 49-00 Bogotá, Colombia. Correo electrónico: jfmikan@umng.edu.co
" Microbióloga. Centro Internacional de Física. Edificio Manuel Ancizar, Ciudad Universitaria, Bogotá. Correo electrónico: castellanosdiana@hotmail.com
Recibido: diciembre 9 de 2003. Aceptado: mayo 31 de 2004.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SCREENING PARA EL AISLAMIENTO Y CARACTERIZACIÓN DE MICROORGANISMOS Y ENZIMAS
|
|
|
|
|
|
|
|
biodiversidad conllevarán a aumentar la probabilidad de descubrir y desarrollar biotecnologías valiosas.
En general, las paredes celulares vegetales pueden considerarse como un sistema de dos fases que comprende una matriz continua hidratada, y contiene una fase organizada de fibrillas de celulosa, las cuales están embebidas en una matriz constituida por xiloglucanos y pectina o glucoarabinoxilanos, y puede tratarse de paredes celulares de dicotiledóneas y de la mayoría de monocotiledóneas (paredes tipo I) o de las paredes celulares de las gramíneas (paredes tipo II), de acuerdo con el modelo establecido por Carpita y Gibeaut (1993).
La hidrólisis enzimática de celulosa y hemicelulosa, componentes principales de las paredes vegetales, se lleva acabo principalmente por un consorcio de enzimas microbianas que actúan conjuntamente, y de las cuales las celulosomas, endoxilanasas y poligalacturonasas son las más estudiadas. Es también conocido que las hidrolasas de las paredes celulares vegetales suelen contener dominios catalíticos y no catalíticos, incluyendo entre estos dominios de unión a los sustratos. Se cree que el papel de tales dominios es permitir el reconocimiento y contacto con las fibras de la pared celular, como se ha demostrado en varios microorganismos (Nogawa et al., 1999; Vincent et al., 1997; Millward-Sadler et al., 1995).
Existe actualmente una demanda creciente por celulasas y hemicelulasas específicas, eficientes y baratas, para utilizarlas en formulaciones de compuestos limpiadores, en los procesos industriales de productos agrícolas tales como la producción de jugos de frutas y conservas, en la producción textil, en la industria de la pulpa y del papel y en la degradación de materiales lignocelulósicos para la producción de compost y bio-etanol. Por esto es de interés incrementar la información sobre la producción de las muy diversas celulasas y hemicelulasas microbianas y su regulación durante el crecimiento de los microorganismos en diferentes fuentes de carbono.
MATERIALES Y MÉTODOS
Extracción de paredes celulares vegetales y aislamiento de microorganismos
Para preparar las fracciones de pared celular vegetal se recolectaron: (i) hojas de clavel y de aster de plantas jóvenes (pared tipo I) y (ii) láminas de
|
plántulas de avena y de maíz (pared tipo II). El material vegetal se maceró en nitrógeno líquido y se suspendió en 2.5 volúmenes de tampón fosfato 0.1 M (pH 6.0). Seguidamente se licuó durante 3 min a alta velocidad y se filtró en dos capas de lienzo. Este material se lavó en 2 volúmenes del mismo tampón 3 veces para lavar el material hidrofílico. Finalmente se realizó un enjuague con 3 volúmenes de agua destilada estéril y se filtró el material fibroso, el cual se suspendió en 2 volúmenes de la mezcla clorofor-mo-metanol (1:1), la que se dejó en reposo durante 5 min para retirar componentes celulares lipídicos. El material vegetal particulado se filtró en dos capas de lienzo, se lavó 3 veces con 2 volúmenes de acetona, y por último se dejó secar a temperatura ambiente y se almacenó a -20 °C.
Se aislaron microorganismos de muestras de compost y de suelos bajo agricultura orgánica y de caldos microbianos de plantas sanas bajo el mismo régimen, directamente en los medios con pared celular vegetal, empleando la técnica de diluciones seriadas y siembra en superficie. Los microorganismos que crecieron en los medios con pared celular vegetal fueron purificados por cultivos monospóricos (hongos) y colonias individuales por dilución para bacterias y actinomycetes. Estos cultivos se reaislaron utilizando Agar nutritivo para bacterias, Agar-PDA para los hongos y Agar-Caseína-Almidón para actinomycetes (Ramírez, 1996), conservándose en medios de cultivo sólidos con pared celular vegetal como única fuente de carbono hasta su posterior utilización.
Selección inicial de microorganismos
Las paredes celulares vegetales se utilizaron en medios de cultivo sólidos conteniendo dicho material como única fuente de carbono, en concentración del 1% (p/v), suspendida en una solución mineral compuesta de (g/L): 1g KH2PO4, 2g NaNO3, 0.5 g MgSO4.7 H2O y 9.76 g MES y agar 1.5% p/v (Cooper y Wood, 1980). Se inocularon medios de cultivo en cajas de Petri con cuatro divisiones, cada división contenía cada uno de los diferentes tipos de pared. Se sembraron en paralelo cajas controles (agar 1.5% p/v en agua, agar 1.5% p/v en la solución de minerales anteriormente descrita y la solución de minerales sin agar). Se evaluó la viabilidad de todos los inóculos sembrándolos en medios nutritivos.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No. 1 Julio 2004 58 - 71
|
|
|
|
|
|
|
|
Se partió de un total de 65 aislamientos, cuyas concentraciones se ajustaron a 108 ufc/mL para bacterias (tubo No. 1 del patrón de Mac Farland según Rico, 1997); 105 a 108 células/ mL para actinomycetes y 105 y 107 esporas/mL para hongos filamentosos (contados con cámara de Neubauer). Cada una de las suspensiones microbianas a evaluar se inoculó en medios de cultivo sólidos (siembra masiva), con cada una de las cuatro paredes celulares como única fuente de carbono, y en los medios controles. Se consideró como unidad experimental el inóculo sembrado en una caja de Petri con cuatro divisiones. Cada unidad experimental contó con tres réplicas. Las cajas se incubaron bajo las siguientes condiciones: para bacterias y actinomycetes a 25 °C y hongos a temperatura ambiente. La evaluación del crecimiento de los microorganismos en los medios de cultivo (colonias evidentes) se realizó a las 24 y 48 horas para bacterias y entre 3 a 5 días para hongos y actinomycetes. Los microorganismos seleccionados se almacenaron en los medios con las paredes celulares con el fin de asegurar y potencializar la capacidad enzimática para degradar de este tipo de sustratos.
Segunda selección de microorganismos
Un total de 46 aislamientos fueron capaces de crecer en paredes celulares. Con ellos se inocularon medios de cultivo sólidos que contenían como fuente única de carbono los siguientes sustratos al 1% p/v (todos Sigma): carboximetil celulosa (CMC), xilano de hojuelas de avena (XYL) y pectina de manzana (PEC), disueltos en la solución de minerales y agar (1.5% p/v). La inoculación se realizó sumergiendo un disco de papel filtro estéril de 0.5 cm de diámetro en la suspensión microbiana, para luego colocarlo en el centro de la caja de Petri, y así permitir tomar la medida del halo de degradación realizada por la actividad hidrolítica del microorganismo. Este procedimiento se realizó por triplicado, incubando las bacterias a 25 °C por 48 h, y los hongos y actinomycetes a temperatura ambiente entre 3 a 5 días. Los halos de degradación se evidenciaron adicionando revelantes disueltos en agua, después del tiempo de incubación: rojo congo al 1% (p/v) para celulosa y xilano, y rojo de rutenio al 0.2% (p/v) para pectina. Se midió el diámetro de las colonias y de los halos producto de la degradación enzimática. Se calculó el tamaño de los halos de hidrólisis, aplicando la fórmula A-B= C; donde A hace referencia al diámetro de la colonia más el halo de hidrólisis, B es el diámetro de la colonia y C
|
es el resultado de la diferencia de las dos medidas y equivalente al halo de degradación o de hidrólisis que formó el microorganismo (Pedroza et al., 2001).
Medios de cultivo líquidos con paredes celulares como única fuente de carbono para el estudio de la cinética de la expresión de las actividades hidrolíticas
Para medir las actividades hidrolíticas de los actinomycetes y hongos provenientes de la segunda selección se realizaron cultivos líquidos en frascos de 30 mL, con 5 mL de suspensiones de pared celular de maíz o de clavel al 1 % (p/v) en solución de sales minerales. Cada aislamiento contó con tres frascos por cada uno de los cinco intervalos de tiempo (0, 72, 96, 120, 168 h). Cada frasco fue inoculado con una suspensión de 107 cél/mL e incubado en agitación a 150 rpm y a 28 °C. En el momento de la recolección de muestras, se tomó una alícuota de 100 ^L para realizar recuentos de células en cámara de Neubauer, con el fin de evaluar el crecimiento de cada uno de los microorganismos del ensayo. Luego, los cultivos se centrifugaron a 12.000 xg por 10 min para remover el material suspendido. Los sobrenadantes se congelaron a -20 °C para luego hacer cuantificación de las proteínas totales (Stoscheck, 1990) y las actividades enzimáticas. Las actividades endo-poligalacturonasa y endoxilanasa fueron determinadas por ensayos viscosímetricos, midiendo la disminución de la viscosidad de los sustratos PEC y XYL, con un viscosímetro de cilindros de rotación coaxial (HAAKE, Rotovisco RV20). A una solución de 7 mL de los sustratos, en concentración 1% (p/v) en tampón fosfato de sodio 50mM pH 6.0, se añadió 1 mL de los sobrenadantes y se dejaron reaccionar durante 30 min a 37 °C, tomando mediciones cada 5 min. Como control se utilizó 1 mL del tampón fosfato. Se obtuvieron 6 lecturas de viscosidad para cada muestra, las cuales se analizaron con un programa diseñado en el sistema MATLAB 6.5, el cual determinó la ecuación de la curva y el punto donde se presentó una reducción del 20% en la viscosidad. Las actividades enzimáticas se expresaron como unidades de viscosidad relativa (UVR), definidas como el tiempo en el cual hay una disminución del 20% en la viscosidad inicial.
La actividad celulolítica de sobrenadantes de los cultivos se determinó por medición de los azúcares reductores producidos por la actividad hidrolítica sobre CMC (Somogyi, 1951). Se mezclaron 10 ^L de
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SCREENING PARA EL AISLAMIENTO Y CARACTERIZACIÓN DE MICROORGANISMOS Y ENZIMAS
|
|
|
|
|
|
|
|
sobrenadante con 90 ^L de solución de CMC (0.1% p/v), disuelto en un tampón acetato de sodio 50 mM pH 5.5 y se dejaron reaccionar por 30 min a 42 °C. La reacción se detuvo por inmersión en baño de agua a 94 °C por 5 min. En seguida se agregaron las soluciones de Somogyi, se colocaron de nuevo los tubos al baño de 94 °C por 30 min, se dejaron enfriar y se agregaron 100 ^L del reactivo de Nelson y 500 ^L de agua. Finalmente, se leyeron alícuotas de 200 ^L en una placa de microtitulación en un lector de Elisa (MPR- 2100) con filtro de 630 nm y utilizando como blanco tampón acetato. Las absorbancias se convirtieron a nanokatales (nKats), con el uso de una curva de calibración de concentraciones conocidas de glucosa (rango de 0-100 \ig) para reportar actividad enzimática en nKats/mL.
Las actividades glicosidasas y acetilesterasa fueron cuantificadas midiendo el incremento de la absorbancia a 405 nm, dada por la liberación de p-nitrofenol de los sustratos p-nitrofenil derivados (todos Sigma): oc-L-arabinofuranosido, p-D-glucuronido, p-D-galactopiranosido, p-D-glucopiranosido y p-D-xylopiranosido, para la determinación de las actividades glicosidasas, y p-nitrofenilacetato (Sigma) para la actividad acetilesterasa. Todos los sustratos se disolvieron en tampón acetato de sodio 50 mM pH 5.5 a una concentración de 5 mM. Cada reacción consistió en 90 ^L de la solución de sustratos en tampón y 10 ^L de la muestra, la cual se incubó a 42 °C durante 30 min. Las reacciones se detuvieron con la adición de 200 \iL de NaHCO3 al 6% (p/v). La absorbancia se leyó en un lector de Elisa (Sytron MPR- 2100) con un filtro de 405 nm, utilizando como blanco tampón acetato de sodio. Se realizó una curva de calibración de p-nitrofenol en el rango de 0-5 Rimóles, con la cual se transformaron las absorbancias en nKats.
Tercera selección de microorganismos
Se seleccionaron cinco aislamientos, teniendo en cuenta sus actividades depolimerasas, glicosidasas y esterasas: se cultivaron 3 actinomycetes y 2 hongos para obtener un mayor volumen de muestras y hacer isoelectroenfoque (IEF). Para ello se obtuvo biomasa cultivando en medios líquidos enriquecidos por 3 días en agitación constante a 150 rpm y 28 °C. Luego, los medios se filtraron en una membrana de nylon (tamaño de poro de 0.22 ^irn), para separar la biomasa, lavarla en agua destilada estéril e incubarla en una solución de sales minerales durante 24 horas, para generar condiciones de estrés nutricional
|
e inducir expresión génica (Coleman et al.,1997). En seguida, la biomasa se filtró y se pasó a los medios líquidos con pared celular vegetal (maíz o clavel, 1% p/v), los cuales se incubaron durante 5 días a 150 rpm y 28 °C. Finalmente los medios líquidos con pared celular se centrifugaron a 12.000 xg durante 15 min, con lo que se separaron los sobrenadantes. Éstos se liofilizaron para concentrar las proteínas, las cuales se resuspendieron en agua desionizada.
Cromatografía de afinidad en xilano entrecruzado y paredes celulares I y II
Ya que muchas enzimas hidrolíticas contienen dominios de unión a los sustratos sobre los que actúan, se procedió a realizar ensayos de purificación parcial de depolimerasas por adsorción a xilano entrecruzado y a las mismas paredes celulares. Se preparó xilano entrecruzado con el uso de epiclorihidrina (Rozie et al., 1992; Mikán, 2001), mezclando 8 g de XYL en 12.5 mL de agua destilada y 26.5 mL de NaOH 5M con agitación continua en un baño a 40 °C. A esto se añadió 10.5 mL de (+)-epiclorohidrina (Aldrich), continuado la agitación hasta que la mezcla gelificó. La reacción se dejó a 40 °C por otras 24 h, después de las cuales se aumentó la temperatura a 70 °C por 16 horas. El gel seco se trituró en mortero hasta obtener partículas finas, las cuales fueron lavadas, primero con un 1 litro de ácido acético al 7% (v/v) y luego con la misma cantidad de agua hasta obtener pH neutro. Finalmente las partículas se liofilizaron.
Se estableció una batería de tampones acetato de sodio (pH 4.0 y 5.8) y Tris-HCl (pHs 7.6 y 9.0), todos en concentración de 20 mM. Posteriormente, 50 mg de xilano entrecruzado o de las paredes celulares de clavel y de maíz, se resuspendieron en 1 mL de los diferentes tampones, incubándose a 20 °C por 10 min, para luego centrifugar a 1.000 g x 5 min. Los sobrenadantes se descartaron y se reemplazaron por soluciones frescas. Esta operación se repitió 3 veces de manera que se estabilizara la concentración de los tampones y el pH de los sustratos. Después el xilano entrecruzado y las paredes celulares se resuspendieron en 0.4 mL de cada uno de los tampones a lo que se añadió 0.1 mL de medio de cultivo concentrado (que contenía más de 200 mg de proteínas). Las suspensiones fueron incubadas nuevamente a 20 °C por 30 min, centrifugadas y decantadas. El pellet (sustratos) se lavó tres veces con 1.5 mL del mismo tampón, después de lo cual las proteínas fueron desorbidas de los sustratos, agregando
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 58 - 71
|
|
|
|
|
|
|
|
400 \iL del mismo tampón más 0.5 M NaCl. Las suspensiones se equilibraron por 15 min y se centrifugaron nuevamente. Los sobrenadantes (400 ^L) se desaltaron usando columnas de 5 mL de Sephadex G-25 equilibradas con tampón acetato 5 mM pH 5.5. Las fracciones se concentraron seguidamente por precipitación con dos volúmenes de acetona fría (-20 °C). Una vez secos, los pellets se resuspendieron en agua deionizada, para luego medir las actividades depolimerasas por la cantidad de azúcares reductores producidos (Somogyi, 1951), en una reacción como la descrita anteriormente. El grado de adsorción de las proteínas se determinó midiendo la diferencia entre las actividades depolimerasas de los controles (el mismo procedimiento pero en ausencia de sustratos de adsorción) y la actividad de los sobrenadantes con enzimas desorbidas.
Isoelectroenfoque (IEF) y Zimogramas
Se prepararon geles de IEF para analizar el número de bandas presentes en sobrenadantes con actividades enzimáticas y el punto isoeléctrico de los polipéptidos, empleando marcadores de pI (Ampholine pH de 3 a 10, Pharmacia-Biotech) y tinciones específicas. Medios de cultivo concentrados, resuspendidos en 50 a 100 ^L de agua desionizada se corrieron en geles de poliacrilamida de 125 x 105 x 0.4 mm en un aparato de electroforesis horizontal (LKB Bromma 2117 Multiphor, Pharmacia), el cual fue conectado a un sistema refrigerante a 6 °C (MultiTem III, Pharmacia). Las condiciones de corrido fueron: (i) precorrido a 1000V, 12 mA ,12W por 30 min; (ii) aplicación de muestras (1 a 10 ^L); (iii) corrido 1 a 2200V, 12 mA , 11W por 45 min; (iv) remoción de papeles de siembra; (v) corrido 2 a 2400V, 10 mA , 10W por 45 min y (vi) focalizacion a 3000V, 10 mA, 10W por 30 min; usando como electrolitos NaOH 1 M y H3PO41 M. La actividad celulolítica y xilanolítica fue detectada siguiendo el método de Mackenzie y Williams (1984), sobreponiendo un gel de agarosa (1.5% p/v) con XYL o CMC (0.1% p/v) en tampón acetato de sodio 100 mM pH 5.5 por 7 min a 42 °C. La reacción se detuvo sumergiendo el gel en solución NaCl 1M y se coloreó con Rojo congo (0.1% p/v en agua) por 20 min; las bandas de actividad se observaron después de lavar el gel con NaCl 1M.
RESULTADOS Y DISCUSIÓN
Se evaluaron 18 aislamientos de bacterias, 27 de actinomycetes y 20 de hongos, observando su capa-
|
cidad de crecimiento en 4 sustratos: 2 paredes celulares tipo I (clavel y aster) y 2 paredes celulares tipo II (maíz y avena). Todas las cepas mostraron un crecimiento abundante en medios nutritivos, confirmando así la viabilidad de los inóculos empleados. Los hongos filamentosos y los actinomycetes fueron los grupos con mayor número de aislamientos capaces de crecer en paredes celulares vegetales: 18 hongos y 25 actinomycetes (destacándose el género Streptomyces con 9 aislamientos); entre tanto, en los sutratos sólo crecieron bacterias del género Bacillus (2 aislamientos) y un0 de Pseudomonas. Todos los microorganismos mostraron capacidad de crecer igualmente en los 4 sustratos, indicando que dentro del grupo inicial estudiado ninguno presenta baterías enzimáticas especializadas para la degradación de hemicelulosas ricas en pectatos (paredes tipo I) o glucorabinoxilanos (paredes tipo II). Esto estaría de acuerdo con un grupo de saprófitos típicos o patógenos facultativos, estando ausentes dentro del grupo estudiado los patógenos o saprófitos especializados por uno u otro tipo de pared, cuyas células hubieran tenido crecimiento selectivo (Tonukari et al., 2000; Cooper, 1987; Magro, 1984).
En la segunda selección sobre sustratos específicos se observó que las tres cepas bacterianas seleccionadas no mostraron halos de degradación en PEC, y que sus halos en XYL y CMC no superaron el diámetro de 0.3 cm, el cual fue bastante inferior a los valores obtenidos por los hongos y actinomycetes evaluados, razón por la cual se determinó no incluir ninguna bacteria en la tercera etapa del estudio (cinética de actividades enzimáticas). Respecto a los halos de degradación de los actinos, en general éstos fueron mayores en CMC y XYL que en PEC; además, mostraron un promedio de diámetro de halos de degradación mayor que el de los hongos filamentosos y bacterias (figura 1), destacándose aislamientos del género Streptomyces. No obstante, se observó una dispersión amplia de los datos de diámetro de los halos de las distintas especies de actinomycetes respecto de su promedio (figura 1B). Como criterio de selección para la siguiente fase se utilizaron diferencias significativas: se consideraron primero diferencias entre el promedio de diámetro de los halos en xilano y celulosa, que pudieran indicar mayor capacidad para degradar uno u otro sustrato. Así, los halos de degradación de las cepas 9 y 11 fueron significativamente mayores en celulosa (1.0 y 1.1 cm) que en xilano (0.7 y 0.6 cm). Por el contrario, los aislamientos 14, 21 y 24 formaron halos significativamente
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SCREENING PARA EL AISLAMIENTO Y CARACTERIZACIÓN DE MICROORGANISMOS Y ENZIMAS
|
|
|
|
|
|
|
|
mayores en xilano (1.4, 1.2, 1.3) que en celulosa (0.8, 0.9 y 1.0). Tales resultados podrían indicar que estos dos grupos de actinomycetes poseen complejos enzimáticos diferentes, que actuarían más eficientemente en uno u otro tipo de sustrato, por lo cual se sugerirían como candidatos para continuar estudios posteriores en la producción y purificación de xilanasas libres de celulasas, que pudieran tener aplicación en el blanqueo ecológico del papel (Kulkarni et al., 1999).
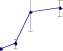
Por otro lado, los hongos presentaron mayores halos de degradación en PEC que los otros microorganismos, por lo que inicialmente se usó este criterio para seleccionarlos, utilizando el tamaño de los halos de degradación en XYL y CMC como segunda categoría. Así, los hongos que se presentan en la figura 1A continuaron para estudio de la cinética de actividades enzimáticas.
Para determinar las actividades endopectinasas y endoxilanasa se consideró la proporcionalidad inversa entre la actividad enzimática y la viscosidad de los sustratos (PEC y XYL), la cual disminuye por la hidrólisis de las cadenas internas de los polímeros.
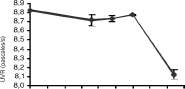
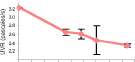
La reducción de la viscosidad en la pectina, atribui-ble principalmente a la actividad endopoligalacturonasa, fue muy escasa en los actinomycetes, siendo las cepas 5 y 6, las únicas que mostraron UVR cercanas a las producidas por los hongos (figura 2). Entre éstos, las actividades más altas fueron para Clonostachys
|
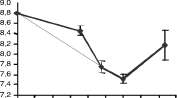
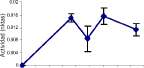
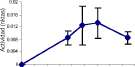
rosea (0.782 pascal/s), Fusarium merismoides (0.759 pascal/s), Cladosporium sp (0.751 pascal/s). y F. oxysporum (0.790 pascal/s). Por otra parte, las actividades endo-xilanasas más altas fueron para los aislamientos de actinomycetes 2, 6 y 7 (figura 3); y para los hongos F. merismoides, C. rosea, F. oxysporum y Penicillium sp. (figura 4).
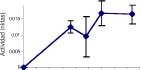
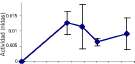
Se detectó actividad celulasa únicamente en las cepas de actinomycetes 5, 6 y 7, con la actividad más baja en la cepa 5 (0.057 nKats), y en las cepas 6 y 7 los picos mayores (0.1 y 0.062 nKats, respectivamente). Así mismo, C. rosea, F. oxysporum, F. merismoides y Penicillium sp. fueron los únicos hongos que mostraron actividad celulasa detectable (figura 5), la cual se expresa desde el comienzo del cultivo, y con Penicillium sp. con la mayor actividad (0.1 nKats).
Las actividades arabinosidasa, xilosidasa y acetilesterasa se consideran accesorias a la degradación de xilano como heteropolímero, existiendo gran variación en el porcentaje de grupos laterales de arabinofuranósidos, xiosidos y acetilos, entre paredes celulares tipo II de diferentes plantas (Carpita y Gibeaut, 1993).
Las arabinosidasas y acetilesterasas contribuyen con la remoción de grupos laterales arabinofuranósidos y acetilos, los cuales pueden causar impedimentos estéricos para la acción de las endo-xilansas; mientras que las xilosidasas remueven los sustituyentes de xilosa e hidrolizan xilotriosas y xilobiosas (Biely, 1985; Coughlan y Hazlewood, 1993).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Halos de degradación de algunos hongos en CMC, xilano y pectina
|
|
Halos de degradación de los actinomycetes
■ Celulosa n Xilano
|
|
|
|
|
|
|
|
|
|
|
|
1 2 5 6 7 9 10 11 14 15 16 18 19 21 24
Cepas
|
|
|
|
F. merismoides Paecilomyces Clonostachys Penicillium sp. Fusarium
sp. rosea No.1 oxysporum 2H
|
|
|
|
|
|
|
|
Figura 1. Diámetro de halos de degradación (cm) de algunos de los hongos filamentosos (panel A) en CMC, xilano y pectina, y de diferentes Streptomyces (panel B) en CMC y xilano. Las barras muestran (±) una desviación estándar del promedio de tres réplicas.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 58 - 71
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
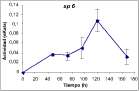
Viscosidad de Sp. 5 en Pectina
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Viscosidad de Cladosporium sp.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Viscosidad de Sp. 6 en Pectina
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180 Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Viscosidad de F. merismoides
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Viscosidad de Cladosporium sp.
|
|
|
|
|
|
|
|
|
60 80 100 120 140 160 180 Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Viscosidad Fusarium oxysporum
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
) 20 40 60 80 100 120 140 160 180 Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 40 60 80 100 120 140 160 180 Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figura 2. Actividades pectinolíticas para: (1) aislamientos de Streptomyces 5 y 6; (2) hongos filamentosos. Se presenta la actividad endopoligalacturonasa (medida por reducción de la viscosidad) y galactosidasa (accesoria para poligalacturonasas) de Cladosporium sp. y de F. oxysporum. Las barras muestran (±) una desviación estándar del promedio de tres réplicas.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SCREENING PARA EL AISLAMIENTO Y CARACTERIZACIÓN DE MICROORGANISMOS Y ENZIMAS
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Viscosidad sp 1 en Xilano
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Viscosidad de Sp. 2en Xilano
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Viscosidad de Sp. 3 en Xilano
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50 100 150 200 Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figura 3. Actividades xilanolíticas para distintos aislamientos de Streptomyces: (1) 1 ;(2) 2; (3) 3. Se presentan actividades endoxilanasas (medidas por reducción de la viscosidad en unidades de viscosidad relativa); y arabinofuranosidasas y xilosidasas correspondientes (accesorias para endoxilanasas). Las barras muestran (±) una desviación estándar de tres réplicas.
|
|
|
|
|
|
|
|
En tal sentido se observaron actividades hidrolíticas complementando la actividad endoxilansa en los actinomycetes (figura 3), como altas actividades arabinofuranosidasa y xilosidasa (Streptomyces 2 y 7), altas actividades xilosidasa y acetilesterasa (Streptomyces 2) o arabinosidasa y acetilesterasa (Streptomyces 1). Similarmente, los hongos F. oxysporum, F. merismoides y C. rosea mostraron actividades arabinofuranosidasa y acetilesterasa (figura 4), destacándose C. rosea como el único hongo que presentó actividad xilosidasa, además de las anteriores. Penicillium sp. se destacó por la altísima actividad arabinofuranosidasa, alcanzando valores 10 veces mayores que el resto de hongos.
|
No se observó actividad galactosidasa significativa para ninguna de las cepas (figura 2), lo que está de acuerdo con su baja capacidad pectinolítica, donde las galactosidasas se encargan de remover los grupos laterales de galactosas de las cadenas de ácido poligalacturonico. C. rosea y F. oxysporum mostraron incremento de actividad galactosidasa concomitante con la reducción de la viscosidad de la solución de PEC.
Se realizó una tercera selección de microorganismos considerando no sólo los valores de las diferentes actividades enzimáticas, sino además la relación entre las actividades polisacaridasas y las correspondientes actividades accesorias (glicosidasas y esteresas) y el tamaño de los halos de degradación de los sustratos específicos.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 58 - 71
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180
Tiempo (h)
|
0 20 40 60 80 100 120 140 160 180
Tiempo (h)
|
0 20 40 60 80 100 120 140 160 180
Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180 Tiempo (Horas)
|
0 20 40 60 80 100 120 140 160 180
Tiempo (h)
|
0 20 40 60 80 100 120 140 160 180
Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.24 -i
B -^ 0.16 -
■o' 0.12-
"O
"*• 0.04 -
|
|
|
|
|
3 20 40 60 80 100 120 140 160 180
Tiempo (Horas)
|
|
) 20 40 60 80 100 120 140 160 180
Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180
______________Tiempo (h)_______________
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180
Tiempo (Horas)
|
|
|
0 20 40 60 80 100 120 140 160 180
Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180
Tiempo (h)
|
|
|
|
|
|
|
|
Figura 4. Actividades xilanolíticas para: (1) F. merismoides; (2) F. oxysporum; (3) Penicillium sp. y (4) C. rosea. Se presentan actividades endoxilanasas (medidas por reducción de la viscosidad en unidades de viscosidad relativa); y arabinofuranosidasas, acetilesterasas y xilosidasas correspondientes (accesorias para endoxilanasas). Las barras muestran (±) una desviación estándar de tres réplicas.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SCREENING PARA EL AISLAMIENTO Y CARACTERIZACIÓN DE MICROORGANISMOS Y ENZIMAS
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40 60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 80 100 120 140 160 180
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,14 ■ 0,12 0,1 0,08 0,06 0,04 0,02
|
|
|
|
|
|
|
|
|
|
60 80 100 120 140 160 Tiempo (h)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 20 40 60 80 100 120 140 160 180 Tiempo (h)
|
|
|
|
|
|
|
|
Figura 5. Actividades celulolíticas para: (1) las cepas de hongos filamentosos; (2) aislamientos de de Streptomyces sp. Las barras muestran (±) una desviación estándar de tres réplicas.
|
|
|
|
|
|
|
|
Purificación parcial por cromatografía de afinidad en xilano entrecruzado y paredes celulares tipo I y tipo II
Se evaluó la influencia del pH (en el intervalo de 4 a 9) en la adsorción de proteínas de Streptomyces sp. 5 y del hongo Clonostachys rosea; a los soportes xilano entrecruzado (XC) y paredes celulares de clavel (PC, tipo I) o avena (PA, tipo II). El porcentaje de recuperación, definido como la relación entre la actividad enzimática de las proteínas desorbidas (en nKats) y la actividad enzimática de los controles (sobrenadantes sin sustrato de adsorción), es en general mayor a pH 9 (figura 6). Para el Streptomyces sp. 5 se recuperó una mayor cantidad de actividad celulolítica y xilanolítica cuando la adsorción se realizó a pH 9.0 en XC, PA o PC, con porcentajes desde el 68 al 98%. Por el contrario, los pH 4.0, 5.8 y 7.6 al parecer no favorecen la adsorción de dichas proteínas (figura 6 A y B).
Es posible que a pH 9.0 se favorezca la atracción electrostática de las proteínas al soporte o que a dicho pH éstas adquieran la conformación más adecuada para que el domino de unión al sustrato de la enzima reconozca y se adhiera al sustrato (Nogawa et al., 1999). En cuanto a la adsorción de proteínas con actividad pectinolítica, es claro que
|
ocurrió en los tres soportes (XC, 43%; PC, 51%; y PA, 56%) sólo a pH 9.0 (figura 6C), excepto en PA, que mostró adsorción del 97% a pH 7.6. Sin embargo, tal porcentaje no podría considerarse satisfactorio cuando se analizan los datos de actividad específica que relaciona la actividad/concentración de proteínas, los cuales revelan un bajo rendimiento (ver tabla 1A). Esto podría explicarse como adsorción no específica, es decir, adsorción de todas las proteínas en general y no de actividades pectinolíticas específicas.
Al respecto, Rozie et al. (1992) sugieren el uso de soportes de pectina entrecruzada donde se logra la adsorción específica de un 75% de actividad poligalacturonasa, de una solución cruda de A. níger a pH 4.4.
Los datos de rendimiento empleando PA a pH 9.0, revelan que las actividades xilanolíticas y celulolíticas se incrementan cerca de 280 y 350%, respectivamente, lo que indica que estos soportes podrían ser aprovechados en la purificación parcial de las mencionadas enzimas, como primer paso en un proceso de purificación cualitativa, o como un proceso de purificación rápida (gruesa), con miras a mejorar un proceso de compostaje u otro proceso industrial.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 58 - 71
|
|
|
|
|
|
|
|
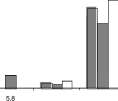
Recuperación de actividad celulolítica de la cepa de actinomycete
|
Recuperación de actividad Xilanolítica en la cepa de Actinomycetes
|
|
|
|
|
|
|
|
100 , 90 -80 -70 -60 -50 -40 -30 -20 -
10 -0 --
|
|
100 -|
90 -
80 -
70 -
60 -
50 -
40 -
30 .
20 -
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 -. 90 -80 -70 -60 -50 -40 -30 -20 -10 -0 —
|
Recuperación actividad Pectinolítica en la cepa de actinomycete
■ Avena ■ Xilano d Clavel
|
Recuperación de actividad celulolítica de la cepa de Hongo
100 , 90 -
|
|
|
|
|
|
|
|
80 -
S 60-
% 50-
u
£ 40 -
S 30-S5 20 -
10 -0 -
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Recuperación de actividad Xilanolítica en la cepa de Hongo
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
■ Avena ■ Xilano □ Clavel
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Recuperación de actividad pectinolítica para cepa de hongo
|
|
|
|
|
|
|
|
|
|
|
■ Avena ■ Xilano □ Clavel
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figura 6. Porcentaje de recuperación de actividades celulolítica, xilanolítica y pectinolítica, utilizando como soportes xilano entrecruzado, y paredes celulares de clavel y de avena. Extractos de Streptomyces No. 5 (paneles A, B y C) y de Closnostachys rosea (paneles D, E y F).
|
|
|
|
|
|
|
|
La purificación parcial de actividades celulolíticas del cultivo de C. rosea mostró una mayor recuperación en el soporte PC a pH 9.0 con un 93% de actividad recuperada; mientras que a pH 4.0, 5.8 y 7.6 el porcentaje de recuperación adsorbida estuvo entre 16 y 33%. Los porcentajes de recuperación a pH 9.0
|
empleando XC y PA fueron menores al valor obtenido en la pared de clavel (figura 6D).
Las actividades xilanolíticas también fueron recuperadas mayormente a pH 9.0, con más del 80% en los tres soportes analizados. En XC se adsorbieron
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SCREENING PARA EL AISLAMIENTO Y CARACTERIZACIÓN DE MICROORGANISMOS Y ENZIMAS
|
|
|
|
|
|
|
|
Tabla 1. Rendimiento de la purificación parcial de actividades celulolítica,
xilanolítica y pectinolítica en los soportes xilano entrecruzado (XC), pared avena (PA)
y pared de clavel (PC) para el actinomycete sp. 5 (A); y el hongo Clonostachys rosea (B)
|
Las bandas más tenues presentaron diferentes valores, desde pI ácidos (5.69 y 6.32) hasta básicos (7.70, 7.95 y 9.76). C. rosea presentó cuatro bandas con actividad, 3 con pI básico: 8.64, 9.04 y 9.14; y sólo una banda con pI ácido (4.44). Entre los actinomycetes, Streptomyces sp. 7 produjo el mayor número de isoformas (9), con bandas intensas de pI 6.07, 6.69 y 7.57. Streptomyces sp. 5 produjo cuatro bandas, la más intensa con pI 9.01; mientras Streptomyces sp. 6 mostró ocho
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rendimiento (actividad específica)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rendimiento (actividad específica)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
bandas, siendo las de pI 5.88 y 9.01 las de mayor intensidad.
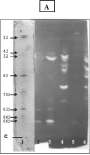
Los zimogramas para actividad celulolítica mostraron que F. oxysporum produjo el mayor número de isoenzimas con 11 bandas (figura 7B), con puntos isoeléctricos a través de todo el rango de pH (entre 4.54 y 8.33). Las
|
|
|
|
|
|
|
|
proteínas incluso a pH 4.0 (figura 6E), hecho que no se observó al emplear las paredes celulares, donde la adsorción ocurrió a un pH mínimo de 5.8, con valores inferiores al 30%. Las enzimas con actividad pectinolítica adsorbieron a pH 9.0 en los tres soportes con porcentajes menores al 20%; y a pH 5.8 solo con el soporte XC, con un 9% de recuperación (figura 6F). Así mismo, los datos de rendimiento sugieren que los soportes no fueron adecuados para la adsorción de actividades pectinolíticas, y que gran parte de las proteínas adheridas no hidrolizan este polisacárido.
Con respecto a los demás valores de rendimiento en la purificación parcial se comprobó que el soporte PC a pH 9.0 permite concentrar las proteínas con actividad xilanolítica y celulolítica con rendimientos del 530 y 500% respectivamente (tabla 1 B).
Del grupo de los 14 microorganismos de la segunda selección se escogieron solamente 5 para el estudio de los patrones de IEF para actividades xilanolítica y celulolítica: 3 especies diferentes del género Streptomyces y 2 hongos filamentosos (F. oxysporum y C. rosea). Los zimogramas para enzimas xilanolíticas revelan que F. oxysporum presentó mayor número de isoformas (8) con bandas claras e intensas (figura 7A) de pI 7.57, 6.94 y 5.81.
|
isoenzimas producidas por C. rosea fueron todas de carácter ácido, contrario a la mayoría de isoformas producidas por actinomycetes, las cuales fueron de carácter básico, destacándose (por presentar las bandas más intensas) las de pI 8.78 en Streptomyces sp. 6; pI 6.56 y 6.83 en Streptomyces sp. 7 y pI 8.78 en Streptomyces sp. 5.
|
|
|
|
|
|
|
|
|
|
|
|
|
y.y -
XI ■-í.í ■■ M5" Í.4J-
c
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figura 7. Zymograma para: xilanasas (panel A) obtenido por sobreposición de un gel de xilano en agarosa sobre un gel de acrilamida para IEF; y celulasas (panel B) por sobreposición de un gel de celulosa en agarosa sobre un gel de acrilamida para IEF: (1) patrones de pI; (2) Streptomyces sp. 5; (3) Streptomyces sp. 6; (4) Streptomyces sp. 7; (5) Clonostachys rosea; (6) Fusarium oxysporum. La ubicación del cátodo se representa con C.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 58 - 71
|
|
|
|
|
|
|
|
Las numerosas isoformas de ambas actividades (xilanolítica y celulolítica) en F. oxysporum podrían estar relacionadas con el carácter patogénico-facultativo de este microorganismo, ya que el poseer enzimas en el rango de pH podría favorecer su colonización en el material vegetal (Cooper, 1983; Roncero et al., 2000), o actuar como saprófito en detritos del suelo, habilidad que tal vez le proporcionaría ventajas frente a otros fitopatógenos (Annis y Goodwin, 1997). Estos resultados se relacionan con los obtenidos en ensayos con otros hongos fitopatógenos como Stagonospora nodorum, donde se revelaron numerosas isoformas con actividad xilanolítica y arabinosidasa, que se correlacionaron positivamente con la agresividad de los aislamientos en la infección de hojas de trigo (Mikán, 2001).
Finalmente, la abundancia de isoformas abre la posibilidad de iniciar estudios de purificación por cromatografía de intercambio iónico, estudiar las actividades óptimas y otras propiedades de las enzimas purificadas y las posibilidades para su uso en diferentes procesos industriales.
CONCLUSIONES
Se evaluó la capacidad de 65 microorganismos para degradar y utilizar paredes celulares como única fuente de carbono. Tres bacterias, 18 de los hongos y 25 de los actinomycetes (entre los cuales se destacaron diferentes especies de Streptomyces sp.), crecieron sobre este sustrato, por lo que se seleccionaron para evaluar sus halos de degradación de los sustratos XYL, CMC y PEC, como única fuente de carbono. Según el diámetro de los halos, se escogieron 7 actinomycetes y 7 hongos filamentosos, para estudiar la cinética de sus actividades depolimerasas e hidrolasas accesorias. Tres especies de Streptomyces y dos hongos mostraron incrementos concomitantes de actividades depolimerasas e hidrolasas, indicando degradación eficiente de los sustratos. Se realizó un experimento exploratorio de purificación parcial, utilizando cultivos de un actinomycete (Streptomyces sp.5) y de un hongo (C. rosea). Para ambos, la mayor adsorción de proteínas con actividad celulolítica y xilanolítica ocurrió en pH 9.0, usando PC como sustrato; mientras que ningún sustrato se mostró adecuado para la adsorción de actividades pectinolíticas. Respecto de la caracterización de isoformas para xilanasas y celulasas, se destacaron Streptomyces sp. 7, F. oxysporum y C. rosea, por el número de bandas y por su distribución en el rango de pH. En
|
suma se puede afirmar que los cinco microorganismos seleccionados son muy promisorios como: (i) productores de actividades capaces de degradar residuos vegetales; (ii) productores de enzimas de interés industrial, tales como xilanasas para la aclaración de jugos naturales procesados y pectinasas para la preparación de mermeladas de frutas tropicales. Así mismo, se describió un proceso de purificación parcial, rápido y muy económico para concentrar actividades xilanolíticas y celulolíticas, que puede ser de gran utilidad como primer paso en la purificación y caracterización de enzimas de interés. Se han determinado y caracterizado actividades depolimerasas de interés por isoelectroenfoque, lo que se constituye en información muy pertinente para desarrollos futuros de este trabajo. Así, este trabajo representa un buen punto de partida para el desarrollo de proyectos biotecnológicos aplicados, con miras al aprovechamiento de la diversidad microbiológica.
AGRADECIMIENTOS
Los autores desean expresar sus agradecimientos a Colciencias y a la Universidad Militar Nueva Granada por la financiación de los proyectos código 2228-05-1108 y MED-2002-001, respectivamente, dentro de los cuales se desarrolló este estudio. Al Instituto de Ciencia y Tecnología de Alimentos (ICTA) de la Universidad Nacional, por el préstamo del viscosímetro, y al Instituto de Biotecnología de la Universidad Nacional por el apoyo. Especial agradecimiento a la microbióloga Marien Villamil por su contribución.
BIBLIOGRAFÍA
Annis, S.; Goodwin, P. 1997. Recent advances in the molecular genetics of plant cell wall-degrading enzymes. European Journal of Plant Pathology. 103: 1-14.
Biely, P. 1985. Microbial xylanolytic systems. Trends Biotechnology. 3:286-290.
Carpita, N. C.; Gibeaut, D. M. 1993. Structural models of primary cell walls in flowering plants: consistency of molecular structure with the physical properties of the walls during growth. The Plant Journal. 31 (1):1-50.
Coleman, M.; Henricot, B.; Arnau, J.; Oliver, R. 1997. Starvation-induced genes of the tomato pathogen C. fulvum also induced in planta. Molecular Plant-Microbe Interactions. 10:1106-1109.
Cooper, R. M.1983. The mechanisms and significance of enzymatic degradation of host cell walls by parasites. En: Biochemical Plant Pathology. J. A. Callow (ed.). New York: John Wiley & Son Ltd., pp. 101-135.
Cooper, R. M. 1987. The use of mutants in exploring depolymerases as determinants of pathogenicity. En: Genetics and Plant Pathogenesis. Day P. R. & Jellis G. J. (eds). Oxford: Blackwell Scientific, pp. 261-281.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SCREENING PARA EL AISLAMIENTO Y CARACTERIZACIÓN DE MICROORGANISMOS Y ENZIMAS
|
|
|
|
|
|
|
|
Cooper, R. M.; Wood, R. K. 1980. Cell wall degrading enzymes of vascular wilt fungi. Physiological Plant Pathology. 16:285-300.
Coughlan, M.; Hazlewood, G. 1993. b-1,4-D-xylan-degrading enzyme systems: biochemistry, molecular biology and applications. Biotechnology Applied Biochemistry. 17:259-289.
Kulkarni, N.; Abnay, S.; Rao, M. 1999. Molecular and biotechnological aspects of xylanases. FEMS Microbiology Reviews. 23:411-456.
Mackenzie, C. R.; Williams, R. E. 1984. Detection of cellulase and xylanase activity in isoelectric-focused gels using agar substrate gels supported on plastic film. Canadian Journal of Microbiology. 30:1522-1525.
Magro, P. 1984. Production of polysaccharide-degrading enzymes by S. nodorum in culture and during pathogenesis. Plant Science Letters. 37:63-68.
Mikán, J. F. 2001. Arabinoxylan degrading enzymes of the wheat pathogen Stagonospora nodorum . PhD Thesis. The University of Bath, Bath, U. K.
Millward-Sadler, S. ; Davidson, K. ; Hazlewood, G. P. ; Black, G. W.; Gilbert, H. J. ; Clarke, J. H. 1995. Novel cellulose binding domains, NodB homologues and conserved modular architecture in xylanases. Biochemical Journal. 312:39-48.
Nogawa, M.; Yatsui, K.; Tomioka, A.; Okada, H.; Morikawa, Y. 1999. An a-L-arabinofuranosidase from T. reesei containing a noncatalytic xylan-binding domain. Applied and Environmental Microbiology. 65:3964-68
|
Pedroza, A. M.; Matiz, A.; Gómez, D. 2001. Manual de laboratorio. Introducción a la Biotecnología. Pontificia Universidad Javeriana, pp. 27-32.
Ramírez, C. 1996. Guía para la preparación, uso y manejo de caldos microbianos de rizosfera de plantas. Universidad Nacional de Colombia. Instituto de Biotecnología.
Rico, M. 1997. Manual de prácticas de microbiología básica. Bogotá: Pontificia Universidad Javeriana.
Roncero, I.; Di Pietro, A.; Ruiz, C.; Huertas, D.; García F.; Meglecz, E.; Jiménez, A.; Sancho, R.; Hera, C.; Gómez, E.; González, C.; Páez, K. 2000. Papel de enzimas líticas de la pared celular en la patogenicidad de Fusarium oxysporum. Revista Iberoamericana de Micología 17: S47-S43.
Rozie, H.; Somers, W.; Bonte et al. 1992. Crosslinked xylan as an affinity adsorbent for endo-xylanases. Carbohydrate Polymers. 263:19-28.
Somogyi, M. 1951. Notes on sugar determination. Journal of Biological Chemistry. 160: 61-67.
Stoscheck, C. M. 1990. Increased uniformity in the response of the Coomasie Blue G protein assay to different proteins. Analytical Biochemistry. 184 : 111 -116
Tonukari, N.; Scott-Craig, J.; Walton. 2000. The C. carbonum SNF1 gene is required for cell wall-degrading enzyme expression and virulence on maize. The Plant Cell. 12:237-247.
Vincent, P.; Shareck, F.; Dupont, C.; Morosi, R.; Kluepfel, D. 1997. New arabinofuranosidase produced by S. lividans. Biochemical Journal. 322: 845-852.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|