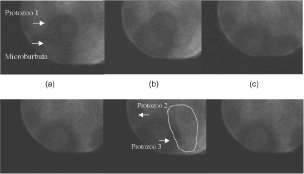
BIONOTA. MANIPULACIÓN DE PROTOZOOS POR ULTRASONIDO
distancia de separación varía entre 0.5 y 2 mm, dependiendo del voltaje aplicado. Su función es la de producir microburbujas dentro del líquido, aprovechando para ello el fenómeno de la electrólisis.
lla descargado, por lo que el cuarto terminal de la compuerta está conectado directamente a tierra (0 lógico), forzando su salida a un 1 lógico. El condensador comenzará a cargarse por medio de la resistencia R1 a un voltaje de 5V, es decir, que conmuta de bajo a alto.


En el momento en que supera su voltaje de umbral de subida, la salida del inversor cambia a un 0 lógico. El condensador comenzará a descargarse a través de la
resistencia R1, pasando de alto a bajo. Cuando pase el voltaje de umbral de bajada, la salida del inversor cambiará a un 1 lógico, re
(a)
(b)
-lil ='
entrada de
I" -"'-J
salida de
pitiéndose el ciclo ya descrito.
La salida de la primera compuerta NAND es conectada a las cuatro entradas de la segunda compuerta NAND, con el objeto de mejorar la señal, obteniéndose una onda cuadrada de 0 a 5V, cuya frecuencia puede cambiar entre 15 kHz y 1 MHz, a libre albedrío dependiendo del valor de la resistencia variable.
agua
(c)
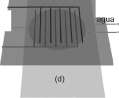
Figura 1. Secuencia del montaje de la cámara ultrasónica. (a) Base plástica, (b) Piezo-buzzer, (c) Rejilla de electrodos y agujas hipodérmicas, (d) Portaobjetos.
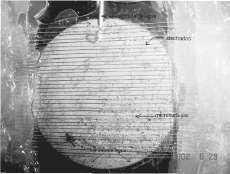
Otros componentes son: Los portaobjetos son elementos de vidrio utilizados para cubrir el área del transductor mientras se realiza la observación directa del proceso. Las agujas hipodérmicas son elementos utilizados para permitir el flujo de líquido en el interior del transductor. La base plástica es utilizada para sujetar toda la estructura, aislando la conexión eléctrica del agua, y permitiendo la libre vibración del piezobuzzer para producir el ultrasonido. Sus dimensiones varían en función del tamaño del piezoeléctrico.
Para amplificar la onda cuadrada se conecta la salida de la segunda compuerta NAND a la base de un transistor 2N3904, en saturación o corte dependiendo de la señal aplicada en la base. Finalmente, el transductor es conectado entre el colector y el emisor del transistor. Cuando el transistor está en corte, el piezoeléctrico se cargará a un voltaje de 12V (fuente de alimentación 2) a través de la resistencia R2, y cuando el transistor se encuentra en saturación, el piezoeléctrico se descargará a través del transistor.
Circuito oscilador
El desarrollo del oscilador se basó en el empleo de un circuito integrado 74LS13, constituido por dos compuertas NAND Schmitt Trigger, y el uso de un transistor de baja potencia 2N3904 como se muestra en la figura 2.
A continuación se describe el funcionamiento del circuito. Se cortocircuitan tres de las cuatro entradas de la primera compuerta NAND y se conectan a un voltaje DC de 5V (1 lógico). En el instante t0 el condensador C1 se ha-
resistencia variable de precisión
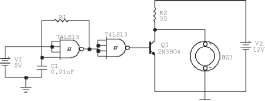
Figura 2. Circuito oscilador que alimenta al transductor piezoeléctrico.
81