
NÍNIVE ESPINOZA-RODRÍGUEZ
JOANMYRA CARRASQUERO
KAREEN DE TURRIS-MORALES
GABRIELA DELGADO-ORTEGA
HÉCTOR BARRIOS-GARRIDO
Laboratorio de Ecología General. Departamento de Biología. FEC. LUZ, Apartado 526 A. Av. Universidad, Maracaibo-Estado Zulia, Venezuela. espinozaninive@aol.com: Autor para correspondencia. joanmyra@hotmail.com, deturriskareen@gmail.com, gabrieladelgado3@gmail.com
Tropical Water and Aquatic Ecosystem Research, College of Marine and Environmental Sciences. James Cook University, Townsville, QLD 4811, Australia.
Laboratorio de Ecología General. Departamento de Biología. FEC. LUZ, Apartado 526 A. Av. Universidad, Maracaibo-Estado Zulia, Venezuela
Centro de Modelado Científico (CMC). FEC. LUZ, Apartado 526 A. Av. Universidad, Maracaibo-Estado Zulia, Venezuela. hbarriosg@gmail.com
RESUMEN
Las asociaciones entre aves marinas y mamíferos marinos es un evento común en todos los mares y océanos del mundo. Muchos autores han denominado estas asociaciones como relaciones comensalistas, oportunistas o parasitarias, según el efecto que dicha interacción resulte sobre una o ambas especies relacionadas. Con la finalidad de describir la existencia de agrupaciones entre Sotalia guianensis y aves marinas en la porción sur del Golfo de Venezuela, desde junio 2011 a junio 2012 se realizaron observaciones en plataformas móviles de grupos de este cetáceo y aves marinas, utilizando el protocolo "group-follow" bajo la metodología de "Ad libitum sampling". Todos los avistamientos fueron georreferenciados, realizándose anotaciones de la ocurrencia o no-asociación con aves marinas, de igual forma, se registró la especie y el número de aves presentes al momento de la interacción. Se realizaron 721 avistamientos, de los cuales en 197 eventos se registró asociación entre aves marinas y Sotalia guianensis. Las especies de aves marinas residentes que presentaron mayor frecuencia en eventos de asociación con S. guianensis fueron: Fregata magnificens (49%; n=98), Phalacrocorax brasilianus (29,5%; n=59) y Pelecanus occidentalis (22,5%; n=45); siendo Thalasseus maxima (71%; n=142) la única especie migratoria. Durante las observaciones realizadas en el período de muestreo se notó la presencia de una especie de golondrina (Riparia riparia) en un solo evento de agrupación con Sotalia guianensis. Dichas asociaciones aves-delfines, sólo fueron observadas cuando notables congregaciones de peces fueron registrados, donde el o los grupos de delfines realizaban alguna actividad con grandes movimientos de agua, lo que pudiese permitir a las aves realizar un menor gasto energético en la ubicación y la captura de la presa.
Palabras clave. Aves marinas, Sotalia guianensis, Canal de navegación, Golfo de Venezuela.
ABSTRACT
Associations between seabirds and marine mammals are a common event in all seas and oceans of the world. Several authors have called these associations as commensal, opportunistic or parasitic relationships, depending on the result of such interaction effect on one or two related species. In order to describe the presence of associations among Sotalia guianensis and sea birds in the southern region of the Gulf of Venezuela, from June 2011 to June 2012, observations of groups of this cetacean and seabirds were made on mobile platforms, using the "group follow" protocol following an "Ad libitum sampling". All sightings were geo-referenced and annotations about the occurrence or non-association with seabirds, species and number of birds present at the association were made. During the sampling period 721 sightings were recorded, of which 197 events of aggregation between seabirds and S. guianensis were registered. The resident seabird species most frequently presented at each event associated with S. guianensis were: Fregata magnificens (49%; n=98), Phalacrocorax brasilianus (29.5%; n=59) and Pelecanus occidentalis (22.5%; n=45); being Thalasseus maxima (71%; n=142) the only migratory species. During all sampling sightings was observed only one interaction between a swallow species (Riparia riparia) and Sotalia guianensis. These bird-dolphin associations were only observed when a notable congregation of fish was registered and a dolphin or a group of dolphins were performing any activity with large movements of water that allowed birds to find and locate their preys with low energy cost.
Key words. Seabirds, Sotalia guianensis, Navigation channel, Gulf of Venezuela.
Recibido: 05/08/2013
Aceptado: 22/10/2015
INTRODUCCIÓN
Las asociaciones entre aves y mamíferos marinos son eventos comunes a nivel mundial (Hawke & Dobinson 2001, Cremer et al. 2004, Rossi-Santos & Flores 2009), varios autores han denominado estas asociaciones como relaciones comensalistas, oportunistas o parasitarias, cada una de ellas según el efecto que dicha interacción cause sobre una o ambas especies relacionadas (Cremer et al. 2004, Rossi-Santos & Flores 2009).
La tonina del Lago o delfín de Guyana Sotalia guianensis (P. J. Van Bénédén, 1864) (Cetacea: Delphinidae) (Flores et al. 2010), presenta una distribución discontinua en aguas costeras y estuarinas del Caribe y el Atlántico Sur, desde Honduras hasta la región oriental del estado de Pará en Brasil (Da Silva et al. 2010; Emin-Lima et al. 2010; Flores et al. 2010). En el sistema de Maracaibo es conocido como "tonina del lago" (Bolaños-Jiménez et al. 2008), frecuentemente avistada durante todo el año, principalmente en la zona sur del Golfo de Venezuela, en las zonas aledañas al poblado de Barranquitas (zona centro-occidental del Lago de Maracaibo) y en la desembocadura del río Catatumbo, al sur del sistema (Bolaños-Jiménez et al. 2008, Portocarrero Aya et al. 2010).
Las interacciones entre las aves marinas y S. guianensis se han registrado en varias localidades a lo largo de su distribución mundial (SimõesLopes 1988, Monteiro-Filho 1992, Lodi 2000, Edwards & Schnell 2001), dichas asociaciones generalmente han sido relacionadas con actividades de alimentación (Cremer et al. 2004). A pesar de que estas interacciones entre aves marinas y la tonina del lago son frecuentemente mencionadas, han sido poco evaluadas en detalle (Fox 2010). Razón por la cual el objetivo de esta contribución es registrar y describir la asociación entre S. guianensis y diferentes especies de aves marinas en la zona sur del Golfo de Venezuela.
MATERIALES Y MÉTODOS
Área de estudio
El sistema de Maracaibo se encuentra localizado al occidente de Venezuela, está compuesto por cuatro cuerpos de agua íntimamente relacionados entre sí (Lago de Maracaibo, Estrecho de Maracaibo, Bahía El Tablazo y Golfo de Venezuela) (Rodríguez, 2000). Este sistema comprende una extensa planicie costera que se extiende entre los 9° y 12° Norte y aproximadamente entre los 70°15' y 72°15' Oeste (Rodríguez, 2000).
El Golfo de Venezuela está categorizado como una ecorregión diferenciada en el país (Miloslavich & Klein 2008). Posee una gran variedad de hábitats y ecosistemas acuáticos (playas arenosas, manglares, parches de arrecife, praderas de fanerógamas, lagunas costeras, entre otros) (Rodríguez 2000, Montiel-Villalobos et al. 2010). Además, presenta un ambiente rico en nutrientes dominado por una importante zona de surgencia, que permite que una gran cantidad de organismos se alimenten, desarrollen y reproduzcan en esta zona (Rodríguez 2000, Rueda-Roa & Muller-Karger 2013).
En la zona sur del Golfo de Venezuela (Fig. 1), los avistamientos de S. guianensis son notablemente numerosos y frecuentes (Agudo et al. 1994, Barrios-Garrido & Montiel-Villalobos 2005, Barrios-Garrido et al. En prensa.). Esta región está caracterizada por presentar temperaturas del agua cálidas y estables (28 30 °C) y pH alcalinos (7 8) (Febres & Masciangioli 2000, Espinoza et al. 2011). Esta zona, junto a la Bahía El Tablazo y el Estrecho de Maracaibo, son consideradas las regiones estuarinas por excelencia (Rodríguez, 2000), con valores promedio de salinidad entre 8 y 15 ups (Rodríguez 2000, Espinoza et al. 2011).

El clima característico de la zona es semiárido con precipitaciones anuales promedio de 500 mm/año y temperaturas medias de 28 °C (Masciangioli & Febres 2000). Los vientos en la zona mantienen una dirección constante de 45 grados durante casi todo el año proveniente de los alisios del NE, soplando regularmente y con mayor velocidad de noviembre a abril (sequía) y disminuyen de mayo a octubre (lluvia) (Masciangioli & Febres 2000, Rodríguez 2000).
Muestreo y procesamientos de las muestras
Desde junio 2011 hasta a junio 2012, se realizaron observaciones de los grupos de S. guianensis y aves marinas, bajo el protocolo de seguimiento del grupo o manada (group-follow) usando el método de muestreo a voluntad del investigador (Ad libitum), donde la colección de datos del grupo de cetáceos no implica restricciones sistemáticas de lo que se registra y cuando se registra (Mann, 1999). En las observaciones realizadas se verificó la especie a través de los rasgos físicos que poseen (coloración y talla), su comportamiento (en superficie, reproducción y/o alimentación) y estructura, llevando una trayectoria continua y pausada sin interferir ni interactuar con la manada (Altmann 1974, Shane 1990, Lenher 1996, León 2005, Bazzalo et al. 2008, Bandeira Costa et al. 2012), esto sobre una plataforma móvil y maniobrable (Carwardine et al. 1999), específicamente una embarcación con casco de 7 m y una anchura de 1,80 m, 2 motores de 40 hp fuera de borda y capacidad para 12 personas con autonomía de 4 horas a 30 millas/h (Barrios-Garrido & Montiel-Villalobos, 2005).
Cada avistamiento fue georreferenciado con un GPS Garmin legend e-trex, a la par se realizaron anotaciones de la ocurrencia o no-asociación de los delfines con las aves marinas, identificando la especie o especies de aves involucradas en la asociación (Cremer et al. 2004), así como el comportamiento exhibido por el grupo de delfines según la clasificación descrita por Bandeira Costa et al. (2012), donde engloban los comportamientos en superficie (saltos, coletazos, movimientos de locomoción, juegos), de reproducción (se presume por presencia de crías) y alimentación (citándose una variedad de estrategias conocidas para dicha especie la mayoría con golpes de la aleta caudal, vueltas, cercado y persecución de sus presas).
Para la identificación y el arreglo taxonómico de las especies de la avifauna observadas se emplearon diversas claves taxonómicas (Lira & Casler 1979, Calchi 2000, Hilty 2002), para la nomenclatura se siguieron las listas de especies de aves y orden taxonómico reconocidos por la Asociación Internacional de Ornitología (BirdLife International, 2012).
Los datos se organizaron en una tabla con fecha de observación, coordenadas, especies de aves involucradas, comportamiento del grupo de delfines y frecuencia de interacción entre especies específicas de aves y/o grupo de especies y delfines (según Cremer et al. 2004, la frecuencia de interacción se define como la cantidad de veces que se repite un evento de asociación entre aves-delfines con respecto a la muestra total de la variable evaluada, en este caso, una frecuencia por especie de ave o por grupos mixtos de aves), para calcular dichos porcentajes se utilizaron las interacciones registradas con grupos mixtos y no-mixtos de aves (Rossi-Santos & Flores 2009, Bandeira Costa et al. 2012).
RESULTADOS
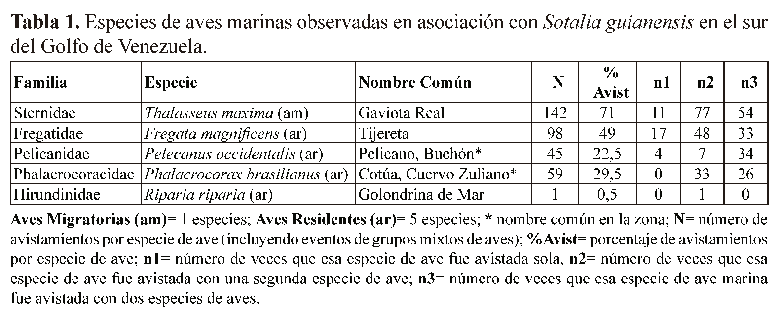
De 721 avistamientos de S. guianensis fueron contabilizados 197 eventos de asociación con diferentes especies de aves marinas (Fig. 2); registrándose a cinco especies de aves marinas en dichas asociaciones (Tabla 1). Durante el período de muestreo (Junio 2011 Junio 2012), las especies de aves marinas residentes que presentaron mayor frecuencia en eventos de asociación con S. guianensis fueron: Fregata magnificens (tijereta) (n = 98; 49%), Phalacrocorax brasilianus (cotúa) (n = 59; 29,5%) y Pelecanus occidentalis (buchón o pelícano) (n = 45; 22,5%); siendo Thalasseus maxima (gaviota real,) (n = 142; 71%) la única especie migratoria. En este estudio, sólo fue observado en una ocasión la especie de Golondrina de Mar, Riparia riparia, en conjunto con un grupo de S. guianensis.

De los eventos de asociación entre aves marinas y la tonina del Lago en el sur del Golfo de Venezuela, se registró un 16,24% (n=32) donde sólo fue observada una especie de ave; 51,23% (n=101) dos especies de aves; y 32,39% (n=64) eventos entre 3 especies de aves y S. guianensis.
Las asociaciones aves-delfín se presentaron en su totalidad cuando el o los grupos de delfines ejecutaban algún tipo de comportamiento que presentara grandes movimientos de agua, siendo los comportamientos en superficie (como saltos, coleteos, movimientos de locomoción) aquellos que resultaron con mayor porcentaje en dichas asociaciones (n = 180; 91, 37%).
DISCUSIÓN
Varias especies de aves marinas han sido observadas participando en agregaciones de alimentación junto a delfines y atunes (Au & Pitman 1986); estas interacciones de múltiples especies, permiten en la mayoría de los casos, la accesibilidad y mejoramiento en la técnica de captura de la presa; en algunos escenarios para las aves, en otros para los delfines (Rossi-Santos & Flores 2009, Fox 2010). Las especies de aves observadas en este estudio (Tabla 1) en asociación con S. guianensis en el sur del Golfo de Venezuela, son similares a las encontradas por Monteiro-Filho (1992), Cremer et al. (2004) y Rossi-Santos & Flores (2009) en Brasil. Según las observaciones de campo Thalasseus maxima (n=142, 71%) y Fregata magnificens (n=98, 49%) fueron las especies más frecuentemente observadas en las asociaciones ave-delfín. Monteiro-Filho (1992) registró con mayor frecuencia a las gaviotas del género Thalasseus y cotúas del género Phalacrocorax en las asociaciones ave-delfín, en la zona de Cananéia, Estado de São Paulo-Brasil, mientras que en otros sitios, como en la Bahía de Babitonga (Brasil), por el contrario se les calificó como especies raras (SimôesLopes 1988).
En las asociaciones registradas en la presente investigación fue frecuente observar como las aves buscaban específicamente las actividades de movimientos fuertes de agua, los cuales coincidían con eventos de alimentación o juegos por parte de los delfines, lo que pudiese incrementar la posibilidad de pesca para las aves, reduciendo el gasto de energía en la búsqueda de sus presas (Schöner 1971, Cremer et al. 2004). Este hecho podría sugerir que en esta interacción comensalista son las aves marinas quienes se ven favorecidas. Los eventos de asociación ave-delfín en otros estudios han señalado, que las aves marinas son los taxones que comienza la formación del consorcio, en su mayoría son considerados como eventos ocasionales y oportunistas, lo cual implica la independencia de cualquiera de las partes (Cremer et al. 2004; Rossi-Santos & Flores 2009, Fox 2010).
De Turris et al. (2010) mencionaron que una de las estrategias exhibidas por S. guianensis en el Sistema de Maracaibo es de tipo cooperativa, donde es común observar nados bruscos y rápidos en la superficie, natación de varios individuos en círculo, saltos (altos, bajos, de costado), y fuertes golpes de cola, lo cual promueve un gran desplazamiento de agua y la ubicación y/o disposición de la presa a los individuos más jóvenes e inexpertos en la caza. Luego, los descartes o trozos de peces que las toninas no consumen, son aprovechados por las aves, este evento también fue mencionado por Barrios-Garrido & Montiel-Villalobos (2005) en la misma zona de estudio de la presente investigación.
Las observaciones de las asociaciones aves-delfín en el presente estudio corresponden a los resultados expuestos por Cremer et al. (2004), presentándose cuando los delfines se encontraban realizando algún tipo de movimiento de agua o alimentándose. Estos autores concuerdan que dichas asociaciones se caracterizan por la cercanía y la permanencia de las aves a un grupo de delfines, y la presencia de comportamientos de pesca con una duración variable.
El comportamiento de las aves durante las asociaciones presentó características propias para cada especie; P. brasilianus por ejemplo, permanecía en mayor frecuencia sobre el agua, boyas o en el muro de contención del canal de navegación para atrapar sus presas, en pocas ocasiones fueron avistadas volando en grupo. Contrario a las gaviotas y tijeretas, las cuales presentaban vuelos especializados para la caza de peces o colecta de residuos de peces recientemente descartados por S. guianensis durante su alimentación. Comportamientos similares fueron evidenciados por Rossi-Santos & Flores (2009), y Cremer et al. (2004) en varias localidades de las costas de Brasil.
AGRADECIMIENTOS
A Francisco "Piñita" Rodríguez y familia, Danny Vílchez, Jean Carlos Vílchez, Javier Vílchez, Sandro "Foca" Morán, Neiro "Casco Azul" Flores, Jhomberlys Vílchez, quienes colaboraron activamente para la culminación de la fase de campo de la presente investigación. Igualmente, a los colaboradores y asistentes de campo del Laboratorio de Ecología General de la Facultad Experimental de Ciencias de la Universidad del Zulia por su apoyo logístico. Finalmente, Ministerio del Poder Popular para el Ambiente por la designación del permiso requerido para realizar este estudio (oficio 0038) y a los evaluadores que prestaron su tiempo para corregir y presentar sugerencias sobre este manuscrito.
LITERATURA CITADA
1. Agudo, I.A., A. Viloria, J. Coty, & R. Acosta. 1994. Cetofauna (Mammalia: Cetacea) del estado Zulia, Venezuela Nor-occidental. Anartia 5:1-23.
2. Altmann, J. 1974. Observational study of behavior: sampling methods. Behaviour 48:227-267.
3. Au, D.W. & R. Pitman. 1986. Seabird associations with dolphins and tuna in the eastern tropical pacific. The Condor 88: 304-317.4. Bandeira-Costa, M.E., Y. Le Pendu & M. Costa-Neto. 2012. Behavior of Sotalia guianensis (van Bénéden, 1864) (Cetacea, Delphinidae) and ethnoecological knowledge of artisanal fishermen from Canavieras, Bahi, Brazil. Journal of Ethnobiology and Ethnomedicine 8:18.
5. Barrios-Garrido, H. & M.G. Montiel-Villalobos. 2005. Distribución de avistamientos y comportamiento en superficie del tucuxi (Sotalia fluviatilis) en la costa norte del Lago de Maracaibo entre 2002 y 2005: representación en un sistema de información geográfica (SIG). En: J.E. Rincón (ed.). Libro de resúmenes del VI Congreso Venezolano de Ecología. 217-218. Ediciones Universidad del Zulia. Maracaibo, Venezuela.
6. Barrios-Garrido, H., K. de Turris-Morales, C. Nash, G. Delgado-Ortega & N. Espinoza-Rodríguez. 2016. Acoustic Parameters of Guiana Dolphin (Sotalia guianensis) whistles in the Southern Gulf of Venezuela. Aquatic Mammals 42 (2): Aceptado, en imprenta.
7. Bazzalo, M., P. Flores & M. Pereira. 2008. Uso de hábitat y principales comportamientos del delfín gris (Sotalia guianensis, Van Bénéden, 1864) en la Bahía Norte, Estado de Santa Catarina, Brasil. Mastozoología Neotropical 15(1):9-22.
8. Birdlife International. 2012. Species Taxonomic checklist. http://www.birdlife.org/.
9. Bolaños-Jiménez, J., D. Pirela, J. Rojas & T. León. 2008. Bufeo negro: Sotalia guianensis. En: J.P. Rodríguez & F. Rojas-Suárez (eds). Libro Rojo de la Fauna Venezolana: 112. Provita y Shell Venezuela, S.A. Caracas, Venezuela.
10. Calchi, R. 2000. La fauna estuarina: Aves. En: G. Rodríguez (ed). El Sistema de Maracaibo: 237241.Instituto Venezolano de Investigaciones Científicas (IVIC). Caracas, Venezuela.
11. Carwardine, M., E. Hoyt, R.E. Fordyce & P. Gill. 1999. Ballenas, Delfines y Marsopas. Omega S.A . Barcelona. 288pp.
12. Cremer, M.J., P. Simöes-Lopes & J. Pires. 2004. Interações entre aves marinhas e Sotalia guianensis (P. J. Van Bénédén, 1864) na baía da babitonga, sul do Brasil. Rev. Bras. ZoociênciasJuiz de Fora 6 (1): 103-114.
13. Da Silva, V., D. Fettuccia, E. Da S. Rodrigues, H. Edwards, I. Moreno, J. de Moura, L. Wedekin, M. Bazzalo, N. Emin-Lima, N. Carmo, S. Siciliano & V. Utreras. 2010. Report of the working group on distribution, habitat characteristics and preferences, and group size. Lajam 8(1-2):31-38.
14. De Turris, K., D. Delgado, N. Espinoza, H. Barrios-Garrido & M. Montiel. 2010. Nota sobre el comportamiento alimenticio del delfín estuarino (Sotalia guianensis) en la zona centro-occidental del Lago de Maracaibo. Ecotrópicos 23(2): 114-116.
15. Edwards, H. & G. Schnell. 2001. Status and ecology of Sotalia fluviatilis in the Cayos Miskito Reserve, Nicaragua. Mar. Mamm. Sci. 17(3): 445-472.
16. Emin-Lima, R., L. NegrãoMoura, A.L. Figueiredo Rodrigues & M.L. Silva. 2010. Group size and behavior of Guiana dolphins (Sotalia guianensis) (Cetacea: Delphinidae) in Marapanim bay, Pará, Brazil. Lajam 8(1-2): 167-170.
17. Espinoza-Rodríguez, N., L. Morán, Y. Pernía, N. Wildermann, & H. Barrios-Garrido. 2011. Fluctuaciones anuales y espaciales de factores fisicoquímicos en aguas superficiales de la costa nor-occidental del Sistema de Maracaibo: años 2009 2010. En: P. Navarro & O. Marín (eds). Memorias del IX Congreso Venezolano de Ecología. (CC5) 582. Ediciones IVIC. Nueva Esparta, Venezuela.
18. Febres, G. & P. Masciangioli. 2000. Hidrografía del Sistema de Maracaibo. En: G. Rodríguez (ed). El Sistema de Maracaibo: 3359. Instituto Venezolano de Investigaciones Científicas (IVIC). Caracas, Venezuela.
19. Fox, A. 2010. Interactions between birds and strand-feeding dolphins (Tursiops truncatus) in a South Carolina salt marsh. Degree of Master of Science in Coastal Marine and Wetland Studies in the College of Natural and Applied Sciences Coastal Carolina University. South Carolina. United States of America. 104 pp.
20. Flores, P., M. Bazzalo, S. Caballero, M. de O. Santos, M. Rossi-Santos, F. Trujillo, J. Bolaños-Jimenez, M. Cremer, L. May-Collado, F.J.L. Silva, M.G. Montiel-Villalobos, A. Azevedo, A. Meirelles, L. Flach, H. Barrios-Garrido, P. Simões-Lopes, H. Cunha & K. van Waerebeek. 2010. Proposed English common name for the Neotropical Delphinid Sotalia guianensis (P-J. van Bénedén, 1864). Lajam 8(1-2): 179-181.
21. Hawke, D.J. & J. Dobinson. 2001. Short notes on seabird associations with Dusky dolphins (Lagenorhynchus obscurus) at Kai Kouraand with Orca (Orcinus orca) at Nelson, New Zealand. Notornis 48:5658.
22. Hilty, S.L. 2002. Birds of Venezuela.Princeton University Press. New Jersey, USA. 928 pp.
23. Lehner P.N. 1996. Handbook of ethological methods.Cambridge University Press. Cambridge. 694pp.
24. León, T. 2005. Craneometría del género Sotalia y algunos aspectos de su ecología. Trabajo especial de grado. Universidad del Zulia. Facultad Experimental de Ciencias. Maracaibo, Venezuela. 99pp.
25. Lira, J.R. & C. Casler. 1979. Aves acuáticas nuevas para el estado Zulia. Bol. Centro. Inv. Biol 13: 89-96.
26. Lodi, L.F. 2000. Cleptoparasitismo entre fragatas (Fregata magnificens) e botos-cinza (Sotalia fluviatilis) na Baía de Paraty, Rio de Janeiro, Brasil. Biociências 8(1): 5964.
27. Masciangioli, P. & G. Febres. 2000. Climatología del Sistema de Maracaibo. En: G. Rodríguez (ed.). El Sistema de Maracaibo: 2132. Instituto Venezolano de Investigaciones Científicas (IVIC). Caracas, Venezuela.
28. Miloslavich, P. & E. Klein. 2008. Ecorregiones marinas del caribe venezolano. En: E. Klein (ed.). Prioridades de PDVSA en la conservación de la biodiversidad en el caribe venezolano: 16-19. Petróleos de Venezuela, S.A. Universidad Simón Bolívar. The Nature Conservancy. Caracas, Venezuela.
29. Monteiro-Filho, E.L. 1992. Pesca associada entre golfinhos e aves marinhas. Revta. bras. Zool. 9(1/2): 29-37.
30. Montiel-Villalobos, M.G, H. Barrios-Garrido, A. Cardozo, A. Lizaraz & K. Rodríguez-Clark. 2010. Habitat characterization of Green Sea Turtle (Chelonia mydas) key foraging ground, at the north area of Peninsula Guajira, Gulf of Venezuela. En: D. Kama & M. López-Castro (eds.). Proceedings of the 28th Annual Symposium on Sea Turtle Biology and Conservation.: 35. NOAA. Loreto, Baja California Sur, México. Technical Memorandum NOAA NMFS-SEFSC-602 pp.
31. Portocarrero-AYA, M., A. Ferrer, C. Lasso, M. Ruiz-García, J. Bolaños-Jiménez & S. Caballero. 2010. Status, distribution and conservation of the river dolphins Inia geoffrensis and Sotalia spp. in Venezuela. En: F. Trujillo, E. Crespo, P. Van Damme & J. Usma (eds.). The Action Plan for South American River Dolphins 2010 2020: 17 28. WWF, FundaciónOmacha, WDS, WDCS, SOLAMAC. Bogotá, D.C.
32. Rodríguez, G. 2000. Fisiografía del Sistema de Maracaibo. En: G. Rodríguez (ed.). El Sistema de Maracaibo: 7 19. Instituto Venezolano de Investigaciones Científicas (IVIC). Caracas, Venezuela.
33. Rossi-Santos, M.R & P. Flores. 2009. Commensalism between Guiana dolphins Sotalia guianensis and sea birds in the North Bay of Santa Catarina, Southern Brazil. The Open Marine Biology Journal 3:7782.
34. Rueda-Roa, D. & F.E. Muller-Karger. 2013. The southern Caribbean upwelling system: Sea surface temperature, wind forcing and chlorophyll concentration patterns. Deep Sea Research I. 78: 102-114.
35. Schoener, T.W. 1971. Theory of feeding strategies. Ann. Rev. Ecol. System. 4:259-271.
36. Simões-Lopes, P.C. 1988. Ocorrência de uma população de Sotalia fluviatilis Gervais, 1853, (Cetacea: Delphinidae) no limite sul de sua distribuição, Santa Catarina, Brasil. Biotemas 1(1): 57-62.
37. Shane, S.H. 1990. Behavior and ecology of the bottlenose dolphin at Sanibel Island, Florida. En: S. Leatherwood & R. Reeves (eds.). The Bottlenose Dolphin. Academic Press. San Diego. 450pp.