 1, Adonis Giorgi1, Beatriz González2
1, Adonis Giorgi1, Beatriz González2
 1, Adonis Giorgi1, Beatriz González2
1, Adonis Giorgi1, Beatriz González2
1 Departamento de Ciencias Básicas, Universidad Nacional de Luján, Luján, Argentina.
Sebastián Kravetz: sebastiankravetz@yahoo.com.ar; ORCID: 0000-0002-8039-4040
2 Departamento de Tecnología, Universidad Nacional de Luján, Luján, Argentina
Fecha de recepción: 16 Marzo de 2016. |
Fecha de aprobación: 12 Septiembre de 2016 |
Resumen
Los efluentes industriales textiles constituyen un grave problema de contaminación ambiental. Dada la gran complejidad y diversidad de los compuestos utilizados en los procesos y la magnitud en que son eliminados en los efluentes, producen un gran impacto sobre los ecosistemas acuáticos receptores. Con el objetivo de evaluar la capacidad de una matriz biológica conformada por micelio para decolorar efluentes textiles, se realizaron una serie de experimentos estáticos, en los que se utilizó micelio de Pleurotus ostreatus, desarrollado en avena como sustrato e incubado en oscuridad durante 25 días a 25°C. Se comprobó que el micelio continuó creciendo adecuadamente al exponerlo al efluente, aun cuando éste no hubiera sido esterilizado. Además, se demostró que el tiempo necesario para la decoloración varía entre 24 y 72 horas dependiendo de la intensidad del color del efluente. Se encontró que la mejor relación sustrato colonizado por P. ostreatus (matriz)/efluente fue de 5% masa/volumen y se comprobó que dicha matriz de micelio puede reutilizarse, aunque se reduce su capacidad decolorativa. Los resultados indicaron que este sistema podría ser utilizado para la decoloración de efluentes de industrias textiles, disminuyendo así su impacto sobre los ecosistemas naturales. CC BY-NC-SA Gestión y Ambiente (2016).
Palabras clave: colorantes textiles; biodegradación; decoloración; contaminación; hongo de la pudrición blanca.
Abstract
The textile industrial wastewaters cause a serious problem of environmental pollution. Given the complexity and diversity of the compounds used in the process and the high quantity to which they are released by the effluents, they produce an important impact on aquatic ecosystems. In order to evaluate the ability of a mycelium biological matrix to bleach textile effluents, a series of static experiments were conducted, in which mycelia of Pleurotus ostreatus grown in oatmeal and incubated in darkness for 25 days at 25°C were used. Results show that the mycelium continued to grow properly when exposed to the effluent even though it had not been sterilized, and that the time required for discoloration ranged from 24 to 72 hours, depending of the intensity of effluent coloration. It was estimated that the best matrix/effluent relationship was 5% mass/volume and that this mycelium matrix can be reused, although its discoloration capability would be lower. Results indicate that this system could be used for bleaching the effluents of textile industries, thus reducing their impact on natural ecosystems. CC BY-NC-SA Gestión y Ambiente (2016).
Keywords: textile dyes; biodegradation; decolaurization; pollution; white rot fungus.
Introducción
Las industrias textiles se encuentran entre las más contaminantes ya que eliminan desperdicios líquidos que contienen una gran variedad de compuestos tóxicos. Entre ellos, se destacan los colorantes, pigmentos y metales pesados como cadmio y cromo, cuyos efectos perjudiciales en los ecosistemas han sido ampliamente estudiados (Rott et al., 1998; Rott y Minke, 1999; Chequer et al., 2013). El impacto nocivo sobre los cursos hídricos se incrementa, al desecharse, una gran cantidad de materia orgánica disuelta y en suspensión, sólidos disueltos, pesticidas organoclorados y altas concentraciones de fosfatos, sodio, cloro y sulfatos. El daño provocado es debido tanto a la magnitud de los volúmenes liberados como a la modificación de la calidad del agua y a la dificultad para la eliminación de estos compuestos por parte de los ecosistemas (ONeill et al., 1999; Wesenberg et al., 2003; Rodríguez et al., 2006; Luchetti y Giorgi, 2009; Cortazar-Martínez et al., 2012).
En promedio, el 15 % de los colorantes utilizados en las industrias textiles se pierden durante el proceso de teñido (Cardona et al., 2009). Tanto los colorantes como los pigmentos contienen estructuras aromáticas complejas que, al tener baja velocidad de depolimerización y un gran poder de bioacumulación, resultan recalcitrantes a la acción de los organismos presentes en los cuerpos de agua receptores (Wesenberg et al., 2003; Rodríguez et al., 2006). Su presencia disminuye la transparencia de las aguas, al actuar como grupos que absorben luz, afectando así la actividad fotosintética de las algas y plantas que habiten en el cuerpo de agua receptor. Como consecuencia, se reduce el contenido de oxígeno disuelto, lo que provoca un efecto negativo aún mayor en los ecosistemas acuáticos (Rodríguez et al., 2006).
Existe una gran variedad de colorantes que se utilizan en las industrias textiles, según el tipo de tela, la tonalidad a lograr y el proceso de aplicación de los mismos. Los más frecuentes, están compuestos por grupos químicos azo, antraquinonas, trifenilmetanos, heterocíclicos y complejados con metales, que a su vez pueden contener varios sustituyentes, como grupos nitro, sulfónico u otros aromáticos (Robinson et al., 2001; Cortazar-Martínez et al., 2012). Esta gran diversidad estructural hace que estos compuestos tengan diferentes susceptibilidades a la descomposición por los métodos convencionales utilizados en las plantas de tratamiento de efluentes industriales (Wong y Yu, 1999; Cortazar-Martínez et al., 2012). Se han desarrollado numerosas tecnologías para el tratamiento de aguas residuales de este tipo de industrias, pero dada la complejidad y diversidad de su composición resultan técnica y económicamente poco satisfactorias, siendo necesaria la utilización de varias estrategias para lograr la eliminación de los contaminantes (Wesenberg et al., 2003; Cortazar-Martínez et al., 2012).
Desde finales del siglo pasado, se está estudiando la posibilidad de tratar los efluentes textiles mediante el uso de un grupo de organismos que degradan naturalmente la lignina. Son los denominados hongos de la podredumbre blanca de los leños, los que incluyen géneros que pertenecen al Phylum Basidiomycota. Entre los más estudiados se encuentran Phanerochaete, Pleurotus y Trametes (Wong y Yu, 1999; Biyik et al., 2009; Cortazar-Martínez et al., 2012). En condiciones naturales, estos organismos degradan celulosa y lignina, mediante complejos enzimáticos extracelulares. Guillén-Navarro et al. (1998) analizaron la producción de biomasa y enzimas ligninolíticas de Pleurotus ostreatus en medio sintético, a diferentes concentraciones de glucosa, peaches y temperaturas de incubación, obteniendo las enzimas lacasa y manganeso peroxidasa. Este mismo hongo produjo luego de 19 días de fermentación sólida, mayor actividad de lacasa que otros hongos con acción degradadora como Trametes sp. (Márquez-Araque et al., 2007). A la vez, se ha descripto la utilización de especies de Pleurotus para degradar la coloración proveniente de la vinaza o de la pulpa de café identificando a la enzima lacasa como responsable del proceso. (Rodríguez et al., 2003).
La producción de estas enzimas permite además que los hongos ligninolíticos toleren elevadas concentraciones de contaminantes. En particular la lacasa ha sido empleada en la degradación de compuestos xenobióticos, de hidrocarburos poliaromáticos y de pesticidas. Esta enzima, a diferencia de las peroxidasas, tiene la ventaja de no requerir peróxido de hidrógeno como cofactor. La degradación de compuestos tóxicos y la decoloración está relacionada con su actividad (Rodríguez et al., 2003).
Pleurotus ostreatus (Jacq. ex Fr.) P. Kumm. es una especie rústica, muy tolerante a altas concentraciones de contaminantes, soporta condiciones ambientales variables y sus enzimas resisten un amplio rango de temperaturas, valores de pH y salinidades variadas. Además, es buena productora de enzimas ligninolíticas y celulolíticas y tiene crecimiento rápido, permitiendo obtener un aumento considerable del hongo en tiempos reducidos (Zhao y Hardin, 2007; Arulmani et al., 2008; Biyik et al., 2009).
Diversos estudios muestran la capacidad de P. ostreatus para su uso en la reutilización de sustratos, vermicompost, producción de biogas, biorremediación y biotecnología. Se ha demostrado que puede degradar, biosorber y/o bioacumular diversos compuestos xenobióticos, desde metales pesados e hidrocarburos, hasta un amplio rango de colorantes como azoicos, dispersos, ácidos y antraquinónicos (Wesenberg et al., 2003; Palmieri et al., 2005; Rodríguez et al., 2006; Zhao y Hardin, 2007; Arulmani et al., 2008; Biyik et al., 2009; Picornell et al., 2015).
En el partido de Luján, Provincia de Buenos Aires, Argentina, lugar donde se desarrolló este estudio, el 25% de las industrias pertenecen al rubro textil. La mayoría descarga sus efluentes en pequeños cursos de agua, y en determinadas épocas del año, su caudal puede superar el del arroyo receptor (Luchetti y Giorgi, 2009).
Allí también se encuentra ampliamente disponible P. ostreatus, por ser cultivado como hongo comestible. Los establecimientos productores, emplean como inóculo granos de trigo o avena colonizados por el hongo y el sustrato para la obtención de los basidiomas (gírgolas) es paja de los mismos cereales.
Este estudio tuvo como objetivo adecuar los parámetros necesarios de una matriz decolorante preparada con P. ostreatus para tratar los efluentes eliminados por la industria textil.
Materiales y métodos
Durante 2013, se realizaron experimentos empleando efluentes de una industria textil ubicada en Luján, Buenos Aires (Estampados Rotativos S.A.). Las muestras se tomaron con recipientes estériles a partir de su canal de evacuación y fueron obtenidas el mismo día en que se utilizaron para los experimentos. Las características fisicoquímicas de estos efluentes fueron estudiadas por Giorgi y Malacalza (2002) y reiteradas en varios monitoreos hasta 2012.
Se utilizó micelio de Pleurotus ostreatus (Jacq. ex Fr.) P. Kumm., que se obtuvo a partir del inóculo utilizado para producción de gírgolas (basidiomas), en la Cooperativa de productores de Hongos Comestibles Aldea (Registro No. 44958), radicada en la zona de Luján, Buenos Aires, Argentina. La cepa se encuentra depositada en el laboratorio de Fitopatología de la Universidad Nacional de Luján, Argentina. El micelio se desarrolló en granos de avena, previamente esterilizados en autoclave a 121°C durante 45 minutos. La matriz con micelio se preparó en la proporción 5% en peso húmedo de granos colonizados/granos estériles. Los procedimientos realizados fueron a escala de laboratorio. Se incubó en una estufa de cultivo marca San Jor modelo SL70CDB (San Jor, Buenos Aires) en oscuridad a 25°C durante 25 días, tiempo en el cual los granos estuvieron totalmente colonizados.
La decoloración se evaluó con una escala visual semicuantitativa que se elaboró para estudiar los cambios de tonalidades de los efluentes cuando fueron sometidos a los distintos tratamientos. Dicha escala consistió en cinco categorías: grado 5, color original del efluente; grado 4, predominó el color original pero con un cambio en la tonalidad hacia un color más claro; grado 3, poca evidencia del color original; grado 2, ausencia del color original, tonalidad de mayor intensidad que el grado 1; grado 1, color del agua producido por efecto de la matriz (Figura adicional 1). En todos los experimentos las observaciones fueron realizadas por los dos evaluadores que participaron del ensayo. Debido al empleo de esta escala, no se realizaron promedios entre réplicas sino que se presentan los cambios registrados en cada una de ellas.
Diseño de los experimentos
Para los ensayos se prepararon réplicas matriz-efluente y en un caso agua en reemplazo del efluente textil: se dispuso la matriz en vasos plásticos de 250 cm3, a los que se les realizó 10 perforaciones circulares de 5 mm de diámetro, una de ellas en el centro de la cara inferior y las demás equidistantes a 1 cm de la base sobre la cara lateral, que en conjunto representaron una superficie perforada de 2 cm2. Los vasos perforados conteniendo la matriz, se introdujeron en bandejas rectangulares de 9 cm de ancho, 14 cm de largo y 5 cm de alto, conteniendo 300 mL de efluente textil coloreado, cuya altura del nivel en las bandejas fue de aproximadamente 2,5 cm, de manera que el micelio tomó contacto con el líquido a través de las perforaciones y a su vez mantuvo una superficie de contacto de 44 cm2 con la atmósfera, que le permitió el intercambio de gases.
Los controles consistieron en el efluente textil sólo (control efluente), para observar si parte de la decoloración fue producto de la exposición a las condiciones experimentales y del sustrato sin inoculación del hongo (control sustrato), reemplazando la matriz por granos de avena estériles sin desarrollo de P. ostreatus, para determinar si el sustrato en el que se desarrolló la matriz contribuye en el proceso de decoloración. Ambos controles se realizaron en todos los ensayos, a excepción de la evaluación de la posibilidad de reutilización de la matriz, en el que sólo se utilizó control efluente.
En todos los casos, los ensayos fueron estáticos y la incubación se realizó en oscuridad a 20°C. Se registró el pH durante la realización de los experimentos. El equipo utilizado fue un peachímetro portátil marca HANNA HI9125. Los registros se tomaron directamente sobre el líquido sin dilución.
Se evaluó el efecto de los efluentes sobre el crecimiento del micelio, según se observó o no la presencia de hifas al final de los experimentos sobre la superficie de los granos de avena, que estuvieron en la parte superior de la matriz expuesta a la atmósfera y la formación de masas compactas de micelio.
Coloración generada por la matriz. Se estudió el aporte de color de la matriz sobre agua destilada y los efluentes, observando la tonalidad final obtenida al exponer la matriz tanto a un líquido coloreado (efluente textil) como a uno incoloro (agua). Para ello se realizó un ensayo en el que se utilizó seis réplicas matriz-efluente y seis réplicas matriz-agua, en ambos casos se utilizaron 30 g de matriz y 300 mL de líquido. Luego de 6 días, se evaluó el aporte de color de la matriz sobre el agua y se lo comparó con el producido en el efluente textil.
Efecto de la esterilización del efluente. Se evaluó la necesidad de esterilización del efluente por la presencia de diversos organismos en los efluentes y se constató mediante observación microscópica. Se analizó el efecto de su presencia en el proceso de decoloración. Para el experimento se utilizó efluente industrial esterilizado en autoclave (a 121°C y 15 min), y sin esterilizar. Ambos fueron expuestos a la matriz fúngica. Se realizaron seis réplicas matriz-efluente, control sustrato y control efluente para cada tratamiento, en los que se utilizaron 30 g de matriz y 300 mL de efluente por cada réplica. Las observaciones se realizaron cada 24 horas (h) durante 3 días y luego al día 6.
Proporción matriz-efluente. Se estudió la cantidad adecuada de micelio para producir decoloración. Se utilizaron réplicas matriz-efluente, cada una c 300 mL de efluente textil y distintas cantidades de matriz: 7,5; 15,0 y 30,0 g, que correspondieron a las proporciones de matriz/efluente, 2,5%; 5,0% y 10,0% m/v (masa/volumen, gm L-1), respectivamente. Se utilizó efluente industrial sin esterilizar. Para cada proporción se prepararon tres réplicas matriz-efluente, control sustrato y control efluente textil. Las observaciones se realizaron a las 24, 72 y 144 h.
Se realizó un ensayo para confirmar los resultados obtenidos en los experimentos anteriores. Se empleó un nuevo efluente textil sin esterilizar. Se utilizaron tres réplicas matriz-efluente de proporción 5% m/v; control sustrato y control efluente.
Reutilización de la matriz. Finalmente se analizó la posibilidad de reutilización de la matriz. Se prepararon seis réplicas matriz-efluente y control efluente. En la primera parte del ensayo se registró la decoloración a las 24 y 48 h. Cuando se observó grado 1, según escala visual, en el 50% de las réplicas, se retiró el líquido y se agregó a cada recipiente el efluente original conservado en refrigerador a 4°C. Las observaciones en este caso se realizaron a las 24, 48, 72 y 120 h. No se realizó control sustrato dado que el experimento tuvo como objetivo demostrar la posible reutilización de la matriz, habiendo ya comprobado en experimentos anteriores su capacidad decolorativa con respecto al sustrato no colonizado.
Análisis estadístico. Para el análisis de los datos se utilizó el programa SPSS Statistics v. 20.0 (IBM®, Armonk, NY). Se realizaron pruebas no paramétricas utilizando el estadístico de Kruskal - Wallis para muestras independientes (Zar, 2010). La utilización de pruebas no paramétricas se basó en que se obtuvieron datos que carecen de continuidad ni poseen distribución normal. El estadístico utilizado en particular permite establecer diferencias entre muestras por rangos y estimando límites de confianza entre las diferencias de dichos rangos.
Resultados y discusión
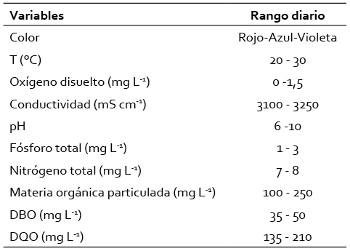
Las principales características fisicoquímicas del efluente del cual se obtuvieron las muestras, registradas entre 2000 y 2012 se resumen en la Tabla 1.
Coloración generada por la matriz
Inicialmente, el efluente presentó una tonalidad violácea oscura y pH= 8,34. Cuando se incubó la matriz fúngica en el efluente textil, se observó al sexto día un tono amarillo fuerte en el líquido correspondiente a grado 1 y pH= 6,79±0,87. En un ensayo similar, se reemplazó el efluente industrial por agua destilada y pudo observarse la misma tonalidad como resultado (Figura adicional 2), en coincidencia con Jadeja (2012), quién obtuvo el mismo color al finalizar sus experimentos. A partir de estos resultados se deduce que la tonalidad amarilla producida podría deberse en gran parte a la liberación de compuestos hidrosolubles desde la matriz hacia el líquido y ser consecuencia de la acción enzimática del hongo sobre el sustrato y el efluente.
La capacidad decolorativa de P. ostreatus podría estar relacionada a dos características de su modo de vida. Por un lado, libera enzimas peroxidasas y lacasas, así como otras enzimas implicadas en la degradación de compuestos complejos. Estas enzimas pueden actuar sobre los colorantes, con la consecuente producción de radicales catiónicos, que continúan vía enzimática o reactiva el proceso de degradación hasta la mineralización total (Fernández et al., 2009; Wesenberg et al., 2003).
Efecto de la esterilización del efluente
Cuando se evaluó el efecto de la esterilización del efluente sobre la capacidad decolorativa de la matriz (Figura 1), se observó, luego de 24 horas de incubación que en ambos tratamientos, efluente estéril y efluente no estéril, se produjeron cambios similares. Cuatro réplicas matriz-efluente presentaron grado 3, y las restantes grado 4, al igual que los controles sustrato y efluente textil. Al segundo día, cuatro réplicas con efluente sin esterilizar presentaron grado 2 y las restantes grado 3, al igual que el control sustrato; en el tratamiento con efluente industrial estéril solo una réplica cambió a grado 2. Los controles efluente permanecieron sin cambios en ambos casos. Luego de 72 horas, en el tratamiento estéril, las réplicas 1 y 5 presentaron grado 3, no hubo variaciones en el tratamiento con efluente sin esterilizar, al igual que en los controles sustrato y efluente de ambos tratamientos. Finalmente, al sexto día, cinco réplicas de ambos tratamientos adquirieron grado 2; la restante de cada uno presentó grado 3, al igual que los controles sustrato. Los controles efluente se mantuvieron en grado 4. El análisis estadístico de Kruskal-Wallis resultó no significativo al comparar los dos tratamientos para cada día del experimento (P>0,05).
En base a estos resultados, se concluye que la esterilización del efluente no es necesaria para la utilización de la matriz, dado que en ambos casos se pierde la coloración original y las diferencias no son significativas entre ambos tratamientos. La decoloración observada en los controles efluente podría deberse a factores fisicoquímicos como reacciones oxidativas o la cinética de degradación de los colorantes. En el caso de los controles sustrato, es probable que la decoloración durante las primeras 24 horas, sea producto de la sorción de parte de los colorantes a los granos de avena, lo cual se podría acentuar a medida que pasa el tiempo por hidratación y ruptura, generando de esa forma mayor superficie para que se produzca este proceso. Radhika et al. (2014) proponen que durante el comienzo del tratamiento la disminución de la coloración sería producto exclusivo de la sorción del colorante. Sin embargo, Yan et al. (2009) reportaron solo un 5% de colorante adsorbido, el que fue encontrado en la superficie del sustrato y no del hongo. Por otro lado, dichos autores encontraron una gran actividad enzimática, sobre todo de lacasas, entre los días 3 y 6, cuando se incluyó paja de arroz al sistema decolorativo. Por lo que hasta ese momento la decoloración sería producto casi exclusivo de la sorción.
Pant et al. (2008), utilizaron Phanerochaete chrysosporium, otro hongo de la podredumbre blanca, para decolorar soluciones de rojo congo, verde de malaquita y cristal violeta, con la adición de fuentes de nitrógeno y glucosa. Comprobaron que la esterilización de la solución coloreada y el agregado de las fuentes de nutrientes no beneficiaron en conjunto al proceso, ya que se produjo un aumento en la coloración de la solución. La posibilidad de utilizar el efluente sin esterilizar tiene implicaciones prácticas, porque los volúmenes que normalmente producen las industrias textiles son elevados, y por ello, implementar una esterilización como pretratamiento, aumentaría los costos. Como consecuencia de ello, en los ensayos posteriores, se utilizó efluente industrial sin pretratamiento.
Proporción matriz-efluente
Al evaluar la proporción adecuada de matriz-efluente, a las de 24 h de incubación, el tratamiento 2,5% m/v presentó grado 4 en que todas las réplicas, control sustrato no varió, al igual que el control efluente; en el caso del tratamiento 5% m/v, el cambio fue mayor: dos réplicas matriz-efluente presentaron grado 2 y la restante grado 3; el control sustrato cambió a grado 4 y el control efluente se mantuvo sin variaciones; la proporción 10% m/v presentó en todas las réplicas matriz-efluente grado 3; el control sustrato grado 4 y el control efluente no varió (Figura 2). Al tercer día, las réplicas matriz-efluente del tratamiento 2,5% m/v presentaron grado 3, al igual que el control sustrato, el control efluente no varió; en el caso de las proporciones 5% m/v y 10% m/v, todas las réplicas presentaron grado 1, los controles sustrato grado 3 y controles efluente no variaron. Luego de 6 días las réplicas del tratamiento 2,5% m/v presentaron grado 2, el control sustrato no varió mientras que en el control efluente se registró grado 4; los otros dos tratamientos tuvieron comportamientos similares: los controles sustrato presentaron grado 2 y los controles efluente grado 4; las réplicas matriz efluente permanecieron con grado 1.
De esta forma, los mejores resultados se obtuvieron cuando se incrementó la proporción matriz-efluente de 2,5 a 5 % m/v, ya que no hubo diferencias significativas (P>0,05) entre este último tratamiento y 10 % m/v, aunque si entre los tratamientos y los controles sustrato y efluente (P<0,05 en ambos casos). La ventaja de la matriz respecto al sustrato en este caso, no sólo es una decoloración más rápida y de mayor grado, ya que al tercer día de tratamiento con la matriz 5 % masa/volumen de efluente, se alcanza grado 1 y con el sustrato recién al sexto día grado 2, sino que además la matriz degrada compuestos complejos presentes en los efluentes, que el sustrato sin desarrollo de micelio no podría degradar, dado que este sólo actuaría por mecanismos de sorción.
Extrapolando estos resultados a condiciones de campo, la cantidad de matriz necesaria para la utilización en un sistema de tratamiento de efluentes sería relativamente alta si se tiene en cuenta los volúmenes de agua coloreada arrojados por las industrias textiles: Luchetti y Giorgi (2009) registraron un caudal de 1,6 m3 s-1, producido por dos industrias en la zona. En base a este valor y a los resultados de este estudio, se puede calcular que se deberían retener unos 200.000 m3 de efluente, durante 3 días como mínimo, para eliminar una tonalidad intensa en el líquido de este efluente, y para ello, se necesitarían unas 10 toneladas de sustrato colonizado por P. ostreatus.
Los resultados obtenidos, se confirmaron en un ensayo en el que se empleó un nuevo efluente textil sin esterilizar, con una tonalidad más oscura y una proporción de 5% m/v de matriz-efluente (Figura adicional 3). Se comprobó que la matriz fue capaz de eliminar la coloración en 3 días y, llegar a grado 1, en 6 días (Figura 3). En todas las réplicas matriz-efluente se observó un cambio similar, de un grado cada 24 h durante 3 días, hasta alcanzar grado 2. Posteriormente, no se observaron cambios hasta el sexto día, en el cual presentaron grado 1. El control sustrato tuvo grado 4 en el día 2 y se mantuvo hasta finalizar el experimento. El control efluente presentó grado 4 desde el día 5 al 6. La decoloración observada en ambos tipos de controles se atribuye, al igual que en los casos anteriores, a factores fisicoquímicos y mecanismos de sorción por parte del sustrato.
Reutilización de la matriz
Al evaluarse la posibilidad de reutilización de la matriz, durante la primera parte del experimento, se comprobó que luego de 24 h de incubación, cuatro réplicas matriz-efluente presentaron grado 4 y las dos restantes grados 2 y 3; el control efluente no presentó variaciones. Al segundo día, en la mitad de las réplicas se obtuvo grado 1 (Figura 4), se retiró el líquido y se incorporó efluente original, dando comienzo a la segunda parte del ensayo: Luego de 24 h, todas las réplicas presentaron grado 4. El segundo día, en 5 réplicas se observó grado 3 y en la restante grado 2. El tercer día, tres réplicas presentaron grado 2 y las restantes grado 3. Finalmente, al quinto día de incubación, cuatro de las réplicas tuvieron grado 1, mientras que las dos restantes grado 2. El control efluente el tercer día presentó grado 4 y se mantuvo hasta finalizar el experimento. De esta forma, al reutilizarse la matriz, retirando el líquido tratado y agregando efluente original, el tiempo necesario para obtener un efecto de decoloración similar al original se incrementó a 5 días.
Los resultados demuestran que la matriz puede ser reutilizada al menos una vez, aunque el proceso de decoloración es más lento. Las diferencias entre la primera y segunda utilización de la misma podrían ser explicadas en base a la capacidad de sorción de la misma: sería mayor en el primer uso y las superficies quedarían parcialmente saturadas.
Estos resultados fueron semejantes a los obtenidos por Palmieri et al. (2005) utilizando P. ostreatus. En ese caso, el micelio se pudo reutilizar hasta tres veces para decolorar tinturas sintéticas, aunque los porcentajes de eliminación del colorante disminuyeron durante las sucesivas etapas. A diferencia de lo observado por los autores mencionados, en este estudio la primera decoloración se produjo en 48 h, con grado 1 en la mitad de las réplicas, pero cuando se reutilizó el micelio fueron necesarios 5 días de incubación. La posibilidad de reutilización de la matriz tiene potencial para incrementar la eficiencia de su utilización.
Uno de los mayores problemas que se presentan en las plantas depuradoras convencionales es su poca adaptabilidad para degradar un amplio rango de compuestos estructuralmente diferentes como los colorantes, y como consecuencia el impacto sobre los cursos hídricos continúa. La matriz fúngica preparada en este trabajo fue eficiente para eliminar la coloración de efluentes con las mezclas de tintes y otras sustancias complejas que eliminan las industrias textiles, lo que demuestra su capacidad para adaptarse a la diversidad estructural de los componentes de esos efluentes, producto de la poca especificidad de las enzimas y los mecanismos que intervienen en el proceso de decoloración (Wesenberg et al., 2003; Fernández et al., 2009).
Con respecto al crecimiento del micelio durante el proceso decolorativo, el mismo fue intenso sobre el sustrato, e inclusive en algunos casos, sobre la superficie del líquido. Al finalizar los experimentos, en todas las réplicas matriz-efluente de todos los ensayos realizados, pudo observarse un crecimiento exuberante del micelio sobre la superficie de los granos de avena en contacto con la atmósfera, ocultando por completo el sustrato que inicialmente era lo más visible de la matriz (Figura adicional 4). En el interior de los recipientes el mismo tuvo un crecimiento compacto en todos los casos. La matriz fue capaz de decolorar los efluentes textiles utilizados en los experimentos, observándose un efecto visual más acentuado ante las intensidades bajas de coloración.
En cuanto a los valores de pH, inicialmente se observaron valores entre 8 y 9 en el efluente. Al comienzo de los tratamientos con la matriz, se observó una disminución de los mismos, a valores de entre 6,5 y 7,5 que se incrementaron en los siguientes días del ensayo, volviendo a valores finales cercanos a los iniciales. En los controles no sucedió lo mismo, en ambos tipos de controles el pH siempre se mantuvo por encima de los valores iniciales del efluente (8,06 9,85).
Los resultados de los experimentos realizados demuestran que la decoloración es debida a la presencia de P. ostreatus, aunque el sustrato contribuiría en el proceso por mecanismos de sorción. La posibilidad de utilizar la matriz conformada por este hongo, para actuar sobre un efluente no esterilizado, así como su reutilización son resultados alentadores para la remoción de la coloración de los efluentes textiles.
Conclusiones
En condiciones estáticas, se observa un gran desarrollo del micelio de P. ostreatus, se desarrolla notablemente cuando una parte de la matriz se encuentra sumergida en un efluente textil y la otra expuesta al aire. La matriz con micelio de P. ostreatus, que crece sobre semillas de avena, es eficiente para producir decoloración de efluentes textiles, aún cuando los mismos se encuentran sin esterilizar. El efecto se debe al hongo, si bien el sustrato contribuiría en el proceso por mecanismos de sorción, según se observa en los controles sustrato. Sin embargo, su efecto sería moderado, como se demuestra al analizarse estadísticamente las diferencias de los controles sustrato con las réplicas matriz-efluente en el experimento que se compararon las proporciones.
La matriz puede decolorar efluentes con distintas intensidades de coloración, obteniéndose como resultado final una tonalidad amarilla tenue del líquido, grado 1. Cuando la tonalidad del efluente es intensa, la decoloración ocurre de forma gradual.
La proporción matriz efluente, adecuada para observar decoloración en tiempo cortos, es 5 % m/v (gramos de micelio/mililitros de efluente industrial).
Es posible reutilizar la matriz en una segunda decoloración, aunque el proceso se hace más lento.
Sería necesario evaluar los parámetros fisicoquímicos de los efluentes y los productos de decoloración para optimizar el proceso y ampliar la comprensión del mecanismo de decoloración ejercido por el hongo, así como la capacidad de la matriz para eliminar otras sustancias presentes en el efluente. También podría comenzar a utilizarse en procesos industriales que tuvieran vías separadas de eliminación de efluentes, producidos durante el proceso de teñido, evitando su mezcla con agua utilizada en otros procesos de la industria, para exponer la fracción coloreada a este sistema de tratamiento y que permita reducir los volúmenes de agua desechada y en el que uno de los componentes del tratamiento sea la matriz integrada por P. ostreatus.
Agradecimientos
Los ensayos fueron realizados con el apoyo de un subsidio interdepartamental de la Universidad Nacional de Luján, otorgado a Adonis Giorgi y constituyeron parte de la tesis de licenciatura en Ciencias Biológicas de Sebastián Kravetz. Dirigida por Adonis Giorgi y Beatriz González.
Bibliografía
Arulmani, M., Murugesan, K., Geetha, V., Kalaichelvan, P., 2008. Decolourization of effluent using immobilized fungus (Pleurotus sp. MAK-II). ENVIS Newsl. 6, 5-7.
Biyik, H., Kalyoncu, F., Oryasin, E., Azbar, N., Kalmis, E., Gamze Basbülbül, G., 2009. Evaluation of wild and commercial types of Pleurotus strains for their ability to decolorize cibacron black W-NN textile dye. Afr. J. Microbiol. Res. 3, 325-329.
Cardona, M., Osorio, J., Quintero, J., 2009. Degradación de colorantes industriales con hongos lignolíticos. Rev. Fac. Ing. Univ. Antioquia 48, 27-37.
Chequer, F., Olivera, G., Ferraz, E., Cardoso, J., Zanoni, M., Olivera, D., 2013. Textile dyes: dyeing process and environmental impact. En: Günay, M. (Ed.), Eco-friendly textile dyeing and finishing. InTech, Rijeka, Croacia. pp. 151-176. DOI: 10.5772/53659
Cortazar-Martínez, A., González-Ramírez, C., Coronel-Olivares, C., Escalante-Lozada, J., Castro-Rosas, J., Villagómez-Ibarra, J., 2012. Biotecnología aplicada a la degradación de colorantes de la industria textil. Univ. Cienc. 28, 187-199.
Fernández, J., Henao, L., Pedroza-Rodríguez, A., Quevedo-Hidalgo, B., 2009. Inmovilización de hongos ligninolíticos para la remoción del colorante negro reactivo 5. Rev. Colomb. Biotecnol. 11, 59-72.
Giorgi, A., Malacalza, L., 2002. Effect of an industrial discharge on water quality and periphyton structure in a pampean stream. Environ. Monit. Assess. 75, 107-119. DOI: 10.1023/A:1014474128740
Guillén-Navarro, K., Márquez-Rocha, F., Sanchez-Vázquez, J., 1998. Producción de biomasa y enzimas ligninolíticas por Pleurotus ostreatus en cultivo sumergido. Rev. Iberoam. Micol. 15, 302-306.
Jadeja, A., 2012. Studies on decolorization of textile dye effluent by lignin degrading fungi. Tesis de doctorado. Facultad de Ciencias, Maharaja Krishnakumarsinhji Bhavnagar University, Bhavnagar, India. pp. 53-68.
Luchetti, M., Giorgi, A., 2009. ¿Cómo considerar las propiedades ecológicas de los sistemas acuáticos superficiales en la gestión ambiental pública? El caso del partido de Luján, Provincia de Buenos Aires, Argentina. Ing. Sanit. Ambient. 103, 75-78.
Márquez-Araque, A., Mendoza-Martínez, G., González-Muñoz, S., Buntinx-Dios, S., Loera-Corral, O., 2007. Actividad fibrolítica de enzimas producidas por Trametes sp. EUM1, Pleurotus ostreatus IE8 y Aspergillus niger AD96.4 en fermentación sólida. Interciencia 32, 780-785.
ONeill, C., Hawkes, F., Hawkes, D., Lourenco, N., Pinheiro, H., Delée, W., 1999. Colour in textile effuents - sources, measurement, discharge consents and simulations: a review. J. Chem. Tech. Biotechnol. 74, 1009-1018. DOI: 10.1002/(SICI)1097-4660(199911)74:11%3c1009::AID-JCTB153%3e3.0.CO;2-N
Palmieri, G., Cennamo, G., Sannia, G. 2005. Remazol Brilliant Blue R decolourisation by the fungus Pleurotus ostreatus and its oxidative enzymatic system. Enzym. Microb. Technol. 36, 17-24. DOI: 10.1016/j.enzmictec.2004.03.026
Pant, D., Singh, A., Satyawali, Y., Gupta, R., 2008. Effect of carbon and nitrogen source amendment on synthetic dyes decolourizing efficiency of white-rot fungus, Phanerochaete chrysosporium. J. Environ. Biol. 29, 79-84.
Picornell, M., Pardo, A., de Juan, J., 2015. Reuse of degraded Pleurotus ostreatus substrate through supplementation with wheat bran and Calprozime® quantitative parameters. Agron. Colomb. 33, 261-270. DOI: 10.15446/agron.colomb.v33n2.49760
Radhika, R., Jebapriya, G., Gnanadoss, J., 2014. Decolourization of synthetic textile dyes using the edible mushroom fungi Pleurotus. Pak. J. Biol. Sci. 17, 248-253. DOI: 10.3923/pjbs.2014.248.253
Robinson, T., McMullan, G., Marchant, R., Nigam, P., 2001. Remediation of dyes in textile effluent: a critical review on current treatment technologies with a proposed alternative. Bioresourc. Technol. 77, 247-255. DOI: 10.1016/S0960-8524(00)00080-8
Rodríguez, S., Bermúdez, R., Serrat, M., Kourouma, A., 2006. Selección de cepas de Pleurotus ostreatus para la decoloración de efluentes industriales. Rev. Mex. Micol. 23, 9-15.
Rodríguez, S., Fernández, M., Bermúdez, R.C., Morris, H., 2003. Tratamiento de efluentes industriales coloreados con Pleurotus spp. Rev. Iberoam. Micol. 20, 164-168.
Rott, E., Duthie, H., Pipp, E., 1998. Monitoring organic pollution and eutrophication in the Grand River, Ontario, by means of diatoms. Can. J. Fish. Aquat. Sci. 55, 1443-1453. DOI: 10.1139/f98-038
Rott, U., Minke, R. 1999. Overview of wastewater treatment and recycling in the textile processing industry. Water Sci. Technol. 40, 137-144. DOI: 10.1016/S0273-1223(99)00381-9
Wesenberg, D., Kyriakides, I., Agathos, S., 2003. White-rot fungi and their enzymes for the treatment of industrial dye effluents. Biotechnol. Adv. 22, 161-187. DOI: 10.1016/j.biotechadv.2003.08.011
Wong, Y., Yu, J., 1999. Laccase-catalyzed decolorization of synthetic dyes. Water Res. 33, 3512-3520. DOI: 10.1016/S0043-1354(99)00066-4
Yan, K., Wang, H., Zhang, X., Yu, H., 2009. Bioprocess of triphenylmethane dyes decolorization by Pleurotus ostreatus BP under solid-state cultivation. J. Microbiol. Biotechnol. 19, 1421-1430. DOI: 10.4014/jmb.0901.0033
Zar, J., 2010. Biostatistical analysis. 5a ed. Prentice Hall, Upper Saddle River, NJ. 944 p.
Zhao, X., Hardin, I., 2007. HPLC and spectrophotometric analysis of biodegradation of azo dyes by Pleurotus ostreatus. Dyes Pigm. 73, 322-325. DOI: 10.1016/j.dyepig.2005.11.014