Empleo de un Recubrimiento Formulado con Propóleos para el Manejo Poscosecha de Frutos de Papaya (Carica papaya L. cv. Hawaiana)
Use of a Coating Formulated with Propolis for Postharvest Handling of Papaya (Carica papaya L. cv. Hawaiian) Fruits
Elizabeth Barrera Bello1; Marcela Gil Loaiza2; Carlos Mario García Pajón3; Diego Luis Durango Restrepo4 y Jesús Humberto Gil González5
1 Estudiante Maestría en Ciencia y Tecnología de Alimentos. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias. A.A. 1779, Medellín, Colombia. <ebarrerab@unal.edu.co>
2 Ingeniera Química. Universidad Nacional de Colombia - Sede Medellín - Facultad de Minas. A.A. 1027, Medellín, Colombia. <marcegil88@hotmail.com>
3 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias. A.A. 3840, Medellín, Colombia. <cmgarcia@unal.edu.co>
4 Profesor Asistente. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias. A.A. 3840, Medellín, Colombia. <dldurango@unal.edu.co>
5 Profesor Asociado. Universidad Nacional de Colombia - Sede Medellín - Facultad de Ciencias Agrarias. A.A. 1779, Medellín, Colombia. <jhgilg@unal.edu.co>
Recibido: Abril 01 de 2011; aceptado: Enero 23 de 2012.
Resumen. El fruto de papaya es reconocido por las propiedades nutricionales y sensoriales; no obstante, su tiempo de vida útil en poscosecha es muy corto. En los últimos años, para incrementar la vida de almacenamiento del fruto se ha implementado el uso de recubrimientos como vehículos de agentes antimicrobianos y antioxidantes, entre otros. En este trabajo se comparó el efecto de dos recubrimientos; cera comercial (control) y cera comercial conteniendo un extracto etanólico de propóleos (5% p/v), sobre la vida en poscosecha de frutos de papaya (Carica papaya L. cv. Hawaiana) almacenados a temperatura ambiente (28 ± 2 ºC) y humedad relativa entre 65 y 70%. El efecto de los recubrimientos se determinó mediante el índice de deterioro de los frutos y el recuento microbiano (mesófilos aerobios, mohos y levaduras). Adicionalmente, se evaluaron durante 12 días las propiedades fisicoquímicas de los frutos (cambio de color, textura, pH, acidez total titulable, pérdida de peso y sólidos solubles). Los resultados mostraron que las papayas tratadas con el recubrimiento formulado con el extracto de propóleos, presentó un menor deterioro en cuanto a su apariencia y mayor inhibición del crecimiento de microorganismos durante los primeros 6 días de evaluación en comparación con los frutos control; además, no se observaron diferencias, producto de los recubrimientos, en relación a las características fisicoquímicas de los frutos.
Palabras clave: Recubrimientos comestibles, vida en poscosecha, calidad de las frutas, patógenos.
Abstract. Papaya fruit is known for the nutritional and sensory properties; however, its postharvest shelf life is very short. In recent years, to extend the storage life of this fruit, the use of coatings as a carrier of antimicrobial agents and antioxidants, has been implemented. In this work, the effect of two coatings, commercial wax (control) and commercial wax containing an ethanolic extract of propolis (5% w/v) on the postharvest of papaya (Carica papaya L. cv. Hawaiian) was compared. The fruits were stored at room temperature (28 ± 2 ºC) and a relative humidity between 65 and 70%. The effect of coatings was determined by the deterioration index of the fruit, and the microbial counts (aerobic mesophiles, molds and yeasts). Additionally, during 12 days were evaluated physicochemical properties of the fruits (color, texture, pH, titratable acidity, weight loss and soluble solids). The results showed that the papaya fruits treated with the coating containing the propolis extract presented less deterioration in their appearance and greater inhibition growth of microorganisms during the first 6 days compared with control fruits; moreover, no differences among the coatings in relation to the physicochemical characteristics of the fruit were observed.
Key words: Edible coatings, fruit shelf life, fruit quality, pathogens.
La papaya (Carica papaya) es una de las frutas tropicales mas apetecidas por los consumidores debido a que se le atribuyen propiedades nutricionales, digestivas y medicinales; además, posee un agradable aroma, sabor y textura. Para los agricultores este cultivo es muy atractivo debido a que presenta un periodo corto entre la siembra y la cosecha, y al mismo tiempo tiene un alto rendimiento ya que la producción es continua. Durante el año 2009, Colombia produjo 189.007 t de papaya (FAOSTAT, 2009); aunque se encuentran cultivos distribuidos en todo el país, las zonas principales de producción se localizan en los departamentos del Valle del Cauca, Córdoba, Casanare, Magdalena y Meta.
Los frutos de papaya al ser climatéricos son altamente perecederos y susceptibles al ataque de microorganismos patógenos, que causan grandes pérdidas en poscosecha. Su conservación se lleva a cabo durante periodos máximos de 2 a 4 semanas entre 8 y 10 ºC, o de 5 a 7 días si la temperatura es de 22 ºC (Paull et al., 1997). Con el fin de prolongar la vida útil del fruto, sin afectar sus propiedades fisicoquímicas y organolépticas, se han estudiado diversos métodos de conservación entre los que se incluyen: la utilización de extractos acuosos de hojas y semillas de chirimoya y papaya (Bautista et al., 2003), la aplicación de bicarbonato de sodio (Gamagae et al., 2003), la irradiación con rayos gamma y UV (Cia et al., 2007), el almacenamiento en atmosferas modificadas (González et al., 2003 ), entre otros.
La aplicación de recubrimientos se presenta como un método exitoso para la conservación de frutas, debido a que ayudan a extender la vida útil de los productos puesto que la barrera que ellos crean es selectiva a la transmisión de gases, vapor de agua y otros solutos, previniendo así la deshidratación y retardando la maduración. Además, los recubrimientos mejoran la calidad y apariencia de los frutos y sirven como vehículo para sustancias de interés, tales como vitaminas, antioxidantes y compuestos con actividad antimicrobiana (Paull et al., 1997).
Un agente que podría ser utilizado para el biocontrol de enfermedades de frutas y hortalizas durante el manejo poscosecha es el propóleos. Esta sustancia de origen natural es elaborada por las abejas melíferas (Apis mellifera) a partir de los exudados de las cortezas y diversos tejidos de las plantas y es utilizado al interior de la colmena para controlar el crecimiento de bacterias, hongos y otros microorganismos, generando un ambiente aséptico. En general, el propóleos está compuesto de resinas y bálsamos (50%), ceras (30%), aceites esenciales y aromáticos (10%), polen (5%) y un 5% de otras sustancias, (Scazzocchio et al., 2006). A los propóleos se les atribuyen diferentes propiedades biológicas, tales como: antitumorales, antiprotozoarias, antivirales, antioxidantes, antiinflamatorias, antibacteriales y antifúngicas (Santos et al., 2003); en particular, se ha encontrado que esta sustancia inhibe el desarrollo de patógenos de poscosecha como Botrytis cinerea y Penicillium expansum (Tripathi y Dubey, 2003). Adicionalmente, se ha reportado el efecto fungistático in vitro de extractos de propóleos colombianos contra Colletotrichum gloeosporioides y Botryodiplodia theobromae, logrando la reducción del crecimiento micelial hasta en un 30 y 49% respectivamente (Meneses et al., 2009). Por lo tanto, la inclusión de propóleos en la formulación de recubrimientos, podría representar una alternativa novedosa para el control de patógenos en poscosecha. Por consiguiente, el objetivo de esta investigación fue comparar el efecto de dos recubrimientos, uno de ellos formulado con un extracto etanólico de propóleos, sobre las propiedades microbiológicas y los atributos de calidad fisicoquímica de frutos de papaya cv. Hawaiana mantenidos a una temperatura promedio de 28 ºC y una humedad relativa entre 65 y 70%.
MATERIALES Y MÉTODOS
Propóleos. El propóleos se obtuvo en el apiario La Alianza del municipio de Caldas (Antioquia-Colombia), ubicado a 22 km de Medellín y a una altura de 1.759 msnm. La muestra se colectó en época de verano, durante los meses de junio-julio de 2007, por el método de malla plástica. El propóleos crudo, se sometió a extracción exhaustiva con etanol destilado del 96% durante 48 h a temperatura ambiente y en ausencia de luz (Palomino et al., 2009). Posteriormente, la mezcla se centrifugó a 3.000 rpm durante 10 min y se filtró por gravedad. Al filtrado obtenido se le adicionó agua destilada y se dejó en refrigeración hasta precipitar las ceras (12 h, aproximadamente). El ciclo de refrigeración se repitió hasta no observar ceras precipitadas. Después de filtrar, el filtrado se sometió a un proceso de evaporación al vacío y temperatura de 40 °C, hasta sequedad. La resina obtenida del extracto etanólico (EEP) se envasó en viales ámbar y se refrigeró a -12 °C hasta posterior utilización.
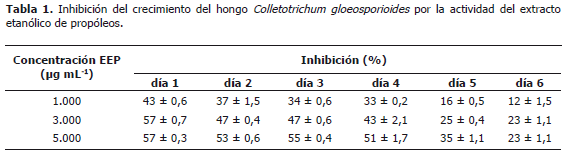
Actividad antifúngica in vitro del extracto etanólico de propóleo (EEP). Se empleó el método del alimento envenenado descrito por Grover y Moore (1962) con algunas modificaciones. La cepa de C. gloesporioides fue caracterizada morfológicamente y donada por el Laboratorio de Sanidad Vegetal de la Facultad de Ciencias Agropecuarias de la Universidad Nacional de Colombia - Sede Medellín. Las evaluaciones se realizaron en cajas de Petri estériles de 90 mm de diámetro a las cuales se adicionaron 15 mL de medio de cultivo papa, dextrosa, agar (PDA), previamente esterilizado en un autoclave; cuando el medio de cultivo depositado en las cajas alcanzó una temperatura de 50 ºC se adicionó a cada una de ellas la cantidad de EEP necesario para alcanzar las concentraciones de 1.000, 3.000 y 5.000 mg mL-1; se utilizó como solvente de este material una mezcla de etanol/Tween 80® en relación 1 mL/0,5 g. Después que el medio gelificó a temperatura ambiente, se perforó el punto medio de cada una de las cajas con un sacabocados de 6 mm de diámetro y se colocaron inóculos del hongo. Adicionalmente, se realizaron los respectivos controles, absoluto y solvente. Las placas se incubaron durante seis días a 25 ºC y se midió el diámetro de crecimiento micelial cada 24 h. A partir de los datos obtenidos en las mediciones, se calculó el porcentaje de inhibición del crecimiento del hongo considerando como puntos de referencia los valores obtenidos en los controles de blanco solvente. Los resultados se expresan como la media de tres mediciones ± desviación estándar (D.E.).
Material vegetal. Se sometieron a evaluación 126 papayas adquiridas en los centros de mercado locales de la ciudad de Medellín; se utilizaron 63 papayas para cada tratamiento, con un índice de maduración 2 (Rueda, 1999) (coloración verde con trazas amarillas en proporción inferior al 25% del área total), de tamaño y color uniforme, libres de daños físicos e infecciones fúngicas. Los frutos se lavaron con agua, desinfectaron con hipoclorito de sodio (0,2% de CL2) y secaron al ambiente para su posterior recubrimiento.
Preparación y aplicación del recubrimiento. Se preparó un recubrimiento compuesto de cera comercial (Espoquímica S.A., Medellín; a base de colofonias (30%) y libre de compuestos antimicrobianos) y agua en relación 1:1, el cual se aplicó sobre la superficie de los frutos (control). Similarmente, se impregnaron frutos de papaya con el recubrimiento formulado a partir de cera comercial, agua y el EEP a una concentración final del 5% p/v (tratamiento). Los frutos se dejaron secar con aire a temperatura ambiente y se mantuvieron en canastillas plásticas a 28 ± 2 ºC y humedad relativa (HR) entre el 65 y 70%, durante 12 días. Durante el estudio se realizaron muestreos periódicos para llevar a cabo los análisis fisicoquímicos y microbiológicos.
Pérdida de peso. Se registró el peso de un lote de 10 papayas en una balanza digital (± 0,01 g). Posteriormente, los frutos se pesaron diariamente durante todo el periodo de evaluación. Los resultados obtenidos se expresaron como porcentaje de peso perdido en relación al peso inicial (Pérez et al., 2002).
Cambios en el color. El color se determinó utilizando un espectrocolorimetro X-RITE® modelo SP60 con iluminante D65 y el observador de 10º como referencia. Se evaluó diariamente el cambio de color en la piel de los frutos bajo las coordenadas CIE L*a*b*. Se tomaron tres lecturas en sitios alrededor del eje ecuatorial. Para el análisis de la variación del color se analizaron directamente las coordenadas a* (-verde, + rojo) y b* (-azul, +amarillo) sobre tres puntos constantes en el eje ecuatorial de los frutos.
Firmeza. Se evaluó la fuerza máxima de ruptura y la fuerza de la pulpa (expresadas en Newton, N) con la ayuda de un analizador de textura TA.XT2 (Stable Micro Systems®) provisto de un cilindro de 2 mm de diámetro y 3 cm de largo, velocidad de penetración de 2 mm s-1, profundidad de penetración de 10 mm y una celda de 50 kg (Manenoi et al., 2007).
Sólidos solubles, acidez titulable y pH. Se analizó el contenido de sólidos solubles (CSS), la acidez total titulable (ATT) y el pH. Se tomó una muestra representativa de la pulpa la cual fue homogenizada; el CSS (ºBrix) se determinó en un refractómetro portatil (HI 96801, 0-85 °Brix Hanna Instruments®), el cual se calibró con agua previo a los análisis a 25 ºC (AOAC 932.12/00). La ATT se analizó por el método de titulación potenciométrica adicionando NaOH 0,1 M hasta alcanzar el punto final a pH = 8,2; la ATT se expresó como porcentaje de ácido cítrico (ácido cítrico /100 g de fruta) (AOAC 942.15/00). El pH se determinó directamente en la pulpa con un pH-metro (Hanna instruments®) calibrado previamente con soluciones buffer 4,0 y 7,0 (AOAC 973.41/00).
Índice de deterioro. Se evaluaron subjetivamente 10 frutos para cada tratamiento durante 11 días de almacenamiento. Para el signo de deterioro se determinó el área del fruto dañado, incluyendo el ataque por hongos y daños mecánicos; se utilizó una escala hedónica así: 1 = sin daño, 2 = bajo, 3 = moderado y 4 = severo. Se consideró un daño bajo si el área de la superficie dañada era inferior al 10%; y un daño severo cuando era superior al 20% (Pérez et al., 2002). Los resultados fueron expresados como el índice de deterioro (ID) empleando la formula: ID = (1n + 2n + 3n + 4n) N-1, donde n es el numero de frutos clasificados en cada nivel de la escala hedónica y N es el total de frutos analizados en cada tratamiento por día.
Pruebas microbiológicas. Para determinar el crecimiento microbiano en los frutos, se realizó un conteo de mesófilos aerobios (AOAC 990.12, 2000), mohos y levaduras (AOAC 970.0, 2000) a los 3, 7 y 12 días. Se utilizaron películas deshidratadas para conteo de aerobios (AC), y de mohos y levaduras (YM). Las placas se sembraron e incubaron a 37 °C por 48 h para AC, a 25 °C por 72 h para mohos y a 25 °C por 5 días para levaduras.
Análisis estadístico. Se realizó un análisis de varianza multifactor ANAVA con tres factores (tiempo, parámetro a evaluar, recubrimiento). Se utilizó un nivel de confianza del 95% y las diferencias estadísticas se determinaron con P<0,05. En el análisis estadístico se utilizó el programa STATGRAPHICS CENTURION XV.I.
RESULTADOS Y DISCUSIÓN
Actividad antifúngica in vitro del extracto etanólico de propóleos. En el análisis de actividad antifungica in vitro se observó que el EEP presentó actividad fungiestática frente al hongo C. gloeosporioides. En la Tabla 1, se observa que el porcentaje de inhibición del crecimiento del hongo fue dependiente de la concentración del EEP y del tiempo de evaluación. La mayor inhibición se presentó a 5.000 mg mL-1 en las primeras 24 h obteniéndose un valor del 57%; a partir del día cinco, se observó una disminución en la actividad alcanzando valores de inhibición del 23%, lo que sugiere un aparente mecanismo de detoxifiación del EEP por parte del microorganismo. Estos resultados concuerdan con estudios previos (Meneses et al., 2009 y Martínez 2009) en donde se estableció el potencial del propóleos como agente antimicrobiano contra hongos del género Colletotrichum sp. Consecuentemente, se infiere el potencial del EEP como ingrediente antimicrobiano en la formulación de recubrimiento para el manejo poscosecha de frutas. El patógeno Colletotrichum gloeosporioides es responsable de la Antracnosis en una gran cantidad de productos agrícolas; esta enfermedad es considerada el mayor defecto poscosecha de la papaya, limitando altamente su comercialización y su vida en almacenamiento.
Caracterización fisicoquímica y microbiológica de los frutos.
Pérdida de peso. Los frutos de papaya mostraron una pérdida de peso durante todo el periodo de evaluación (Figura 1). Después del tercer día, las papayas control presentaron una pérdida de peso significativamente menor (P<0,05) que los frutos tratamiento; sin embargo, al final del periodo el porcentaje de pérdida de peso fue igual para ambos recubrimientos (cercano al 15% aprox.). La pérdida de peso se debe a la eliminación de agua causada por los procesos de transpiración y respiración; este fruto, al ser climatérico, incrementa su ritmo de respiración y de producción de etileno una vez cosechado, acompañado de cambios estructurales, bioquímicos y organolépticos. Estos datos concuerdan con los resultados de Bautista et al. (2003), quienes no encontraron diferencias significativas en la pérdida de peso entre papayas tratadas con quitosán y extractos acuosos de plantas.
Color de la epidermis. Durante el periodo de almacenamiento se observó cambio en el color de la epidermis de los frutos, independiente del tipo de recubrimiento aplicado. De acuerdo con la Figura 2, la coordenada a* varió rápidamente desde los tonos verdes a rojos (control de -8,26 ± 1,25 a 21,91 ± 2,04 y tratamiento de -8,81 ± 1,14 a 19,51 ± 3,10); es decir, gradualmente se degradó la clorofila y se dio la formación de carotenoides y antocianinas que aportan los colores característicos del fruto maduro. En cuanto a la coordenada b*, se presentó una transición de 29,72 ± 2,59 a 54,67 ± 3,69 para el control y de 30,48 ± 3,10 a 52,89 ± 3,28 para el tratamiento con EEP. Esta variación se manifestó en la intensificación del color amarillo. Al respecto los resultados no son comparables con los obtenidos por Santamaría et al., (2009), quienes estudiaron los cambios de color en cáscara y pulpa de papaya cv. Maradol a 23 ºC y 75% HR, encontrando valores de a*/b*, para frutos con aproximadamente 4 y 10 días de cosechados, de -15/17 y 17/47 respectivamente. Los resultados obtenidos con relación a los parámetros de color de la piel de los frutos, indican que no existe una diferencia significativa entre los frutos control y los del tratamiento.
La variación en el color de los frutos estudiados, se debe a los cambios de pigmentación, que incluyen la biosíntesis y acumulación de carotenoides en las etapas finales de la maduración de la papaya (Pereira, et al., 2009). El cambio de color de verde a amarillo en la epidermis de la misma, se presenta por un proceso de maduración característico en el cual, se disminuye el contenido de clorofila y se aumenta el de carotenoides hasta alcanzar un color amarillo naranja, característico de un fruto sobremaduro. De esta manera, se encontró que el recubrimiento formulado con EEP no afectó el cambio de color de la epidermis, en comparación con el control, permitiendo una maduración normal del fruto.
Firmeza de piel y pulpa. Durante el almacenamiento se observó una disminución en la firmeza del fruto. La pérdida de firmeza pudo estar relacionada con la deshidratación del fruto, cuya piel inicialmente era lisa y suave y posteriormente se tornó rugosa y opaca. De acuerdo con la Figura 3A, la fuerza máxima de ruptura de la piel desciende de 33,02 hasta 5,49 N en el control y de 31,20 a 6,28 N para el tratamiento. Similarmente, la pulpa también sufrió cambios significativos de dureza; la fuerza ejercida para deformar la pulpa inicialmente fue de 14,58 N (control) y 13,99 N (tratamiento), y disminuyó hasta 0,51 y 0,54 N respectivamente (Figura 3B). La disminución de la textura posiblemente es producida por la acción de pectinasas y celulasas, que degradan las sustancias pécticas y la hemicelulosa que se encuentran en la piel de los frutos, además de la acción de otras hidrolasas que contribuyen también al ablandamiento (De la Cruz et al., 2007). Los resultados obtenidos indican que no hubo diferencia significativa entre el control y el tratamiento (P>0,05); por lo tanto la adición del EEP al recubrimiento no afectó la textura de la pulpa de los frutos, ni le otorgó mayor fuerza mecánica al recubrimiento. Bautista et al., (2003) encontraron que al aplicar un extracto vegetal sobre frutos de papaya éste afectó considerablemente la firmeza; sin embargo, cuando se incorporó el extracto en un recubrimiento a base de quitosán, no se encontraron diferencias significativas entre los frutos tratados con quitosán y los revestidos con el quitosán y el extracto vegetal.
Sólidos solubles, acidez y pH. El contenido de solidos solubles (CSS) en el control y el tratamiento, se incrementó gradualmente durante los seis primeros días de evaluación (Tabla 2), posiblemente como resultado de la degradación del almidón en mono y disacáridos y al aumento en la solubilidad de la pectina, debido a la acción de las enzimas hidrolíticas durante la maduración (Corrêa et al., 2008). La ATT alcanzó un máximo de 0,09 y 0,10% para el tratamiento (día 9) y el control (día 3) respectivamente (Tabla 2). Los valores de acidez de los frutos obtenidos fueron similares a los mencionados por Alonso, et al. (2008), quienes caracterizaron cuatro cultivares de papaya, obteniendo valores de acidez entre 0,04 y 0,16%. Los frutos control presentaron un incremento de la acidez hasta el día 3; posteriormente, la ATT disminuyó y a partir del sexto día permaneció constante. Por su parte, los frutos del tratamiento no presentaron cambios significativos en el porcentaje de acidez durante el almacenamiento, lo cual puede estar relacionado con la capacidad del recubrimiento de retardar la senescencia de los frutos. En estudios similares se ha encontrado que la ATT, en frutos de fresa, durazno, tomate y litchi recubiertos con quitosán, disminuyó con el tiempo de almacenamiento aunque a una velocidad menor que los frutos sin recubrimiento (Han et al., 2004).
Los cambios en el pH son un indicativo del grado de acidez de los frutos; se observó una relación inversa entre estos parámetros (Tabla 2). La ATT y el pH en la papaya, tanto para el control como para el tratamiento, confirman el bajo contenido de acidez para este fruto. De acuerdo con los análisis estadísticos, los cambios en CSS, ATT y pH no presentan una diferencia significativa entre los recubrimientos (P>0,05); esto indica que la incorporación del EEP al 5% en la formulación del recubrimiento, no afecta los parámetros fisicoquímicos relacionados con los procesos de maduración de los frutos.
Índice de deterioro (ID). Los principales daños que se observaron durante el estudio tanto para el control como para el tratamiento, fueron ocasionados por deshidratación y pudrición negra en el pedúnculo, formación de moho y lesiones superficiales características de la antracnosis, y posibles efectos causados por Botryodiplodia. En laFigura 4, se presentan los frutos enteros y un corte longitudinal, en donde se aprecia que la incidencia de los daños fue más severa en el control que en el tratamiento, para un mismo periodo de almacenamiento (día 12). En particular, se observaron diferencias en el color y textura de la pulpa, en la intensidad de la pudrición negra del pedúnculo y en las lesiones de la piel del fruto.
Adicionalmente, en la Figura 5 se muestran los resultados obtenidos para el ID, calculado para el control y el tratamiento. El ID incrementó con el periodo de almacenamiento; sin embargo, los frutos control presentaron una mayor pudrición que aquellos tratados con el recubrimiento formulado con propóleos. Durante los tres primeros días, los frutos tratados, presentaron un índice de deterioro igual a 1, lo que quiere decir que en las papayas recubiertas con el EEP hubo menor incidencia de daños, en comparación con el control. Además hasta el día 7, los frutos tratamiento presentaron un ID inferior al control; no obstante, a partir del día 8 se observó un incremento de casi el (50%). Este hecho está en concordancia con el efecto fungistático observado para el EEP durante la evaluación in vitro contra el hongo C. gloeosporioides., en donde la capacidad de inhibición del crecimiento microbiano disminuyó del 57% al 23% en el transcurso del tiempo.
Conteo de mesófilos, mohos y levaduras. En la Tabla 3 se presentan los conteos de microorganismos mesófilos aerobios, levaduras y mohos en la superficie de los frutos control y tratados con propóleos, observados durante el periodo de almacenamiento.
El recuento de AC para los frutos tratados con EEP presentó la mayor reducción logarítmica de los microorganismos entre los días 3 y 7, mostrando diferencias significativas con respecto al control (P<0,05) para el día 7. Posteriormente, se evidenció un incremento en el número de microorganismos aerobios para el día 12, presentándose diferencias significativas entre el control y el tratamiento. Para el recuento de mohos y levaduras en los frutos control se presentó, entre los días 3 y 12, un incremento en el valor del log UFC/g del 100 y 54% respectivamente. Un comportamiento diferente se observó en los frutos tratados con EEP, presentándose una reducción significativa respecto al control en el conteo de mohos y levaduras entre los días 3 y 7. Este hecho evidencia el efecto fungistático del EEP y concuerda con los resultados obtenidos en la evaluación antifungica in vitro y con los del ID, donde la incidencia de daño fue menor para los frutos de papaya tratados con el recubrimiento formulado con propóleos. Sin embargo, para el día 12 no se registraron diferencias entre el control y el tratamiento. Posiblemente, después del día siete, los frutos han alcanzado su maduración y el efecto del EEP disminuye (Tabla 1), de tal modo que los frutos están más expuestos al ataque de hongos y levaduras que causan estrés y daños en los tejidos, acelerando su acción y llevando a cambios inaceptables en sabor, color y textura. Estos cambios conducen al deterioro de los frutos y disminuyen su vida útil.
De acuerdo con los resultados obtenidos, la incorporación de un extracto etanólico de propóleos en un recubrimiento para poscosecha de frutas puede ser considerada una buena alternativa para prevenir el deterioro microbiológico de los frutos, ya que este inhibió el desarrollo de microorganismos en frutos de papaya, durante los primeros siete días de almacenamiento a 28 ± 2 ºC y HR entre el 65 y 70%. Estos resultados concuerdan con lo encontrado por Quiroga et al., (2006) quienes consideraron que los propóleos son una alternativa como principio activo para la inclusión en productos agroquímicos sin causar daños al agroecosistema; no obstante, se hace indispensable evaluar en una fase posterior el efecto de la formulación de la emulsión, la concentración del EEP y la temperatura de almacenamiento sobre la maduración y la calidad microbiológica y sensorial de la papaya.
CONCLUSIONES
La adición de un extracto de propóleos en la formulación de recubrimientos es una alternativa promisoria para mejorar la seguridad microbiana de frutos de papaya, en poscosecha. El recubrimiento conteniendo el extracto etanólico del propóleos al 5% inhibió el crecimiento de microorganismos mesófilos aerobios, mohos y levaduras en los frutos durante los primeros 7 días de almacenamiento a 28 ± 2 ºC y entre 65 y 70% de HR. Además, disminuyó el índice de deterioro de los frutos, reflejado en una mejor calidad visual de los mismos con un proceso de maduración ligeramente tardío respecto al control.
AGRADECIMIENTOS
Los autores agradecen a la Dirección Nacional de Investigaciones de la Universidad Nacional de Colombia y al Ministerio de Agricultura y Desarrollo Rural (contrato 003-2008C3783-3453) por el apoyo en la ejecución de este trabajo.
BIBLIOGRAFÍA
Alonso, M., Y. Torret, M. Aranguren, R. Ramos, K. Rodríguez y M.C. Pastor. 2008. Caracterización de los frutos de cuatro cultivares de papaya del grupo SOLO, introducidos en Cuba. Agronomía Costarricense 32(2): 169-175.
Association of Official Analytical Chemist (AOAC). 2000. Official Methods of Analysis. 16th edition. Washington, DC.
Bautista, S., M. Hernández, E. Bosquez, and C. Wilson. 2003. Effects of chitosan and plant extracts on growth ofColletotrichum gloeosporioides, anthracnose levels and quality of papaya fruit. Crop Protection 22(9): 1087-1092.
Cia, P., S.P. Pascholati, E.A. Benato, E.C. Camili and C.A. Santos. 2007. Effects of gamma and UV-C irradiation on the postharvest control of papaya anthracnose. Postharvest Biology and Technology 43(3): 366-373.
De la Cruz, J., P. Ramírez y H. García. 2007. Estudio del efecto de la maduración acelerada y la refrigeración sobre la fisiología de la papaya Maradol (Carica papaya L.). pp. 199-206. En: Memorias. V Congreso Iberoamericano de Tecnología Postcosecha y Agroexportaciones. Instituto Tecnológico de Veracruz, México.
FAOSTAT. 2009. Datos estadísticos de cultivos, http://faostat.fao.org/site/567/default.aspx#ancor; consulta: marzo 2011.
Corrêa, S.F., M.S. de Souza, T. Pereira, G.V. de L. Alves, J.G. Oliveira, M.G. da Silva e H. Vargas. 2008. Determination of thermal diffusivity in papaya pulpas a function of maturation stage. Revista Brasileira de Fruticultura 30(3): 611-615.
Food and Agriculture Organization of the United Nations. (FAO),http://faostat.fao.org/site/567/DesktopDefault.aspx?PageID=567#ancor; consulta: marzo 2010.
Gamagae, S.U., D. Sivakumar, R.S. Wilson Wijeratnam and R.L. Wijesundera. 2003. Use of sodium bicarbonate andCandida oleophila to control anthracnose in papaya during storage. Crop Protection 22(5):775-779.
González, G.A., J.G. Buta and C.Y. Wang. 2003. Methyl jasmonate and modified atmosphere packaging (MAP) reduce decay and maintain postharvest quality of papaya. 'Sunrise'. Postharvest Biology and Technology 28(3): 361-370.
Grover, R.K. and J.D. Moore. 1962. Toxicometric studies of fungicides against brown rot organisms Sclerotinia fructicola and S. laxa. Phytopathology 52(1): 876-880.
Han, C., Y. Zhao, S.W. Leonard and M.G. Traber. 2004. Edible coating to improve storability and enhance nutritional value of fresh and frozen strawberries (Fragaria ananassa) and respberries (Rubus idaeus). Postharvest Biology and Technology 33(1): 67-78.
Manenoi, A., E.R. Bayogan, S. Thumdee and R.E. Paull. 2007. Utility of 1-methylcyclopropene as a papaya postharvest treatment. Postharvest Biology and Technology 44(1): 55-62.
Martínez, J. 2009. Caracterización físico-química y evaluación de la actividad antifúngica de propóleos recolectados en el suroeste antioqueño. Tesis Magíster en Ciencia y Tecnología de Alimentos. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia, Medellín. 81 p.
Meneses, E., D. Durango and M. Garcia. 2009. Antifungal activity against postharvest fungi by extracts from Colombian propolis. Quimica Nova, 32(8): 2011-2017.
Palomino, L., C. García, J. Gil, B. Rojano y D. Durango. 2009. Determinación del contenido de fenoles y evaluación de la actividad antioxidante de propóleos recolectados en el departamento de Antioquia (Colombia). Vitae 16(3): 388-395.
Paull, R., W. Nishijama, M. Reyes and C. Cavaletto. 1997. Postharvest handling and losses during marketing of papaya (Carica papaya L.). Postharvest Biology and Technology 11(3): 165-179.
Pereira, T., P.S. Gomes de Almeida, I. Gonc, A. Azevedo, M. Cunha, J. Gonc, A. Oliveira, M. Gomes da Silva and H. Vargas. 2009. Gas diffusion in 'Golden' papaya fruit at different maturity stages. Postharvest Biology and Technology 54(1): 123 -130.
Pérez, M., C. Rojas and M.A. del Rio. 2002. Effect of lipid type and amount of edible hidroxypropyl methylcellulose - lipid composited coating used to protect postharvest quality of mandarins cv. Fortune. Journal of Food Science 67(8): 2903-2910.
Quiroga, E.N., D.A. Sampietro, J.R. Sobarón, M.A. Sgariglia and M.A. Vattuone. 2006. Propolis from the northwest of Argentina as a source of antifungal principles. Journal of Applied Microbiology 11(1): 103-110.
Rueda, M.S. 1999. Manejo post-cosecha y comercialización de la papaya. Programa Nacional de Capacitación en Manejo Post-Cosecha y Comercialización de Frutas y Hortalizas, Convenio SENA - Reino Unido: (Serie de paquetes de capacitación sobre manejo post-cosecha de frutas y hortalizas) Centro Agroindustrial del SENA. Primera edición. Armenia, Quindío, Colombia. 198 p.
Santamaría, F., P.R. Díaz, D.E. Sauri, F. Espadas, J.M. Gil and S. Larqué. 2009. Quality characteristics in Maradol papaya fruits at the comsumption ripeness stage. Agricultura Técnica en México 35(3): 347-353.
Santos, F.A., E.M. Bastos, A.B. Maia, M. Uzeda, M.A. Carvalho, L.M. Farias and E.S. Moreira. 2003. Brazilian propolis: physicochemical properties, planta origin and antibacterial activity on periodontopathogens. Pytotherapy Research 17(3): 285-289.
Scazzocchio, F., F.D. D'Auria, D. Alessandrini and F. Pantanella. 2006. Multifactorial aspects of antimicrobial activity of propolis. Microbiological Research 161(4): 327-333.
Tripathi, P. and N.K. Dubey. 2003. Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables. Postharvest Biology and Technology. 32(3): 235-245.