ACTUALIZACIÓN
Análogos de insulina: relevancia clínica y perspectivas futuras
Insulin analogues: clinical relevance and future perspectives
Jhon Jairo Bejarano-Roncancio1, Johan Carlos Almarza-Labarca2, Angélica Lucía Veloza-Naranjos3
1 Nutricionista Dietista. Especialista en Gerencia de Servicios de
Salud. Especialista en Multimedia para la docencia. Magíster
en Educación. Doctorando en Nutrición. Profesor Asociado.
Departamento de Nutrición Humana. Facultad de Medicina.
Universidad Nacional de Colombia. Sede Bogotá.
2 Nutricionista Dietista. Magister en Metabolismo Humano.
Universidad del Zulia. Maracaibo, Venezuela.
3 Nutricionista Dietista. Magíster en Ciencias Biológicas.
Nutricionista Unidad de Endocrinología Hospital Universitario
San Ignacio. Bogotá.
Correspondencia: jjbejaranor@unal.edu.co
Recibido: 1/09/2012 / Enviado a pares: 17/09/2012 / Aprobado: 12/12/2012
Resumen
Desde la década de los noventa han sido diseñados análogos de insulina para el manejo de pacientes diabéticos usando técnicas de ADN recombinante. Las modificaciones de la molécula original de insulina humana les confieren una rápida, ultrarrápida y prolongada acción. Entre las insulinas ultra rápidas están la Aspártica, la Lispro y la Glulisina y entre las de acción prolongada están la Glargina y la Detemir. También se encuentran mezcladas con insulina humana NPH en diferentes proporciones. Aunque existen diferentes tipos de algoritmos terapéuticos, la insulinización sigue siendo una terapia artesanal basada en la experiencia del especialista tratante. La introducción de los análogos de insulina hace más factible el empleo de bolos correctores o dosis extra de insulina para reducir las hipoglicemias puntuales en cualquier momento del día y facilitar el manejo de los carbohidratos en la dieta.
Palabras clave. insulina, farmacocinética, diabetes mellitus, hipoglucemiantes, células secretoras de insulina, (DeCS).
Summary
Insulin analogues have been engineered through recombinant DNA techniques for managing diabetic patients since the 1990s; modifications to the original human insulin molecule have made them rapid, ultra-rapid and prolonged acting. Aspart, lispro and glulisine are ultrafast insulins and glargine and detemir are longacting ones. Such insulins may be premixed in formulations combining neutral protamine Hagedorn (NPH) with regular human insulin (70%/30%). Different types of therapeutic algorithms are available nowadays but insulinisation remains a crafted therapy based on the treating specialist's experience. The introduction of insulin analogues enables using correction boluses or extra doses of insulin to reduce hypoglycaemia at any time of the day and facilitates handling carbohydrates in a particular patient's diet.
Key words. insulin,pharmacokinetics, diabetes mellitus, hypoglycemic, insulin-secreting cells, (MeSH).
Introducción
En el mundo hay más de 346 millones de personas con diabetes. Se calcula que en el año 2004 fallecieron 3,4 millones pacientes como consecuencia de esta enfermedad. Más del 80% de las muertes por diabetes se registran en países de ingresos bajos y medios. Casi la mitad de esas muertes corresponden a personas de menos de 70 años y un 55% son mujeres. La OMS prevé que las muertes por diabetes se multipliquen por dos entre 2005 y 2030 (1).
Una parte fundamental del tratamiento de la diabetes es la insulinoterapia. La presente revisión documental describe el fundamento de la farmacocinética, la farmacodinamia de los análogos de la insulina y su relevancia en el manejo de la diabetes en pacientes insulinodependientes, entre ellos se mencionan los análogos de acción ultrarrápida que tienen una eficacia fisiológica de acuerdo al manejo dietético estricto de los carbohidratos consumidos durante el día y las insulinas de acción prolongada que pueden facilitar la terapéutica del paciente, posterior a las comidas y entre ellas, así como en momentos de ayuno nocturno, permitiendo una regulación glicémica y una mejor respuesta metabólica. Así mismo, se presentan algunos avances en la formulación y desarrollo de diferentes tipos de insulina que a partir de modificaciones moleculares y bioquímicas, podrían ofrecer una alternativa más sencilla para el manejo insulínico y dietario del paciente diabético.
Análogos de insulinas utilizados en la práctica clínica.
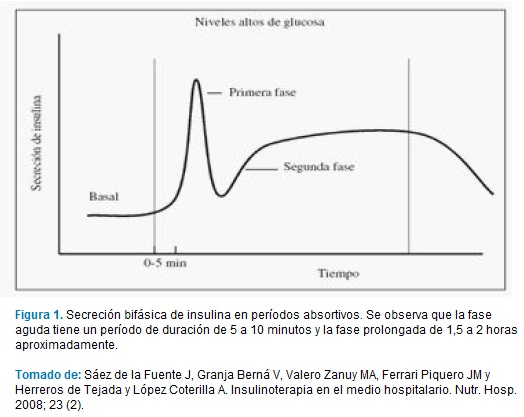
El fundamento del diseño de análogos de la insulina se basa en "imitar" fisiológicamente la secreción oscilatoria de insulina de las células beta del páncreas. En estados basales la insulina se secreta de forma pulsátil en oscilaciones rápidas de 8 a 15 minutos (2-6). En períodos absortivos la secreción de insulina es bifásica. Una fase aguda, que es representada por los gránulos presentes en el citoplasma de las células beta con una duración de 5 a 10 minutos y una fase prolongada la cual es dependiente básicamente de factores hormonales y su duración es de dos horas aproximadamente (Fgura 1). Para solucionar medianamente esta problemática, han surgido nuevos análogos por técnicas de ADN recombinante con mayor eficiencia clínica, mediante sustitución, adición, inversión de aminoácidos o adición de ácidos grasos en su estructura química (Figura 2).
1. Insulinas de acción ultra rápida
Las insulinas de acción ultra rápida son construidas por la modificación de la estructura de la insulina humana, favoreciendo una rápida disociación y formación de monómeros de insulinas estables, debido a esto su absorción es rápida (Ver figura 3) (4). Tres tipos de insulinas están actualmente en el mercado: Lispro, Aspártica y Glulisina. La insulina Lispro fue la primera insulina de acción ultra rápida introducida en el mercado en 1996. Es producida por la inversión de las posiciones 28-29 (prolina y lisina respectivamente) de la cadena B de la insulina. En el mercado se encuentra en forma de Humalog.
La insulina aspártica es producida por el reemplazo de la prolina de la posición 28 por ácido aspártico en la cadena B (figura 2). La insulina aspártica se encuentra en el mercado en forma de Novorapid e incluida en soluciones premezcladas con protamina (Novomix 30). La Glulisina es sintetizada por el reemplazo de la asparagina en la posición 3, por lisina; y la lisina de la posición 29 por ácido glutámico de la cadena B. En el mercado se encuentra en forma de Apidra (4,7,8-13).
La acción rápida de estos análogos insulínicos trata de simular la fase aguda de secreción pancreática. Tienen un pico máximo de acción de 30 a 90 minutos con un inicio de acción a los 15 minutos y una vida media de 4 a 6 horas (figura 3, tabla 1). En niños menores y pacientes geriátricos, cuyas necesidades nutricionales y comportamiento metabólico es relativo, con una ingesta dietética variable es conveniente el uso de este tipo de insulinas antes de cada comida o inmediatamente después (11-12).
2. Insulinas lentas o de acción prolongada
La insulina Glargina y Detemir están disponibles en la actualidad. La Glargina es producida por tres modificaciones aminoacídicas en la cadena B de la molécula de insulina. La modificación de la estructura primaria de la cadena B conduce a la formación de tetrámeros por interacciones electrostáticas con el átomo de zinc haciéndolas más estables en forma polimérica, por tal motivo, la liberación de los monómeros es más prolongada (4-7, 10-11). La Glargina y el Detemir tienen una vida media de 24 horas y 20 horas, respectivamente, después de la administración de 0,4 IU/kg. Por tal motivo este tipo de insulinas se administran una o dos veces al día para compensar los ritmos pulsátiles en estados interprandiales y ayuno nocturno (Figura 3 y 4) (12).
3. Insulinas premezcladas
Las insulinas premezcladas son la combinación de una insulina basal o de acción intermedia con un análogo ultra-rápido. Sirven para imitar esquemas convencionales o intensivos de insulina con dos a tres inyecciones diarias según criterio médico. Entre las soluciones premezcladas que se encuentran en el mercado están HumalogMix 25 y Mix 50, las cuales contienen en solución Lispro más Lisproprotaminizada. Esta última tiene un perfil de acción similar al de la NPH.También se encuentra Novo mix 30/70, 50/50 0 70/30. La cual es una mezcla de insulina Aspartato soluble con aspartato cristalizada protaminizada.
Se ha evidenciado mejoría en el control glucémico al comparar las mezclas de insulina con las insulinas basales. Esto se asocia con una durabilidad adecuada de las insulinas en mezcla (55).
4. Eficacia clínica de los análogos de insulina
En diabéticos mellitus tipo 1 el rol de la insulina Lispro en el mejoramiento de la glicemia postprandial ha sido evaluado en diversos estudios, en comparación a la insulina regular humana. Estos resultados demuestran que las glicemias postprandiales fueron menores con la administración de Lispro, en períodos superiores de un año (14-15).
En diabéticos tipo 2, se ha estudiado el efecto de la inyección de análogos combinados Lispro/Glargina en comparación a la mezcla insulina regular/NPH, demostrando que la combinación de los análogos disminuye los niveles de glucosa postprandial con dosis significativamente bajas y disminuye de forma importante los episodios de hipoglicemias. Estudios realizados con insulinas Aspart y Glulisina mostraron resultados similares en la glucosa postprandial con disminución de los episodios hipoglicémicos nocturnos (16-24).
En el caso de las insulinas de acción prolongada, en diabéticos tipo 1 se ha demostrado la eficacia clínica de la Glargina en comparación con la NPH, presentándose menos episodios de hipoglicemias. Cuando la Glargina se administra en bolo, se demuestra un control glicémico efectivo. Por otro lado, la administración de dos dosis diarias de Detemir, demostró un buen control glicémico, reduce el riesgo de hipoglicemia nocturna y poca ganancia de peso en comparación con regímenes de NPH (25-26). Detemir demuestra poca variabilidad en la glucosa plasmática en comparación con el NPH o Glargina, lo que sugiere que el Detemir puede usarse como terapia en diabéticos tipo 1 (27).
En un estudio aleatorizado reciente de 26 semanas en diabéticos tipo 1, que recibían Gliargina o Detemir, una y dos veces al día respectivamente, en combinación con insulina Aspart, se encontró un buen control glicémico en ambos grupos sin diferencias en los eventos hipoglicémicos (28). En diabéticos tipo 2 la Glargina administrada una vez al día demuestra control glicémico con cambios leves en el peso. En comparación con la Rosiglitazona, tiene una mayor eficacia clínica, encontrándose disminución de la hemoglobina glucosilada, pasando de > 9,5% a concentraciones plasmáticas menores de 7% (29-33).
Se ha demostrado mejoría de la glucosa basal con la administración de Detemir en comparación al grupo de NPH (34). En el LevemirTreattoStudy se ensayó la adición de insulinas de acción prolongada a la terapia de hipoglicemiantes orales, observándose mejoría de los niveles de HbA1c. En diabéticos tipo 1 se ha demostrado una eficiencia tanto de la Glargina y el Detemir en los niveles de HbA1c, y resultados similares fueron encontrados en diabéticos tipo 2 que recibían terapia con hipoglicemiantes orales a las que se les adiciona Glargina (35-36). En la tabla 1 se resume el perfil farmacocinético de los análogos de insulina usados en la práctica clínica.
5. Insulinas en fase de investigación
Debido a la prevalencia mundial de la diabetes y en especial por el manejo terapéutico de la tipo 1 y la fase de insulinodependencia de la tipo 2, la industria farmacéutica ha realizado estudios y avances en el desarrollo de insulinas con mejor respuesta metabólica y que se adapten a las necesidades de los pacientes; estas se pueden clasificar en dos grupos, los que presentan modificaciones covalentes como las aciladas con ácidos grasos, pegiladas, proformas de insulinas y análogos hepatoselectivos; y los que involucran cambios en la unión hormona-receptor como la insulina arg N terminal, los complejos con derivados de vanadio y el SCI-57. Cada una de estas con unas características bioquímicas específicas.
5.1. Análogos con modificaciones covalentes
5.2. Análogos que involucran cambios en la unión hormonareceptor
En general, la farmacocinética y farmacodinamia de los análogos de insulina en desarrollo ofrece una ventana clínica positiva para el manejo del paciente diabético. Los objetivos de estos análogos son simular la acción fisiológica endocrina del páncreas y controlar las funciones glucocontroladoras hepáticas. De esta forma la dietoterapia basada en contaje de carbohidratos sería más fácil de ajustar de acuerdo al análogo que se esté administrando ya que se contaría con una garantía absoluta de una acción eficiente y controlada del análogo de insulina.
5.3. Insulina de próxima utilización: Degludec
La insulina Degludec es una insulina basal de acción prolongada, se encuentra en estudios fase 3 y ya ha sido aprobada en Europa y Japón. Es idéntica a la insulina humana excepto por la deleción del último aminoácido de la cadena B y la adición de un ácido glutámico unido desde la LysB29 al ácido graso hexadecaenoico. Esta característica le permite formar un multihexámero en el sitio de inyección desde el cual los monómeros lentamente se separan y son absorbidos.
Esta propiedad le confiere una duración de más de 40 horas y reduce la variabilidad en las concentraciones plasmáticas de insulina comparada con las insulinas basales de dosis diaria (52). La duración de la acción, la eficacia glucémica y la seguridad de esta insulina Degludeces similar a la de la insulina Glargina tal como lo demostró un estudio que comparó ambas insulinas en 629 pacientes adultos con diabetes tipo 1 y no se encontró mayores diferencias (53). Es importante destacar que al comparar glargina y degludec hubo una reducción de los eventos de hipoglucemia usando la segunda (4,4 vs 5,9 episodios por paciente al año de exposición) (54).
Conclusión
Las complicaciones agudas relacionadas con la farmacocinética y farmacodinamia inestable de las insulinas cristalinas y NPH han motivado el diseño de análogos cuyo perfil farmacológico es el más adecuado para el sistema. El diseño de análogos de insulina hasta la fecha está en constante investigación y desarrollo con el fin de obtener un control metabólico óptimo en pacientes diabéticos. Sin embargo, las oscilaciones fisiológicas de la insulina siguen siendo un reto para los bioquímicos, encargados del área de diseño de análogos.
La terapia más aceptada en la diabetes mellitus tipo 1 es la combinación de insulinas de acción ultra rápida con una de acción prolongada para simular las dos fases de secreción de insulina en sujetos sanos. En pacientes diabéticos tipo 2, el uso de las insulinas de acción prolongada permite un estricto control metabólico, en etapas donde la masa de células betas pancreáticas es escasa, además, siendo útiles para la prevención de episodios de hipoglicemias nocturnas en diabéticos tipo 1 y 2.
Conflicto de intereses
Los autores declaran no tener conflicto de interés.
Referencias
1. World Health Organization. Diabetes. Fact sheet No312. [Internet]. Géneva: World Health Organization; 2011. Disponible en: http://www.who.int/mediacentre/factsheets/fs312/en/index.html [Consultado el día 8 de agosto de 2012].
2. Alberti G. Lecciones de la historia de la Insulina. Diabetes Voice.2001; 46:33-34.
3. Rosenfeld L. Insulin: discovery and controversy. Clin Chem. 2002;48:2270-88.
4. Crasto W, Jarvis J, Khunti K, Davies M. New insulins and new insulin regimens: a review of their role in improving glycemic control in patients with diabetes. Postgrad Med J. 2009; 85:257-67.
5. Oiknine R, Bernbaum M, Mooradian A. A Critical Appraisal of the Role of Insulin Analogues in the Management of Diabetes Mellitus. Drugs 2005; 65:325-40.
6. Bryrne M. Secreción de insulina en el ser Humano. Diabetes mellitus Fundamentos y Clínica segunda edición 2005; Editorial Mc Graw Hill: 131-143.
7. Hirsch I. Insulin Analogues. N Engl J Med. 2005; 352:174-83.
8. Burge M, Schade David S. Insulins. Endocrinology And Metabolism Clinics Of North America 1997; 26:575-98.
9. Starke A, Heinemann L, Hohmann A. The action profiles of human NPH insulin preparations. Diabet Med. 1989; 6:239-44.
10. Ahmad B. Pharmacology of insulin. British Journal of Diabetes & Vascular Disease. 2004; 4:10-11.
11. Guerci B, Sauvanet J. Subcutaneous insulin: pharmacokinetic variability and glycemic variability. Diabetes Metab. 2005; 31:4S7-4S24.
12. De Leeuw I, Vague P, Selam J. Insulin determine used in basal bolus therapy in people with type 1 diabetes is associated with a lower risk of nocturnal hypoglycemia and less weight gain over 12 months in comparison to NPH insulin. Diabetes ObesMetab. 2005; 7:73-82.
13. Rutledge K, Chase H, Klingensmith G. Effectiveness of postprandial Humalog in toddlers with diabetes. Pediatrics. 1997; 100:968-72.
14. Danne T, Aman J, Schober E. A comparison of postprandial and preprandial administration of insulin aspart in children and adolescents with type 1 diabetes. Diabetes Care. 2003; 26:2359-84.
15. Vignati L, Anderson J, Iversen P. Efficacy of insulin lispro in combination with NPH human insulin twice per day in patients with insulin-dependent or non-insulindependent diabetes mellitus. Multicenter Insulin Lispro Study Group. Clin Ther. 1997; 19:1408-21.
16. Davey P, Grainger D, MacMillan J. Clinical outcomes with insulin lispro compared with human regular insulin: a metaanalysis. Clin Ther. 1997; 19:656-74.
17. Murphy N, Keane S, Ong K. Randomized cross-over trial of insulin glargine plus lispro or NPH insulin plus regular human insulin in adolescents with type 1 diabetes on intensive insulin regimens. Diabetes Care. 2003; 26:799-804.
18. Home P, Lindholm A, Riis A. Insulin aspart vs. human insulin in the management of long-term blood glucose control in type 1 diabetes mellitus: a randomized controlled trial. Diabet Med. 2000; 17:762-70.
19. Danne T, Becker Heise. Pharmacokinetics, prandial glucose control, and safety of insulin glulisine in children and adolescents with type 1 diabetes. Diabetes Care. 2005; 28:2100-15.
20. Plank J, Siebenhofer A, Berghold A. Systematic review and meta-analysis of short-acting insulin analogues in patients with diabetes mellitus [abstract]. Arch Intern Med. 2005; 165:1337-44.
21. Brunelle R, Llewelyn J, Anderson J. Meta-analysis of the effect of insulin lispro on severe hypoglycemia in patients with type 1 diabetes. Diabetes Care. 1998; 21:1726-31.
22. Dreyer M, Prager R, Robinson A. Efficacy and safety of insulin glulisine in patients with type 1 diabetes. HormMetab Res. 2005; 37:702-7.
23. Rave K, Klein O, Frick A. Advantage of premeal-injected insulin glulisine compared with regular human insulin in subjects with type 1 diabetes. Diabetes Care. 2006; 29:1812-17.
24. Garg S, Gottlieb P, Hisatomi M. Improved glycemic control without an increase in severe hypoglycemic episodes in intensively treated patients with type 1 diabetes receiving morning, evening, or split dose insulin glargine. Diabetes Res Clin Pract. 2004; 66:49-56.
25. Pieber TR, Draeger E, Kristensen A. Comparison of three multiple injection regimens for Type 1 diabetes: morning plus dinner or bedtime administration of insulin detemir vs. morning plus bedtime NPH insulin. Diabet Med. 2005; 22:850-7.
26. Plank J, Bodenlenz M, Sinner F. A double-blind, randomized, dose-response study investigating the pharmacodynamic and pharmacokinetic properties of the longacting insulin analog detemir. Diabetes Care. 2008; 28:1107-12.
27. Heise T, Nosek L, Ronn B. Lower within-subject variability of insulin detemir in comparison to NPH insulin and insulin glargine in people with type 1 diabetes. Diabetes. 2004; 53:1614-20.
28. Pieber T, Treichel H, Hompesch B. Comparison of insulin detemir and insulin glargine in subjects with Type1 diabetes using intensive insulin therapy. Diabet Med. 2007; 24:635-42.
29. Davies M, Storms F, Shutler S. Improvement of glycemic control in subjects with poorly controlled type 2 diabetes: comparison of two treatment algorithms using insulin glargine. Diabetes Care. 2005; 28:1282-8.
30. Rosenstock J, Sugimoto D, Strange P. Triple therapy in type 2 diabetes: insulin glargine or rosiglitazone added to combination therapy of sulfonylurea plus metformin in insulin-naive patients. Diabetes Care. 2006; 29:554-9.
31. Massi-Benedetti M, Humburg E, Dressler A. A one-year, randomised, multicentre trial comparing insulin glargine with NPH insulin in combination with oral agents in patients with type 2 diabetes. Horm Metab Res. 2006; 35:189-96.
32. Haak T, Tiengo A, Draeger E. Lower within-subject variability of fasting blood glucose and reduced weight gain with insulin detemir compared to NPH insulin in patients with type 2 diabetes. Diabetes Obes Metab. 2003; 7:56-64.
33. Hermansen K, Davies M, DerezinskiT.A 26-week, randomized, parallel, treatto- target trial comparing insulin detemir with NPH insulin as add-on therapy to oral glucose-lowering drugs in insulin-naive people with type 2 diabetes. Diabetes Care. 2006; 29:1269-74.
34. Hermansen K, Fontaine P, Kukolja K. Insulin analogues (insulin detemir and insulin aspart) versus traditional human insulins (NPH insulin and regular human insulin) in basal-bolus therapy for patients with type 1 diabetes. Diabetologia. 2004; 47:622-9.
35. Mullins P, Sharplin P, Yki-Jarvinen H. Negative binomial meta-regression analysis combined glycosylated haemoglobin and hypoglycaemia outcomes acrosseleven Phase III and IV studies of insulin glargine compared with neutral protamine Hagedorn insulin in type 1 and type 2 diabetes mellitus. Clin Ther. 2007; 356:437-40.
36. Mike A. Baxter. The role of new basal insulin analogues in the initiation and optimization of insulin therapy in type 2 diabetes. Acta Diabetol. 2008; 45:253-268.
37. Jiménez E, López P, Ochoa S. Algoritmos terapéuticos de la insulinoterapia en la diabetes mellitus. Sociedad Española de Diabetes 2007; primera edición: 455-472. Editorial Médica Panamericana.
38. American Diabetes Association. Standards of Medical Care in Diabetes. Diabetes Care.2009; 17:1514-1522.
39. De Luis D, Romero E. Análogos de insulina: modificaciones en la estructura, consecuencias moleculares y metabólicas. SEMERGEN - Medicina de Familia; artículo en prensa, https://doi.org/10.1016/j.semerg.2012.04.010.
40. Borgoño C, Zinman B. Insulins: Past, Present, and Future. Endo & Met Clin of N A. 2012; 41:1-24.
41. Uchio T. Site-specific insulin conjugates with enhanced stability and extended action profile. Adv Drug Delivery Rev. 1999; 35:289-306.
42. Hinds, K. Synthesis and characterization of poly(ethylene glycol)-insulin conjugates. Bioconjugate Chem. 2000; 2:195-201.
43. Hinds K. Effects of PEG conjugation on insulin properties. Adv Drug Delivery Rev. 2002; 4:505-30.
44. Gershonov E, Shechter Y. New concept for long-acting insulin: spontaneous conversion of an inactive modified insulin to the active hormone in circulation: 9-fluorenylmethoxycarbonyl derivative of insulin. Diabetes. 1999 48;7:1437-42.
45. Gershonov, E., Goldwaser, I., Fridkin, M., Shechter, Y. A novel approach for a water-soluble long-acting insulin prodrug: design, preparation, and analysis of [(2-sulfo)-9-fluorenylmethoxycarbonyl]( 3)-insulin. J Med Chem. 2000;13:2530-37.
46. Shojaee-Moradie F. Novel hepatoselective insulin analogues: studies with covalently linked thyroxyl-insulin complexes. Diabetic Med. 2002;11:928-36.
47. Shojaee-Moradie F, Eckey H. Novel hepatoselective insulin analogues: studies with covalently linked thyroxyl-insulin complexes. Diabetic Med. 1998; 15:928-36.
48. Shojaee-Moradie F, Powrie, J, Sundermann E. Novel hepatoselective insulin analog: studies with a covalently linked thyroxyl-insulin complex in humans. Diabetes Care. 2000; 23:1124-29.
49. Sreekanth R, Pattabhi V, Rajan S. Structural interpretation of reduced insulin activity as seen in the crystal structure of human Arg-insulin. Biochimie. 2008; 90:467-73.
50. Yamaguchi M, Wakasugi K, Saito R, Adachi Y, Yoshikawa Y, Sakurai H, Katoh A. Syntheses of vanadyl and zinc(II) complexes of 1-hydroxy-4,5,6-substituted 2(1H)-pyrimidinones and their insulin-mimetic activities. Journal of Inorganic Biochemistry. 2006; 100:260-69.
51. Qing-xinHua. Design of an Active Ultrastable Single-chain Insulin Analog synthesis, structure, and therapeutic implications. The Journal of Biological Chemistry. 2008; 283: 14703-716.
52. Jonassen I, Havelund S, Hoeg-Jensen T, Steensgaard DB, Wahlund PO, RibelU. Design of the novel protraction mechanism of insulin degludec, an ultra-long-acting basal insulin. Pharm Res. 2012;29:2104.
53. Heller S, Buse J, Fisher M, Garg S, Marre M, Merker L, Renard E, Russell-Jones D, Philotheou A, Francisco AM, Pei H, Bode B. Insulin degludec, an ultra-long acting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 1 diabetes (BEGIN Basal-Bolus Type 1): a phase 3, randomised, open-label, treat-to-target non-inferiority trial. BEGIN Basal-Bolus Type 1 Trial Investigators. Lancet. 2012;379:1489-97.
54. Torjesen I.FDA raises concerns about ultra-long acting insulins given green light in Europe and Japan. BMJ. 2012;345:e7323.
55. Buse J, Wolffenbuttel B, Herman W, Sthephen H. The Durability of basal vslispromix 75/25 insulin efficacy (DURABLE) trial. Diabetes Care.2011;4:249-55.