VITAMINA D : una estrategia profiláctica en tiempos del SARS-CoV-2. Vitamina D, SARS-CoV-2 y odontología
VITAMIN D: A prophylactic strategy in times of SARS-CoV-2.
DOI:
https://doi.org/10.15446/aoc.v10n3.87991Palabras clave:
Vitamina D, Infección por Coronavirus, COVID-19, Personal de Odontología, Prevención Primaria (es)Vitamint D, Coronavirus Infecctions, COVID-19, Dentistry Staff, Primary Prevention. (en)
Objetivo: ofrecer a todo el personal de salud oral un resumen narrativo de la literatura sobre la relación entre el uso de la vitamina D y la COVID-19, a través de la presentación de los beneficios de este suplemento. Se espera aportar a ampliar el conocimiento sobre esta sustancia orgánica, en tanto herramienta profiláctica para la salud de todos. Método: La búsqueda bibliográfica se realizó en las bases de datos PubMed, Cochrane, Science Direct y Ebsco, entre los años 2010 y 2020. Se seleccionaron 65 referencias bibliográficas relacionadas con la vitamina D, sus funciones intra y extra esqueléticas y su posible relación con el SARS-CoV-2; además, se incluyenon estudios que evalúan la deficiencia de vitamina D en el personal de salud. Resultados: la revisión narrativa efectuada demuestra que la deficiencia de vitamina D es frecuente en el personal de salud y que esta deficiencia reduce la actividad defensiva inmunológica. Además, se demuestra que existe suficiente evidencia de la relación entre niveles deficientes de vitamina D en plasma y el riesgo de desarrollar formas severas de COVID-19, especialmente en población susceptible. Conclusiones: se recomienda, tanto al personal de la salud como a los pacientes, el consumo de un suplemento de vitamina D como medida profiláctica.
Objective: to provide the clinicians and dental health staff with relevant information about the role of Vitamin D in connection with COVID-19, presenting the needs, benefits and risks of Vit D supplementation in the doses suggested in literature, to indicate preventive actions and provide patients advice to reduce the consequences of COVID-19. Method: The bibliographic search was carried out in the PubMed, Cochrane, Science Direct and Ebsco databases, between 2010 and 2020. We selected 65 references related to vitamin D and its intra and extra-skeletal functions, its possible relationship to SARS-CoV-2, and also included studies assessing vitamin D deficiency in health care workers. Results: Vitamin D deficiency is frequent in dental staff and this deficiency reduces the efficiency of immunologic defenses. There is evidence regarding a relationship between vitamin D levels and risk of severe forms of COVID-19. Conclusion: It is recommended the prophylactic use of a Vitamin D supplement for both dentists and dental patients.
Vitamina D: una estrategia profiláctica en tiempos del SARS-CoV-2. Vitamina D, SARS-CoV-2 y odontología
Vitamin D: A prophylactic strategy in times of SARS-CoV-2. Vitamin D, SARS- CoV-2 and Dentistry
Diego Fernando López, Valentina Ríos–Borrás, David Alejandro Rivera, Luis Rogelio Hernández, Marío Alejandro Ortíz
|
Recibido |
Aprobado |
Publicado |
|
03/07/2020 |
16/10/2020 |
30/10/2020 |
Citación sugerida:
López DF, Ríos–Borrás V, Rivera DA, Hernández LR, Ortíz MA. Vitamina D: una estrategia profiláctica en tiempos del SARS-CoV-2. Vitamina D, SARS-CoV-2 y odontología. Acta Odont Col. 2020; 10(Supl. COVID-19): -1. Disponible en: https://revistas.unal.edu.co/index.php/actaodontocol/article/view/87991
Resumen
Objetivo: ofrecer a todo el personal de salud oral un resumen narrativo de la literatura sobre la relación entre el uso de la vitamina D y la COVID-19, a través de la presentación de los beneficios de este suplemento. Se espera aportar a ampliar el conocimiento sobre esta sustancia orgánica, en tanto herramienta profiláctica para la salud de todos. Método: La búsqueda bibliográfica se realizó en las bases de datos PubMed, Cochrane, Science Direct y Ebsco, observando los años 2010 a 2020. Se seleccionaron 65 referencias bibliográficas relacionadas con la vitamina D, sus funciones intra y extra esqueléticas y su posible relación con el SARS-CoV-2; además, se incluyenon estudios que evalúan la deficiencia de vitamina D en el personal de salud. Resultados: la revisión narrativa efectuada demuestra que la deficiencia de vitamina D es frecuente en el personal de salud y que esta deficiencia reduce la actividad defensiva inmunológica. Además, se demuestra que existe suficiente evidencia de la relación entre niveles deficientes de vitamina D en plasma y el riesgo de desarrollar formas severas de COVID-19, especialmente en población susceptible. Conclusiones: se recomienda, tanto al personal de la salud como a los pacientes, el consumo de un suplemento de vitamina D como medida profiláctica.
Palabras clave: COVID-19; vitamina D; infecciones por Coronavirus; SARS-CoV-2; personal de odontología; prevención primaria.
Abstract
Objective: to provide the clinicians and dental health staff with relevant information about the role of Vitamin D in connection with COVID-19, presenting the needs, benefits and risks of Vit D supplementation in the doses suggested in literature, to indicate preventive actions and provide patients advice to reduce the consequences of COVID-19. Method: The bibliographic search was carried out in the PubMed, Cochrane, Science Direct and Ebsco databases, observing the years 2010 to 2020. We selected 65 references related to vitamin D and its intra and extra-skeletal functions, its possible relationship to SARS-CoV-2, and also included studies assessing vitamin D deficiency in health care workers. Results: Vitamin D deficiency is frequent in dental staff and this deficiency reduces the efficiency of immunologic defenses. There is evidence regarding a relationship between vitamin D levels and risk of severe forms of COVID-19. Conclusion: It is recommended the prophylactic use of a Vitamin D supplement for both dentists and dental patients.
Key words: COVID-19; Vitamin D; Coronavirus infections; SARS CoV-2; Dental Staff; Primary Prevention.
Introducción
La vitamina D (VitD), más que una vitamina lipofílica usual es una hormona esteroide que es sintetizada endógenamente en la piel por una reacción catalizada producto de la irradiación UV-B de la luz solar, seguida de otros pasos metabólicos en el hígado y otros tejidos, ver Figura 1 (1,2). El nombre de VitD en general se aplica a las formas activas D2 o D3. La forma activa y predominante en la sangre circulante es conocida como 25(OH)D y la hormona final activa es 1,25-(OH)2D. En el presente artículo se empleará el término para referirse a estas formas activas.
Además de sus conocidos efectos sobre el metabolismo óseo, en la literatura contemporánea se encuentran múltiples estudios encaminados a analizar el papel de la VitD en el sistema inmunológico (3,4-16). Adicionalmente, se ha investigado ampliamente la relación de la 1,25 dihidroxicolecalciferol (DHCC), con el sistema inmunológico, por lo que ahora se considera un micronutriente necesario para prevenir algunas enfermedades por su papel en la proliferación celular y la inmuno-modulación (3,4,17,18). Recientemente, la literatura relacionada con la pandemia ocasionada por el virus SARS-CoV-2 ha presentado una cantidad significativa de investigaciones sobre el rol de la VitD para reducir el riesgo y la severidad de la COVID-19.
Una revisión sistemática exhaustiva de la evidencia disponible realizada por Benskin L. (19) concluye que 141 artículos incluídos en su revisión presentan evidencia biológica plausible de que la VitD incrementa la resistencia a infecciones virales y ayuda a prevenir los síntomas de la forma severa de la infección. Otros 47 estudios demuestran que la deficiencia de VitD puede explicar las diferencias geográficas y estacionales y de riesgo por edad; otras correlaciones muestran que la mortalidad por la COVID-19 llega a ser predecible por los niveles de VitD (19). Al respecto, el estudio de D´Avolio et al. (20) provee la evidencia estadística más directa de una relación entre VitD y COVID-19. El autor sugiere que, en una cohorte de pacientes suizos se encontraron niveles de 25(OH)D significativamente más bajos (11.1 ng/mL) en aquellos con la prueba PCR + para SARS-CoV-2, que en quienes la prueba dio negativa (24.6 ng/mL). Esta diferencia es altamente significativa (p = 0.004) (20).
Según varios estudios, los trabajadores de la salud (21-26) están expuestos al riesgo de hipovitaminosis D debido, entre otros factores, a que la modalidad de su trabajo no les permite tener una exposición suficiente a la luz solar. Por ello, se hace necesario y es muy pertinente dar a conocer a los odontólogos los lineamientos que son convenientes para su protección y la de sus pacientes, especialmente durante el periodo de la pandemia y pos-pandemia.
Así, el objetivo general del presente artículo es ofrecer a todo el personal de salud oral un resumen narrativo de la literatura sobre VitD y COVID-19 y presentar los beneficios/riesgos de una suplementación de VitD en las cantidades sugeridas en la literatura consultada, para, con ello, prevenir las formas agresivas de la virosis. Un objetivo específico fue revisar estudios que determinaran si hay riesgo de hipovitaminosis D en el personal de salud y si la VitD puede tener algunos efectos benéficos en el campo de la odontología.
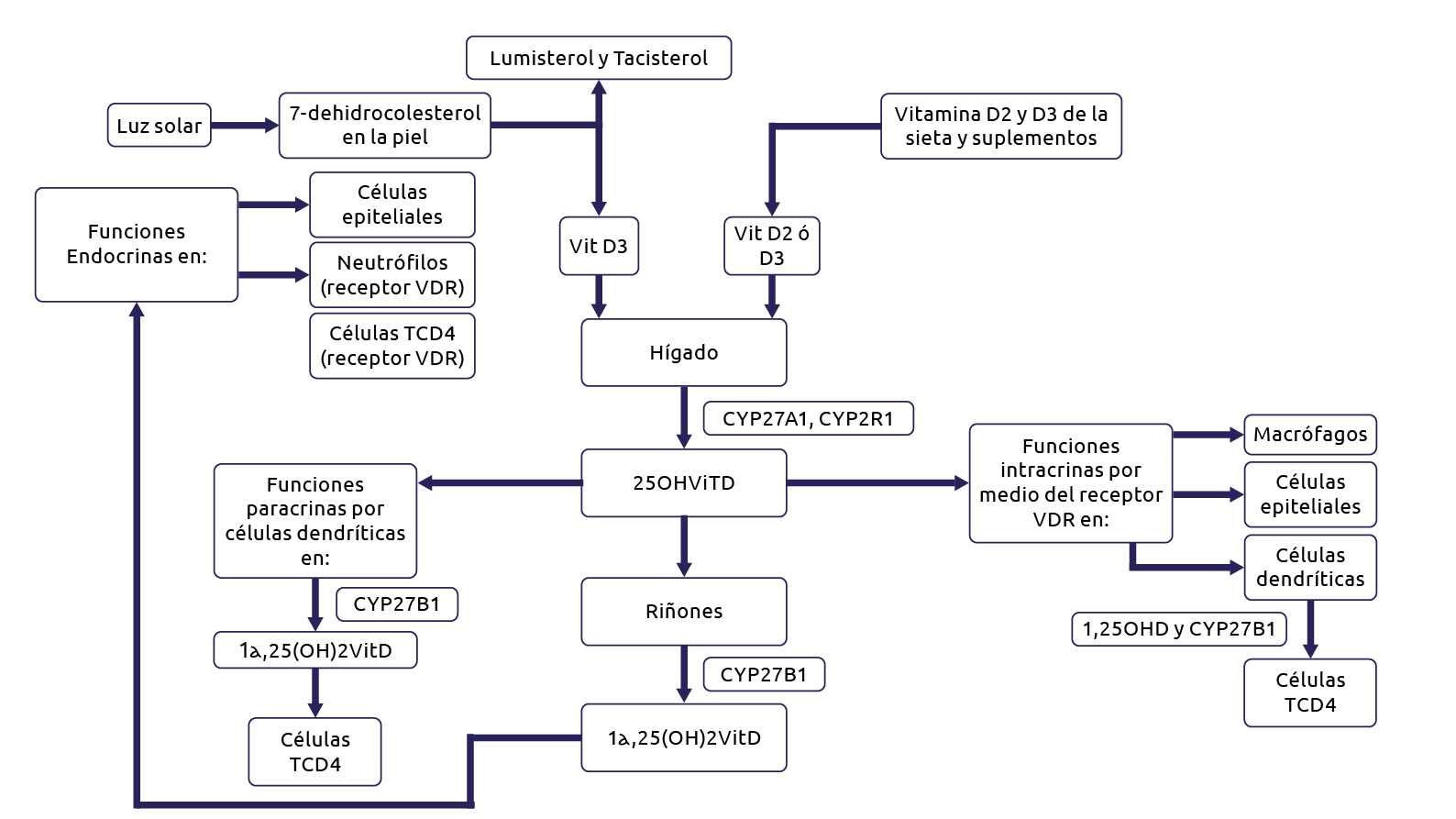
Figura 1. Vías metabólicas de la VitD e interacción de sus metabolitos con las células de la respuesta innata
Fuente: Modificado de Lang et al. 2017 (2)
Método
Se realizó una revisión narrativa de la literatura encontrada en las bases de datos PubMed, Cochrane, Science Direct y Ebsco de publicaciones sobre VitD en los últimos 10 años y sobre SARS-CoV-2 y COVID-19 en el periodo comprendido entre enero 2019 y agosto de 2020. La selección de los artículos se hizó en función de los siguientes criterios: revisiones sistemáticas y estudios en humanos. Se excluyeron los estudios no accesibles en la totalidad del texto. Las palabras clave utilizadas fueron escogidas según la terminología Mesh y DeCS, estas fueron: vitamina D, infecciones por Coronavirus, COVID-19, SARS-CoV-2, personal de odontología y prevención primaria.
El planteamiento para la búsqueda bibliográfica se basó en la obtención de documentación que aportara información sobre las funciones inmunomoduladoras de la VitD, las concentraciones séricas en normalidad como factor protector ante las infecciones respiratorias, específicamente en relación con el SARS-CoV-2, y la situación del personal de salud como población susceptible. Así, se seleccionaron 65 artículos de acuerdo a los criterios de inclusión y, posteriormente, se redactó un resumen narrativo sobre los principales hallazgos. Para priorizar y resumir las conclusiones derivadas de las publicaciones revisadas, se llegó a un consenso entre los autores.
Resultados
Resumen informativo sobre fuentes y metabolismo de la VitD
La VitD es una vitamina liposoluble que se forma a partir de sus respectivas provitaminas: ergosterol y 7-dehidrocolesterol (7-DHC). La fuente natural predominante en los seres humanos es la síntesis en la piel, en la que el 7-DHC sigue una reacción en dos etapas que requiere la irradiación con rayos ultravioleta B (UV-B) para formar la pre-VitD3, seguida de una isomerización térmica para formar la VitD3 (27). Posteriormente, en el hígado, el colecalciferol es hidroxilado para obtener 25(OH)D3 por la acción de las enzimas citocromo P450 hidroxilasas CYP27A1 y CYP2R1. El 25(OH)D es un metabolito activo adicionalmente hidroxilado en células renales y otras células que expresan la enzima CYP27B para producir el metabolito final, este es 1α,25-DHCC (Calcitriol). Esta hormona interactúa con un receptor nuclear (receptor de la VitD, VDR) presente en los órganos diana, para, inducir las respuestas biológicas (3,28,29).
La cantidad sintetizada por el organismo es alrededor de 25000 unidades internacionales (UI) por día. También hay fuentes dietéticas exógenas o complementos vitamínicos (1,15). Por ejemplo, peces como el salmón y el atún, el aceite de hígado de pescado o las yemas de huevo contienen mayores cantidades de VitD3, mientras la VitD2 puede sintetizarse en plantas y hongos por la acción de la luz UV-B sobre el ergosterol (27,29). La VitD en la dieta se absorbe predominantemente en el intestino delgado, mientras que la D3 es la que mejor se absorbe de manera eficiente (30). A su vez, 1,25 DHCC es una de las tres hormonas que regulan el metabolismo fosfocálcico. Las otras dos hormonas reguladoras del calcio son la calcitonina y la PTH (2,16). Por lo tanto, el raquitismo es la consecuencia de una grave deficiencia de VitD, debido a la falta de exposición a la luz solar y a deficiencias de la dieta.
Resumen informativo sobre funciones intra y extra esqueléticas de la VitD
Las acciones más conocidas de la VitD están relacionadas con la absorción intestinal del calcio, la regulación del fosfato cálcico en suero, así como los procesos de formación y resorción ósea (homeostasis ósea). Sin embargo, el gen receptor nuclear de la VitD (VDR) se expresa en aproximadamente 400 tejidos y tipos celulares. Esto sugiere que la VitD tiene funciones normales más extensas y que algunas de sus acciones potenciales se relacionan con la modulación de las defensas en el huésped ante antígenos y patógenos, a través de la identificación de acciones dependientes de la transcripción del gen VDR en las vías de regulación del sistema inmune (2–4). Algunos estudios han demostrado que en el cuerpo humano hay múltiples receptores para VitD, vinculados a cromosomas, en casi todas las células y tejidos, lo que conlleva a importantes efectos en diferentes órganos (28). Por lo anterior se puede inferir que la VitD juega un papel importante durante todo el proceso vital, en el crecimiento, desarrollo y mantenimiento de un cuerpo sano (28).
Relación de la Vit D con el sistema inmune y las infecciones respiratorias
Con respecto al sistema inmune ha habido un gran interés en el papel potencial de la VitD como resistencia ante el huésped productor de las infecciones. Como es sabido el sistema inmunológico comprende dos tipos de inmunidad, innata y adaptativa. Estas interactúan entre sí ante enfermedades infecciosas con el propósito de reconocer los agentes patógenos invasores, prevenir su propagación y expulsarlos del cuerpo (5,11,28).
En relación al proceso de infección respiratoria, es preciso explicar que las tasas de replicación viral y las concentraciones de citoquinas proinflamatorias producen inflamación que daña el epitelio de los pulmones, lo que conlleva a la afectación del sistema respiratorio (21,29). Se ha encontrado una asociación entre bajas concentraciones séricas de 25(OH)D y susceptibilidad a infecciones agudas de las vías respiratorias (7,30-32). Como mecanismo de protección, se puede sintetizar 1,25 DHCC en el pulmón en respuesta a la infección pulmonar, siempre y cuando el sustrato 25(OH)D esté disponible; ello es posible en individuos con altos niveles de VitD. Esto permitirá que el VDR se exprese ampliamente en las células del sistema inmune y en el tracto respiratorio, para inducir respuestas antimicrobianas de amplio espectro que son efectivas contra los patógenos respiratorios virales y bacterianos (33).
De este modo, las formas activas de la VitD ejercen efectos multidireccionales dentro del sistema inmunológico, uno de ellos es ayudar al sistema respiratorio. Estas formas incluyen: la estimulación en la función de los macrófagos (células T y las células B activadas); la maduración de las células dendríticas; la modulación de la expresión del factor de necrosis tumoral (FNT); la producción de proteínas y péptidos antibacterianos neutros, por ejemplo, catelicidinas, β-defensina y especies reactivas del oxígeno, y la expresión de la sintasa inducible de óxido nítrico (5,34). Las catelicidinas y la β-defensina, son péptidos antimicrobianos y antivirales que pueden ser secretados por las células epiteliales de las vías respiratorias para formar una primera línea de defensa contra los patógenos invasores, lo que sugiere un posible mecanismo por el cual la VitD puede aumentar la inmunidad innata a las infecciones respiratorias (33).
En un metanálisis publicado en 2019, Zhou et al. (30) documentaron la asociación entre los niveles de VitD y el riesgo de neumonía adquirida en comunidades. El riesgo era mayor cuando las concentraciones séricas de VitD eran inferiores a 20ng/mL. Martineau et al. (29) obtuvieron resultados similares y concluyeron que el efecto protector de la VitD contra las enfermedades respiratorias es mediado por la inducción de la síntesis de péptidos antimicrobianos, la estimulación de la autofagia y la síntesis de especies reactivas de nitrógeno y oxígeno.
En un ensayo clínico controlado y aleatorizado, realizado en 25 pacientes hospitalizados con neumonía en Nueva Zelanda en el año 2018, se evaluó el efecto de la administración de una dosis única de VitD por vía oral sobre la respuesta del paciente. Con la prueba se encontró que posterior a las seis semanas del tratamiento, los pacientes que presentaban deficiencia de VitD tuvieron una mejor resolución (31).
Así mismo, en la revisión realizada por Zdrenghea et al. (32) se refirie que aunque no hay reportes de que la VitD reduzca la carga viral, sí hay estudios in vitro que sugieren una contribución de la disminución de la inflamación mediante la reducción de citoquinas pro-inflamatorias pulmonares tipo 1, como la IL-12, IFN–γ, IL–6, IL–8 y el FNT–α, así como la IL–17. De otro lado, también, demuestran un incremento en las citoquinas antiinflamatorias como la IL–4, IL–5, e IL–10. Adicionalmente, los autores sugieren que, aunque, la suplementación con niveles de 25(OH)D por encima de los 30 ng/mL se asocia con mejores resultados respiratorios, las dosis deben ser administrados con precaución, pues un nivel alto de VitD podría resultar en inmunosupresión (31).
Poblaciones susceptibles
Un aspecto importante para la suplementación con VitD es el conocimiento de las poblaciones susceptibles de tener una deficiencia (hipovitaminosis D). Un caso representativo respecto a las diferencias demográficas y las tendencias en hipovitaminosis D es el de la población americana en Estados Unidos. Ginde et al. (35) compararon los datos de los 18863 participantes de la encuesta nacional de salud, realizada entre 1988 y 1994, con los 13369 participantes de la encuesta realizada del 2001 al 2004, con respecto a sus niveles séricos de 25(OH)D. En este marco, determinaron que el promedio disminuyó de 30 ng/mL a 24 ng/mL. Adicionalmente la deficiencia severa de VitD aumento de un 2% a un 6% y los niveles > a 30 ng/mL bajaron de 45% a un 23%, demostrando una disminución longitudinal marcada en el tiempo de los niveles saludables de VitD en la población americana (35).
Sobre las variaciones estacionales en los niveles de VitD, estas fueron evaluadas por Heidari et al. (36) en Irán, a través de la medición de los niveles séricos en 576 mujeres y 120 hombres durante diferentes meses del año. Los autores reportaron haber encontrado que independientemente de la estación, el 70% presentaba deficiencia de VitD. De esta forma, para las mujeres los niveles séricos fueron más bajos que para los hombres, asimismo, en invierno y otoño, las mujeres presentaron mayor riesgo de hipovitaminosis.
Dentro de los grupos susceptibles a la hipovitaminosis D se encuentran las personas con piel oscura, puesto que la pigmentación de la piel dada por la melanina actúa como un protector solar natural (comportándose como uno tipo factor 15), con lo cual disminuye la síntesis cutánea de la VitD (37). También, están en riesgo de hipovitaminosis D las mujeres posmenopáusicas, especialmente si hay osteoporosis, según los resultados de una revisión sistemática (38). De igual forma, la edad constituye un factor de riesgo (39-41). En adultos mayores, diversos factores contribuyen a la deficiencia de VitD: periodos más largos de confinamiento en casa, deficiencia dietaría y disminución en la síntesis cutánea, producto de una perdida en la capacidad de la piel en sintetizar la VitD. Así, una persona de 70 años sintetiza cuatro veces menos VitD en comparación con una de 20 años (39-41). La población escolar también puede presentar hipovitaminosis. De acuerdo, a Gordon et al. (39), en un estudio realizado en 307 adolescentes, el 66% presentaron deficiencia de VitD que aumentaba si coincidía con la estación de invierno y si el adolescente era afrodescendiente.
Otro grupo susceptible es la población con obesidad, que, generalmente, tiene un nivel sérico de 25(OH)D más bajo que las personas de peso normal. El nivel de 25(OH)D está inversamente correlacionado con el peso corporal, el índice de masa corporal y la masa grasa. Existe un 20% más de deficiencia de 25(OH)D en suero en las personas obesas comparadas con las de peso normal (42). La población con enfermedades autoinmunes hace parte también del grupo susceptible. (34).
Los profesionales de la salud, incluyendo a los odontólogos, son población en riesgo de hipovitaminosis D
Teniendo en cuenta que una razón de deficiencia de VitD es la falta de exposición rutinaria al sol, los trabajadores de la salud que trabajan dentro de un consultorio, regularmente dentro de edificios de concreto en ambientes cerrados, con insuficiente luz solar y con horarios laborales que van desde las primeras horas de la mañana hasta la noche, tienen menos posibilidad de recibir luz solar mínima en las cantidades necesarias para mantener los niveles séricos de 25(OH)D en rangos normales. Estudios como los de Haney et al. (21), en los que se midieron los niveles séricos de 25(OH) D en 35 residentes de medicina interna en Oregon, USA, durante las temporadas de otoño y primavera, encontraron un alto riesgo de hipovitaminosis en estos residentes, especialmente en las temporadas de invierno.
Igualmente, en Ankara Turquía, Erden et al. (22), en un estudio aplicado a 125 trabajadores del área de anestesiología y 60 trabajadores de otras áreas del hospital, identificaron que solo el 4,8% de ambos grupos tenía niveles suficientes de 25(OH)D al finalizar el invierno. Similares resultados, pero en Brasil, Porto Alegre, un país sin estación de invierno, fueron reportados por Premaor et al. (23). Los autores reportan haber encontrado hipovitaminosis en 73 residentes de medicina, cuyos niveles séricos promedio de 25(OH)D fueron de 17.9+/-8.0 ng/mL. De la misma manera, en Doha, Qatar, en un estudio realizado por Mahdy et al. (24) a 340 trabajadores de la salud, se halló un promedio de 11.7 ng/mL en los niveles de 25(OH)D; el nivel más bajo lo presentaba la población femenina, así, se demostró de manera general una alta hipovitaminosis en los profesionales al cuidado de la salud. De igual forma, en Teherán, Irán, Rajebi et al. (25), en un estudio a 114 enfermeras de un hospital infantil, encontraron que solo el 6,1% de esta población presentaba niveles adecuados de VitD en plasma.
Es así, que la población al cuidado de la salud oral, incluidos odontólogos, higienistas, asistentes y secretarias no se escapan de esta situación, dada la naturaleza del trabajo en ambientes cerrados. Al respecto, dos casos representativos. Dogruel et al. (43) valoraron los niveles séricos de 25(OH)D en 100 trabajadores de la facultad de odontología en Kayseri, Turquía, incluidos odontólogos, asistentes y secretarias, y encontraron un promedio de 12.1+/-8.37 ng/mL., así como también que 51 de los participantes presentaron deficiencias severas por debajo de 10 ng/mL, 36 presentaron deficiencias simples entre 10 y 20 ng/mL, 10 presentaron insuficiencia con valores entre 20 y 30 ng/mL y solo 3, entre los cuales había solo un odontólogo, presentaron niveles normales > 30 ng/mL. Iguales resultados encontraron Varkal et al. (26) en 96 miembros del staff odontológico en donde el nivel promedio fue de 12.5+/-0.6 ng/mL.
SARS-CoV-2 y vitamina D
Los coronavirus son ARN - virus que se distribuyen ampliamente entre los humanos, otros mamíferos y las aves causando enfermedades respiratorias, entéricas, hepáticas y neurológicas. Son conocidas seis especies de coronavirus que causan enfermedades humanas. Cuatro de estos causan síntomas de resfriado común en individuos inmunocompetentes. Las otras dos cepas (SARS-COV y MERS-COV) (SARS por síndrome respiratorio agudo severo y MERS por síndrome respiratorio del Medio Oriente), son de origen zoonótico (44). El receptor del SARS-CoV (ACE2) es una molécula de superficie localizada en las células endoteliales arteriales y venosas, las células del músculo liso arterial, los epitelios del intestino delgado y las vías respiratorias. En el tracto respiratorio, el ACE2 se expresa en las células epiteliales de los alvéolos, la tráquea y los bronquios, glándulas serosas bronquiales, monocitos alveolares y macrófagos (45).
El SARS-CoV y el MERS-CoV son dos virus causantes de neumonía grave en los seres humanos y comparten algunas características estructurales con el SARS-CoV-2. De manera similar, su organización genómica es típica de los coronavirus, ya que tienen un genoma de ARN único y de cadena positiva que codifica cuatro proteínas estructurales virales principales: la espiga (S), la envoltura (E), la membrana (M) y las proteínas 3-5 de la nucleocápside (N), que siguen el orden genético característico (46).
En lo que respecta al SARS-CoV-2 la primera evidencia que respaldaba el papel de la VitD en la reducción del riesgo de la COVID-19 se soportaba en dos premisas. La primera se refería que el brote en China ocurrió en invierno, un periodo en el que las concentraciones de 25(OH)D son más bajas; la segunda se soportaba en que el número de casos en el hemisferio sur cerca del final del verano fue bajo. Posteriormente, se demostró que la deficiencia de VitD contribuye al síndrome de infección respiratoria aguda.
Se ha demostrado que la expresión del receptor 4/CD26, uno de los receptores del virus, se reduce significativamente in vivo al corregirse la deficiencia de VitD. También hay pruebas de que la optimización de los niveles de VitD puede atenuar algunas de las secuelas inmunológicas posteriores críticas, que se cree provocan resultados clínicos más deficientes en la infección por el virus, como la respuesta prolongada al interferón-gamma y la elevación persistente de la interleukina 6, un indicador de pronóstico negativo en los pacientes con neumonía aguda, incluidos los que padecen la COVID-19 (21). En cultivos celulares, que evalúan la eficacia antiviral de la VitD, se ha encontrado que la respuesta es más eficaz ante virus encapsulados, por lo que sería efectiva contra SARS-CoV-2 (14).
McCartney et al. (47) postularon que la corrección de la deficiencia de VitD suprime la molécula CD26, que es una posible molécula de adhesión para el virus y, además, atenúa la producción de interferón gamma y de IL-6, ambos predictores de un pronóstico pobre en pacientes con COVID-19. Por otra parte, los receptores DPP4 y CD26 interactúan con la glicoproteína de la espiga del virus y la expresión de estos receptores se reduce significativamente in vivo cuando se corrige la hipovitaminosis. Estos autores, basándose en los niveles de VitD encontrados en población irlandesa, sugieren como niveles séricos aceptables > 50 nmol/L y recomiendan un suplemento en poblaciones vulnerables, de 20-50 microgramos/día. De tal forma, dosis de 20-50 mcg/día son seguras, de acuerdo a las revisiones sistemáticas ya mencionadas.
D´Avolio et al. (20), en abril 2020, demostraron en una cohorte de pacientes suizos que los niveles de 25(OH)D eran significativamente más bajos (p = 0.004) en pacientes positivos para COVID-19, según la prueba PCR (Reacción en cadena de la polimerasa, sigla en inglés), que en los pacientes PCR negativos. Las medianas respectivas eran 11.1 ng/mL en pacientes positivos y 24.6 en los negativos. La diferencia se corroboró teniendo en cuenta las edades; como se trataba de pacientes del mismo lugar no fue posible atribuir la ausencia de la enfermedad a una situación de contagio diferente.
Este hallazgo es una comprobación directa de lo que sugerían estudios epidemiológicos como el de Ribeiro et al. (48), en Brasil, e Isaia et al. (15) en Italia. Tanto en el país tropical como en el país europeo, había una clara eviencia de hipovitaminosis D, lo que llevó a ambos grupos de investigadores, el de la Universidad de Turin y el brasileño a considerar el tratamiento con VitD como una forma de prevención adicional para el COVID-19.
En junio de 2020, en el campo de la pediatría, Panfili et al. (49) revisaron el posible papel de la VitD en las infecciones por COVID-19 en poblaciones pediátricas. Al respecto, lograron establecer que la menor sensibilidad de los niños al contagio podría relacionarse con los niveles altos de VitD.
En relación al consumo de suplementos de VitD para reducir el riesgo de infección por influenza y por COVID-19, Grant et al., en abril de 2020 (50), hicieron una revisión de la evidencia disponible. Estos investigadores sugieren la inyección de 10000 UI/día para elevar rápidamente la concentración plasmática de 25(OH)D por encima de 40-60 ng/mL, no obstante, para pacientes ya infectados se requerirían dosis todavía mayores.
Uso profiláctico de la VitD. Niveles recomendados
Hasta el momento el mejor evaluador del nivel de VitD del cuerpo humano es la concentración en plasma de 25(OH)D. El propósito de la suplementación con VitD es lograr y mantener las concentraciones óptimas de 25(OH)D sin efectos adversos. Sin embargo, existe controversia acerca de las concentraciones exactas de 25(OH)D que definan la deficiencia y suficiencia de VitD (51,55,56,57). La mayoría de las guías sugieren un nivel sérico de 25(OH)D de 20ng/mL para la población en general, correspondientes a la IDR (ingesta diaria recomendada) que cubren los requisitos de al menos el 97.5% de la población. Así mismo, recomiendan una ingesta necesaria de 600(UI/día) para alcanzar esos niveles en la población de 1 a 70 años tanto en mujeres como en hombres y para los mayores de 70 años, una IDR de 800 (UI/día)(51,52). En general, la dosis diaria recomendada de VitD es de 600 UI/día (20 mcg/día) y los niveles séricos de 25(OH)D son considerados adecuados a una concentración de 30 ng/mL o más. Dosis de 20 a 50 mcg/día son seguras, de acuerdo a la mayoría de las revisiones consultadas (51-54).
Ahora bien, el exceso crónico de VitD es tóxico y causa hipercalcemia, calcificación de tejidos blandos y finalmente, toxicidad renal. Los síntomas de la toxicidad de la VitD son: fatiga, náuseas, vómitos, discapacidad mental e insuficiencia renal (43). Las guías de la Endocrine Society concluyeron que la toxicidad de la VitD no solo es extremadamente rara, sino que se requiere una concentración de 25(OH)D de al menos 150 ng/mL (375 nmol / L), antes de que haya evidencia de toxicidad (54).
En el caso de pacientes con deficiencia de VitD confirmada por el laboratorio, es decir, con una concentración de 25(OH)D inferior a 20 ng/mL (50 nmol/L), debe aplicarse un tratamiento con VitD hasta lograr los niveles normales. Las directrices europeas recomendaron que la dosificación debe ser como se indica en la Tabla 1, siempre y cuando los rangos se ajusten al peso corporal (52,53,56). Para personas con obesidad (IMC> 30 kg / m2), la dosis diaria de VitD necesaria fue tres veces mayor que la dosis recomendada para sujetos con peso corporal normal (56).
El suministro de VitD3 es preferible a la VitD2 como suplemento debido a su mayor potencia y a una vida media más prolongada, lo que produce un almacenamiento 2 a 3 veces mayor posterior a su administración (58).
Con base en el nivel de referencia de 25(OH)D, Chang et al. (59) sugieren las siguientes estrategias generales de tratamiento para la administración de suplementos de VitD en adultos: para individuos con un nivel < 10ng/mL una suplementación de 50000 UI una vez por semana por 6-8 semanas, después mantener con 800 UI diarias. Para un nivel de 10-20ng/mL, suplementación de 800 – 1000 UI por día y para población con niveles de 20-30ng/mL, una suplementación de 600 – 800 UI por día En el caso especial de sujetos con Síndrome de malabsorción subyacente, recomiendan una suplementación de 10000 – 50000 UI por día. Además, sugieren que se debe continuar con un nivel adecuado en suero de 25(OH)D tres meses después del tratamiento y que se puede requerir una dosis más alta si no se alcanza el nivel sérico objetivo (59).
|
Tabla 1. Recomendaciones de suplementación para el tratamiento y prevención de Hipovitaminosis D según protocolos europeos |
||
|
Grupo etario |
Dosis en UI |
Dosis en mg |
|
Recién nacidos (menos de un mes). |
1000 IU/día. |
25mg/ día. |
|
1-12 meses. |
2000-3000 IU/día. |
50-75 mg/ día. |
|
Niños y adolescentes (1-18 años). |
3000-5000 IU/ día. |
75-125 mg/ día. |
|
Adultos y adultos mayores. |
7000-10000 IU/ día o 50000 IU/semana. |
175-250 mg/ día o 1250 mg/semana. |
|
Fuente: Pludowski et al. 2018 (53). |
||
|
Tabla 2. Recomendaciones de suplementación con VitD |
||
|
Grupo etario |
Dosis en UI |
Dosis en mg |
|
< 1 año |
400–1000 IU / día |
10–25 mg |
|
niños > 1 año |
600–1000 IU / día |
15–25 mg |
|
adultos |
1500–2000 IU / día |
37,5–50 mg |
|
Fuente: Sociedad Estadounidense de Endocrinología para el tratamiento y prevención de Hipovitmainosis D (56). |
||
Discusión
Con la presente revisión se cumple primordialmente el objetivo didáctico de presentar información confiable, especialmente en virtud de que el tema de la COVID-19 es a diario objeto de falsas informaciones y especulaciones a través de las redes sociales. Se presenta evidencia de que el personal de salud tiene riesgo de presentar hipovitaminosis D y que la VitD tiene un efecto positivo sobre el sistema inmune.
Es importante precisar que no se diseñó una revisión sistemática de la literatura por dos motivos, el primero, porque la información científica sobre la COVID-19 es reciente y se actualiza y amplía diariamente; el segundo es porque en relación a la VitD se encontró una revisión sistemática de literatura muy completa (Benskin, Julio 2020)(19) que incluye la mayoría de los artículos que ya se habían revisado.
Aunque es evidente la necesidad de ensayos clínicos controlados para evaluar la relación entre la VitD y las infecciones respiratorias, tanto en prevención como en tratamiento, Watkins et al. (60) postularon que la suplementación con VitD en pacientes con deficiencia resulta ser una herramienta económica para estimular el sistema inmune de la población vulnerable y favorecer la resolución de las patologías infecciosas del sistema respiratorio. En ese mismo sentido, y a pesar de que la vacunación es la base principal de la prevención, actualmente no hay vacunas efectivas disponibles para varios de los patógenos que afectan el sistema respiratorio de manera importante como es el caso del SARS-CoV-2, por lo cual se hacen necesarias y urgentes intervenciones alternativas de bajo costo con potencial para proteger contra múltiples patógenos respiratorios. Un creciente nivel de evidencia sugiere que la suplementación con VitD pudiera representar una de esas intervenciones (19,29). Al respecto, los estudios controlados y aleatorizados son difíciles de realizar por motivos éticos y porque se requieren decisiones urgentes para atender la pandemia.
Actualmente, podría haber una deficiencia generalizada de VitD. La razón principal es la insuficiente exposición a la luz solar (cuarentena mundial). La deficiencia de VitD es una condición común, vista en todas las etnias, en todas las regiones geográficas y en todas las condiciones socioeconómicas. Sumado a la falta de exposición, se encuentra que, a menudo, el nivel de VitD en los alimentos es bajo por lo que es insuficiente para satisfacer las necesidades diarias, excepto en el caso de los nutrientes enriquecidos con VitD. Del mismo modo, otras condiciones como la piel oscura, el envejecimiento, el uso de protectores solares, la obesidad, hiperparatiroidismo, linfoma, malabsorción de nutrientes, síndrome nefrótico, insuficiencia renal crónica, insuficiencia hepática crónica y el uso de ciertos medicamentos (anticonvulsivos, antituberculosos) son causas adicionales de la deficiencia de VitD. A su vez, la organización del sistema de salud, los hábitos alimentarios de la sociedad, el entorno cotidiano, las condiciones de trabajo y las susceptibilidades son también causas principales en la deficiencia de VitD (19) y factores para establacer diferencias en la mortalidad por COVID-19.
En el futuro próximo, pos-pandémico, las nuevas condiciones de trabajo virtual, las nuevas restricciones económicas para acceder a una dieta rica en VitD y los cambios ambientales estimularán una hipovitaminosis D en la población. Aunque la mayoría de los estudios que nos entrega la evidencia científica son observacionales, la falta de un tratamiento específico contra la COVID-19 y la falta de una vacuna contra el virus del SARS-CoV-2 propone el reto médico de proteger la población ante la amenaza de una infección masiva, lo que justifica el uso de VitD como una posible terapia coadyuvante.
Así, ante la inminente epidemia de COVID-19, y en ausencia de una vacuna o de una terapia farmacológica antiviral eficaz para tratar a los infectados, la evidencia propone la suplementación prioritaria de todos los pacientes. Se recomienda, además, que la suplementación se dirija a otros grupos vulnerables (por ejemplo, trabajadores de la salud), y finalmente, se extienda al resto de la población para mitigar los graves riesgos de salud pública asociados con la infección por COVID-19.
En este mismo contexto es prioritario tener en cuenta que la suplementación con VitD es solo un factor ayudante dentro de los retos y desafíos en la atención odontológica durante y después de la epidemia, ya sea en épocas de cuarentena donde las atenciones indicadas son las urgencias o después de ella cuando se retoma el trabajo programado con los pacientes. La implementación de protocolos de bioseguridad generales y específicos por especialidad, permitirán prevenir, controlar y detener la diseminación del COVID-19 (47). Existen ya resultados prácticos como los que reportan Meng et al. (61) quienes reportan que en el hospital de estomatología de Wuhan, China, que alberga la universidad de odontología, solo se contagió el 0,47% de sus miembros debido a los protocolos instaurados, que incluían el uso de VitD (61).
De este modo, los suplementos de VitD son eficientes en cuanto a su bajo costo, son de fácil adquisición y seguros. Se recomienda una medición previa de los niveles séricos de VitD para proporcionar solo las dosis necesarias. En casos límite de deficiencia, podría ser tan solo necesario un asesoramiento nutricional y de cambio de hábitos. Igualmente, vale la pena recordar a los ortodoncistas y prostodoncistas que hay evidencia preliminar de que puede haber beneficios adicionales debidos a la capacidad de la VitD para incrementar el movimiento dental en ortodoncia y la oseointegración de los implantes (62-65). Por lo tanto, niveles moderadamente altos de VitD en los pacientes también pueden ser útiles en la práctica clínica.
La presente revisión de literatura provee un buen nivel de evidencia sobre la correlación entre la hipovitaminosis D y la severidad de infecciones respiratorias. Asimismo, hay evidencias de que los trabajadores de la salud, incluyendo los odontólogos, tienen tendencia a presentar hipovitaminosis D.
Por otra parte, no se dispone de evidencia científica de alto nivel sobre el papel preventivo de la VitD para reducir la incidencia y / o la severidad de la COVID-19. No se ha demostrado que esta vitamina tenga acción terapéutica contra esta virosis, pero considerando la carencia actual de una vacuna o un tratamiento específico, se justifica la recomendación de que, como medida preventiva adicional, de bajo costo y accesible, se implemente un suplemento de VitD en los grupos vulnerables para mitigar los riesgos de salud pública asociados con el COVID-19.
La recomendación concreta, derivada de esta revisión, para los profesionales de la salud oral y sus pacientes, es el incremento de la exposición a la luz solar, una dieta más rica en Vitamina D y el consumo de un suplemento nutricional de esta vitamina. Se debe hacer énfasis en que estas recomendaciones tienen valor preventivo, no curativo. En caso de contagio y desarrollo de la infección se puede reducir la gravedad de los síntomas con dosis intravenosas altas.
Contribución de los autores
Diego Fernando López. Director del proyecto, asesor metodológico y construcción del manuscrito. Valentina Ríos Borrás. Búsqueda y revisión de la literatura. David Alejandro Rivera. Búsqueda y revisión de la literatura. Luis Rogelio Hernández. Estandarización y explicación de la terminología en biología molecular. Mario Alejandro Ortiz. Construcción del manuscrito, asesor temático.
Conflicto de interés
Los autores declaran no presentar conflicto de interés y que no han recibido patrocinio, así como tampoco tienen participación comercial o laboral con fabricantes o distribuidores de vitamina D.
Referencias
- Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014; 21(3): 319–29. https://doi.org/10.1016/j.chembiol.2013.12.016
- Lang PO, Aspinall R. Vitamin D Status and the Host Resistance to Infections: What It Is Currently (Not) Understood. Clin Ther. 2017; 39(5): 930–945. https://doi.org/10.1016/j.clinthera.2017.04.004
- Hewison M. An update on vitamin D and human immunity. Clin Endocrinol (Oxf). 2012; 76(3): 315–325. https://doi.org/10.1111/j.1365-2265.2011.04261.x
- Beard JA, Bearden A, Striker R. Vitamin D and the anti-viral state. J Clin Virol. 2011; 50(3): 194–200. https://doi.org/10.1016/j.jcv.2010.12.006
- Lang PO, Samaras N, Samaras D, Aspinall R. How important is vitamin D in preventing infections? Osteoporos Int. 2013; 24(5): 1537–1553. https://doi.org/10.1007/s00198-012-2204-6
- Carlberg C, Seuter S, Heikkinen S. The first genome-wide view of vitamin D receptor locations and their mechanistic implications. Anticancer Res. 2012 Jan; 32(1): 271–282.
- Cannell JJ, Vieth R, Umhau JC, Holick MF, Grant WB, Madronich S, et al. Epidemic influenza and vitamin D. Epidemiol Infect. 2006; 134(6): 1129–1140. https://doi.org/10.1017/s0950268806007175
- Liu W, Zhang L, Xu H-J, Li Y, Hu C-M, Yang J-Y, et al. The Anti-Inflammatory Effects of Vitamin D in Tumorigenesis. Int J Mol Sci. 2018; 19(9): 2736. https://doi.org/10.3390/ijms19092736
- Hansdottir S, Monick MM. Vitamin D Effects on Lung Immunity and Respiratory Diseases. Vitamins and Hormones. 2011; 86: 217–237. https://doi.org/10.1016/B978-0-12-386960-9.00009-5
- Liu PT, Stenger S, Li H, Wenzel L, Tan BH, Krutzik SR, et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science. 2006; 311(5768): 1770–1773. https://doi.org/10.1126/science.1123933
- Skrobot A, Demkow U, Wachowska M. Immunomodulatory Role of Vitamin D: A Review. Adv Exp Med Biol. 2018; 1108: 13–23. https://doi.org/10.1007/5584_2018_246
- Greiller CL, Martineau AR. Modulation of the immune response to respiratory viruses by vitamin D. Nutrients. 2015; 7(6): 4240–4270. https://doi.org/10.3390/nu7064240
- Cao Z, Wu Y, Faucon E, Sabatier J-M. SARS-CoV-2 & COVID-19: Key-Roles of the “Renin-Angiotensin” System / Vitamin D Impacting Drug and Vaccine Developments. Infectious Disorders - Drug Targets. 2020; 20(3): 348–349. https://doi.org/10.2174/187152652099920050517470
- Martín–Giménez VM, Inserra F, Tajer CD, Mariani J, Ferder L, Reiter RJ, et al. Lungs as target of COVID-19 infection: Protective common molecular mechanisms of vitamin D and melatonin as a new potential synergistic treatment. Life Sci. 2020; 254: 117808. https://dx.doi.org/10.1016%2Fj.lfs.2020.117808
- Isaia G, Medico E. Possible prevention and therapeutic role of vitamin D in the management of the COVID-19 pandemic. MINAPIM MAGAZINE. 2020. Disponible en: https://minapim.com/en/possible-preventive-and-therapeutic-role-of-vitamin-d-in-the-management-of-the-covid-19-pandemic/
- McCullough PJ, Lehrer DS, Amend J. Daily oral dosing of vitamin D3 using 5000 TO 50,000 international units a day in long-term hospitalized patients: Insights from a seven year experience. J Steroid Biochem Mol Biol. 2019; 189: 228–239. https://doi.org/10.1016/j.jsbmb.2018.12.010
- Hossein-Nezhad A, Holick MF. Vitamin D for health: A global perspective. Mayo Clin Proc. 2013; 88(7): 720–755. https://doi.org/10.1016/j.mayocp.2013.05.011
- Borella E, Nesher G, Israeli E, Shoenfeld Y. Vitamin D: A new anti-infective agent? Ann N Y Acad Sci. 2014; 1317(1): 76–83. https://doi.org/10.1111/nyas.12321
- Benskin L. A Basic Review of the Preliminary Evidence That COVID-19 Risk and Severity Is Increased in Vitamin D Deficiency. Front Public Health. 2020; 8: 513. https://dx.doi.org/10.3389%2Ffpubh.2020.00513
- D’Avolio A, Avataneo V, Manca A, Cusato J, De Nicolò A, Lucchini R, et al. 25-Hydroxyvitamin D Concentrations Are Lower in Patients with Positive PCR for SARS-CoV-2. Nutrients. 2020;12(5): 1359. https://doi.org/10.3390/nu12051359
- Haney EM, Stadler D, Bliziotes MM. Vitamin D insufficiency in internal medicine residents. Calcif Tissue Int. 2005; 76(1): 11–16. https://doi.org/10.1007/s00223-004-0025-0
- Erden G, Ozdemir S, Ozturk G, Erden A, Kara D, Isik S, et al. Vitamin D Levels of Anesthesia Personnel, Office Workers and Outdoor Workers in Ankara, Turkey. Clin Lab. 2015; 62(5): 931–937. https://doi.org/10.7754/clin.lab.2015.151003
- Premaor MO, Paludo P, Manica D, Paludo AP, Rossatto ER, Scalco R, et al. Hypovitaminosis D and secondary hyperparathyroidism in resident physicians of a general hospital in southern Brazil. J Endocrinol Invest. 2008; 31(11): 991–995. https://doi.org/10.1007/bf03345637
- Mahdy S, Al-Emadi SA, Khanjar IA, Hammoudeh MM, Sarakbi HA, Siam AM, et al. Vitamin D status in health care professionals in Qatar. Saudi Med J. 2010; 31(1): 74–77.
- Rajebi H, Khodadad A, Fahimi G, Abolhassani H. Vitamin D deficiency among female nurses of children’s medical center hospital and its related factors. Acta Med Iran. 2016; 54(2): 146–150.
- Varkal M, Yildiz I, Saygili S, Yildiz M, Kildic A, Darendeliler F, et al. One of the risk groups for Vitamin D Deficiency: Health Workers. İst Tıp Fak Derg. 2015; 78(2): 41–45.
- Chen TC, Lu Z, Holick MF. Photobiology of Vitamin D. En: Holick M (Editor). Vitamin D. 2.ª ed. Human Press; 2010. pp. 35–60.
- Pludowski P, Holick MF, Pilz S, Wagner CL, Hollis BW, Grant WB, et al. Vitamin D effects on musculoskeletal health, immunity, autoimmunity, cardiovascular disease, cancer, fertility, pregnancy, dementia and mortality-A review of recent evidence. Autoimmun Rev. 2013; 12(10): 976–989. https://doi.org/10.1016/j.autrev.2013.02.004
- Martineau AR, Jolliffe DA, Hooper RL, Greenberg L, Aloia JF, Bergman P, et al. Vitamin D supplementation to prevent acute respiratory tract infections: Systematic review and meta-analysis of individual participant data. BMJ. 2017; 356. https://doi.org/10.1136/bmj.i6583
- Zhou Y-F, Luo B-A, Qin L-L. The association between vitamin D deficiency and community-acquired pneumonia: A meta-analysis of observational studies. Medicine (Baltimore). 2019; 98(38): 17252. https://dx.doi.org/10.1097%2FMD.0000000000017252
- Slow S, Epton M, Storer M, Thiessen R, Lim S, Wong J, et al. Effect of adjunctive single high-dose vitamin D3 on outcome of community-acquired pneumonia in hospitalised adults: The VIDCAPS randomised controlled trial. Sci Rep. 2018; 8(1): 13829. https://doi.org/10.1038/s41598-018-32162-2
- Zdrenghea MT, Makrinioti H, Bagacean C, Bush A, Johnston SL, Stanciu LA. Vitamin D modulation of innate immune responses to respiratory viral infections. Rev Med Virol. 2017; 27(1). https://doi.org/10.1002/rmv.1909
- Bals R, Wang X, Zasloff M, Wilson JM. The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface. Proc Natl Acad Sci U S A. 1998; 95(16): 9541–9546. https://doi.org/10.1073/pnas.95.16.9541
- Rosen Y, Daich J, Soliman I, Brathwaite E, Shoenfeld Y. Vitamin D and autoimmunity. Scand J Rheumatol. 2016; 45(6): 439–447. https://doi.org/10.3109/03009742.2016.1151072
- Ginde AA, Liu MC, Camargo CAJ. Demographic differences and trends of vitamin D insufficiency in the US population, 1988-2004. Arch Intern Med. 2009; 169(6): 626–632. https://doi.org/10.1001/archinternmed.2008.604
- Heidari B, Haji Mirghassemi MB. Seasonal variations in serum vitamin D according to age and sex. Casp J Intern Med. 2012; 3(4): 535–540.
- Nesby-O’Dell S, Scanlon KS, Cogswell ME, Gillespie C, Hollis BW, Looker AC, et al. Hypovitaminosis D prevalence and determinants among African American and white women of reproductive age: third National Health and Nutrition Examination Survey, 1988-1994. Am J Clin Nutr. 2002; 76(1): 187–192. https://doi.org/10.1093/ajcn/76.1.187
- Gaugris S, Heaney RP, Boonen S, Kurth H, Bentkover JD, Sen SS. Vitamin D inadequacy among post-menopausal women: a systematic review. QJM. 2005; 98(9): 667–676. https://doi.org/10.1093/qjmed/hci096
- Gordon CM, DePeter KC, Feldman HA, Grace E, Emans SJ. Prevalence of vitamin D deficiency among healthy adolescents. Arch Pediatr Adolesc Med. 2004;158(6): 531–537. https://doi.org/10.1001/archpedi.158.6.531
- Fraser L-A, Adachi JD. Glucocorticoid-induced osteoporosis: treatment update and review. Ther Adv Musculoskelet Dis. 2009; 1(2): 71–85. https://dx.doi.org/10.1177%2F1759720X09343729
- Sullivan SS, Rosen CJ, Halteman WA, Chen TC, Holick MF. Adolescent girls in Maine are at risk for vitamin D insufficiency. J Am Diet Assoc. 2005;105(6): 971–974. https://doi.org/10.1016/j.jada.2005.03.002
- Walsh JS, Bowles S, Evans AL. Vitamin D in obesity. Curr Opin Endocrinol Diabetes Obes. 2017; 24(6): 389–394. https://doi.org/10.1097/med.0000000000000371
- Doǧruel F, Gonen Z, Canpolat D, Ocak H, Bayram F. Investigation of Vitamin D levels in medical staff in a dental clinic. Niger J Clin Pract. 2019; 22(4): 573–577. https://doi.org/10.4103/njcp.njcp_523_18
- Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020; 382(8): 727–733. https://doi.org/10.1056/nejmoa2001017
- Yin Y, Wunderink RG. MERS, SARS and other coronaviruses as causes of pneumonia. Respirology. 2018; 23(2): 130–137. https://dx.doi.org/10.1111%2Fresp.13196
- Song Z, Xu Y, Bao L, Zhang L, Yu P, Qu Y, et al. From SARS to MERS, Thrusting Coronaviruses into the Spotlight. Viruses. 2019; 11(1): 59. https://dx.doi.org/10.3390%2Fv11010059
- McCartney DM, Byrne DG. Optimisation of Vitamin D Status for Enhanced Immuno-protection Against COVID-19. Ir Med J. 2020; 113(4): 58.
- Ribeiro H, Santana K, Oliver S, Rondó P, Mendes M, Charlton K, et al. Does Vitamin D play a role in the management of COVID-19 in Brazil? Rev Saude Publica. 2020; 54:53. https://doi.org/10.11606/s1518-8787.2020054002545
- Panfili FM, Roversi M, D’Argenio P, Rossi P, Cappa M, Fintini D. Possible role of vitamin D in COVID-19 infection in pediatric population. J Endocrinol Invest. 2020. https://doi.org/10.1007/s40618-020-01327-0
- Grant WB, Lahore H, McDonnell SL, Baggerly CA, French CB, Aliano JL, et al. Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths. Nutrients. 2020; 12(4): 988. https://doi.org/10.3390/nu12040988
- Ross AC, Taylor CL, Yaktine AL, Del Valle HB. Dietary Reference Intakes for Calcium and Vitamin D. Washington (DC): National Academies Press (US); 2011. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK56070/
- Heaney RP. Guidelines for optimizing design and analysis of clinical studies of nutrient effects. Nutr Rev. 2014; 72(1): 48–54. https://doi.org/10.1111/nure.12090
- Pludowski P, Holick MF, Grant WB, Konstantynowicz J, Mascarenhas MR, Haq A, et al. Vitamin D supplementation guidelines. J Steroid Biochem Mol Biol. 2018; 175: 125–135. https://doi.org/10.1016/j.jsbmb.2017.01.021
- Pludowski P, Karczmarewicz E, Bayer M, Carter G, Chlebna-Sokol D, Czech-Kowalska J, et al. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe - recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. Endokrynol Pol. 2013: 64(4): 319–327. https://doi.org/10.5603/ep.2013.0012
- Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab. 2011; 96(1): 53–58. https://doi.org/10.1210/jc.2010-2704
- Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011; 96(7): 1911–1930. https://doi.org/10.1210/jc.2011-0385
- Spedding S, Vanlint S, Morris H, Scragg R. Does vitamin D sufficiency equate to a single serum 25-hydroxyvitamin D level or are different levels required for non-skeletal diseases? Nutrients. 2013; 5(12): 5127–5139. https://doi.org/10.3390/nu5125127
- Heaney RP, Recker RR, Grote J, Horst RL, Armas LAG. Vitamin D(3) is more potent than vitamin D(2) in humans. J Clin Endocrinol Metab. 2011; 96(3): 447–452. https://doi.org/10.1210/jc.2010-2230
- Chang S-W, Lee H-C. Vitamin D and health - The missing vitamin in humans. Pediatr Neonatol. 2019; 60(3): 237–244. https://doi.org/10.1016/j.pedneo.2019.04.007
- Watkins RR, Lemonovich TL, Salata RA. An update on the association of vitamin D deficiency with common infectious diseases. Can J Physiol Pharmacol. 2015; 93(5): 363–368. https://doi.org/10.1139/cjpp-2014-0352
- Meng L, Hua F, Bian Z. Coronavirus Disease 2019 (COVID-19): Emerging and Future Challenges for Dental and Oral Medicine. J Dent Res. 2020; 99(5): 481–487. https://doi.org/10.1177/0022034520914246
- Bartzela T, Türp JC, Motschall E, Maltha JC. Medication effects on the rate of orthodontic tooth movement: a systematic literature review. Am J Orthod Dentofac Orthop. 2009; 135(1): 16–26. https://doi.org/10.1016/j.ajodo.2008.08.016
- Collins MK, Sinclair PM. The local use of vitamin D to increase the rate of orthodontic tooth movement. Am J Orthod Dentofacial Orthop. 1988; 94(4): 278–284. https://doi.org/10.1016/0889-5406(88)90052-2
- Javed F, Malmstrom H, Kellesarian SV, Al-Kheraif AA, Vohra F, Romanos GE. Efficacy of Vitamin D3 Supplementation on Osseointegration of Implants. Implant Dent. 2016; 25(2): 281–287. https://doi.org/10.1097/id.0000000000000390
- Blanco J, Díaz R, Gross H, Rodríguez N, Hernádez LR. Efecto de la administración sistémica de 1,25 dihidroxicolecalciferol sobre la velocidad del movimiento ortodóncico en humanos. Rev Odontos. 2001; 8: 13.
Referencias
Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol [Internet]. 2014;21(3):319–29. Available from: http://dx.doi.org/10.1016/j.chembiol.2013.12.016
Lang PO, Aspinall R. Vitamin D Status and the Host Resistance to Infections: What It Is Currently (Not) Understood. Clin Ther [Internet]. 2017;39(5):930–45. Available from: http://dx.doi.org/10.1016/j.clinthera.2017.04.004
Hewison M. An update on vitamin D and human immunity. Clin Endocrinol (Oxf). 2012;76(3):315–25.
Beard JA, Bearden A, Striker R. Vitamin D and the anti-viral state. J Clin Virol [Internet]. 2011;50(3):194–200. Available from: http://dx.doi.org/10.1016/j.jcv.2010.12.006
Lang PO, Samaras N, Samaras D, Aspinall R. How important is vitamin D in preventing infections? Osteoporos Int. 2013;24(5):1537–53.
Carlberg C, Seuter S, Heikkinen S. The first genome-wide view of vitamin D receptor locations and their mechanistic implications. Anticancer Res. 2012 Jan;32(1):271–82.
Cannell JJ, Vieth R, Umhau JC, Holick MF, Grant WB, Madronich S, et al. Epidemic influenza and vitamin D. Epidemiol Infect. 2006;134(6):1129–40.
Liu W, Zhang L, Xu H-J, Li Y, Hu C-M, Yang J-Y, et al. The Anti-Inflammatory Effects of Vitamin D in Tumorigenesis. Int J Mol Sci [Internet]. 2018 Sep 13;19(9):2736. Available from: https://pubmed.ncbi.nlm.nih.gov/30216977
Hansdottir S, Monick MM. Vitamin D Effects on Lung Immunity and Respiratory Diseases [Internet]. 1st ed. Vol. 86, Vitamins and Hormones. Elsevier Inc.; 2011. 217–237 p. Available from: http://dx.doi.org/10.1016/B978-0-12-386960-9.00009-5
Liu PT, Stenger S, Li H, Wenzel L, Tan BH, Krutzik SR, et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science. 2006 Mar;311(5768):1770–3.
Skrobot A, Demkow U, Wachowska M. Immunomodulatory Role of Vitamin D: A Review. Adv Exp Med Biol. 2018;1108:13–23.
Greiller CL, Martineau AR. Modulation of the immune response to respiratory viruses by vitamin D. Nutrients. 2015;7(6):4240–70.
Cao Z, Wu Y, Faucon E, Sabatier J-M. SARS-CoV-2 & Covid-19: Key-Roles of the “Renin-Angiotensin” System / Vitamin D Impacting Drug and Vaccine Developments. Vol. 20, Infectious disorders drug targets. United Arab Emirates; 2020. p. 348–9.
Martín Giménez VM, Inserra F, Tajer CD, Mariani J, Ferder L, Reiter RJ, et al. Lungs as target of COVID-19 infection: Protective common molecular mechanisms of vitamin D and melatonin as a new potential synergistic treatment. Life Sci. 2020 Aug;254:117808.
Isaia G, Medico E. Possible prevention and therapeutic role of vitamin D in the management of the Covid-19. 2020 pandemics University of Turin 2020 available from https://minapim.com/en/possible-preventive-and-therapeutic-role-of-vitamin-d-in-the-management-of-the-covid-19-pandemic/
McCullough PJ, Lehrer DS, Amend J. Daily oral dosing of vitamin D3 using 5000 TO 50,000 international units a day in long-term hospitalized patients: Insights from a seven year experience. J Steroid Biochem Mol Biol. 2019;189(January):228–39.
Hossein-Nezhad A, Holick MF. Vitamin D for health: A global perspective. Mayo Clin Proc [Internet]. 2013;88(7):720–55. Available from: http://dx.doi.org/10.1016/j.mayocp.2013.05.011
Borella E, Nesher G, Israeli E, Shoenfeld Y. Vitamin D: A new anti-infective agent? Ann N Y Acad Sci. 2014;1317(1):76–83.
Benskin L. A Basic Review of the Preliminary Evidence That COVID-19 Risk and Severity Is Increased in Vitamin D Deficiency. Front Public Heal. 2020 Sep 10;8:513.
D’Avolio A, Avataneo V, Manca A, Cusato J, De Nicolò A, Lucchini R, et al. 25-Hydroxyvitamin D Concentrations Are Lower in Patients with Positive PCR for SARS-CoV-2. Nutrients. 2020 May;12(5).
Haney EM, Stadler D, Bliziotes MM. Vitamin D insufficiency in internal medicine residents. Calcif Tissue Int. 2005 Jan;76(1):11–6.
Erden G, Ozdemir S, Ozturk G, Erden A, Kara D, Isik S, et al. Vitamin D Levels of Anesthesia Personnel, Office Workers and Outdoor Workers in Ankara, Turkey. Clin Lab. 2016;62(5):931–7.
Premaor MO, Paludo P, Manica D, Paludo AP, Rossatto ER, Scalco R, et al. Hypovitaminosis D and secondary hyperparathyroidism in resident physicians of a general hospital in southern Brazil. J Endocrinol Invest. 2008;31(11):991–5.
Mahdy S, Al-Emadi SA, Khanjar IA, Hammoudeh MM, Sarakbi HA, Siam AM, et al. Vitamin D status in health care professionals in Qatar. Saudi Med J. 2010 Jan;31(1):74–7.
Rajebi H, Khodadad A, Fahimi G, Abolhassani H. Vitamin D deficiency among female nurses of children’s medical center hospital and its related factors. Acta Med Iran. 2016;54(2):146–50.
Varkal M, Yildiz I, Saygili S, Yildiz M, Kildic A, Darendeliler F, et al. One of the risk groups for Vitamin D Deficiency: Health Workers. İst Tıp Fak Derg. 2015 Jan 1;78(2):41–5.
T. Chen, Z. Lu MFH. Photobiology of Vitamin D, in: M.F. Holick (Ed.), Vitamin D. Mol Biol Clin Appl. 2010;25(1):175–87.
Pludowski P, Holick MF, Pilz S, Wagner CL, Hollis BW, Grant WB, et al. Vitamin D effects on musculoskeletal health, immunity, autoimmunity, cardiovascular disease, cancer, fertility, pregnancy, dementia and mortality-A review of recent evidence. Autoimmun Rev [Internet]. 2013;12(10):976–89. Available from: http://dx.doi.org/10.1016/j.autrev.2013.02.004
Martineau AR, Jolliffe DA, Hooper RL, Greenberg L, Aloia JF, Bergman P, et al. Vitamin D supplementation to prevent acute respiratory tract infections: Systematic review and meta-analysis of individual participant data. BMJ. 2017;356.
Zhou Y-F, Luo B-A, Qin L-L. The association between vitamin D deficiency and community-acquired pneumonia: A meta-analysis of observational studies. Medicine (Baltimore). 2019 Sep;98(38):e17252.
Slow S, Epton M, Storer M, Thiessen R, Lim S, Wong J, et al. Effect of adjunctive single high-dose vitamin D3 on outcome of community-acquired pneumonia in hospitalised adults: The VIDCAPS randomised controlled trial. Sci Rep. 2018;8(1):1–9.
Zdrenghea MT, Makrinioti H, Bagacean C, Bush A, Johnston SL, Stanciu LA. Vitamin D modulation of innate immune responses to respiratory viral infections. Rev Med Virol. 2017 Jan;27(1).
Bals R, Wang X, Zasloff M, Wilson JM. The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface. Proc Natl Acad Sci U S A. 1998;95(16):9541–6.
Rosen Y, Daich J, Soliman I, Brathwaite E, Shoenfeld Y. Vitamin D and autoimmunity. Scand J Rheumatol. 2016;45(6):439–47.
Ginde AA, Liu MC, Camargo CAJ. Demographic differences and trends of vitamin D insufficiency in the US population, 1988-2004. Arch Intern Med. 2009 Mar;169(6):626–32.
Heidari B, Haji Mirghassemi MB. Seasonal variations in serum vitamin D according to age and sex. Casp J Intern Med. 2012;3(4):535–40.
Nesby-O’Dell S, Scanlon KS, Cogswell ME, Gillespie C, Hollis BW, Looker AC, et al. Hypovitaminosis D prevalence and determinants among African American and white women of reproductive age: third National Health and Nutrition Examination Survey, 1988-1994. Am J Clin Nutr. 2002 Jul;76(1):187–92.
Gaugris S, Heaney RP, Boonen S, Kurth H, Bentkover JD, Sen SS. Vitamin D inadequacy among post-menopausal women: a systematic review. QJM. 2005 Sep;98(9):667–76.
Gordon CM, DePeter KC, Feldman HA, Grace E, Emans SJ. Prevalence of vitamin D deficiency among healthy adolescents. Arch Pediatr Adolesc Med. 2004 Jun;158(6):531–7.
Fraser L-A, Adachi JD. Glucocorticoid-induced osteoporosis: treatment update and review. Ther Adv Musculoskelet Dis [Internet]. 2009 Apr;1(2):71–85. Available from: https://pubmed.ncbi.nlm.nih.gov/22870429
Sullivan SS, Rosen CJ, Halteman WA, Chen TC, Holick MF. Adolescent girls in Maine are at risk for vitamin D insufficiency. J Am Diet Assoc. 2005 Jun;105(6):971–4.
Walsh JS, Bowles S, Evans AL. Vitamin D in obesity. Curr Opin Endocrinol Diabetes Obes. 2017;24(6):389–94.
Doǧruel F, Gonen Z, Canpolat D, Ocak H, Bayram F. Investigation of Vitamin D levels in medical staff in a dental clinic. Niger J Clin Pract. 2019;22(4):573–7.
Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020 Feb;382(8):727–33.
Yin Y, Wunderink RG. MERS, SARS and other coronaviruses as causes of pneumonia. Respirology. 2018 Feb;23(2):130–7.
Song Z, Xu Y, Bao L, Zhang L, Yu P, Qu Y, et al. From SARS to MERS, Thrusting Coronaviruses into the Spotlight. Viruses. 2019 Jan;11(1).
McCartney DM, Byrne DG. Optimisation of Vitamin D Status for Enhanced Immuno-protection Against Covid-19. Ir Med J [Internet]. 2020;113(4):58. Available from: http://www.ncbi.nlm.nih.gov/pubmed/32268051
Ribeiro H, Santana K, Oliver S, Rondó P, Mendes M, Charlton K, et al. Does Vitamin D play a role in the management of Covid-19 in Brazil? Rev Saude Publica. 2020 Jan 1;54:53.
Panfili FM, Roversi M, D’Argenio P, Rossi P, Cappa M, Fintini D. Possible role of vitamin D in Covid-19 infection in pediatric population. J Endocrinol Invest [Internet]. 2020; Available from: https://doi.org/10.1007/s40618-020-01327-0
Grant WB, Lahore H, McDonnell SL, Baggerly CA, French CB, Aliano JL, et al. Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths. Nutrients. 2020;12(4):988.
Ross AC, Taylor CL, Yaktine AL, Del Valle HB. Dietary Reference Intakes for Calcium and Vitamin D. Washington (DC): National Academies Press (US); 2011. 3 p. Available from: https://www.ncbi.nlm.nih.gov/books/NBK56070/ doi: 10.17226/13050
Heaney RP. Guidelines for optimizing design and analysis of clinical studies of nutrient effects. Nutr Rev. 2014 Jan;72(1):48–54.
Pludowski P, Holick MF, Grant WB, Konstantynowicz J, Mascarenhas MR, Haq A, et al. Vitamin D supplementation guidelines. J Steroid Biochem Mol Biol. 2018;175(2016):125–35.
Pludowski P, Karczmarewicz E, Bayer M, Carter G, Chlebna-Sokol D, Czech-Kowalska J, et al. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe - recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. Vol. 64, Endokrynologia Polska. Poland; 2013. p. 319–27.
Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab. 2011 Jan;96(1):53–8.
Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011 Jul;96(7):1911–30.
Spedding S, Vanlint S, Morris H, Scragg R. Does vitamin D sufficiency equate to a single serum 25-hydroxyvitamin D level or are different levels required for non-skeletal diseases? Nutrients [Internet]. 2013 Dec 16;5(12):5127–39. Available from: https://pubmed.ncbi.nlm.nih.gov/24352091
Heaney RP, Recker RR, Grote J, Horst RL, Armas LAG. Vitamin D(3) is more potent than vitamin D(2) in humans. J Clin Endocrinol Metab. 2011 Mar;96(3):E447-52.
Chang S-W, Lee H-C. Vitamin D and health - The missing vitamin in humans. Pediatr Neonatol. 2019 Jun;60(3):237–44.
Watkins RR, Lemonovich TL, Salata RA. An update on the association of vitamin D deficiency with common infectious diseases1. Can J Physiol Pharmacol. 2015;93(5):363–8.
Meng L, Hua F, Bian Z. Coronavirus Disease 2019 (COVID-19): Emerging and Future Challenges for Dental and Oral Medicine. J Dent Res. 2020 May;99(5):481–7.
Bartzela T, Türp JC, Motschall E, Maltha JC. Medication effects on the rate of orthodontic tooth movement: a systematic literature review. Am J Orthod Dentofac Orthop Off Publ Am Assoc Orthod its Const Soc Am Board Orthod. 2009 Jan;135(1):16–26.
Collins MK, Sinclair PM. The local use of vitamin D to increase the rate of orthodontic tooth movement. Am J Orthod Dentofacial Orthop [Internet]. 1988;94(4):278–84. Available from: http://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=reference&D=med3&NEWS=N&AN=3177281
Javed F, Malmstrom H, Kellesarian SV, Al-Kheraif AA, Vohra F, Romanos GE. Efficacy of Vitamin D3 Supplementation on Osseointegration of Implants. Implant Dent. 2016 Apr;25(2):281–7.
Blanco J, Díaz R, Gross H, Rodriguez N, Hernadez LR. Efecto de la administracion sistemica de 1,25 dihidroxicolecalciferol sobre la velocidad del movimiento ortodoncico en humanos.pdf. Rev Odontos. 2001;Edición 8:13.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Harold Samuel Noguera Oll, Maria Paula Quintero Gómez, Dora Eugenia Ordóñez Daza, Bruno Gutierrez Quiceno. (2024). Eating disorders and their impacts in dentistry: an examination of case management evidence . Revista Med, 32(1), p.51. https://doi.org/10.18359/rmed.6954.
2. Maryam Afraie, Pourya Bahrami, Parisa Kohnepoushi, Sorour Khateri, Lobat Majidi, Lotfollah Saed, Kamran Zamani, Hedyeh Mohammadi Baharm, Yousef Moradi, Farhad Moradpour, Asirvatham Alwin Robert. (2024). The Effect of Vitamin D Supplementation on Glycemic Control and Cardiovascular Risk Factors in Type 2 Diabetes: An Updated Systematic Review and Meta‐Analysis of Clinical Trials. Journal of Diabetes Research, 2024(1) https://doi.org/10.1155/2024/9960656.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2020 Diego Fernando López

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la licencia Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
- Una vez sometido el artículo no se aceptaran cambios respecto a la incorporación o retiro de autores.






















