Diferencias fenotípicas de fibroblastos gingivales en sujetos con hiperplasia gingival idiopática frente a sujetos periodontalmente sanos: estudio piloto
Phenotypic differences of gingival fibroblasts in subjects with idiopathic gingival hyperplasia versus periodontally healthy subjects: a pilot study
DOI:
https://doi.org/10.15446/aoc.v11n2.88890Palabras clave:
Encía, Fibroblastos, Citoesqueleto de actina, Vimentina, Mitocondria, Hiperplasia gingival; (es)Gingival Hypertrophy, Gingiva, Fibroblasts, Actin cytoskeleton, Vimentin, Mitochondria, Fluorescent antibody technique indirect. (en)
Objetivo: identificar, describir y diferenciar las características fenotípicas de los fibroblastos gingivales (FGs) en pacientes con hiperplasia gingival idiopática (HGI) e individuos periodontalmente sanos. Métodos: los FGs fueron aislados a partir de tejido gingival de individuos periodontalmente sanos (n=2) y pacientes con HGI (n=2). Los FGs se cultivaron en el medio DMEM (Dulbecco's Modified of Eagle Medium) a 37°C con 5% de CO2. La identificación y localización de la actina, vimentina y mitocondrias en FGs fue realizada y evaluada microscópicamente mediante inmunofluorescencia con anticuerpos monoclonales. La capacidad de migración de los FGs en los pacientes con HGI e individuos sanos también fue estudiada. Resultados: todos los FGs fueron mononucleares, fusiformes y con prolongaciones citoplasmáticas visibles. La faloidina permitió identificar una densa red de actina en los FGs de pacientes con HGI, contrariamente a los FGs de individuos periodontalmente sanos. La vimentina y mitocondrias fueron identificadas en los FGs de individuos sanos y pacientes con HGI sin ninguna alteración en su expresión y localización. La migración de la monocapa de los FGs indicó una actividad de migración celular importante en los FGs de los pacientes con HGI, en relación a los FGs de los individuos periodontalmente sanos. Conclusión: los FGs de pacientes con HGI conservan características fenotípicas celulares similares a los FGs de individuos periodontalmente sanos. Sin embargo, los FGs de pacientes con HGI simulan tener una mayor capacidad migratoria que amerita ser explorada en futuros trabajos de investigación.
Objective: To identify and to describe the phenotypic characteristics of gingival fibroblasts from patients with idiopathic gingival hyperplasia (IGH) and periodontally healthy individuals. Methods: Gingival fibroblasts (GFs) were isolated from gingival tissue from periodontally healthy individuals (n=2) and patients with IGH (n=2). The GFs were grown in DMEM (Dulbecco’s Modified of Eagle Medium) at 37°C with 5% CO2. The identification and location of actin, vimentin and mitochondria in GFs were performed and evaluated microscopically by immunofluorescence with monoclonal antibodies. The migration capacity of GFs from IGH and healthy individuals was also studied. Results: All the GFs were mononuclear, fusiform and with visible cytoplasmic extensions. The phalloidin allowed to identify a dense actin network in the GFs of patients with IGH, contrary to the GFs of periodontally healthy individuals. Vimentin and mitochondria were identified in the GFs of healthy individuals and patients with IGH without any alteration in their expression and location. Monolayer migration of GFs indicates significant cell migration activity in the GFs of patients with IGH in relation to the GFs of periodontally healthy individuals. Conclusion: GFs from patients with IGH retain cellular phenotypic characteristic similar to GFs from periodontally healthy individuals. However, the GFs of patients with IGH simulate having a greater migratory capacity that deserves to be explored in future research works.
Diferencias fenotípicas de fibroblastos gingivales en sujetos con hiperplasia gingival idiopática frente a sujetos periodontalmente sanos: estudio piloto
Phenotypic differences of gingival fibroblasts in subjects with idiopathic gingival hyperplasia versus periodontally healthy subjects: a pilot study
Víctor Hugo Simancas–Escorcia, Antonio José Díaz–Caballero, Clara Inés Vergara–Hernández
|
Recibido |
Aprobado |
Publicado |
|
05/07/2020 |
07/05/2021 |
01/07/2021 |
Citación sugerida:
Simancas–Escorcia VH, Díaz–Caballero AJ, Vergara–Hernández CI. Diferencias fenotípicas de fibroblastos gingivales en sujetos con hiperplasia gingival idiopática frente a sujetos periodontalmente sanos: estudio piloto. Acta Odont Col. 2021; 11(2): -1. Disponible en: https://revistas.unal.edu.co/index.php/actaodontocol/article/view/88890
Resumen
Objetivo: identificar, describir y diferenciar las características fenotípicas de los fibroblastos gingivales (FGs) en pacientes con hiperplasia gingival idiopática (HGI) e individuos periodontalmente sanos. Métodos: los FGs fueron aislados a partir de tejido gingival de individuos periodontalmente sanos (n=2) y pacientes con HGI (n=2). Los FGs se cultivaron en el medio DMEM (Dulbecco’s Modified of Eagle Medium) a 37°C con 5% de CO2. La identificación y localización de la actina, vimentina y mitocondrias en FGs fue realizada y evaluada microscópicamente mediante inmunofluorescencia con anticuerpos monoclonales. La capacidad de migración de los FGs en los pacientes con HGI e individuos sanos también fue estudiada. Resultados: todos los FGs fueron mononucleares, fusiformes y con prolongaciones citoplasmáticas visibles. La faloidina permitió identificar una densa red de actina en los FGs de pacientes con HGI, contrariamente a los FGs de individuos periodontalmente sanos. La vimentina y mitocondrias fueron identificadas en los FGs de individuos sanos y pacientes con HGI sin ninguna alteración en su expresión y localización. La migración de la monocapa de los FGs indicó una actividad de migración celular importante en los FGs de los pacientes con HGI, en relación a los FGs de los individuos periodontalmente sanos. Conclusión: los FGs de pacientes con HGI conservan características fenotípicas celulares similares a los FGs de individuos periodontalmente sanos. Sin embargo, los FGs de pacientes con HGI simulan tener una mayor capacidad migratoria que amerita ser explorada en futuros trabajos de investigación.
Palabras clave: hiperplasia gingival; encía; fibroblastos; citoesqueleto de actina; vimentina; mitocondria; inmunofluorescencia indirecta.
Abstract
Objective: To identify and to describe the phenotypic characteristics of gingival fibroblasts from patients with idiopathic gingival hyperplasia (IGH) and periodontally healthy individuals. Methods: Gingival fibroblasts (GFs) were isolated from gingival tissue from periodontally healthy individuals (n=2) and patients with IGH (n=2). The GFs were grown in DMEM (Dulbecco’s Modified of Eagle Medium) at 37°C with 5% CO2. The identification and location of actin, vimentin and mitochondria in GFs were performed and evaluated microscopically by immunofluorescence with monoclonal antibodies. The migration capacity of GFs from IGH and healthy individuals was also studied. Results: All the GFs were mononuclear, fusiform and with visible cytoplasmic extensions. The phalloidin allowed to identify a dense actin network in the GFs of patients with IGH, contrary to the GFs of periodontally healthy individuals. Vimentin and mitochondria were identified in the GFs of healthy individuals and patients with IGH without any alteration in their expression and location. Monolayer migration of GFs indicates significant cell migration activity in the GFs of patients with IGH in relation to the GFs of periodontally healthy individuals. Conclusion: GFs from patients with IGH retain cellular phenotypic characteristic similar to GFs from periodontally healthy individuals. However, the GFs of patients with IGH simulate having a greater migratory capacity that deserves to be explored in future research works.
Key words: Gingival Hyperplasia; Gingiva; Fibroblasts; Actin cytoskeleton; Vimentin; Mitochondria; Indirect immunofluorescence.
Introducción
La hiperplasia gingival (HG) es una condición patológica heterogénea caracterizada por el aumento excesivo de los elementos del tejido conectivo de la encía libre, adherida e interpapilar. Las formas severas de HG causan problemas funcionales y de fonación, además, de problemas estéticos y psicológicos (1, 2). La HG es de evolución lenta, progresiva, generalizada o localizada (3). La etiología de esta condición patológica no está bien establecida. Sin embargo, esta estaría relacionada con enfermedades hereditarias, neoplasias, tratamiento ortodóntico, la ingesta prolongada de ciertos medicamentos y factores idiopáticos (4-6). En la actualidad, no existe un tratamiento curativo para la HG.
La HG hereditaria es una enfermedad rara que puede desarrollarse como un trastorno patológico aislado o sindrómico. Se estima que tiene una prevalencia de 1/175000 y que afecta, indistintamente, a hombres y mujeres (7, 8). A diferencia de la HG hereditaria, en la hiperplasia gingival idiopática (HGI) el agente causal responsable no se ha establecido. De manera general, la HG pone en evidencia un tejido epitelial paraqueratinizado e hiperplásico con crestas epiteliales engrosadas y algunas de ellas fusionadas. El tejido conectivo de pacientes con HG es denso y abundante en fibras de colágeno. Esta acumulación excesiva de colágeno, principalmente, colágeno tipo I y tipo III, parece ser una característica común en todas las formas de HG, incluso, en pacientes con HGI (9).
Aunque los mecanismos celulares y moleculares que participan en el aumento del colágeno de tejidos gingivales de pacientes con HG son desconocidos, estos, probablemente, obedecen a un desequilibrio en la homeostasis de moléculas que participan en la degradación de la matriz extracelular (MEC), como las metaloproteinasas de la matriz (MMPs) y factores que promueven la proliferación de los FGs (1, 10). Los FGs son células mononucleares, referenciadas como las más numerosas del tejido conectivo gingival (~200.106 células por cm3 de tejido), cuyas funciones favorecen el remodelaje, homeostasis y cicatrización tisular (11).
La escasa información sobre los aspectos morfológicos de los FGs en procesos de HGI, sumada a los hallazgos histológicos que indican una acumulación de las fibras de colágeno en los tejidos gingivales, justifica la realización de estudios morfológicos en los FGs de estos pacientes a través de diferentes marcadores citoplasmáticos. Por lo anterior, el objetivo de este estudio fue identificar, describir y diferenciar las características fenotípicas de los FGs en pacientes con HGI.
Métodos
Participantes
Como participantes se incluyeron cuatro sujetos que se dividieron en dos grupos de estudio; el primero, integrado por individuos periodontalmente sanos (encías rosadas en ausencia de sangrado) (control; n=2) y el segundo, compuesto por personas diagnosticadas con HGI (test: n=2), atendidas en el Centro de Referencia de Hipertrofia Gingival de la Facultad de Odontología de la Universidad de Cartagena, Colombia. Los participantes fueron mayores de 18 años, no se encontraban bajo tratamiento farmacológico ni eran fumadores. Todos presentaron un buen estado de salud sistémica luego de una evaluación médica-odontológica, la cual fue corroborada con la información registrada en sus respectivas historias clínicas. Se excluyeron mujeres en estado de embarazo, personas con cirugía periodontal inferior a 1 año, con signo radiográfico de pérdida ósea y con periodontitis. El estudio incluyó 3 hombres (1 con diagnóstico de HGI y 2 individuos periodontalmente sanos) y 1 mujer con HGI. La edad promedio de los sujetos participantes fue de 21 años.
Respecto a las muestras de tejido gingival, estas fueron obtenidas previamente con la realización de una fase higiénica periodontal, llevada a cabo siete días antes del procedimiento quirúrgico. Las muestras del grupo control se obtuvieron luego de un alargamiento coronal por razones estéticas o protésicas y en el grupo test, por gingivectomía. Ambas intervenciones quirúrgicas las realizó un periodoncista bajo anestesia infiltrativa con lidocaína 2% y epinefrina 1:80000 en el área quirúrgica, con previa incisión a bisel externo e intrasulcular con bisturí Bard Parker hoja N°15. Una evaluación post-quirúrgica, a los 7 días, permitió verificar una adecuada cicatrización tisular en todos los participantes, sin ninguna complicación. Los tejidos recuperados fueron lavados en solución salina tamponada con fosfato (PBS 1X, Gibco™), a su vez, fueron conservados y transportados en un medio DMEM (Dulbecco’s Modified Eagle Medium - Gibco™) + 1% de penicilina-estreptomicina (10,000 U/mL) (Gibco™).
Cultivo celular
En una campana de flujo laminar y en un recipiente estéril, los tejidos fueron cortados en fragmentos de aproximadamente 2 mm3 y cultivados con el método de explante de acuerdo al protocolo descrito por Simancas et al. (12). Cuando los FGs alcanzaron una confluencia de aproximadamente 90% fueron separadas de su soporte mediante Tripsina (GibcoTM) y cultivadas en caja de Petri estériles (Gosselin™). El medio de cultivo utilizado contenía DMEM (1X) con GlutaMAX™ (Gibco™), 10% de suero fetal bovino-SFB (GibcoTM), 1% de penicilina-estreptomicina (GibcoTM), 1% de aminoácidos esenciales, 0.5% de anfotericina B (GibcoTM) y 50 μm/mL de ácido ascórbico (GibcoTM). Los FGs fueron incubados a 37°C en una atmósfera a 5% de CO2 y los medios de cultivos fueron cambiados cada 48 horas. Todos los experimentos fueron realizados con células entre el segundo y tercer pasaje.
Inmunofluorescencia
Después de una semana de cultivo, las células fueron lavadas en PBS1X (GibcoTM) y fijadas con una solución de paraformaldehído al 4% durante 10 minutos a 4°C. Posteriormente, las células fueron permeabilizadas con 0.5% de un agente tensoactivo no iónico (Triton X-100- Sigma-Aldrich®) e incubadas en una solución de 1% de BSA/glicina (Sigma-Aldrich®) por 20 minutos. Luego, los FGs estuvieron en contacto con los anticuerpos primarios anti-vimentina (Mouse monoclonal Anti-Vimentin antibody, dilución 1:400, clone V9, Sigma-Aldrich) y anti-TOMM20 (Mouse monoclonal Anti-TOMM20 antibody, dilución 1:800, clone 4F3, Sigma-Aldrich) toda la noche a 4°C. Al día siguiente, previo lavado de las células con PBS1X, estas fueron incubadas con el anticuerpo secundario Alexa Fluor 488 donkey anti-mouse (Life Technologies Corporation) durante 2 horas a temperatura ambiente. Los filamentos de actina fueron identificados mediante Alexa FluorTM 594 Phalloidin (Thermo Fisher Scientific) durante 15 minutos, de acuerdo a las recomendaciones del fabricante. Finalmente, se llevó a cabo un marcaje con DAPI (4’,6-diamidino-2-fenilindol-Thermo Fisher; dilución 1:1000) y el montaje con un medio acuoso (Immu-Mount™-Thermo Scientific™). Las observaciones fueron realizadas en el microscopio IXplore Pro (Olympus).
Capacidad de migración
Los FGs de los diferentes pacientes, incluidos en el presente trabajo, fueron cultivados en cajas de 6 pozos por triplicado. Una vez en confluencia (90% aproximadamente), una cicatriz fue realizada con la ayuda de un cono estéril, de acuerdo a lo descrito por Grada et al. (13). Las fotografías fueron realizadas a las 0, 24 y 48 horas, con el fin de evaluar la capacidad de las diferentes poblaciones celulares para migrar.
Consideraciones éticas
Los participantes firmaron un consentimiento informado de acuerdo con lo establecido por el Comité de Ética en Investigaciones de la Universidad de Cartagena, quien otorgó el aval a esta investigación mediante el Acta No. 349902016, con fecha 21/03/2017. Los principios éticos contemplados durante el desarrollo del proyecto fueron promover y velar por la salud, la dignidad, la integridad, el derecho a la autodeterminación, la intimidad y la confidencialidad de la información personal de las personas que participaron en investigación, siguiendo la Declaración de Helsinki (2013). De acuerdo con la Resolución 008430 de 1993, del Ministerio de Salud y Protección Social de Colombia, el proyecto se clasificó como de riesgo mínimo.
Resultados
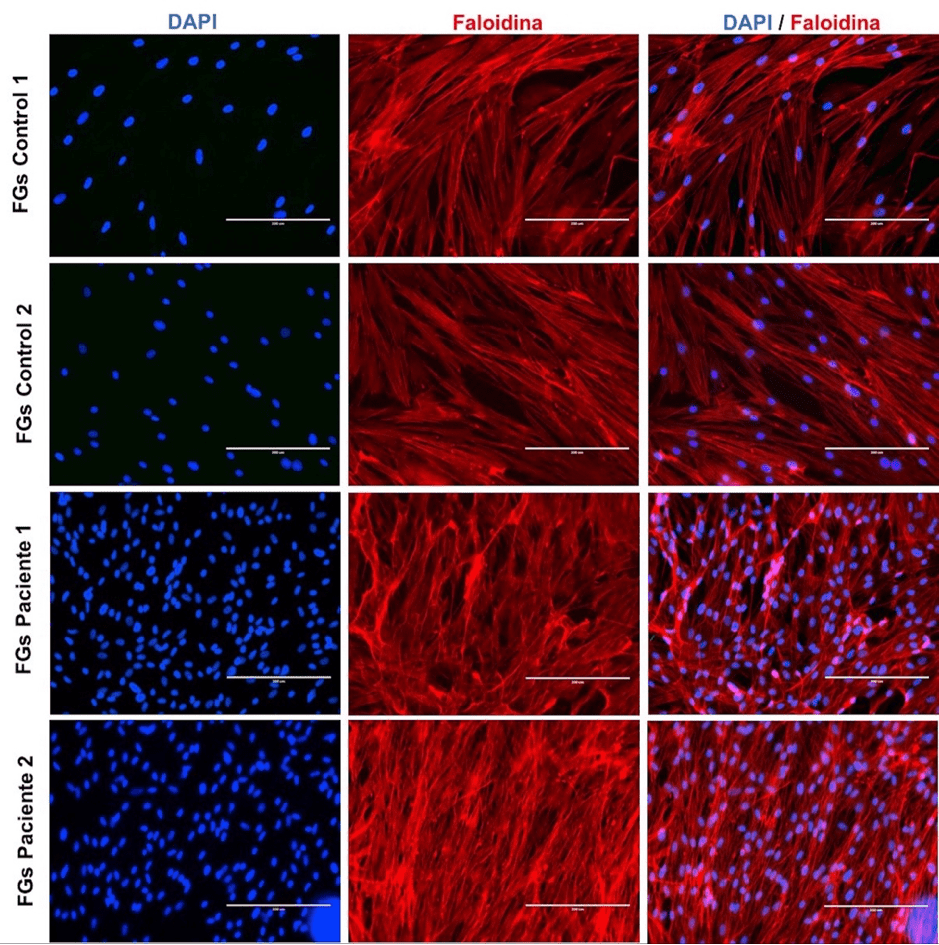
Luego de 21 días de cultivo primario, los FGs migraron alrededor de los explantes de tejido gingival e inmediatamente fueron replicados en cajas de Petri. Después del segundo pasaje (2 semanas), las células formaron una monocapa, característica de los FGs. Estas células presentaron una forma fusiforme, mononuclear; fue evidente la presencia de prolongaciones citoplasmáticas que hacían posible el contacto con otros fibroblastos. La distribución nuclear de los FGs fue identificada por inmunofluorescencia (DAPI), lo que puso en evidencia tanto los núcleos ovalados bien definidos en el grupo control, como en el grupo test. Ninguna alteración microscópica fue observada. Sin embargo, se apreció una cantidad no cuantificable y probablemente mayor de núcleos en los cultivos del grupo test, a diferencia del grupo control. El inmunomarcaje de la actina de los FGs, elemento fundamental en la arquitectura del citoesqueleto y el movimiento celular, fue constatado mediante la faloidina. Este marcaje fluorescente permitió observar los microfilamentos de los FGs. En el grupo test se identificó una densa red de actina (Figura 1).
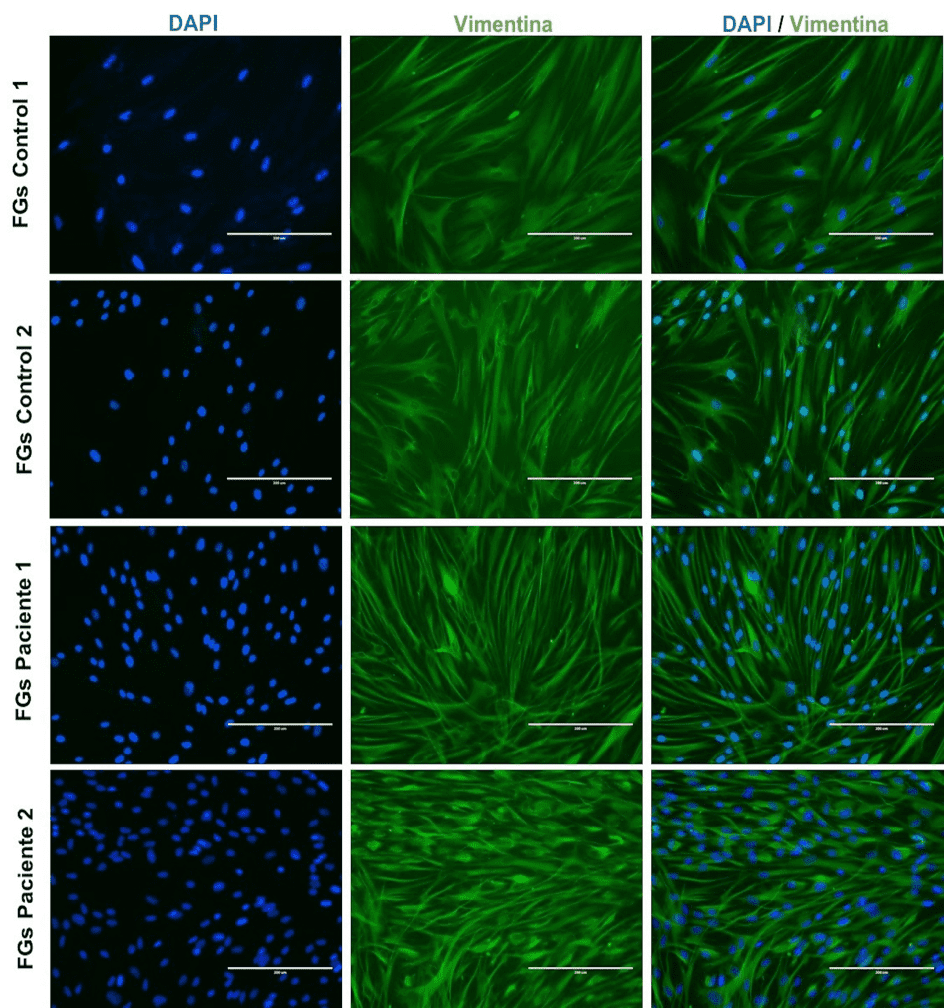
La inmunodetención positiva de la vimentina, proteína fibrosa que hace parte de los filamentos intermedios, fue observada en los FGs de los individuos del grupo control y del grupo test. En la monocapa de los FGs de ambos grupos no se identificó alteraciones en la expresión de la vimentina que hicieran intuir cambios morfológicos o estructurales de las células estudiadas. Aunque, se pudo constatar una red compacta de la expresión de la vimentina en los FGs del grupo test, en contraposición a los FGs del grupo control (Figura 2).
El inmunomarcaje con TOMM20 hizo posible distinguir las mitocondrias en los FGs de individuos del grupo control y pacientes del grupo test (Figura 3). La expresión positiva y distribución de TOMM20 fue similar en todos los FGs de los pacientes evaluados. Así, la detención inmunofluorescente de este marcador reveló una localización citoplasmática y alrededor de la membrana nuclear de los FGs. Ningún cambio en la distribución y localización inmunofluorescente de este marcador fue constatado.
Por su parte, la observación que indica el cierre de la monocapa celular sometida a una herida evidenció una actividad de migración celular visiblemente mayor en los FGs del grupo test, respecto a los FGs del grupo control. En los FGs de los dos pacientes con HGI se identificó una migración probablemente superior, en comparación a los FGs de los individuos periodontalmente sanos después de las 24 y 48 horas. La observación de la capacidad de migración de los FGs de cada uno de los individuos estudiados aquí, parece ser diferente (Figura 4).
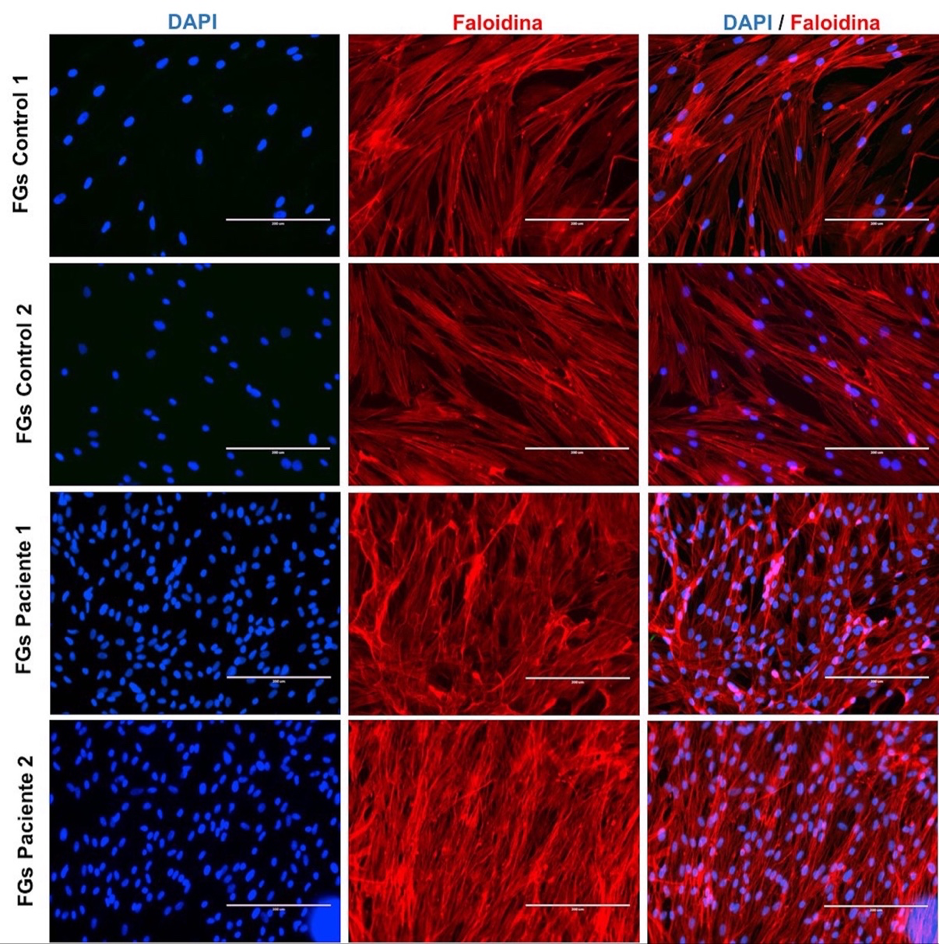
Figura 1. Microfotografía de núcleos y filamentos de actina en fibroblastos gingivales.
Distribución de núcleos y de la estructura del citoesqueleto de los FGs en individuos sin alteraciones gingivales (control 1 y 2) y pacientes con HGI (pacientes 1 y 2) observada con DAPI (azul) y faloidina (rojo), respectivamente. FGs: fibroblastos gingivales. Barra blanca: 200µm.
Fuente: elaboración propia.

Figura 2. Inmunomarcaje de la vimentina en fibroblastos gingivales.
Aspecto de la inmunolocalización de núcleos y filamentos intermedios en FGs de individuos sin alteraciones gingivales (control 1 y 2) y pacientes con HGI (pacientes 1 y 2) mediante DAPI (azul) y vimentina (verde), respectivamente. FGs: fibroblastos gingivales. Barra blanca: 200µm.
Fuente: elaboración propia.

Figura 3. Distribución de inmunomarcaje mitocondrial en fibroblastos gingivales.
Localización inmunofluorescente de núcleos y mitocondrias de los FGs de individuos sin alteraciones gingivales (control 1 y 2) y pacientes con HGI (pacientes 1 y 2), con DAPI (azul) y TOMM20 (verde), respectivamente. FGs: fibroblastos gingivales. Barra blanca: 200µm.
Fuente: elaboración propia.

Figura 4. Capacidad de migración de fibroblastos gingivales.
Fotografías representativas de la migración de la monocapa celular sometida a una herida en fibroblastos gingivales de individuos sin alteraciones gingivales (control 1 y 2) y pacientes con HGI (pacientes 1 y 2). Las líneas blancas muestran los frentes de migración. T0: tiempo cero; H: horas; FGs: fibroblastos gingivales. Objetivo 4x.
Fuente: elaboración propia.
Discusión
El presente estudio piloto identificó los aspectos fenotípicos de los FGs a partir de dos pacientes diagnosticados con HGI e individuos periodontalmente sanos. La HG puede tener un origen genético o presentarse como una entidad patológica idiopática. Esta patología, también, se ha descrito en pacientes con ingesta prolongada de medicamentos como los bloqueadores de calcio, anticonvulsivantes, inmunosupresores e, incluso, en pacientes portadores de tratamiento ortodóntico (14-16). Otros reportes describen pacientes con HG y síndromes relacionados con hipertricosis, retraso mental, macrocefalia, sordera progresiva y querubismo (17-19).
En este estudio, los FGs obtenidos y caracterizados se obtuvieron a partir de pacientes sin ningún grado de consanguineidad, sin medicación farmacológica ni portadores de aparatos de ortodoncia. En ninguno de los participantes se identificaron signos o sintomatología que pudieran dar cuenta de una HG sindrómica, incluidos los individuos con HGI, quienes fueron evaluados por un médico internista y dos patólogos orales. Como hallazgo aislado, se identificó que la HGI es principalmente esporádica. No obstante, también, es posible encontrar pacientes con un patrón de herencia autosómico dominante o muy raramente de herencia autosómica recesiva. No obstante, los pacientes afectados por la HGI estudiados aquí no reportaron antecedentes médicos personales ni familiares relacionados con alguna patología sistémica. Futuros estudios genéticos serán de gran utilidad para descartar o confirmar un posible origen genético.
Morfológicamente, los FGs de los pacientes del grupo test y del grupo control presentaron un aspecto fusiforme, con núcleos voluminosos y prolongaciones bien marcadas. Al respecto, una limitante del presente trabajo de investigación fue la ausencia de análisis estadísticos que evaluara la proliferación de las células fibroblásticas; se pudo observar una cantidad mayor (no cuantificable) de núcleos en los FGs del grupo test en contraste con los FGs del grupo control. Estos resultados son similares a los observados por Gawron K et al. (20) en una investigación donde se evaluaron las características y la tasa de proliferación de los FGs en tres pacientes con HGI. Este estudio demostró un aumento en la proliferación celular de estos pacientes, lo que confirmó la hipótesis que indicaba un mantenimiento del potencial proliferativo de los FGs in vivo e in vitro de los individuos con HGI.
Probablemente, el aumento en la proliferación de los FGs en los pacientes con HGI podría explicarse por la incidencia sobre estas células de factores estimulantes proliferativos, como el factor de crecimiento transformante beta 1(TGF-β1) (21). TGF-β1 ha sido considerado un regulador maestro en la acumulación de la MEC y, consecuentemente, un potencial impulsor de la hiperplasia. Esto, debido a que promueve la producción de fibronectina y colágeno mediante la activación transcripcional de factores de señalización que conducen a la expresión de genes pro-fibróticos como los que codifican para α-SMA, proteínas ECM, citocinas secretadas y factores de crecimiento, que modifican aún más la respuesta celular efectora fibrogénica (22).
Por su parte, la identificación de la actina puso de manifiesto la presencia de los filamentos esenciales del citoesqueleto de los FGs. Sobre esto, es relevante informar que el presente trabajo utilizó la faloidina con fines de visualizar la actina y no con el propósito de cuantificarla. Empero, esta limitación no impidió constatar, en la monocapa de los FGs de pacientes del grupo test, una densa red de actina en relación a los FGs del grupo control. De esta forma, se estima que el nivel de visualización del inmunomarcaje de la actina, en las células de los pacientes pertenecientes al grupo test, obedeció al mayor número de células presentes al momento de su identificación, como eventual consecuencia de una mayor tasa de proliferación de los FGs en cultivo.
La actina, además de asegurar las funciones de adherencia entre las células o con la MEC, también participa en la locomoción y la fagocitosis de moléculas (23). El rol de la actina en la fagocitosis parece iniciar con la internalización de partículas mediante un proceso de interacción receptor-ligando. Segal G et al. (24) han puesto en evidencia la implicación de la actina en la regulación de la fagocitosis del colágeno. Estos autores, al tratar los fibroblastos humanos en cultivo con Latrunculin B (inhibidor de la polimerización de la actina), constataron la desconexión de la actina a los receptores de integrina β1 y el aumento de la unión de las fibras de colágeno. Dichos resultados apoyarían la hipótesis según la cual, la HG es inducida por la reducción de la fagocitosis del colágeno en los FGs a través de la interacción α2β1 en la superficie celular.
De otro lado, en los FGs de los individuos del grupo control y del grupo test se identificó la vimentina sin ninguna alteración aparente. Esto revelaría que esta proteína perteneciente a los filamentos intermediarios, y una de las principales constituyentes del citoesqueleto de células eucarióticas, podría desempeñar un rol importante en la supervivencia y proliferación de los FGs. De hecho, Cheng F et al. (25) describieron el rol de la vimentina en la proliferación y diferenciación celular a partir de un estudio con ratones KO vimentina, con el cual establecieron que la pérdida de la vimentina induce una reducción en el crecimiento de los fibroblastos, lo que a su vez inhibe la señalización de TGF-β1 y la abolición en la acumulación de colágeno. Este estudio demuestra que la vimentina coordina la proliferación de fibroblastos y el depósito de colágeno.
En lo que respecta a las mitocondrias, estas, también, fueron identificadas en los FGs de individuos del grupo control y en los pacientes del grupo test. La identificación de la traslocasa de la membrana externa, subunidad 20 (TOM20) responsable del movimiento de proteínas a través de la membrana hacia el interior del espacio mitocondrial (26), localizada en el citoplasma y cerca de la envoltura nuclear, es un hallazgo que coincide con el reporte de Pêgo et al. (27). Estos autores revelaron en un estudio descriptivo, mediante microscopía electrónica a transmisión en nueve pacientes con HG, la presencia de mitocondrias como unas de las organelas celulares observadas de manera más frecuente.
La migración de los FGs del grupo test fue observada desde las primeras horas de cultivo celular. Esto permitió constatar la destacada capacidad migratoria de estos fibroblastos. Con el uso de esta técnica descriptiva fue evidente que los FGs de pacientes con HGI tienen una cinética de proliferación potencialmente mayor a los FGs de los individuos del grupo control. Lo anterior puede obedecer a un mayor estímulo de los FGs por parte de moléculas como el TGF-β1, explicado en párrafos precedentes, pero, también, es probable comprenderla como una respuesta a la sobreexpresión de CCN2 (connective tissue growth factor), una proteína de la matriz que regula la proliferación y la migración celular. Así, se ha establecido que TGF-β1 induce de manera rápida y potente a CCN2 en los tejidos, con lo cual crea un ambiente adecuado para la fibrogénesis. En los tejidos con HG, CCN2 se asocia directamente con el grado de fibrosis (28). Por ello, el rol TGF-β1/CCN2 requiere ser evaluado en la HGI y establecer su implicación sobre la migración de los FGs en estos pacientes.
Como conclusión de este estudio piloto se establece que los FGs de pacientes con HGI conservan las mismas características fenotípicas celulares de los FGs de individuos periodontalmente sanos. Se ha demostrado por inmunomarcaje de proteínas del citoesqueleto y organelas celulares que la localización de la actina, vimentina y mitocondrias en FGs de pacientes con HGI no presentaría modificaciones en su distribución celular. Los FGs de pacientes con HGI simulan tener una capacidad migratoria destacable que amerita ser explorada a profundidad en otros trabajos de investigación. En general, este estudio preliminar constituyó un primer acercamiento al cultivo celular y análisis morfológico por inmunofluorescencia de los FGs en pacientes con HGI. Futuros estudios deberán ser consagrados a estimar la tasa de proliferación celular, la expresión génica de marcadores pro-fibróticos y rol de proteínas de la MEC en la regulación del colágeno a partir de los FGs de pacientes con HGI. Se estima, que esta información será de gran utilidad para esclarecer el rol de marcadores y probables vías de señalización particulares o comunes a los pacientes que padecen HGI.
Contribuciones de los autores
Víctor Hugo Simancas–Escorcia: concepción del estudio, recolección, análisis de muestras, redacción del artículo. Antonio José Díaz–Caballero: concepción del estudio, recolección, análisis de muestras, redacción del artículo. Clara Inés Vergara–Hernández: recolección, análisis de muestras, redacción del artículo.
Conflictos de interés
Los autores declaran no tener conflictos de intereses.
Referencias
- Pêgo SBP, Coletta RD, Mendes DC, De Faria PR, Melo–Filho MR, Alves–Rodrigues L, et al. Hereditary gingival fibromatosis: clinical and ultrastructural features of a new family. Med Oral Patol Oral Cir Bucal. 2015; 20(2): e150–e155. https://doi.org/doi:10.4317/medoral.20170
- Guzmán–Rivera E, López–Álvarez A, Harris–Ricardo J. Fibromatosis gingival hereditaria: una rara enfermedad. Reporte de una familia. Rev Cienc Salud. 2018; 16(2): 365–372. https://dx.doi.org/10.12804/revistas.urosario.edu.co/revsalud/a.6775
- Silva–Cunha JL, Carvalho da Cruz–Ramos MA, Menezes–Regis DM, Sanchéz–Romero C, de Andrade ME, Torres–Bezerra B, et al. Generalized hereditary gingival fibromatosis in a child: clinical, histopathological and therapeutic aspects. Autops Case Rep. 2020; 10(1): e2020140. https://doi.org/10.4322/acr.2020.140
- Manzur–Villalobos I, Díaz–Rengifo IA, Manzur–Villalobos D, Díaz–Caballero AJ. Agrandamiento gingival farmacoinducido: Serie de casos. Univ. Salud. 2018; 20(1): 89–96. https://doi.org/10.22267/rus.182001.113
- Souza–Pinto A, Severo–Alves L, Do Amaral–Zenkner JE, Batistin–Zanatta FB, Maltz M. Gingival enlargement in orthodontic patients: Effect of treatment duration. Am J Orthod Dentofacial Orthop. 2017; 152(4): 477–482. https://doi.org/10.1016/j.ajodo.2016.10.042
- Boutiou E, Ziogas IA, Giannis D, Doufexi AE. Hereditary gingival fibromatosis in children: a systematic review of the literature. Clin Oral Investig. 2021; 25(6): 3599–3607. https://doi.org/10.1007/s00784-020-03682-x
- Almiñana–Pastor PJ, Buitrago–Vera PJ, Alpiste–Illueca FM, Catalá–Pizarro M. Hereditary gingival fibromatosis: Characteristics and treatment approach. J Clin Exp Dent. 2017; 9(4): e599–e602. https://doi.org/10.4317/jced.53644
- Gawron K, Łazarz–Bartyzel K, Potempa J, Chomyszyn–Gajewska M. Gingival fibromatosis: clinical, molecular and therapeutic issues. Orphanet J Rare Dis. 2016; 11: 9. https://doi.org/10.1186/s13023-016-0395-1
- Jadhav AS, Marathe SP. Recurrent idiopathic gingival fibromatosis with generalized aggressive periodontitis: A rare case report. J Indian Soc Periodontol. 2015; 19(1): 93–95. https://doi.org/10.4103/0972-124X.145833
- Roman–Malo L, Bullon B, de Miguel M, Bullon P. Fibroblasts Collagen Production and Histological Alterations in Hereditary Gingival Fibromatosis. Diseases. 2019; 7(2): 39. https://doi.org/10.3390/diseases7020039
- Simancas–Escorcia V, Díaz–Caballero A. Fisiología y usos terapéuticos de los fibroblastos gingivales. Odous Cientifica. 2019; 20(1): 41–57. Disponible en: http://servicio.bc.uc.edu.ve/odontologia/revista/vol20n1/art05.pdf
- Simancas–Escorcia V, Vergara–Hernández C, Díaz–Caballero A. Influencia del suero fetal bovino en el cultivo de fibroblastos gingivales. Av Odontoestomatol. 2018; 34(6): 299–309. Disponible en: https://scielo.isciii.es/pdf/odonto/v34n6/0213-1285-odonto-34-6-299.pdf
- Grada A, Otero–Vinas M, Prieto–Castrillo F, Obagi Z, Falanga V. Research Techniques Made Simple: Analysis of Collective Cell Migration Using the Wound Healing Assay. J Invest Dermatol. 2017; 137(2): e11–e16. http://doi.org/10.1016/j.jid.2016.11.020
- Gopinath S, Harishkumar VV, Santhosh VC, Puthalath S. Case report on low dose of Cilnidipine: A fourth-generation calcium channel blocker-induced gingival overgrowth. J Indian Soc Periodontol. 2019; 23(4): 377–380. https://doi.org/10.4103/jisp.jisp_557_18
- Alshahrani A, Togoo RA, Kamran MA, Alshahrani I. Clinical periodontal, bacterial, and immunological outcomes of antimicrobial photodynamic therapy in orthodontic treatment-induced gingival enlargement. Photodiagnosis Photodyn Ther. 2020; 31: 101934. https://doi.org/10.1016/j.pdpdt.2020.101934
- Lauritano D, Moreo G, Limongelli L, Tregambi E, Palmieri A, Carinci F. Drug-Induced Gingival Overgrowth: A Pilot Study on the Effect of Diphenylhydantoin and Gabapentin on Human Gingival Fibroblasts. Int J Environ Res Public Health. 2020; 17(21): 8229. https://dx.doi.org/10.3390/ijerph17218229
- Bubna AK, Veeraraghavan M, Anandan S, Rangarajan S. Congenital Generalized Hypertrichosis, Gingival Hyperplasia, a Coarse Facies with Constriction Bands: A Rare Association. Int J Trichology. 2015; 7(2): 67–71. https://doi.org/10.4103/0974-7753.160113
- Diaz–Rojas KA, Simancas–Escorcia V. Caracterización fenotípica del Síndrome de Raine. Cienc Salud Virtual. 2019; 11(2): 131–142. Disponible en: https://revistas.curn.edu.co/index.php/cienciaysalud/article/view/1267
- Gita B, Chandrasekaran S, Manoharan P, Dembla G. Idiopathic gingival fibromatosis associated with progressive hearing loss: A nonfamilial variant of Jones syndrome. Contemp Clin Dent. 2014; 5(2): 260–263. https://doi.org/10.4103/0976-237X.132387
- Gawron K, Łazarz–Bartyzel K, Kowalska A, Bereta G, Nowakowska Z, Plakwicz P, et al. Fibroblasts from recurrent fibrotic overgrowths reveal high rate of proliferation in vitro - findings from the study of hereditary and idiopathic gingival fibromatosis. Connect Tissue Res. 2019; 60(1): 29–39. https://doi.org/10.1080/03008207.2018.1517758
- Hazzaa HH, Gouda OM, Kamal NM, Ali SAM, El Shiekh MAM, Tawfik MM. Expression of CD163 in hereditary gingival fibromatosis: A possible association with TGF-β1. J Oral Pathol Med. 2018; 47(3): 286–292. https://doi.org/10.1111/jop.12679
- Kim KK, Sheppard D, Chapman HA. TGF-β1 Signaling and Tissue Fibrosis. Cold Spring Harb Perspect Biol. 2018; 10(4): a022293. https://doi.org/10.1101/cshperspect.a022293
- Gopal S, Multhaupt HAB, Couchman JR. Calcium in Cell-Extracellular Matrix Interactions. Adv Exp Med Biol. 2020; 1131: 1079–1102. https://doi.org/10.1007/978-3-030-12457-1_43
- Segal G, Lee W, Arora PD, McKee M, Downey G, McCulloch CA. Involvement of actin filaments and integrins in the binding step in collagen phagocytosis by human fibroblasts. J Cell Sci. 2001; 114(1): 119–129. https://doi.org/10.1242/jcs.114.1.119
- Cheng F, Shen Y, Mohanasundaram P, Lindström M, Ivaska J, Ny T, et al. Vimentin coordinates fibroblast proliferation and keratinocyte differentiation in wound healing via TGF-β–Slug signaling. Proc Natl Acad Sci USA. 2016; 113(30): e4320–e4327. https://doi.org/10.1073/pnas.1519197113
- Komuro Y, Miyashita N, Mori T, Muneyuki E, Saitoh T, Kohda D, et al. Energetics of the Presequence-Binding Poses in Mitochondrial Protein Import Through Tom20. J Phys Chem B. 2013; 117(10): 2864–2871. https://doi.org/10.1021/jp400113e
- Pêgo SPB, De Faria PR, Santos LAN, Coletta RD, de Aquino SN, Martelli–Júnior H. Ultrastructural evaluation of gingival connective tissue in hereditary gingival fibromatosis. Oral Surg Oral Med Oral Pathol Oral Radiol. 2016; 122(1): 81–88. https://doi.org/10.1016/j.oooo.2016.04.002
- Yang WH, Deng YT, Hsieh YP, Wu KJ, Kuo MYP. Thrombin Activates Latent TGFβ1 via Integrin αvβ1 in Gingival Fibroblasts. J Dent Res. 2016; 95(8): 939–945. https://doi.org/10.1177/0022034516634288
Recibido: 5 de julio de 2020; Aceptado: 7 de mayo de 2021; : 1 de julio de 2021
Resumen
Resumen
Objetivo: identificar, describir y diferenciar las características fenotípicas de los fibroblastos gingivales (FGs) en pacientes con hiperplasia gingival idiopática (HGI) e individuos periodontalmente sanos. Métodos: los FGs fueron aislados a partir de tejido gingival de individuos periodontalmente sanos (n=2) y pacientes con HGI (n=2). Los FGs se cultivaron en el medio DMEM (Dulbecco's Modified of Eagle Medium) a 37°C con 5% de CO2. La identificación y localización de la actina, vimentina y mitocondrias en FGs fue realizada y evaluada microscópicamente mediante inmunofluorescencia con anticuerpos monoclonales. La capacidad de migración de los FGs en los pacientes con HGI e individuos sanos también fue estudiada. Resultados: todos los FGs fueron mononucleares, fusiformes y con prolongaciones citoplasmáticas visibles. La faloidina permitió identificar una densa red de actina en los FGs de pacientes con HGI, contrariamente a los FGs de individuos periodontalmente sanos. La vimentina y mitocondrias fueron identificadas en los FGs de individuos sanos y pacientes con HGI sin ninguna alteración en su expresión y localización. La migración de la monocapa de los FGs indicó una actividad de migración celular importante en los FGs de los pacientes con HGI, en relación a los FGs de los individuos periodontalmente sanos. Conclusión: los FGs de pacientes con HGI conservan características fenotípicas celulares similares a los FGs de individuos periodontalmente sanos. Sin embargo, los FGs de pacientes con HGI simulan tener una mayor capacidad migratoria que amerita ser explorada en futuros trabajos de investigación.
Palabras clave
hiperplasia gingival, encía, fibroblastos, citoesqueleto de actina, vimentina, mitocondria, inmunofluorescencia indirecta.Abstract
Abstract
Objective: To identify and to describe the phenotypic characteristics of gingival fibroblasts from patients with idiopathic gingival hyper plasia (IGH) and periodontally healthy individuals. Methods: Gingival fibroblasts (GFs) were isolated from gingival tissue from periodontally healthy individuals (n=2) and patients with IGH (n=2). The GFs were grown in DMEM (Dulbecco’s Modified of Eagle Medium) at 37°C with 5% CO2. The identification and location of actin, vimentin and mitochondria in GFs were performed and evaluated microscopically by immunofluorescence with monoclonal antibodies. The migration capacity of GFs from IGH and healthy individuals was also studied. Results: All the GFs were mononuclear, fusiform and with visible cytoplasmic extensions. The phalloidin allowed to identify a dense actin network in the GFs of patients with IGH, contrary to the GFs of periodontally healthy individuals. Vimentin and mitochondria were identified in the GFs of healthy individuals and patients with IGH without any alteration in their expression and location. Monolayer migration of GFs indicates significant cell migration activity in the GFs of patients with IGH in relation to the GFs of periodontally healthy individuals. Conclusion: GFs from patients with IGH retain cellular phenotypic characteristic similar to GFs from periodontally healthy individuals. However, the GFs of patients with IGH simulate having a greater migratory capacity that deserves to be explored in future research works.
Keywords
Gingival Hyperplasia, Gingiva, Fibroblasts, Actin cytoskeleton, Vimentin, Mitochondria, Indirect immunofluorescence.Introducción
La hiperplasia gingival (HG) es una condición patológica heterogénea caracterizada por el aumento excesivo de los elementos del tejido conectivo de la encía libre, adherida e interpapilar. Las formas severas de HG causan problemas funcionales y de fonación, además, de problemas estéticos y psicológicos (1, 2). La HG es de evolución lenta, progresiva, generalizada o localizada (3). La etiología de esta condición patológica no está bien establecida. Sin embargo, esta estaría relacionada con enfermedades hereditarias, neoplasias, tratamiento ortodóntico, la ingesta prolongada de ciertos medicamentos y factores idiopáticos (4, 5, 6). En la actualidad, no existe un tratamiento curativo para la HG.
La HG hereditaria es una enfermedad rara que puede desarrollarse como un trastorno patológico aislado o sindrómico. Se estima que tiene una prevalencia de 1/175000 y que afecta, indistintamente, a hombres y mujeres (7, 8). A diferencia de la HG hereditaria, en la hiperplasia gingival idiopática (HGI) el agente causal responsable no se ha establecido. De manera general, la HG pone en evidencia un tejido epitelial paraqueratinizado e hiperplásico con crestas epiteliales engrosadas y algunas de ellas fusionadas. El tejido conectivo de pacientes con HG es denso y abundante en fibras de colágeno. Esta acumulación excesiva de colágeno, principalmente, colágeno tipo I y tipo III, parece ser una característica común en todas las formas de HG, incluso, en pacientes con HGI (9).
Aunque los mecanismos celulares y moleculares que participan en el aumento del colágeno de tejidos gingivales de pacientes con HG son desconocidos, estos, probablemente, obedecen a un desequilibrio en la homeostasis de moléculas que participan en la degradación de la matriz extracelular (MEC), como las metaloproteinasas de la matriz (MMPs) y factores que promueven la proliferación de los FGs (1, 10). Los FGs son células mononucleares, referenciadas como las más numerosas del tejido conectivo gingival (~200.106 células por cm. de tejido), cuyas funciones favorecen el remodelaje, homeostasis y cicatrización tisular (11).
La escasa información sobre los aspectos morfológicos de los FGs en procesos de HGI, sumada a los hallazgos histológicos que indican una acumulación de las fibras de colágeno en los tejidos gingivales, justifica la realización de estudios morfológicos en los FGs de estos pacientes a través de diferentes marcadores citoplasmáticos. Por lo anterior, el objetivo de este estudio fue identificar, describir y diferenciar las características fenotípicas de los FGs en pacientes con HGI.
Métodos
Participantes
Como participantes se incluyeron cuatro sujetos que se dividieron en dos grupos de estudio; el primero, integrado por individuos periodontalmente sanos (encías rosadas en ausencia de sangrado) (control; n=2) y el segundo, compuesto por personas diagnosticadas con HGI (test: n=2), atendidas en el Centro de Referencia de Hipertrofia Gingival de la Facultad de Odontología de la Universidad de Cartagena, Colombia. Los participantes fueron mayores de 18 años, no se encontraban bajo tratamiento farmacológico ni eran fumadores. Todos presentaron un buen estado de salud sistémica luego de una evaluación médica-odontológica, la cual fue corroborada con la información registrada en sus respectivas historias clínicas. Se excluyeron mujeres en estado de embarazo, personas con cirugía periodontal inferior a 1 año, con signo radiográfico de pérdida ósea y con periodontitis. El estudio incluyó 3 hombres (1 con diagnóstico de HGI y 2 individuos periodontalmente sanos) y 1 mujer con HGI. La edad promedio de los sujetos participantes fue de 21 años.
Respecto a las muestras de tejido gingival, estas fueron obtenidas previamente con la realización de una fase higiénica periodontal, llevada a cabo siete días antes del procedimiento quirúrgico. Las muestras del grupo control se obtuvieron luego de un alargamiento coronal por razones estéticas o protésicas y en el grupo test, por gingivectomía. Ambas intervenciones quirúrgicas las realizó un periodoncista bajo anestesia infiltrativa con lidocaína 2% y epinefrina 1:80000 en el área quirúrgica, con previa incisión a bisel externo e intrasulcular con bisturí Bard Parker hoja N°15. Una evaluación post-quirúrgica, a los 7 días, permitió verificar una adecuada cicatrización tisular en todos los participantes, sin ninguna complicación. Los tejidos recuperados fueron lavados en solución salina tamponada con fosfato (PBS 1X, Gibco™), a su vez, fueron conservados y transportados en un medio DMEM (Dulbecco’s Modified Eagle Medium - Gibco™) + 1% de penicilina-estreptomicina (10,000 U/mL) (Gibco™).
Cultivo celular
En una campana de flujo laminar y en un recipiente estéril, los tejidos fueron cortados en fragmentos de aproximadamente 2 mm. y cultivados con el método de explante de acuerdo al protocolo descrito por Simancas et al. (12). Cuando los FGs alcanzaron una confluencia de aproximadamente 90% fueron separadas de su soporte mediante Tripsina (GibcoTM) y cultivadas en caja de Petri estériles (Gosselin™). El medio de cultivo utilizado contenía DMEM (1X) con GlutaMAX™ (Gibco™), 10% de suero fetal bovino-SFB (GibcoTM), 1% de penicilina-estreptomicina (GibcoTM), 1% de aminoácidos esenciales, 0.5% de anfotericina B (GibcoTM) y 50 μm/mL de ácido ascórbico (GibcoTM). Los FGs fueron incubados a 37°C en una atmósfera a 5% de CO2 y los medios de cultivos fueron cambiados cada 48 horas. Todos los experimentos fueron realizados con células entre el segundo y tercer pasaje.
Inmunofluorescencia
Después de una semana de cultivo, las células fueron lavadas en PBS1X (GibcoTM) y fijadas con una solución de paraformaldehído al 4% durante 10 minutos a 4°C. Posteriormente, las células fueron permeabilizadas con 0.5% de un agente tensoactivo no iónico (Triton X-100- Sigma-Aldrich®) e incubadas en una solución de 1% de BSA/glicina (Sigma-Aldrich®) por 20 minutos. Luego, los FGs estuvieron en contacto con los anticuerpos primarios anti-vimentina (Mouse monoclonal Anti-Vimentin antibody, dilución 1:400, clone V9, Sigma-Aldrich) y anti-TOMM20 (Mouse monoclonal Anti-TOMM20 antibody, dilución 1:800, clone 4F3, Sigma-Aldrich) toda la noche a 4°C. Al día siguiente, previo lavado de las células con PBS1X, estas fueron incubadas con el anticuerpo secundario Alexa Fluor 488 donkey anti-mouse (Life Technologies Corporation) durante 2 horas a temperatura ambiente. Los filamentos de actina fueron identificados mediante Alexa FluorTM 594 Phalloidin (Thermo Fisher Scientific) durante 15 minutos, de acuerdo a las recomendaciones del fabricante. Finalmente, se llevó a cabo un marcaje con DAPI (4',6-diamidino-2-fenilindol-Thermo Fisher; dilución 1:1000) y el montaje con un medio acuoso (Immu-Mount™-Thermo Scientific™). Las observaciones fueron realizadas en el microscopio IXplore Pro (Olympus).
Capacidad de migración
Los FGs de los diferentes pacientes, incluidos en el presente trabajo, fueron cultivados en cajas de 6 pozos por triplicado. Una vez en confluencia (90% aproximadamente), una cicatriz fue realizada con la ayuda de un cono estéril, de acuerdo a lo descrito por Grada et al. (13). Las fotografías fueron realizadas a las 0, 24 y 48 horas, con el fin de evaluar la capacidad de las diferentes poblaciones celulares para migrar.
Consideraciones éticas
Los participantes firmaron un consentimiento informado de acuerdo con lo establecido por el Comité de Ética en Investigaciones de la Universidad de Cartagena, quien otorgó el aval a esta investigación mediante el Acta No. 349902016, con fecha 21/03/2017. Los principios éticos contemplados durante el desarrollo del proyecto fueron promover y velar por la salud, la dignidad, la integridad, el derecho a la autodeterminación, la intimidad y la confidencialidad de la información personal de las personas que participaron en investigación, siguiendo la Declaración de Helsinki (2013). De acuerdo con la Resolución 008430 de 1993, del Ministerio de Salud y Protección Social de Colombia, el proyecto se clasificó como de riesgo mínimo.
Resultados
Luego de 21 días de cultivo primario, los FGs migraron alrededor de los explantes de tejido gingival e inmediatamente fueron replicados en cajas de Petri. Después del segundo pasaje (2 semanas), las células formaron una monocapa, característica de los FGs. Estas células presentaron una forma fusiforme, mononuclear; fue evidente la presencia de prolongaciones citoplasmáticas que hacían posible el contacto con otros fibroblastos. La distribución nuclear de los FGs fue identificada por inmunofluorescencia (DAPI), lo que puso en evidencia tanto los núcleos ovalados bien definidos en el grupo control, como en el grupo test. Ninguna alteración microscópica fue observada. Sin embargo, se apreció una cantidad no cuantificable y probablemente mayor de núcleos en los cultivos del grupo test, a diferencia del grupo control. El inmunomarcaje de la actina de los FGs, elemento fundamental en la arquitectura del citoesqueleto y el movimiento celular, fue constatado mediante la faloidina. Este marcaje fluorescente permitió observar los microfilamentos de los FGs. En el grupo test se identificó una densa red de actina (Figura 1).
La inmunodetención positiva de la vimentina, proteína fibrosa que hace parte de los filamentos intermedios, fue observada en los FGs de los individuos del grupo control y del grupo test. En la monocapa de los FGs de ambos grupos no se identificó alteraciones en la expresión de la vimentina que hicieran intuir cambios morfológicos o estructurales de las células estudiadas. Aunque, se pudo constatar una red compacta de la expresión de la vimentina en los FGs del grupo test, en contraposición a los FGs del grupo control (Figura 2).
El inmunomarcaje con TOMM20 hizo posible distinguir las mitocondrias en los FGs de individuos del grupo control y pacientes del grupo test (Figura 3). La expresión positiva y distribución de TOMM20 fue similar en todos los FGs de los pacientes evaluados. Así, la detención inmunofluorescente de este marcador reveló una localización citoplasmática y alrededor de la membrana nuclear de los FGs. Ningún cambio en la distribución y localización inmunofluorescente de este marcador fue constatado.
Por su parte, la observación que indica el cierre de la monocapa celular sometida a una herida evidenció una actividad de migración celular visiblemente mayor en los FGs del grupo test, respecto a los FGs del grupo control. En los FGs de los dos pacientes con HGI se identificó una migración probablemente superior, en comparación a los FGs de los individuos periodontalmente sanos después de las 24 y 48 horas. La observación de la capacidad de migración de los FGs de cada uno de los individuos estudiados aquí, parece ser diferente (Figura 4).
Figura 1: Microfotografía de núcleos y filamentos de actina en fibroblastos gingivales.
Figura 2: Inmunomarcaje de la vimentina en fibroblastos gingivales
Figura 3.: Distribución de inmunomarcaje mitocondrial en fibroblastos gingivales
Figura 4: Capacidad de migración de fibroblastos gingivales.
Discusión
El presente estudio piloto identificó los aspectos fenotípicos de los FGs a partir de dos pacientes diagnosticados con HGI e individuos periodontalmente sanos. La HG puede tener un origen genético o presentarse como una entidad patológica idiopática. Esta patología, también, se ha descrito en pacientes con ingesta prolongada de medicamentos como los bloqueadores de calcio, anticonvulsivantes, inmunosupresores e, incluso, en pacientes portadores de tratamiento ortodóntico (14, 15, 16). Otros reportes describen pacientes con HG y síndromes relacionados con hipertricosis, retraso mental, macrocefalia, sordera progresiva y querubismo (17, 18,19).
En este estudio, los FGs obtenidos y caracterizados se obtuvieron a partir de pacientes sin ningún grado de consanguineidad, sin medicación farmacológica ni portadores de aparatos de ortodoncia. En ninguno de los participantes se identificaron signos o sintomatología que pudieran dar cuenta de una HG sindrómica, incluidos los individuos con HGI, quienes fueron evaluados por un médico internista y dos patólogos orales. Como hallazgo aislado, se identificó que la HGI es principalmente esporádica. No obstante, también, es posible encontrar pacientes con un patrón de herencia autosómico dominante o muy raramente de herencia autosómica recesiva. No obstante, los pacientes afectados por la HGI estudiados aquí no reportaron antecedentes médicos personales ni familiares relacionados con alguna patología sistémica. Futuros estudios genéticos serán de gran utilidad para descartar o confirmar un posible origen genético.
Morfológicamente, los FGs de los pacientes del grupo test y del grupo control presentaron un aspecto fusiforme, con núcleos voluminosos y prolongaciones bien marcadas. Al respecto, una limitante del presente trabajo de investigación fue la ausencia de análisis estadísticos que evaluara la proliferación de las células fibroblásticas; se pudo observar una cantidad mayor (no cuantificable) de núcleos en los FGs del grupo test en contraste con los FGs del grupo control. Estos resultados son similares a los observados por Gawron K et al. (20) en una investigación donde se evaluaron las características y la tasa de proliferación de los FGs en tres pacientes con HGI. Este estudio demostró un aumento en la proliferación celular de estos pacientes, lo que confirmó la hipótesis que indicaba un mantenimiento del potencial proliferativo de los FGs in vivo . in vitro de los individuos con HGI.
Probablemente, el aumento en la proliferación de los FGs en los pacientes con HGI podría explicarse por la incidencia sobre estas células de factores estimulantes proliferativos, como el factor de crecimiento transformante beta 1(TGF-β1) (21). TGF-β1 ha sido considerado un regulador maestro en la acumulación de la MEC y, consecuentemente, un potencial impulsor de la hiperplasia. Esto, debido a que promueve la producción de fibronectina y colágeno mediante la activación transcripcional de factores de señalización que conducen a la expresión de genes pro-fibróticos como los que codifican para α-SMA, proteínas ECM, citocinas secretadas y factores de crecimiento, que modifican aún más la respuesta celular efectora fibrogénica (22).
Por su parte, la identificación de la actina puso de manifiesto la presencia de los filamentos esenciales del citoesqueleto de los FGs. Sobre esto, es relevante informar que el presente trabajo utilizó la faloidina con fines de visualizar la actina y no con el propósito de cuantificarla. Empero, esta limitación no impidió constatar, en la monocapa de los FGs de pacientes del grupo test, una densa red de actina en relación a los FGs del grupo control. De esta forma, se estima que el nivel de visualización del inmunomarcaje de la actina, en las células de los pacientes pertenecientes al grupo test, obedeció al mayor número de células presentes al momento de su identificación, como eventual consecuencia de una mayor tasa de proliferación de los FGs en cultivo.
La actina, además de asegurar las funciones de adherencia entre las células o con la MEC, también participa en la locomoción y la fagocitosis de moléculas (23). El rol de la actina en la fagocitosis parece iniciar con la internalización de partículas mediante un proceso de interacción receptor-ligando. Segal G et al. (24) han puesto en evidencia la implicación de la actina en la regulación de la fagocitosis del colágeno. Estos autores, al tratar los fibroblastos humanos en cultivo con Latrunculin B (inhibidor de la polimerización de la actina), constataron la desconexión de la actina a los receptores de integrina β1 y el aumento de la unión de las fibras de colágeno. Dichos resultados apoyarían la hipótesis según la cual, la HG es inducida por la reducción de la fagocitosis del colágeno en los FGs a través de la interacción α2β1 en la superficie celular.
De otro lado, en los FGs de los individuos del grupo control y del grupo test se identificó la vimentina sin ninguna alteración aparente. Esto revelaría que esta proteína perteneciente a los filamentos intermediarios, y una de las principales constituyentes del citoesqueleto de células eucarióticas, podría desempeñar un rol importante en la supervivencia y proliferación de los FGs. De hecho, Cheng F et al. (25) describieron el rol de la vimentina en la proliferación y diferenciación celular a partir de un estudio con ratones KO vimentina, con el cual establecieron que la pérdida de la vimentina induce una reducción en el crecimiento de los fibroblastos, lo que a su vez inhibe la señalización de TGF-β1 y la abolición en la acumulación de colágeno. Este estudio demuestra que la vimentina coordina la proliferación de fibroblastos y el depósito de colágeno.
En lo que respecta a las mitocondrias, estas, también, fueron identificadas en los FGs de individuos del grupo control y en los pacientes del grupo test. La identificación de la traslocasa de la membrana externa, subunidad 20 (TOM20) responsable del movimiento de proteínas a través de la membrana hacia el interior del espacio mitocondrial (26), localizada en el citoplasma y cerca de la envoltura nuclear, es un hallazgo que coincide con el reporte de Pêgo et al. (27). Estos autores revelaron en un estudio descriptivo, mediante microscopía electrónica a transmisión en nueve pacientes con HG, la presencia de mitocondrias como unas de las organelas celulares observadas de manera más frecuente.
La migración de los FGs del grupo test fue observada desde las primeras horas de cultivo celular. Esto permitió constatar la destacada capacidad migratoria de estos fibroblastos. Con el uso de esta técnica descriptiva fue evidente que los FGs de pacientes con HGI tienen una cinética de proliferación potencialmente mayor a los FGs de los individuos del grupo control. Lo anterior puede obedecer a un mayor estímulo de los FGs por parte de moléculas como el TGF-β1, explicado en párrafos precedentes, pero, también, es probable comprenderla como una respuesta a la sobreexpresión de CCN2 (connective tissue growth factor), una proteína de la matriz que regula la proliferación y la migración celular. Así, se ha establecido que TGF-β1 induce de manera rápida y potente a CCN2 en los tejidos, con lo cual crea un ambiente adecuado para la fibrogénesis. En los tejidos con HG, CCN2 se asocia directamente con el grado de fibrosis (28). Por ello, el rol TGF-β1/CCN2 requiere ser evaluado en la HGI y establecer su implicación sobre la migración de los FGs en estos pacientes.
Como conclusión de este estudio piloto se establece que los FGs de pacientes con HGI conservan las mismas características fenotípicas celulares de los FGs de individuos periodontalmente sanos. Se ha demostrado por inmunomarcaje de proteínas del citoesqueleto y organelas celulares que la localización de la actina, vimentina y mitocondrias en FGs de pacientes con HGI no presentaría modificaciones en su distribución celular. Los FGs de pacientes con HGI simulan tener una capacidad migratoria destacable que amerita ser explorada a profundidad en otros trabajos de investigación. En general, este estudio preliminar constituyó un primer acercamiento al cultivo celular y análisis morfológico por inmunofluorescencia de los FGs en pacientes con HGI. Futuros estudios deberán ser consagrados a estimar la tasa de proliferación celular, la expresión génica de marcadores pro-fibróticos y rol de proteínas de la MEC en la regulación del colágeno a partir de los FGs de pacientes con HGI. Se estima, que esta información será de gran utilidad para esclarecer el rol de marcadores y probables vías de señalización particulares o comunes a los pacientes que padecen HGI.
Contribuciones de los autores
Víctor Hugo Simancas–Escorcia: concepción del estudio, recolección, análisis de muestras, redacción del artículo. Antonio José Díaz–Caballero: concepción del estudio, recolección, análisis de muestras, redacción del artículo. Clara Inés Vergara–Hernández: recolección, análisis de muestras, redacción del artículo.
Conflictos de interés
Los autores declaran no tener conflictos de intereses.
Referencias
Referencias
Pêgo SBP, Coletta RD, Mendes DC, De Faria PR, Melo–Filho MR, Alves–Rodrigues L, et al. Hereditary gingival fibromatosis: clinical and ultrastructural features of a new family. Med Oral Patol Oral Cir Bucal. 2015; 20(2): e150–e155. http://dx.doi.org/doi:10.4317/medoral.20170
Guzmán–Rivera E, López–Álvarez A, Harris–Ricardo J. Fibromatosis gingival hereditaria: una rara enfermedad. Reporte de una familia. Rev Cienc Salud. 2018; 16(2): 365–372. https://dx.doi.org/10.12804/revistas.urosario.edu.co/revsalud/a.6775
Silva–Cunha JL, Carvalho da Cruz–Ramos MA, Menezes–Regis DM, Sanchéz–Romero C, de Andrade ME, Torres–Bezerra B, et al. Generalized hereditary gingival fibromatosis in a child: clinical, histopathological and therapeutic aspects. Autops Case Rep. 2020; 10(1): e2020140. https://doi.org/10.4322/acr.2020.140
Manzur–Villalobos I, Díaz–Rengifo IA, Manzur–Villalobos D, Díaz–Caballero AJ. Agrandamiento gingival farmacoinducido: Serie de casos. Univ. Salud. 2018; 20(1): 89–96. http://dx.doi.org/10.22267/rus.182001.113
Souza–Pinto A, Severo–Alves L, Do Amaral–Zenkner JE, Batistin–Zanatta FB, Maltz M. Gingival enlargement in orthodontic patients: Effect of treatment duration. Am J Orthod Dentofacial Orthop. 2017; 152(4): 477–482. http://dx.doi.org/10.1016/j.ajodo.2016.10.042
Boutiou E, Ziogas IA, Giannis D, Doufexi AE. Hereditary gingival fibromatosis in children: a systematic review of the literature. Clin Oral Investig. 2021; 25(6): 3599–3607. http://dx.doi.org/10.1007/s00784-020-03682-x
Almiñana–Pastor PJ, Buitrago–Vera PJ, Alpiste–Illueca FM, Catalá–Pizarro M. Hereditary gingival fibromatosis: Characteristics and treatment approach. J Clin Exp Dent. 2017; 9(4): e599–e602. http://dx.doi.org/10.4317/jced.53644
Gawron K, Łazarz–Bartyzel K, Potempa J, Chomyszyn–Gajewska M. Gingival fibromatosis: clinical, molecular and therapeutic issues. Orphanet J Rare Dis. 2016; 11: 9. https://doi.org/10.1186/s13023-016-0395-1
Jadhav AS, Marathe SP. Recurrent idiopathic gingival fibromatosis with generalized aggressive periodontitis: A rare case report. J Indian Soc Periodontol. 2015; 19(1): 93–95. https://doi.org/10.4103/0972-124X.145833
Roman–Malo L, Bullon B, de Miguel M, Bullon P. Fibroblasts Collagen Production and Histological Alterations in Hereditary Gingival Fibromatosis. Diseases. 2019; 7(2): 39. https://doi.org/10.3390/diseases7020039
Simancas–Escorcia V, Díaz–Caballero A. Fisiología y usos terapéuticos de los fibroblastos gingivales. Odous Cientifica. 2019; 20(1): 41–57. Disponible en: http://servicio.bc.uc.edu.ve/odontologia/revista/vol20n1/art05.pdf
Simancas–Escorcia V, Vergara–Hernández C, Díaz–Caballero A. Influencia del suero fetal bovino en el cultivo de fibroblastos gingivales. Av Odontoestomatol. 2018; 34(6): 299–309. Disponible en: https://scielo.isciii.es/pdf/odonto/v34n6/0213-1285-odonto-34-6-299.pdf
Grada A, Otero–Vinas M, Prieto–Castrillo F, Obagi Z, Falanga V. Research Techniques Made Simple: Analysis of Collective Cell Migration Using the Wound Healing Assay. J Invest Dermatol. 2017; 137(2): e11–e16. http://doi.org/10.1016/j.jid.2016.11.020
Gopinath S, Harishkumar VV, Santhosh VC, Puthalath S. Case report on low dose of Cilnidipine: A fourth-generation calcium channel blocker-induced gingival overgrowth. J Indian Soc Periodontol. 2019; 23(4): 377–380. https://doi.org/10.4103/jisp.jisp_557_18
Alshahrani A, Togoo RA, Kamran MA, Alshahrani I. Clinical periodontal, bacterial, and immunological outcomes of antimicrobial photodynamic therapy in orthodontic treatment-induced gingival enlargement. Photodiagnosis Photodyn Ther. 2020; 31: 101934. https://doi.org/10.1016/j.pdpdt.2020.101934
Lauritano D, Moreo G, Limongelli L, Tregambi E, Palmieri A, Carinci F. Drug-Induced Gingival Overgrowth: A Pilot Study on the Effect of Diphenylhydantoin and Gabapentin on Human Gingival Fibroblasts. Int J Environ Res Public Health. 2020; 17(21): 8229. https://dx.doi.org/10.3390/ijerph17218229
Bubna AK, Veeraraghavan M, Anandan S, Rangarajan S. Congenital Generalized Hypertrichosis, Gingival Hyperplasia, a Coarse Facies with Constriction Bands: A Rare Association. Int J Trichology. 2015; 7(2): 67–71. http://dx.doi.org/10.4103/0974-7753.160113
Diaz–Rojas KA, Simancas–Escorcia V. Caracterización fenotípica del Síndrome de Raine. Cienc Salud Virtual. 2019; 11(2): 131–142. Disponible en: https://revistas.curn.edu.co/index.php/cienciaysalud/article/view/1267
Gita B, Chandrasekaran S, Manoharan P, Dembla G. Idiopathic gingival fibromatosis associated with progressive hearing loss: A nonfamilial variant of Jones syndrome. Contemp Clin Dent. 2014; 5(2): 260–263. http://dx.doi.org/10.4103/0976-237X.132387
Gawron K, Łazarz–Bartyzel K, Kowalska A, Bereta G, Nowakowska Z, Plakwicz P, et al. Fibroblasts from recurrent fibrotic overgrowths reveal high rate of proliferation in vitro - findings from the study of hereditary and idiopathic gingival fibromatosis. Connect Tissue Res. 2019; 60(1): 29–39. https://doi.org/10.1080/03008207.2018.1517758
Hazzaa HH, Gouda OM, Kamal NM, Ali SAM, El Shiekh MAM, Tawfik MM. Expression of CD163 in hereditary gingival fibromatosis: A possible association with TGF-β1. J Oral Pathol Med. 2018; 47(3): 286–292. https://doi.org/10.1111/jop.12679
Kim KK, Sheppard D, Chapman HA. TGF-β1 Signaling and Tissue Fibrosis. Cold Spring Harb Perspect Biol. 2018; 10(4): a022293. http://dx.doi.org/10.1101/cshperspect.a022293
Gopal S, Multhaupt HAB, Couchman JR. Calcium in Cell-Extracellular Matrix Interactions. Adv Exp Med Biol. 2020; 1131: 1079–1102. https://doi.org/10.1007/978-3-030-12457-1_43
Segal G, Lee W, Arora PD, McKee M, Downey G, McCulloch CA. Involvement of actin filaments and integrins in the binding step in collagen phagocytosis by human fibroblasts. J Cell Sci. 2001; 114(1): 119–129. https://doi.org/10.1242/jcs.114.1.119
Cheng F, Shen Y, Mohanasundaram P, Lindström M, Ivaska J, Ny T, et al. Vimentin coordinates fibroblast proliferation and keratinocyte differentiation in wound healing via TGF-β–Slug signaling. Proc Natl Acad Sci USA. 2016; 113(30): e4320–e4327. https://doi.org/10.1073/pnas.1519197113
Komuro Y, Miyashita N, Mori T, Muneyuki E, Saitoh T, Kohda D, et al. Energetics of the Presequence-Binding Poses in Mitochondrial Protein Import Through Tom20. J Phys Chem B. 2013; 117(10): 2864–2871. https://doi.org/10.1021/jp400113e
Pêgo SPB, De Faria PR, Santos LAN, Coletta RD, de Aquino SN, Martelli–Júnior H. Ultrastructural evaluation of gingival connective tissue in hereditary gingival fibromatosis. Oral Surg Oral Med Oral Pathol Oral Radiol. 2016; 122(1): 81–88. https://doi.org/10.1016/j.oooo.2016.04.002
Yang WH, Deng YT, Hsieh YP, Wu KJ, Kuo MYP. Thrombin Activates Latent TGFβ1 via Integrin αvβ1 in Gingival Fibroblasts. J Dent Res. 2016; 95(8): 939–945. https://doi.org/10.1177/0022034516634288
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2021 Victor Hugo Simancas Escorcia, Antonio Díaz Caballero, Clara Vergara Hernandez

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la licencia Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
- Una vez sometido el artículo no se aceptaran cambios respecto a la incorporación o retiro de autores.