Biooxidación de sulfuros mediante cepas nativas de acidófilos compatibles con Acidithiobacillus ferrooxidans y thiooxidans, mina de oro El Zancudo, (Titiribí, Colombia)
Sulphide bioxidation using native Acidithiobacillus ferrooxidans and thiooxidans, related acidophile strains from "El Zancudo" gold mine (Titiribí, Colombia)
Palabras clave:
quimiolitotrofos, biolixiviación, 0 pirita, arsenopirita, mineralogía aplicada, chemolithotrophics, bioleaching, pyrite, arsenopyrite, applied mineralogy (es)|
|
||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 55-66
|
||
|
|
||
|
Biooxidación de sulfuros mediante cepas nativas de
acidófilos compatibles con Acidithiobacillus ferrooxidans y thiooxidans, mina de oro El Zancudo,
(Titiribí, Colombia)
Sulphide bioxidation using native Acidithiobacillus
ferrooxidans and thiooxidans, related acidophile
strains from "El Zancudo" gold mine
(Titiribí, Colombia)
Diana M. Ossa H.*, Marco A. Márquez G.**
RESUMEN
El propósito de esta investigación fue evaluar a escala de laboratorio la acción de microorganismos acidófilos nativos compatibles con las especies Acidithiobacillus ferrooxidans y thiooxidans, aislados de la mina El Zancudo, Titiribí (Antioquia) sobre la oxidación de sulfuros donde predominan la pirita y arsenopirita, variando las concentraciones de sustrato (8% y 16%), y el tamaño de partícula (75 um y 106 )xm). Los resultados de las mediciones diarias de pH y potencial redox realizadas por un tiempo de 25 días, demuestran que hubo una actividad de oxidación eficiente y se llegó a valores de pH de 1,4 y potencial redox de 600 mV, además de encontrarse en solución niveles altos de alrededor de 20 g/L de As y 60 g/L de Fe. Por los análisis de DRX, FTIR y SEM/EDX, se evidencia la presencia de productos propios de la oxidación bacteriana, como jarosita y arsenatos de hierro, además de una corrosión inicial y avanzada en los granos de pirita y arsenopirita, respectivamente.
Palabras clave: quimiolitotrofos, biolixiviación, pirita, arsenopirita, mineralogía aplicada.
ABSTRACT
This investigation was aimed at a laboratory evaluation of the action of native Acidithiobacillus ferrooxidans-and thiooxidans-related acidophile micro-organism (isolated from El Zancudo gold mine in Titiribí, Colombia) on the oxidation of sulphides, mainly consisting of pyrite and arsenopyrite; sulphide concentration varied from 8% to 16% and particle size from 75 um to 106 um. pH and redox potential measurement revealed efficient oxidation for each culture over a 25-day period, reaching 1,4 pH and 600 mV redox potential. 20 g/L As and 60 g/L Fe levels were reached in solution. XRD, FTIR and SEM/EDX analysis revealed the presence of bacterial oxidation products such as jarosite and iron arsenates, as well as low and high corrosion in pyrites and arsenopyrites, respectively.
Key words: chemolithotrophics, bioleaching, pyrite, arsenopyrite, applied mineralogy.
|
||
|
|
||
|
* M. Sc. Biotecnología. Universidad Nacional de Colombia, sede Medellín. Correo electrónico:
dossahenao@hotmail.com ** Ph D. Mineralogía. Universidad Nacional de Colombia, sede Medellín. Correo electrónico:
mmarquez@unalmed.edu.co
Recibido: Enero 27 de 2004 Aceptado: Noviembre 20 de 2005
|
||
|
|
||
|
55
|
||
|
|
||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 55-66
|
|||
|
|
|||
|
INTRODUCCIÓN
El problema de la refractariedad en menas de sulfuros para la extracción de metales preciosos es bien conocido y documentado a nivel mundial. Los minerales auríferos refractarios objeto de este estudio son aquellos en que la mayor presencia del oro está directamente asociada a los minerales sulfuros, bien por oclusión o bien por asociación, y en que las especies más comunes son la pirita y la arsenopirita, encontrándose en menor cantidad sulfuros como la esfaleri-ta y la galena, además de sulfosales de cobre y antimonio. Se considera que en Colombia es común que los depósitos de orofiloniano muestren al menos cierto grado de refractariedad, lo que afecta la extracción de este metal (Ingeominas, 1987). Una alternativa biotecnológica para solucionar el problema de la refractariedad es la utilización de una variada cantidad de microorganismos quimiolitotrofos acidófilos, los cuales lixivian y oxidan los minerales que contienen sulfuros metálicos. Dicha tecnología ha venido ganando un gran auge en las últimas décadas, debido al mejoramiento en la cinética y la eficiencia de los mecanismos implicados en los procesos de metalurgia extractiva.
La biooxidación de los minerales no consiste en fenómenos constantes, es más una sucesión de diferentes pasos y es fuertemente influenciada por la interacción entre la temperatura, el pH y el potencial redox; por esta razón puede existir un control bioquímico específico para cada mineral. Este fenómeno también puede cambiar con relación al contenido lixiviado, al crecimiento bacteriano, al tamaño de partícula y a parámetros físicos como patrones de corrosión, entre otros (Mustin et ál., 1992).
Los conocimientos biológicos de cepas microbianas nativas en la recuperación de metales, contribuyen al conjunto de estudios en el área de biohidrometalurgia que se adelantan en varias universidades nacionales e internacionales, para im-plementar tecnologías limpias y económicas de aplicación en la comunidad minera, aportando soluciones no solo a los problemas de impacto ambiental, sino también al de carácter económico, y posibilitando la recuperación de oro en menas refractarias.
El objetivo general de este trabajo es evaluar a nivel de laboratorio la acción de cepas nativas de
|
acidófilos compatibles con Acidithiobacillus ferrooxi-dans y thiooxidans, provenientes de la mina El Zancudo, Titiribí (Antioquia), sobre el mineral concentrado de sulfuros, comparando la eficiencia de oxidación al utilizar cultivos puros de cada una de estas bacterias, valiéndonos de técnicas analíticas como absorción atómica, microscopía electrónica de barrido (SEM/EDX), difracción de rayos X (DRX) y espectroscopía infrarroja (FTIR).
MATERIALES Y MÉTODOS Aislamiento de microorganismos
Se tomó un total de cinco muestras en zonas de oxidación intempérica de sulfuros y en lixiviados de efluentes en el depósito de la mina El Zancudo, Titiribí (Antioquia), las cuales se inocularon en los medios selectivos T&K pH 1,8 y 9K pH 2,8 para el aislamiento de A. f. y A .t., respectivamente; para este fin se toman 10 g o 10 mL de muestra y se adicionan a 90 mL de medio de cultivo en condiciones estériles (García et ál., 1995). De dichos cultivos se obtuvieron cepas compatibles con los quimiolitotrofos mencionados, de acuerdo con la identificación bioquímica según el manual Bergey (Staley et. ál., 1991).
Preparación del sustrato
El mineral proveniente de la mina El Zancudo, Titiribí (Antioquia), se concentró en mesa Wiffley y luego se pasó por batea, asegurando que dicha concentración estuviera alrededor de 80% de sulfuros, donde predominan la pirita y la arsenopirita. Luego se procedió a tamizar el mineral con el fin de asegurar tamaños de partícula 75 \im pasante malla 200 y 106 |im pasante malla 140. El mineral concentrado se esterilizó en autoclave a 18 p.s.i. y T 110 °C por 40 minutos (Lasse y Olli, 1991).
Descripción de ensayos
Una vez que las cepas nativas compatibles con A. f. y A. t. fueron aisladas y seleccionadas, se adaptaron al mineral concentrado de la mina El Zancudo, colocándolas en agitación constante con dicho sustrato como única fuente de energía por un período de 15 a 30 días (García et ál., 1995). Luego se procedió a realizar el montaje de los ensayos utilizando las siguientes variables: cultivos puros de A. f. y A. t., porcentaje de sustrato de 8% y 16%, tamaño de partícula de 75 |im y 106 |im (Deveci, 2004). En cada cultivo se
|
||
|
|
|||
|
56
|
|||
|
|
|||
|
|
|||
|
BIOOXIDACIÓN DE SULFUROS MEDIANTE CEPAS NATIVAS DE ACIDÓFILOS COMPATIBLES
|
|||
|
|
|||
|
adicionó un 10% de inóculo de las bacterias, donde la población tenía un promedio de 107 y 108 células por mililitro (conteo en cámara de Neubawuer). Se adicionaron 180 mL de caldo 9K fresco, para completar un volumen final de 200 mL. Los cultivos se incubaron a 35 °C, en agitación constante a 150 rpm, por un período de 25 días.
Cada uno de los ensayos se realizó por duplicado. Denominación de los ensayos: cultivos 1-2, consistente en inóculos puros de las cepas seleccionadas de A. ferrooxidans, y cultivos 3-4, consistente en inóculos puros de las cepas seleccionadas de A. thiooxidans. Condición I: cultivo puro de Ac. ferroox., cultivo puro de Ac. thioox., 8% de mineral concentrado y tamaño de partícula de 75 u/n (pasante malla 200). Condición II: cultivo puro de Ac. ferroox., cultivo puro de Ac. thioox., 16% de mineral concentrado y tamaño de partícula de 75 u,m (pasante malla 200). Condición III: cultivo puro de Ac. ferroox., cultivo puro de Ac. thioox., 8% de mineral concentrado y tamaño de partícula de 106 u,m (pasante malla 140). Condición IV: cultivo puro de Ac. ferroox., cultivo puro de Ac. thioox., 16% de mineral concentrado y tamaño de partícula de 106 u,m (pasante malla 140).
Monitoreo del proceso de biooxidación
Para monitorear el proceso de biooxidación, a cada ensayo se le realizaron mediciones diarias de pH (todos los ensayos parten de un pH inicial de 2,2), potencial redox (equipo potenciómetro/ionó-metro marca Methrom), concentración de hierro ferroso (método de titulación con permanganato
|
de potasio) y concentración de hierro y arsénico total en solución (la cual se determinó por absorción atómica, equipo marca Solaar) en el laboratorio del Cimex de la Universidad Nacional de Colombia, sede Medellín. Además se realizaron análisis por espectroscopía de infrarrojo (FTIR) y difracción de rayos X (DRX), en el laboratorio de Física del plasma, de la Universidad Nacional de Colombia, sede Manizales, y análisis de microscopía electrónica de barrido con analizador de rayos X característicos (SEM/EDX) en la Universidad Nacional de Colombia, sede Medellín, con el objeto de caracterizar el mineral después de la acción de los microorganismos.
RESULTADOS
Monitoreo de pH y Eh en el tiempo
En general, en todos los cultivos se observa un incremento del pH en las primeras 48 horas, a la vez que el potencial de oxidorreducción baja a valores alrededor de 200 mV; sin embargo, a partir de esta hora todos los ensayos muestran una disminución gradual de pH y un aumento en el Eh a través del tiempo (figuras 1 y 2).
En los cultivos 1 y 2 (cultivos puros de A. f.) se observan diferencias marcadas entre las condiciones y se define una tendencia muy similar para las condiciones I y III, en las cuales el pH aumenta levemente en las primeras horas, llegando a valores cercanos a 3, para luego estabilizarse alrededor de 2 hasta el final. En las condiciones II y IV se observa un incremento considerable en el pH, que llega a
|
||
|
|
|||
 |
|||
|
|
|||
|
Figura 1. a) Variación del pH en el tiempo de los cultivos 1 y 2(At. f.)en las condiciones I (8% pulpa, 75 (j,m), II (16% pulpa, 75 (j,m), III (8% pulpa, 140 (j,m) y IV (16% pulpa, 140 (j,m). b) Variación del Eh en el tiempo de los cultivos 1 y 2 en las condiciones I, II, III y IV.
|
|||
|
|
|||
|
57
|
|||
|
|
|||
|
|
||||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 55-66
|
||||
|
|
||||
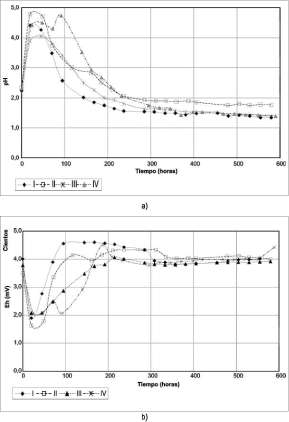 |
gradualmente y llega a valores muy ácidos cercanos a 1.4 (figura 2).
Disolución de Fe y As
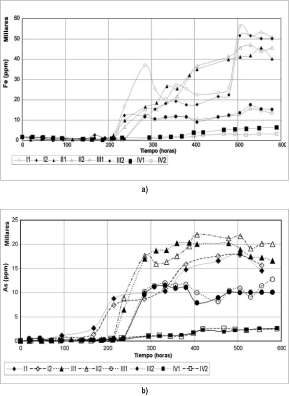
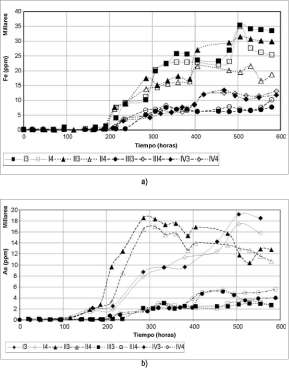
En general, se observan diferencias significativas en la biolixiviación de hierro en las condiciones tratadas, para los cultivos puros de A. f. y A. t. En los cultivos puros de A. f., la condición I (8% de pulpa y 75 u,m) alcanza altos valores de hierro total en solución, mayores de 50000 ppm, seguida de la condición II (16% de pulpa y 75 u,m) que llega a concentraciones por encima de 40000 ppm, al final del tiempo. Mientras que las condiciones III y IV solo alcanzan a disolver alrededor de 10000 ppm, siendo mucho menor en la condición IV (figura 3a).
Para los cultivos puros de A. t., la tendencia de disolución de Fe en las condiciones es muy similar a la de los otros cultivos, pero en las condiciones I y II estos solo logran lixiviar alrededor de 30000 ppm., (figura 3b).
En cuanto a la biolixiviación de arsénico, se observa que en los cultivos de A. f. las condiciones I y II alcanzan concentraciones cercanas a 20000 ppm, mientras que la condición III logra lixiviar alrededor de 10000
|
|||
|
ppm y la condición IV solo obtiene una concentración de As por debajo de
Figura 2. a) Variación del pH en el tiempo de los cultivos 3 y 4 (At. t.) en las condi- 5000 DDm ciones I, II, III y IV. b)Variación del Ehenel tiempodeloscultivos3y4en lascondi-cionesI, II, IIIyIV.
Para los cultivos de A. t. los resultados son similares a los anteriores;
|
||||
|
|
||||
|
valores de 4, lo que repercute también en la caída del Eh en el sistema, ya que este tiene un comportamiento inversamente proporcional al pH. Sin embargo, a partir de las 100 horas, se activa en el sistema el proceso de oxidación y el pH comienza a disminuir a la vez que el Eh aumenta (figura 1).
En los cultivos 3 y 4 (cultivos puros de A. t.) el comportamiento del pH no muestra diferencias significativas para todas las condiciones; la tendencia es que aumenta hasta las 100 horas aproximadamente, luego de las cuales comienza a bajar
|
sin embargo, las condiciones III y IV se comportan como la condición IV de A. f., llegando a
|
|||
|
lixiviar 5000 ppm al final del experimento.
Espectroscopía infrarroja por transformada de Fourier (FTIR)
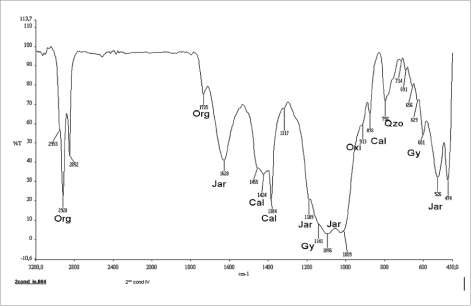
En general en todas las muestras de los bioensayos se establece la presencia de materia orgánica, en los picos 2958, 2923 y 2853 cm-1 reportados en Van der Marel y Beutelspacher (1976). La intensidad de estos picos varía un poco en las muestras; son más
|
||||
|
|
||||
|
58
|
||||
|
|
||||
|
|
||||
|
BIOOXIDACIÓN DE SULFUROS MEDIANTE CEPAS NATIVAS DE ACIDÓFILOS COMPATIBLES
|
||||
|
|
||||
 |
Las fases de los sulfatos hidratados de hierro, donde las más importantes y más comunes en el proceso de biooxidación de sulfuros son las jarosi-tas, se reconocen por varios modos vi-bracionales, los más importantes son: la banda 1635 cm-1 usualmente considerada como deformaciones 5 H2O del agua de las jarositas (Sasaki y Konno, 2000); las bandas 1196 cm-1, 1080 cm-1, pertenecientes a las vibraciones de los sulfatos; la banda 1002 cm-1 correspondiente a y1 y la banda 628 cm-1 correspondiente al modo y4 de las jaro-sitas (Sasaki y Konno, 2000; Lazaroff et ál., 1982).
La banda 1400 cm-1 comúnmente interpretada como perteneciente a la deformación del amonio (NH4) de la amoniojarosita (Sasaki, 1997; Lazaroff et ál., 1982).
Por último, las bandas observadas en 508 cm-1, y 472 cm-1 consideradas por Lazaroff et ál. (1982) como correspondientes al modo tOh de la amoniojarosita.
En las muestras, los sulfatos de calcio, como el yeso, pueden ser reconocidos en las bandas 600 cm-1 y 660 cm-1. También en las bandas 1117 cm-1, 1143 cm-1 y la banda 1165 cm-1, cercanas a la región de las jarositas ya mencionadas (Van der Marel y Beutelspacher, 1976). Además son claras las bandas de cuarzo 798 cm-1, 778 cm-1 y 694 cm-1, siempre presentes en el mineral (Márquez, 1999).
|
|||
|
Figura 3. a) Variación de la concentración de hierro total en solución en el tiempo de los cultivos 1 y 2 (At. f.)en las condiciones I (8% pulpa, 75 (j,m), II (16% pulpa, 75 (j,m), III (8% pulpa, 140 (j,m) y IV (16% pulpa, 140 (j,m). b) Variación de la concentración de arsénico total en solución en el tiempo de los cultivos 1 y 2 en las condiciones I, II, III y IV.
|
||||
|
intensos en los cultivos puros de A. t. y en la condición IV (figura 5).
La banda 1433 cm-1 es típica del modo vibra-cional v3 del carbonato calcita (carbonato de calcio), según Nyquist y Kagel (1971), y la banda 876 cm-1 del modo vibracional y2 y 712 cm-1, según Van der Marel y Beutelspacher (1976), lo que indica la presencia de carbonatos como la calcita en el concentrado y que apoya la teoría acerca del comportamiento de pH y potencial redox que se presentó en los cultivos (figura 5).
|
|
|||
|
Difracción de rayos X (DRX)
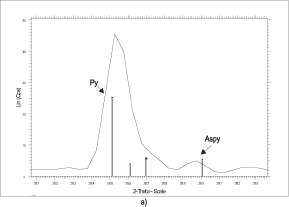
Con el fin de comparar equitativamente los resultados de las cuatro condiciones experimentadas, se tomaron varias reflexiones como punto de referencia para los minerales más representativos dentro de las muestras, los cuales son pirita, arsenopirita yjarosita.
Además se evaluó la presencia de otras fases minerales comunes en la oxidación bacteriana de
|
||||
|
|
||||
|
59
|
||||
|
|
||||
|
|
||||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 55-66
|
||||
|
|
||||
 |
70% de jarosita. Es importante notar que los porcentajes consignados no pueden considerarse como datos cuantitativos reales; sin embargo, son muy útiles como parámetro de comparación en cuanto a las proporciones relativas de cada mineral en las muestras.
Microscopía electrónica de barrido (SEM/EDX)
Los análisis de microscopía electrónica y los análisis microquímicos se realizaron en algunas muestras seleccionadas por presentar una buena eficiencia en el proceso de biooxi-dación de sulfuros, demostrada por las medidas de pH, Eh y concentraciones de hierro y arsénico en solución.
Además de las jarositas, se evidencian otras fases minerales propias de oxidación bacteriana, como el arse-nato de hierro escorodita, el cual incluye algo de sulfatos; sin embargo, estos se encuentran en menor proporción comparados con la jarosita. Al igual que la muestra 2 condición I, se observan otros sulfuros oxidados, como es-falerita y galena; también sulfosales de antimonio, como boulangerita, las cuales comúnmente, se ven muy oxidadas en esta muestra (figura 9).
|
|||
|
Figura 4. a) Variación de la concentración de hierro total en solución en el tiempo de los cultivos 3 y4(At. t.) en las condiciones I, II, III y IV. b) Variación de la concentración de arsénico total en solución en el tiempo de los cultivos 3 y 4 en las condiciones I, II, III y IV.
|
||||
|
|
||||
|
este tipo de sulfuros como los arsenatos. Por último, también se consideraron otros picos importantes en la muestra, por su intensidad.
De esta forma, para comparar la pirita y la arse-nopirita se tomaron las reflexiones (2 0 0) con 33.04° 28 equivalente a la intensidad de 100% de la pirita, y (1 21) con 36.76° 28 equivalente a la intensidad de 100% de arsenopirita.
Para comparar la pirita y la jarosita se tomaron las reflexiones (2 2 0) con 47.43° 28 equivalente a la intensidad de 42% de pirita; (1 1 3) con 29.02° 28 equivalente a la intensidad de 100% de jarosita, y (0 2 1) con 28.63° 28 equivalente a la intensidad de
|
Según las imágenes, es claro que la arsenopirita se oxida, por lo menos en buena parte (figuras 7 y 10), generando seudomorfos e indicando así que muy buena parte del azufre, hierro y arsénico sufren el proceso de oxidación in situ, es decir, sin haber algún tipo de lixiviación (solubilización) de estos iones.
Igualmente se evidencia la biooxidación de otros sulfuros y sulfosales presentes en pocas cantidades en la mena, como la galena (figura 11), y sulfosales de antimonio, como la boulangerita o jame-sonita (figura 9); para el caso de la galena, el mecanismo de oxidación parece simular al de la arsenopirita, presentando seudomorfos de jarosita, sin alta presencia de plomo.
|
|||
|
|
||||
|
60
|
||||
|
|
||||
|
|
|||
|
BIOOXIDACIÓN DE SULFUROS MEDIANTE CEPAS NATIVAS DE ACIDÓFILOS COMPATIBLES
|
|||
|
|
|||
 |
|||
|
|
|||
|
Figura 5. Espectro infrarrojo del cultivo 3 (A. thioox.) de la condición IV.
|
|||
|
|
|||
|
DISCUSIÓN
Análisis de pH y Eh en el tiempo
Para los cultivos puros de A. f. se observan diferencias claras entre los ensayos. En general las condiciones II y IV, con una concentración de sustrato del 16%, se ven más afectadas en comparación con las condiciones I y III, lo cual se ve reflejado en el comportamiento del pH y el Eh (figura 1), ya que esto está directamente relacionado con el tiempo que tarda el sistema en adquirir un pH ácido; interfieren tanto los carbonatos presentes en el mineral, los cuales se disuelven en ambientes ácidos entre pH de 0 a 5 (Marsden y House, 1992), como el estrés causado a las bacterias por las condiciones más drásticas a las que fueron sometidas.
Una característica de los cultivos puros de A. t. es que el potencial adquiere siempre un valor de estabilidad cercano a 400 mV, lo que puede explicarse en parte por el hecho de que en el sistema la concentración del ión férrico es menor, ya que
|
estas bacterias no son oxidantes de hierro, por lo tanto la presencia de este ión se debe a la oxidación química por el oxígeno. Como es sabido, el ión férrico es el principal controlador cinético del sistema, ya que es un fuerte oxidante de los sulfu-ros, por lo tanto una de las funciones más importantes de estas bacterias es mantener una concentración elevada de este elemento (García et. ál., 1995), lo cual no es posible con cultivos puros de A. t.; esta es una de las principales razones de la baja eficiencia relativa en la oxidación, encontrada en estos cultivos.
De otro lado, estos cultivos alcanzan valores de pH menores en comparación con los cultivos puros de A. f., llegando en todos los casos a un pH de 1.4, como es de esperarse para los medios donde se encuentra activo A. t., ya que esta bacteria se especializa en oxidar compuestos reducidos del azufre hasta sulfatos, en una serie de reacciones intermedias donde se genera gran cantidad de ácido sulfúrico (Brock y Madigan 1998; Schippers ySand, 1999).
|
||
|
|
|||
|
61
|
|||
|
|
|||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 55-66
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
En cuanto a los valores de potencial de oxido-rreducción obtenidos en este trabajo, se pudo observar una gran variación dependiendo de los cultivos y de los tratamientos. En general este comportamiento se puede explicar por el hecho de que cuando el Eh se dispara hacia valores más positivos, esto se relaciona directamente con el incremento neto del radio Fe3+/Fe2+ en solución. Cuando el pH se dispara hacia valores ácidos, es el resultado del balance entre un consumo simultáneo de protones en la biooxida-ción del hierro ferroso y la liberación de protones relacionada con la precipitación de hierro férrico (Me-ruane y Vargas, 2003).
|
Los resultados también demuestran que el tamaño de partícula del mineral influye en la eficiencia del proceso de oxidación, ya que en la condición IV las partículas son más grandes (106 u,m, pasante malla 140). Un tamaño de partícula grande significa una menor área superficial de los granos, lo que se relaciona directamente con la eficiencia en la capacidad oxidativa de las bacterias y del ión férrico (Acevedoy Gentina, 1989; Fowleret ál., 1999).
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Análisis de la disolución de Fe y As
Los cultivos puros de A. t. registraron en general una menor eficiencia relativa en el proceso, ya que obtienen los valores más bajos en la concentración de hierro en solución, en comparación con los cultivos puros de A. f. Sin embargo, con la concentración de arsénico en solución no se observan diferencias muy significativas entre ellos (figuras 3 y 4).
En general, los cultivos puros de A. f. muestran una alta eficiencia relativa en el proceso global de biooxida-ción y biolixiviación de sulfuros en las condiciones I y II, basados en los resultados obtenidos por las mediciones de los parámetros cinéticos (pH, Eh, Fe, As a través del tiempo) y la caracterización del mineral. En estas condiciones, los cultivos logran lixiviar cantidades representativas de hierro y arsénico al compararlas con las alcanzadas por los demás cultivos (figuras 3 y 4).
Las condiciones III y IV presentan una eficiencia relativa menor en el proceso global de biooxidación y biolixiviación, representada en una baja disolución de hierro y arsénico. Parece que esto se debe principalmente al efecto del tamaño de partícula de 106 u.m (Deveci, 2004).
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
b)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 6. Proporciones relativas jarosita/pirita. a) Muestra del cultivo 3 (A. thioox.), condición I. b) Muestra del cultivo 1 (A. ferroox.), condición I.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
62
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
BIOOXIDACIÓN DE SULFUROS MEDIANTE CEPAS NATIVAS DE ACIDÓFILOS COMPATIBLES
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 1. Valores porcentuales relativos de los principales minerales presentes en el mineral biooxidado,
analizados por DRX.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Análisis de FTIR
Se considera que la presencia de materia orgánica proviene de la biomasa precipitada y productos propios del metabolismo de las células. Posiblemente en la última condición (IV) las células, al estar más adaptadas al sistema, proliferan en mayor número o, por el contrario, en estas condiciones las células se afectaron más negativamente y se precipitaron como biomasa.
Esta técnica evidencia la presencia de jarositas definidas y jarositas amorfas en cultivos con alta y con baja eficiencia de biooxidación, respectivamente; además de bandas de arsenatos y de oxihidróxi-dos de hierro en menor intensidad para los cultivos puros de A. t.
Análisis de DRX
En general, por los análisis de DRX, se observa lo que parece ser una tendencia de los cultivos puros de A. t. a oxidar preferencialmente la pirita, ya que las proporciones relativas de este sulfuro siempre son menores con respecto a los cultivos de A. f., lo que no ocurre con la arsenopirita, pues las
|
cantidades de esta son mayores (tabla 1 y figura 6). Sin embargo, este resultado no indica de modo con-cluyente que la arsenopirita no se oxide en este sistema, ya que por los análisis químicos se establecen concentraciones similares (a las obtenidas por A. f.) de arsénico total en solución. Probablemente las A f. posean una mejor capacidad de oxidar la pirita, debido a que este sulfuro posee más azufre, el cual es una de las principales fuentes de energía de estos microorganismos (Brocky Madigan, 1998).
Para los cultivos puros de A f. se registran proporciones relativas de arsenopirita menores (figura 6) con respecto a los demás, lo que indica una oxidación activa de este sulfuro, lo cual se evidencia también por microscopía electrónica, mientras que la pirita muestra una fase de oxidación inicial o parcial. Además, de estas condiciones, la condición I es la que exhibe un mejor comportamiento en el proceso global de biooxidación, pues presenta proporciones mayores de jarositas (sulfato hidratado de hierro), y esta es la fase mineral más abundante como producto secundario del proceso según Konhauser (1998) y Márquez (1999). Las A f. oxidan más fácilmente el hierro, por esta razón podrían oxidar preferencialmente la
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
63
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 55-66
|
|||
|
|
|||
 |
 |
||
|
Figura 7. Grano de arsenopirita totalmente oxidada, con jarosi-tas precipitadas alrededor, y grano de Py con oxidación inicial.
|
|||
|
Figura 10. Granos de arsenopirita en los cuales se observan diferentes estados de corrosión, uno con oxidación total, otra muy avanzada con un núcleo pequeño remanente y otro con un núcleo grande.
|
|||
 |
|||
 |
|||
|
Figura 8. Grano de pirita corroído.
|
|||
 |
|||
|
Figura 11. Seudomorfo parcial de galena con núcleo remanente que muestra un estado de corrosión avanzada.
|
|||
|
arsenopirita, ya que este sulfuro es más susceptible a la oxidación microbiana por su estructura molecular; además se ha reportado que estas bacterias tienen una mayor capacidad para tolerar altas concentraciones de arsénico y parecen estar involucradas en su precipitación (Du-quesne etál., 2003).
Análisis de SEM/EDX
En general, la muestra 1 condición II parece presentar una mejor oxidación que la muestra 2 condición I. A pesar de que la condición II poseía un tamaño de
|
|||
|
Figura 9. Grano de sulfosal de antimonio en estado de corrosión avanzada.
|
|||
|
|
|||
|
64
|
|||
|
|
|||
|
|
|||
|
BIOOXIDACIÓN DE SULFUROS MEDIANTE CEPAS NATIVAS DE ACIDÓFILOS COMPATIBLES
|
|||
|
|
|||
|
partícula mayor, posiblemente las bacterias van avanzando en su adaptación a la oxidación de sulfuros, ya que esto se ve reflejado en un mayor número de granos de arsenopirita casi en su totalidad oxidados con núcleos remanentes medianos y pequeños, así como en la presencia muy frecuente de seudo-morfos de arsenopirita totalmente oxidada (figura 7) y piritas con mayor grado de corrosión, que muestra golfos de corrosión mucho más profundos y con porosidad intensa hacia los bordes (figura 8), así como granos extensivamente corroídos, con grandes poros hacia el interior del cristal.
En general, en las muestras se observa que las partículas más grandes, sobre todo de pirita, se encuentran menos oxidadas. Sin embargo, las partículas de menor tamaño se presentan frecuentemente con un mayor grado de biooxidación.
En todas las muestras analizadas, lasjarositas se encuentran precipitadas como cristales individuales y aislados. En cuanto a la química mineral de los productos de oxidación jarosita y, en pequeñas cantidades, escorodita (arsenato de hierro), se puede decir que tienen cantidades variables de As. Este tipo de cristal presenta con frecuencia cantidades mayores de potasio, menores de fósforo y trazas de plata y muy raramente contenidos menores de elementos como el plomo o el antimonio.
Se considera que el K y el P provienen del medio de cultivo, y que Ag, Sb y Pb son producto de la lixiviación de fases minerales presentes en el concentrado, como galena, boulangerita, tetraedrita, entre otras. El K podría eventualmente provenir de la oxidación de moscovitas o feldespatos, presentes como minerales de la ganga, lo cual también puede aportar Si y Al a estas.
CONCLUSIONES
En esta investigación, las cepas nativas compatibles con Acidithiobacillus ferrooxidans y thiooxidans aisladas de la mina El Zancudo, Titiribí (Antioquia), revelan actividad oxidativa de sulfuros, mediante los análisis de los parámetros pH, Eh, Fe y As total en solución a través del tiempo y la caracterización del mineral pretratado, hallándose diferencias significativas entre ellos.
En general, todos los cultivos muestran una disminución gradual de pH y un aumento en el Eh a
|
través del tiempo. En este trabajo se define que los cultivos se afectan por la presencia de carbonatos en el mineral, lo cual interfiere en la fase de adaptación de las bacterias, retardándola. Sin embargo, se presentan diferencias en dicho retraso o inhibición, de acuerdo con el tipo de cepa utilizada y las condiciones a las que se sometieron los cultivos; las condiciones con mayor porcentaje de sustrato fueron las más afectadas. En un aspecto muy general, se podría analizar que los comportamientos en el pH/Eh se agrupan con base en el porcentaje de pulpa, mientras que la biolixiviación de hierro y arsénico aparentemente se afecta más por el tamaño de partícula.
Todos los cultivos mostraron normalmente las fases típicas de crecimiento microbiano: fase lag o de adaptación, fase de crecimiento exponencial y fase de estabilidad, las cuales se reflejan indirectamente por las mediciones diarias de pH, Eh, hierro y arsénico en solución. Además, las concentraciones de los dos elementos más representativos en el sistema (el hierro y el arsénico), que provienen de los sulfuros predominantes en el mineral, los cuales son la pirita y la arsenopirita, aumentan en todos los cultivos en el transcurso del experimento, y alcanzan altas concentraciones en solución, de alrededor de 60000 ppm para el hierro y 20000 para el arsénico.
En todos los cultivos de este bioensayo, el tamaño de partícula fue un factor evidentemente inhibitorio, ya que, como se discutió anteriormente, las condiciones III y IV exhiben una menor lixiviación de hierro y arsénico. En este trabajo la selección de los tamaños de partícula se hizo con base en dos factores; uno porque el tamaño de 75 |im pasante malla 200 es el que comúnmente se utiliza a nivel de laboratorio; el otro factor es que para un proceso de biolixiviación a gran escala, el tamaño de partícula es un parámetro crítico por su influencia en la velocidad del proceso y por los costos asociados con la reducción de tamaño a nivel industrial. Por esta razón se escogió el tamaño de 106 |im, ya que en nuestro medio es el más común en los procesos industriales.
Por los análisis de caracterización se evidenció y complementó la evaluación de la actividad oxidativa de las bacterias, por la formación de fases minerales propias de estos procesos, como sulfatos hidratados de hierro, arsenatos y oxihidróxidos de hierro. Además, se analizó el mecanismo oxidativo y se determinó corrosión y oxidación avanzada de los
|
||
|
|
|||
|
65
|
|||
|
|
|||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 55-66
|
|||
|
|
|||
|
sulfuros mediante análisis por microscopía electrónica con sonda de analizador microquímico (SEM/EDX).
Mediante el análisis mineralógico se pudo concluir que existen dos mecanismos diferentes en la biooxidación de la arsenopirita y la pirita. La arseno-pirita oxida generando seudomorfos y presentando oxidación y corrosión avanzadas, mientras que en la pirita predomina la disolución de las especies constituyentes (hierro y azufre) y no se observa la formación de cristales seudomorfos.
Se puede decir que el sistema evaluado es muy complejo ya que hay muchas especies metálicas en solución que interactúan entre sí al lixiviarse por acción directa e indirecta de los microorganismos. Dichos iones metálicos, como Fe, As, Cu, Zn, Pb, Ag, entre otros, tienen diferentes capacidades para precipitarse con las fases minerales que se forman en el proceso; por ejemplo, el Cu y el Zn no poseen dicha afinidad, pero el Pb y la Ag sí pueden precipitarse con las jarositas.
Este fenómeno se evidenció por SEM/EDX en este sistema, lo cual podría ayudar a explicar el proceso global de biooxidación, al establecer cuál o cuáles de estas especies desempeñan un papel importante como controladores cinéticos en este sistema.
AGRADECIMIENTOS
A Colciencias por la coofinanciación, a los laboratorios de: Instituto de Minerales CIMEX, Microscopía Electrónica, Química, Microbiología de la Sede Me-dellín y el laboratorio de Física del Plasma de la Sede Manizales.
BIBLIOGRAFÍA
Acevedo, F.; Gentina, J. C. 1989. Process engineering as-pects of the bioleaching of copper ores. Bioprocess Engineering. 4: 223-229.
Brock, T. D.; Madigan, M. T. 1998. Ecología de los microoga-nismos. 8a. ed. Illinois.
Deveci, H. 2004. Effect of particle size and shape of solids on the viability of acidophilic bacteria during mixing in sti-rred tank reactors. Hydrometallurgy. 71: 385-396.
Duquesne, K.; Lebrun, S.; Casiot, C.; Bruneel, O.; Personné, J.-C.; Leblanc, M.; Elbaz-Poulichet, F.; Marín, G.; Bon-nefoy, V. 2003. Immobilization of arsenite and ferric iron by Acidithiobacillus ferrooxidans and its relevance to
|
acid mine drainage. Applied and Environmental Micro-biology. 69 (10): 6165-6173.
Fowler, T. A.; Holmes, P. R.; Crundwell, F. K. 1999. Mecha-nism of pyrite dissolution in the presence of Thiobacillus ferrooxidans. Applied and Environmental Microbiology. 65 (7): 2987-2993.
García, O.; Bigham, J. M.; Tuovinen, O. H. 1995. Sphalerite oxidation by Thiobacillus ferrooxidans and Thiobacillus thiooxidans. Canadian Journal Microbiology. 41: 578-584.
Ingeominas. 1987. Recursos minerales de Colombia. Publicaciones Geológicas Especiales del Ingeominas. Tomo I. Segunda edición.
Konhauser, K. O. 1998. Diversity of bacterial iron mineraliza-tion. Elsevier, Earth-Science Reviews. 43: 91-121.
Lasse, A.: Olli, T. 1991. Temperature effects on bacterial lea-ching of sulfide minerals in shake flask experiments. Applied Environmental Microbiology. 57 (1): 138-145.
Lazaroff, N.; Sigal, W.; Wasserman, A. 1982. Iron oxidation and precipitation of ferric hydroxysulfates by resting Thiobacillus ferrooxidans cells. Applied Environmental Microbiology. Apr. 924-938.
Márquez, M. A. 1999. Mineralogía dos processos de oxidaçno sobre pressno e bacteriana do minerio de ouro da mina Sao Bento, MG. Tese de doutorado. Universidad de Brasilia.
Marsden, J.; House, I.1992. The chemistry of gold extraction. England: Ed. Ellis Horwood.
Meruane, G.; Vargas T. 2003. Bacterial oxidation of ferrous iron by Acidithiobacillus ferrooxidans in the pH range 2.5-7.0. Hydrometallurgy. 71: 149-158.
Mustin, C.; Berthelin, J.; Marion, P.; Donato, P. 1992. Corrosion and electrochemical oxidation of a pyrite by Thiobacillus ferrooxidans. Applied Environmental Microbiology. 58 (4): 1175-1182.
Nyquist, R. A.; Kagel, R. O.1971. Infrared spectra of inorganic compounds (3800 - 45 cm-1). New York and London: Academic Press. 495.
Sasaki, K. 1997. Morphological characterization of jarosite groups formed through mediation of Thiobacillus ferrooxidans. J. Mineral. Soc. Japan. 26,47-50. (in Japanese, with English abstr.)
Sasaki, K.; Konno, H. 2000. Morphology of jarosite groups compounds precipitated from biologically and chemi-cally oxidized Fe ions. Canadian Mineralogist. 45-46.
Schippers,A.;Sand,W. 1999. Bacterial leachingof metal sulfi-des proceeds by two indirect mechanisms via thiosulfa-te or via polysulfides and sulfur. Applied and Environmental Microbiology. 38: 319-321.
Staley, J. T.; Bryant, M. P.; Pfennig, N.; Hott, J. G. 1991. Bergey's manual of systematic bacteriology. 3: 1842-1858.
Van der Marel, H. W.; Beutelspacher, H. 1976. Atlas of infrared spectroscopy of clay minerals and their admixtures. New York: Elsevier Scientific Publishing Com-pany. 396.
|
||
|
|
|||
|
66
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2005 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















