Evaluación de la bioestimulación en la biodegradación de TPHs en suelos contaminados con petróleo
Bioestimulation process during the biodegradation of TPH in oil contaminated soil
Palabras clave:
biodegradación, bioestimulación, TPHs, petróleo, nutrientes, biodegration, bioestimulation, petroleum, nutrients (es)|
|
||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 67-78
|
||
|
|
||
|
Evaluación de la bioestimulación en la biodegradación de TPHs en suelos contaminados con petróleo
Bioestimulation process during the biodegradation of TPH in oil contaminated soil
Victoria Vallejo*, Laura Salgado**, Fabio Roldan***
RESUMEN
El presente estudio evaluó el efecto de la adición de nutrientes (N y P) en forma de sales inorgánicas simples (SIS) y un fertilizante inorgánico compuesto (FIC) en la biodegradación de hidrocarburos totales de petróleo (TPHs). Se emplearon mesocosmos con suelo contaminado (20,000 mgTPH/kgps) y se evaluó un control abiótico y un control sin nutrientes (n=3). El estudio se realizó durante 125 días con 5 eventos de muestreo (EM). Durante el estudio se evaluaron y compararon dos métodos analíticos para la cuantificación de TPHs: el método D-5831 (ASTM, 1995) y el método modificado de extracción por agitación mecánica y determinación gravimétrica (EAMG) (EPA, 1994; Schawab et ál., 1999). Para monitorear la biorremediación se evaluaron parámetros físico-químicos: pH, porcentaje de humedad y nutrientes, y microbiológicos: recuento en placa de heterótrofos y degradadores de HCs por la técnica del número más probable (NMP-INT). Finalmente, se realizó una caracterización bioquímica de los degradadores. Las mayores tasas de degradación de TPHs se observaron durante los primeros 28 días en SIS y FIC (278 y 235 mgTPHs/kgps/d, respectivamente) con relación a los controles (110 mgTPHs/kgps/d). El control abiótico mostró que la biodegradación intrínseca fue el proceso predominante en la degradación de TPHs durante el estudio. Aunque no hubo diferencias significativas en las concentraciones de TPHs a través del tiempo, entre los tratamientos y el control sin nutrientes, las SIS mostraron un mayor porcentaje de degradación (39% y 41% por los métodos D-5831y EAMG, respectivamente). El bajo número de degradadores (1x103 NMP/gps) y el bajo pH (4,1) alcanzado en los tratamientos pudieron haber limitado mayores porcentajes de degradación. Stenotrophomonas maltophilia fue la especie predominante durante el estudio (34%).
Palabras clave: biodegradación, bioestimulación, TPHs, petróleo, nutrientes.
ABSTRACT
The present study evaluated the effect of the nutrients addition (N and P) by using the amendment of inorganic simple fertilizer (SIS) and inorganic compound fertilizers (FIC) in the biodegradation of total hydrocarbon petroleum (TPH). Mesocosmos were used with contaminated soil (20,000 mgTPH/kgdw), abiotic control and a control without nutrient (n=3) were used to evaluate the effect of nutrient amendment. The study was conducted during 125 days with 5 sampling events (EM). During the study two analytical methods for the determination of total petroleum hydrocarbons (TPHs): Method D-5831 (ASTM) and the modified extraction by mechanical agitation and gravimetric determination method (EAMG) (EPA, 1994; Schawab et al., 1999) were evaluated and compared. To monitor the bioremediation physic-chemical (pH, % moisture, and nutrients) and microbiological (heterotrophic and hydrocarbon degrader microorganisms) parameters were evaluated. The highest TPH degradation rates were observed during the first 28 days in the SIS and FIC
|
||
|
|
||
|
Bacterióloga, M. Sc. Joven investigadora, Pontificia Universidad Javeriana, Bogotá D. C. Correo electrónico:
vvallejo@javeriana.edu.co ** Estudiante de Microbiología Industrial, Pontificia Universidad Javeriana. Correo electrónico:
lauraram@hotmail.com *** Microbiólogo, M. Se, Ph. D. Profesor Asistente, Pontificia Universidad Javeriana. Coordinador de la Unidad de
Saneamiento y Biotecnología Ambiental (USBA). Teléfono: 3208320 ext: 4089. Correo electrónico:
fabio. roldan@javeriana.edu.co
Recibido: Octubre 20 de 2005 Aceptado: Noviembre 30 de 2005
|
||
|
|
||
|
67
|
||
|
|
||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 67-78
|
|||
|
|
|||
|
treatments (278 and 235 mgTPHs/kgdw/d, respectively) compared to the controls (110 mgTPHs/kgdw/d). The abiotic control indicated that the intrinsic bioremediation was the main process during the TPH degradation. Although, there was not significant differences between treatments and the control without nutrients, SIS showed the highest TPH degradation (39% and 41% by D-5831 and EAMG methods, respectively). The low pH (4,1) at the end of the study and the low degraders numbers (1x103 NMP/gdw) in the treatments could be the limiting factors to achieve higher degradations rates. Stenotrophomonas maltophilia was the predominant microorganism during the study (34%).
Key words: biodegration, bioestimulation, TPHs, petroleum, nutrients.
|
|||
|
|
|||
|
INTRODUCCIÓN
Uno de los problemas de contaminación ambiental más importantes a nivel mundial es el vertido de hidrocarburos totales de petróleo (TPHs) en ecosistemas acuáticos y terrestres (Rahman et ál., 2003; Ye-rushalmi et ál., 2003). La mayor contaminación por TPHs se ocasiona durante los procesos de embarque y desembarque de crudo en los puertos, operaciones de prospección, actividades de extracción, transporte, almacenamiento y refinamiento de petróleo (Ecopetrol, 2001; Roling et ál., 2002). En Colombia, la explotación petrolera y todos los procesos relacionados con esta actividad han generado un incremento en la contaminación por vertimiento de petróleo y la disposición de residuos en los ecosistemas. La presencia de TPHs representa graves problemas ambientales para los ecosistemas y problemas económicos para las compañías. Por esta razón, es necesaria la búsqueda y aplicación de procesos como la biorremediación, la cual proporciona una solución ambientalmente segura, efectiva y económica para la remediación de suelos contaminados con petróleo. El objetivo principal de la biorremediación es acelerar la degradación total o parcial del contaminante orgánico disminuyendo su toxicidad, movilidad e impacto ambiental (Dua et ál., 2002).
La biodegradación de TPHs puede verse afectada por las condiciones ambientales que se presenten en el sitio contaminado, por este motivo es indispensable controlarlas para que la actividad de los microorganismos degradadores sea eficiente. Los factores que más intervienen dentro de la biodegradación son: temperatura, pH, Humedad, aceptores de electrones y nutrientes. Adicionalmente, después de un derrame de petróleo, se observa una elevada concentración de carbono y una carencia de nitrógeno (N) y fósforo (P) necesarios para el metabolismo microbiano por este motivo se debe optar por la
|
implementación de estrategias de biorremediación como la bioestimulación o la bioaumentación.
Durante la bioestimulación se suministran factores limitantes como nutrientes y aceptores de electrones (AEs) que estimulan el metabolismo y la velocidad de crecimiento de los degradadores, lo cual acelera las tasas de biodegradación si las condiciones ambientales son favorables (Marguesin y Schin-ner, 1997; Marguesin et ál., 2000; Kaplan y Kitts, 2004). La adición de nutrientes en ambientes contaminados permite una degradación más rápida y eficaz de los hidrocarburos (HCs) por parte de los microorganismos nativos (Hamme et ál., 2003; Margesin et ál., 2003a, b). La técnica de biolabranza se basa en un proceso biológico que estimula y mantiene una población microbiana aeróbica que utiliza los HCs como fuente de carbono y energía, convirtiéndose en una opción efectiva para la eliminación de los HCs de petróleo y de resultados favorables para la industria petrolera (Reynolds et ál., 1997; Cunning-ham y Philp, 2000; Margesin et ál.; 2000; Cleves y Sandoval, 2001).
Estudios previos reportaron que la bioestimulación acelera las tasas de biodegradación en suelos contaminados con TPHs, controlando factores como pH, porcentajes de humedad, concentración de TPHs (fracciones de difícil degradación), AEs y temperatura. Sin embargo, en la mayoría de estos estudios se logró incrementar la actividad de biodegradación únicamente con la adición de nutrientes en forma de fertilizantes inorgánicos compuestos (FIC) y sales inorgánicas simples (SIS) (Dibble y Bartha, 1979; Song y Bartha, 1990; Song et ál., 1990; Margesin et ál,. 2000; Margesin y Schinner, 2001; Broock et ál., 2001; Coulon y Delille, 2003; Yerushal-mi et ál., 2003).
El objetivo del presente estudio fue evaluar el efecto de la bioestimulación (adición de nutrientes)
|
||
|
|
|||
|
68
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
EVALUACIÓN DE LA BIOESTIMULACIÓN EN LA BIODEGRADACIÓN DE TPHs EN SUELOS CONTAMINADOS
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
en la degradación de TPHs en suelos contaminados con petróleo. Se comparó la adición de SIS y FIC, correlacionando factores físico-químicos y microbio-lógicos. Se cuantificaron, aislaron e identificaron bioquímicamente los microorganismos degradadores de HCs. Para la evaluación de TPHs se comparó la técnica modificada de extracción por agitación mecánica y determinación gravimétrica (EAMG) (EPA, 1994; Schawab et ál., 1999) y con el método D-5831 (ASTM, 1995). Este estudio permitió ampliar el conocimiento sobre los diversos parámetros ambientales que influyen durante los procesos de biorremedia-ción, y de la diversidad microbiana de degradadores nativos y su potencial uso biotecnológico en el tratamiento de suelos contaminados con TPHs.
MATERIALES Y MÉTODOS
El estudio se realizó en mesocosmos de polietile-no de alta densidad (60 cm x 40 cm x 35 cm), material seleccionado por su baja permeabilidad y mínima absorción de TPHs (Margesin et ál., 2000, 2003a). Durante el estudio se evaluó la adición de SIS en forma de NH4NO3 (Mol-Labs) y K2HPO4 (JT Baker) y FIC de tipo N:P:K (15:15:15) (Fergon®). Los fertilizantes se adicionaron los días 0 y 63 del estudio para generar un aporte equitativo de nitrógeno y fósforo (Margesin y Schinner, 1997; Cleves y Sandoval, 2001; Margesin et ál., 2000, 2003a). Adicionalmente, se utilizó un control abiótico (Basamid®, 70 g/m2) y un control sin adición de nutrientes. Todos los tratamientos y controles se hicieron por triplicado (n=3). El estudio se realizó durante 125 días con 5 eventos de mues-treo (EM) cada 25 días. Se tomaron 2 muestras aleatorias por mesocosmo para un total de 6 muestras por tratamiento.
Localización del área de estudio
El estudio se realizó en el invernadero de la Facultad de Ciencias de la Pontificia Universidad Javeriana (PUJ), (Bogotá). Los análisis físico-químicos y mi-crobiológicos se llevaron a cabo en el laboratorio de la Unidad de Saneamiento y Biotecnología Ambiental (USBA) de la Pontificia Universidad Javeriana.
Suelo
El suelo empleado en el montaje de los mesocosmos se obtuvo de la finca San Javier-PUJ (Zipa-quirá, Cundinamarca). Este suelo no había recibido
|
contaminación alguna con petróleo ni había sido fertilizado. La capa vegetal fue removida por descapote manual y el suelo se tomó hasta una profundidad de 20 cm. Para la caracterización inicial del suelo se realizaron análisis físico-químicos en los laboratorios del Instituto Geográfico Agustín Codazzi (IGAC) (tabla 1).
Montaje de los mesocosmos
Se contaminaron 500 kg de suelo con 10 kg de crudo (tipo Castilla: 12° API) para una concentración final de 20,000 mgTPH/kgps. Con base en las concentraciones de N y P presentes en el suelo (tabla 1) se realizó el balance y adición de los nutrientes, con el objetivo de ajustar la relación final de C:N:P en la mezcla resultante. Se utilizó una relación 100:10:1, reportada como eficiente en numerosos estudios de biorremediación (Margesin y Shinner, 1997; Ávila, 1999; Margesin et ál., 2000; Cleves y Sandoval, 2001; Hamme et ál., 2003). Para evaluar el efecto de la adición de FIC, se seleccionó el fertilizante triple quince por su bajo costo, fácil adquisición y manejo. Además, este fertilizante había sido empleado en diferentes estudios de biorremediación
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 1. Características físico-químicas y granulométricas del suelo empleado en el estudio
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
69
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 67-78
|
|||
|
|
|||
|
de suelos (Cleves y Sandoval, 2001; Margesin y Shinner, 1997, 2000, 2003a). Se adicionaron 534 g de FIC y como SIS: 229 g de NH4NO3 y 44 g de K2HPO4 por mesocosmo.
Métodos analíticos para la determinación de TPHs
Durante el estudio se evaluaron y compararon 2 métodos analíticos para la cuantificación de TPHs: el método modificado de extracción por agitación mecánica y determinación gravimétrica (EAMG) (EPA, 1994; Schawab et ál., 1999) y el método estándar para la determinación de combustibles en suelos D-5831 (ASTM, 1995) utilizado previamente en otros estudios (Cleves y Sandoval, 2001; Roldan, 2001). Para comparar la eficiencia en los procesos de extracción y determinación de TPHs por los métodos analíticos se utilizaron diferentes matrices: suelo sin contaminar (SSC), suelo contaminado (SC), arena sin contaminar (ASC) y arena contaminada (AC) con 60,000 mgTPH/kgps. Los métodos se compararon con relación a sus límites de cuantificación (LC), límites de detección del método (LDM), coeficientes de variación (% CV) y porcentajes de recuperación (% P).
Para el método EAMG modificado se realizó un proceso de extracción de TPHs con acetona:di-clorometano (1:1) (Mallinckrodt, GR) en agitación a 120 rpm por 30 min y se centrifugó a 1000 rpm por 10 min. El sobrenadante se recogió y este procedimiento se repitió 3 veces. Este sobrenadante se filtró (Whatman No. 40) con 1 g de sílica gel (Merck®) que se secó previamente durante 1 h a 250 °C. El filtrado se puso en tubos de vidrio de 50 mL previamente pesado (± 0,0001 g) (Mettler; AJ 150) y colocados en baño maría (Precision Scienti-fic) a una temperatura de 55 ± 5 °C, durante 2 horas hasta peso constante. La concentración de TPHs presente en las muestras se obtuvo por la diferencia del peso del tubo antes y después de la evaporación (determinación gravimétrica) (EPA, 1994).
Análisis fisicoquímicos
Para monitorear el proceso de biorremediación se evaluó: pH por el método 9045c (EPA, 1999), nitratos, amonio y fósforo por los métodos 366, 391 y 531 (HACH, 1994).
|
Análisis microbiológicos
Para el recuento de microorganismos heterótrofos se empleó el método de recuento en placa en medio agar infusión suelo (ASM, 1986; Standard Methods, 2000). El recuento de microorganismos degradadores de HCs se realizó mediante el método del número más probable (NMP) en placas de 96 pozos, empleando el indicador yodonitrotetrazolium (INT) (Wrein y Venosa, 1996; Hainnes et ál., 1996). Se empleó el medio mínimo de sales Bushnell-Haas (BH) y diésel como fuente de carbono y energía. Una combinación de pozos positivos/negativos de las 5 diluciones realizadas se analizó en el programa Most Probable Number Cal-culator (v4.04,1996). Las bacterias degradadoras fueron aisladas de los pozos de las diluciones más altas que presentaron crecimiento en el NMP. Se estableció una atmósfera saturada de HCs usando sensidiscos (Whattman No. 40) impregnados con 20 |iL diésel localizados en la tapa de la caja de petri (Margesin et ál., 2003a, b). Las cajas se incubaron durante 15 días a temperatura ambiente (22 ± 2 °C). Las colonias que presentaron características diferentes macro y microscópicamente se seleccionaron y se identificaron mediante pruebas bioquímicas (Crystal®).
Análisis estadístico
Inicialmente se realizó una prueba de Shapiro Wilk (p<0.05) (Statistix 8,2003) para determinar si los datos seguían una distribución normal. Las variables que no presentaron una distribución normal se transformaron con el logaritmo base 10. Posteriormente se realizó el análisis de los resultados empleando un análisis de varianza (Anova) (p<0.05). Este último se soportó con un análisis de comparaciones múltiples (Scheffé) (p<0.05). Finalmente se realizó el análisis de correlación de Pearson (distribución paramétrica) o Sperman (distribución no paramétrica).
RESULTADOS Y DISCUSIÓN Caracterización del suelo
Con la adición de petróleo al suelo las concentraciones de nutrientes fueron significativamente menores que las concentraciones iniciales deN-NO3, N-NH4+ y P (12.0 ± 2.8, 4.5 ± 0.7 y 11.8 ± 0.2 mg/kgps, respectivamente) (t-student, 2 colas, p< 0.05) (n=6). El pequeño tamaño de partícula y de poro por el alto porcentaje de arcilla dificultó el
|
||
|
|
|||
|
70
|
|||
|
|
|||
|
|
|||
|
EVALUACIÓN DE LA BIOESTIMULACIÓN EN LA BIODEGRADACIÓN DE TPHs EN SUELOS CONTAMINADOS
|
|||
|
|
|||
|
proceso de humedecimiento, preparación y homo-genización de la mezcla. El pH inicial del suelo (5.0 ± 0.1) no se modificó para no afectar los microorganismos nativos y debido a los estudios exitosos de bio-rremediación de TPHs en suelos ácidos (Leahy y Colwell, 1990; Hickey, 1995; Raymond et ál., 1998; Margesin y Shinner, 2001).
Análisis de pH y porcentaje de humedad
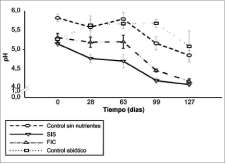
Durante el estudio, se observó una reducción significativa del pH en SIS y FIC: 4,1 ± 0.1 y 4,2 ± 0.2, respectivamente (Scheffé, p<0.05; n= 120) (figura 1). Esta disminución de pH coincidió con el aumento en la concentración de nitratos en SIS.
|
Análisis de nutrientes (nitrato, amonio y fósforo)
Las concentraciones de nitrato (14.0 ± 3.6 y 23.0 ± 7.7 mg N -NO3/kgps) y amonio (28.6 ± 10.7 y 39.0 ± 15.3 mg N - NH4 /kgps) en el control abiótico y sin nutrientes, respectivamente, fueron constantes durante el estudio y no presentaron cambios significativos (Anova, p<0.05; n=120) (figura 2).
|
||
|
Después de la adición inicial de nutrientes, las concentraciones de nitratos en SIS y FIC fueron de 404.0 ± 18.8 y 62.7 ± 2.8 mg N -NO3/kgps (n=6), respectivamente (figura 2). Se observó un consumo significativo de nitrato en SIS inmediatamente después de la adición de los tratamientos (días 0 y 63). Esto pudo ser causado porque el nitrato presente en este tipo de fertilizante es más soluble que el nitrato presente en el FIC, y por esta razón es asimilado más rápidamente por los microorganismos degradadores.
La baja concentración de nitrato en FIC se atribuyó a que el amonio es la fuente principal de nitrógeno en este tratamiento. El aumento significativo hacia el día 28 (300.0 ± 35.2 mg N-NO3/kgps) fue causado por la liberación lenta de este tipo de fertilizante, el cual aporta progresivamente la fuente de nitrógeno al suelo (Suppo, 1996). Adicionalmente, este fenómeno pudo ser el resultado del proceso de nitrificación al utilizar el amonio como donador de electrones en presencia de oxígeno. Durante este período (> 28d) se presentó la reducción más significativa de los valores de pH en el suelo, posiblemente debido a este proceso, en el cual se liberan iones de hidrógeno (H+) que incrementan la acidez del suelo (Sylvia et ál., 2005; Atlas y Bartha, 2001).
Las concentraciones de amonio después de la adición inicial de nutrientes fueron de 134.1 ± 34.6 y 276.9 ± 34.5 mg N-NH4+/kgps para SIS y FIC, respectivamente (figura 2). Esta concentración de amonio en SIS fue constante durante el estudio. Por otro lado, en FIC se evidenció una reducción significativa hasta el día 99 (Scheffé, p<0.05). Este descenso de amonio pudo ser causado por su incorporación en la biomasa microbiana durante la degradación o la inmovilización en las matrices del suelo de este nutriente (Margesin y Schinner, 1997 y 2001).
Durante el estudio no se observaron cambios en las concentraciones de fósforo en los controles (figura 2) (Scheffé, p<0.05; n=120). Por el contrario,
|
|||
 |
|||
|
Figura 1. Valores de pH durante el estudio. Se presenta el valor promedio (n = 6) y barras de error (± 1 ds).
|
|||
|
La disminución inicial de pH pudo estar asociada a la baja capacidad amortiguadora del suelo y al metabolismo activo microbiano en presencia de TPHs y nutrientes (Margesin y Schinner, 1997; Atlas y Bartha, 2001), fenómeno que no se observó en el control abiótico. Adicionalmente, los bajos valores de pH evidenciados a partir del día 63 pudieron haberse causado por la formación de ácido nítrico, presencia de fosfatos de hierro y aluminio en el suelo (Wrennetál., 1994; Margesin y Schinner, 1997; Margesin et ál., 2000, 2003b). Aunque inicialmente los degradadores nativos estaban adaptados a un pH moderadamente ácido (5,0), los bajos valores presentes al final del estudio (4,0), pudieron inhibir el desarrollo y crecimiento de estas poblaciones, lo cual se evidenció por los bajos recuentos de heterótrofos y degradadores hacia el final del estudio en los tratamientos con nutrientes.
|
|||
|
|
|||
|
71
|
|||
|
|
|||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 67-78
|
|||
|
|
|||
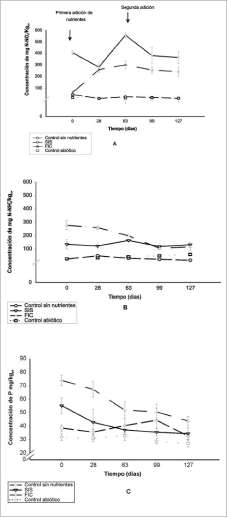 |
2001). El FIC (15% de P2O5 y 15% de P soluble en agua) aportó una mayor cantidad de fósforo que las SIS (74.03 ± 3.76 mg P/kgps y 55.22 ±4.16 mg/kgps, respectivamente), lo cual es importante a la hora de seleccionar el tipo de fertilizante adecuado para la biorremediación, teniendo en cuenta su costo-eficiencia.
El FIC es de fácil aplicación, bajo costo y, por ser un fertilizante de liberación lenta, aporta los nutrientes en forma gradual y continua, a una tasa ajustada a las necesidades de los microorganismos. Sin embargo, su presentación en forma de gránulos secos en algunos casos dificultó su distribución uniforme y homoge-nización en el suelo. Por el contrario, aunque las SIS se disuelven más rápidamente en el agua, son más costosas y aportan una baja cantidad de fósforo, el cual se consume rápidamente por los microorganismos degradadores al inicio de la biodegradación.
Comparación de los métodos analíticos para la cuantificación de TPHs
Los límites de cuantificación (LC) y los límites de detección del método (LDM) para el método ASTM fueron significativamente menores que los de EAMG (tabla 2). Por este motivo, concentraciones menores de TPH pudieron detectarse y cuantificar-se por el método de ASTM. Esta diferencia pudo ser causada porque en el método de EAMG se utilizó la desviación estándar (ds) de los datos obtenidos en ASC, mientras que para el ASTM se utilizó la absorbancia del estándar de calibración más bajo empleado en las curvas de calibración (10 mg/L). El método de ASTM presentó interferencias con los compuestos orgánicos presentes en el SC mostrando un bajo %P (82.0 ± 5.0%), a diferencia del método EAMG en el cual fueron significativamente mayores (101.3 ± 7.5%).
La precisión del método ASTM (%CV) durante el análisis de ASC y SSC (57.8 y 17.0 %, respectivamente) estuvo por fuera del rango recomendado, a diferencia del método de EAMG en el cual todos los %CV se encontraron dentro del rango recomendado, excepto para el SSC (44%) (tabla 2). Comparando la precisión de las muestras de SC analizadas durante el estudio, se observó que hubo diferencias significativas en los %CV de los 2 métodos evaluados (t-student, 2 colas, p<0.05). Esta diferencia pudo ser causada por la alta variabilidad y poca
|
||
|
Figura 2. Concentración de nitrato (A), amonio (B) y fósforo (C). Se presenta el valor promedio (n = 6) y barras de error (+1 ds). Las fechas indican la adición de nutrientes.
se observó un consumo significativo en SIS y FIC (Anova, p<0.05; n=120). La disminución de este nutriente pudo ser causada por el metabolismo activo de los microorganismos durante la degradación (Margesin y Schinner, 1997; Rittman y Mc Carty,
|
|||
|
|
|||
|
72
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
EVALUACIÓN DE LA BIOESTIMULACIÓN EN LA BIODEGRADACIÓN DE TPHs EN SUELOS CONTAMINADOS
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
homogeneidad presente en la mezcla de suelo: petróleo, ocasionada por el gran contenido de arcilla del suelo. En términos generales, el método EAMG presentó una mejor precisión y exactitud que el método ASTM en las diferentes matrices de suelo que se analizaron.
Biodegradación de TPHs
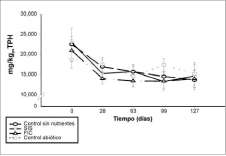
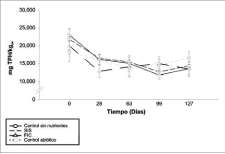
La concentración inicial de TPHs en el suelo fue de 21,344 ± 2,910 mg TPH/kgps. Al finalizar el estudio se observó una degradación significativa de HCs en los tratamientos con nutrientes y controles (Anova, p<0.05; n=120) (figuras 3 y 4). Sin embargo, la mayor degradación de TPHs durante el estudio se evidenció durante los primeros 28 días. Las mayores tasas de biodegradación se presentaron en SIS y FIC (278.2 ± 3.7 y 234.4 ± 5.6 mg TPH/kgps/d, respectivamente), comparados con los controles (116.5 ± 32.1 mg TPH/kgps/d). De igual forma, en este período se presentó un consumo marcado de nutrientes, específicamente nitrato y fósforo (figura 2), lo cual indica que la adición de nutrientes estimuló la biodegradación por parte de los microorganismos nativos.
|
Después del día 28 las tasas de degradación fueron más lentas, posiblemente por la disminución del pH, que se presentó en los tratamientos con nutrientes, lo cual pudo llegar a inhibir el crecimiento de los degradadores. Adicionalmente, la presencia de compuestos de alto peso molecular difíciles de degradar por parte de los microorganismos pudo reducir las tasas de degradación (Margesin y Schinner, 1997; Ercoli et ál., 2001; Ritmman y Mc Carty, 2001). Estudios previos reportaron que la degradación de HCs disminuye con el tiempo, debido a que estos se vuelven menos disponibles para la biodegradación por su carácter recalcitrante y su limitada biodisponi-bilidad. Además, se observó una tendencia decreciente de los recuentos microbianos antes del agotamiento de los TPHs (Song y Bartha, 1990; Margesin y Schinner, 1999).
A pesar de que no se observaron diferencias significativas en las concentraciones finales de TPHs (Anova, p<0.05; n=120) (figuras 3 y 4), la SIS y el FIC presentaron los mayores porcentajes de remoción a lo largo del estudio (40 y 34%, respectivamente), comparados con los controles sin nutrientes y abiótico (30 y 13% respectivamente), lo que indica que la
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
73
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 67-78
|
||||
|
|
||||
 |
Estudios microbiológicos
El recuento de heterótrofos en el suelo antes de ser contaminado (7.8 x106 UFC/gps) fue similar a lo reportado en la literatura para suelos de la Sabana de Bogotá con altos porcentajes de materia orgánica y arcilla (IGAC, 1995). Sin embargo, el recuento de degradadores fue 21x104NMP/gps, el cual se considera bajo al compararlo con lo reportado en otros estudios: 106-109gps para suelos alpinos, con altos porcentajes de arena (53%) y con pH cercanos a la neutralidad (6,0-7,0) (Macnaughton et ál., 1999; Margesin et ál., 2000; Margesin y Shinner, 2001).
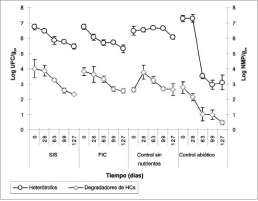
El control sin nutrientes no presentó cambios significativos en el recuento de heterótrofos (Anova, p<0.05; n=120); mientras que el recuento de microorganismos degradadores en el día 0 fue el más bajo del estudio (45x101 NMP/gps). Los recuentos en este control se incrementaron hasta el día 28 y alcanzaron un recuento similar al de SIS y FIC (86x102 NMP/gps). Este control mostró un proceso de adaptación de los microorganismos a los HCs que permitió el aumento de la población microbiana hasta el día 28 (figura 5).
La adición de nutrientes estimuló las poblaciones de heterótrofos y degradadores al inicio del estudio (figura 5). Posteriormente, se presentó una disminución significativa en los recuentos de microorganismos hasta alcanzar recuentos similares
|
|||
|
Figura 3. Concentraciones de TPHs durante el estudio por el método D-5831 (ASTM, 1995). Se presenta el valor promedio (n=6) y barras de error (± 1ds).
|
||||
 |
||||
|
Figura 4. Concentraciones de TPHs durante el estudio por el método de EAMG (EPA, 1994; Schawab et ál., 1999). Se presenta el valor promedio (n=6) y barras de error (±1 ds).
|
||||
|
|
||||
|
biodegradación intrínseca fue el proceso predominante en este estudio. Los mayores porcentajes de degradación observados en las SIS pudieron ser causados por la mayor solubilidad y disponibilidad de los nutrientes en el suelo para los microorganismos nativos (Wrenn et ál., 1994). Sin embargo, se reportó que la bioestimulación no siempre incrementa los porcentajes de degradación de TPHs, debido a que otros factores pueden limitar la actividad microbiana o interactuarcon los nutrientes, disminuyendo la tasa de degradación. Algunos de los factores identificados son: bajo pH (<5.0), bajo porcentaje de humedad, concentración de los TPHs (fracciones de difícil degradación), AE, temperatura y biodisponibi-lidad, entre otros (Speight, 1991; Cleves y Sandoval, 2001).
|
 |
|||
|
Figura 5. Relación de heterótrofos y degradadores de HCs durante el estudio. Se muestra el valor promedio (n=6) y barras de error (±1 ds).
|
||||
|
|
||||
|
74
|
||||
|
|
||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
EVALUACIÓN DE LA BIOESTIMULACIÓN EN LA BIODEGRADACIÓN DE TPHs EN SUELOS CONTAMINADOS
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
al control sin nutrientes. Estos bajos recuentos de microorganismos se observaron en diferentes estudios de remediación cuando las concentraciones de TPHs disminuyen con el tiempo o cuando algún factor limita el crecimiento (Margesin y Schinner, 1997a; Margesin y Schinner, 2001; Margesin et ál., 2003a, b). La reducción de los recuentos de degra-dadores en SIS y FIC pudo estar relacionada con los bajos valores de pH que se presentaron a partir del día 28, que inhibieron su crecimiento e hicieron más lentas las tasas de degradación de TPHs. Al inicio del estudio el control abiótico mostró altos recuentos de heterótrofos y degradadores; por esta razón se aplicó el producto nuevamente y se obtuvieron bajos recuentos a partir del día 63 (<102 UFC/gps) (figura 5).
Se identificaron 6 especies de microorganismos degradadores de HCs: Stenotrophomonas mal-tophilia, Acinetobacter iwoffii, Burkholderia cepacia, Pseudomonas putida, Chomobacterium violaceum, Flavimonas oryzihabitans, las cuales se reportaron en estudios de biorremediación (Macnaughton et ál., 1999; Rahman et ál., 2002; Roling et ál., 2002; Margesin et ál., 2003b). La especie predominante durante el estudio fue S. maltophilia (34%), que mostró su amplia diversidad y capacidad metabólica para degradar una variedad de HCs. Whyte y colaboradores
|
(1997) aislaron Pseudomonas sp. de un suelo antártico contaminado con petróleo, y evaluaron su capacidad para degradar alcanos, benceno, tolueno y naftaleno. Rahman y colaboradores (2003) realizaron estudios con microorganismos degradadores de HCs, entre los cuales se encontraban: Pseudomonas sp., Acinetobacter sp., Strenophotomonas sp., Bacillussp. Las Pseudomonas sp. han sido bastante estudiadas y existen diferentes publicaciones por su capacidad para degradar HCs e hidrocarburos po-licíclicos aromáticos (PAH). Finalmente, C. violaceum y F. orizihabitans se reportan como degrada-doras de PAHs y clasificadas como especies del genero Pseudomonas sp. (Eriksson et ál., 2003; Hammeetál.,2003).
Análisis de correlaciones
El análisis de Pearson mostró una fuerte correlación positiva entre el recuento de heterótrofos totales y los degradadores de HCs (p<0.05), es decir que los recuentos de microorganismos degradadores dependen de la densidad de heterótrofos presentes. La correlación de los parámetros microbiológicos y el pH indicó que los recuentos microbianos se afectaron negativamente por los bajos valores de pH observados durante el estudio en los tratamientos. Este factor pudo llegar a inhibir el crecimiento de la
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 3. Análisis de correlaciones entre variables significativas evaluadas durante el estudio
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Sig.= significancia p<0.05.
Solo se muestran las correlaciones más significativas.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
75
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 67-78
|
|||
|
|
|||
|
población de microorganismos nativos presente en el suelo. La concentración de nitratos mostró una correlación negativa con el pH, y positiva con los recuentos de microorganismos, lo cual indica que los bajos valores de pH pudieron ser causados por el incremento en las concentraciones de nitrato (tabla 3). Se observó una correlación negativa entre los TPHs y las concentraciones de nutrientes (nitratos y amonio), que indica que la presencia de nutrientes estimuló la degradación de TPHs. La fuerte correlación entre TPHs, pH y porcentaje de humedad mostró la importancia de estos parámetros dentro del proceso de biodegradación.
CONCLUSIONES
Las mayores tasas de degradación se presentaron en los tratamientos (SIS y FIC) durante los primeros 28 días, lo cual indica que la adición de nutrientes estimuló la degradación de TPHs. Sin embargo, esta reducción después de los 28 días no fue significativamente diferente al control sin nutrientes, debido al bajo pH que se presentó en los tratamientos. El pH pudo inhibir el crecimiento de heterótrofos y degra-dadores y, por lo tanto, reducir las tasas de degradación de TPHs.
Los porcentajes de remoción de TPHs para SIS fueron mayores por los 2 métodos analíticos evaluados, debido a su mayor solubilidad y disponibilidad para los degradadores nativos encargados de llevar a cabo el proceso de biorremedia-ción. Este resultado permite sugerir el uso de SIS en suelos donde la capacidad amortiguadora sea alta o durante estudios donde se controle externamente el pH. Por otra parte, FIC aportó mayores cantidades de fósforo y fue de menor costo con relación a SIS.
De acuerdo con el control de calidad y los resultados obtenidos durante el estudio, los 2 métodos evaluados para la determinación de TPHs (ASTM y EAMG) pueden utilizarse para la cuantifi-cación de TPHs durante los procesos de biorreme-diación. Sin embargo, se debe tener un especial cuidado durante el análisis de TPHs en suelos por las interferencias de la materia orgánica en el proceso de extracción. Finalmente, el uso del control abiótico permitió determinar que la biodegradación intrínseca fue el proceso más importante en el presente estudio.
|
AGRADECIMIENTOS
Este proyecto (1203198010112E) fue financiado por la Vicerrectoría Académica de la Pontificia Universidad Javeriana.
BIBLIOGRAFÍA
ASM. 1986. Manual of Industrial Microbiology and Biotechno-logy. Department of Nutrition and Food Science. Mas-sachusetts Institute of Technology, Cambridge. Washington D. C., pp. 46-58.
ASTM. 1995. D5831-96. Standard Test Method forScreening Fuels in Soils. American Society for Testing Materials. West Conshohocken, PA, pp. 1-9.
Atlas, R.; Bartha, R. 2001. Ecología microbiana y ambiental. Quinta edición. California: The Benjamin/Cummings Publishing Company, Inc., pp. 559-610.
Ávila, M. 1999. La biorremediación, procesos y aplicaciones. Instituto de investigación tecnológica. Escuela Politécnica Nacional. Ecuador. 23 (2): 1-33.
Braddock, J., Brown, E. 1990. Sheen screen a miniaturized most-probable number method for enumeration of oil degradation microorganism. Applied and Environmental Microbiology. 56: 3895-3896.
Broook, T.; Warren, S.; Zynther, R. 2001. Biodegradation of diesel fuel in soil under different nitrogen addition regi-mes. Soil and Sediment Contamination. 10: 539-553.
Cleves, I.; Sandoval, M. 2001. Evaluación de la biodegradación de hidrocarburos presentes en suelos contaminados con lodos aceitosos de la industria petrolera (Hui-la-Colombia). Trabajo de grado. Facultad de Ciencias Básicas. Pontificia Universidad Javeriana.
Coulon, F.; Delille, D. 2003. Effects of bioestimulation on growth of indigenous bacteria in sub-Antarctic soil con-taminated with oil hydrocarbons. Oil & Gas Science and Technology. 4: 469-479.
Cunningham, J.; Philp, J. 2000. Comparation of bioaugmenta-tion and bioestimulation in ex situ treatment of diesel contaminated soil. Land Contamination and Reclama-tion. 4: 262-270.
Dibble, J.; Bartha, R. 1979. Effect of environmental parame-ters on the biodegradation of oil sludge. Applied and Environmental Microbiology. 37 (4): 729-739.
Dua, M.; Sing, A.; Sethunathan.; Johri, A. 2002. Biotechnology and bioremediation: successes and limitations (Mini-re-view). Applied Microbiology and Biotechnology. 59: 143-152.
Ecopetrol. 2001. Incremento de atentados contra la infraestructura petrolera en Colombia. Reporte especial. Grupo de información, Ecopetrol-Bogotá, pp. 1-18.
epa. 1994. Oil and grease extraction method for sludge and sediment samples, method 9071 A. Methodsforchemi-cal analysis of water and wastes. Cincinnati, OH, U.S. Environmental Protection Agency, pp. 1-15.
|
||
|
|
|||
|
76
|
|||
|
|
|||
|
|
|||
|
EVALUACIÓN DE LA BIOESTIMULACIÓN EN LA BIODEGRADACIÓN DE TPHs EN SUELOS CONTAMINADOS
|
|||
|
|
|||
|
EPA. 1999. Determination of pH (9045c) in soils. Revision No. 4, pp. 1-8.
Ercoli, E.; Gálvez, J.; Di Paola, M.; Cantero, J.; Medaura, M.; Bauza, J. 2001. Análisis y evaluación de parámetros críticos en biodegradación de hidrocarburos en suelo. Laboratorio de Bioprocesos, reporte especial. Facultad de Ingeniería, Universidad Nacional de Cuyo, Mendoza.
Eriksson, M.; Sodersten, E.; Zhongtang, Y.; Dalhammar, G.; Mohn, W. 2003. Degradation of polycyclic aromatic hydrocarbons at low temperature under aerobic and ni-trate-reducing conditions in enrichment cultures from northerm soils. Applied Environmental Microbiology. 69: 275-284.
HACH, 1994 DRL/2000. Spectrophotometer Hand Book. HACH Company. Procedures Manual. USA, pp. 35-44.
Haines, J.; Wrenn, B.; Holder, E.; Strohmeir, K.; Herrington, R.; Venosa, A. 1996. Measurement of hydrocarbon de-grading microbial populations by a 96 well plate most probable number procedure. Journal of Industrial Microbiology. 16: 36-41.
Hamme, J.; Sing, A.; Ward, O. 2003. Recent advances in petroleum microbiology. Microbiology and Molecular Bio-logyReviews. 67: 503-549.
Hickey, W. 1995. Biodegradation and bioremediation. Techni-cal reports. Soil ventilation: effects on microbial populations in gasoline contaminated subsurface soils. Journal Environmental. 24: 571-582.
IGAC. 1995. Suelos de Colombia: origen, evolución clasificación, distribución y uso. Malagón, D.; Pulido, C.; Llinás, R.; Chamorro, C. República de Colombia, Ministerio de Hacienda y Crédito Público. Bogotá, Colombia, pp. 469-483.
Kaplan, C.; Kitts, C. 2004. Bacterial succession in a petroleum land treatment unit. Applied and Environmental Microbiology. 70: 1777-1786.
Leahy, J.; Colwell, R. 1990. Microbial degradation of hydrocarbons in the environmental. Microbial Reviews. 54 (3): 305-315.
Macnaughton, S.; Stephen, J.; Venosa, A.; Davis, G.; Chang, Y.; White, D. 1999. Microbial population changes during bioremediation of an experimental oil spill. Applied and Environmental Microbiology. 8: 3566-3573.
Margesin, R.; Schinner, F. 1997. Bioremediation of diesel oil contaminated alpine soils at low temperatures. Applied and Environmental Microbiology. 47: 462-468.
Margesin, R.; Zimmerbauer, A.; Schinner, F. 2000. Monitoring of bioremediation by soil biological activities. Chemosp-here. 40: 339-346.
Margesin, R.; Schinner, F. 2001. Biodegradation and bioremediation of hydrocarbons in extreme environments. Applied and Environmental Microbiology. 56: 650-663.
Margesin, R.; Labbé, D.; Schinner, R.; Greer, W.; Whyte, L. 2003a. Characterization of hydrocarbon degradative microbial populations in contaminated and pristine alpine soils. Applied and Environmental Microbiology. 6: 3985-3992.
|
Margesin, R.; Walder, G.; Schinner, F. 2003b. Bioremediation assessment of BTEX contaminated soil. Act ofBiotech-nology. 1 (26): 29-36.
Rahman, K.; Rahman, S.; Lakshmanaperumalsamy, P.; Mar-chant, R.; Banat, R. 2003. The potential of bacterial iso-lates from emulsification with a range of hydrocarbons. Acta Biotecnológica 23: 335-345.
Raymond, D.; Dwayne, S.; Sayler, G.; Stacey, G. 1998. Biodegradation of aromatic hydrocarbons in an extremely aci-dic environment. Applied and Environmental Microbio-logy. 64:4180-4184.
Reynolds, C.; Bhunia, P.; Koenen, B. 1997. Soil remediation demonstration project: biodegradation of heavyfuel oils. Special report, pp. 20-47.
Rittman, B.; Mc Carty. 2001. Biotecnología del medio ambiente: principios y aplicaciones. Sexta edición. Madrid, España: Editorial McGraw-Hill, pp. 626-647.
Roldan, F. 2001. Evaluation of the effects of addition of oxygen (O2) and nitrate (NO3-) terminal electron acceptors to the enhanced in situ bioremediation of an oil contaminated Salt marsh. University of New Hampshire. Civil Engi-neering. Tesis doctoral.
Roling, W.; Milner, M.; Jones, M.; Lee, K.; Daniel, F.; Swannell, Head, I. 2002. Robust hydrocarbon degradation and dynamics of bacterial communities during nutrient-en-hanced oil spill bioremediation. Applied and Environmental Microbiology. 68: 5537-5548.
Saadoun, I. 2002. Isolation and characterization of bacteria from crude petroleum oil contaminated soil and their potential to degrade diesel fuel. Journal ofBasic Microbiology. 42: 420-428.
Sánchez, J.; Aguilar, G.; Rodríguez, R. 1998. La biorremedia-ción como alternativa al tratamiento de suelos contaminados. Avance y Perspectiva. 17: 293-297.
Schawab, A.; Wetzel, S.; Pekarek, S.; Banks, K. 1999. Extrac-tion petroleum hydrocarbons from soil by mechanical shaking. Environmental Science and Technology. 33: 1940-1944.
Speight, J. 1991. The Chemistry and Technology of Petroleum. New York: Marcel Dekker, Inc. pp. 321-353.
Song, H.; Wang, X.; Bartha, R. 1990. Bioremediation potential of terrestrial fuel spills. Applied and Environmental Microbiology. 56 (3): 652-656.
Song, H.; Bartha, R. 1990. Effects ofjetfuel spills on the microbial community of soil. Applied and Environmental Microbiology. 56 (3): 646-651.
Standard Methods. 2000. Standard Methods forthe Examina-tion of Water and Wastewater. American Public Health Association. American Water Works Association. Water Environmental Federation. 18th ed. Washington D. C.
Suppo, F. 1996. Fertilizantes: nutrición vegetal. México, D. F. Tercera edición. AGT Editores, S.A., pp. 23-31.
Sylvia, D.; Fuhrmann, J.; Harter, P.; Zuberer, D. 2005. Principles and applications of soil microbiology. Second edi-tion. N. J.: Prentice Hall, pp. 20-34.
|
||
|
|
|||
|
77
|
|||
|
|
|||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VII No. 2 Diciembre 2005 67-78
|
|||
|
|
|||
|
Vidali, M. 2001. Bioremediation: an overview. Pure Applied Chemical (Italia). 7: 1163-1172.
Whyte, L.; Bourbonniere, L.; Greer, C. 1997. Biodegradation of petroleum hydrocarbons by psychotropic Pseudomo-nas strains possessing both alkane (alk) and naphthale-ne (nah) catabolic pathways. Applied and Environmen-tal Microbiology. 63: 3719-3723.
Wrenn, B.; Haines, J.; Venosa, A.; Kadkhodayan, M.; Suidan, M. 1994. Effects of nitrogen source on crude oil
|
biodegradation. Journal of Industrial Microbiology. 13: 279-283.
Wrenn, B.; Venosa, A. 1996. Selective enumeration of aroma-tic and aliphatic hydrocarbon degrading bacteria by a most probable number procedure. Journal Microbiology. 42: 252-258.
Yerushalmi, L.; Rocheleau, S.; Cimpoia, R.; Sarrazin, M.; Su-nahara, G.; Peisajovich, A.; Leclair, G.; Guiot, S. 2003. Enhanced biodegradation of petroleum hydrocarbons in contaminated soil. Bioremediation Journal. 7: 37-51.
|
||
|
|
|||
|
78
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2005 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















