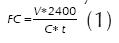Evaluación de la producción experimental de enzimas coagulantes de leche utilizando cepas de Rhizomucor spp
Evaluation of experimental production of milk-clotting enzymes using Rhizomucor spp strains
DOI:
https://doi.org/10.15446/rev.colomb.biote.v17n1.50701Palabras clave:
renina microbiana, fuerza de cuajo, actividad proteolítica, productividad. (es)Título en ingles: Evaluation of experimental production of milk-clotting enzymes using Rhizomucor spp strains
Título corto: Producción de enzimas coagulantes de leche
Resumen: La producción experimental de enzimas coagulante de leche se llevó a cabo en un medio de cultivo de laboratorio durante 190 h de incubación, utilizando tres cepas certificadas de Rhizomucor pusillus, R. miehei y dos especies nativas de Rhizomucor spp. BIOMI-12 y 13. La evaluación se realizó midiendo la concentración de glucosa y proteína durante la incubación, estimación de la productividad, actividad específica, índice fuerza de cuajo/actividad proteolítica en los extractos enzimáticos crudos, determinación de los pesos moleculares y actividad proteolítica en los extractos enzimáticos parcialmente purificado. Todas las cepas mostraron un consumo de glucosa similar, el mismo comportamiento se observó en el contenido de proteína, excepto la cepa BIOM-13. Los incrementos en el contenido de proteínas después del descenso, coincidieron con la máxima actividad coagulante registrada por cada cepa, siendo el extracto crudo de la cepa BIOMI-13 la de mayor actividad coagulante (148,15 FC), productividad (3,09 FC/h), índice fuerza de cuajo/actividad proteolítica (142,60 FC/U) y actividad específica (1.062,00 FC/mg). Los extractos enzimáticos parcialmente purificados de las cepas R miehei 37, Rhizomucor spp BIOM-12 y 13, presentaron proteínas con pesos moleculares en aproximadamente 22,6 y 46,52 KDa, mientras el extracto R pusillus 39 presentó una banda adicional de 39,6 KDa. En el zimograma se observó para todas las cepas actividad proteolítica en las bandas comprendidas entre 40-50 KDa y 20-22 KDa, no así para el R pusillus 36, donde fue escasa. Finalmente se determinó que la cepa BIOMI-13, tiene la mayor capacidad para producir enzimas coagulantes de la leche.
Palabras clave: renina microbiana, fuerza de cuajo, actividad proteolítica, productividad.
Key words: microbial rennet, rennet strength, proteolitic activity, productivity.
Recibido: mayo 14 de 2014 Aprobado: abril 21 de 2015
Experimental production of milk clotting enzymes was conducted on a laboratory culture medium for 190 h incubation, using three certified strains of Rhizomucor pusillus, miehei and two native Rhizomucor spp. BIOMI-12 and 13. The evaluation was performed by measuring the concentration of glucose and protein during incubation, estimate productivity, specific activity, rennet strength/proteolytic activity index in the crude enzyme extracts, determining the molecular weights and proteolytic activity in the partially purified enzyme extracts. All strains showed consumption rates of glucose, the same behavior observed protein content, except strain BIOMI-13. The increase in protein content after descent coincided with the recorded maximum coagulant activity each strains, being the crude extract of strain BIOMI-13 higher coagulant activity (148,15 FC), productivity (3.09 HR / h), rennet strength/proteolytic activity index (142,60 FC/U) and specific activity (1,062 FC/mg). The partially purified enzyme extracts from strains R miehei 37, Rhizomucor spp BIOMI-12 and 13, presented proteins with molecular weights in approximately 22,6 kDa and 46.52, while the extract R pusillus 39 present an additional band of 39,6 KDa. In the zymogram was observed for all strains, proteolytic activity in the bands between 40-50 KDa and 20-22 KDa, but not for the R pusillus 36, where activity was very dim. Finally it was determined that the strain BIOMI-13, has the greatest capacity to produce milk clotting enzymes.
Key words: microbial rennet, rennet strength, proteolitic activity, productivity.
DOI: https://doi.org/10.15446/rev.colomb.biote.v17n1.50701
ARTÍCULO DE INVESTIGACIÓN
Evaluación de la producción experimental de enzimas coagulantes de leche utilizando cepas de Rhizomucor spp
Evaluation of experimental production of milk-clotting enzymes using Rhizomucor spp strains
Osmar T. Morillo Piña*, Pablo J. García Lugo**, Balmore Ruizdael Guerrero Cardena***, Yzoleth Torres Vielma****, Rafael F. Castañeda Ruiz*****
* Ingeniero Químico, cPhD en Biotecnología de Microorganismo. Correo de correspondencia: osmthom@yahoo.com
** PhD Ciencias Biológicas, rfcastaneda@inifat.co.cu y pgarcial2008@gmail.com
*** Lic. en Biología, MSc Biotecnología de Microrganismo, balmoregc@gmail.com.
**** Lic. en Biología, yzoleth@hotmail.com. Universidad de Los Andes. Facultad de Ciencias. Dpto. Biología. Lab. "Sixto David Rojo", Biotecnología de Microorganismo. La hechicera. CP 5101. Apartado de correos No 37. Telfs. 2401309 – 1283.
***** PhD ciencias agrícolas, Instituto de Investigaciones Fundamentales en Agricultura Tropical "Alejandro de Humboldt" (INIFAT), Calle 1 Esq. 2, Santiago de Las Vegas, C. Habana, Cuba, C.P. 17200. rfcastaneda@inifat.co.cu
Recibido: mayo 14 de 2014 Aprobado: abril 21 de 2015
Resumen
La producción experimental de enzimas coagulante de leche se llevó a cabo en un medio de cultivo de laboratorio durante 190 h de incubación, utilizando tres cepas certificadas de Rhizomucor pusillus, R.miehei y dos especies nativas de Rhizomucor spp. BIOMI-12 y 13. La evaluación se realizó midiendo la concentración de glucosa y proteína durante la incubación, estimación de la productividad, actividad específica, índice fuerza de cuajo/actividad proteolítica en los extractos enzimáticos crudos, determinación de los pesos moleculares y actividad proteolítica en los extractos enzimáticos parcialmente purificado. Todas las cepas mostraron un consumo de glucosa similar, el mismo comportamiento se observó en el contenido de proteína, excepto la cepa BIOMI-13. Los incrementos en el contenido de proteínas después del descenso, coincidieron con la máxima actividad coagulante registrada por cada cepa, siendo el extracto crudo de la cepa BIOMI-13 la de mayor actividad coagulante (148,15 FC), productividad (3,09 FC/h), índice fuerza de cuajo/actividad proteolítica (142,60 FC/U) y actividad específica (1.062,00 FC/mg). Los extractos enzimáticos parcialmente purificados de las cepas R miehei 37, Rhizomucor spp BIOMI-12 y 13, presentaron proteínas con pesos moleculares en aproximadamente 22,6 y 46,52 KDa, mientras el extracto R pusillus 39 presentó una banda adicional de 39,6 KDa. En el zimograma se observó para todas las cepas actividad proteolítica en las bandas comprendidas entre 40-50 KDa y 20-22 KDa, no así para el R pusillus 36, donde fue escasa. Finalmente se determinó que la cepa BIOMI-13, tiene la mayor capacidad para producir enzimas coagulantes de la leche.
Palabras clave: renina microbiana, fuerza de cuajo, actividad proteolítica, productividad.
Abstract
Experimental production of milk clotting enzymes was conducted on a laboratory culture medium for 190 h incubation, using three certified strains of Rhizomucor pusillus, miehei and two native Rhizomucor spp. BIOMI-12 and 13. The evaluation was performed by measuring the concentration of glucose and protein during incubation, estimate productivity, specific activity, rennet strength/proteolytic activity index in the crude enzyme extracts, determining the molecular weights and proteolytic activity in the partially purified enzyme extracts. All strains showed consumption rates of glucose, the same behavior observed protein content, except strain BIOMI-13. The increase in protein content after descent coincided with the recorded maximum coagulant activity each strains, being the crude extract of strain BIOMI-13 higher coagulant activity (148,15 FC), productivity (3.09 HR / h), rennet strength/proteolytic activity index (142,60 FC/U) and specific activity (1,062 FC/mg). The partially purified enzyme extracts from strains R miehei 37, Rhizomucor spp BIOMI-12 and 13, presented proteins with molecular weights in approximately 22,6 kDa and 46.52, while the extract R pusillus 39 present an additional band of 39,6 KDa. In the zymogram was observed for all strains, proteolytic activity in the bands between 40-50 KDa and 20-22 KDa, but not for the R pusillus 36, where activity was very dim. Finally it was determined that the strain BIOMI-13, has the greatest capacity to produce milk clotting enzymes.
Key words: microbial rennet, rennet strength, proteolitic activity, productivity.
Introducción
Las enzimas coagulantes de la leche, juegan un papel fundamental en la producción de quesos, conocidas con el nombre de cuajo, o renina, nombre derivado del vocablo anglosajón rennet, se obtiene como una mezcla de quimosina y pepsina provenientes del tejido del obomaso de ternero, donde la quimosina está presente en mayor proporción de 88-94% dependiendo de la edad del animal. Las quimosina es una enzima proteolítica (EC3.4.23.4), que cataliza la hidrólisis específica de la κ-caseína de la leche en los enlaces Phe105-Met106. Está clasificada como una proteasa del ácido aspártico o aspartoproteasa EC 3.4.23., pertenecen al grupo de enzimas endopeptidasas (Ruiz, 2005). Debido a la escasez, altos precios, problemas asociados con la matanza de animales y a la capacidad de producción para satisfacer la industria quesera, ha sido necesaria la búsqueda de otras alternativas para la sustitución de la renina de ternero (Merheb-Dini, Gomes, Boscolo & Da Silva, 2010). Un adecuado sustituto debe tener una intensa actividad coagulante de la leche, es decir, alta capacidad de atacar el enlace peptídico 105-106 de κ-caseína y una baja actividad proteolítica para minimizar la disolución de los coágulos, permitiendo así altos rendimientos en quesería y productos con características sensoriales de alta aceptación.
Las investigaciones están orientadas a la búsqueda de proteasas de origen microbianos, animal o fuentes vegetales (Merheb-Dini et al., 2010). Sin embargo, las proteasas animales y vegetales han demostrado ser fuentes de enzimas de acción inespecíficas en la coagulación de la leche, produciendo quesos con sabores amargos y texturas no deseadas. Por lo tanto, la atención se ha centrado en las fuentes microbianas, debido a su especificidad y las ventajas de su producción, tales como períodos cortos de crecimiento de los microorganismos (Cheng, Bai, & Wang, 2008; Khademi Abachi, Mortazavi, Ehsani, Tabatabaei & Malekzadeh, 2013), suministro ilimitado, bajos costos de producción y permite diseñar nuevos sistemas enzimáticos que no son posibles de obtener a partir de fuentes vegetales o animales. En la actualidad las enzimas coagulantes de la leche de origen fúngica son utilizadas en más de un tercio en la industria lechera en todo el mundo (Khademi, Abachi & Malekzadeh, 2013), producidas experimental e industrialmente por especies como Thermomucor indicae-seudaticae (Merheb-Dini et al., 2010), Bacillus subtilis natto (Shieh, Phan Thi & Shihb, 2009), Mucor circinelloides (Sathya, Pradeep, Angayarkanni & Palaniswamy, 2009), Rhizomucor nainitalensis (Khademi et al., 2013), Mucor mucedo DSM 809 (Yegin, Fernández-Lahore, Guvenc & Goksungur, 2010), Rhizomucor pusillus y Rhizomucor miehei (Maheshwari, Bharadawaj & Mahalingeshwara, 2000; Jacob, Jaros & Rohm, 2011; Foda, Moharam, Ramadan & El-Bendary, 2012). Siendo la proteasa aspártica producida por R. miehei la más usada comercialmente (Jacob et al., 2011). Bajo esta premisa se presenta el siguiente trabajo cuyo objetivo principal fue la evaluación y comparación de la capacidad productiva de enzimas con actividad coagulante de cinco cepas de hongos del género Rhizomucor.
Materiales y métodos
Microorganismos
Se utilizaron cepas de Rhizomucor pusillus CVCM-3036 (RP-36), Rhizomucor miehei CVCM-3037 (RM-37) y Rhizomucor pusillus CVCM-3039 (RP-39) provenientes de la Colección Venezolana de Cultivo de Microorganismos y dos cepas de Rhizomucor spp, identificadas como BIOMI-12 (Rspp-12) y BIOMI-13 (Rspp-13) proveniente de la colección de cultivo del laboratorio de Biotecnología de Microorganismo de la ULA.
Suspensión de esporas
Para cada cepa a evaluar se obtuvieron suspensiones de esporas utilizando el método modificado de Osorio, Gómez, & Sánchez (2008). A micelios esporulados crecidos en erlenmeyer de 250 ml conteniendo 50 ml de medio Agar Papa Dextrosa, incubados durante 96 h a 37 °C, se adicionaron 30 ml de agua destilada estéril con 25 perlas de vidrio de 0,5 mm de diámetro y se agitaron manualmente. Una vez recuperada la suspensión, la concentración de esporas se determinó mediante recuento en Cámara Neubauer.
Producción de enzimas con actividad coagulante de la leche
En experiencias cuádruples las diferentes cepas de hongos fueron crecidas en Erlenmeyer de 500 ml conteniendo 150 ml del medio de cultivo, formulado con caseína (4 g/l), glucosa (20 g/l), extracto de malta (4 g/l), peptona bacteriológica (4 g/l) y KH2PO4 (2 g/l), se inocularon con 8x106 esporas de cada cepa e incubados a 37 °C a 150 rpm durante 190 h. Se tomaron muestras de 4 ml cada 24 h se centrifugaron y filtraron en papel de filtro de celulosa de 11 μm de porosidad, al sobrenadante obtenido se le determinó actividad coagulante de la leche, concentración de proteína y glucosa.
Técnicas analíticas
El consumo de glucosa se cuantificó por el método de DNS para azúcares reductores (Miller, 1959). La tasa de consumo de glucosa se estimó por regresión lineal de los datos.
La variación del contenido de proteína durante el cultivo se determinó por el método de Bradford (Bollag & Edelstein, 1991) usando como estándar albumina bovina.
La actividad coagulante de la leche, se midió por el método de Osorio et al. (2008). Consistió en tomar el tiempo que tarda en coagular una muestra de 5,0 ml de leche descremada (al 10 % en 0,01 M de cloruro de calcio) al adicionarle 0,5 ml de sobrenadante del cultivo proveniente de la fermentación. Esta determinación se logró haciendo rotar de manera manual las muestras en un baño maría a una temperatura de 37 °C. La lectura del tiempo de coagulación se hace justo cuando el aspecto de la película de leche sobre la pared interna del tubo de ensayo cambia de fluido laminar a viscoso formándose pequeños grumos. La actividad enzimática se expresó como la fuerza de cuajo (FC) definida como la cantidad de leche cuajada en mililitros por gramo o mililitro de sobrenadante del cultivo en 40 minutos a 37 °C y se calcula mediante la siguiente relación:
Dónde: FC: fuerza de cuajo, V: cantidad de leche (ml), C: cantidad de sobrenadante del cultivo (ml), t: tiempo de coagulación de la muestra (s), 2.400: tiempo en que normalmente cuaja la leche a 37 °C con un cuajo estándar (s).
La actividad proteolítica se determinó utilizando el método modificado de Anson. Cuantificando los péptidos solubles que resultan de la acción proteolítica de la enzima o de un extracto enzimático sobre la caseína bovina. A 4 ml de solución de caseína bovina al 1%, se agregó 1 ml de extracto enzimático proveniente del medio de cultivo, la mezcla de reacción se incubó a 37 °C durante 20 minutos la reacción se detuvo agregando 4 ml ácido tricloacético al 10 %. Se filtró y se midió la absorbancia a 280 nm. Definiendo la unidad de actividad proteolítica (U) como la cantidad de enzima que cataliza la conversión de 1 mg de caseína por minuto. Se utilizó el coeficiente extinción molar de 0,81 ml mg-1. (Panouille, Nicolai, Benyahia & Durand, 2005)
Capacidad productiva y especificidad de las enzimas coagulantes
La capacidad productiva se evaluó a través de la siguiente relación:
Dónde: FCmax: máxima fuerza de cuajo alcanzada; tFCmax: tiempo en que se alcanza la máxima fuerza de cuajo.
Se determinó la actividad específica (FCmax/mg de proteína) como medida de especificad de los extractos enzimáticos crudos, y el índice actividad coagulante/actividad proteolítica (FCmax /U) dividiendo la mayor actividad coagulante registrada por la actividad proteolítica sobre caseína registrada en ese mismo tiempo. La comparación entre las cepas en productividad, índice de actividad coagulante/actividad proteolítica (FC/U) y la actividad específica, se realizó por análisis de varianza de un solo factor para un nivel de significancia del 5% y una comparación de medias a través de la prueba de Tukey. Para ello se estimó la media y la desviación estándar a partir de tres réplicas.
Concentración de los extractos crudos y Electroforesis en geles de poliacrilamida (PAGE- SDS)
Los extractos crudos que presentaron la mayor fuerza de cuajo fueron saturados con 15% de sulfato de amonio, luego se dejó en reposo durante 2 horas en baño de agua-hielo y se centrifugaron a 2900 g durante 10 minutos, el sobrenadante obtenido se llevó hasta una saturación del 70% y dejado en reposo en agua-hielo, 12 horas. El precipitado se recuperó por centrifugación y disuelto en 1 ml de agua destilada, posteriormente dializado en agua destilada.
Los extractos concentrados fueron analizados en electroforesis en gel de poliacrilamida al 12 % en condiciones desnaturalizantes PAGE-SDS, según Leammli (1970). En cada pozo se agregó aproximadamente 20 µg de proteína de muestras y 5 µg de marcador de peso molecular preteñido: miosina 194,665 KDa, β-galactosidasa 116,531 KDa, albúmina sérica bovina 97,220 KDa, ovoalbúmina 50,195 KDa, anhidrasa carbónica 37,620 KDa, inhibidor de tripsina de soya 29,284 KDa, lisozima 20,010 KDa y aprotinina 7,150 KDa. El peso molecular de cada banda se calculó utilizando el método de Weber y Osborrn (1969).
La actividad enzimática de los extractos concentrados fue evaluada en un zimograma según el método modificado de Egito (2007) y Leammli (1970). El gel de resolución se preparó al 12% de acrilamida con 0,1% de caseinato de sodio. Las electroforesis se realizaron a 200 voltios durante 30 min, utilizando un equipo Mini-Proteam III (Bio-Rad). Se agregaron 20 µg de muestras en cada pozo. Después de la migración electroforética el gel fue lavado dos veces con Triton X-100 (2% v/v) durante 30 minutos. Los geles lavados fueron incubados a 37°C en buffer fosfato (pH 5,4) durante 18 horas, después de este tiempo fueron teñidos en una solución de azul de Coomassie y posteriormente fueron desteñidos.
Resultados y discusión
Producción de enzimas coagulantes por las cepas de Rhizomucor spp
La variación de la concentración de glucosa del medio cultivo durante la incubación, fue similar para todas las cepas evaluadas, mostrando la misma tendencia (figura 1) y tasas de consumo de glucosa (tabla 1). Un comportamiento similar fue registrado por la cepa Mucor miehei en un medio estándar utilizando glucosa y almidón soluble como fuente principal de carbono (Osorio et al., 2008).
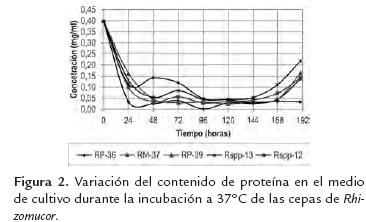
Durante las primeras 48 horas, la concentración de proteínas en el medio de cultivo disminuyó desde 0,4 mg/ml hasta valores aproximados de 0,04 mg/ml, para cuatro de las cepas (RP-36, RP-37, Rspp-12 y RP-39) (figura 2), manteniéndose constante hasta las 144 horas, momento en el cual se registra un incremento. En el caso de la cepa Rpss-13 se observó disminución en la concentración de proteínas durante las primeras 24 (0,11 mg/ml) y un incremento a las 48h, (0,148 mg/ml), tiempo en el cual disminuye hasta concentraciones de 0,05 mg/ml (96 h), valor que permanece constante hasta finalizado el tiempo de incubación.
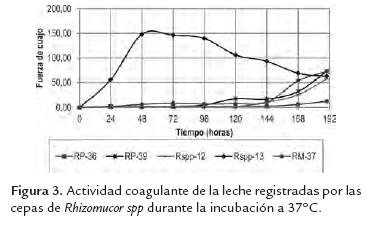
Los aumentos en las concentraciones de proteínas en los medios de cultivo (figura 2) coincidieron con la máxima actividad coagulante registrada por los extractos crudos de cada cepa (figura 3). El mayor valor de actividad coagulante se obtuvo con la cepa Rspp-13 (148,15 FC) a las 48 horas, aproximadamente el doble del valor de las actividades obtenida con la cepa RM-37 y RP-39 de 72,73 FC, registradas a las 190 horas de incubación, mientras que las cepas Rspp-12 y RP-36 presentaron actividades coagulantes de 57,14 FC y 12,50 respectivamente en las mismas condiciones. La máxima actividad coagulante de cada cepa en estudio, fueron inferiores a los registrado por una cepa de Mucor miehei (594,19 FC, en un tiempo 45 h), cultivado en un medio de cultivo estándar de laboratorio (1,8% de almidón soluble, 1,8% de glucosa monohidratada y 0,2 % fosfato diácido de potasio, 3,1 % extracto de malta, 0,8 % bactopeptona y 0,8 % caseína) (Osorio et al., 2008). En todos los caso en las primeras horas de cultivo, la caseína presente en el medio fue utilizada como fuente nitrógeno para el crecimiento de las cepas, mientras que el incremento posterior en la concentración de proteínas se atribuye a la síntesis y excreción de enzimas extracelulares entre ellas las que presentan actividad coagulante de la leche. El hecho de que la cepa Rspp-13 muestre la mayor actividad, es indicativo que bajo las condiciones de cultivo utilizadas posee mayor capacidad para la excreción de proteínas y particularmente de proteasas con actividad coagulante.
En términos generales las tendencias en el consumo de las principales fuentes carbono (glucosa) y nitrógeno (caseína), así como la producción de proteasas con actividad coagulante de las cepas objeto de estudio, indican que la tasa de consumo de glucosa no debe ser un factor que influye en la excreción de las enzimas, no así su concentración en el medio de cultivo. A concentraciones de glucosa 3-4 g/l y 0,05 mg/ml de proteínas en el medio, se observa el mayor incremento de la excreción en cuatro de las cepas. Mientras que la cepa Rspp-13 a concentraciones de 15g/l y 0,1 mg/l de proteínas en el medio, produce la mayor excreción de proteínas coagulantes. Estos resultados indican que los niveles de glucosa (fuente de carbono) y proteínas (fuente de nitrógeno) pueden estar implicados en la regulación de la excreción de proteínas durante el crecimiento. Cuatro de las cepas son reguladas de una forma similar, la cepa Rspp-13 muestra un mecanismo menos reprimido por glucosa.
Comparación de la capacidad productiva
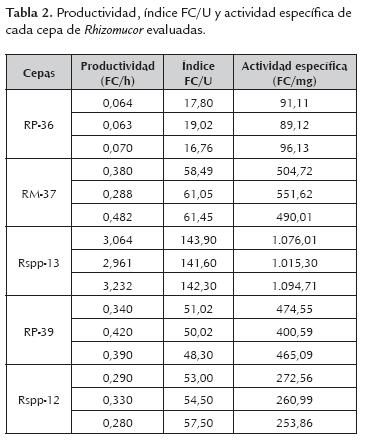
Los resultados mostrados en la tabla 2 indican que bajo condiciones similares de cultivo la cepa Rspp-13 presenta mayor productividad, índice FC/U y actividad específica que las demás cepas estudiadas, esta condición podría variar según las condiciones y formulación del medio de cultivo, por lo que se requiere una evaluación más amplia de estas cepas.
El análisis de varianza para los valores de productividad de las cepas, confirmó la existencia de diferencia significativa entre ellas (tabla 3). La comparación de medias determinó que la cepa Rspp-13 de mayor productividad (3,0857±0,1368 FC/h) y la cepa RP-36 de menor productividad (0,0657±0,0038 FC/h), presentaron diferencias significativas entre sí y con el resto de las cepas evaluadas, las cuales registraron valores intermedios, comprendidos en un rango de 0,3000±0,0265 y 0,3833±0,097 FC/h sin diferencias significativas entre ellas. Los valores de productividad de las cinco cepas en estudio, fueron inferiores a la registrada por la cepa Mucor miehei (13,59 FC/h) (Osorio et al., 2008), probablemente debido a la diferencia de los medios utilizados.
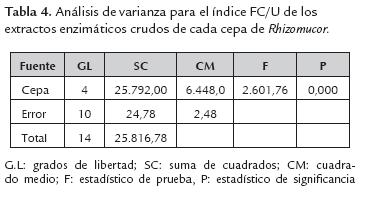
De acuerdo al análisis de varianza y la comparación de medias para los índices FC/U, arrojó diferencias significativas entre todos los extractos enzimáticos crudos (tabla 4), siendo el de la cepa Rspp-13 de mayor índice (142,60±1,18) y RP-36 de menor valor (17,86±1,13), el resto registró valores intermedios de 60,33±1,1; 55,00±2,29 y 49,78±1,38 para los extractos enzimáticos crudos de las cepas RM37, Rspp-12 y RP39 respectivamente.
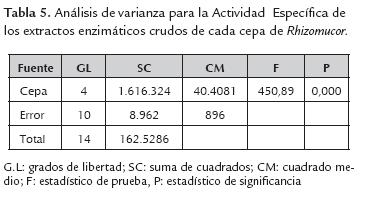
Al igual que los parámetros anteriores, el análisis de la varianza para la actividad específica, determinó la existencia de diferencia significativa entre los extractos enzimáticos crudos (tabla 5). La comparación de medias determinó que los extractos enzimáticos crudos de la cepa Rspp-13 de mayor actividad específica (1.062,00± 41,5 FC/mg) y RP-36 de menor actividad específica (92,1±3,6), presentaron diferencias significativas entre sí y con el resto de los extractos enzimáticos, mientras que los de las cepas RM-37 y RP-39 no presentaron diferencias significativa entre sí (515,53 ±32,2 y 446,74±40,2 respectivamente), pero si con la cepa Rspp-12 quien registro una actividad específica de 262,59±9,4 FC/mg.
Peso molecular de los extractos enzimáticos
El extracto enzimático de la cepa Rspp-13 parcialmente purificado, presentó dos bandas de 22,6 y 46,52 KDa (carril 4 - figura 4a), siendo muy similar en número a las presentes en los extractos Rspp-12 y RP-36 (carriles 2 y 3 - figura 4a), de un rango de 42 y 50 KDa (bandas superiores); 22,2 y 20,1 respectivamente para las bandas inferiores, estos resultados difieren de lo reportado por Preetha & Boopathy (1997), cuyos extractos crudo y parcialmente purificado de Rhizomucor miehei, revelaron más de dos bandas en los geles de electroforesis. La cepa RM-37 (carril 5 - figura 4a) presentó una proteína adicional de 194,1 KDa, mientras que el extracto RP-39 mostró cuatro bandas de 23,5; 39,6, 51,2 y 193,8 KDa. Otros estudios han mostrado sucesiones de bandas en geles de poliacrilamida en la caracterización de extractos (crudos y tratados de sulfato de amonio) provenientes de cultivos de cepas de Mucor y Rhizomucor pusillus (Nouani, Moulti- Mati, Belbraouet & Bellal, 2011).
Todos los perfiles de las proteínas excretadas muestran la diferencia existente entre las cepas estudiadas, mostrando cada una un perfil característico. La actividad proteolítica presente en cada extracto está asociada a las proteínas de 40 – 50 KDa y 22 KDa, correspondientes a los extractos Rspp-12, Rspp- 13, RM-37 y RP-39 (carriles 2, 5, 7 y 9 de la figura 4b), no así para el extracto RP-36 (carril 3), donde el halo de hidrólisis apenas se puede apreciar. Las bandas calculadas en 194,1 y 193,8 KDa de las cepas RM-37 y RP-39 no presentaron actividad bien definida en el zimograma (carriles 7 y 9 de la figura 4b). La intensidad de la actividad enzimática registradas por las cepas Rspp-13 y RP-36 en el zimograma se corresponden con la capacidad de producción de enzimas coagulantes evaluadas en estas dos cepas, la cepa Rspp-13 presenta la mayor intensidad.
Conclusión
Todas las cepas evaluadas en este estudio mostraron tener capacidad para producir enzimas con actividad coagulante de la leche, excepto la cepas de Rhizomucor pusillus RP-36, mientras que la cepa Rhizomucor spp BIOMI-13, presentó la mayor actividad específica, índice de productividad y relación FC/U entre las cepas evaluadas, siendo la de mayor capacidad para producir enzimas con actividad coagulante.
Agradecimiento
Los autores agradecen a la Fundación CIEPE y al Laboratorio de Biotecnología de Microorganismo "Sixto David Rojo", Facultad de Ciencias, Universidad de los Andes, Mérida, Venezuela, quienes apoyaron y financiaron la realización de este trabajo.
Referencias bibliográficas
Bollang, D., & Edelstein, S. (1991). Proteins methods. Geneva, Switzerland: Wiley-Liss.
Cheng, Q., Bai, X., & Wang, Y. (2008). Isolation and fermentation condition of milk-clotting enzyme producing strain from glutinous rice wine. Chinese Journal of Biotechnology, 24(6), 999-1003.
Egito, A., Girardet, J., Laguna, L., Poirson, C., Molle´, D., Miclo L., Humbert G., & Gaillard J. (2007). Milk-clotting activity of enzyme extracts from sunflower and albizia seeds and specific hydrolysis of bovine k-casein. International Dairy Journal, 17, 816-825. doi:10.1016/j.idairyj.2006.09.012.
Foda, M., Moharam, M., Ramadan, A., & El-Bendary, M. (2012). Over Production of Milk Clotting Enzyme from Rhizomucor miehei Through Adjustment of Growth Under Solid State Fermentation Conditions. Australian Journal of Basic and Applied Sciences, 6(8), 579-589.
Jacob M., Jaros D., & Rohm, H. (2011). Recent advances in milk clotting enzymes. International Journal of Dairy Technology, 64(1), 14-33. doi: 10.1111/j.1471-0307.2010.00633.x
Khademi, F., Abachi, S., & Malekzadeh, F. (2013). Semi-purification and kinetic study of microfungal rennet biosynthesized by local isolate of Rhizomucor nainitalensis using solid-state fermentation system: Concentration methods and determinant factors in clotting activity. European Journal of Experimental Biology, 3(2), 167-174.
Khademi, F., Abachi, S., Mortazavi, A., Ehsani, M.A., Tabatabaei, M.R., & Malekzadeh, F.A. (2013). Optimization of Fungal Rennet Production by local isolate of Rhizomucor nainitalensis. Under Solid Substrate Fermentation system. IOSR Journal of Pharmacy and Biological Sciences, 5(2), 115-121.
Khademi, F., Abachi, S., Mortazavi, A., Ehsani, M. A, Tabatabaei, M.R., & Malekzadeh F. (2013). Screening and isolation of substitute-rennet producing thermophilic phycomycetes, by modified Warcup method and improved selective medium. IOSR Journal of Agriculture and Veterinary Science, 2(2), 30-37.
Leammli, U. (1970). Cleavage of structural proteins during the assembly of the heat of bacteriophage T4. Nature, 227(5259), 680-685.
Maheshwari, R., Bharadawaj, G., & Mahalingeshwara, K. (2000). Thermophilic fungi: their physiology and enzyme. Microbiology and Molecular Biology Reviews, 64(3), 461-488.
Merheb-Dini, C., Gomes, E., Boscolo, M., & Da Silva, R. (2010). Production and characterization of a milk-clotting protease in the crude enzymatic extract from the newly isolated Thermomucor indicae-seudaticae N31 (Milk-clotting protease from the newly isolated Thermomucor indicae-seudaticae N31). Food Chemistry, 120, 87-93.
Miller, G. L. (1959). Use of dinitrosalicylic acid reagent for determination of reducing sugar". Analitical Chemistry, 31, 426-428.
Nouani, A., Moulti- Mati, F., Belbraouet. S., & Bellal, MM. (2011). Purification and characterization of a milk-clotting protease from Mucor pusillus: Method comparison. African Journal of Biotechnology, 10(9), 1655-1665.
Osorio, A., Gómez, N., & Sánchez, C. (2008). Evaluación de diferentes fuentes de carbono y de nitrógeno para la producción de renina a partir del moho Mucor miehei. Revista de la Facultad de Ingeniería. Universidad de Antioquia, 45, 17-26.
Panouillé M., Nicolai T., Benyahia L., & Durand D. (2005). Aggregation and gelation of casein sub-micelles. In: Dickinson E editors. Food Colloids. Interactions, microstructure and processing. Cambridge, UK: The Royal Society of Chemistry.
Preetha. S., & Boopathy, R. (1997). Purification and characterization of a milk clotting protease from Rhizomucor miehei. World Journal of Microbiology & Biotechnology, 13, 573-578.
Ruiz, J. (2005). Extracción y Caracterización de Proteasas de Especies Vegetales Nativas y su Potencial Utilización en Quesería. (Tesis Licenciatura). Universidad Austral de Chile. Valdivia, Chile.
Weber K., & Osbor M. (1969). The reability of molecular weigth determinations by dodecylsulfate-polycrylamide gel electrophoresis. Journal of Biological Chemistry, 244(16), 4406-4412.
Shieh, C., Phan Thi, L., & Shihb, I. (2009). Milk-clotting enzymes produced by culture of Bacillus subtilis natto. Biochemical Engineering Journal, 43, 85-91.
Sathya, R., Pradeep, B., Angayarkanni, J., & Palaniswamy, M. (2009). Production of Milk Clotting Protease by a Local Isolate of Mucor circinelloides under SSF using Agro-industrial Wastes. Biotechnology and Bioprocess Engineering, 14, 788-794.
Yegin, S., Fernández-Lahore, M., Guvenc, U., & Goksungur, Y. (2010). Production of extracellular aspartic protease in submerged fermentation with Mucor mucedo DSM 809. African Journal of Biotechnology, 9(38), 6380-6386.
Referencias
Bollang, D., & Edelstein, S. (1991). Proteins methods. Geneva, Switzerland: Wiley-Liss.
Cheng, Q., Bai, X., & Wang, Y. (2008). Isolation and fermentation condition of milk-clotting enzyme producing strain from glutinous rice wine. Chinese Journal of Biotechnology, 24(6), 999-1003.
Egito, A., Girardet, J., Laguna, L., Poirson, C., Molle´, D., Miclo L., Humbert G., & Gaillard J. (2007). Milk-clotting activity of enzyme extracts from sunflower and albizia seeds and specific hydrolysis of bovine k-casein. International Dairy Journal, 17, 816–825. doi:10.1016/j.idairyj.2006.09.012.
Foda, M., Moharam, M., Ramadan, A., & El-Bendary, M. (2012). Over Production of Milk Clotting Enzyme from Rhizomucor miehei Through Adjustment of Growth Under Solid State Fermentation Conditions. Australian Journal of Basic and Applied Sciences, 6(8), 579-589.
Jacob M., Jaros D., & Rohm, H. (2011). Recent advances in milk clotting enzymes. International Journal of Dairy Technology, 64(1), 14–33. doi: 10.1111/j.1471-0307.2010.00633.x
Khademi, F., Abachi, S., & Malekzadeh, F. (2013). Semi-purification and kinetic study of microfungal rennet biosynthesized by local isolate of Rhizomucor nainitalensis using solid-state fermentation system: Concentration methods and determinant factors in clotting activity. European Journal of Experimental Biology, 3(2), 167-174.
Khademi, F., Abachi, S., Mortazavi, A., Ehsani, M.A., Tabatabaei, M.R., & Malekzadeh, F.A. (2013). Optimization of Fungal Rennet Production by local isolate of Rhizomucor nainitalensis. Under Solid Substrate Fermentation system. IOSR Journal of Pharmacy and Biological Sciences, 5(2), 115-121.
Khademi, F., Abachi, S., Mortazavi, A., Ehsani, M. A, Tabatabaei, M.R., & Malekzadeh F. (2013). Screening and isolation of substitute-rennet producing thermophilic phycomycetes, by modified Warcup method and improved selective medium. IOSR Journal of Agriculture and Veterinary Science, 2(2), 30-37.
Leammli, U. (1970). Cleavage of structural proteins during the assembly of the heat of bacteriophage T4. Nature, 227(5259), 680-685.
Maheshwari, R., Bharadawaj, G., & Mahalingeshwara, K. (2000). Thermophilic fungi: their physiology and enzyme. Microbiology and Molecular Biology Reviews, 64(3), 461-488.
Merheb-Dini, C., Gomes, E., Boscolo, M., & Da Silva, R. (2010). Production and characterization of a milk-clotting protease in the crude enzymatic extract from the newly isolated Thermomucor indicae-seudaticae N31 (Milk-clotting protease from the newly isolated Thermomucor indicae-seudaticae N31). Food Chemistry, 120, 87–93.
Miller, G. L. (1959). Use of dinitrosalicylic acid reagent for determination of reducing sugar”. Analitical Chemistry, 31, 426-428.
Nouani, A., Moulti- Mati, F., Belbraouet. S., & Bellal, MM. (2011). Purification and characterization of a milk-clotting protease from Mucor pusillus: Method comparison. African Journal of Biotechnology, 10(9), 1655-1665.
Osorio, A., Gómez, N., & Sánchez, C. (2008). Evaluación de diferentes fuentes de carbono y de nitrógeno para la producción de renina a partir del moho Mucor miehei. Revista de la Facultad de Ingeniería. Universidad de Antioquia, 45, 17-26.
Panouillé M., Nicolai T., Benyahia L., & Durand D. (2005). Aggregation and gelation of casein sub-micelles. In: Dickinson E editors. Food Colloids. Interactions, microstructure and processing. Cambridge, UK: The Royal Society of Chemistry.
Preetha. S., & Boopathy, R. (1997). Purification and characterization of a milk clotting protease from Rhizomucor miehei. World Journal of Microbiology & Biotechnology, 13, 573-578.
Ruiz, J. (2005). Extracción y Caracterización de Proteasas de Especies Vegetales Nativas y su Potencial Utilización en Quesería. (Tesis Licenciatura). Universidad Austral de Chile. Valdivia, Chile.
Weber K., & Osbor M. (1969). The reability of molecular weigth determinations by dodecylsulfate-polycrylamide gel electrophoresis. Journal of Biological Chemistry, 244(16), 4406-4412.
Shieh, C., Phan Thi, L., & Shihb, I. (2009). Milk-clotting enzymes produced by culture of Bacillus subtilis natto. Biochemical Engineering Journal, 43, 85–91.
Sathya, R., Pradeep, B., Angayarkanni, J., & Palaniswamy, M. (2009). Production of Milk Clotting Protease by a Local Isolate of Mucor circinelloides under SSF using Agro-industrial Wastes. Biotechnology and Bioprocess Engineering, 14, 788-794.
Yegin, S., Fernández-Lahore, M., Guvenc, U., & Goksungur, Y. (2010). Production of extracellular aspartic protease in submerged fermentation with Mucor mucedo DSM 809. African Journal of Biotechnology, 9(38), 6380-6386.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Patryk Wiśniewski, Monika Małkowska-Kowalczyk, Adriana Łobacz, Anna Zadernowska, Justyna Żulewska. (2025). Invited review: Milk-clotting enzymes of microbial origin and their role in cheesemaking—A review. Journal of Dairy Science, 108(10), p.10427. https://doi.org/10.3168/jds.2025-26973.
2. Héctor A. Fileto-Pérez, Luis G. Montoya-Ayón, Esther Soto-García, Jesús B. Páez-Lerma, Nicolás O. Soto-Cruz, Blanca E. García-Caballero, José G. Rutiaga-Quiñones. (2020). Effect of fermentation time and acid casein concentration as nitrogen source on microbial rennet production. Journal of Dairy Research, 87(3), p.379. https://doi.org/10.1017/S0022029920000655.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2015 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).