Cultivos de alta densidad celular por retención interna: aplicación a la fermentación continua de etanol
High cell density cultures produced by internal retention: application in continuous ethanol fermentation
Palabras clave:
reactor de membrana, Saccharomyces cerevisiae, fermentación alcohólica, recirculación celular, Membrane reactor, alcoholic fermentation, cell recycling (es)|
|
||
|
_____________________REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No. 2 Diciembre 2004 25-30
Cultivos de alta densidad celular por retención interna: aplicación a la fermentación continua de etanol
High cell density cultures produced by internal retention: application in continuous ethanol fermentation
Berta Carola Pérez**, Sonia Amparo Ospina***, Rubén Darío Godoy***
RESUMEN
El etanol ha generado gran interés por su potencial como combustible alternativo. No obstante, para que este producto sea competitivo económicamente, es necesario desarrollar procesos de fermentación que incrementen la baja productividad volumétrica lograda en cultivos convencionales (por lote o continuo), por medio de técnicas que permitan altas concentraciones celulares y reduzcan la inhibición por producto. Uno de los métodos empleados frecuentemente involucra la recirculación celular; por ello, en este trabajo se desarrolló un reactor de membrana incorporando un módulo de filtración, con unidades tubulares de 5 u,m en acero inoxidable, dentro de un fermentador de tanque agitado de 3L, para investigar su aplicación en la producción continua de etanol. Los efectos de la concentración celular y la caída de presión transmembranal sobre el flux de permeado fueron evaluados para probar el desempeño del módulo de filtración. Previa selección de las condiciones de fermentación (30 °C, 1,25 -1,75 vvm, pH 4,5), el sistema con retención celular interna fue operado en el cultivo continuo de Saccharomyces cerevisiae a partir de sacarosa. La permeabilidad de las unidades filtrantes fue mantenida mediante la aplicación de pulsos de aire. Más del 97% de las células cultivadas fueron retenidas en el fermentador, alcanzándose una concentración celular de 51 g/L y una productividad promedio de etanol, en el cultivo con retención celular, de 8,51 g/L.h, la cual fue dos veces mayor a la que se obtiene en un cultivo continuo convencional.
Palabras clave: reactor de membrana, Saccharomyces cerevisiae, fermentación alcohólica, recirculación celular.
ABSTRACT
Ethanol has provoked great interest due to its potential as an alternative fuel. Nevertheless, fermentation processes must be developed by increasing the low volumetric productivity achieved in conventional cultures (batch or continuous) to make this product become economically competitive. This can be achieved by using techniques leading to high cell concentration and reducing inhibition by the end-product. One of the frequently employed methods involves cell recycling. This work thus developed a membrane reactor incorporating a filtration module with 5 u,m stainless steel tubular units inside a 3L stirred jar fermenter for investigating its application in continuous ethanol production. The effects of cell concentration and transmembrane pressure difference on permeate flux were evaluated for testing the filtration module's performance. The internal cell retention system was operated in Saccharomyces cerevisiae continuous culture derived from sucrose, once fermentation conditions had been selected (30 °C, 1.25 -1.75 vvm, pH 4.5). Filter unit permeability was maintained by applying pulses of air. More than 97% of the grown cells were retained in the fermenter, reaching 51 g/L cell concentration and 8.51 g/L.h average ethanol productivity in culture with internal cell retention; this was twice that obtained in a conventional continuous culture.
Key words: Membrane reactor, Saccharomyces cerevisiae, alcoholic fermentation, cell recycling.
* Este artículo corresponde a la presentación oral que obtuvo el segundo lugar en la sala de bioprocesos,
bioprospección y ambiental del Segundo Congreso Colombiano de Biotecnología. ** Ingeniera Química, Departamento de Ingeniería Química, Universidad Nacional de Colombia, correo electrónico:
carola_perezm@hotmail.com
Química farmaceuta, Ph. D.; Departamento de Farmacia, Universidad Nacional de Colombia, correo electrónico:
saospinas@unal.edu.co **** Ingeniero Químico, M. Se, Departamento de Ingeniería Química, Universidad Nacional de Colombia.
Recibido: octubre 22 de 2004. Aceptado: octubre 29 de 2004.
|
||
|
|
||
|
25
|
||
|
|
||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 25-30
|
|||
|
|
|||
|
INTRODUCCIÓN
El desarrollo creciente y acelerado de la economía moderna impone nuevos retos a los países exigiéndoles competitividad e implementación de tecnologías de alta eficiencia que permitan reducir costos e incrementar el rendimiento de los procesos.
Dentro de los procesos biotecnológicos, uno de los más comunes e importantes es la fermentación de etanol, en el cual la productividad del reactor juega un papel importante en la determinación tanto de los costos de construcción y mantenimiento de la planta como en los costos de operación (Chang y Furusaki, 1991).
En Colombia, el etanol es empleado básicamente en las industrias licorera y farmacéutica, y posee un gran potencial de aplicación como combustible alternativo (Lee y Chang, 1987). Actualmente, la baja productividad de la fermentación clásica en sistemas discontinuos, y la inhibición por producto del crecimiento celular a determinadas concentraciones de etanol, han conducido a fermentaciones de larga duración y elevados costos de producción, generando un creciente aumento en las importaciones de etanol del país, que alcanzaron en el año 2002 un valor cercano a los 40 millones de litros. Es necesario, entonces, desarrollar procesos que aumenten la productividad volumétrica de los reactores, mediante técnicas que permitan alcanzar altas concentraciones celulares.
Los métodos empleados frecuentemente involucran los cultivos por lote alimentado o fed-batch, inmovilización y recirculación celular. No obstante, a menudo se prefiere la recirculación celular por los elevados costos de control en cultivos fed-batch y las dificultades para mantener unas condiciones de operación y de transferencia de oxígeno adecuadas con células inmovilizadas (Chang y Furusaki, 1991; Chang et al., 1994; Suzuki et al., 1994).
La recirculación celular puede realizarse por sedimentación, centrifugación y filtración mediante membranas. Este último método ha sido muy empleado para lograr altas productividades en el reactor. Sin embargo, la mayoría de los módulos de filtración utilizados han sido externos, exponiendo a las células a un medio inadecuado de crecimiento al recircularlas entre el fermentador y el separador, generando problemas tales como inadecuado suministro de oxígeno y remoción de dióxido de carbono, variaciones de pH y escasez de nutrientes en el módulo de separación; aparte
|
de ello, la esterilización del módulo externo es difícil y la recirculación del caldo requiere de bombas y energía adicional para la operación (Chang et al., 1993).
Para sobrellevar los problemas que involucran los procesos con recirculación celular externa, en el presente trabajo se llevó a cabo el desarrollo y montaje de un reactor de membrana a escala laboratorio para obtener cultivos de alta densidad celular por retención interna (Pérez, 2003). Se empleó como sistema modelo la fermentación de etanol por Saccharomyces cerevisiae.
MATERIALES Y MÉTODOS
Microorganismo. Se utilizó una cepa industrial mejorada de Saccharomyces cerevisiae, altamente sensible a la temperatura. Esta cepa fue cultivada y almacenada en tubos inclinados en cuña con agar Sabouraud constituido por neopeptona (10g/L), bac-todextrosa (40 g/L) y bacto-agar (15 g/L) a 4 °C.
Medio de cultivo. El medio de crecimiento y de fermentación contenía sacarosa (100 g/L) como sustrato, extracto de levadura (9,0 g/L), NH4Cl (1,3 g/L), MgSO4.7H2O, (0,12 g/L) y CaCl2 (0,06 g/L).
Módulo de filtración. El módulo de filtración desarrollado en este estudio se esquematiza en la figura 1. El material de filtración fue malla de acero inoxidable con un tamaño de poro efectivo de 5 |jm. El módulo de filtración consistía en unidades tubulares plisadas de 125 mm de altura, dispuestas en un soporte de acero inoxidable. El área total de la superficie disponible para la filtración de cada unidad era de 50 cm2.
|
||
 |
|||
|
Figura 1. Módulo interno de filtración en acero inoxidable.
|
|||
|
|
|||
|
26
|
|||
|
|
|||
|
|
|||
|
CULTIVOS DE ALTA DENSIDAD CELULAR POR RETENCIÓN INTERNA
|
|||
|
|
|||
|
Una vez realizados los experimentos, el módulo de filtración era separado del fermentador, inspeccionado visualmente para descartar cualquier daño físico y limpiado con una solución de NaOH 1N a 40 °C durante dos horas. Posteriormente era drenado y lavado con agua destilada hasta que el pH del permeado fuese igual al del agua. Una vez realizados estos tratamientos, el desempeño del módulo de filtración era verificado para asegurar que el flux de agua destilada correspondiese al obtenido inicialmente con la membrana virgen, antes de su reutilización.
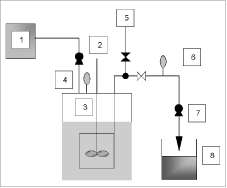
Sistema Reactor de Membrana. El montaje experimental para el sistema de filtración interna se esquematiza en la figura 2. El fermentador empleado fue un recipiente de vidrio de 3L con un volumen de trabajo de 2L dentro del cual se ubicaba el módulo de filtración. En el eje central de agitación se colocaron impulsores de tipo axial. Con el objetivo de incrementar la transferencia de oxígeno al medio de cultivo, se dispuso en el módulo de filtración una unidad plisada en acero inoxidable de 5 |jm para la dispersión de oxígeno. La salida de filtrado del módulo fue conectada mediante válvulas auna bomba de succión y a un compresor, que eran alternados cada hora por un periodo de tiempo de un minuto para la introducción de aire a 3,5 bar, a fin de permitir la recuperación de la permeabilidad de la membrana por remoción del material celular que se hubiese incrustado en los poros de la membrana.
|
El sistema fue operado en flujo tangencial para reducir la acumulación de células de levadura en la superficie de la membrana.
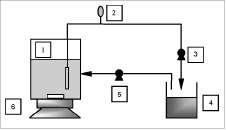
Prueba del desempeño de filtración. La capacidad de retención de las unidades de filtración fue evaluada filtrando una suspensión de células de levaduras. Las células obtenidas de un cultivo batch en el fermentador fueron centrifugadas y el sobrenadante fue removido. Posteriormente, se resuspendieron en una solución salina amortiguadora que consistía de NaCl (8,5 g/L), KH2PO4 (2 g/L) y Na2HPO4 (4 g/L) hasta ajustar la suspensión a una concentración celular aproximada de 4 g/L. La suspensión de levaduras fue colocada en un reservorio de 5L a 100 rpm y 1 vvm de aireación. Los experimentos fueron llevados a cabo a pH 7,0 y temperatura ambiente (20 °C), para mantener constante la concentración de células en la suspensión durante las pruebas, considerando que bajo estas condiciones se reduce la actividad me-tabólica del microorganismo. La suspensión fue filtrada a través de cada unidad de filtración y se tomaron muestras en intervalos de 15 minutos hasta que la concentración celular en el filtrado fuese invariable. Para mantener tanto el volumen de fluido como la concentración celular constantes en el sistema, el permeado era recirculado al reservorio (figura 3.)
El coeficiente de retención se definió como:
|
||
|
|
|||
|
R=100
|
|||
|
|
|||
 |
donde CF y CR son las concentraciones de células en el permeado y en el retenido, respectivamente.
Una vez determinada la permeabilidad de las unidades de filtración, se investigaron los efectos del gradiente de presión transmembranal y la concentración celular sobre el flux de permeado en el reactor equipado con el módulo de retención celular interna. Se asumió un estado estable del sistema cuando el flux de filtrado no presentó variaciones significativas con el tiempo.
Inoculación. El inóculo fue preparado a partir de células cultivadas aeróbicamente en un erlenmeyerde 1L, que contenía 160 mL de medio de crecimiento, y llevado a incubación a 30 °C en un agitador orbital a 200 rpm durante 12 horas. El volumen de inoculación fue el 10% (v/v) del volumen de trabajo para la fermentación.
|
||
|
Figura 2. Montaje experimental para la fermentación continua de Saccharomyces cerevisiae: 1) almacenamiento de medio de cultivo, 2) bomba peristáltica, 3) fermentador equipado con módulo de filtración, 4) manómetro, 5) compresor, 6) vacuómetro, 7) bomba de succión, 8) recipiente para filtrado.
|
|||
|
|
|||
|
27
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 25-30
|
|||
|
|
|||
 |
85%, demostrando que un tamaño de poro de 5 |jm es adecuado para la separación de células de levadura.
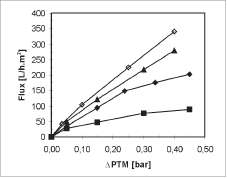
Los efectos de la concentración celular y la caída de presión transmembranal sobre el flux de per-meado se presentan en la figura 4. Los experimentos se llevaron a cabo a una velocidad de agitación de 500 rpm, considerando que el esfuerzo de corte generado a esta velocidad fue lo suficientemente alto para mantener tanto la superficie de la membrana libre de depósitos como para obtener caídas del flux de filtrado relativamente bajas con el tiempo.
Como se muestra en la figura 4, el flux de per-meado se reduce con el incremento de la concentración de células en el medio hasta un límite a partir del cual experimenta pequeños incrementos adicionales en el flux.
El primer fenómeno corresponde a un régimen dependiente de la presión, en el cual el factor controlante que limita el flux es la resistencia interna de la membrana debida a la incrustación de células en los poros. En el segundo fenómeno, la formación de gradientes de concentración de levadura en la proximidad de la membrana (polarización de la concentración) es demasiado alta y cualquier incremento adicional en la presión únicamente sirve para compactar la capa de gel y aumentar su espesor. Este último predomina a medida que aumenta la concentración celular y por ello domina el proceso utilizado en este estudio.
|
||
|
Figura 3. Diagrama esquemático del montaje experimental para las pruebas de retención celular: 1) reservorio equipado con unidad de filtración, 2) presión de vacío, 3) bomba de succión, 4) recipiente para filtrado, 5) bomba peristáltica, 6) placa de agitación.
|
|||
|
Operación para la fermentación de etanol. Inicial-mente, el cultivo se hizo en modo batch hasta agotar el sustrato y luego fue operado en modo continuo. La velocidad de alimentación del medio fue ajustada mediante una bomba peristáltica. El nivel del fermentador fue controlado en una altura fija para que el flujo de entrada fuese aproximadamente igual al flujo de salida. El medio fresco fue suministrado continuamente al fermentador por una bomba peristáltica, al mismo tiempo que el producto era removido a través del módulo de filtración por una bomba de succión. El fermentador y el módulo de filtración fueron simultáneamente esterilizados por 40 min. a 121 °C. La fermentación se llevó a cabo a 30 °C y el pH fue controlado en 4,5 mediante la adición de KOH 2N y HCl concentrado al 37%. Para mantener la viabilidad celular, se suministró continuamente aire estéril al fermentador a una tasa de 1,25-1,75 vvm.
Métodos analíticos. Las concentraciones de azúcares reductores (sacarosa, glucosa y fructuosa) y de etanol se analizaron por HPLC usando una columna Sugar Pak. La concentración celular fue medida usando un espectrofotómetro a 600 nm. El peso seco de las células fue calculado después de centrifugar la suspensión celular dos veces, desechar el sobrenadante, lavar el pellet con solución salina isotónica y secar hasta peso constante a 45 °C. La viabilidad celular se determinó por el método de tinción con azul de metileno.
RESULTADOS Y DISCUSIÓN
Desempeño del módulo de filtración. Las unidades en acero inoxidable dispuestas en el módulo de filtración reportaron coeficientes de retención superiores al
|
|||
 |
|||
|
Figura 4. Cambio del flux en función de la presión transmembranal a diferentes concentraciones celulares. [■] 13,92 g/L, [♦] 6,84 g/L, [•*•], 3,12 g/L, [O], 1,37 g/L.
|
|||
|
|
|||
|
28
|
|||
|
|
|||
|
|
|||
|
CULTIVOS DE ALTA DENSIDAD CELULAR POR RETENCIÓN INTERNA
|
|||
|
|
|||
|
Estos fenómenos son similares a los que se obtienen con cualquier mecanismo externo de filtración.
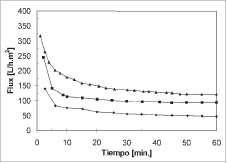
Los cambios en el flux durante la filtración de suspensiones de diferente concentración celular se observan en la figura 5. En general, el flux cae rápidamente al inicio de la filtración, experimentando posteriormente un descenso gradual hasta la estabilización. Este comportamiento es ocasionado por las células suspendidas que son conducidas hacia la superficie de la membrana por el flujo de permeado, al comienzo de la filtración, ocasionando que se depositen en el interior de la misma. A medida que se incrementa el porcentaje de sólidos depositados, el flux disminuye. Sin embargo, conforme se reduce el flux, la fuerza hidráulica que empuja a las células hacia el interior de la membrana disminuye y el efecto del flujo tangencial en la remoción de células se incrementa. Como resultado, se previene que se depositen más células y por lo tanto el flux alcanza un valor constante.
|
 |
||
|
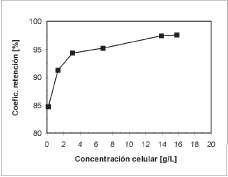
Figura 6. Cambio del coeficiente de retención con la concentración celular a una APTM de 0,15.
|
|||
 |
|||
 |
|||
|
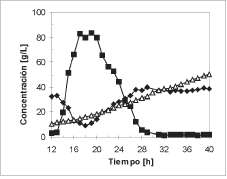
Figura 7. Cultivo con retención celular interna total de Saccharomyces cerevisiae. (A) Biomasa (♦) Etanol (■) Azúcares Reductores Totales.
|
|||
|
Figura 5. Cambio del flux en función del tiempo para diferentes concentraciones celulares, a una APTM de 0,15 bar. [♦] 13,92 g/L, [■]6,84g/L, [A] 3,12 g/L.
La figura 6 presenta la variación del coeficiente de retención como función de la concentración celular a una presión transmembranal de 0,15 bar. La capa de gel que se forma sobre la superficie de la membrana durante la filtración constituye una segunda membrana dinámica que debe superar la suspensión celular. Al paso de la suspensión, esta barrera retiene células, incrementando el espesor de la capa de gel y, por consiguiente, el coeficiente de retención. El espesor de la capa de gel es mayor a medida que aumenta la concentración celular de la suspensión.
Cultivo con retención celular interna. El perfil de concentraciones del cultivo de Saccharomyces
|
|||
|
cerevisiae con un sistema de filtración interno usando una membrana en acero inoxidable de 5 |jm se muestra en la figura 7. El cultivo fue operado inicial-mente en modo batch, como se mencionó. Al final del cultivo batch, cuando el sustrato fue agotado y la concentración celular fue de 10,36 g/L se arrancó la operación en modo continuo con retención celular. La fermentación continua de etanol fue exitosamente llevada a cabo durante 28 horas, tiempo después del cual la resistencia hidráulica de la membrana, debida al efecto de polarización de concentración en la superficie de la misma, y la viscosidad del medio llegaron a ser demasiado altas para mantener un adecuado flujo de filtración.
|
|||
|
|
|||
|
29
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL.VI No. 2 Diciembre 2004 25-30
|
|||
|
|
|||
|
En el comienzo del cultivo continuo, la concentración de azúcares reductores totales se incrementó rápidamente hasta 83,6 g/L debido a la baja concentración de células de levadura; después se redujo gradualmente, llegando a ser nula después de 9 horas. La máxima concentración celular obtenida en este estudio fue de 51 g/L, siendo cinco veces mayor a la que puede ser alcanzada en un cultivo continuo convencional (Cysewski y Wilke, 1976). Más del 97% de las células fueron retenidas dentro del reactor, manteniéndose una viabilidad celular durante el proceso mayor al 84%. La concentración celular alcanzada es similar a la que se logra en un sistema de recirculación celular externo operado en un rango de dilución de 0,23 h-1 a 0,41 h-1, en un tiempo de fermentación aproximado de 30 horas (Lee y Chang, 1987). Sin embargo, el sistema de cultivo con retención celular interna tiene significativas ventajas sobre los sistemas tradicionales de recirculación externa, debido a que reduce los costos de mantenimiento y los gastos operacionales.
La productividad global de etanol del proceso, incluyendo la fase batch, fue de 6,15 g/L.h.
La concentración promedio de etanol en el filtrado durante la limitación de sustrato fue de 37,7 g/L y el coeficiente promedio de rendimiento, Yp/s, fue de 0,37. En esta fase, la productividad de etanol fue de 8,51 g/L.h., 3,2 veces la obtenida en la etapa batch (Pp/t = 2,69 g/L.h) y 2 veces mayor a la de un cultivo continuo convencional (Parketal., 1999).
CONCLUSIONES
En la mayoría de sistemas de cultivo con recirculación celular externa y en sistemas multirreactores, los problemas de contaminación y daño celular durante el transporte de células entre el fermentadory el separador han sido inevitables. El reactor de membrana reportado en este estudio para la retención celular fue exitoso en sobrellevar estos inconvenientes al disponer un módulo de filtración dentro de un reactor de tanque agitado.
La capacidad del módulo de filtración fue lo suficientemente alta para alcanzar cultivos celulares de alta densidad de 51 g/L de levadura, manteniendo una alta viabilidad en el cultivo por la remoción de productos inhibitorios tales como el etanol. Asimismo,
|
permitió incrementar notablemente la productividad volumétrica del reactor en la fermentación de etanol, en comparación con la que se obtiene en un cultivo batch, sin observarse pérdidas significativas en el desempeño del módulo.
En posteriores estudios es primordial controlar la concentración celular en el fermentador para la estabilización y operación a largo término del sistema con retención celular, dado que la concentración de células continúa incrementándose hasta hacer el proceso inoperable. Este control puede ser llevado a cabo mediante una corriente de remoción celular cuya magnitud puede ser determinada por la tasa de dilución y la velocidad de crecimiento celular.
El sistema desarrollado es aplicable a varios procesos microbiológicos permitiendo incrementar la concentración celular por el suministro continuo de nutrientes y por la extracción de metabolitos inhibitorios.
BIBLIOGRAFÍA
Chang, H.; Furusaki, S. 1991. Membrane Bioreactors: Present and Prospects. Advances in Biochemical Engineering. 44: 27-64.
Chang, H., Lee, W.; Kim, B. 1993. Cell retention culture with an internal filter module: Continuous ethanol fermenta-tion. Biotechnology and Bioengineering. 41: 677- 681.
Chang, H., Yoo, I.; Kim, B. 1994. High density cell cultures by membrane-based cell recycle. Biotechnology Advances. 12:467-487.
Cysewski, G.; Wilke, C. 1976. Utilization of cellulosicmaterials through enzymatic hydrolysis I. Fermentation of hydrolysis to ethanol and single cell protein. Biotechnology and Bioengineering. 18: 1927-1313.
Lee, W.; Chang, H. 1987. Kinetics of ethanol fermentations in membrane cell recycle fermentors. Biotechnology and Bioengineering. 29: 1105-1112
Park, B.; Lee, W.; Chang, Y.; Chang, H. 1999. Long-term operation of continuous high cell density culture of Saccharomyces cerevisiae with membrane filtration and on-line cell concentration monitoring. Bioprocess Engineering. 21: 97-100.
Pérez, B. 2003. Montaje de un reactor de membrana para obtener cultivos de alta densidad celular por retención interna. Aplicación a Saccharomyces cerevisiae. Trabajo de Grado. Bogotá, Colombia, Universidad Nacional. Departamento de Ingeniería Química.
Suzuki, T.; Sato, T.; Kominami, M. 1994. A dense cell retention culture system using a stirred ceramic membrane reactor. Biotechnology and Bioengineering. 44: 1186-1192.
|
||
|
|
|||
|
30
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2004 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















