Propagación in vitro de materiales seleccionados de Rubus glaucus Benth (mora de Castilla) en la provincia de Pamplona, región nororiental de Colombia
Propagation in vitro of selected materials of Rubus glaucus Benth (mora de Castilla) in the province of Pamplona, northeastern Colombia
DOI:
https://doi.org/10.15446/rev.colomb.biote.v17n2.54262Palabras clave:
Mora de los Andes, micropropagación, asociaciones de cultivadores, 6-benzil aminopurina, Andean blackberry, micropropagation, growers associations, 6-aminopurine (es)En este estudio los materiales fueron seleccionados en 53 fincas pertenecientes a cuatro asociaciones de cultivadores de mora en los municipios de Pamplona y Chitagá (Norte de Santander, Colombia). Se emplearon como explantes segmentos nodales, los cuales permitieron obtener en poco tiempo brotes adventicios adecuados para la multiplicación masiva. Para la etapa de establecimiento se empleó el medio de cultivo Murashige y Skoog, (MS 1962), suplementado con ácido giberélico (GA3) (0.0-0.1 mg/L) y 6-benzil aminopurina (BAP) (0,0-2,0 mg/L), en la etapa de multiplicación MS ,suplementado con GA3 (0,0-0,03 mg/L-1) y BAP (0,0-2,5 mg/L) y para la etapa de enraizamiento MS, suplementados con ácido indolbutírico (AIB) (0,0-1,0 mg/L). A los datos generados en las tres etapas, se les aplicó un diseño experimental de bloques completos al azar y se analizaron estadísticamente los promedios de los tratamientos mediante una prueba de Tukey. Los resultados alcanzados indicaron tasas promedio de contaminación (16,5-49,7 %) multiplicación (3,8-4,3 brotes/explante) y enraizamiento (3,3-4,3 raíces/planta) in vitro para los diferentes materiales seleccionados y evaluados. Estos resultados, logrados por primera vez en la región Nororiental de Colombia, son importantes por cuanto se contara con materiales seleccionados disponibles para los cultivadores de mora de la región.
In this study plant materials were selected in 53 farms belonging to four growers associations of blackberry in the municipalities of Pamplona and Chitagá (North of de Santander, Colombia). Nodal segments were used as initial explants of R. glaucus. For the establishment stage Murashige and Skoog, 1962 (MS) media was used and, supplemented with of gibberellic acid (GA3) (0.0 -0.1 mg/L) and 6-aminopurine (BAP) (0.0 -2.0 mg/L); for the multiplication stage MS was supplemented with GA3 (0.0 -0.03 mg/L) and BAP, (0.0 -2.5 mg/L) and for the rooting stage MS was supplemented with acid indolbutirico (0.0 -1.0 mg/L). From the data generated during the three stages, an experimental design of incomplete blocks was randomly applied and the treatments averages were statistically analyzed using the Tukey Test. The results indicated average rates of contamination (16.5-49.7 %), multiplication (3.8-4.3 shoots/explant) and in vitro rooting (3.3-4.3 roots/plant) for the different evaluated materials. These results, achieved first in the Northeastern region of Colombia, are important in that they will feature selected materials available for blackberry growers in the region.
Key words: Andean blackberry, micropropagation, growers associations, 6-aminopurine.
DOI: https://doi.org/10.15446/rev.colomb.biote.v17n2.54262
ARTÍCULO DE INVESTIGACIÓN
Propagación in vitro de materiales seleccionados de Rubus glaucus Benth (mora de Castilla) en la provincia de Pamplona, región nororiental de Colombia
Propagation in vitro of selected materials of Rubus glaucus Benth (mora de Castilla) in the province of Pamplona, northeastern Colombia
Giovanni Orlando Cancino-Escalante*, Enrique Quevedo García**, Carmen Edilia Villamizar***, Claudia Díaz Carvajal****
* Profesor Asociado PhD. Universidad de Pamplona - Facultad de ciencias básicas - Departamento de Biología. Km 1 vía Bucaramanga el Buque, Pamplona, Norte de Santander, Colombia. gcancino@unipamplona.edu.co
** Profesor Asociado MSc. Universidad de Pamplona, Facultad de Ciencias Agrarias - Departamento de Agronomía. km 1 vía Bucaramanga el Buque, Pamplona, Norte de Santander, Colombia. enriquegarcia@unipamplona.edu.co
*** Profesor MSc. Universidad de Pamplona, Facultad de Educación. km 1 vía Bucaramanga el Buque, Pamplona, Norte de Santander, Colombia. cevill28@gmail.com.
**** MSc Universidad de Pamplona - Facultad de ciencias básicas - Departamento de Biología. Km 1 vía Bucaramanga el Buque, Pamplona, Norte de Santander, Colombia. gcancino@unipamplona.edu.co
Recibido: octubre 15 de 2014 Aprobado: septiembre 2 de 2015
Resumen
En este estudio los materiales fueron seleccionados en 53 fincas pertenecientes a cuatro asociaciones de cultivadores de mora en los municipios de Pamplona y Chitagá (Norte de Santander, Colombia). Se emplearon como explantes segmentos nodales, los cuales permitieron obtener en poco tiempo brotes adventicios adecuados para la multiplicación masiva. Para la etapa de establecimiento se empleó el medio de cultivo Murashige y Skoog, (MS 1962), suplementado con ácido giberélico (GA3) (0.0-0.1 mg/L) y 6-benzil aminopurina (BAP) (0,0-2,0 mg/L ), en la etapa de multiplicación MS ,suplementado con GA3 (0,0-0,03 mg/L-1) y BAP (0,0-2,5 mg/L) y para la etapa de enraizamiento MS, suplementados con ácido indolbutírico (AIB) (0,0-1,0 mg/L). A los datos generados en las tres etapas, se les aplicó un diseño experimental de bloques completos al azar y se analizaron estadísticamente los promedios de los tratamientos mediante una prueba de Tukey. Los resultados alcanzados indicaron tasas promedio de contaminación (16,5-49,7 %) multiplicación (3,8-4,3 brotes/explante) y enraizamiento (3,3-4,3 raíces/planta) in vitro para los diferentes materiales seleccionados y evaluados. Estos resultados, logrados por primera vez en la región Nororiental de Colombia, son importantes por cuanto se contara con materiales seleccionados disponibles para los cultivadores de mora de la región.
Palabras clave: Mora de los Andes, micropropagación, asociaciones de cultivadores, 6-benzil aminopurina.
Abstract
In this study plant materials were selected in 53 farms belonging to four growers associations of blackberry in the municipalities of Pamplona and Chitagá (North of de Santander, Colombia). Nodal segments were used as initial explants of R. glaucus. For the establishment stage Murashige and Skoog, 1962 (MS) media was used and, supplemented with of gibberellic acid (GA3) (0.0 -0.1 mg/L) and 6-aminopurine (BAP) (0.0 -2.0 mg/L); for the multiplication stage MS was supplemented with GA3 (0.0 -0.03 mg/L) and BAP, (0.0 -2.5 mg/L) and for the rooting stage MS was supplemented with acid indolbutirico (0.0 -1.0 mg/L). From the data generated during the three stages, an experimental design of incomplete blocks was randomly applied and the treatments averages were statistically analyzed using the Tukey Test. The results indicated average rates of contamination (16.5-49.7 %), multiplication (3.8-4.3 shoots/explant) and in vitro rooting (3.3-4.3 roots/plant) for the different evaluated materials. These results, achieved first in the Northeastern region of Colombia, are important in that they will feature selected materials available for blackberry growers in the region.
Key words: Andean blackberry, micropropagation, growers associations, 6-aminopurine.
Introducción
El género Rubus es uno de los más diversos en términos morfológicos y genéticos. Presenta un amplio espectro de especies silvestres y las cultivadas son apetecidas por sus frutos comestibles (Jennings, 1988). Los frutos son consumidos frescos o procesados y actualmente existe gran interés por sus propiedades medicinales debido a su alta actividad antioxidante (Seeram et al., 2006, Cusba Mejia 2011).
La especie de Rubus que actualmente se cultiva comercialmente de manera masiva en Suramérica es R. glaucus Benth. Esta especie se distribuye ampliamente en el país, desde el departamento del Putumayo hasta el Valle del Magdalena y se cultiva en altitudes entre 2 000 y 3200 m s.n.m. Según datos del Ministerio de Agricultura y Desarrollo Rural y el Departamento Administrativo de Estadística (DANE) para noviembre de 2013, Colombia contaba con 7 007 hectáreas plantadas, de las cuales 4 922 están en edad productiva y una producción de 73 856 toneladas anuales. Adicionalmente los departamentos de Cundinamarca, Santander, Norte de Santander y Antioquia, son los que presentan los mayores porcentajes en aérea y producción (DANE, 2013).
A pesar del gran potencial de la mora en el mercado internacional, su propagación se hace vegetativamente en Colombia a partir de materiales no identificados como élite; productores y viveros propagan los materiales regionales sin normas de calidad fisiológica y sanitaria ni ofrecen seguridad de la identidad genética del material (Castro & Díaz, 2001; Castro, Díaz, Montoya & Ríos, 2006).
En este contexto, el cultivo de tejidos vegetales in vitro o micropropagación se constituye en una herramienta práctica que permite superar estas limitaciones. Adicionalmente, es una técnica rápida en especies frutales y puede producir masivamente individuos de Rubus genéticamente idénticos y libres de virus en un espacio reducido, sin ser afectados por las variaciones ambientales (Zimmerman, 1991; Sobczykiewicz, 1992).
A nivel mundial se han publicado varios trabajos de cultivo in vitro de diferentes especies de Rubus. El primer trabajo de propagación in vitro de Rubus fue desarrollado por Broome y Zimmerman (1978) en los cultivares thornless y harper de mora. Posteriormente las investigaciones se han centrado en los factores que influyen en la respuesta in vitro como son la desinfección de los explantes y las bajas tasas de propagación (McPheeters, Skirvin & Hall 1988; Tian, Duan & Wang, 2005; Wu, Miller, Hall & Mooney, 2009, Clark & Finn, 2011). Igualmente se destacan experimentos que se focalizan en la micropropagación de nuevos cultivares y en los existentes (Donnelly & Daubeny 1986; Bobrowski, Mello Farias & Peters, 1996; González et al., 2000; Zawadzka & Orlikowska, 2006). En Colombia, Marulanda y Márquez (2002), obtuvieron plantas mediante organogénesis, procedentes de la zona cafetera colombiana; Castro y Díaz (2001) por su parte han desarrollado metodologías para la micropropagación de mora de material seleccionado. Adicionalmente, Valderrama et al., 2009 publicaron la validación y escalonamiento de plántulas de mora in vitro y manejo ex vitro para entrega a agricultores de Silvania, Cundinamarca. Igualmente se destaca las investigaciones de Sigarro y García (2011), quienes evaluaron la micropropagación en R. glaucus sin espinas. Sin embargo a pesar de las diferentes investigaciones a través de los años un gran número de cultivares son todavía recalcitrantes al cultivo de tejidos. Entre los factores críticos que influyen en la respuesta in vitro se encuentran la desinfección del explante y la baja tasa de propagación (Daubeny, 1986, McPheeters et al., 1988; Donnelly y Daubeny, 1986 y Bobrowski et al., 1996; González, López, Valdés y Ordas, 2000; Tian et al., 2005, Zawadzka y Orlikowska, 2006, Clark y Finn, 2011).
En consecuencia el presente trabajo tuvo como objetivo evaluar la micropropagación de materiales seleccionados de R. glaucus de ocho fincas comerciales en los municipios de Pamplona y Chitagá los cuales habían sido caracterizados tanto agronómicamente como molecularmente (Cancino, Quevedo, Villamizar, Sánchez y Díaz, 2014).
Materiales y métodos
Material vegetal
Entre marzo de 2009 y noviembre de 2011 se efectuaron salidas de campo para la recolección de muestras R. glaucus en 53 fincas de cuatro asociaciones de cultivadores de mora de los municipios de Pamplona y Chitagá. De acuerdo con los resultados de encuestas a agricultores y características agronómicas, se seleccionaron 8 fincas en las cuales se encontraban los mejores materiales de las cuatro asociaciones (figura 1, tabla 2). Para la evaluación de micropropagación se seleccionó un material por finca para un total de ocho materiales. Previamente estos materiales habían sido caracterizados agronómica y molecularmente (Cancino et al., 2011, 2014). Las fincas se localizan en 14 veredas de los municipios de Pamplona y Chitagá, entre 7°,7',60" y 7°,28',15" norte y 72°,35',16" y 72°,42',43" Oeste (figura 1). Todas las fincas poseen cultivos comerciales de R. glaucus, mora de Castilla con espinas (CE) y sin espinas (SE) rodeados de bosques secundarios y matorrales a altitudes entre los 2 070 y 2 860 m s.n.m.

Establecimiento in vitro
Para el establecimiento in vitro de explantes del material seleccionado en las diferentes fincas se efectuaron nuevamente salidas de campo en cada uno de los predios. Se recolectaron segmentos de tallo de ramas jóvenes de 50 cm de longitud y se llevaron en vueltas en papel periódico, al laboratorio de cultivos vegetales invitro de la Universidad de Pamplona. Las ramas fueron cortadas hasta obtener segmentos nodales (microestacas) de 3-5 cm de longitud aproximadamente con una yema axilar; los explantes fueron lavados en una solución jabonosa; posteriormente, se sometieron a dos tratamientos de desinfección superficial (tabla 1). Finalizados los tiempos de desinfección superficial, se efectuaron 5 enjuagues en los explantes, con agua destilada estéril y se colocaron en una solución de ácido cítrico 150 mg/L para controlar la oxidación, mientras se procedía a su siembra. Los explantes desinfectados se cortaron nuevamente hasta obtener un explante (microestaca con yema axilar) de 2 cm de longitud. Cada explante, fue colocado en el medio de establecimiento MS suplementado, con concentraciones de ácido giberélico (GA3) y 6-benzil aminopurina (BAP). Al cabo de una semana se tomaron los ápices meristemáticos que emergieron de cada microestaca libres de cualquier contaminación y se transfirieron a medio fresco con el fin de garantizar un rápido establecimiento de los explantes y 30% de sacarosa. Los medios con un pH ajustado de 5,8 se esterilizaron con autoclave durante 15 minutos a 15 libras de presión y 121°C. Para la solidificación de los medios se utilizó agar bacteriológico al 7%. Posteriormente, al cabo de 20 días de incubación a una temperatura de 20±2ºC, fotoperiodo de 16 horas luz/8horas de oscuridad y una intensidad lumínica de 2000 lux, se descartaron los explantes contaminados y dejaron por 20 días más los explantes sin contaminación. El establecimiento de los explantes se realizó bajo condiciones de estricta asepsia utilizando para ello una cámara de flujo laminar previamente acondicionada. Los explantes fueron establecidos en frascos de compota con 20 ml de medio de cultivo semisólido.
Multiplicación in vitro
Los explantes sanos y libres de contaminantes se dividieron y se transfirieron al medio de multiplicación MS, suplementados con concentraciones de (GA3) y (BAP), (tabla 3, medios M2, M3, M5 y M6) y 30% de sacarosa. Luego de cuatro semanas de crecimiento se dividieron los explantes nuevos y se transfirieron a un medio fresco de multiplicación hasta obtener el número de explantes para cada genotipo evaluado.
Enraizamiento in vitro
Los explantes multiplicados se dividieron, se sembraron en el medio de enraizamiento MS suplementados con ácido indolbutírico (tabla 3, medios M8 y M9) y 30% de sacarosa. Los explantes se incubaron durante cuatro semanas a las mismas condiciones de temperatura, fotoperiodo e intensidad lumínica establecidas en la etapa de establecimiento y multiplicación.
Diseño experimental y análisis de datos
Se realizó un diseño de bloques completos al azar, con arreglo factorial 9 x 3. Este arreglo significó nueve medios con tres concentraciones hormonales (en cada etapa) en MS para cada uno de los diferentes materiales de R. glaucus Benth evaluados para un total de veinte y siete tratamientos. Cada tratamiento tuvo 5 repeticiones, en donde cada replica estaba representada por un frasco de cultivo con un explante. Se realizó una análisis de varianza (ANDEVA), posteriormente se hizo una comparación de medias de Tukey con un nivel de significancia de 5% para determinar cuáles de los tratamientos presentaban diferencias estadísticas significativas. Los datos fueron colectados durante 8 semanas. Se empleó el programa estadístico SPSS versión 19. Se realizaron análisis estadísticos de los datos para obtener el valor promedio y valores de dispersión. Asimismo, se realizó un análisis de varianza y en caso de existir diferencias estadísticas entre localidades se realizó la prueba Tukey de separación de medias. El modelo estadístico para realizar el ANDEVA fue completamente al azar con efecto anidado o jerárquico (Dytham, 2012).
Resultados y discusión
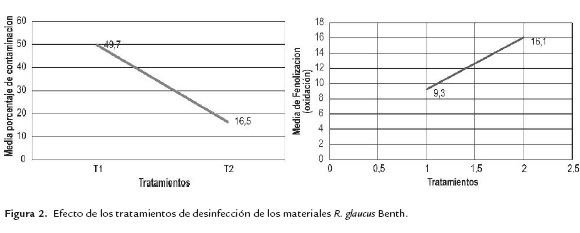
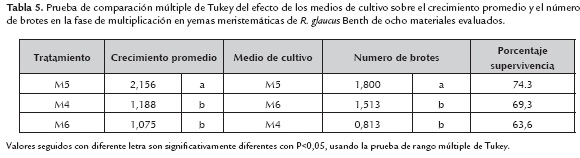
Efecto de los tratamientos de desinfección en los materiales de las ocho fincas evaluadas en el estudio
Se presentaron diferencias significativas a un nivel del 5% (P<0,05) entre los tratamientos T1 y T2 de desinfección (figura 2). En el tratamiento T1 se observó una mayor contaminación en los materiales de las ocho fincas evaluadas. Debido a que los explantes fueron expuestos a menores tiempos con los agentes desinfectantes que con el tratamiento T2. Sin embargo en el tratamiento T2 se presentó mayor oxidación. Por otra parte se observó que los genotipos de R. glaucus sin espinas presentaron menores porcentajes de contaminación que los genotipos con espinas. Posiblemente la presencia de las espinas favorece que diversos tipos de contaminantes permanezcan en los explantes incrementando la contaminación superficial. Los resultados contrastan con los observados por Valderrama et al., 2009 quienes registraron porcentajes entre 28 y 57% en R. glaucus SE. En este contexto es importante indicar que la selección y concentración de los desinfectantes y el tiempo de desinfección se determinan en gran medida por las características del explante, y se establecen experimentalmente por ensayo y error (Pedraza-Manrique, 2008). El porcentaje de contaminación y por ende el de supervivencia de los explantes está fuertemente influenciado por varios factores como son: la época del año, el estado fisiológico de la planta, las condiciones ambientales y la morfología del explante. En el presente estudio, los materiales fueron recolectados en la época seca (meses de diciembre-marzo, junio-agosto) lo cual favoreció los bajos índices de contaminación. Por el contrario la recolección de los explantes por parte de Valderrama, Álvarez, Barrero, Robayo y Nuñez (2009) fue efectuada en diferentes épocas del año lo cual posiblemente determino niveles mayores de contaminación en los materiales del estudio de estos investigadores. Es importante señalar que lo más recomendable para el establecimiento de plantas in vitro es el empleo de explantes proveniente de plantas mantenidas en condiciones de invernadero, a las cuales se les debe realizar desinfección con fungicidas y bactericidas. Sin embargo, para el presente estudio no fue posible contar con plantas mantenidas en condiciones de invernadero. En lo que respecta a la fenolización u oxidación de los explantes con los dos tratamientos de desinfección en las microestacas se evidencio mayor oxidación en todos los materiales con el tratamiento T2 con respecto a T1. Es importante destacar que el subcultivo de las yemas adventicias de las microestacas luego de una semana de cultivo permitió reducir la contaminación endógena hasta un nivel mínimo, sin necesidad de emplear procedimientos fuertes para la desinfección del material vegetal.
Efecto de los medios de cultivo M1, M2 y M3 sobre la longitud y numero de hojas en la fase de establecimiento en yemas meristemáticas de R. glaucus Benth
El efecto de los medios de cultivo sobre el desarrollo de los explantes durante la fase de establecimiento en los ocho materiales se observa en la tabla 4. Se encontraron diferencias significativas (P<0,05), en número de hojas entre medios de cultivo, observándose un mayor crecimiento y desarrollo de ápices meristemáticos en el medio M3 lo que permitió una mejor formación de plántulas previo al inicio de la fase de multiplicación. Varios autores Muñoz y Reyes (2006), Sigarroa y García (2011), han observado que en el cultivo de meristemos de R. glaucus Benth la utilización de AG3 presenta los mejores desarrollos cuando se aplica en combinación con BAP. Tanto el número de hojas como el crecimiento en longitud fueron altos en relación a los otros tratamientos (17,8 hojas y 1,41 cm respectivamente) (tabla 4).
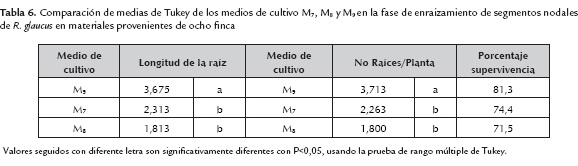
Multiplicación de los brotes
Luego de cuatro semanas de establecidos los explantes en los medios de multiplicación se obtuvieron plantas en el medio M5 en el cual alcanzaron mayores longitudes y números de brotes que los medio M4 y M6 (P<0,05) (tabla 5). Se encontraron diferencias significativas entre los tratamientos (P<0,05) para las variables crecimiento promedio y numero de brotes (tabla 5). Se observaron mejores resultados en el medio M5 debido a una menor concentración de GA3 y que en el medio M6 e igual concentración de BAP. Es importante resaltar que el número de brotes obtenidos en todos los materiales evaluados fueron menores a lo descrito por Sigarroa y García (2011) (7,5), Villa, Gómez, Salles y Pascual (2009) (3,99) y Castro y Díaz 2001 (4,7). Para el caso de esta investigación es evidente que la gran diversidad de materiales de R. glaucus Benth SE y CE evaluados presentaron una respuesta muy heterogénea en la variable número de brotes. La diferencia en el número de brotes obtenidos puede ser el resultado de las diferencias de los diferentes genotipos evaluados.
Enraizamiento in vitro
Los brotes se seccionaron y sembraron en el medio de enraizamiento y permanecieron por cuatro semanas hasta el desarrollo y formación de raíces. Se observaron los mejores resultados en el medio M9. El número promedio de raíces en este medio para los diferentes materiales evaluados fue muy homogéneo observándose de 4,3 a 3,3 raíces por planta a las cuatro semanas de cultivo (tabla 6). Igualmente el crecimiento en longitud de la raíces se presentó entre 4,9 y 2,1 cm. Estos resultados son similares a los obtenidos por Muñoz y Reyes (2006) en los cuales el efecto del IBA para la formación de raíces fue el mejor que el de otros reguladores como ácido indolacético (IAA) y ácido naftalenacético (ANA) para esta etapa. Los resultados alcanzados bajo este estudio son similares a los descritos por Castro et al., (2006), quienes realizaron estudios de enraizamiento en diferentes especies de Rubus bajo la aplicación de ácido indolbutírico (IBA) en diferentes concentraciones, encontrándose que en concentraciones de IBA entre 1 y 3 mg/L inducen un porcentaje de enraizamiento del 100%. Igualmente Muñoz y Reyes (2006), indican una respuesta similar al anterior estudio es así ya que con 1,0 mg/L de IBA se obtienen plantas con mayor número de raíces y con 100% de plantas enraizadas.
Conclusiones
El empleo de microestacas con yema axilar es una eficiente metodología para iniciar un proceso de micropropagación (figura 3) en diferentes genotipos de R. glaucus Benth, facilitando la obtención de plántulas libres de contaminantes para las siguientes fases del proceso de micropropagación. Los mejores resultados observados para las fases de establecimiento y multiplicación de los ocho genotipos de R. glaucus Benth evaluados fueron M3 (6 benzilaminopurina 6BAP 2,0 mg/L, Acido giberélico GA3 1,0 mg/L) y M5 (6BAP 2,5 mg/L GA3 0,03 mg/L) respectivamente. Favoreciendo progresivamente la longitud, el desarrollo foliar y el número de brotes. La aplicación de ácido indolbutírico (IBA) 2,0 mg/L favorece el desarrollo radicular en los diferentes genotipos de R. glaucus Benth evaluados. Los ocho genotipos evaluados respondieron adecuadamente a la metodología desarrollada bajo este estudio lo cual la hace promisoria y apropiada para propagar masivamente estos materiales en la región de Pamplona y Chitagá (Norte de Santander, Colombia).
Agradecimientos
Los autores expresan sus agradecimientos a la Universidad de Pamplona, al Ministerio de Agricultura y Desarrollo Territorial (proyecto 2008L72264-7141), a las asociaciones de cultivadores de mora de Pamplona y Chitagá (Aspagro, Aprochit, Sanfrimora y Aspri).
Financiación
El presente trabajo fue financiado por el Ministerio de Agricultura y Desarrollo Territorial y la Universidad de Pamplona, en Alianza con las Asociaciones de Cultivadores de Mora de los municipios de Pamplona y Chitagá (Norte de Santander, Colombia. Proyecto: Caracterización molecular de especies de mora (Rubus sp.) cultivadas y multiplicación clonal de accesiones promisorias con características de alta productividad y tolerancia a enfermedades código 2008L72264-7141. 2009-2011.
Referencias
Bobrowski, V., Mello Farias, P., & Peters, J. (1996). Micropropagation of blackberries (Rubus sp.) cultivars. Revista Brasileira de Agrociencia, 2 (1), 17-20.
Broome, O., & Zimmerman, R. (1978). In vitro propagation of blackberry. Hort Science, 13,151-153.
Cancino Escalante, G., Sánchez-Montaño, L., Quevedo García, E., & Díaz Carvajal, C. (2011). Caracterización fenotípica de accesiones de especies de Rubus de los municipios de Pamplona y Chitagá, región nororiental de Colombia. Universitas Scientiarum, 16 (3), 219-233.
Cancino Escalante, G., Quevedo-García, E, Villamizar, C., Sánchez Montaño, L., & Díaz Carvajal, C. (2014). Selección de materiales promisorios de mora (R. glaucus Benth) en los municipios de Pamplona y Chitagá, región Nororiental de Colombia. Bistua, 12 (1), 93-114.
Castro, D., & Díaz, J. (2001). Alternativas para el manejo integrado del cultivo de la mora de Castilla (R. glaucus Benth). Medellín, Colombia. Universidad Católica de Oriente, Unidad de Biotecnología Vegetal.
Castro, D., Díaz, J., Montoya, J., & Ríos, D. (2006). Micropropagación de especies de interés hortícola y forestal en bioreactores de inmersion temporal . Revista Universidad Católica De Oriente, 1, 63 -71.
Clark, J., & Finn, Ch. (2011). Blackberry Breeding and Genetics. Recuperado de http://www.globalsciencebooks.info/JournalsSup/images/Sample/FVCSB_5%28SI1%2927-43o.pdf.
Cusba Mejia, M. (2011). Contribución al estudio de la huella genómica de genotipos élite de mora (R. glaucus Benth.) mediante marcadores SSRs. (Tesis de pregrado). Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia.
DANE, (Departamento Nacional de Estadística). (2013). El cultivo de la mora de Castilla (Rubus glucus Benth) frutal de clima frío moderado, con propiedades curativas para la salud humana. Recuperado en http://www.dane.gov.co/files/.../insumos_factores_de_produccion_nov_2013.pdf.
Donnelly, D., & Daubeny, H. (1986). Tissue culture of Rubus species. Acta Horticulturae,183,305-314.
Dytham, C. (2011). Choosing and Using Statistics. A Biologist's Guide. Oxford. Editorial: Willey-Blackwell.
González, M., López, M., Valdes, A., & Ordas, R. (2000). Micropropagation of three berry fruit species using nodal segments from field-grown plants. Annals of Applied Biology,137, 73-78.
Jennings, D. (1988). Raspberries and blackberries: their breeding, diseases and growth. London. Academic Press.
Marulanda, M., & Márquez, M. (2002). Evaluación de la estabilidad genética de vitroplantas de Rubus glaucus Benth mediante marcadores moleculares RAPD. Actualidades Biológicas, 24, 31-36.
McPheeters, K., Skirvin, R., & Hall, H. (1988). Brambles (Rubus spp.). Biotechnology in agriculture. London. Bajaj YPS.
Murashige, T., & Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia. Plantarum,15,437-497.
Muñoz, I., & Reyes, H. (2006). Efecto de reguladores de crecimiento, l-cisteína y ácido ascórbico en el cultivo in vitro de mora de castilla (R. glaucus Benth). (Tesis de pregrado). Universidad Nacional Agraria, Managua, Nicaragua. Recuperado de http://cenida.una.edu.ni/Tesis/tnf01m967.pdf.
Pedraza-Manrique, J. (2008). Aplicaciones del cultivo de tejidos vegetales en condiciones in vitro. Bogotá, Colombia. Universidad Distrital Francisco José de Caldas.
Seeram, N., Adams, L., Zhang, Y., Lee, R., Sand, D., Scheuller, H., & Heber, D. (2006). Blackberry, black raspberry, blueberry, cranberry red raspberry and strawberry extracts inhibit growth and stimulate apoptosis of human cancer cell in vitro. Journal of Agricultural and Food Chemistry,54, 9329-9339.
Sigarroa, A., & García, D. (2011). Establecimiento y multiplicación in vitro de mora de castilla (Rubus glaucus Benth.) variedad sin espinas, mediante ápices meristemáticos. Acta Agronómica, 60 (4): 347-354.
Sobczykiewicz, D. (1992). Micropropagation of raspberry (Rubus idaeus L.). En high-tech and micropropagation, (pp. 80-89). London: Bajaj YPS (ed.), Biotechnology in agriculture and forestry, II. Springer.
Tian, Y., Duan, X., & Wang, F. (2005). The effect of season on rapid propagation of raspberry. Journal of Xinjiang Agricultural University, 28, 18-21.
Valderrama, A., Álvarez, R., Barrero, L., Robayo, M., & Núñez, V. (2009). Validación y escalamiento de plántulas de mora in vitro y manejo ex vitro para entrega a agricultores de Silvania. En L. Barrero Meneses, Corpoica - Ministerio de Agricultura y Desarrollo Rural. (Ed.), Caracterización, evaluación y producción de material limpio de mora con alto valor agregado. Pp. 64 - 75. Bogotá.
Villa, F., Gomez, A., Salles, L., & Pascual, M. (2005). Multiplicação In vitro da amoreira-preta 'Ebano' em diferentes concentrações de meio MS e BAP. Ciência e Agrotecnologia, 29 (3), 582 - 589.
Wu, J., Miller, S., Hall, H., & Mooney, P. (2009). Factors affecting the efficiency of micropropagation from lateral buds and shoot tips of Rubus. Plant Cell Tissues and Organ Culture, 99, 17-25.
Zawadzka, M., & Orlikowska, T. (2006). Increase in the quality of raspberry cultures under the influence of FeEDDTA. Acta Horticulturae,725, 161-164.
Zimmerman, R. (1991). Micropropagation of temperate zone fruit and nut crops. En Micropropagation , Debergh PC, Zimmerman RH (Ed.), Kluwer. Pp. 231-246. The Netherlands.
Zimmerman, R., & Galletta, O. (1980). Propagation of thornless blackberies by one cuttings. Journal of American Society for Horticultural Science, 105(3), 405-407.
Referencias
Bobrowski, V., Mello Farias, P., & Peters, J. (1996). Micropropagation of blackberries (Rubus sp.) cultivars. Revista Brasileira de Agrociencia, 2 (1), 17–20.
Broome, O., & Zimmerman, R. (1978). In vitro propagation of blackberry. HortScience, 13,151–153.
Cancino Escalante, G., Sánchez-Montaño, L., Quevedo García, E., & Díaz Carvajal, C. (2011). Caracterización fenotípica de accesiones de especies de Rubus de los municipios de Pamplona y Chitagá, región nororiental de Colombia. Universitas Scientiarum, 16 (3), 219-233.
Cancino Escalante, G., Quevedo-García, E, Villamizar, C., Sánchez Montaño, L., & Díaz Carvajal, C. (2014). Selección de materiales promisorios de mora (R. glaucus Benth) en los municipios de Pamplona y Chitagá, región Nororiental de Colombia. Bistua, 12 (1), 93-114.
Castro, D., & Díaz, J. (2001). Alternativas para el manejo integrado del cultivo de la mora de Castilla (R. glaucus Benth). Medellín, Colombia. Universidad Católica de Oriente, Unidad de Biotecnología Vegetal.
Castro, D., Díaz, J., Montoya, J., & Ríos, D. (2006). Micropropagación de especies de interés hortícola y forestal en bioreactores de inmersion temporal . Revista Universidad Católica De Oriente, 1, 63 -71.
Clark, J., & Finn, Ch. (2011). Blackberry Breeding and Genetics. Recuperado de http://www.globalsciencebooks.info/JournalsSup/images/Sample/FVCSB_5%28SI1%2927-43o.pdf.
Cusba Mejia, M. (2011). Contribución al estudio de la huella genómica de genotipos élite de mora (R. glaucus Benth.) mediante marcadores SSRs. (Tesis de pregrado). Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia.
DANE, (Departamento Nacional de Estadística). (2013). El cultivo de la mora de Castilla (Rubus glucus Benth) frutal de clima frío moderado, con propiedades curativas para la salud humana. Recuperado en http://www.dane.gov.co/files/.../insumos_factores_de_produccion_nov_2013.pdf.
Donnelly, D., & Daubeny, H. (1986). Tissue culture of Rubus species. Acta Horticulturae, 183,305–314.
Dytham, C. (2011). Choosing and Using Statistics. A Biologist's Guide. Oxford. Editorial: Willey-Blackwell.
González, M., López, M., Valdes, A., & Ordas, R. (2000). Micropropagation of three berry fruit species using nodal segments from field-grown plants. Annals of Applied Biology, 137, 73–78.
Jennings, D. (1988). Raspberries and blackberries: their breeding, diseases and growth. London. Academic Press.
Marulanda, M., & Márquez, M. (2002). Evaluación de la estabilidad genética de vitroplantas de Rubus glaucus Benth mediante marcadores moleculares RAPD. Actualidades Biológicas, 24, 31-36.
McPheeters, K., Skirvin, R., & Hall, H. (1988). Brambles (Rubus spp.). Biotechnology in agriculture. London. Bajaj YPS.
Murashige, T., & Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia. Plantarum, 15,437–497.
Muñoz, I., & Reyes, H. (2006). Efecto de reguladores de crecimiento, l-cisteína y ácido ascórbico en el cultivo in vitro de mora de castilla (R. glaucus Benth). (Tesis de pregrado). Universidad Nacional Agraria, Managua, Nicaragua. Recuperado de http://cenida.una.edu.ni/Tesis/tnf01m967.pdf.
Pedraza-Manrique, J. (2008). Aplicaciones del cultivo de tejidos vegetales en condiciones in vitro. Bogotá, Colombia. Universidad Distrital Francisco José de Caldas.
Seeram, N., Adams, L., Zhang, Y., Lee, R., Sand, D., Scheuller, H., & Heber, D. (2006). Blackberry, black raspberry, blueberry, cranberry red raspberry and strawberry extracts inhibit growth and stimulate apoptosis of human cancer cell in vitro. Journal of Agricultural and Food Chemistry, 54, 9329–9339.
Sigarroa, A., & García, D. (2011). Establecimiento y multiplicación in vitro de mora de castilla (Rubus glaucus Benth.) variedad sin espinas, mediante ápices meristemáticos. Acta Agronómica, 60 (4): 347-354.
Sobczykiewicz, D. (1992). Micropropagation of raspberry (Rubus idaeus L.). En high-tech and micropropagation, (pp. 80-89). London: Bajaj YPS (ed.), Biotechnology in agriculture and forestry, II. Springer.
Tian, Y., Duan, X., & Wang, F. (2005). The effect of season on rapid propagation of raspberry. Journal of Xinjiang Agricultural University, 28, 18–21.
Valderrama, A., Álvarez, R., Barrero, L., Robayo, M., & Núñez, V. (2009). Validación y escalamiento de plántulas de mora in vitro y manejo ex vitro para entrega a agricultores de Silvania. En L. Barrero Meneses, Corpoica – Ministerio de Agricultura y Desarrollo Rural. (Ed.), Caracterización, evaluación y producción de material limpio de mora con alto valor agregado. Pp. 64 – 75. Bogotá.
Villa, F., Gomez, A., Salles, L., & Pascual, M. (2005). Multiplicação In vitro da amoreira-preta ‘Ebano’ em diferentes concentrações de meio MS e BAP. Ciência e Agrotecnologia, 29 (3), 582 - 589.
Wu, J., Miller, S., Hall, H., & Mooney, P. (2009). Factors affecting the efficiency of micropropagation from lateral buds and shoot tips of Rubus. Plant Cell Tissues and Organ Culture, 99, 17–25.
Zawadzka, M., & Orlikowska, T. (2006). Increase in the quality of raspberry cultures under the influence of FeEDDTA. Acta Horticulturae, 725, 161–164.
Zimmerman, R. (1991). Micropropagation of temperate zone fruit and nut crops. En Micropropagation , Debergh PC, Zimmerman RH (Ed.), Kluwer. Pp. 231–246. The Netherlands.
Zimmerman, R., & Galletta, O. (1980). Propagation of thornless blackberies by one cuttings. Journal of American Society for Horticultural Science, 105(3), 405-407.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Germán Franco, Jorge Alonso Bernal Estrada, Luz Adriana Váquez Gallo, Alegría Saldarriaga Cardona, Juan Camilo Henao Rojas, John Díaz Montaño, Ana Elizabeth Díaz Montilla, Germán Andrés Aguilera Arango, María Cristina García Muñoz, Jorge Humberto Argüelles Cárdenas, Mónica Betancourt Vásquez, Érika Patricia Sánchez Betancourt, Yimmy Alexander Zapata Narváez, Camilo Rubén Beltrán Acosta, Alba Marina Cotes Prado, Germán Alonso Antía Londoño, Carlos Eduardo Orrego Alzate, Natalia Salgado Alzate, Lady Joana Rodríguez, Yeimy Alejandra Rodríguez Restrepo, Álvaro de Jesús Tamayo Vélez, Cipriano Arturo Díaz Díez, Pablo Julián Tamayo Molano. (2020). Tecnología para el cultivo de la mora (Rubus glaucus Benth).. https://doi.org/10.21930/agrosavia.manual.7403251.
2. Edy Abril-Espin, Karime Montes-Escobar, Javier de la Hoz-M, Felipe R. Garcés-Fiallos, Carlos A. Salas-Macias. (2024). Exploring global trends in scientific research on Rubus glaucus Benth.: A comprehensive analysis integrating bibliometrics, LDA, and HJ-Biplot. Journal of Berry Research, 14(4), p.287. https://doi.org/10.1177/18785093241284955.
3. Kevin Brayan Murillo Borrero, Liliana Corozo-Quiñónez, Mateo León Durán, Fátima Macías Ponce, Miryan Pinoargote, Luis Alberto Saltos-Rezabala. (2024). A protocol for in vitro propagation of Morella pubescens: a protected species in the Tambillo community protected area—Ecuador. Plant Cell, Tissue and Organ Culture (PCTOC), 156(1) https://doi.org/10.1007/s11240-023-02643-y.
4. Fernando Ramírez. (2023). Latin American Blackberries Biology. , p.85. https://doi.org/10.1007/978-3-031-31750-7_5.
5. Yoiner K. Lapiz-Culqui, Jegnes Benjamín Meléndez-Mori, José Jesús Tejada-Alvarado, Denny Cortez, Eyner Huaman, Victor M. Núñez Zarantes, Manuel Oliva. (2024). Study of the physicochemical characteristics, antimicrobial activity, and in vitro multiplication of wild blackberry species from the Peruvian highlands. Scientific Reports, 14(1) https://doi.org/10.1038/s41598-024-54058-0.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2015 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).