Efecto del número de aplicaciones de cloprostenol sobre la regresión de cuerpos lúteos, el retorno al celo y la ovulación, después de un tratamiento superovulatorio en donantes de embriones bovinos
Keywords:
superovulación, prostaglandina, luteólisis, ciclo estral. (es)Downloads
EFECTO DEL NÚMERO DE APLICACIONES DE CLOPROSTENOL
SOBRE LA REGRESIÓN DE CUERPOS LÚTEOS, EL RETORNO AL CELO
Y LA OVULACIÓN, DESPUÉS DE UN TRATAMIENTO SUPEROVULATORIO
EN DONANTES DE EMBRIONES BOVINOS
THE EFFECT OF NUMBER OF CLOPROSTENOL APLICATIONS ON CORPUS
LUTEUM REGRESSION, RETURN TO ESTRUS AND OVULATION,
AFTER A SUPEROVULATORY TREATMENT IN BOVINE EMBRYO DONORS
C. Cabra,*1 J. V. Garzón 2, A. Tribulo3, R. Mapletoft 4, C. Jiménez 5, G. Bo6
1 Universidad Nacional de Colombia, Bogotá (Colombia).
2 Instituto Reproducción Animal de Córdoba, Córdoba (Argentina).
3 Instituto de Reproducción Animal de Córdoba, Córdoba (Argentina).
4 Universidad de Saskatchewan, Saskatoon (Canadá)
5 Universidad Nacional de Colombia, Bogotá (Colombia).
6 Instituto Reproducción Animal de Córdoba, Córdoba (Argentina).
*Autor para correspondencia: ccabrag@unal.edu.co
Artículo recibido: 2 de noviembre de 2010; aprobado: 9 de marzo de 2011
Resumen
El objetivo del presente trabajo fue evaluar la respuesta de la aplicación doble o triple de prostaglandina sobre la regresión de CL, ovulación y retorno al celo después de un tratamiento superovulatorio en vacas donantes de embriones. Para este experimento se tomaron 44 vacas asignadas al azar a dos grupos de tratamiento. Al primero (n = 23; CLO 0 & 7) se le aplicó una dosis de 500 μg de cloprostenol los días 0 (denominado día de la colecta) y 7; al segundo grupo (n = 21; CLO 0, 1 & 7) se le aplicó una inyección adicional el día 1. Los animales fueron examinados por ultrasonografía los días 0, 4, 7, 10 y 13 para evaluar la regresión de cuerpos lúteos y la ovulación. Se realizó observación del celo dos veces al día (mañana y tarde). El 60,8 y 52,3% de los grupos CLO 0 & 7 y CLO 0, 1 & 7, respectivamente, presentaron signos de celo. No se presentaron diferencias en el día del celo entre los grupos (7,2 ± 0,3, 7,3 ± 0,5 días). Tampoco hubo diferencia para la variable ovulación (8,5 ± 0,9 y 9,8± 0,9 días). Todas las vacas tratadas regresaron los cuerpos lúteos antes de finalizar el experimento. Cuando se analizó el tiempo de ovulación, se encontró que las vacas con 4 o menos cuerpos lúteos ovulan en un tiempo menor (P < 0,01) que las vacas con 5 o más cuerpos lúteos. Se concluye que no hay diferencia entre la doble o triple aplicación de cloprostenol para las variables. Sería innecesaria una aplicación adicional de cloprostenol el día 7.
Palabras clave: superovulación, prostaglandina, luteólisis, ciclo estral.
Abstract
The purpose of the present study was to evaluate the effect of prostaglandin (PG) treatment schedule on luteal regression and return to estrus in superovulated cows. A group of 44 donor cows were randomly assigned to two groups on the day of ova/ embryo collection (day 0). The first group (n = 23; CLO 0 & 7) was treated with 500 μg of cloprostenol on days 0 and 7 after embryo recovery; the second group (n = 21; CLO 0, 1 & 7) received an additional treatment with cloprostenol on day 1. All animals were scanned by transrectal ultrasonography on days 0 (embryo recovery), 4, 7, 10 and 13 to evaluate CL regression and subsequent ovulation. Estrus detection was done twice daily (am/pm) starting on day 4. There were no significant differences between groups in the percentage of animals returning to estrus (60.8% and 52.3%, respectively), or the intervals from the first PG treatment to estrus (7.2 ± 0.3 vs 7.3 ± 0.5 days), or ovulation (8.5 ± 0.9 vs 9.8± 0.9 days). All cows had luteolysis before the end of the experiment. Animals that had 4 CL or less ovulated earlier than cows that had 5 or more CL (P<0.01). In summary, there was no difference in luteal regression and the return to estrus and ovulation in donor cows treated with cloprostenol twice or three times after superovulation. It would not appear to be necessary to treat donors with PG 7 days later, since all cows had luteal regression after the first PG treatment.
Key words: superovulation, prostaglandins, luteolysis, oestrous cycle .
INTRODUCCIÓN
El objetivo de la superovulación (SPO) incluye inducir un gran número de ovulaciones y también una alta tasa de fertilización, junto con la presencia de un útero sano que proporcione el ambiente necesario para el desarrollo de los embriones.
La superovulación es la clave para la producción de embriones. La repetición de procesos de superovulación que arrojen buenos resultados depende de diferentes variables dentro de las cuales se encuentran: el tiempo en el que ocurre la regresión de los cuerpos lúteos (CL), la manifestación de signos de celo y la presentación de una nueva ovulación después de la colecta de embriones. El pronto regreso al celo después de una SPO es indispensable para realizar un nuevo tratamiento, y de esta manera optimizar la producción de embriones en un menor tiempo (Desaulniers et ál. 1990).
Durante varios años se pensó que las SPO sucesivas causaban una reducción progresiva en los tratamientos subsiguientes, pero hay evidencia de que no hay tal relación. Kafi y McGowan (1997) superovularon novillas mestizas entre cinco y diez veces, no se observó ninguna diferencia entre la recuperación de ovocitos-embriones y el porcentaje de embriones viables recuperados.
La expresión del celo en la vaca es un fenómeno en el que intervienen cambios endocrinos tales como el descenso de los niveles séricos de progesterona (luteólisis) y el aumento de los niveles de estradiol producido por el folículo preovulatorio. Además, dichos estrógenos actúan en el útero aumentando la masa del endometrio y del miometrio, generan contractibilidad uterina, incrementan el flujo sanguíneo y la acción inmunoprotectora en el tejido uterino (Bo et ál. 2008). Esto genera el retorno de un ambiente uterino favorable para la presencia de futuros embriones en un nuevo tratamiento superovulatorio.
En 1930 se descubrió una sustancia en el semen humano y en vesículas seminales de ovinos que causaba una contracción muscular lisa y aumento de la presión sanguínea. Esta sustancia fue llamada “prostaglandina” porque provenía de la próstata (Rathbone et ál. 2001). A pesar de que varias hormonas han demostrado capacidad luteolítica directa o indirectamente, la prostaglandina F2α (PGF2α) y sus análogos han demostrado que son los más efectivos para la inducción de la luteólis y la sincronización de celos (Beal 1996). Una inyección única intramuscular de PGF2α puede causar luteólisis en bovinos entre el día 5 y 21 del ciclo estral, y muestra su mayor efecto si es aplicada 12 días después del celo (Beal 1996). Después de una inyección de PGF2α en vacas con ciclos normales, las concentraciones de progesterona descienden rápidamente 6 horas después del tratamiento y 24 horas más tarde descienden a niveles menores a 1 ng/ml (Beal 1996). La presentación de los celos después de la aplicación de una dosis de PGF2α o cualquiera de sus análogos depende del estadio del ciclo estral y del tamaño y madurez del folículo dominante presente en el momento de realizar el tratamiento (Beal 1996; Bo et ál. 2007), siendo mejores las respuestas en animales entre los 10 y 15 días después del celo en comparación con los que están en el día cinco a nueve posteriores al estro (Rathbone et ál. 2001; Beal 1996).
Generalmente, el parámetro de los días de retorno al celo después de una SPO es mayor, debido al mayor número de CL presentes en el ovario, que además de ocupar espacio en este, producen progesterona, con lo cual se genera un proestro más prolongado de lo normal, debido a que el proceso de luteólisis no es tan rápido como en un ciclo normal, y también a que quizás haya un desarrollo folicular alterado (Lucy et ál. 1990).
Después de la administración de cloprostenol, se observó un incremento agudo en la liberación de PGF2α y de la prostaglandina E2 intraluteal, lo cual confirma que la producción de estas prostaglandinas está involucrada en la luteólisis completa. La administración de PGF2α induce la expresión de la ciclooxigenasa 2 (COX 2), lo cual estimula la liberación endógena adicional de prostaglandina proveniente de las células luteales grandes (Hayashi et ál. 2003). Las causas de fallas de las PGF2α en la luteólisis (10% de las vacas tratadas) no están claras, pero pueden relacionarse con: a) falta de respuesta de los CL; b) tratamiento demasiado pronto en la fase luteal; c) técnica incorrecta de inyección intramuscular, ya que si se aplica en grasa o en tejido ligamentoso no tiene igual efecto; d) corta vida media de la hormona exógena (Delgado et ál. 2009).
La PGF2α o sus análogos han sido usados para la inducción del celo en vacas después de la SPO, y en promedio entre 60 y 85% de las vacas muestran celo dentro de los 10 días siguientes al tratamiento. (Misra y Pant 2003; Halbert et ál. 1989).
Una vez que los múltiples CL regresan y las vacas ovulan (Mapletoft et ál. 1991), los patrones normales de ondas foliculares son reestablecidos y la SPO puede ser nuevamente realizada. El día de recolección de oocitos-embriones, las vacas reciben una inyección de PGF2α que a menudo se repite 10 y 15 días, o luego de los 7 días, si la donante no ha sido observada en celo (Bó et ál. 2007; Delgado et ál. 2009).
El objetivo del presente trabajo fue evaluar la respuesta de la aplicación doble o triple de prostaglandina sobre la regresión de CL, ovulación y retorno al celo después de una SPO en vacas donantes de embriones, con el fin de evaluar si la rapidez en el retorno al celo posterior a procesos superovulatorios puede acelerar, y mejorar la respuesta de los embriones colectados en superovulaciones sucesivas (intervalos de veintiocho días entre colectas).
MATERIALES Y MÉTODOS
Animales y localización:
Se utilizaron 44 vacas de las razas Aberdeen Angus (n = 30), Brangus (n = 11) y Simmental (n = 3), donantes de embriones, con una condición corporal entre 3,0 a 4,5 (escala 1 a 5), mantenidas en condiciones de manejo y sanidad óptimas. El experimento fue realizado entre las estaciones de verano y otoño (febrero, marzo y abril) del hemisferio sur (Irac-Biogen, Córdoba, Argentina).
Grupos experimentales:
Se realizaron bloques experimentales dependiendo de la cantidad de CL (1-2, 3-4, 5-10, 11-15 y > 15) el día de la colecta y posteriormente divididas en dos grupos tratados al azar. Los tratamientos consistieron en la aplicación intramuscular profunda de 500 μg de cloprostenol (Ciclase®, Syntex, Argentina) los días 0 y 7 (CLO 0 & 7), y al otro grupo la aplicación de la misma dosis los días 0, 1 y 7 (CLO 0, 1 & 7).
Se realizaron ultrasonografías (Falco100, Pie Medical®, Holanda, equipado con un transductor lineal de 7,5 MHz) transrectales los días 0 (aquel en que se realiza la colecta de embriones), 4, 7, 10 y 13 en donde se siguieron los diámetros de los CL y su tiempo de regresión (tomando la regresión cuando cada CL presentaba diámetros menores a los 10 mm), la ovulación (desaparición del folículo más grande) y la aparición de un nuevo CL. Se determinó el porcentaje de vacas con un CL nuevo el día 13. Se observaron celos 2 veces (mañana y tarde) por día a partir del día 4 del tratamiento.
Los datos fueron analizados por el método de análisis de varianza (Anava). Se tomaron como variables: tiempo de regresión de CL, días de presentación de celo y días de ovulación. Se realizó una regresión lineal modelada con polinomio grado 2 para relacionar el número de CL (1-2, 3-4, 5-10, 11-15 y > 15) y su efecto sobre la ovulación. Para el cálculo de estos valores se utilizó el programa InfoStat (Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba, Argentina). Se descartaron del análisis estadístico 5 animales, el primero por no haber tenido ningún CL en el momento de la colecta y los otros 4 por tener temperamento nervioso y haber presentado folículos pequeños sin CL el día 13.
RESULTADOS
La totalidad de los CL de las vacas tratadas (n = 44) hicieron luteólisis antes de finalizar el experimento. Al analizar el momento de regresión de los CL en las vacas tratadas, se observó que para el grupo CLO 0 & 7 el tiempo fue de 5,4 ± 0,5 días y para el grupo CLO 0, 1 & 7 de 5,3 ± 0,3 días por lo que no se observó diferencia estadística (p = 0,80).
Durante el experimento, el 60,8% (n = 14) de los animales del grupo CLO 0 & 7 y 52,3% (n = 11) del grupo CLO 0, 1 & 7 presentaron celo. El día de presentación de celo en el primer grupo fue de 7,2 ± 0,3 días y de 7,3 ± 0,5 para el segundo grupo. No se encontró diferencia significativa (p = 0,38) para esta variable. De igual manera, no se encontró diferencia significativa (p = 0,30) en la variable ovulación (69,5 y 66,6%), en donde el tiempo fue de 8,5 ± 0,9 y 9,8 ± 0,9 días para los grupos CLO 0 & 7 y CLO 0, 1 & 7, respectivamente (tabla 1). El 60% de los animales mantuvieron un nuevo CL visible al chequeo ultrasonográfico el día 13 para los dos grupos evaluados, en donde no se muestra ninguna diferencia entre estos (p = 0,97).
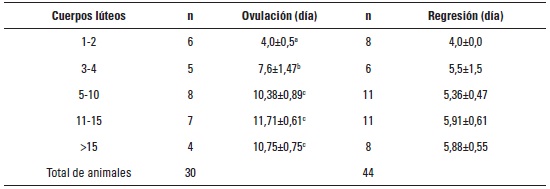
Cuando se analizó el tiempo de ovulación de los animales tratados según la cantidad de CL el día de la colecta, se encontró diferencia significativa (p < 0,0001) entre las vacas con 1-2 CL, 3-4 CL y las de más de 5 CL. Las de menor cantidad (1-2) de CL ovularon en un menor tiempo (tabla 2).
Tabla 1. Comparación entre los tratamientos de prostaglandina sobre el día de regresión de los
cuerpos lúteos (CL), el día de presentación de celo, y el tiempo de ovulación.
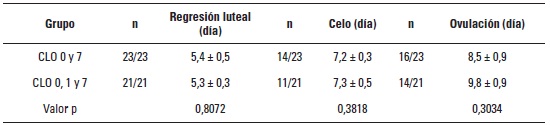
Tabla 2. Día de regresión luteal y de ovulación en vacas según la cantidad de cuerpos lúteos (CL)
en la colecta
Esto es explicado por la curva cuadrática (figura 1). De la misma curva se generó la fórmula para el cálculo del día de ovulación a partir de la cantidad de CL:
Día de Ovulación = CL(1,02)+[(-0,03) (CL)]+4,18
DISCUSIÓN
Al analizar los datos del experimento no se encontraron diferencias significativas para ninguna de las variables analizadas (regresión luteal, día de presentación de celo y ovulación) entre los dos tratamientos.
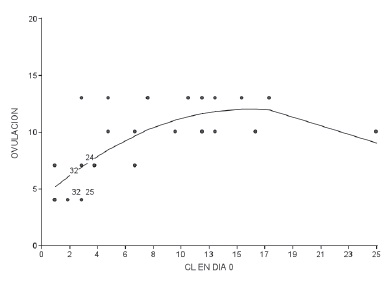
Figura 1: Curva cuadrática para retorno a la
ovulación de vacas superovuladas, posterior a
la aplicación de PGF2α y cantidad de cuerpos
lúteos (CL) al día 0 del tratamiento.
La media de presentación de celo fue de 7,2±0,3 y 7,3±0,5 días para el tratamiento CLO 0 & 7 y CLO 0, 1 & 7, respectivamente, lo que difiere del resultado encontrado por Halbert et ál. (1989), quienes mencionan la aparición de signos de celo entre los días 10 y 18, pero no diferentes a los encontrados por Mapletoft et ál. (1991) y Desaulniers et ál. (1990), quienes lo reportaron entre 7,2 y 7,6 días, respectivamente, después del tratamiento realizado con PGF2α a vacas superovuladas.
Con respecto a la presentación de signos de celo, los resultados del presente estudio fueron similares (52,3-60,8%) a los presentados por Mapletoft et ál. (1991), quienes observaron entre 56 y 88% y a los de Desaulniers et ál. (1990), quienes lo hicieron entre 60 y 65%. La baja presentación de celos (en donde un número mayor de vacas ovularon con respecto a las vacas que presentaron signos de celo) puede ser explicada porque las vacas con estrés calórico (el experimento se realizó en las estaciones de verano e inicios de otoño en donde las altas temperaturas fueron características) alteran el crecimiento folicular ovárico y su dominancia durante el periodo preovulatorio, lo que genera una función anormal ovárica manifestada por una disminución del pico de estradiol en el proestro (Wilson et ál. 1998).
Cuando se analizaron las vacas que no presentaron celo y no ovularon se encontró que 2/9 y 4/10 vacas en el tratamiento CLO 0 & 7 y CLO 0, 1 & 7, respectivamente, tuvieron al final del experimento (día 13) un folículo mayor o igual a 10 mm, posiblemente dominante, en donde se podría generar una ovulación con la formación de un nuevo CL días después de la evaluación. Debido a esto, se sugeriría esperar unos días adicionales para la recuperación de la dinámica folicular fisiológica, ya que los 13 días esperados serían pocos para esta restauración.
El tiempo transcurrido para la regresión luteal (entendida como el momento cuando un CL tiene un diámetro menor a 10 mm visible a la ultrasonografía transrectal) fue 5,4±0,5 y 5,3±0,3 días para los tratamientos CLO 0 & 7 y CLO 0,1 & 7, respectivamente, por lo cual se encontraron diferencias con el trabajo publicado por Mapletoft et ál. (1991), quienes reportan tiempos entre 3,1 y 3,6 días. La diferencia en este parámetro puede deberse a que en el trabajo publicado por Mapletoft et ál (1991), la regresión luteal se determinó cuando las concentraciones de progesterona descendieron a niveles menores que 1 ng/ml, por lo que de alguna manera, algunos de los CL observados en nuestro trabajo pudieron haber sido afuncionales. Kastelic et ál. (1990) mencionan que el tejido luteal se incrementa de la misma manera que las concentraciones de progesterona durante el crecimiento luteal (días 2, 5 y 8), pero durante la regresión luteal el tejido regresa más despacio que las concentraciones de progesterona sanguíneas (Kastelic et ál. 1990). Sin embargo, los niveles de progesterona fueron menores a 1 ng/ml cuando el CL era menor a 10 mm de diámetro (Kastelic et ál. 1990). Teniendo en cuenta que en la regresión luteal, la media resultante fue entre los días 5,4 y 5,6, la aplicación de una prostaglandina el día 7 después de la colecta de embriones parecería innecesaria; por esta razón, sería fundamental realizar estudios adicionales complementarios con una aplicación doble (días 0 y 1) y una sencilla (día 0) para evaluar la verdadera necesidad de una segunda aplicación de cloprostenol sobre las variables evaluadas.
En el momento en que se analizaron los datos agrupados por la cantidad de CL el día de la colecta de embriones, se demuestra que existe diferencia significativa entre las respuestas para la variable ovulación, en donde las vacas con hasta 4 CL ovulan en un tiempo menor que las vacas con más de 5 CL. Esta diferencia puede deberse a que el tiempo para restablecer valores reproductivos hormonales en las vacas con más de 4 CL es mayor que en vacas con menores cantidades de los mismos.
Si se administra una dosis de prostaglandina en vacas de ciclos normales el día 8 del ciclo (día 0, celo), las vacas entrarán en promedio en celo entre 48 y 72 h y ovularán el cuarto día en promedio. Si el folículo dominante en el momento de la inyección, se encuentra en la fase estática tardía o de regresión, el folículo dominante de la próxima onda será el ovulatorio y el animal entrará en celo y ovulará entre 5 y 7 días después (Bo et ál. 2007). En nuestro caso, la ovulación se dio en promedio en 8,5±0,9 y 9,8±0,9 días para CLO 0 & 7 y CLO 0, 1 & 7, respectivamente, lo cual evidencia que el ciclo estral de vacas que fueron superovuladas está alterado. Las vacas con 1-2 CL se comportaron de manera similar a vacas con ciclos normales, ya que fueron las que ovularon en 4,0±0,5 días. Mientras que las del grupo de 3-4 CL ovularon a los 7,6±1,5 días. Los tiempos de respuesta al tratamiento se ven afectados y aumentados ante una presencia de más de 4 CL, posiblemente debido a que algunos CL tardan más en regresar, a la dinámica folicular que esté presente en el ovario, ya que aparentemente existe una asociación negativa entre los múltiples CL y los folículos.
A pesar de que todos los CL regresan en las vacas tratadas, es claro que se necesita de un tiempo determinado para que la dinámica folicular se restablezca, y que de nuevo se genere un folículo preovulatorio, un aumento de estradiol sanguíneo, un pico de LH y una nueva ovulación. Dos estudios realizados en 1990 (Desaulniers et ál. 1990; Lucy et ál. 1990) sugieren que altas concentraciones de progesterona pueden generar una retroalimentación negativa sobre la secreción de FSH y el posterior desarrollo folicular, debido a que en vacas con respuestas superovulatorias buenas (mayor a un embrión colectado) 1 o 2 días después de que la progesterona sanguínea empieza a descender (días 11-12 después de la colecta) se observa el aumento de la cantidad de folículos menores a 5 mm de diámetro (Lucy et ál. 1990). Trabajos posteriores también plantean que la progesterona tiene una relación dosis-dependiente sobre el crecimiento del folículo dominante (Adams et ál. 1992), pero que esta relación está más relacionada con el efecto inhibitorio de la progesterona sobre la pulstalidad de la LH y consecuentemente sobre la selección, dominancia y crecimiento final del folículo dominante ovulatorio (Kulick et ál. 1999; Stock y Fortune 1993). Sin embargo, es posible en el caso de vacas superovuladas que, al ser los niveles de progesterona mayores a los niveles normales de la fase luteal, la supresión de la progestereona sobre la liberación de la GnRH se exprese en una disminución tanto de LH como de FSH.
CONCLUSIÓN
Se concluye que no hay diferencia entre dos o tres aplicaciones de cloprostenol para las variables estudiadas (regresión de CL, presentación de celo y ovulación). Existe diferencia en cuanto a menor tiempo de ovulación en vacas con 4 o menos CL en comparación con las de 5 o más. Teniendo en cuenta que la regresión luteal se dio en promedio entre los días 5,4 y 5,6, la aplicación de una prostaglandina el día 7 después de la colecta de embriones podría ser innecesaria. Por último, sería necesario esperar un tiempo mayor a 13 días para aplicar un nuevo tratamiento superovulatorio.
AGRADECIMIENTOS
Al Instituto de Reproducción Animal de Córdoba en Argentina por el apoyo a la realización del presente trabajo, y a la Línea de Profundización en Reproducción Animal de la Universidad Nacional de Colombia por todos los conocimientos teórico-prácticos ofrecidos.
REFERENCIAS
1. Adams GP, Matteri RL, Ginther OJ. 1992. The effect of progesterone on growth of ovarian follicles, emergence of follicular waves and circulating FSH in heifers. J Reprod Fertil. 95: 627-640.
2. Beal WE. 1996. Application of knowledge about corpus luteum function in control of estrus and ovulation in cattle. Theriogenology. 45: 1399-1411.
3. Bo GA, Cutaia L, Moreno D, Tribulo HE. 2007. Sincronización de celos e inseminación artificial. 1a ed. Córdoba, Argentina.
4. Bo GA, Cutaia L, Moreno D, Tríbulo HE, Carcedo J, Armonia A, Martínez M, Baruselli P. 2008. Fisiología de la reproducción de la vaca. 1a ed. Córdoba, Argentina.
5. Delgado LA, Amagua JI, Guzmán F. 2009. Efecto de la dosis de prostaglandina sobre el regreso de los cuerpos luteos y el retorno al celo en vacas donantes de embriones. Córdoba: Instituto de Reproducción Animal de Córdoba.
6. Desaulniers DM, Guay P, Vaillancourt D. 1990. Estrus induction with prostaglandin F2α, cloprostenol or fenprostalene during the normal estrous cycle, superovulation and after embryo collection. Theriogenology. 34: 667-682.
7. Halbert GW, Leslie KE, Walton JS, Betteridge KJ. 1989. Evaluation of return to estrus in superovulated dairy heifers following prostaglandin treatment. Theriogenology. 31: 201.
8. Hayashi K, Acosta JT, Berisha B, Kobayashi S, Ohtani M, Schams D, et ál. 2003. Changes in prostaglandin secretion by the regressing bovine corpus luteum. Prostag Oth Lipid M. 70: 339-349.
9. Kafi M, McGowan MR. 1997. Factors associated with variation in the superovulatory response of cattle. Anim Reprod Sci. 48: 137- 157.
10. Kastelic JP, Bergfelt DR, Ginther OJ. 1990. Relationship between ultrasonic assessment of the corpus luteum and plasma progesterone concentration in heifers. Theriogenology. 33: 1269-1278.
11. Kulick LJ, Kot K, Wiltbank MC, Ginther OJ. 1999. Follicular and hormonal dynamics during the first follicular wave in heifers. Theriogenology. 52: 913-921.
12. Lucy MC, Macmillan KL, Thatcher WW, Drost M, Tan HS. 1990. Effect of timing of prostaglandin PGF2α injection subsequent to embryo collection on the resumption of normal follicular development following superovulatory treatment in cattle. Theriogenology. 34: 7-19.
13. Mapletoft RJ, Bo GA, Willmott N, Pierson RA. 1991. The effect of dose of cloprostenol on return to estrus of superovulated donor cows. Theriogenology. 35: 237.
14. Misra AK, Pant HC. 2003. Estrus induction following PGF2a treatment in the superovulated buffalo (Bubalus bubalis). Theriogenology. 59: 1203-1207.
15. Rathbone MJ, Kinder JE, Fike K, Kojima F, Clopton D, Ogle CR, Bunt CR. 2001. Recent advances in bovine reproductive endocrinology and physiology and their impact on drug delivery system design for the control of the estrous cycle in cattle. Adv Drug Deliver Rev. 50: 277-320.
16. Savio JD, Keenan L, Boland MP, Roche JF. 1988. Pattern of growth of dominant follicles during the oestrus cycle of heifers. J Reprod Fertil. 83: 663-671.
17. Stock AE, Fortune JE. 1993. Ovarian follicular dominance in cattle: relationship between prolonged growth of the ovulatory follicle and endocrine parameters. Endocrinology. 132: 1108-1114.
18. Wilson SJ, Marion RS, Spain JN, Spiers DE, Keisler DH, Lucy MC. 1998. Effects of controlled heat stress on ovarian function of dairy cattle. 1. Lactating cows. J Dairy Sci.81: 2124-2131.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Copyright (c) 2011 C. Cabra, J. V. Garzón, A. Tribulo, R. Mapletoft, C. Jiménez, G. Bo

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
This article is published under the terms of the Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
The authors retain copyright of their work and grant the journal the right of first publication.
Readers are free to copy and redistribute the material in any medium or format under the license terms, provided proper attribution is given, the work is not used for commercial purposes, and no modifications or derivatives are made.
















