Susceptibilidad antimicrobiana de aislamientos de Salmonella enterica provenientes de pisos, equipos, utensilios y producto terminado en el beneficio porcino en Colombia
DOI:
https://doi.org/10.15446/rfmvz.v63n1.56903Keywords:
Salmonella spp., beneficio porcino, inocuidad, resistencia antimicrobiana. (es)Downloads
La diseminación de aislamientos de Salmonella spp resistentes a antimicrobianos, a través de las cadenas productivas de alimentos de origen animal, es una preocupación de salud pública de carácter mundial. Éste estudio describe los patrones de resistencia antimicrobiana de 283 aislamientos de Salmonella enterica procedentes de plantas de beneficio porcino en Colombia. Se evaluó la susceptibilidad antimicrobiana frente a diez antimicrobianos: amoxacilina-ácido clavulánico (30 ug), ampicilina(10 ug), ceftiofur (30 ug), ciprofloxacina (5 ug), cloranfenicol (30 ug), florfenicol (30 ug), gentamicina (10 ug), sulfadiazina/trimetroprim (25 ug), tetraciclina (30 ug) y tilmicosina (15 ug) mediante el método de difusión en disco (Bauer & Kirby, 1966). Los resultados evidenciaron la presencia de 279 aislamientos multiresistentes de Salmonella enterica de origen porcino provenientes del ambiente y producto terminado de las plantas de beneficio evaluadas (46.64% n: 132). Se detectaron 52 patrones de multiresistencia, el más común fue ceftiofur-tetraciclina-tilmicosina en el 9,89% (n: 28) de los aislamientos. Con referencia a éstos antimicrobianos el 96,82% (n: 274) de los aislamientos fueron resistentes a tetraciclina, 73,14% (n: 207) a tilmicosina y 28,27% (n: 80) a ceftiofur. De especial interés fue la alta proporción de aislamientos resistentes a éste último, debido a una posible resistencia cruzada con ceftriaxona. Los resultados obtenidos demuestran la necesidad de promover y fortalecer un Programa oficial de Vigilancia de la Resistencia Antimicrobiana y sistemas de monitoreo voluntario en cada eslabón de las cadenas productivas, para contribuir a la prevención y control de la transmisión de microorganismos resistentes de origen alimentario en el marco del sistema de gestión de inocuidad alimentaria en Colombia.
SUSCEPTIBILIDAD ANTIMICROBIANA DE AISLAMIENTOS DE Salmonella entérica PROVENIENTES DE PISOS, EQUIPOS, UTENSILIOS Y PRODUCTO TERMINADO EN PLANTAS DE BENEFICIO PORCINO EN COLOMBIA
ANTIMICROBIAL SUSCEPTIBILITY OF Salmonella enterica STRAINS ISOLATED FROM FLOORS, EQUIPMENT, MACHINERY, AND FINISHED PRODUCT IN PORCINE SLAUGHTERHOUSES IN COLOMBIA
P. M. Bermúdez1, S. L. Pulecio1, M. C. SuárezI*
1 Grupo Genética Molecular de Patógenos Gempa, Laboratorio de Microbiología,
Departamento de Ciencias para la Salud Animal, Facultad de Medicina Veterinaria
y de Zootecnia,
Universidad Nacional de Colombia - sede Bogotá. Cr. 30 nro.
45-03, Bogotá (Colombia).
*Autor para correspondencia: mcsuarezal@unal.edu.co
Artículo recibido: 8 de enero de 20I5 · Aprobado: 27 de julio de 20I5
RESUMEN
La diseminación de Salmonella spp. resistente a antimicrobianos en las cadenas productivas de alimentos de origen animal es una preocupación de salud pública de carácter mundial. Este estudio describe los patrones de resistencia antimicrobiana de 283 aislamientos de Salmonella enterica procedentes de plantas de beneficio porcino en Colombia. Se evaluó la susceptibilidad antimicrobiana frente a diez antimicrobianos mediante el método de difusión en disco: amoxacilina-ácido clavulánico (30 ug), ampicilina (10 ug), ceftiofur (30 ug), ciprofloxacina (5 ug), cloranfenicol (30 ug), florfenicol (30 ug), gentamicina (10 ug), sulfadiazina/trimetroprim (25 ug), tetraciclina (30 ug) y tilmicosina (15 ug). Los resultados evidenciaron la presencia de 279 aislamientos multirresistentes de Salmonella enterica de origen porcino provenientes del ambiente y del producto terminado en las plantas de beneficio evaluadas (46,64% n: 132). Se detectaron 52 patrones de multiresistencia: el más común fue ceftiofur-tetraciclina-tilmicosina en el 9,89% (n: 28) de los aislamientos. Con referencia a estos antimicrobianos, 96,82% (n: 274) de los aislamientos fueron resistentes a tetraciclina, 73,14% (n: 207) a tilmicosina y 28,27% (n: 80) a ceftiofur. De especial interés fue la alta proporción de aislamientos resistentes a ceftiofur, debido a una posible resistencia cruzada con ceftriaxona. Los resultados obtenidos demuestran la necesidad de promover el diseño e implementación de un Programa oficial Integrado de Vigilancia de la Resistencia Antimicrobiana, además de sistemas de monitoreo voluntario en cada eslabón de la cadena productiva porcina, para contribuir a la prevención y control de la transmisión de microorganismos resistentes de origen alimentario en el marco del sistema de gestión de inocuidad alimentaria en Colombia.
Palabras clave: Salmonella spp., beneficio porcino, inocuidad, resistencia antimicrobiana.
ABSTRACT
The development and spread of antimicrobial multidrug resistance_of Salmonella spp. from food chain is a public health concern global. This study aimed to describe the antimicrobial resistance patterns of 283 isolates of Salmonella enterica from pork slaughterhouse in Colombia. Antimicrobial susceptibility on ten antimicrobials was evaluated: amoxicillin - clavulanic acid (30 ug), ampicillin (10 ug), ceftiofur (30 ug), ciprofloxacin (5 ug), chloramphenicol (30 ug), florfenicol (30 ug), gentamicin (10 ug), sulfadiazine/trimethoprim (25 ug), tetracycline (30 ug) and tilmicosin (15 ug) using the disc diffusion method. The results showed the high presence of isolates multidrug resistant of Salmonella enterica widespread on environmental of slaughterhouse (46.64% n: 132). 52 multidrug resistance patterns were detected. The most common was ceftiofur - tetracycline - tilmicosin in 9.89% (n = 28) of isolates. These same three antimicrobials were less effective with 96.82 % (n = 274) resistant-isolates against tetracycline, 73.14 % (n = 207) against tilmicosin and 28.27 % (n = 80) against ceftiofur. Of particular concern was the high rate of resistance to ceftiofur due to its cross-resistance to ceftriaxone. The results demonstrate the need to promote and strengthen an official Integrated Program for Antimicrobial Resistance Surveillance and volunteer monitoring systems in each link of the porcine production chain, to contribute to the prevention and control of food-borne infections in the context of safety management system in Colombia.
Key words: Salmonella spp., pork slaughter, food safety, antimicrobial resistance.
INTRODUCCIÓN
Se ha estimado que los patógenos transmitidos por alimentos son responsables de 47,8 millones de casos de enfermedad en humanos, 128.000 hospitalizaciones y 3.000 muertes cada año en los Estados Unidos (CDC 2011; Baer et al. 2013). La salmonelosis no tifoidea ha sido reconocida como de una de las zoonosis más importantes y como la primera Enfermedad Transmitida por Alimento (ETA) causante de hospitalización (35%) o muerte (28%), así como la segunda ETA más adquirida (11%) (CDC 2011). En 2011 se estimó la ocurrencia de 1.027.561 casos de enfermedad, 19.336 hospitalizaciones y 378 muertes por salmonelosis no tifoideas que correpondieron a cerca del 11% de todas las ETAs en EE.UU. (Baer et al. 2013; CDC 2011). En Colombia, el estudio de Durango et al. halló en el 2004 una prevalencia de Salmonella spp. del 5,2% (n:6/N:115) en carne de cerdo correspondiente a aislamientos en la Costa Altántica (Durango et al. 2004).
La presencia de este patógeno ha sido descrita en el cerdo y en las producciones porcícolas (Baer et al. 2013; Wilkins et al. 2010). En Colombia, se ha reportado una prevalencia de 12,79% (n:11 / N:86) de Salmonella spp. aislada a partir del ambiente de plantas de beneficio y expendios en el departamento de Tolima (Arcos et al. 2013). Pese a que los casos de ETA no han sido asociados frecuentemente con el consumo de carne de cerdo, que es una de las más demandadas en todo el mundo y de ella derivan gran variedad de subproductos (Baer et al. 2013; Duggan et al. 2010). Adicionalmente, en EE.UU, entre el 6 y el 9% de los brotes causados por Salmonella spp. se ha reportado como ETA y del 15 al 20% de los brotes en Dinamarca, previamente al inicio del exhaustivo programa de control de Salmonella spp. en granjas y plantas de beneficio. Además, los cerdos son el principal reservorio de aislamientos de Salmonella Typhimurium multirresistentes y pertenecientes a fagotipos epidémicos, particularmente vinculados con brotes en humanos y que en el cerdo pueden causar infección subclínica (Sisák et al. 2004). Por tanto, la carne de cerdo se reconoce como fuente potencial de este patógeno causante de ETA (Baer et al. 2013).
En países en vía de desarrollo la sal-monelosis por consumo de alimentos de origen animal, como la carne de cerdo, es de especial interés debido al control menos especializado en las producciones primarias (animales vivos), transporte, tiempos de espera prebeneficio y plantas de beneficio (Bahnson et al. 2006). Por consiguiente, su control en el marco de la seguridad alimentaria, es un propósito definido bajo el concepto ”de la granja a la mesa".
Partiendo de dicho propósito, es necesario monitorear la presencia de Salmonella spp. en cada etapa de la cadena productiva. Especialmente, el ingreso a las plantas de beneficio de cerdos portadores asintomáticos de Salmonella spp., se considera la mayor fuente de contaminación de canales (Bahnson et al. 2006), aunque la contaminación puede ocurrir en cualquiera de las etapas del beneficio porcino. El microorganismo puede diseminarse a través de heces, tejido intestinal o ganglios linfáticos principalmente, contaminando canales, equipos y utensilios, lo cual posteriormente da origen a contaminación cruzada de otras canales; dicha contaminación ocurre usualmente durante las etapas de depilado o evisceración (Baer et al. 2013; Schmidt et al. 2012; Bahnson et al. 2006). Algunos estudios han informado sobre variaciones de la prevalencia del patógeno durante fases del proceso: Schmidt et al. (2012) reportaron una prevalencia del 91% en canales pre-escaldado, de 19% en canales pre-eviscerado y alrededor de 3,7% posterior al enjuague y refrigeración final, en aquellos casos en los que el proceso es asumido con rigor (Baer et al. 2013; Schmidt et al. 2012). Por lo tanto, en la medida que ingresen animales portadores de Salmonella spp. a la planta de beneficio, o que las canales puedan contaminarse durante el proceso, también existirá un mayor potencial de transmisión del microorganismo a los consumidores (Berends et al. 1996; Berends et al. 1997) aún si el proceso es realizado adecuadamente (Olsen et al. 2001). En consecuencia, el monitoreo de Salmonella spp. en plantas de beneficio porcino contribuye al entendimiento de la dinámica del microorganismo en las etapas de prebeneficio, beneficio y posbeneficio, y suministra información valiosa para su posterior prevención.
Adicionalmente al riesgo inherente que Salmonella spp. representa para la salud pública como ETA, la emergencia del fenómeno de multirresistencia antimicrobiana (Foley y Lynne 2008; Varma et al. 2005) y su potencial dispersión a través de las cadenas productivas, ha sido confirmada y asociada al consumo de carnes de pollo, pavo, res y cerdo (Berends et al. 1998; Sisáket al. 2004; Wedel et al. 2005; IFT 2006). El amplio uso de antimicrobianos en producciones pecuarias (en planes terapéuticos, profilácticos, metafilácticos y en la alimentación), en piscicultura, agricultura, manufactura de alimentos y medicina humana (uso en comunidad y hospitalario), ejerce una presión selectiva que favorece la resistencia (IFT 2006; Sisák et al. 2004; Varma et al. 2005). Por lo tanto, su uso injustificado, excesivo, en concentración, tiempos y dosificación menor a la prescrita, o cómo promotores de crecimiento, son rutinas que impactan fuertemente la selección de patógenos resistentes (FDA 2012) y socavan la eficacia de la terapéutica antimicrobiana, lo cual representa una amenaza para la salud humana y animal.
El monitoreo de Salmonella spp. en las plantas de beneficio permite estimar el riesgo potencial de contaminación cruzada durante el proceso (canal-canal; equipo-canal-equipo) (Lomonaco et al. 2009), así como la presencia y posible transmisión de patógenos resistentes a través de la cadena productiva (Rosengren et al. 2008). Dicho monitoreo puede realizarse a partir de los contenidos rectal y cecal, ganglios linfáticos y el medio ambiente (pisos, depiladora, cuchillos) (Berends 1997).
El objetivo principal de este estudio fue describir los perfiles de resistencia antimicrobiana de aislamientos de Salmonella spp., de origen ambiental y de producto terminado (canales), en plantas de beneficio de zonas de alta producción porcícola en Colombia.
MATERIALES Y MÉTODOS
Para el presente estudio de tipo descriptivo experimental, se utilizaron 283 aislamientos del repositorio del laboratorio de Microbiología Veterinaria de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, sede Bogotá, provenientes de cuatro plantas de beneficio porcino de zonas de alta producción porcí-cola en Colombia, previamente obtenidos a partir de restos de procesamiento de la depiladora, cuchillos para la apertura torácica y abdominal, separación del recto y evisceración, piso e interior y exterior de la canal, durante el periodo comprendido entre marzo y agosto del año 2011.
Obtención de muestras
Pisos. Para la obtención de las muestras de piso, el personal encargado de muestrear realizó una limpieza, desinfección a profundidad y secado de las botas de goma de uso obligatorio en las plantas de beneficio, las cuales fueron recubiertas con doble juego de polainas quirúrgicas desechables; se procedió a caminar ida y regreso en la zona intermedia de la planta de beneficio (área de flujo de personal posterior al área del depilado y antes de la etapa de eviscerado). Finalmente, las polainas externas se empacaron cuidadosamente en bolsas estériles, para su posterior procesamiento en el laboratorio.
Equipos y utensilios. Se obtuvieron especímenes procedentes de la máquina depiladora, así como de los cuchillos para apertura torácica y abdominal, y para separación de recto y eviscerado. Las muestras fueron obtenidas mediante fricción con esponja previamente humedecida en agua peptonada siguiendo los lineamientos descritos en la norma ISO 17604: 2003. En la máquina depiladora (D) se tomaron muestras de la superficie del equipo (uñas del equipo, cortinas, barras o mesón donde cae el cerdo posterior al depilado), y adicionalmente se recogieron 25 g de los residuos (pelos y porciones de piel) producidos en la etapa intermedia y al final del proceso. En los cuchillos de apertura torácica y abdominal (C1), separación del recto (C2) y eviscerado (C3), las muestras se obtuvieron en cuatro momentos diferentes durante todo el proceso.
Producto terminado. La toma de muestras en exterior e interior de la canal se realizó según los lineamientos de la norma ISO 17604, en el área de oreo o en el cuarto frío, según la planta de beneficio. Las muestras de canal externa fueron recuperadas mediante fricción vertical sobre la canal, desde el jamón hasta la línea media de abdomen (ventral) y desde el tórax hasta los carrillos. La fricción sobre la canal interna se realizó sobre las cavidades pélvica, abdominal y torácica.
Todas las muestras fueron empacadas en bolsas estériles(Nasco®). Posteriormente, según el tipo de muestra, cada bolsa fue empacada en otra más grande y transportada en refrigeración hasta el laboratorio donde fueron procesadas.
Aislamiento e identificación
El aislamiento e identificación de los microorganismos se realizó según la técnica ISO 6579:2002; estos fueron confirmados con el sistema automatizado VITEK® 2 Compact System y mediante aglutinación en placa con antisuero Poly A-I & Vi (BD - Difco®) en el laboratorio de Microbiología Veterinaria de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia, sede Bogotá.
Evaluación de la susceptibilidad antimicrobiana
La susceptibilidad antimicrobiana fue establecida por medio del método estandarizado de difusión en disco de Kirby-Bauer. La medición de la zona de inhibición e interpretación de los resultados se realizó conforme a las recomendaciones técnicas del CLSI (Clinical Laboratory Standar Institute) para aislamientos de origen animal (CLSI 2008. Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated From Animals, Approved Standard, Third edition; M31-A3).
La selección de los antimicrobianos se realizó de acuerdo con los siguientes criterios: antimicrobianos de uso veterinario en porcicultura registrados en Colombia (registro ICA -Instituto Colombiano Agropecuario), reportados en la lista de antimicrobianos de importancia veterinaria de la OIE (World Organization for Animal Healt) (OIE 2008), incluidos en los antimicrobianos evaluados por el programa EQUAS ( The External Quality Assurance System of the WHO Global Salm-Surv, 2008) para la vigilancia mundial de las resistencias de Salmonella spp. y, adicionalmente, aquellos antimicrobianos incluidos en los registros del CLSI para interpretación de resultados (CLSI 2008).
Se consideró que un microorganismo era resistente si el aislamiento mostraba resistencia o susceptibilidad intermedia y multirresistente cuando exhibía resistencia simultánea a tres o más familias de antimicrobianos. El control de calidad fue realizado con la cepa Escherichia coli ATCC 25922. Los antimicrobianos probados fueron: amoxacilina-ácido clavulánico (Amc; 20/10 ug), ampicilina (Amp; 10 ug), ceftiofur (Eft; 30 ug), ciprofloxacina (Cip; 5 ug), cloranfenicol (C; 30 ug), florfenicol (Ffc; 30 ug), gentamicina (Gn; 10 ug), sulfametoxazol/trimetroprim (Sxt; 25 ug), tetraciclina (Te; 30 ug) y tilmicosina (Til; 15ug). Si bien cloranfenicol, florfenicol y tilmicosina no hacen parte del repertorio de antimicrobianos de uso frecuente en la terapéutica humana, fueron incluidos debido a la fuerte presión de selección que estos ejercen en las producciones porci-nas. Los datos fueron analizados según las proporciones de resistencia de cada antimicrobiano y su patrón de acuerdo al punto del aislamiento utilizando el programa Microsoft Excel versión 2010.
RESULTADOS
Resistencia antimicrobiana global
De los 283 aislamientos de Salmonella ente-rica, 98,59% (n: 279) fueron resistentes al menos a un antimicrobiano y sólo 1,41% (n: 4) resultaron susceptibles frente a los diez antimicrobianos evaluados.
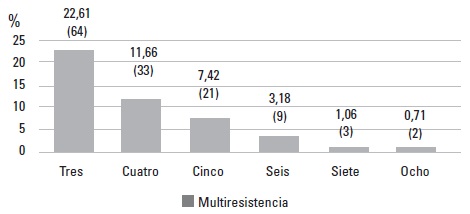
La resistencia frente a cada antimicrobiano fue variable según el punto de muestreo; sin embargo, se observó alguna homogeneidad (Tabla 1). El porcentaje de aislamientos resistentes e intermedios para cada antimicrobiano se muestra en la Figura 1. El 18,37% (n: 52) de los aislamientos fue resistente frente a un solo antimicrobiano y el 33,57% (n: 95) a dos. El 46,64% (n: 132) del total de aislamientos fue multiresistente; los porcentajes de multiresistencia se muestran en la Figura 2.
El patrón de multiresistencia más frecuente fue ceftiofur-tetraciclina-tilmicosi-na en el 9,89% (n: 28) de los aislamientos (Tabla 2). Un total de 52 patrones de multiresistencia fueron encontrados en los diferentes puntos evaluados.
FIGURA 1. Porcentaje de aislamientos de Salmonella entérica proveniente del ambiente de plantas de beneficio porcino que exhibieron resistencia y resistencia intermedia frente a diez antibióticos evaluados.
FIGURA 2. Porcentaje de multiresistencia exhibida por aislamientos de Salmonella entérica provenientes del ambiente de plantas de beneficio porcino en Colombia.
TABLA 1. Distribución de resistencias antimicrobianas de Salmonella entérica en diferentes puntos de muestreo en plantas de beneficio porcino en Colombia.
Resistencia antimicrobiana N (%) |
|||||||||||
Totalaislamientos |
Amc |
Amp |
Eft |
Cip |
C |
Ffc |
Gn |
Te |
Til |
Sxt |
|
Pisos |
53(18,7) |
11 (20,75) |
13 (24,53) |
16(30,19) |
1 (1,89) |
2(3,77) |
4(7,55) |
2 (3,77) |
48 (90,57) |
24 (45,28) |
1 (1,89) |
Depiladora |
19(6,7) |
0(0) |
1 (5,26) |
1 (5,26) |
0(0) |
0(0) |
1 (5,26) |
3(15,79) |
19(100) |
7 (36,84) |
0(0) |
Cuchillo C1 |
14(4,9) |
0(0) |
0(0) |
3 (42,86) |
0(0) |
0(0) |
0(0) |
0(0) |
14(100) |
14(100) |
0(0) |
Cuchillo C2 |
65(23) |
2(3,08) |
7(10,77) |
17(26,15) |
0(0) |
15(23,08) |
18(27,69) |
8(12,31) |
65(100) |
60(92,31) |
23 (35,38) |
Cuchillo C3 |
15(5,3) |
0(0) |
1 (6,67) |
5 (33,33) |
0(0) |
0(0) |
0(0) |
1 (6,67) |
14(93,33) |
11 (73,33) |
0(0) |
Interior canal |
80 (28,3) |
1 (1,25) |
10(12,5) |
19(23,75) |
2(2,5) |
3 (3,75) |
13(16,25) |
11 (13,75) |
78(97,5) |
59 (73,75) |
9(11,25) |
Exterior canal |
37(13,1) |
4(10,81) |
11 (29,73) |
19(51,35) |
3(8,11) |
5(13,51) |
9 (24,32) |
8(21,62) |
36 (97,30) |
32 (86,49) |
7(18,92) |
Total aislamientos |
283(100) |
18(6,36) |
43(15,19) |
80 (28,27) |
6(2,12) |
25 (8,83) |
45(15,9) |
33(11,66) |
274(96,82) |
207(73,14) |
40(14,13) |
Amc:
amoxacilina-ácido clavuIónico; Amp: ampicilina; Eft: ceftiofur; Cip:
ciprofloxacina; C: cloranfenicol; Ffc: florfenicol; Gn: gentamicina; Te:
tetraciclina; Til: tilmicosina; Sxt: sulfametoxazol-trimetroprim.
N: Número de
aislamientos resistentes en cada punto de muestreo.
C: cuchillos; C1:
apertura abdominal y torácica, C2: separación rectal, C3: evisceración.
TABLA 2. Distrib ución de patrones de multiresistencia más frecuentes en aislamientos de Salmonella entérica en diferentes puntos de muestreo en plantas de beneficio porcino en Colombia.
Patrones de multiresistencia más frecuentes |
|||||||||
Patrón de Multiresistencia |
Pisos |
Depiladora |
Cuchillo 1 |
Cuchillo 2 |
Cuchillo 3 |
Interior canal |
Exterior canal |
N |
(%) |
EftTeTil |
0 |
1 |
3 |
5 |
3 |
10 |
6 |
28 |
9,89 |
GnTeTil |
0 |
0 |
0 |
5 |
1 |
5 |
3 |
14 |
4,95 |
AmcAmpEftTeTil |
9 |
0 |
0 |
0 |
0 |
0 |
0 |
9 |
3,18 |
CFfcTeTiISxt |
0 |
0 |
0 |
7 |
0 |
0 |
0 |
7 |
2,47 |
AmpEftTeTiISxt |
0 |
0 |
0 |
1 |
0 |
0 |
5 |
6 |
2,12 |
Aislamientos multiresistentes |
9 |
1 |
3 |
18 |
4 |
15 |
14 |
64 |
22,61 |
Total aislamientos evaluados |
283 |
100% |
|||||||
Ame: amoxacilina-ácido
clavulánico; Amp: ampicilina; Eftceftiofur; Cip: ciprofloxacina; C:
cloranfenicol; Ffc: florfenicol; Gn: gentamicina;
Te: tetraciclina; Til:
tilmicosina; Sxt: sulfametoxazol-trimetroprim.
N: Número de
aislamientos resistentes en cada punto de muestreo.
Pisos
En este sitio de muestreo 53 aislamientos, equivalentes a 94,33% (n: 50) fue resistente al menos a un antimicrobiano y 30,19% (n: 16) fue multiresistente. El patrón de multiresistencia más común hallado en pisos fue: ampicilina-amoxa-cilina-ceftiofur-tetracilina-tilmicosina en 27% (n: 9) de los aislamientos. Un aislamiento fue resistente frente a siete antimicrobianos ampicilina-amoxaci-lina-ceftiofur-florfenicol-gentamicina-tetracilina-tilmicosina. Se reportan tres aislamientos sensibles frente a todos los antimicrobianos probados.
Equipos y utensilios
De 19 aislamientos obtenidos de la máquina depiladora, el 26,31% (n: 5) fue multiresistente, siendo el patrón de mul-tiresistencia más frecuente: gentamicina-tetraciclina-tilmicosina en 10,53% (n: 2) de los aislamientos.
En los cuchillos de apertura torácica y abdominal (C1), separación de recto (C2) y eviscerado (C3), el 21,43% (n: 3), el 63,08% (n: 41) y el 33,33% (n: 5) de los aislamientos, respectivamente, fueron multiresistentes. En las muestras obtenidas del cuchillo de eviscerado un aislamiento fue sensible frente a todos los antimicrobianos evaluados. Los patrones de multiresistencia más comunes fueron: ceftiofur-tetracilina-tilmicosina en el 21,43% (n: 3) en los cuchillos de apertura torácica y abdominal (C1); ampicilina-tetracilina-tilmicosina en el 10,77% (n: 7) en cuchillos de separación del recto (C2) y ceftiofur-tetracilina-tilmicosina en el 20% (n: 3) de los aislamientos de cuchillos de eviscerado (C3).
Producto terminado
De los 37 aislamientos recuperados del exterior de la canal, el 70,27% (n: 26) fueron multiresistentes; el patrón más detectado fue ampicilina-ceftiofur-tetra-cilina-tilmicosina-sulfametoxazol/trime-troprim en el 13,51% (n: 5). En esta zona de muestreo se hallaron dos aislamientos multiresistentes a ocho antimicrobianos y uno a siete antimicrobianos.
De los aislamientos recuperados a partir del interior de la canal, el 45% (n: 36) fue multiresistente. El 12,5% (n: 10) resultaron multiresistentes frente a ceftiofur-tetracilina-tilmicosina. Uno de los aislamientos detectados fue resistente frente a siete antimicrobianos: ampicilina-ceftiofur-ciprofloxacina-cloranfenicol-florfenicol-tetracilina-tilmicosina.
DISCUSIÓN
En este estudio, 98,59% (n: 279) de los aislamientos de Salmonella entérica provenientes de plantas de beneficio porcino en Colombia mostraron resistencia antimicrobiana, observándose multiresistentencia en 46.64% (n: 132) de los aislamientos, distribuida en 52 patrones de resistencia. Diversos autores han informado previamente altas proporciones de resistencia antimicrobianas en plantas de beneficio. Schmidt et al. (2012) reportaron que 76,9% de 5.318 aislamientos de Salmonella spp., obtenidos a partir de canales preescaldado, fue resistente al menos a uno de tres antimicrobianos probados (ampicili-na, kanamicina, tetraciclina), el 71,2% expresó multiresistencia, el 72,9% de aislamientos de canales pre-eviscerado presentó resistencia al menos uno de tres antimicrobianos y el 47,8%, al menos a tres de 15 antimicrobianos probados. En los aislamientos provenientes de canales refrigeradas, se reportó hasta un 98% de resistencia al menos a uno de los tres antimicrobianos y 77,5% de multiresistencia (Schmidt et al. 2012).
En un estudio realizado en Irlanda (Prendergast et al. 2008), seis de ocho aislamientos ambientales de Salmonella spp. en planta de beneficio fueron resistentes al menos frente a dos antimicrobianos; tres de estos aislamientos fueron multiresistentes y uno de ellos lo fue frente a siete antimicrobianos y finalmente, en dicho estudio se detectaron cuatro patrones diferentes de resistencia. En Brasil, Kich et al. (2011) encontraron que el 83% (475/572) y el 43% (246/572) de aislamientos de Salmonella spp. obtenidos a partir del ambiente pre-beneficio y de las canales, fueron resistentes al menos a uno y cuatro antimicrobianos respectivamente; además, se detectaron 59 diferentes perfiles de resistencia antimicrobiana (Kich et al. 2011). Lo anterior, contrasta con los resultados de Sisák et al. (2004) quienes reportaron que el 29,6% (8/27) de los aislamientos de Salmonella spp. de canales de cerdo exhibieron resistencia frente al menos un antimicrobiano (Sisák et al. 2004).
Según varios estudios, el ambiente de las plantas de beneficio puede contribuir a la difusión de Salmonella spp. a las canales. (Mannion et al. 2012; Prendergast et al. 2008). Específicamente, en el estudio de Prendergast et al. (2008) se encontró una fuerte asociación entre las superficies de los equipos en las plantas de beneficio y la contaminación de canales con Salmonella spp. (Prendergast et al. 2008); dicho nexo también tiene relación con la transferencia de bacterias o genes de multiresistencias a través de la cadena productiva de la carne de cerdo, dado que algunos genes que codifican la resistencia antimicrobiana se localizan en elementos transmisibles, como plásmidos o integrones, que permitirían su potencial diseminación entre serovarie-dades presentes en el ambiente en plantas de beneficio y canales (Foley y Lynne 2007). Por lo tanto, animales destinados al consumo podrían ser un reservorio importante de aislamientos de Salmonella spp. multiresistentes (Wedel et al. 2005) que potencialmente podrían diseminarse a través de las cadenas productivas.
En aislamientos de piso, el 35,14% (n: 13) del total de aislamientos fueron resistentes a por lo menos un antimicrobiano, y el 33,96% (n: 18) fueron multitesistentes, uno de ellos a siete antimicrobianos. Tres aislamientos fueron sensibles a los diez antimicrobianos. Estos aislamientos se realizaron a partir del piso del área intermedia dentro la planta, un área de gran flujo de personal, lo cual podría representar una forma de difusión de bacterias multiresistentes entre las diferentes áreas de las plantas de beneficio. La importancia de la presión de selección sobre la carga bacteriana ambiental subyace a los mecanismos de diseminación de microorganismos resistentes. Uno de estos mecanismos bacterianos, la transformación, permite que el ADN libre en al ambiente (de células muertas o lesionadas) pueda ser captado, integrado y expresado en otra bacteria receptora (Foley y Lynne 2007; Prendergast et al. 2008).
De otra parte Salmonella spp. podría permanecer sobre la superficie del equipo de depilado (Gill y Bryant 1992), especialmente si la canal se ha contaminado con heces. Se detectó la presencia de aislamientos multirresistentes provenientes de depiladora en un 21,05% (n: 4), lo cual podría sugerir que este es un punto crítico para prevenir la transmisión entre equipos y canales. Además, es relevante mencionar la presencia del patrón de multiresistencia más comúnmente detectado en este estudio (Tabla 2), el cual se presentó con mayor frecuencia en la medida en que avanzó el proceso de beneficio, encontrándose incluso diez aislamientos con dicho patrón al interior de la canal. Sin embargo, para afirmar que dichos aislamiento provienen del mismo clon, se requeriría comparar los aislamientos mediante métodos de genética molecular.
El estudio de Peel y Simmons (1978) demostró que Salmonella spp. podría sobrevivir en la superficie de cuchillos no esterilizados adecuadamente (Peel y Simmons 1978); la presencia de aislamientos multiresistentes registrada en los cuchillos evaluados en nuestro estudio (52,13%, n: 49) podría deberse a deficiente limpieza y desinfección del instrumental que, al entrar en contacto con heces, tejido del tracto gastrointestinal o ganglios linfáticos, se contamina con el microorganismo favoreciendo su propagación entre canales (Berends et al. 1997).
Teniendo en cuenta que hasta el 69% de la contaminación de la canal con Salmonella spp. es resultado de la contaminación ambiental durante el beneficio (Duggan et al. 2010), los aislamientos detectados en canales resultan ser indicadores indirectos de la calidad del proceso. Confrontando lo anterior con los resultados obtenidos en el presente estudio, se observó que los aislamientos multiresistentes detectados en el interior de la canal fueron considerablemente más altos (45%, n: 36) que los detectados en exterior de la canal (72,97%, n: 27). Previamente se ha reconocido que la presencia de Salmonella spp. sobre la superficie interna de las canales es indicador de contaminación a partir de fuentes externas como: exterior de la canal, ganglios linfáticos, tracto gastrointestinal o fuentes ambientales durante el beneficio (Berends et al. 1997). Entre los aislamientos del exterior de la canal se encontraron dos multiresistentes a ocho antimicrobianos y uno frente a siete antimicrobianos, este último patrón de resistencia fue idéntico a otro hallado en un aislamiento de interior de la canal.
Por otra parte, el patrón de multirresis-tencia más frecuentemente detectado fue ceftiofur-tetraciclina-tilmicosina (9,89%) distribuido en todos los puntos evaluados, lo cual contrasta con el fenotipo más común de multiresistencia reportado por el Sistema Nacional de Monitoreo de Resistencia Antimicrobiana (NARMS) de EEUU en 2006: ampicilina, cloranfenicol, estreptomicina, sulfonamidas y tetracicli-nas (ACSSuT), detectado en el 9,3% de los aislamientos humanos y 4,8% de los aislamientos de fuentes animales (Foley y Lynne 2007). El patrón de resistencia ACSSuT también fue el más encontrado en el estudio de Schmidt et al. (2012) y en el de Sisák et al. (2004).
El fenotipo de resistencia ACSSuT frecuentemente se asocia con S. Typhimurium DT 104 y con genes de resistencia que codifican |3-lactamasas (blapSE1), bombas de flujo (floR y tetG), enzimas que inactivan el antimicrobiano (aadA2) o disminuyen su afinidad al blanco en la bacteria (sullK) y podrían ser genómicos (isla de patoge-nicidad I) o transmitidos por plásmidos (Foley y Lynne 2007; Schmidt et al. 2012; Sisák et al. 2004). La importancia en salud pública de este fagotipo radica en la fuerte asociación entre pentaresistencia, bacteremia y hospitalización en humanos y sus subsecuentes efectos, como el fracaso terapéutico, el riesgo de otras complicaciones (meningitis, endocarditis, sepsis, muerte), periodos de hospitalización más frecuentes y largos con las subsecuentes ausencia laboral y costo hospitalario (Varma et al. 2005). Prendegast et al. (2008), reportaron a tetraciclina-minociclina como el patrón de resistencia más frecuentemente hallado en aislamientos ambientales de plantas de beneficio, en tanto que Kich et al. (2011), reportaron ampicilina-gentaminicina-kanamicina-tetraciclina como el patrón de resistencia más común (Kich et al. 2011; Prendergast et al. 2008).
El alto porcentaje de resistencia frente a tetraciclina (97,28%), tilmicosina (74,15%) y ceftiofur (29,93%), además de relacionarse con el patrón de resistencia más frecuentemente detectado y distribuido, puede ser resultado de la presión de selección en la producción primaria, ya que los tres antimicrobianos son de uso común en las producciones porcícolas del país y suelen prescribirse como profilácticos, metafilácticos y promotores de crecimiento (IFT 2006). Además, su administración ocurre en periodos intermitentes y de forma masiva (en agua o alimentos), con lo cual varía la cantidad de antimicrobiano que cada individuo consume. Lo anterior podría favorecer la selección de genes de resistencia y su posterior diseminación.
De especial atención es la alta resistencia expresada frente a ceftiofur. El NARMS (2006) reportó una tendencia al aumento de las resistencias frente a ceftiofur y amoxacilina/ácido clavulánico, casi ocho veces mayor en el trascurso de nueve años (1997-2005) en aislamientos de origen animal. El reflejo de este aumento en aislamientos humanos fue alrededor de cuatro veces mayor (Foley y Lynne 2007). Lo anterior, cobra gran importancia en la salud pública, ya que el ceftiour es una cefalosporina de espectro extendido cuya resistencia cruzada impacta a la ceftriaxona, el antimicrobiano de elección para la sal-monelosis severa en niños menores de 16 años (Foley y Lynne 2007) y en pacientes inmunocomprometidos.
Aunque los casos de salmonelosis humana relacionados con el consumo de carne de cerdo o sus subproductos, son ocasionados en su mayoría por una cocción irregular o por contaminación cruzada de otros alimentos con carne cruda (Lomonaco et al. 2009), para garantizar la inocuidad de los alimentos y contribuir a disminuir la diseminación de aislamientos de Salmonella spp. resistentes, se requiere implementar y fortalecer sistemas de gestión de calidad e inocuidad oficiales y voluntarios tales como Buenas Prácticas Agrícolas (según los lineamientos de GlobalG.A.P), Buenas Prácticas de Manufactura, HACCP (Hazard Analysis and Critical Control Points'), ISO 9000 o ISO 22000, entre otros, durante el prebeneficio (incluida la producción primaria), el beneficio y el posbeneficio bajo un enfoque de riesgo, en las diferentes etapas de la cadena productiva, como parte de un esfuerzo conjunto que busca preservar la eficacia de los antimicrobianos en la lucha contra las enfermedades infecciosas tanto en humanos como en animales. No obstante, el énfasis de la emergencia de patógenos multiresistentes se dirige especialmente a las enfermedades humanas graves con pocas alternativas terapéuticas.
El monitoreo continuo de farmaco-resistencias, en especial, para las serova-riedades no tifoideas de Salmonella spp. con potencial de diseminación en las cadenas productivas, es fundamental para contribuir a implementar programas de prevención y control de la diseminación de patógenos resistentes y maximizar la eficacia y disponibilidad de los antimicrobianos usados en veterinaria, en consonancia con los principios de uso prudente expuestos por la OIE.
CONCLUSIÓN
Los datos reportados en este estudio indican una importante contaminación ambiental de algunas plantas de beneficio porcino en Colombia con aislamientos multiresistentes de Salmonella entérica, lo que sugiere que los procedimientos de limpieza y desinfección deben ser mejorados como parte fundamental de los sistemas de gestión de calidad e inocuidad en las plantas de beneficio.
AGRADECIMIENTO
Al Ministerio de Agricultura y Desarrollo Rural (MADR) por el soporte financiero.
REFERENCIAS
Alcaine SD, Sukhnanand SS, Warnick LD, Su WL, McGann P, McDonough P, Wiedmann M. 2005. Ceftiofur-resistant Salmonella strains isolated from dairy farms represent multiple widely distributed subtypes that evolved by independent horizontal gene transfer. An. Ag. Ch. 49(10): 4061-4067.
Arcos EQ Mora L, Fandiño L, Rondón NS. 2013. Prevalencia de Salmonella spp. en carne porcina, plantas de beneficio y expendios del Tolima. Orinoquia. 17(1): 59-68.
Arnold T, Scholz HC, Marg H, Rosler U, Hensel A. 2004. Impact of inv ThPCR and culture detection methods on occurrence and survival of Salmonella in the flesh, internal organs and lymphoid tissues of experimentally infected pigs. J. Vet. Med. B. Infect. Dis. Vet. Public Health. 51(10): 459-63.
Baer AA, Miller MJ, Dilger AC. 2013. Pathogens of interest to the pork industry: A review of research on interventions to assure food safety. Compr. Rev. Food Sci. Food Saf. 12(2): 183-217. Doi: 10.1111/1541-4337.12001.
Bahnson PB, Fedorka-Cray PJ, Ladely SR, Mateus-Pinilla NE. 2006. Herd-level risk factors for Salmonella enterica subsp. enterica in U.S. market pigs. Prev. Vet. Med. 76: 249-262. Doi: 10.1016/j.prevetmed.2006.05.009.
Berends BR, Van Knapen F, Snidjers JM, Mossel DA. 1997. Identification and quantification of risk factors spp. on pork carcasses regarding Salmonella spp. on pork carcasses. Int. J. Food Microbiol. 36: 199-206.
Berends BR, Urlings HAP, Snijders JMA, Van Knapen F. 1996. Identification and quantification of risk factors in animal management and transport regarding Salmonella spp. in pigs. Int. J. Food Microbiol. 30: 37-53. Doi: 10.1016/0168-1605(96)00990-7.
Berends BR, Van Knapen F, Mossel DAA, Burt SA, Snijders JMA. 1998. Impact on human health of Salmonella spp. on pork in The Netherlands and the anticipated effects of some currently proposed control strategies. Int. J. Food Microbiol. 44(3): 219-229. Doi: 10.1016/S0168-1605(98)00121-4.
[CDC] Center for Disease Control and Prevention [Internet]. 2011. Estimates of foodborne illness in the United States. Atlanta (GA): U.S. Department of Health & Human Services; [consultado 2013 dic. 2]. Disponible en: http://www.cdc.gov/foodborneburden/2011-foodborne-estimates.html.
[CLSI] Clinical Laboratory and Standards Institute. 2008. Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals. 3° ed. Wayne (PA): Clinical Laboratory and Standards Institute.
De Busser EV, Maes D, Houf K, Dewulf J, Im-berechts H, Bertrand S, De Zutter L. 2011. Detection and characterization of Salmonella in lairage, on pig carcasses and intestines in five slaughterhouses. Int. J. Food Microbiol. 145(1): 279-286. Doi: 10.1016/j.ijfoodmi-cro.2011.01.009.
Duggan SJ, Mannion C, Prendergast DM, Leonard N, Fanning S, Gonzales-Barron U, Egan J, Butler F, Dufíy G. 2010. Tracking the Salmonella status of pigs and pork from lairage through the slaughter process in the Republic of Ireland. J. Food Prot. 73(12): 2148-2160.
Durango J, Arrieta G, Mattar S. 2004. Presencia de Salmonella spp. en un área del Caribe Colombiano: un riesgo para la salud pública. Biomédica. 24: 89-96.
[FDA] Food and Drug Administration. 2012. Guidance for Industry #209. The judicious use of medically important antimicrobial drugs in food-producing animals [Internet]. Rockville (MD): Food and Drug Administration; [consultado 2013 dic. 2]; Disponible en: http://www.fda.gov/downloads/AnimalVeterinary/GuidanceComplianceEnforcement/GuidanceforIndustry/UCM2l6936.pdf.
Foley SL, Lynne AM. 2008. Food animal-associated Salmonella challenges: pathogenicity and antimicrobial resistance. J. Anim. Sci. 86: E173-187.
Fosse J, Seegers H, Magras C. 2009. Prevalence and risk factors for bacterial food-borne zoonotic hazards in slaughter pigs: a review. Zoonoses Public Health. 56(8): 429-54.
Frenzen PD, Buzby JC, Roberts T. 1999. An updated estimate of the economic costs of human illness due to foodborne Salmonella in the United States [Internet]. 3rd Int. Symp. Epidemiol. Cont. Salmonella Pork: Economics and Policy. 215-218. Disponible en: http://lib.dr.iastate.edu/cgi/viewcontent.cgi?article=1970_context=safepork.
Gill CO, Bryant J. 1992. The presence of Escherichia coli, Salmonella and Campylobacterin pig carcass dehairing equipment. Food Microbiol. 10(4): 337-344. Doi: 10.1006/fmic.1993.1039.
Hedberg CW 2002. The role of pork as a vehicle for confirmed food borne disease outbreaks in the United States, 1990-1997 [Internet]. School of Public Health, University of Minnesota; [citado 2014 nov. 30] Disponible en: http://porkgate-way.org/wp-content/uploads/2015/07/role-of-pork-as-a-vehicle-for-confirmed-foodborne-disease-outbreaks-in-the-united-states1.pdf.
Hendriksen R, Karlsmose S, Jensen AB, Aarestrup F. 2009. The external quality assurance system of the WHO global Salm-Surv, year 2008 [Internet]. 2° ed. Copenhagen (DM): National Food Institute, Technical University of Denmark; [citado 2014 nov. 22]. Disponible en: http://www.antimicrobialresistance.dk/data/images/eqas/eqasfullreport2008_isbn.pdf.
[IFT] Institute of Food Technologist. 2006. Antimicrobial resistance: implications for the food system. An expert report, funded by the IFT Foundation. Compr. Rev. Food Sci. Food Saf. 5(3): 71-137. Doi: 10.1111/j.1541-4337.2006.00004.x.
Kich JD, Coldebella A, Morés N, Nogueira MG, Cardoso M, Fratamico PM, Call JE, Fedorka-Cray P, Luchansky JB. 2011. Prevalence, distribution, and molecular characterization of Salmonella recovered from swine finishing herds and a slaughter facility in Santa Catarina, Brazil. Int. J. Food Microbiol. 151(3): 307-313. Doi: 10.1016/j.ijfoodmicro.2011.09.024.
Lomonaco S, Decastelli L, Bianchi DM, Nucera D, Grassi MA, Sperone V, Civera T. 2009. Detection of Salmonella in finishing pigs on farm and at slaughter in Piedmont, Italy. Zoonoses Public Health. 56(3): 137-44. Doi: 10.1111/j.1863-2378.2008.01192.x.
Mannion C, Fanning J, McLernon J, Lendrum L, Gutierrez M, Duggan S, Egan J. 2012. The role of transport, lairage and slaughter processes in the dissemination of Salmonella spp. in pigs in Ireland. Food Res. Int. 45(2): 871-879. Doi: 10.1016/j.foodres.2011.02.001.
Olsen A, Jensen T, Dahl J, Christensen H. 2001. Reduction in level of Salmonella on swine carcasses after slaughter without splitting the head. Proceedings of the 4th International Symposium on the Epidemiology and Control of Salmonella and Other Food Borne Pathogens in Pork, 124-126.
Peel B, Simmons GC. 1978. Factors in the spread of Salmonellas in meatworks with speial reference to contamination of knives. Aust. Vet. J. 54(3): 106-110.
Prendergast DM, Duggan SJ, Fanning S, Cormican M, Gonzales-Barron U, Butler F, Duffy G. 2008. Prevalence and numbers of Salmonella spp. and Enterobacteriaceae on pork cuts in abattoirs in the Republic of Ireland. J. Appl. Microbiol. 105(4): 1209-1219. Doi: 10.1111/j.1365-2672.2008.03854.x.
Rosengren LB, Waldner CL, Reid-smith RJ, Check-ley SL, Mcfall ME, Rajic A. 2008. Antimicrobial resistance of fecal Salmonella spp. isolated from all phases of pig production in 20 herds in Alberta and Saskatchewan. Can. J. Vet. Res. 72(2): 151-159.
Schmidt JW Brichta-Harhay DM, Kalchayanand N, Bosilevac JM, Shackelford SD, Wheeler TL, Koohmaraie M. 2012. Prevalence, enumeration, serotypes, and antimicrobial resistance phenotypes of Salmonella enterica isolates from carcasses at two large United States pork processing plants. Appl. Environ. Microbiol. 78(8): 2716-2726. Doi: 10.1128/AEM.07015-11.
Sisák F, Havlícková H, Karpísková R RI. 2004. Prevalence of Salmonella and Their Resistance to Antibiotics in Slaughtered Pigs in the Czech Republic. Czech J. Food Sci. 22(6): 230-236.
Varma JK, Molbak K, Barrett TJ, Beebe JL, Jones TF, Rabatsky-Ehr T, Smith KE, Vugia DJ, Chang HG, Angulo FJ. 2005. Antimicrobial-resistant nontyphoidal Salmonella is associated with excess bloodstream infections and hospitalizations. J. Infect. Dis. 191(4): 554-561.
Wedel SD, Bender JB, Leano FT, Boxrud DJ, Hed-berg C, Smith KE. 2005. Antimicrobial-drug Susceptibility of Human and Animal Salmonella Typhimurium, Minnesota, 1997-2003. Emerg. Infect. Dis. 11(12): 1899-1906.
Wilkins W, Rajic A, Waldner C, Mcfall M, Chow E, Muckle A. 2010. Distribution of Salmonella serovars in breeding , nursery , and grow-to-finish pigs , and risk factors for shedding in ten farrow-to-finish swine farms in Alberta and Saskatchewan. Can. J. Vet. Res. 74: 81-90.
[OIE] World Organisation for Animal Healt. 2008. Manual of diagnostic tests and vaccines for terrestrial animals [Internet]. 6° ed. Vol. 1. Paris (FR): World Organisation For Animal Health; [citado 2014 nov. 20]. Disponible en: http://www.oie.int/doc/ged/D7710.pdf.
Article citation:
Bermúdez PM, Pulecio SL, Suárez MC. Susceptibilidad antimicrobiana de aislamientos de Salmonella enterica provenientes de pisos, equipos, utensilios y producto terminado en plantas de beneficio porcino en Colombia [Antimicrobial susceptibility of Salmonella enterica strains isolated from floors, equipment, machinery, and finished product in porcine slaughterhouses in Colombia]. Rev Med Vet Zoot. 63(1): 39-53. Doi: 10.15446/rfmvz.v63n1.56903.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
CrossRef Cited-by
1. Alejandro de Jesús Cortés-Sánchez, Raquel Garcia-Barrientos, Hugo Minor-Pérez, Octavio Dublán-García, Alejandra L. San Martin-Azocar. (2017). Food Safety and Antimicrobial Resistance an Approach to the Genus <i>Salmonella</i> spp.. Journal of Biosciences and Medicines, 05(02), p.55. https://doi.org/10.4236/jbm.2017.52006.
Dimensions
PlumX
Article abstract page views
Downloads
License
Copyright (c) 2016 P. M. Bermúdez, S. L. Pulecio, M. C. Suárez

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
This article is published under the terms of the Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
The authors retain copyright of their work and grant the journal the right of first publication.
Readers are free to copy and redistribute the material in any medium or format under the license terms, provided proper attribution is given, the work is not used for commercial purposes, and no modifications or derivatives are made.