Efecto del ácido giberélico y la 6-bencilaminopurina sobre el desarrollo de yemas en injertos de cacao (Theobroma cacao L.)
Downloads
Gran parte de los cultivos de cacao en el país son viejos y necesitan ser renovados debido a sus bajos rendimientos. Por esta razón se aborda la producción masiva de plántulas injertadas con materiales de alta productividad, que sin embargo presentan problemas en el prendimiento y desarrollo de las yemas. En el Centro de Investigación Nataima-Corpoica (Espinal, Tolima), plántulas de cacao del clon IMC67 tratadas con desbrote apical fueron injertadas con yemas de los clones CCN51 e ICS95. El ensayo siguió un diseño completamente aleatorizado con siete tratamientos, tres de ellos correspondientes a concentraciones de 5, 10 y 15 mg L-1 de ácido giberélico (AG3), y otros tres aplicando 6-bencilaminopurina (6BAP) en las mismas concentraciones, más un testigo sin aplicación de hormonas. Cada 3 días se midieron la altura, el diámetro, la longitud, el número de hojas y el área foliar del injerto, además de su masa fresca y seca al final del experimento, el cual duró 30 días. El AG3 permitió alcanzar los mayores valores en longitud, número de hojas, área foliar y masa fresca y seca del injerto. Para los mismos parámetros, los tratamientos con 6BAP alcanzaron valores similares a los obtenidos con AG3 (con diferencias estadísticas en algunos casos), además de los mayores diámetros del injerto. Dentro de las aplicaciones de AG3, la realizada a una concentración de 10 mg L-1 mostró los mejores resultados en ambos clones. Sin la aplicación de hormonas, las yemas del clon ICS95 desarrollaron una mayor área foliar y alcanzaron mayores valores de masa fresca y seca que las yemas del clon CCN51. Sin embargo, después de aplicar los tratamientos, los dos clones presentaron valores similares.
Propagación y cultivo de tejidos
Julián F. Cárdenas-Hernández1, 2, 4, Javier Giovanni Álvarez-Herrera2, Eduardo Barragán Q.3 y Carlos Mauricio Rivera1
1 Departamento de Agronomía, Facultad de Agronomía, Universidad Nacional de Colombia, Bogotá (Colombia).
2 Grupo de Investigaciones Agrícolas, Facultad de Ciencias Agropecuarias, Universidad Pedagógica y Tecnológica de Colombia (UPTC), Tunja (Colombia).
3 Área de Ecofisiología Vegetal, Centro de Investigación Nataima, Corporación Colombiana de Investigación Agropecuaria (Corpoica), Espinal (Colombia).
4 Autor de correspondencia. julianentero@gmail.com
Fecha de recepción: 21 de abril de 2009. Aceptado para publicación: 5 de marzo de 2010.
RESUMEN
Gran parte de los cultivos de cacao en el país son viejos y necesitan ser renovados debido a sus bajos rendimientos. Por esta razón se aborda la producción masiva de plántulas injertadas con materiales de alta productividad, que sin embargo presentan problemas en el prendimiento y desarrollo de las yemas. En el Centro de Investigación Nataima-Corpoica (Espinal, Tolima), plántulas de cacao del clon IMC67 tratadas con desbrote apical fueron injertadas con yemas de los clones CCN51 e ICS95. El ensayo siguió un diseño completamente aleatorizado con siete tratamientos, tres de ellos correspondientes a concentraciones de 5, 10 y 15 mg L-1 de ácido giberélico (AG3), y otros tres aplicando 6-bencilaminopurina (6BAP) en las mismas concentraciones, más un testigo sin aplicación de hormonas. Cada 3 días se midieron la altura, el diámetro, la longitud, el número de hojas y el área foliar del injerto, además de su masa fresca y seca al final del experimento, el cual duró 30 días. El AG3 permitió alcanzar los mayores valores en longitud, número de hojas, área foliar y masa fresca y seca del injerto. Para los mismos parámetros, los tratamientos con 6BAP alcanzaron valores similares a los obtenidos con AG3 (con diferencias estadísticas en algunos casos), además de los mayores diámetros del injerto. Dentro de las aplicaciones de AG3, la realizada a una concentración de 10 mg L-1 mostró los mejores resultados en ambos clones. Sin la aplicación de hormonas, las yemas del clon ICS95 desarrollaron una mayor área foliar y alcanzaron mayores valores de masa fresca y seca que las yemas del clon CCN51. Sin embargo, después de aplicar los tratamientos, los dos clones presentaron valores similares.Palabras clave: Clon IMC67, Clon CCN 51, Clon ICS 95, desbrote apical, reguladores de crecimiento.
ABSTRACT
Most of the cacao plantations of Colombia are certainly old and need to be renewed due to low yield. For this reason, the present work takes on the massive production of high yielding scions, which, notwithstanding, have shown grafting problems, specifically regarding bud initiation and further growth. In Nataima-Corpoica Research Center, located in the municipality of Espinal (Tolima, Colombia), buds of cacao clones CCN51 and ICS95 were grafted onto shoot tip excised seedlings of clone IMC67. The experiment followed a completely randomized design with seven treatments consisting in 5, 10 and 15 mg L-1 solutions of both gibberellic acid (GA3) and 6-benzylaminopurine (6BAP), plus a hormone-free control. Scion height, length, diameter, number of leaves and foliar area were measured every three days. At the end of the experiment, which took a total of 30 days, scion fresh and dry mass were also determined. Regarding scion number of leaves, foliar area and fresh and dry mass, the highest counts were reached due to the GA3 treatments. Besides the highest diameters, the 6BAP treated scions reached close records to those of the materials that received GA3, although sometimes exhibiting statistical differences. Among the GA3 applications, the 10 mg L-1 one showed the best results in both clones. In the control treatment, clone ICS95 developed larger foliar area and fresh and dry mass records than clone CCN51. However, after receiving the hormone treatments, both clones showed similar data.
Key words: Clone IMC67, Clone CCN51, Clone ICS95, shoot tip excision, growth regulator.
Introducción
El 70% de las plantaciones viejas de cacao en el país, necesitan ser rehabilitadas debido a los bajos rendimientos que están originando. Existen árboles que genéticamente presentan baja producción y una gran cantidad de estos son improductivos; además, la alta presencia de enfermedades y el deficiente manejo agronómico, hacen que los rendimientos se reduzcan considerablemente (Palencia et al., 2006).
Por esta razón, se está llevando a cabo la producción masiva de plántulas de cacao injertadas con materiales previamente establecidos para cada región agroecológica con el fin de renovar las plantaciones viejas con clones de alto rendimiento, resistentes a plagas y enfermedades o tolerantes a toxicidad por aluminio (Ramírez, 2006). Sin embargo, los injertos han mostrado problemas fisiológicos en su desarrollo posiblemente relacionados con desbalances hormonales.
En cultivos in vitro la diferenciación en raíces y follaje depende de la relación auxina: citoquinina en el medio de cultivo. Mientras una relación auxina: citoquinina alta estimula la formación de raíces, una baja relación ayuda a la formación de follaje. A niveles intermedios, el tejido crece como un callo indiferenciado (Skoog y Miller, 1965), lo cual puede ocurrir naturalmente como respuesta a heridas o a la unión de injertos donde los tallos de dos plantas distintas están interactuando. En yemas, la citoquinina endógena es baja debido a que el sitio principal de síntesis son las raíces, por lo que la adición exógena de citoquininas en los medios de establecimientos es generalizada (Jiménez, 1998).
Las citoquininas inician el crecimiento de las yemas laterales (Taiz y Zeiger, 2002). La benciladenina (citoquinina) se utiliza para promover la brotación lateral en numerosas especies (Rease y Burst, 1983) ya que induce la división celular, incrementa el contenido de clorofila a través de la diferenciación de cloroplastos, aumenta la actividad fotosintética, participa en la pérdida de dominancia apical y retrasa la senescencia (Davies et al., 1995).
Las citoquininas están envueltas en el control de la biogénesis y función de los cloroplastos. Estas afectan la ultraestructura de los cloroplastos, las funciones de las enzimas de estos organelos, la acumulación de pigmentos y la tasa de fotosíntesis (Lerbs et al., 1984; Chory et al., 1994; Kusnetsov et al., 1994, 1998, 1999; Yaronskaya et al., 2006). El estado de desarrollo y el metabólico de los plastidios afecta la respuesta de las hojas a la aplicación exógena de citoquininas (Kulaeva et al., 2002).
Por su parte, las giberelinas incrementan tanto la elongación como la división celular (Taiz y Zeiger, 2002). Las giberelinas cumplen un importante papel fisiológico en la elongación de brotes y tallos. Además, estas hormonas promueven la biosíntesis de auxinas e inhiben su degradación por la AIA oxidasa que incrementan su cantidad en la planta (Law, 1987). Al aplicar una giberelina específica, ésta coincidirá a lo sumo con una de las naturales que contiene el vegetal. En Silene armeria, el AG7 promueve la floración mientras AG3 no ejerce ningún efecto (Ballester-Olmos, 2005).
Los resultados de la aplicación de giberelinas en yerba mate (Ilex paraguariensis) sugieren que las giberelinas están involucradas en el control de la brotación y crecimiento de tallos, observándose una estrecha relación entre la estructura química de la hormona y la respuesta morfogénica del explante (Sansberro et al., 2000).
Cuando se trabaja con injertos, se debe tener en cuenta que después de injertar la yema, la cual estaba dentro de una arquitectura diferente y compleja, pasa a tener un crecimiento longitudinal; bajo estas condiciones el efecto de la dominancia apical es más fuerte (Valdés et al., 2003). Las hormonas de la planta controlan el mantenimiento de este crecimiento que a su vez define la ramificación lateral por el fenómeno conocido como dominancia apical. El crecimiento de las yemas laterales es modulado a través de
los efectos antagónicos de las citoquininas (que lo promueven) y las auxinas (que lo inhiben) (Cline, 1994). Muchos investigadores consideran que el crecimiento de la yema depende de la proporción de estas hormonas más que del nivel absoluto de cada una, lo cual sugiere que la relación entre las dos es mantenida por una retroalimentación negativa/ positiva (Bangerth, 2000; Valdés et al., 2003).
Con el presente estudio se buscó determinar el efecto del ácido giberélico y la 6-bencilaminopurina sobre el crecimiento y desarrollo de yemas de cacao de los clones CCN51 e ICS95 injertadas sobre el patrón IMC67, con el fin de garantizar que la producción de material vegetal sea de buena calidad.
Materiales y métodos
El ensayo se realizó en el Centro de Investigación Nataima- Corpoica en el municipio de Espinal (Tolima), el cual se encuentra a una altura de 420 msnm, con una temperatura promedio de 28°C y una precipitación anual de 1.400 mm.
Se utilizaron plántulas de cacao del clon IMC67 de tres meses después de trasplante a las cuales se les cortó la yema terminal y se les removieron las hojas dejando solo una a cada plántula. Las plántulas fueron injertadas con yemas de los materiales CCN51 e ICS95, procedentes de ramas jóvenes, utilizando el injerto de parche. A los injertos sometidos a tratamientos se les dio el mismo manejo que al resto de los injertos; se sembraron en una mezcla de tierra, arena y materia orgánica dentro de bolsas de 1 kg y se regaron cada 3 d con manguera; la cantidad de agua aplicada dependió de la precipitación, de tal forma que el suelo de las bolsas permaneció a capacidad de campo.
Los tratamientos consistieron en la aplicación de tres concentraciones diferentes (5, 10 y 15 mg L-1) de giberelina y citoquinina. Como fuente de giberelinas se utilizó Progibb con 10% de AG3 y como fuente de citoquininas se utilizó 6BAP a un 98%. Las soluciones se realizaron en agua destilada y desionizada con el fin de garantizar la pureza de la mezcla.
Se utilizó un diseño completamente al azar con siete tratamientos para cada clon Tab. 1). Cada tratamiento tuvo cinco repeticiones y la unidad experimental estuvo conformada por una plántula de cacao injertada.

Antes de aplicar los tratamientos, fueron seleccionadas 60 plántulas de cacao, con la misma edad desde germinación e injertadas en la misma fecha. Los tratamientos fueron
aplicados una vez, al inicio del experimento en la hoja del patrón con un atomizador. La aplicación se realizó a las 7 h para evitar las pérdidas de producto por evapotranspiración.
Se seleccionaron cinco plántulas de cada tratamiento que permanecieron durante 30 días después de la aplicación de las hormonas (dda); en estas plántulas se midieron cada 3 d las siguientes variables: número de hojas, diámetro y longitud del injerto. También se midió el largo y ancho de la hoja para luego calcular el área foliar (AF) del injerto mediante la ecuación 1.
Al final (30 dda), se midieron la masa fresca y seca de cada una de las cinco plántulas analizadas. Para el análisis de los datos se usó el software SAS® v. 8.1e. (SAS Institute Inc. Cary, NC), se realizó un Anava y la prueba de promedios de Tukey al 5%, para comparar tratamientos y concentraciones de cada hormona.
Resultados y discusión
Diámetro del injerto
En CCN51 se encontraron diferencias altamente significativas entre los tratamientos en los dos últimos días del experimento y también diferencias significativas y altamente significativas entre las concentraciones de citoquininas durante la mayoría de los días del experimento; la concentración de 10 mg L-1 mostró los valores más altos (Fig. 1A). ICS95 mostró diferencias altamente significativas el último día de medición (Fig. 1B).
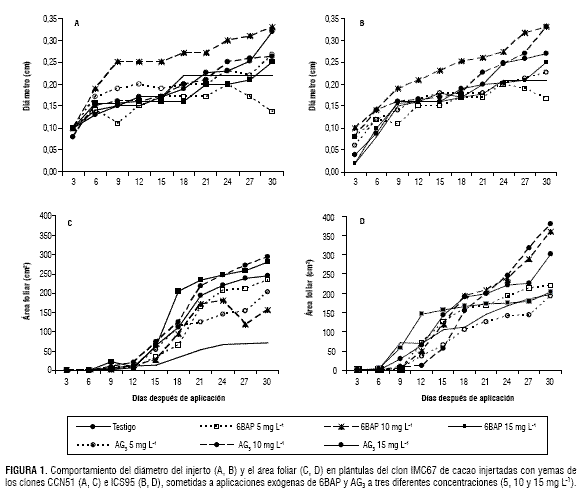
El testigo y el 6BAP en la concentración más baja (5 mg L-1) presentaron los menores diámetros de injerto en CCN51 e ICS95 (Fig. 1A y 1B). La concentración de 10 mg L-1 tanto e giberelinas como de citoquininas fue la mejor al mostrar un aumento constante del diámetro del injerto durante todo el ensayo.
Resultados similares se encontraron en soya (Glycine max) en lo que se refiere a los tratamientos con AG3, pero el efecto de las citoquininas en esta especie es distinto. El tratamiento con 100 mg L-1 de AG3 aplicado foliarmente a plantas de G. max contribuyó al aumento del diámetro del tallo, mientras que el tratamiento con 30 mg L-1 de citoquininas no muestra ningún efecto en el diámetro del tallo (Leite et al., 2003). En Helianthus annuus se observó el efecto contrario, la aplicación de Biogib (giberelina) redujo el diámetro tanto del tallo como del peciolo (Silva et al., 2001). Esto corrobora el hecho de que los efectos producidos por las giberelinas están influenciados por los cambios en la concentración de la hormona y la susceptibilidad del tejido vegetal (Ikeda et al., 2001).
Estos resultados sugieren que la aplicación tanto de citoquininas como de giberelinas contribuye de forma indirecta a una mejor nutrición del brote que se está desarrollando en el injerto, ya que el diámetro del peciolo es una característica que puede correlacionarse con el aporte de agua y minerales a la hoja y a la salida de savia elaborada (Silva et al., 2001). Esto podría sugerir, que además del efecto de las hormonas sobre la actividad celular, el aumento en el tamaño de tallos y hojas de los injertos, producto de la aplicación de hormonas, puede estar relacionado con un mejor aporte de nutrientes a estos órganos en comparación con los injertos que se desarrollan sin la aplicación exógena de reguladores de crecimiento.
En general, las giberelinas pueden acortar la interfase del ciclo celular ya que inducen la síntesis de DNA en células que se encuentran en la fase G1. Esto se ve reflejado en un mayor crecimiento de la zona meristemática debido al mayor número de células que entran en división celular con la aplicación de giberelinas (Azcón-Bieto y Talón, 2000;
Taiz y Zeiger, 2002).
Longitud del injerto
Entre los tratamientos no hubo diferencias estadísticas para la longitud del injerto para CCN51 como tampoco para ICS95. Las plántulas tratadas con AG3 a 10 y a 15 mg L-1 y con 6BAP a 10 mg L-1, presentaron los injertos más largos en ambos clones durante la mayor parte del experimento. El testigo mostró injertos más largos que los tratamientos de 6BAP a 5 y a 15 mg L-1 y de AG3 a 5 mg L-1 (Tab. 2), esta situación puede explicarse probablemente porque el contenido endógeno de estas hormonas es mayor o similar, por lo cual las aplicaciones exógenas no influyeron en la longitud.
Los injertos de ambos clones crecen rápidamente durante los nueve primeros dda, luego el crecimiento desacelera un poco hasta el día 18 cuando tiende a estabilizarse y sigue creciendo muy lentamente hasta el día 30. Este comportamiento es similar en todos los tratamientos con excepción de AG3 a 10 mg L-1 en el cual los injertos exhiben un crecimiento acelerado casi constante hasta el día 21 cuando tiende a estabilizarse (datos no reportados).
En G. max (Leite et al., 2003) y en Vigna unguiculata (Emongor, 2007) la aplicación foliar de AG3 contribuyó a aumentar la longitud de la planta y del primer nudo, mientras que la aplicación de citoquininas no afectó esta variable. Cabe anotar que las plantas de dichos ensayos no fueron cortadas o modificadas en su estructura.
Trabajos previos en injertos de Persea americana mostraron que dosis de 250 mg L-1 de BAP en plántulas con desbrote apical lograron un efecto positivo en el incremento porcentual del crecimiento de brotes de púas injertadas, sin embargo esto no ocurrió en plántulas sin desbrote apical (Rodríguez, 2003), lo cual concuerda con lo observado en los injertos CCN51 e ICS95.
En I. paraguariensis las aplicaciones de giberelinas AG1 y AG4 promovieron significativamente la producción de brotes de más de 5 mm de longitud, comparadas con el control, cuando se emplearon dosis de 5 mg L-1 y entre 1 y 5 mg L-1, respectivamente. Las dosis menores no fueron efectivas (Sansberro et al., 2000). Por otro lado, la aplicación de giberelinas en Citrus sp. a diferentes concentraciones incrementó significativamente la longitud del brote respecto al control (Ratna Babu y Lavania, 1985).
Número de hojas del injerto
Ningún clon presentó diferencias estadísticas en el número final de hojas, tampoco se presentaron significancias entre tratamientos, sin embargo, los valores más altos fueron
alcanzados con los tratamientos de giberelinas en los dos clones (Tab. 2).

El testigo en ambos clones muestra un comportamiento muy similar a los tratamientos durante las tres primeras semanas, pero después decae hasta alcanzar valores bajos comparados con la mayoría de tratamientos. Ambos clones muestran un aumento acelerado en la producción de hojas durante los nueve primeros días, que luego tiende a
estabilizarse entre el día 9 y el día 24. En los últimos días, el número de hojas en el clon CCN51 tiende a permanecer constante en las plántulas tratadas con AG3, mientras que
las plántulas que recibieron 6BAP muestran hojas secas, lo que disminuye el número de las mismas. Por el contrario, el clon ICS95 tiende a aumentar el número de hojas en las
plántulas de los tratamientos tanto de giberelinas como de citoquininas, cuando el injerto está por cumplir un mes de crecimiento.
En Phaseolus vulgaris (Castro et al., 1990) y en Vicia faba (Harb, 1992) se observó un aumento del número de hojas después del tratamiento con AG3. Sin embargo, los mismos resultados no fueron obtenidos en plantas de G. max (Leite et al., 2003) ni en plantas de Pisum sativum (Saimbhi et al., 1975). La respuesta a la aplicación exógena de hormonas puede estar relacionada también con las diferentes técnicas y tasas de aplicación (King et al., 2000), o con las características propias del cultivar (Nalawadi et al., 1973).
Al igual que con AG3, la aplicación de citoquininas en plantas de G. max cultivadas bajo óptimas condiciones no presentó ningún efecto sobre el número de hojas (Leite et al., 2003), mientras que en V. unguiculata la aplicación de AG3 aumenta el número de hojas por planta (Emongor, 2007) tal como ocurre con los injertos de cacao.
Área foliar
A pesar de no presentar diferencias estadísticas entre los tratamientos, el área foliar presentó diferencias entre las concentraciones de cada hormona para los 30 dda en CCN51 y del día 15 al 30 para ICS95. Esta variable presentó los valores más elevados con 10 mg L-1 de 6BAP y con 10 y 15 mg L-1 de AG3 para ICS95, mientras CCN51 mostró un mejor comportamiento con los tratamientos de 6BAP a 15 mg L-1 y AG3 a 10 y 15 mg L-1. Los demás tratamientos en cada uno de los clones presentaron comportamientos muy similares a los del testigo (Fig. 1C y 1D).
Los valores bajos de área foliar en el testigo se deben a un alto porcentaje de área foliar marchita en comparación con las hojas de los injertos tratados con giberelinas o citoquinininas. Al respecto, Romanko et al. (1969) reportan que la aplicación exógena de citoquininas retrasa la senescencia de hojas después de ser separadas del tallo y mantiene los cloroplastos fotosintéticamente activos por más tiempo. Los cloroplastos contienen enzimas para la biosíntesis de un grupo de citoquininas naturales, incluyendo bases, ribosidos, ribotidos y N-glucósidos (Benkova et al., 1999; Kasahara et al., 2004; Polanska et al., 2007). Sumado a lo anterior, Leite et al. (2003) reportan que el tratamiento de G. max con 100 mg L-1 de AG3 promueve el aumento del área foliar de las plantas.
Por otro lado, en Brassica oleracea las aplicaciones de AG3 y Bencilamina individuamente produjeron un aumento tanto del largo como del ancho de las hojas, lo cual se vio reflejado en el aumento del área foliar (Kato y Sooen, 1980).
Masa del injerto
La masa seca del injerto mostró diferencias significativas entre los tratamientos para el caso del clon CCN51, lo cual no ocurre en ICS95 donde los tratamientos fueron similares en masa seca. Para CCN51 el mejor tratamiento fue el de 10 mg L-1 de AG3 con un promedio de 3,22 g de masa fresca y 1,11 g de masa seca seguido por el tratamiento de 15 mg L-1 de 6BAP con 2,71 g de fresca y 0,97 g de seca. En contraste, el testigo alcanzó 2,01 g de masa fresca y 0,58 g de masa seca, siendo estos los valores más bajos (Fig. 2). Tanto en ICS95 como en CCN51 alcanzaron los valores más altos con el tratamiento de 10 mg L-1 de AG3 con 3,4 g en fresco y 0,82 g en seco y los valores más bajos fueron con 5 mg L-1 de 6BAP (1 g en fresco y 0,31 g en seco).

Los tratamientos con giberelinas exógenas mostraron ser efectivos al aumentar la masa seca de plantas de G. max (Leite et al., 2003) y de V. unguinculata (Emongor, 2007),
mientras que los tratamientos con citoquininas no mostraron efecto alguno sobre la masa de la primera especie (Leite et al., 2003). El efecto observado en este ensayo con
los injertos de cacao está influenciado por el hecho de que las plántulas presentaban desbrote apical lo cual, como ya se mencionó, puede mejorar los efectos causados por la
aplicación exógena de citoquininas.
A nivel general, estos resultados apoyan el postulado de que el crecimiento de la yema depende de la proporción hormonal antes que de niveles individuales (Bangerth, 2000; Valdés et al., 2003); el éxito en las variables en ningún caso fue proporcional a la concentración de la hormona aplicada, siendo los valores intermedios los que lograron los mejores resultados y sugiriendo que estos tratamientos son los que proporcionan un mejor balance hormonal para el crecimiento y desarrollo de las yemas de los injertos de cacao.
Las auxinas están implicadas en la regulación de la ramificación. Con las auxinas moviéndose en forma basipétala en el tallo principal, inhiben el crecimiento de las yemas axilares (Napoli et al., 1999). Leyser et al. (1993) y Lincoln et al. (1990) reportan que el gen AUXIN RESISTANT1 (AXR1), en Arabidopsis, confiere un defecto inicial en la transcripción regulada por las auxinas. Las mutaciones en este gen resultaron en un aumento de la ramificación del follaje y la resistencia a las auxinas del meristemo apical (Booker et al., 2003).
Además del papel principal de las auxinas, es claro que este regulador actúa indirectamente, ya que las axinas no entran en las yemas (Hall y Hillman, 1975; Morris, 1997) y la aplicación de auxinas directamente en las yemas no inhibe el crecimiento de las mismas (Brown et al., 1979). Sumado a esto, la expresión del tipo silvestre de gen AXR1 en el parénquima del xilema y en el tejido interfascicular del tallo es suficiente para restablecer el hábito de brotación propia del tipo silvestre en el mutante AXR1-12. Por lo anterior, las auxinas en el tallo pueden influir en el crecimiento de las yemas, a una determinada distancia (Bennett et al., 2006).
Parece ser que uno de los blancos de la ruta del gen AXR1 incluye genes codificantes para la biosíntesis de citoquininas (Nordstrom et al., 2004), esto puede reducir la disponibilidad de citoquininas en la yema y por lo tanto reducir la actividad de la yema (Bennett et al., 2006). Al respecto, se ha mostrado que las auxinas pueden regular la síntesis y exportación de citoquininas de la raíz (Ekölf et al., 1995) y su síntesis local en la parte aérea (Nordstrom et al., 2004), sugiriendo que las auxinas pueden actuar mediante la reducción del suplemento de citoquininas a las yemas y así inhibir su crecimiento (Bennett et al., 2006).
Para el caso de las plántulas de cacao, en el presente ensayo, el corte de las yemas apicales debió reducir el flujo basipétalo de auxinas en el tallo; por ende, la inhibición de esta hormona hubiera podido causar en la producción y el transporte de las citoquininas con un aumento en la brotación de yemas laterales. A pesar de esto, la regulación génica de la producción y actividad de las citoquininas posiblemente se mantuvo lo suficientemente fuerte para mantener bajos los niveles de esta hormona en la yema injertada, insuficientes para generar un crecimiento vigoroso de la misma; esto se ve reflejado en un menor desarrollo de las yemas sin aplicación exógena de citoquininas. Adicionalmente, el hecho de que la aplicación exógena de citoquininas revierta estos procesos y permita un crecimiento más rápido de las yemas sugiere un efecto directo sobre la cinética de crecimiento celular, y efectos indirectos sobre la nutrición.
Esta posible interacción hormonal puede entenderse mejor si se conoce el efecto que tiene el corte de la yema terminal sobre el desarrollo de la yema injertada cuando se aplican reguladores de crecimiento de forma exógena. En este ensayo no se conoce este efecto ya que todas las plantas utilizadas presentaban desbrote apical, lo cual es una práctica generalizada en el centro de investigación de Nataima.
Con respecto a la acción de las giberelinas, se encontró que la aplicación exógena de GA4-7 sobre yemas laterales y terminales de Pinus sylvestris no tuvo efecto cualitativo sobre la organización del meristemo apical, pero se observó un incremento en la actividad mitótica del ápice desde el primer día después de la aplicación. A las cuatro semanas de realizada la aplicación se observó un incremento en la longitud y de las dimensiones en general del domo apical (Hejnowicz, 1987).
El aumento observado en el diámetro de las yemas de cacao sugiere un mecanismo similar al ocurrido en P. sylvestris, el aumento en el crecimiento de las yemas observado al final del experimento pudo ser el resultado del aumento en la actividad mitótica inducido en un corto periodo después de la aplicación de AG3.
Conclusiones
La aplicación de la concentración de 10 mg L-1 de 6BAP mejoró el prendimiento de las yemas de cacao en cuanto al diámetro y la longitud del injerto, en tanto que la concentración de 15 mg L-1 promueve el aumento en el número de hojas, el área foliar total y la masa seca y fresca del injerto. La concentración de 10 mg L-1 de AG3 mostró los mejores resultados en los clones CCN51 e ICS95. Sin la aplicación de hormonas, las yemas del clon ICS95 desarrollan una mayor área foliar y una mayor masa fresca y seca que las yemas del clon CCN51; sin embargo, después de aplicar los tratamientos, los dos clones presentan valores similares. El efecto de la aplicación de 6BAP está influenciado por el hecho de que las plántulas utilizadas no presentaban meristemos apicales, presentando así una menor carga de auxinas.
Literatura citada
Azcón-Bieto, J. y M. Talón. 2000. Fisiología y bioquímica vegetal. McGraw Hill/Interamericana, Barcelona, España.
Ballester-Olmos, J.F. 2005. Reguladores del crecimiento para su uso en viveros. En: Ministerio de Medio Ambiente y Medio Rural y Marino, Gobierno de España, http://www.mapa.es/ministerio/pags/biblioteca/revistas/pdf_hortint%5Chortint_2005_E_96_103.pdf; consulta: marzo de 2010.
Bangerth, F., C.-J. Li y J. Gruber. 2000. Mutual interaction of auxin and cytokinins in regulating correlative dominance. Plant Growth Regul. 32, 205-217.
Benkova, E., E. Witters, W. Van Donger, J. Kolar, V. Motyka, B. Brzobohaty, H.A. Van Onckelen e I. Machaceková. 1999. Cytokinins in tobacco and wheat chloroplasts, occurrence and changes due to light/dark treatment. Plant Physiol. 121, 245-251.
Bennett, T., T. Sieberer, B. Willett, J. Booker, C. Luschnig y O. Leyser. 2006. The Arabidopsis MAX pathway controls shoot branching by regulating auxin transport. Curr. Biol. 16, 553-563.
Booker, J.P., S.P. Chatfield y H.M.O. Leyser. 2003. Auxin acts in xylem-associated or medullary cells to mediate apical dominance. Plant Cell 15, 495-507.
Brown, B.T., C. Foster, J.N. Phillips y B.M. Rattigann. 1979. The indirect role of 2,4-D in the maintenance of apical dominance in decapitated sunflower seedlings (Helianthus annuus L.). Planta 146, 475-480.
Castro, P.R.C., B. Appezzato, C. Lara, A. Pelissari, M. Pereira, M.J. Medina, A.C. Bolonhezi y J.A. Silveira. 1990. Ação de reguladores vegetais no desenvolvimento, aspectos nutricionais, anatômicos e na produtividade do feijoeiro (Phaseolus vulgaris cv. Carioca). Anais da ESALQ 47, 11-28.
Chory, J., D. Reinecke, S. Sim, T. Wasburn y M. Brenner. 1994. A role for cytokinins in de-etiolation in Arabidopsis. Plant Physiol. 104, 339-347.
Cline, M. 1994. The role of hormones in apical dominance. New approaches to an old problem in plant development. Plant Physiol. 90, 230-237.
Davies, P.J. 1995. The plant hormones: their nature, occurence and factors in plant physiology, biochemistry and molecular biology. 2a ed. Kluwer Academic Publishers, Ithaca, NY.
Emongor, V. 2007. Gibberellic acid influence on vegetative growth, nodulation and yield of cowpea (Vigna unguiculata L.) Walp.J. Agron. 6(4), 509-517.
Ekolf, S., C. Astot, J. Blackwell, T. Moritz, O. Olsson y G. Sandberg. 1995. Auxin/cytokinin interactions in wild-type and transgenic tobacco. Plant Cell Physiol. 38, 225-235.
Hall, S.M. y J.R. Hillman. 1975. Correlative inhibition of lateral bud growth in Phaseolus vulgaris L. timing of bud growth following decapitation. Planta 123, 137-143.
Harb, E.Z. 1992. Effect of soaking seeds in some growth regulators and micronutrients on growth, some chemical constituents and yield of faba bean and cotton plants. Bull. Fac. Agric., Cairo Univ. 43, 429-452.
Hejnowicz, A. 1987. Changes in the development of apical meristem of Pinus sylvestris in response to gibberellin application. For. Ecol. Manage. 19(1-4), 99-106.
Ikeda, A., M. Ueguchi-Tanaka, Y. Sonoda, H. Kitano, M. Koshioka, Y. Futsuhara, M. Matsuoka y J. Yamaguchi. 2001. Slender rice, a constitutive gibberellin response mutant, is caused by a null mutation of the SLR1 gene, an ortholog of the height regulating gene AGI/RAG/RHT/D8. Plant Cell 13, 999-1010.
Jiménez, G.E. 1998. Propagación vía organogénesis. Fase 0 o preparativa. Fase I: establecimiento o iniciación de los cultivos. p. 134. En: Curso Internacional de Propagación Masiva in Vitro de Especies Vegetales. Instituto Biotecnología de las Plantas. Santa Clara, Cuba.
Kasahara, H., K. Takei, N. Ueda, S. Hishiyama, T. Yamaya, Y. Kamiya, S. Yamaguchi y H. Sakakibara. 2004. Distinct isoprenoid origins of cis- and trans-zeatin biosyntheses in Arabidopsis. J. Biol. Chem. 279, 14040-14054.
Kato, T. y A. Sooen. 1980. Physiological studies on the head formation in cabbage. III. Role of terminal bud in the head formation posture. J. Japan. Soc. Hort. Sci. 48(4), 426-434.
King, R.W., H. Seto y R.M. Sachs. 2000. Response to gibberellin structural variants shows that ability to inhibit flowering correlates with effectiveness for promoting stem elongation of some plant species. Plant Growth Regul. 19, 8-14.
Kulaeva, O.N., E.A. Burhanova, N.N. Karavaiko, S.Y. Selivankina, S.A. Porfirova, G.G. Maslova, Y.V. Zemlyachenko y T. Börner. 2002. Chloroplasts affect the leaf response to cytokinin. J. Plant Physiol. 159, 1308-1316.
Kusnetsov, V.V., R.G. Herrmann, O.N. Kulaeva y R. Oelmüller. 1998. Cytokinin stimulates and abscisic acid inhibits greening of etiolated Lupinus luteus cotyledons by effecting the expression of the light-sensitive protochlorophyllide oxidoreductase. Mol. Gen. Genet. 259, 21-28.
Kusnetsov, V.V., M. Landsberger, J. Meurer y R. Oelmüller. 1999. The assembly of the CAAT-box binding complex at a photosynthesis gene promoter is regulated by light, cytokinin, and the stage of the plastids. J. Biol. Chem. 274, 36009-36014.
Kusnetsov, V.V., R. Oelmüller, M. Sarwat, S.A. Porfirova, G.N. Cherepneva, R.G. Herrmann y O.N. Kulaeva. 1994. Cytokinins, abscisic acid and light affect accumulation of chloroplast proteins in Lupinus luteus cotyledons, without notable effect on steady-state mRNA levels. Planta 194, 318-327.
Law, D.W. 1987. Gibberellin-enhanced indole-3-acetic acid biosynthesis: D-tryptophan as a precusor of indole-3-acetic acid. Physiol. Plant. 70, 626-632.
Leite, V.M., C.A. Rosolem y J.D. Rodrigues. 2003. Gibberellin and cytokinin effects on soybean growth. Sci. Agric. 60(3), 537-541.
Lerbs, S., W. Lerbs, N.L. Klyachko, E.G. Romanko, O.N. Kulaeva, R. Wollgiehn y B. Parthier. 1984. Gene expression in cytokinin - and light-mediated plastogenesis of Cucurbita cotyledons: ribulose-1,5-bisphosphate carboxylase/oxygenase. Planta 162, 289-298.
Leyser, H.M., C.A. Lincoln, C. Timpte, D. Lammer, J. Turner y M. Estelle. 1993. Arabidopsis auxin-resistance gene AXR1 encodes a protein related to ubiquitin-activating enzyme E1. Nature 364, 161-164.
Lincoln, C., J.H. Britton y M. Estelle. 1990. Growth and development of the axr1 mutants of Arabidopsis. Plant Cell 2, 1071-1080.
Morris, D.A. 1977. Transport of exogenous auxin in twobranched dwarf pea seedlings (Pisum sativum L.). Planta 136, 91-96.
Nalawadi, U.G., R. Prithvi y K. Krishnamurthy. 1973. Improvement in the seed germination of soybean varieties by pre-soaking treatments. Indian J. Agric. Sci. 43, 546-550.
Napoli, C.A., C.A. Beveridge y K.C. Snowden. 1999. Reevaluating concepts of apical dominance and the control of axillary branching. Curr. Top. Dev. Biol. 44, 127-169.
Nordstrom, A., P. Tarkowski, D. Tarkowska, R. Norbaek, C. Astot, K. Dolezal y G. Sandberg. 2004. Auxin regulation of cytokinin nbiosynthesis in Arabidopsis thaliana: a factor of potential importance for auxin-cytokinin-regulated development. Proc. Natl. Acad. Sci. USA 101, 8039-8044.
Palencia C., G.E., R. Gómez S., N.H. Díaz A., N. Contreras M. y J.A. Tolosa O. 2006. Rehabilitación de plantaciones de cacao. Corpoica, Estación Experimental La Suiza. Bucaramanga.
Polanska, L., A. Vicankova, M. Novakova, J. Malbeck, P.I. Dobrev, B. Brzobohaty, R. Vankova e I. Machackova. 2007.Altered cytokinin metabolism affects cytokinin, auxin, and abscisic acid contents in leaves and chloroplasts, and chloroplast ultrastructure in transgenic tobacco. J. Exp. Bot. 58, 637-649.
Ramírez, C.L. 2006. Producción de clones de cacao de calidad para el departamento del Huila. Manual Técnico Cacao 31. C.I. Nataima, Corpoica, El Espinal, Colombia.
Ratna Babu, G.H.V. y M.L. Lavania. 1985. Vegetative growth and nutritional status as influenced by auxins and gibberellic acid, and their effect on fruit yield in lemon. Scientia Hort. 26, 25-33.
Rease, J. y E. Burst. 1983. Increased yield and suppression of shoot growth and nute populations of d anjou pear trees with nitrogen and paclobutrazol. HortScience 18, 212-214
Rodríguez, A.C. 2003. Implementación de las técnicas de etiolación y acodo y microinjertación en paltos (Persea americana Mill.). Pontificia Universidad Católica de Valparaíso, Valparaíso, Chile.
Romanko, E.G., H.J. Hein, O.N. Kulaeva y A.A. Nichiporovich. 1969. Effect of cytokinin on the physiological activity of chloroplasts. Progr. Photosynth. Res. 1, 296-303.
Saimbhi, M.S., S.K. Arora e I.M. Chhibba. 1975. Influence of seed treatment with 2-chloroethylphosphonic acid, gibberellic acid, ascorbic acid, and simazine on growth and nutrient composition of pea (Pisum sativum L.) seedlings. Plant Soil 43, 697-699.
Sansberro, P.A., L.A. Mroginski y R.A. Bottini. 2000. Giberelinas y brotación de la Yerba Mate (Ilex paraguariensis St. Hill.). En: XI Reunión de Comunicaciones Científicas y Técnicas. Facultad de Ciencias Agrarias, Universidad Nacional del Nordeste. En: www.unne.edu.ar/Web/cyt/cyt/2000/5_agrarias/a_pdf/a_044.pdf; consulta: marzo de 2010.
Silva, M., H. Gámez, F. Zavala, B. Cuevas y M. Rojas. 2001. Efecto de cuatro fitoreguladores comerciales en el desarrollo y rendimiento del girasol. Ciencia UANL 4, 69-75.
Skoog, F. y C.O. Miller. 1965. Chemical regulation of growth and organ formation in plant tissues cultured in vitro. pp. 481-494. En: Bell, E. (ed.). Molecular and cellular aspects of development, Harper and Row, New York, NY.
Taiz, L. y E. Zeiger. 2002. Plant physiology. 3a ed. Sinauer Associates, Sunderland, MA.
Valdés, A.E., M.L. Centeno y B. Fernández. 2003. Changes in the branching pattern of Pinus radiata derived from grafting are supported by variations in the hormonal content. Plant Sci. 165, 1397-1401.
Yaronskaya, E., I. Vershilovskaya, Y. Poers, A.E. Alawady, N. Averina y B. Grimm. 2006. Cytokinin effects on tetrapyrrole biosynthesis and photosynthetic activity in barley seedlings. Planta 224, 700-709.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Copyright (c) 2010 Agronomía Colombiana

This work is licensed under a Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
© Centro Editorial de la Facultad de Ciencias Agrarias, Universidad Nacional de Colombia
Reproduction and quotation of material appearing in the journal is authorized provided the following are explicitly indicated: journal name, author(s) name, year, volume, issue and pages of the source. The ideas and observations recorded by the authors are their own and do not necessarily represent the views and policies of the Universidad Nacional de Colombia. Mention of products or commercial firms in the journal does not constitute a recommendation or endorsement on the part of the Universidad Nacional de Colombia; furthermore, the use of such products should comply with the product label recommendations.
The Creative Commons license used by Agronomia Colombiana journal is: Attribution - NonCommercial - ShareAlike (by-nc-sa)

Agronomia Colombiana by Centro Editorial of Facultad de Ciencias Agrarias, Universidad Nacional de Colombia is licensed under a Creative Commons Reconocimiento-NoComercial-CompartirIgual 4.0 Internacional License.
Creado a partir de la obra en http://revistas.unal.edu.co/index.php/agrocol/.



















