EXTRACCIÓN Y MEDIDA DE ACTIVIDAD DE PECTIN METIL ESTEARASA EN PITAYA AMARILLA (Acanthocereus pitajaya), ENZIMA RELACIONADA CON EL ABLANDAMIENTO
En diversas técnicas aplicadas para la conservación en fresco de la pitaya amarilla (Acanthocereus pitajaya) se ha encontrado que el ablandamiento excesivo de su corteza contribuye al deterioro de su calidad. Puesto que pectinmetilestearasa (PME) se ha vinculado con el ablandamiento de frutos este estudio se desarrolló con el objeto de determinar el efecto de la incorporación de los aditivos tritón X-100, NaCl y cisteína en buffer fosfatos 20 mM pH 7,0 sobre la cantidad de proteína extraída y sobre la actividad de PME. También se evaluó la necesidad de recu-rrir al proceso de diálisis en buffer fosfatos 20 mM pH 7,0. En la medida de actividad se pusieron a punto el tiempo de incubación, la concentración del cofactor NaCl, pH, temperatura y concentración de sustrato (pectina cítrica). Se encontró que el mejor sistema de extracción fue el compuesto por buffer fosfato 20 mM, pH 7,0 con concen-traciones de NaCl que pueden estar entre 0,0 a 1,0 M. La medida de actividad se puede realizar empleando pectina cítrica entre 0,40 a 0,75%, a valores de pH entre 5,0 a 8,0, con incubación a una temperatura entre 40 a 45 °C, durante 2,5 min.
Palabras claves: pectinmetilesterasa, pectina, ablandamiento, frutas, pitaya.
ABSTRACT Using diverse techniques applied to keep the freshness of yellow pitaya (Acanthocereus pitajaya) fruit it has been found that excessive softening of its crust leads to quality deterioration. Since pectinmethyl esterase (PME) has been related to fruit softening in this study we evaluated the protein levels and the PME activity after the addition of Triton X-100 1% and NaCl in concentrations from 0 to 2 M in buffer 20 mM phosphate pH 7.0. Effects of cysteine addition and dialysis were also evaluated for the extraction Acta biol. Colomb., Vol. 14 No. 2, 2009 73 - 82 processes. Factors that can affect the activity of PME such as incubation time, different NaCl concentration, as value level of pH during the incubation, temperature and pectin (citric pectin) concentration were evaluated. The best system found in this study for PME extraction was buffer phosphate 20 mM, pH 7.0 and NaCl from 0.0 to 1.0 M. The best system for the activity measurement is to use pectin from 0.40 to 0.75%, keep the pH between 5 and 8 and incubate from 40 to 45 °C during 2.5 min.
Key words: Pectinmetilesterase, pectin, softening, fruits, pitaya.
EXTRACCIÓN Y MEDIDA DE ACTIVIDAD DE PECTIN METIL ESTEARASA EN PITAYA AMARILLA (Acanthocereus pitajaya), ENZIMA RELACIONADA CON EL ABLANDAMIENTO
Extraction And Assay Of Pectinmethyl Esterase From Pitaya Amarilla (Acanthocereus pitajaya), Enzyme Vinculated To Softening
INGRID LILIANA CARABALÍ MIRANDA1, CARLOS EDUARDO NARVÁEZ CUENCA1, Profesor Asistente, LUZ PATRICIA RESTREPO SÁNCHEZ1*, Profesora Asociada. 1Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá, Colombia. cenarvaezc@unal.edu.co
* Correspondencia: lprestrepos@unal.edu.co Oficina 435, Teléfono: 316 50 00, ext. 14455.
Presentado 15 de agosto de 2008, aceptado 16 de junio de 2009, correcciones 27 de julio de 2009
RESUMEN
En diversas técnicas aplicadas para la conservación en fresco de la pitaya amarilla (Acanthocereus pitajaya) se ha encontrado que el ablandamiento excesivo de su corteza contribuye al deterioro de su calidad. Puesto que pectinmetilestearasa (PME) se ha vinculado con el ablandamiento de frutos este estudio se desarrolló con el objeto de determinar el efecto de la incorporación de los aditivos tritón X-100, NaCl y cisteína en buffer fosfatos 20 mM pH 7,0 sobre la cantidad de proteína extraída y sobre la actividad de PME. También se evaluó la necesidad de recurrir al proceso de diálisis en buffer fosfatos 20 mM pH 7,0. En la medida de actividad se pusieron a punto el tiempo de incubación, la concentración del cofactor NaCl, pH, temperatura y concentración de sustrato (pectina cítrica). Se encontró que el mejor sistema de extracción fue el compuesto por buffer fosfato 20 mM, pH 7,0 con concentraciones de NaCl que pueden estar entre 0,0 a 1,0 M. La medida de actividad se puede realizar empleando pectina cítrica entre 0,40 a 0,75%, a valores de pH entre 5,0 a 8,0, con incubación a una temperatura entre 40 a 45 °C, durante 2,5 min.
Palabras claves: pectinmetilesterasa, pectina, ablandamiento, frutas, pitaya.
ABSTRACT
Using diverse techniques applied to keep the freshness of yellow pitaya (Acanthocereus pitajaya) fruit it has been found that excessive softening of its crust leads to quality deterioration. Since pectinmethyl esterase (PME) has been related to fruit softening in this study we evaluated the protein levels and the PME activity after the addition of Triton X-100 1% and NaCl in concentrations from 0 to 2 M in buffer 20 mM phosphate pH 7.0. Effects of cysteine addition and dialysis were also evaluated for the extraction processes. Factors that can affect the activity of PME such as incubation time, different NaCl concentration, as value level of pH during the incubation, temperature and pectin (citric pectin) concentration were evaluated. The best system found in this study for PME extraction was buffer phosphate 20 mM, pH 7.0 and NaCl from 0.0 to 1.0 M. The best system for the activity measurement is to use pectin from 0.40 to 0.75%, keep the pH between 5 and 8 and incubate from 40 to 45 °C during 2.5 min.
Key words: Pectinmetilesterase, pectin, softening, fruits, pitaya.
INTRODUCCIÓN
La pitaya es el fruto de una planta rústica xerofítica de la familia de las cactáceas, originaria de América tropical. Fue observada por primera vez en forma silvestre por los conquistadores españoles en México, Colombia, Centroamérica y las Antillas, quienes le dieron el nombre de pitaya que significa fruta escamosa. En los mercados internacionales actualmente se comercializan la pitaya amarilla y la pitaya roja (Robayo, 2002). En la década de los 80 la pitaya amarilla (Acanthocereus pitajaya) adquirió una gran importancia como cultivo comercial en Colombia por ser considerada como una de las frutas exóticas del trópico, de sabor muy delicado y exquisito. Debido a la gran importancia de la pitaya como producto de exportación, algunos estudios se han enfocado en evaluar la influencia de las condiciones de almacenamiento sobre la calidad fisicoquímica, química y fisiológica del fruto (Arenas y Camero, 1995; Camargo y Moya, 1995; Robayo, 2002). De los anteriores estudios se evidencia que el ablandamiento, aunque necesario para lograr el máximo desarrollo sensorial, es uno de los factores que puede llegar a contribuir con el deterioro sensorial de ese fruto.
Los componentes principales que le confieren rigidez a los frutos están ubicados en la pared celular y son principalmente celulosa, hemicelulosa, pectina y lignina. Las pectinas corresponden al éster metílico del ácido (α-1,4) poligalacturónico con diversos grados de esterificación. La pectinmetilesterasa (PME, E.C. 3.1.1.11) cataliza la hidrólisis de los ésteres metílicos de pectina, por lo que disminuye su grado de esterificación, se reduce la adhesividad intracelular y la rigidez tisular (Abu-Goukh y Bashir, 2003; Wu et al., 2004; Deng et al., 2005; Pires y Finardi-Filho, 2005). Aunque la PME ha sido estudiada en una gran cantidad de frutas y hortalizas no hay reportes de esta enzima en pitaya amarilla. Para dar inicio al estudio de la participación de esta enzima en el ablandamiento de la corteza de pitaya amarilla es necesario desarrollar una metodología adecuada de extracción y medida de actividad en la que se obtenga una respuesta adecuada.
Al revisar en la literatura se encuentra que la extracción de este tipo de enzimas se efectúa en algunos casos recurriendo al uso de tritón X-100 en concentraciones que varían entre 0,5 a 1,5%, con cisteína como agente reductor (Payasi y Sanwal, 2003) y en otros al uso de NaCl en concentraciones entre 1 y 2 M (Ali et al., 2004; Van Dijk et al., 2005). Al momento de efectuar la cuantificación existen dos tendencias claras: una en donde la mezcla de reacción se incuba durante un periodo de tiempo, posteriormente la enzima se inactiva y por último se titulan los protones liberados por la acción catalítica con NaOH o se hace lectura espectrofotométrica del metanol generado (Maldonado y Strasser, 1998; Raposo y Finardi-Filho, 2005). La otra, consiste en mantener el pH constante durante la reacción por adición permanente de NaOH (Pressey y Woods, 1992; Warrilow y Jones, 1995; Abu-Goukh y Bashir, 2003; Wu et al., 2004; Deng et al., 2005). Para medir la actividad de esta enzima se reportan diferentes valores de pH, por lo general básicos o cercanos a la neutralidad: desde pH 6,5 para PME extraída de la fracción comestible de tallos de chayote (Sechium edule Swartz), producto comercializado en Taiwán (Wu et al., 2004) hasta pH 7,4 para la extraída de durazno (Prunas persica, cv. Hermoza; Zhou et al., 2000). Algunos trabajos evalúan, además, el efecto de diferentes valores de pH sobre la medida de actividad, por lo que se pueden ubicar los intervalos de pH de máxima actividad: entre 7,0 hasta 8,0 para PME extraída de arracacha (Arracacia xanthorriza B.; Pires y Finardi-Filho, 2005), y entre 7,5 y 9,0 para tres iso-PME extraídas de tomate (Lycopersicon esculentum, variedad Ailsa Craig; Warrilow y Jones, 1995). De otro lado, para PME purificada de papa se reporta un pH óptimo de 7,5 (Puri et al., 1982).
Las temperaturas y tiempos de incubación suelen ser diferentes: desde 22 °C para tres iso-PME extraídas de tomate, sin reportar tiempos de incubación (Warrilow y Jones, 1995), 25 °C durante 5 min para dos iso-PME extraídas de tomate (Pressey y Woods, 1992) hasta 35 °C por 10 min para PME extraída de uvas (Vitis vinifera L., variedad Labrusca L.; Deng et al., 2005). En chayote (Wu et al., 2004) y en papa (Puri et al., 1982) tras estudiar diferentes temperaturas de incubación se llegó a una óptima de 60 y 55 °C, respectivamente.
Se ha encontrado que existe un efecto de la concentración de NaCl en la mezcla de reacción. Así, en tomate, se encontró que la actividad de tres iso-PME es máxima a concentraciones de NaCl de 30, 150 y 150 mM (Warrilow y Jones, 1995) y para PME extraída de chayote la actividad es máxima cuando la concentración de NaCl en la mezcla de reacción es 200 mM (Wu et al., 2004). Algunos autores, fijan ciertos valores de NaCl en la mezcla que suelen ir desde 0 mM para PME extraída de guayaba (Psidium guajava L.; Abu-Goukh y Bashir, 2003) hasta 257 mM en la mezcla de reacción para PME de durazno (Zhou et al., 2000). Las concentraciones de pectina suelen ir desde 0,16% (Pressey y Woods, 1992) hasta 0,8% (Zhou et al., 2000; Abu-Goukh y Bashir, 2003). Durante la revisión de los anteriores reportes se encuentra que existen también diferencias en los tiempos de extracción, valores de pH a los cuales se hace la extracción, diferentes sistemas buffer para lograr un mismo pH, entre otros. Una vez expuestos algunos de los parámetros que se suelen fijar al momento de medir la actividad de la PME se evidencia que no existen valores universales para la extracción ni para medida de actividad de esta enzima. El presente trabajo tiene como objetivo evaluar algunas condiciones para extracción y medida de actividad de PME, enzima que puede estar relacionada con el ablandamiento de la corteza de pitaya amarilla.
MATERIALES Y MÉTODOS
MATERIAL VEGETAL
Los frutos de pitaya amarilla (Acanthocereus pitajaya) fueron adquiridos en mercados locales en la ciudad de Bogotá, Colombia; en estado de maduración 4 (Camargo y Moya, 1995). Éste corresponde a un fruto de color amarillo con las brácteas ligeramente verdosas con llenado parcial. Se seleccionaron frutos que no presentaran daños biológicos ni mecánicos en su corteza.
TÉCNICA GENERAL DE EXTRACCIÓN
Se tomaron 5,0 g de la corteza de la pitaya los cuales fueron homogenizados con 25 mL de acetona a -8 ºC y se filtraron. El residuo se lavó dos veces con 25 mL de acetona. La masa resultante de la filtración fue suspendida en 25 mL del buffer de extracción (fosfatos 20 mM, NaCl 1 M, pH 7,0) y colocada en agitación a 2 ºC por 24 h. Terminado este tiempo se procedió a centrifugar a 8.000 x g durante 30 min a 4 ºC. El residuo sólido fue desechado y en el sobrenadante se efectuó la cuantificación de proteína y la medida de actividad de PME.
PARÁMETROS EVALUADOS EN LA EXTRACCIÓN
Se evaluó el efecto del tipo de extractante, para lo cual se estudiaron dos efectos: la acción de la fuerza iónica del NaCl en concentraciones entre 0 a 2,0 M y el efecto detergente del tritón X-100 al 1%, sobre la proteína extraíble y la actividad enzimática. Se evaluó la necesidad del uso de cisteína 20 mM como agente reductor y de la diálisis. Los extractos que contenían tritón fueron dializados de manera exhaustiva para evitar su interferencia en la medida de proteína.
CUANTIFICACIÓN DE PROTEÍNA
Se utilizó el método de Bradford linealizado, con BSA como estándar (Zor y Selinger, 1996).
TÉCNICA GENERAL DE MEDIDA DE ACTIVIDAD ENZIMÁTICA
Se elaboró una mezcla de reacción de 25 mL, la cual contenía 2,5 mL de extracto enzimático, pectina cítrica al 1,0% (7,1% metoxilo, Sigma®) y NaCl 0,2 M a pH 7,0 en la mezcla, ajustado con NaOH. Se incubó a 37 ºC y al cabo de 10 min se detuvo la reacción enzimática por ebullición al baño maría durante 10 min. La actividad de la PME fue determinada por cuantificación de los protones liberados en la hidrólisis por titulación con NaOH 0,01M. Para esto se midió el volumen de base necesaria para ajustar el pH nuevamente a 7,0. Se realizaron blancos de sustrato y de extracto, en los cuales se mantuvieron las mismas condiciones de incubación y de cuantificación que en la mezcla de reacción. La técnica de medida fue modificada cada vez que se establecía un parámetro. Una unidad de actividad de PME (UPME) fue definida como los meq H+ generados/ hora y, la actividad especifica como los meq H+ generados/hora/mg de proteína extraída. En algunos casos, la actividad enzimática fue expresada como los meq H+ generados/hora/g de corteza.
PARÁMETROS EVALUADOS EN LA MEDIDA DE ACTIVIDAD
Se evaluó el efecto de la concentración de NaCl durante la reacción enzimática desde 0,0 hasta 0,4 M en la mezcla de reacción. Para el ensayo de 0,0 M de NaCl los extractos fueron dializados. Se ensayaron dos maneras de cuantificar la actividad de PME, ambas por titulación ácido-base, en períodos de tiempo que variaron entre 2,5 y 60 min. En la primera de ellas se incubó la mezcla de reacción durante periodos de tiempo que variaron entre 0 a 60 min, posteriormente se inactivó por ebullición al baño maría y por último se tituló con base (como se describe en la técnica general de medida de actividad). En la segunda, se mantuvo el pH constante durante el transcurso de la reacción por adición permanente de NaOH 0,01 M. Al determinar el mejor tiempo de incubación se realizó un tercer ensayo, en condición amortiguadora de pH. Se evaluó el efecto del pH, a través de la primera técnica, sobre la actividad enzimática a valores comprendidos entre 4,0 y 9,0. También se investigó el efecto de la temperatura, en un intervalo comprendido entre 0 a 80 °C. Por último, se evaluó el efecto de la concentración de pectina en un intervalo comprendido entre 0,05 a 1,50%.
ANÁLISIS DE DATOS
Para la puesta a punto de cada parámetro de extracción y de medida de la actividad se realizaron tres extracciones de un número igual de frutos. De cada extracto se efectuaron dos medidas de proteína y de actividad enzimática. Así, para el cálculo de cada promedio se contó con seis determinaciones. Sobre los resultados obtenidos se efectuaron los ANDEVA respectivos y se compararon las diferencias entre promedios por la prueba de Tuckey.
RESULTADOS
Parámetros evaluados en la extracción. En la tabla 1 se muestran tanto el efecto del aditivo adicionado en la solución extractante, así como el efecto de la concentración del NaCl sobre la proteína extraída y la actividad enzimática. Cuando al buffer de extracción se adicionó tritón X-100 se logró una mayor extracción de proteína a la alcanzada cuando se empleó NaCl. De otro lado, la adición de cisteína, empleada en ciertos casos para proteger los grupos sulfidrilos de las proteínas (Payasi y Sanwal, 2003), no resultó ser un factor determinante ni en la cantidad de proteína extraída, ni en la actividad de la enzima de la corteza del fruto.

Al evaluar el efecto del tipo de extractante sobre la actividad de PME (referida a g de corteza o a mg proteína) se observa que con el NaCl se logra una mayor respuesta que con tritón X-100, excepto en el extracto con tritón X-100 dializado, en el que la actividad referida a g de corteza es significativamente igual a los tratamientos en los que se empleó NaCl. En el extracto obtenido con NaCl no se observa cambio significativo tras la diálisis, mientras que en el extracto obtenido con tritón X-100 hay un incremento significativo en la respuesta después de la diálisis. De otro lado, no se observó un efecto significativo de la presencia de cisteína en el medio de extracción sobre la actividad enzimática. En la tabla 1 también se puede apreciar una tendencia al incremento de la solubilización de proteínas al aumentar la concentración de NaCl. Se observa que la actividad enzimática permanece, en general, estadísticamente invariable a concentraciones inferiores a 1,0 M de NaCl con una disminución importante en 2,0 M. Al final de estos ensayos, se consideró que el mejor buffer de extracción es el que utiliza como herramienta la fuerza iónica: buffer fosfato de sodio 20 mM, NaCl 1,0 M, pH 7,0 sin cisteína.
PARÁMETROS EVALUADOS EN LA MEDIDA DE ACTIVIDAD
En las figuras 1A y 1B se observan los datos de actividad en función del tiempo de reacción, en A cuando no se mantiene constante el pH durante el transcurso de la reacción y en B cuando se mantiene invariable el pH por adición constante de NaOH. En ellas se ve claramente cómo la actividad específica de la PME, en ambos casos, disminuye con respecto al tiempo de incubación. Sin embargo, la actividad obtenida tras la aplicación del primer método es superior a la que se obtiene por el segundo. Nose muestran tiempos menores de incubación debido a que las lecturas arrojaban unadispersión en extremo alta. Al evaluar la actividad enzimática manteniendo el pHamortiguado se halló que este método arroja un resultado significativamente igual alque se obtiene cuando el pH se mantiene constante por adición permanente de NaOH(datos no mostrados). Para los siguientes ensayos se decidió continuar con la medidade actividad enzimática sin controlar el pH durante el transcurso de la reacción, peroincubando ya no durante 10 min sino durante 2,5 min.
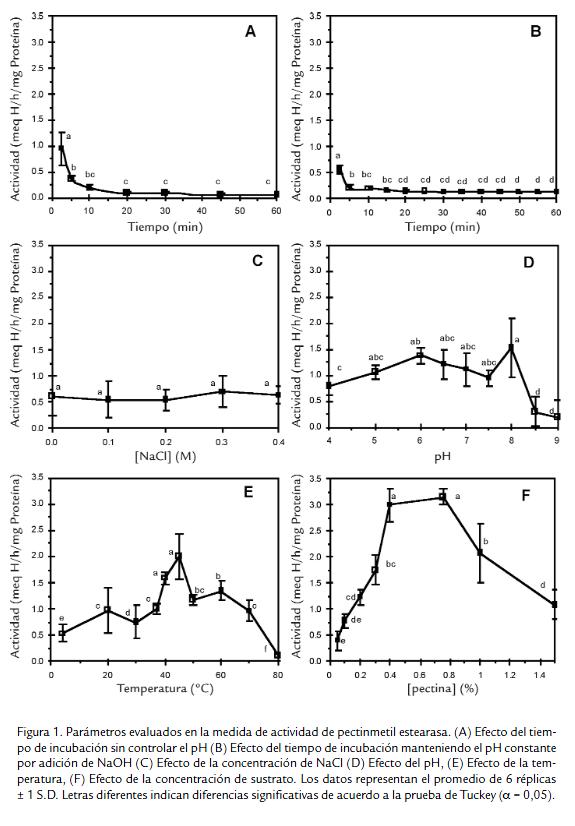
El NaCl evaluado como cofactor de la PME no mostró un efecto significativo de estafuente de variación sobre la actividad catalítica (Fig. 1C). En la figura 1D se puedeobservar el efecto del pH inicial sobre la actividad; a valores de pH comprendidosentre 5,0 y 8,0 la actividad es significativamente igual al máximo obtenido a pH 8,0.De la figura 1E se obtiene que la mejor temperatura para la PME, a pH 8,0 y 0,2 Mde NaCl, es 45 °C; además, se logra la inactivación total de la enzima en 80 °C. Alevaluar el efecto de la concentración de sustrato (Fig. 1F) sobre la actividad de PMEse observa un comportamiento creciente de la actividad conforme la concentraciónse incrementa desde 0 hasta 0,75% y la actividad empieza a disminuir a partir de esevalor. De esta gráfica se evidencia que la mejor concentración de pectina para evaluarla actividad no es 1,00% como se venía trabajando sino que está entre 0,40 % y 0,75%.Al efectuar la linealización de los anteriores datos se encontró un valor de KMaparente de 20,3 mM de metoxilo, o de 8,87 mg/ml de pectina cítrica y un valor deVMAX aparente de 1,90 meq H+/h.
DISCUSION
Durante la extracción fueron ensayados dos aditivos ampliamente utilizados para laextracción de enzimas relacionadas con ablandamiento. Aunque con tritón X-100 seTratamiento logró una alta extracción de proteínas, la extracción con NaCl proporcionó una actividad específica mucho mas alta de la enzima en estudio. Además, fue clara la inhibición que sobre la actividad de PME ejerció el tritón X-100.
En este estudio se encontró que la actividad de PME obtenida cuando el buffer no contenía NaCl fue estadísticamente igual a la obtenida cuando en el medio la concentración de esta sal era 1 M. Puesto que esta sal, podría afectar, no sólo la extracción sino también la actividad enzimática, en todos los casos la cantidad de NaCl en la mezcla se reacción fue siempre la misma: 200 mM. Auque ensayos posteriores mostraron que no había efecto de la cantidad de NaCl presente en el medio de reacción, en trabajos realizados sobre tres iso-PME extraídas de tomate (Warrilow y Jones, 1995) se reporta que éstas requieren de concentraciones de 50, 200 y 200 mM de NaCl, respectivamente, para manifestar su actividad óptima y que si en la mezcla de reacción la concentración de NaCl supera estos valores se produce inhibición competitiva. En chayote y en papaya se reporta que la concentración óptima de NaCl para la actividad de PME está también en 200 mM y que a concentraciones superiores la actividad se ve inhibida (Fayyaz et al., 1995; Wu et al., 2004).
La fuerza iónica se ha conocido como un factor que afecta la actividad de PME, además se ha determinado que cada isoforma de la enzima podrá requerir una concentración de NaCl distinta para alcanzar un nivel de actividad óptimo (Pressey y Avants, 1972; Warrilow y Jones, 1995). Esto es explicado de la siguiente forma: para la hidrólisis del grupo éster del ácido galacturónico la PME debe producir un complejo enzima-sustrato catalíticamente activo, pero a ciertos valores de pH se pueden originar cargas positivas en la PME que producen un complejo no específico catalíticamente inactivo debido a fuerzas electrostáticas, el efecto activante ejercido por los cationes consiste en proteger las cargas negativas de la pectina y así reducir la formación de complejo inactivo. Esto es ratificado por Warrilow y Jones, 1995, donde al reducir la concentración de la pectina disminuye también la concentración óptima de NaCl. Del trabajo en mención también hay que resaltar el efecto de inhibición que puede llegar a tener esta sal en altas concentraciones.
El valor de pH al que se logró la máxima actividad de PME coincide con el reportado para esta enzima extraída de papaya (Fayyaz et al., 1995) y de durazno (Javeri y Wicler, 1991). El pH 8,0 no es un valor muy alejado de algunos otros reportados, ya que se encontró para PME purificada de banano un pH óptimo de 7,0 a 0,117 M de NaCl (Ly et al., 2002), en enzima purificada de manzanas un pH mayor a 7,5 (Denés et al., 2000) y en un rango de pH 6,5-7,5 (Lee y Wiley, 1970). Además, se reporta para PME parcialmente purificada de papas un pH óptimo de 7,5 (Puri et al., 1982). En cuanto a los valores de las temperaturas adecuadas para la medida de actividad de PME se reporta un valor de 55 °C para PME parcialmente purificada de papas (Puri et al., 1982) y 65 °C para PME extraída de papaya (Fayyaz et al., 1995).
En cuanto al valor de KM obtenido para PME de pitaya amarilla no se puede hacer una comparación muy amplia con los valores de las constantes reportadas en la literatura ya que estas últimas son generalmente de otros frutos, pectinas de diferente fuente, enzimas purificadas y/o isoenzimas. Así, para tres isoenzimas de PME extraídas y purificadas de tomate (Warrilow y Jones, 1995) se hallaron valores de KM de 0,14, 0,14 y 6,5 mM metoxilo, usando como sustrato pectina de manzana y una concentración 200 mM de NaCl. Para PME purificada de banano (Ly et al., 2002) se reporta un valor de KM de 0,151 mg/mL de pectina de manzana cuyo grado de esterificación (DE) era 75%, a 0,117 M NaCl, pH 7,0 y 35 ºC. Finalmente, en PME de naranja (Christensen et al., 1998) se reporta un valor de KM de 0,7 mg/mL para pectina cítrica (DE 70%) y 17 mg/mL para pectina con DE de 25%.
El valor relativamente alto de KM obtenido en el presente trabajo indica que la enzima no es muy afín con la pectina cítrica, pero esta no es razón para afirmar que la PME no sea una enzima de gran influencia sobre el ablandamiento de corteza de pitaya amarilla (Acanthocereus pitajaya), ya que se ha observado (Warrilow y Jones, 1995) que la desesterificación del ácido galacturónico permite que la poligalacturonasa rompa más fácilmente los enlaces glucosídicos de dicho ácido solubilizando la pectina del tejido y por tanto reduciendo la firmeza del mismo, por tal razón una leve hidrólisis puede desencadenar o agilizar la acción de la poligalacturonasa. Además, es cierto que los valores de KM dependen del grado de metoxilación de la pectina empleada, del pH, concentración de NaCl, temperatura, entre otros (Fayyaz et al., 1995; Warrilow y Jones, 1995).
CONCLUSIONES
En conclusión, tras los experimentos efectuados se encontró que NaCl es un extractante más eficiente que tritón X-100. Como sistema de extracción se puede emplear buffer fosfatos 20 mM pH 7,0 con NaCl a concentración igual o inferior a 1M, sin necesidad de emplear ni cisteína ni diálisis. Si por el contrario se emplea tritón X-100, es necesario dializar pues éste actúa como inhibidor. Para la medida de actividad de PME se encontró que NaCl en la mezcla de reacción no afecta la respuesta en un intervalo entre 0 y 0,4
M. Puesto que la actividad disminuye considerablemente al transcurrir el tiempo de incubación se recomienda incubar por 2,5 min sin controlar el pH durante la incubación. El pH inicial de la mezcla de reacción se puede fijar entre 5,0 a 8,0. La temperatura de incubación puede estar entre 40 y 45 °C y la concentración de pectina entre 0,40 a 0,75%.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento a la Universidad Nacional de Colombia por el apoyo brindado para la ejecución de esta investigación.
BIBLIOGRAFÍA
ABU-GOUKH AA-B, BASHIR HA. Changes in pectic enzymes and cellulase activity during guava fruit ripening. Food Chem. 2003;83:213-218.
ALI ZM, CHIN L-H, LAZAN H. A comparative study on wall degrading enzymes, pectin modifications and softening during ripening of selected tropical fruits. Plant Sci. 2004;167:317-327.
ARENAS CL, CAMERO LF. Influencia del dióxido de carbono en la inhibición de los daños por frio de la pitaya amarilla (Acanthocereus pitajaya) [trabajo de grado]. Bogotá: Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia; 1995.
CAMARGO AE, MOYA OM. Estudio preliminar de la influencia del choque térmico en la inhibición de daños por frío en la pitaya amarilla (Acanthocereus pitajaya) [trabajo de grado]. Bogotá: Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia; 1995.
CHRISTENSEN TMIE, NIELSON JE, KREIBERG JD, RASMUSSEN P, MIKKELSEN JD. Pectin methyl esterase from orange fruit: characterization and localization by in-situ hybridization and immunohistochemistry. Planta. 1998;206:493-503.
DENG Y, WU Y, LI Y. Changes in firmness, cell wall composition and cell wall hydrolases of grapes stored in high oxygen atmospheres. Food Res Intern. 2005;38:769-776.
FAYYAZ A, ASBI BA, GHAZALI HM CHE-MAN YB, JINAP S. Kinetics of papaya pectinesterase. Food Chem. 1995;53:129-135.
JAVERI H, WICKER L. Partial purification and characterization of peach pectinesterase. J Food Biochem. 1991;15:241-252.
LEE YS, WILEY RC. Measurement and partial characterization of pectinesterase in apple fruits. J Am Soc Hortic Sci. 1970;95:465-468.
LY B, LOEY A, FACHIN D, VERLENT I, HENDRICKX I. Purification, characterization, thermal, and high-pressure inactivation of pectin methylesterase from bananas (cv Cavendish). Biotechnol Bioeng. 2002;78:683-691.
MALDONADO MC, STRASSER DESAM. Production of pectinesterase and polygalacturonase by Aspergillus niger in submerged and solid state systems. J Ind Microbiol Biotechnol. 1998;20:34-38.
PAYASI A, SANWAL GG. Pectate lyase activity during ripening of banana fruit. Phytochemistry. 2003;63:243-248.
PIRES RTC, FINARDI-FILHO F. Extraction and assay of pectin enzymes from Peruvian carrot (Arracacia xanthirrizaBancroft). Food Chem. 2005;89:85-92.
PRESSEY R, AVANTS J. Multiple forms of pectinesterase in tomatoes. Phytochemistry. 1972;11:3139-3142.
PRESSEY R, WOODS FM. Purification and properties of two pectinesterases from tomatoes. Phytochemestry. 1992,31:1139-1142.
PURI A, SOLOMOS T, KRAMER A. Partial purification and characterization of potato pectinesterase. Food Chem. 1982;8:203-213.
RAPOSO PTC, FINARDI-FILHO F. Extraction and assay of pectin enzymes from Peruvian carrot (Arracacia xanthirriza Bancroft). Food Chem. 2005;89:85-92.
ROBAYO MP. Estudio de la influencia de atmósferas modificadas pasivas y del grado de madurez inicial en el tiempo de conservación de pitaya amarilla (Selinicereus megalanthus Shuman) [trabajo de grado]. Bogotá: Facultad de Agronomía. Universidad Nacional de Colombia; 2002.
VAN DIJK C, BOERIU C, STOLLE-SMITS T, TIJSKENS LMM. The firmness of stored tomatoes (cv. Tradiro). 2. Kinetic and near infrared models to describe pectin degrading enzymes and firmness loss. J Food Eng. 2006;77:585-593.
WARRILOW A, JONES M. Different forms of tomato pectinesterase have different kinetic properties. Pythochemistry. 1995;39:277-282.
WU M, CHEN Y, HWANG J, LEE B, CHANG H. Transacylation of citrus pectin as catalyzed by pectinesterase from tendril shoots of chayote [Sechium edule (Jacq.) Swartz]. Food Res Intern. 2004;37:759-765.
ZOR T, SELINGER Z. Linealization of the Bradford protein assay increases its sensitivity: Theorical and experimental studies. Anal Biochem. 1996;236:302-308.
ZHOU H, BEN-ARIE R, LURIE S. Pectin esterase, polygalacturonase and gel formation in peach pectin fractions. Pythochemistry. 2000;55:191-195.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2009 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).




















