Producción in vitro de antocianinas - revisión
Palabras clave:
cultivos celulares, cultivo de tejidos, inductores, pigmentos, precursores (es)PRODUCCIÓN in vitro DE ANTOCIANINAS - REVISIÓN
In Vitro Production of Anthocyanins - A Literature Review
JAVIER GÓMEZ-ZELEDÓN1, B.Sc.; VÍCTOR M. JIMÉNEZ1, Ph.D.; 1CIGRAS, Universidad de Costa Rica, 2060 San Pedro, Costa Rica. Teléfono: (506) 2 511 34 30. Fax: (506) 2 511 43 46. victor.jimenez@ucr.ac.cr
Presentado 24 de diciembre de 2009, aceptado 22 de junio de 2010, correcciones 2 de febrero de 2011.
RESUMEN
La producción de metabolitos secundarios en cultivos celulares de plantas puede ser de interés para obtener compuestos difíciles de sintetizar o aislar de otras fuentes, lo cual generalmente se relaciona con un alto valor económico, aunque también puede ser útil para ayudar a dilucidar las vías metabólicas involucradas en la síntesis de estos compuestos. En este trabajo se presenta una descripción general de las antocianinas, un grupo de pigmentos de gran importancia para la industria, complementada con la referencia de los trabajos científicos recientes que se han publicado sobre la producción in vitro de las mismas. Con relación a esto último, se hace una descripción del efecto de cambios en las condiciones de cultivo, de la adición de precursores, del uso de reguladores de crecimiento, así como de la utilización de inductores y factores de estrés sobre la producción de estos compuestos. Finalmente, se hace mención al uso de raíces en cabellera, en inglés hairy roots, obtenidas mediante el uso de Agrobacterium rhizogenes, para la producción de estos compuestos.
Palabras clave: cultivos celulares; cultivo de tejidos; inductores; pigmentos; precursores.
ABSTRACT
The production of secondary metabolites in plant cell cultures may be of interest for obtaining compounds that are difficult to synthesize or isolate from other sources, which is usually associated with high economic value of the substances, but may also be useful to help elucidating the metabolic pathways involved in the synthesis of such compounds. This paper presents a general description of anthocyanins, a group of pigments of great importance to the industry, complemented by referring the scientific papers that have been recently published on their in vitro production. Regarding the latter, a description of the effect of changes in growing conditions, of the addition of precursors, of the use of growth regulators, and of the utilization of elicitors and stressors on the production of these compounds, is done. Finally, this review mentions the use of hairy roots obtained by the use of Agrobacterium rhizogenes for the production of these compounds.
Key words: cell cultures; elicitors; pigments; precursors; tissue culture.
INTRODUCCIÓN
Los pigmentos, sustancias químicas que dan color, están presentes en prácticamente todos los organismos. El color se produce cuando una molécula específica (cromóforo) captura la energía de ciertas longitudes de onda y refleja la energía no absorbida, la cual es recibida por el ojo, generando el impulso nervioso, que en el cerebro es interpretado como un color determinado (Delgado-Vargas et al., 2000).
La gran diversidad de colores presente en flores y frutos muestra la importancia ecológica que tienen los pigmentos en la naturaleza. Es bien conocido el hecho de insectos, aves y mamíferos, en su búsqueda de una fuente de alimento, se ven atraídos hacia las flores gracias a las tonalidades que estas poseen (Chittka y Menzel, 1992; Sumner et al., 2005). Asimismo, los pigmentos se ven involucrados en la dispersión de frutos al funcionar como atrayentes para los dispersores (Willson y Whelan, 1990). Además, los pigmentos también pueden actuar como sustancias de defensa contra la herbivoría (Gronquist et al., 2001), especialmente en hojas jóvenes (Karageorgou y Manetas, 2006), como protección contra hongos patógenos (Lachman y Hamouz, 2005) y como protección contra la radiación ultravioleta (Stafford, 1994).
Las antocianinas son pigmentos solubles en agua, ampliamente distribuidos en las plantas vasculares. Estos pigmentos son responsables de la mayoría de los colores rojos, naranjas y azules de las flores, y se derivan de una rama de la vía de los flavonoides (Grotewold, 2006). Las antocianinas poseen un esqueleto de 15 carbonos, con un anillo cromático y otro aromático, y una o más moléculas de azúcar adheridas en diferentes posiciones hidroxiladas de la estructura básica. Esto les confiere una infinidad de posibles combinaciones con glucósidos y grupos acil, lo que, junto con la interacción con otras moléculas, hace que la gama de colores que se derivan de estas sustancias sea enorme (Delgado-Vargas et al., 2000).
A pesar de que en algunos casos ha sido posible observar una correlación entre el grupo taxonómico al que pertenecen las plantas y los patrones de antocianinas (Sharma y Crowden, 1974), esta es una característica muy variable, ya que incluso se ha observado que dentro de variedades de una misma especie, los patrones y las concentraciones de los pigmentos presentan gran diversidad (Gao y Mazza, 1995). Por esta razón, no se les considera un carácter con mucho valor taxonómico (van Wyk et al., 1997). Las antocianinas están presentes en la gran mayoría de plantas, incluyendo algunos musgos y helechos; sin embargo, se encuentran ausentes en algas, hepáticas y otras vasculares inferiores (Delgado-Vargas et al., 2000). Sólo un pequeño grupo de angiospermas (Caryophylalles) no tiene este tipo de pigmentos, pues posee un grupo de pigmentos equivalente, betalaínas, y nunca se han encontrado ambos pigmentos en una misma planta (Stafford, 1994). Hasta la fecha se han identificado más de 600 compuestos químicos catalogados como antocianinas, considerados de particular interés para la industria de colorantes para alimentos (Konczak y Zhang, 2004; Sajilata y Singhal, 2006). Este interés ha ido en aumento (Zhang y Furusaki, 1999), tanto por su alta capacidad antioxidante (Kong et al., 2003; Prior, 2003; Einbond et al., 2004), como por su capacidad para eliminar radicales libres (Wang et al., 1997; Espín et al., 2000), teniendo así efectos benéficos múltiples sobre la salud, atribuyéndoseles incluso propiedades anti-cancerígenas (Satué-Gracia et al., 1997; Stintzing y Carle, 2004; Zhao et al., 2004).
Los cultivos celulares in vitro son capaces de producir y acumular muchos metabolitos secundarios con valor medicinal o nutricional. Los compuestos medicinales han tenido una especial atención y se han dedicado grandes esfuerzos para obtener gran variedad de ellos. Una gran cantidad de alcaloides, saponinas, cardenólidos, antraquinonas, polifenoles y terpenos han sido producidos a partir de cultivos vegetales in vitro. También se ha desarrollado una gran cantidad de métodos para la producción in vitro de compuestos antioxidantes, entre los que destacan las antocianinas (Matkowski, 2008). Estos pigmentos tienen un alto potencial, tanto para el reemplazo de colorantes sintéticos en alimentos, como para su uso en productos farmacéuticos y cosméticos (Chattopadhyay et al., 2008; Garzón, 2008). La identificación de secuencias promotoras, genes reguladores y factores de transcripción para los genes involucrados en la biosíntesis de antocianinas ha facilitado, en gran medida, la producción in vitro de las mismas (Holton y Cornish, 1995; Mano et al., 2007; Shimada et al., 2007; Allan et al., 2008; Zhou et al., 2008; Streisfeld y Rausher, 2009). De esta manera, la aplicación biotecnología en la producción de pigmentos surge como una propuesta interesante a nivel industrial, ya que permitiría eliminar las desventajas de la estacionalidad, las variaciones geográficas y anuales en los cultivos, y las fluctuaciones en los rendimientos debido a enfermedades o plagas, que surgen al cultivar las plantas en campo (Konczak et al., 2005).
A continuación se presenta una breve descripción de algunos de los métodos utilizados para la producción in vitro de antocianinas, compuestos que, como se indicó antes, adquieren cada día mayor importancia, debido a sus múltiples aplicaciones. En esta revisión bibliográfica se busca presentar una actualización a la última revisión específica conocida por los autores sobre el tema, que fue publicada hace más de diez años (Zhang y Furusaki, 1999). Únicamente se citan trabajos anteriores al año 1999 cuando estos no fueron citados en la revisión mencionada, o cuando se consideró relevante su alusión para explicar un proceso o idea en particular. Este tema también ha sido revisado recientemente, aunque no con tanto detalle, en un trabajo sobre la producción in vitro de metabolitos secundarios (Matkowski, 2008). También se publicó una revisión enfocada específicamente en Catharanthus roseus (Piovan y Filippini, 2007).
GENERALIDADES
La producción in vitro de metabolitos secundarios en tejidos vegetales se ha estudiado con gran detalle debido al gran potencial que tiene. Sin embargo, se han encontrado muchas limitaciones en el proceso, ya que, en comparación con microorganismos, las células vegetales requieren de más espacio, mayor tiempo para crecer y multiplicarse, así como el hecho de que algunas de sus rutas metabólicas para la producción de muchos metabolitos no se conocen en detalle. Paralelamente, en muchas ocasiones ocurre que determinados compuestos se producen solo en un tipo de células. El desarrollo de cultivos celulares ha sido de gran ayuda en este campo, ya que estos poseen tasas metabólicas más altas que las de muchas células diferenciadas de una planta intacta, lo que ha hecho posible el desarrollo de métodos de cultivo in vitro específicos para la producción de sustancias de interés (Dörnenburg y Knorr, 1995).
En los estudios sobre rutas metabólicas tradicionalmente se han utilizado callos con poco grado de diferenciación. Sin embargo, se ha observado que las suspensiones celulares permiten la recuperación de grandes cantidades de células, siendo así posible aislar los compuestos de interés más fácilmente. Muchas veces, los cultivos celulares no producen el compuesto que se busca, o bien, lo producen en bajas cantidades, lo que dificulta la aplicación del proceso a nivel industrial. Esto ha llevado a la búsqueda de métodos que induzcan una mayor producción de determinados metabolitos en los cultivos, y entre los más frecuentes y exitosos, está el uso de inductores, como se verá más adelante (Bourgaud et al., 2001). Avances en la producción de tejidos transgénicos han tenido gran importancia, y han redireccionado en cierta medida el cultivo in vitro con fines de producción de metabolitos secundarios, ya que al manipular genéticamente las vías metabólicas de las células, es posible dirigirlas hacia la producción de compuestos de interés (Rao y Ravishankar, 2002).
Muchos de los compuestos producidos por células vegetales se almacenan en vacuolas. Para poder tener acceso a estos, es necesario penetrar la barrera de ambas membranas, la de la vacuola, y la de la célula. La permeabilización de membranas es el método más común para lograr que las células liberen estos metabolitos secundarios, y se logra formando poros en las mismas. El objetivo principal de esta técnica es permitir que las células liberen las sustancias de interés almacenadas en su interior, manteniendo su viabilidad (Rao y Ravishankar, 2002). Se han probado varios tratamientos para permeabilizar células y así liberar pigmentos, en donde se altera pH, o se sonica, se somete a estrés térmico y/o estrés por reducción de oxígeno, entre otros. Muchas veces el éxito de estas técnicas es bajo, ya que se recobra poco producto después de aplicarlas, y también debido a que las células pierden o reducen su viabilidad (Thimmaraju et al., 2003). Una alternativa para reducir esta pérdida de viabilidad, que ha funcionado para antocianinas, es el uso concentraciones altas de calcio después de un tratamiento térmico para la liberación del pigmento (Takeda et al., 2003).
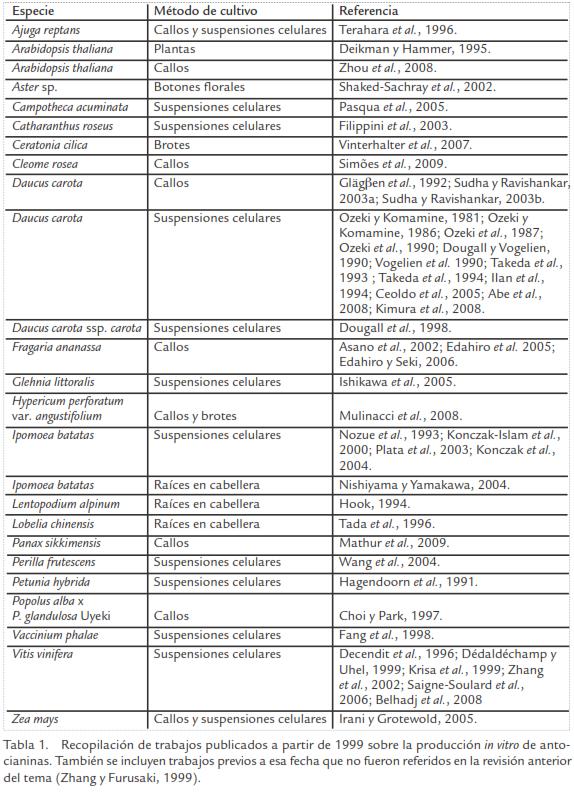
La producción de antocianinas in vitro ha sido reportada en un gran número de especies y utilizando distintos métodos de cultivo. En la Tabla 1 se presentan los trabajos publicados a partir de 1999 en el tema, o bien trabajos anteriores que no fueron incluidos en la revisión anterior sobre este tópico (Zhang y Furusaki, 1999).
VARIACIÓN DE LAS CONDICIONES DE CULTIVO
La producción de antocianinas se encuentra ligada a las condiciones lumínicas en que las plantas se desarrollan in vitro (Toguri et al., 1993). Se ha observado que los genes que codifican para las enzimas claves en la síntesis de antocianinas en Stellaria longipes requieren estímulo lumínico para su expresión (Alokam et al., 2002). Estudios in vitro con Ceratonia siliqua revelaron que en condiciones de baja luminosidad, e incluso en oscuridad, se dió la síntesis de antocianinas (Vinterhalter et al., 2007).
Además de la intensidad lumínica, la calidad de la luz juega también un papel importante en la producción de antocianinas. Estudios in vitro con corolas de Petunia hybrida demostraron que distintas longitudes de onda (rojo, verde, azul, rojo lejano) tienen efectos diferentes sobre la producción de estos pigmentos en flores, siendo más efectiva la azul (Weiss y Halevy, 1991). Irradiando plantas de Brassica rapa con luz de distintas longitudes de onda (rojo lejano, rojo, azul, UV-A, UV-B bajo, UV-B alto, UVA + rojo lejano, UV-A + rojo, UV-A + azul) se pudo monitorear el comportamiento de las mismas ante este tipo de estímulo. Las plantas que estuvieron por 24 horas en presencia de luz UV-A fueron las que presentaron la mayor concentración de anto cianinas en sus tejidos, cuatro veces más que plantas mantenidas en oscuridad. La combinación de otros tipos de luz con UV-A estimuló en menor grado la producción de pigmentos o no presentó diferencias significativas que cuando se utilizó sólo luz UV-A.
También se observó un aumento en la expresión de varios de los genes involucrados en la síntesis de antocianinas (fenilalanina amonio liasa, chalcona sintasa, flavanona 3hidroxilasa, dihidroflavonol 4-reductasa y antocianidina sintasa) al someter plantas a este tipo de radiación (Zhou et al., 2007).
La temperatura es otra de las condiciones de cultivo que afecta la producción de antocianinas. Shvarts et al., 1997, determinaron que condiciones de temperatura moderadamente baja podían aumentar la síntesis de antocianinas en petunia, incrementando la expresión de genes que codifican para las enzimas que participan en su síntesis. De igual manera, en un estudio con híbridos de Aster, se observó la misma tendencia, ya que las corolas de las flores de estas plantas presentaban la mitad de la concentración normal de antocianinas a temperatura promedio de 13 °C que al ser cultivadas a temperaturas mayores (en promedio 25 °C). Sin embargo, se encontró que aumentando los niveles de magnesio en estas plantas era posible evitar el efecto de la temperatura sobre la síntesis de antocianinas, aumentando la concentración de las mismas en las flores (Shaked-Sachray et al., 2002). En rosa cultivada en invernadero se ha encontrado que los efectos de temperaturas elevadas se observan principalmente en los nuevos brotes, cuando son expuestos a las mismas desde etapas tempranas de su desarrollo. Incluso, se pudo cons-tatar que la proporción en la que se encuentran distintas antocianinas en la planta cambia drásticamente al ser cultivadas a altas temperaturas (Dela et al., 2003). Un efecto combinado de luz, temperatura y diversos componentes del medio de cultivo en la producción de antocianinas fue observado en callos de Cleome rosea, una planta ornamental brasileña. En este caso, Simões et al., 2009, encontraron que la producción de antocianinas fue mayor al reducir la temperatura y aumentar la radiación lumínica.
ADICIÓN DE PRECURSORES
Muchas veces sucede que la producción de metabolitos secundarios no sigue el mismo patrón en cultivos in vitro que en plantas intactas cultivadas ex vitro. Esto puede deberse a la falta de los estímulos necesarios, a un desacople de la maquinaria enzimática, o a una expresión insuficiente de los genes relacionados con la biosíntesis. Sin embargo, considerando que las enzimas que participan en la síntesis están presentes, la adición exógena de precursores puede ayudar a solucionar el problema (Matkowski, 2008).
En el caso específico de las antocianinas, se ha estudiado el comportamiento de cultivos celulares en presencia de su precursor, fenilalanina. Al agregarlo al medio, se ha visto cómo la producción de antocianinas en cultivos celulares de Vitis vinifera se incrementa de forma significativa (Krisa et al., 1999). También se ha observado que fenilalanina puede actuar como un inductor de transcripción de genes que codifican para enzimas involucradas en la síntesis de antocianinas, como chalcona sintasa, en esta misma especie (Kakegawa et al., 1995). La adición fraccionada de concentraciones bajas de fenilalanina mostró ser más efectiva para la síntesis de antocianinas en cultivos celulares de fresa (Fragaria ananassa) que cuando se adicionó una cantidad mayor únicamente al momento del establecimiento (Edahiro et al., 2005).
Además, se ha visto que la adición de ácidos carboxílicos al medio de cultivo causa cambios en los patrones de antocianinas en cultivos celulares de zanahoria silvestre (Daucus carota spp. carota) a causa de acilación, formándose compuestos con colores más estables (Dougall et al., 1998). Los ácidos carboxílicos se estarían uniendo al azúcar de la antocianina y actuando, por lo tanto, como una especie de precursor de las nuevas antocianinas formadas.
USO DE REGULADORES DE CRECIMIENTO
Los reguladores de crecimiento juegan un papel importante en el desarrollo de plantas, determinando patrones de crecimiento, desarrollo de órganos, arquitectura de la planta y diferenciación celular (Gaspar et al., 2003). Dado el amplio rango de efectos de los reguladores de crecimiento sobre las plantas, se ha investigado también la participación que estos tienen sobre la producción de metabolitos secundarios en cultivos celulares. Ozeki y Komamine, 1986, utilizando cultivos celulares de zanahoria, lograron identificar el efecto inhibidor de auxinas, principalmente del ácido 2,4-diclorofenoxiacético (2,4-D), sobre la producción de antocianinas. Al añadir 2,4-D a cultivos celulares productores de antocianinas que habían cesado su crecimiento, se logró activar de nuevo la división celular, pero inmediatamente desapareció la acumulación de antocianinas. En concordancia, cultivos de camote comenzaron a sintetizar antocianinas cuando fueron transferidos a medio desprovisto de 2,4-D (Nozue et al., 1993). El ácido giberélico (AG3) y el ácido abscísico también mostraron tener un efecto inhibidor, similar al de auxinas. Para el caso de citoquininas, la respuesta fue distinta, ya que todas las que se evaluaron (zeatina, kinetina, isopentenil adenosina, benciladenina [BAP] y 4 piridilfenilurea) promovieron un aumento en la síntesis de antocianinas en cultivos de zanahoria (Ozeki y Komamine, 1986). Contrario a los resultados anteriores, Mizukami et al., 1988, observaron un incremento en la síntesis de antocianinas, sumado a un aumento en el crecimiento, en callos de Hibiscus sudariffa, utilizando 1 µM de 2,4-D. La combinación de esta auxina con kinetina también estimuló, en esta especie, la síntesis de estos pigmentos en mayor grado que sólo con auxina. El AG3, por otra parte, se comportó de la misma manera que en zanahoria, ya que demostró tener también, un efecto inhibidor sobre la síntesis de antocianinas en Hibiscus sudariffa (Mizukami et al., 1988).
Se observó producción de antocianinas en suspensiones celulares de fresa (Fragaria ananassa cv. Shikinari) cultivadas en medio LS (Linsmaier y Skoog, 1965) desprovisto de reguladores de crecimiento. Sin embargo, al agregar 2,4-D o BAP se logró aumentar la síntesis de antocianinas, y al utilizar estos reguladores en combinación, se llegó a tener un aumento de siete veces la producción del pigmento obtenida en el medio libre de reguladores (Mori et al., 1994).
Callos de Oxalis linearis presentaron una reducción en la producción de antocianinas al agregarse ácido naftalenacético al medio, en concentraciones de 8-32 µM. Al utilizar 2,4-D en concentraciones bajas (2 µM) se documentó la mayor producción de los pigmentos y, utilizando concentraciones altas, el efecto se volvió inhibitorio. En este estudio, las citoquininas (zeatina, tidiazuron y BAP) también resultaron tener un efecto inductor sobre la producción de antocianinas, al ser utilizadas a una concentración de 8 µM, en combinación con la misma concentración de 2,4-D (Meyer y van Staden, 1995).
Utilizando kinetina en el medio de cultivo de suspensiones celulares de Vaccinium phalae se logró inducir la síntesis de antocianinas. Sin embargo, después de múltiples subcultivos en este medio, las células perdieron o disminuyeron su capacidad de producir estos pigmentos. Al sustituir kinetina por BAP se logró, de nuevo, inducir la síntesis de antocianinas, e incluso se llegó a tener un aumento de tres veces en la producción total de las mismas, y una producción más temprana en el ciclo de cultivo de estas suspensiones. Este aumento en la producción de antocianinas al utilizar BAP, a diferencia de otros sistemas de producción de metabolitos secundarios, no se dio a expensas del crecimiento celular, ya que este también se vio incrementado al usar esta citoquinina (Fang et al., 1998). Sin embargo, la respuesta puede depender de la especie, como se observó en Campotheca acuminata, usando estos mismos reguladores, ya que la producción de antocianinas que se obtuvo utilizando kinetina, fue significativamente mayor que cuando se utilizó BAP. En este estudio también se encontró un efecto positivo sobre la producción de antocianinas al utilizar 2,4-D, como se había informado anteriormente en otras especies y al combinarlo con kinetina se llegó a obtener la concentración más alta de estos pigmentos (Pasqua et al., 2005). A pesar de esto, el 2,4-D también presentó efectos represivos sobre la producción de antocianinas en cultivos celulares de Vitis sp. (Yamakawa et al., 1983). Por ello no es posible establecer una tendencia general clara de la respuesta ante los distintos reguladores de crecimiento.
USO DE INDUCTORES Y FACTORES DE ESTRÉS
El término inductor, en inglés elicitor, hace referencia a una molécula o un estímulo que induce la síntesis y la acumulación de sustancias, que por lo general tienen efectos antimicrobianos o antiestrés en células vegetales. Las plantas, como organismos sésiles, se valen de este tipo de mecanismos para responder ante el estrés causado por agentes patógenos, de los cuales no pueden escapar (Yoshikawa et al., 1993). Gran parte de la investigación sobre este tema se ha concentrado en dilucidar este tipo de mecanismo de defensa de las plantas, desde la percepción de la señal, hasta la cadena de eventos que se derivan y su respectiva regulación (Hahn, 1996). Estrechamente relacionada con esta respuesta de la planta ante condiciones de estrés, está la producción y acumulación de metabolitos secundarios, que viene dada por uno o varios estímulos que funcionan como inductores. Los mecanismos que perciben y regulan este tipo de señales son complejos, y su comprensión es de suma importancia para la optimización y producción comercial de metabolitos secundarios (Zhao et al., 2005).
La producción in vitro de antocianinas puede ser potencializada utilizando inductores y factores de estrés. Dada la conocida actividad antimicrobiana de estos pigmentos (Lachman y Hamouz, 2005; Zhao et al., 2009), se han utilizado cultivos fúngicos como inductores para promover su síntesis en varias plantas. En callos in vitro de Daucus carota se utilizaron extractos de cultivos de Aspergillus niger, Aspergillus flavus, Penicillium notatum y Fusarium oxysporum, así como filtrados de los medios en que crecían estos hongos. La respuesta de los cultivos fue distinta ante cada hongo, y en los tratamientos con A. flavus se logró aumentar al doble la producción de antocianinas. En el filtrado del medio de este hongo también se logró detectar un aumento en la concentración de estos pigmentos, aunque no tan alto como con el extracto del hongo (Rajendran et al., 1994). En estudios posteriores con inductores fúngicos se observó cómo el calcio jugó un papel preponderante en lo que se refiere a la respuesta de células vegetales a estas sustancias. Al aumentar los niveles de calcio en el medio, en presencia del inductor fúngico, los callos de D. carota produjeron mayor cantidad de antocianinas, que los que tenían calcio en proporciones normales. Al usar sustancias que bloquean los canales de sodio en estos callos se observó una producción disminuida de antocianinas y reducción en el crecimiento, comprobándose que el calcio es pieza clave en la respuesta a este tipo de inductores fúngicos (Sudha y Ravishankar, 2003a).
En estudios similares con D. carota, utilizando extractos celulares y filtrados del cultivo de bacterias y levaduras, se ha observado que la respuesta de los callos varía de acuerdo con la bacteria o levadura utilizada y con la concentración final del inductor en el medio. Se pudo determinar que para estos callos los extractos de la levadura Rhodotorula rubra fueron los que dieron mejores resultados, aumentando al doble la concentración de antocianinas en los cultivos. En este mismo estudio se probó el efecto de distintos metales (Ca, Mg, Fe, Zn, Co y V) sobre la producción de antocianinas en los callos y se observó que el calcio era el que tenía el mejor efecto (Suvarnalatha et al., 1994).
Además del uso de organismos patogénicos como inductores en la producción de metabolitos secundarios, se han utilizado también extractos de algas, como en el caso de Spirulina platensis, un tipo de cianobacteria, usada en la industria como suplemento alimenticio por su alto valor nutricional. Esta cianobacteria contiene un pigmento azul, conocido como ficocianina, dentro del complejo de captación de luz típico de las llamadas comúnmente algas verde-azuladas. Este pigmento fue utilizado en callos de D. carota para aumentar la síntesis de antocianinas en callos pigmentados. Se probaron distintas concentraciones del inductor y se llegó a obtener un aumento del doble de la producción de estos pigmentos en callos (Rao et al., 1996).
Los azúcares poseen la capacidad de actuar como moléculas de señalización y su concentración en un tejido puede llevar a activar o desactivar determinados genes. Por lo tanto su capacidad de actuar como inductores para la síntesis de antocianinas también ha sido estudiada. Utilizando Arabidopsis thaliana, se demostró regulación positiva específica de sacarosa, independiente del efecto osmótico que pudiera tener, sobre la producción de antocianinas (Solfanelli et al., 2006). Sin embargo, en Ceratonia siliqua se encontró que el efecto positivo de la concentración de azúcares en el medio sobre la cantidad de antocianinas producidas fue más bien de naturaleza osmótica (Vinterhalter et al., 2007). Un aumento en la síntesis de antocianinas fue observado por Sudha y Ravishankar, 2003b, al cultivar callos de Daucus carota en presencia de metil jasmonato y ácido salicílico, sustancias relacionadas con la respuesta a estrés y la activación de mecanismos de defensa en plantas, respectivamente.
A pesar de que el pH es un factor crítico en el cultivo in vitro de plantas, se le ha dado poca importancia en el estudio de la producción de metabolitos secundarios. Sin embargo, en un estudio con fresa (Fragaria ananassa), se descubrió el potencial de este factor en la producción de antocianinas. Al aumentar el pH en cultivos de suspensiones celulares se obtuvo mayor pigmentación en las células. Cuando se utilizó un pH de 8,7 la concentración de antocianinas alcanzó su máximo a los nueve días de cultivo. Sin embargo, en los días subsiguientes la concentración de antocianinas disminuyó debido a la lisis y la muerte de muchas células (Zhang y Furusaki, 1997).
La adición de medio de cultivo condicionado con el filtrado de medio en el que estaban creciendo cultivos celulares de Fragaria ananassa productores de antocianinas, logró inducir la producción de este pigmento en cultivos celulares de Rosa hybrida que normalmente no lo producían. Este es un indicio, de que cultivos en los que se están produciendo antocianinas podrían liberar al medio sustancias que actúen como inductores (Sakurai et al., 1997). El óxido nitroso puede llegar a ser una sustancia muy dañina para plantas, dado su efecto inhibidor sobre la fotosíntesis. A pesar de esto, se pudo observar que al exponer discos de hojas de Pisum sativum a nitroprusiato de sodio, una sustancia productora de óxido nitroso, en presencia de luz, se dio una acumulación de antocianinas, que coincidió con una reducción drástica de la fotosíntesis de estas hojas (Ganjewala et al., 2008).
TRANSFORMACIÓN CON Agrobacterium rhizogenes
El uso de cultivos celulares indiferenciados (callos) para la producción de metabolitos secundarios tiene la gran limitante de que estos cultivos pueden ser genética o epigenéticamente inestables, y además tienden a tener rendimientos bajos. Un método alternativo ha sido la generación in vitro de raíces en cabellera, en inglés hairy roots, utilizando Agrobacterium rhizogenes. Este método ha resultado muy prometedor, dada la estabilidad genética y bioquímica de estas raíces, así como el crecimiento rápido que presentan (Giri y Narasu, 2000).
La producción de metabolitos secundarios in vitro cobra mayor importancia cuando la especie de la que estos se podrían extraer está en peligro de extinción, y no puede ser recolectada en condiciones silvestres pues está bajo algún sistema de protección. Este es el caso de Leontopodium alpinum, de la familia Asteraceae, pues es muy escasa, y para realizar estudios fitoquímicos con ella fue necesario recurrir a la producción in vitro de raíces en cabellera. En estos cultivos se reportó la presencia de antocianinas, la cual se vio aumentada en forma considerable (en un 70%) cuando se pusieron a crecer en un medio con 0,5 mg/L de BAP (Hook, 1994).
Explantes de hoja de Ipomea batatas cv. Ayamurasaki transformados con A. rhizogenes A13 produjeron antocianinas, con una tendencia a incrementar la concentración del pigmento conforme se aumentaba la concentración de sacarosa en el medio (Nishiyama y Yamakawa, 2004). También se ha determinado que el medio PRL-4C (Gamborg, 1966) favoreció la producción de antocianinas en estos cultivos. En la oscuridad se ha visto que también se produce el pigmento, pero sólo utilizando mayor concentración de azúcar, y no en la misma concentración que en los cultivos expuestos a la luz. Además, se ha podido determinar que cultivos de raíces en cabellera producen mayor cantidad de pigmento en medio sólido PRL-4C expuestos a la luz que en medio líquido PRL-4C y en oscuridad. Esta es una evidencia adicional de la importancia de la selección del medio y las condiciones de cultivo para la producción de antocianinas (Nishiyama y Yamakawa, 2004).
En cultivos de raíces en cabellera de Lobelia chinensis, una campanulácea medicinal del este asiático, expuestos a luz, se encontró la presencia de las antocianinas cianidin 3-O-glucósido y cianidin-3-0-rutinísido. La producción de estos pigmentos en los cultivos se vio favorecida en los medios Gamborg B5 (B5) y en root culture (RC), medios con una relación alta de NO3-/Np+, y en los cuales también se había reportado anteriormente buen rendimiento en la producción de clorofila (Tada et al., 1996).
CONCLUSIONES
A pesar de que los cultivos celulares de origen vegetal pueden producir gran cantidad de metabolitos secundarios, la producción comercial de los mismos aun es un reto. La falta de conocimiento de las vías metabólicas de muchos de los procesos enzimáticos es la barrera más importante que está impidiendo el desarrollo comercial en la producción de metabolitos secundarios in vitro. También se han mencionado algunos problemas técnicos y biológicos intrínsecos de células vegetales, como su gran tamaño si se les compara con microorganismos, su alta sensibilidad a la agitación y su baja tasa de crecimiento, que son responsables de la poca cantidad de procesos industriales en los que se utilizan para la producción de metabolitos secundarios (Dörnenburg y Knorr, 1995).
En el caso de las antocianinas, existen incluso residuos vegetales de los cuales se pueden extraer estos compuestos a un costo muy bajo, como por ejemplo de la vid (Kammerer et al., 2004). Lo anterior hace que el uso de cultivos in vitro como fuente de este tipo de pigmentos no sea actualmente una alternativa económicamente viable. Sin embargo, los altos rendimientos de producción de antocianinas obtenidos en varios trabajos, hacen pensar que el escalamiento de estos procesos, para llevarlos a nivel industrial, es posible (Rao y Ravishankar, 2002).
AGRADECIMIENTOS
A CIGRAS, Universidad de Costa Rica.
BIBLIOGRAFÍA
ABE Y, SAWADA A, MOMOSE T, SASAKI N, KAWAHARA N, KAMAKURA H, et al. Structure of an anthocyanin-anthocyanin dimer molecule in anthocyanin-producing cells of a carrot suspension culture. Tetrahedron Lett. 2008;49(51):7330-7333.
ALLAN AC, HELLENS RP, LAING WA. MYB transcription factors that colour our fruit. Trends Plant Sci. 2008;13(3):99-102.
ALOKAM S, LI Y, LI W, CHINNAPA CC, REID DM. Photoregulation of phenylalanine ammonia-lyase (PAL) and chalcone synthase (CHS) in the accumulation of anthocyanin in alpine and prairie ecotypes of Stellaria longipes under varied R/FR. Physiol Plant. 2002;116(4):531-538.
ASANO S, OHTSUBO S, NAKAJIMA M, KUSUNOKI M, KANEKO K, KATAYAMA H, et al. Production of anthocyanins by habituated cultured cells of Nyoho strawberry (Fragaria ananassa Duch.). Food Sci Technol Res. 2002;8(1):64-69.
BELHADJ A, TELEF N, SAIGNE C, CLUZET S, BARRIEU F, HAMDI S, et al. Effect of methyl jasmonate in combination with carbohydrates on gene expression of PR proteins, stilbene and anthocyanin accumulation in grapevine cell cultures. Plant Physiol Biochem. 2008;46(4):493-499.
BOURGAUD F, GRAVOT A, MILESI S, GONTIER E. Production of plant secondary metabolites: a historical perspective. Plant Sci. 2001;161(5):839-851.
CEOLDO S, LEVI M, MARCONI AM, BALDAN G, GIAROLA M, GUZZO F. Image analysis and in vivo imaging as tools for investigation of productivity dynamics in anthocyanin-producing cell cultures of Daucus carota. New Phytol. 2005;166(1):339-352.
CHATTOPADHYAY P, CHATTERJEE S, SEN SK. Biotechnological potential of natural food grade biocolorants. Afr J Biotechnol. 2008;7(17):2972-2985.
CHITTKA L, MENZEL R. The evolutionary adaptation of flower colours and the insect pollinators color vision. J Comp Physiol A. 1992;171(2):171-181.
CHOI MS, PARK YG. Selection of a high anthocyanin-producing cell line from callus cultures of hybrid poplar (Populus alba L. x P. glandulosa Uyeki). Forest Genetics 1997;4(4):253-257.
DECENDIT A, RAMAWAT KG, WAFFO P, DEFFIEUX G, BADOC A, MÉRILLON J-M. Anthocyanins, catechins, condensed tannins and piceid production in Vitis vinifera cell bioreactor cultures. Biotechnol Lett. 1996;18(6):659-662.
DÉDALDÉCHAMP F, UHEL C. Induction of anthocyanin synthesis in nonpigmented grape cell suspensions by acting on DFR substrate availability or precursors level. Enzym Microb Technol. 1999;25(3-5):316-321.
DEIKMAN J, HAMMER PE. Induction of anthocyanin accumulation by cytokinins in Arabidopsis thaliana. J Plant Physiol. 1995;108(1):47-57.
DELA G, OR E, OVADIA R, NISSIM-LEVI A, WEISS D, OREN-SHAMIR M. Changes in anthocyanin concentration and composition in Jaguar rose flowers due to transient high-temperature conditions. Plant Sci. 2003;164(3):333-340.
DELGADO-VARGAS F, JIMÉNEZ AR, PAREDES-LÓPEZ O. Natural pigments: carotenoids, anthocyanins, and betalains - characteristics, biosynthesis, processing, and stability. Crit Rev Food Sci Nutr. 2000;40(3):173-289.
DÖRNENBURG H, KNORR D. Strategies for the improvement of secondary metabolite production in plant cell cultures. Enzyme Microb Technol. 1995;17(8):674-684.
DOUGALL DK, VOGELIEN DL. Anthocyanin yields of clonal wild carrot cell cultures. Plant Cell Tissue Organ Cult. 1990;23(2):79-91.
DOUGALL DK, BAKER DC, GAKH EG, REDUS MA, WHITTEMORE NA. Anthocyanins from wild carrot suspension cultures acylated with supplied carboxylic acids. Carbohydr Res. 1998;310(3):177-189.
EDAHIRO J-I, SEKI M. Phenylpropanoid metabolite supports cell aggregate formation in strawberry cell suspension culture. J Biosci Bioeng. 2006;102(1):8-13.
EDAHIRO J-I, NAKAMURA M, SEKI M, FURUSAKI S. Enhanced accumulation of anthocyanin in cultured strawberry cells by repetitive feeding of L-phenylalanine into the medium. J Biosci Bioeng. 2005;99(1):43-47.
EINBOND LS, REYNERTSON KA, LUO X-D, BASILE MJ, KENELLY EJ. Anthocyanin antioxidants from edible fruits. Food Chem. 2004;84(1):23-28.
ESPÍN JC, SOLER-RIVAS C, WICHERS HJ, GARCÍA-VIGUERA C. Anthocyanin-based natural colorants: A new source of antiradical activity for foodstuff. J Agric Food Chem. 2000;48(5):1588-1592.
FANG Y, SMITH MAL, PÉPIN, M-F. Benzyl adenine restores anthocyanin pigmentation in suspension cultures of wild Vaccinium pahalae. Plant Cell Tissue Organ Cult. 1998;54(2):113-122.
FILIPPINI R, CANIATO R, PIOVAN A, CAPPELLETTI EM. Production of anthocyanins by Catharanthus roseus. Fitoterapia. 2003;74(1-2):62-67.
GAMBORG, OL. Aromatic metabolism in plants: II. Enzymes of the shikimate pathway in suspension cultures of plant cells. Biochem Cell Biol. 1966;44(6):791-799.
GANJEWALA D, BOBA S, RAGHAVENDRA AS. Sodium nitroprusside affects the level of anthocyanin and flavonol glycosides in pea (Pisum sativum L. cv Arkel) leaves. Acta Biologica Szegediensis. 2008;52(2):301-305.
GAO L, MAZZA G. Characterization, quantitation, and distribution of anthocyanins and colorless phenolics in sweet cherries. J Agric Food Chem. 1995;43(2):343-346.
GARZÓN GA. Las antocianinas como colorantes naturales y compuestos bioactivos: revisión. Acta biol Colomb. 2008;13(3):27-36.
GASPAR T, KEVERS C, FAIVRE-RAMPANT O, CRÈVECOEUR M, PENEL CL, GREPPIN H, et al. Changing concepts in plant hormone action. In Vitro Cell Dev Biol Plant. 2003;39(2):85-106.
GIRI A, NARASU L. Transgenic hairy roots: recent trends and applications. Biotechnol Adv. 2000;18(1):1-22.
GLÄßGEN WE, SEITZ HU, METZGER JW. High-performance liquid chromatography /electrospray mass spectrometry and tandem mass spectrometry of anthocyanins from plant tissues and cell cultures of Daucus carota L. Biol Mass Spectrom. 1992;21(6):271-277.
GRONQUIST M, BEZZERIDES A, ATTYGALLE A, MEINWALD J, EISNER M, EISNER T. Attractive and defensive functions of the ultraviolet pigments of a flower (Hypericum calycinum). Proc Natl Acad Sci U S A. 2001;98(24):13745-13750.
GROTEWOLD E. The genetics and biochemistry of floral pigments. Annu Rev Plant Biol. 2006;57:761-780.
HAGENDOORN MJM, ZETHOF JLM, VAN HUNNIK E, VAN DER PLAS LHW. Regulation of anthocyanin and lignin synthesis in Petunia hybrida cell suspensions. Plant Cell Tissue Organ Cult. 1991;27(2):141-147.
HAHN MG. Microbial elicitors and their receptors in plants. Annu Rev Phytopathol. 1996;34:387-412.
HOLTON TA, CORNISH EC. Genetics and biochemistry of anthocyanin biosynthesis. Plant Cell. 1995;7(7):1071-1083.
HOOK I. Secondary metabolites in hairy root cultures of Leontopodium alpinum Cass. (Edelweiss). Plant Cell Tissue Organ Cult. 1994;38(2-3):321-326.
IIAN A, ZANEWICH KP, ROOD SB, DOUGALL DK. Gibberellic acid decreases anthocyanin accumulation in wild carrot cell suspension cultures but does not alter 3-nucleotidase activity. Physiol Plant. 1994;92(1):47-52.
IRANI NG, GROTEWOLD E. Light-induced morphological alteration in anthocyanin-accumulating vacuoles of maize cells. BMC Plant Biol 2005;5(7):1-15
ISHIKAWA A, KITAMURA Y, OZEKI Y, ITOH Y, YAMADA A, WATANABE M. Post-stress metabolism involves umbelliferone production in anthocyanin-producing and non-producing cells of Glehnia littoralis suspension cultures. J Plant Physiol. 2005;162(6):703-710.
KAKEGAWA K, SUDA J, SUGIYAMA M, KOMAMINE A. Regulation of anthocyanin biosynthesis in cell suspension cultures of Vitis in relation to cell division. Physiol Plant. 1995;94(4):661-666.
KAMMERER D, CLAUS A, CARLE R, SCHIEBER A. Polyphenol screening of pomace from red and white grape varieties (Vitis vinifera L.) by HPLC-DAD-MS/MS. J Agric Food Chem. 2004; 52(14):4360-4367.
KARAGEORGOU P, MANETAS Y. The importance of being red when young: anthocyanins and the protection of young leaves of Quercus coccifera from insect herbivory and excess light. Tree Physiol. 2006;26(5):613-621.
KIMURA S, CHIKAGAWA, KATO M, MAEDA K, OZEKI Y. Upregulation of the promoter activity of the carrot (Daucus carota) phenylalanine ammonia-lyase gene (DcPAL3) is caused by new members of the transcriptional regulatory proteins, DcERF1 and DcERF2, which bind to the GCC-box homolog and act as an activator to the DcPAL3 promoter. J Plant Res. 2008;121(5):499-508.
KONCZAK I, ZHANG W. Anthocyanins - more than natures colours. J Biomed Biotechnol. 2004;5:239-240.
KONCZAK I, OKUNO S, YOSHIMOTO M, YAMAKAWA O. Caffeoylquinic acids generated in vitro in a high-anthocyanin-accumulating sweet potato cell line. J Biomed Biotechnol. 2004;5:287-292.
KONCZAK I, TERAHARA N, YOSHIMOTO M, NAKATANI M, YOSHINAGA M YAMAKAWA O. Regulating the composition of anthocyanins and phenolic acids in a sweetpotato cell culture towards production of polyphenolic complex with enhanced physiological activity. Trends Food Sci Technol. 2005;16(9):377-388.
KONCZAK-ISLAM I, YOSHINAGA M, NAKATANI M, TERAHARA N, YAMAKAWA O. Establishment and characteristics of an anthocyanin-producing cell line from sweet potato storage root. Plant Cell Rep. 2000;19(5):472-477.
KONG J-M, CHIA L-S, GOH N-K, CHIA T-F, BROUILLARD R. Analysis and biological activities of anthocyanins. Phytochemistry. 2003;64(5):923-933.
KRISA S, TÉGUO PW, DECENDIT A, DEFFIEUX G, VERCAUTEREN J, MÉRILLON J-M. Production of 13C-labelled anthocyanins by Vitis vinifera cell suspension cultures. Phytochemistry. 1999;51(5):651-656.
LACHMAN J, HAMOUZ K. Red and purple coloured potatoes as a significant antioxidant source in human nutrition-a review. Plant Soil Environ. 2005;51(11):477-482.
LINSMAIER EM, SKOOG F. Organic growth factor requirements of tobacco tissue cultures. Physiol Plant. 1965;18:100-127.
MANO H, OGASAWARA F, SATO K, HIGO H, MINOBE Y. Isolation of a regulatory gene of anthocyanin biosynthesis in tuberous roots of purple-fleshed sweet potato. J Plant Physiol. 2007;143(3):1252-1268.
MATHUR A, MATHUR AK, GANGWAR A, YADAV, VERMA P, SANGWAN RS. Anthocyanin production in a callus line of Panax sikkimensis Ban. In Vitro Cell Devel Biol Plant. 2010;46(1):13-21.
MATKOWSKI A. Plant in vitro culture for the production of antioxidants -A review. Biotechnol Adv. 2008;26(6):548-560.
MEYER HJ, VAN STADEN J. The in vitro production of anthocyanin from callus cultures of Oxalis linearis. Plant Cell Tissue Organ Cult. 1995;40(1):55-58.
MIZUKAMI H, TOMITA K, OHASHI H, HIRAOKA N. Anthocyanin production in callus cultures of roselle (Hibiscus sabdariffa L.). Plant Cell Rep. 1988;7(7):553-556.
MORI T, SAKURAI M, SEKI M, FURUSAKI S. Use of auxin and cytokinin to regulate anthocyanin production and composition in suspension cultures of strawberry cell. J Sci Food Agric. 1994;65(3):271-276.
MULINACCI N, GIACCHERINI C, SANTAMARIA AR, CANIATO R, FERRARI F VALLETTA A, et al. Anthocyanins and xanthones in the calli and regenerated shoots of Hypericum perforatum var. angustifolium (sin. Fröhlich) Borkh. Plant Physiol Biochem. 2008;46(4):414-420.
NISHIYAMA Y, YAMAKAWA T. Effect of medium composition on the production of anthocyanins by hairy root cultures of Ipomoea batatas. Plant Biotechnol. 2004;21(5):411-414.
NOZUE M, KUBO H, NISHIMURA M, KATOU A, HATTORI C, USUDA N, et al. Characterization of intravacuolar pigmented structures in anthocyanin-contaning cells of sweet potato suspension cultures. Plant Cell Physiol. 1993;34(6):803-808.
OZEKI Y, KOMAMINE A. Induction of anthocyanin synthesis in relation to embryogenesis in a carrot suspension culture: Correlation of metabolic differentiation with morphological differentiation. Physiol Plant. 1981;53(4):570-577.
OZEKI Y, KOMAMINE A. Effects of growth regulators on the induction of anthocyanin synthesis in carrot suspension cultures. Plant Cell Physiol. 1986;27(7):1361-1368.
OZEKI Y, KOMAMINE A, NOGUCHI H, SANKAWA U. Changes in activities of enzymes involved in flavonoid metabolism during the initiation and suppression of anthocyanin synthesis in carrot suspension cultures regulated by 2,4-dichlorophe-noxyacetic acid. Physiol Plant. 1987;69(1):123-128.
OZEKI Y, KOMAMINE A, TANAKA Y. Induction and repression of phenylalanine ammonia-lyase and chalcone synthase enzyme proteins and mRNAs in carrot cell suspension cultures regulated by 2,4-D. Physiol Plant. 1990;78(3):400-408.
PASQUA G, MONACELLI B, MULINACCI N, RINALDI S, GIACCHERINI C, INNOCENTI M, et al. The effect of growth regulators and sucrose on anthocyanin production in Camptotheca acuminata cell cultures. Plant Physiol Biochem. 2005;43(3):293-298.
PIOVAN A, FILIPPINI R. Anthocyanins in Catharanthus roseus in vivo and in vitro: a review. Phytochem Rev. 2007;6(2-3):235-242.
PLATA N, KONCZAK-ISLAM I, JAYRAM S, MCCLELLAND K, WOOLFORD T, FRANKS P. Effect of methyl jasmonate and p-coumaric acid on anthocyanin composition in a sweet potato cell suspension culture. Biochem Eng J. 2003;14(3):171-177.
PRIOR RL. Fruit and vegetables in the prevention of cellular oxidative damage. Am J Clin Nutr. 2003;78(3):570S-578S.
RAJENDRAN L, SUVARNALATHA G, RAVISHANKAR GA, VENKATARAMAN LV. Enhancement of anthocyanin production in callus cultures of Daucus carota L. under the influence of fungal elicitors. Appl Microbiol Biotechnol. 1994;42(2-3):227-231.
RAO SR, RAVISHANKAR GA. Plant cell cultures: Chemical factories of secondary metabolites. Biotechnol Adv. 2002;20(2):101-153.
RAO SR, SARADA R, RAVISHANKAR GA. Phycocyanin, a new elicitor for capsaicin and anthocyanin accumulation in plant cell cultures. Appl Microbiol Biotechnol. 1996;46(5-6):619-621.
SAIGNE-SOULARD C, RICHARD T, MÉRILLON J-M, MONTI J-P. 13C NMR analysis of polyphenol biosynthesis in grape cells: Impact of various inducing factors. Anal Chim Acta. 2006;563(1-2):137-144.
SAJILATA MG, SINGHAL RS. Isolation and stabilisation of natural pigments for food applications. Stewart Postharvest Review 2006;2(5): 1-29.
SAKURAI M, OZEKI Y, MORI T. Induction of anthocyanin accumulation in rose suspension-cultured cells by conditioned medium of strawberry suspension cultures. Plant Cell Tissue Organ Cult. 1997;50(3):211-214.
SATUÉ-GRACIA MT, HEINONEN M, FANKEL EN. Anthocyanins as antioxidants on human low-density lipoprotein and lecithin-liposome systems. J Agric Food Chem. 1997;45(9):3362-3367.
SHAKED-SACHRAY L, WEISS D, REUVENI M, NISSIM-LEVI A, OREN-SHAMIR M. Increased anthocyanin accumulation in aster flowers at elevated temperatures due to magnesium treatment. Physiol Plant. 2002;114(4):559-565.
SHARMA PJ, CROWDEN RK. Anthocyanins in some Eucalyptus species. Aust J Bot. 1974;22(3):623-627.
SHIMADA S, OTSUKI H, SAKUTA M. Transcriptional control of anthocyanin biosynthetic genes in the Caryophyllales. J Exp Bot. 2007;58(5):957-967.
SHVARTS M, BOROCHOV A, WEISS D. Low temperature enhances petunia flower pigmentation and induces chalcone synthase gene expression. Physiol Plant. 1997;99(1):67-72.
SIMÕES C, BIZARRI CHB, CORDEIRO LS, DE CASTRO TC, COUTADA LCM, DA SILVAAJR, et al. Anthocyanin production in callus cultures of Cleome rosea: Modulation by culture conditions and characterization of pigments by means of HPLC-DAD/ESIMS. Plant Physiol Biochem. 2009;47(10):895-903.
SOLFANELLI C, POGGI A, LORETI E, ALPI A, PERATA P. Sucrose-specific induction of the anthocyanin biosynthetic pathway in Arabidopsis. Plant Physiol. 2006;140(2):637-646.
STAFFORD HA. Anthocyanins and betalains: evolution of the mutually exclusive pathways. Plant Sci. 1994;101(2):91-98.
STINTZING FC, CARLE R. Functional properties of anthocyanins and betalains in plants, food, and in human nutrition. Trends Food Sci Technol. 2004;15(1):19-38.
STREISFELD MA, RAUSHER MD. Altered trans-regulatory control of gene expression in multiple anthocyanin genes contributes to adaptive flower color evolution in Mimulus aurantiacus. Mol Biol Evol. 2009;26(2):433-444.
SUDHA G, RAVISHANKAR GA. Elicitation of anthocyanin production in callus cultures of Daucus carota and involvement of calcium channel modulators. Current Science. 2003a;84(6):775-779.
SUDHA G, RAVISHANKAR GA. Elicitation of anthocyanin production in callus cultures of Daucus carota and the involvement of methyl jasmonate and salicylic acid. Acta Physiol Plant. 2003b;25(3):249-256.
SUMNER P, ARRESE CA, PARTRIDGE JC. The ecology of visual pigment tuning in an Australian marsupial: The honey possum Tarsipes rostratus. J Exp Biol. 2005;208(10):1803-1815.
SUVARNALATHA G, RAJENDRAN L, RAVISHANKAR GA, VENKATARAMAN LV. Elicitation of anthocyanin production in cell cultures of carrot (Daucus carota L.) by using elicitors and abiotic stress. Biotechnol Lett. 1994;16(12):1275-1280.
TADA H, TERAHARA N, MOTOYAMA E, SHIMOMURA K, ISHIMARU K. Anthocyanins in Lobelia chinensis hairy roots. Plant Tissue Cult Lett. 1996;13(1):85-86.
TAKEDA J, ABE S, HIROSE Y, OZEKI Y. Effect of light and 2,4-dichlorophe-noxyacetic acid on the level of mRNAs for phenylalanine ammonia-lyase and chalcone synthase in carrot cells cultured in suspension. Physiol Plant. 1993;89(1):4-10.
TAKEDA J, OBI I, YOSHIDA K. Action spectra of phenylalanine ammonia-lyase and chalcone synthase expression in carrot cells in suspension. Physiol Plant. 1994;91(3):517-521.
TAKEDA T, INOMATA M, MATSUOKA H, HIKUMA M, FURUSAKI S. Release of anthocyanin from strawberry cultured cells with heating treatment. Biochem Eng J. 2003;15(3):205-210.
TERAHARA N, CALLEBAUT A, OHBA R, NAGATA T, OHNISHI-KAMEYAMA M, SUZUKI M. Triacylated anthocyanins from Ajuga reptans flowers and cell cultures. Phytochemistry. 1996;42(1):199-203.
THIMMARAJU R, BHAGYALAKSHMI N, NARAYAN MS, RAVISHANKAR GA. Kinetics of pigment release from hairy root cultures of Beta vulgaris under the influence of pH, sonication, temperature and oxygen stress. Process Biochemistry. 2003;38(7):1069-1076.
TOGURI T, UMEMOTO N, KOBAYASHI O, OHTANI T. Activation of anthocyanin synthesis genes by white light in eggplant hypocotyl tissues, and identification of an inducible P-450 cDNA. Plant Mol Biol. 1993;23(5):933-946.
VAN WYK B-E, WINTER PJD, BUYS MH. The major flower anthocyanins of Lobostemon (Boraginaceae). Biochem Syst Ecol. 1997;25(1):39-42.
VINTERHALTER B, NINKOVIC S, KOZOMARA B, VINTERHALTER D. Carbohydrate nutrition and anthocyanin accumulation in light grown and etiolated shoot cultures of´ carob (Ceratonia siliqua L.). Archives of Biological Sciences Belgrade. 2007;59(1):51-56.
VOGELIEN DL, HRAZDINA G, REEVES S, DOUGALL DK. Phenotypic differences in anthocyanin accumulation among clonally related culture cells of carrot. Plant Cell Tissue Organ Cult. 1990;22(3):213-222.
WANG H, CAO G, PRIOR RL. Oxygen radical absorbing capacity of anthocyanins. J Agric Food Chem. 1997;45(2):304-309.
WANG JW, XIA ZH, CHU JH, TAN RX. Simultaneous production of anthocyanin and triterpenoids in suspension cultures of Perilla frutescens. Enzyme Microb Tech. 2004;34(7):651-656.
WEISS D, HALEVY AH. The role of light reactions in the regulation of anthocyanin synthesis in Petunia corollas. Physiol Plant. 1991;81(1):127-133.
WILLSON MF, WHELAN CJ. The evolution of fruit color in fleshy-fruited plants. Am Nat. 1990;136(6):790-809.
YAMAKAWA T, KATO S, ISHIDA K, KODAMA T, MINODA Y. Production of anthocyanins in Vitis cells in suspension culture. Agric Biol Chem. 1983;47(10):2185-2191.
YOSHIKAWA M, YAMAOKA N, TAKEUCHI Y. Elicitors: their significance and primary modes of action in the induction of plant defense reactions. Plant Cell Physiol. 1993;34(8):1163-1173.
ZHANG W, FURUSAKI S. Regulation of anthocyanin synthesis in suspension cultures of strawberry cell by pH. Biotechnol Lett. 1997;19(11):1057-1061.
ZHANG W, FURUSAKI S. Production of anthocyanins by plant cell cultures. Biotechnol Bioprocess Eng. 1999;4(4):231-252.
ZHANG W, CURTIN C, KIKUCHI M, FRANCO C. Integration of jasmonic acid and light irradiation for enhancement of anthocyanin biosynthesis in Vitis vinifera suspension cultures. Plant Sci. 2002;162(3)459-468.
ZHAO C, GIUSTI MM, MALIK M, MOYER MP, MAGNUSON BA. Effects of commercial anthocyanin-rich extracts on colonic cancer and nontumorigenic colonic cell growth. J Agric Food Chem. 2004;52(20):6122-6128.
ZHAO J, DAVIS LC, VERPOORTE R. Elicitor signal transduction leading to production of plant secondary metabolites. Biotechnol Adv. 2005;23(4):283-333.
ZHAO X, ZHANG C, GUIGAS C, MA Y, CORRALES M, TAUSCHER B, et al. Composition, antimicrobial activity, and antiproliferative capacity of anthocyanin extracts of purple corn (Zea mays L.) from China. Eur Food Res Technol. 2009;228(5):759-765.
ZHOU B, LI Y, XU Z, YAN H, HOMMA S, KAWABATA S. Ultraviolet A-specific induction of anthocyanin biosynthesis in the swollen hypocotyls of turnip (Brassica rapa). J Exp Bot. 2007;58(7):1771-1781.
ZHOU L-L, ZENG H-N, SHI M-Z, XIE D-Y. Development of tobacco callus cultures over expressing Arabidopsis PAP1/MYB75 transcription factor and characterization of anthocyanin biosynthesis. Planta. 2008;229(1):37-51.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2011 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).




















