DISTRIBUCIÓN VERTICAL DE ARAÑAS ASOCIADAS A Quercus humboldtii Y Clusia spp. EN EL SANTUARIO DE FAUNA Y FLORA IGUAQUE, COLOMBIA
Palabras clave:
Modelos arquitectónico vegetal, Estratificación, Estacionalidad, Estados de Desarrollo, Alta montaña tropical. (es)DISTRIBUCIÓN VERTICAL DE ARAÑAS ASOCIADAS A Quercus humboldtii Y Clusia spp. EN EL SANTUARIO DE FAUNA Y FLORA IGUAQUE, COLOMBIA
Vertical Distribution of Spiders Associated to Quercus humboldtii and Clusia spp. at Sanctuary of Fauna and Flora Iguaque, Colombia
SILVIA VANEGAS1, M.Sc.; GIOVANNY FAGUA2, M.Sc.; EDUARDO FLÓREZ3, M.Sc.
1 Subdirección Evaluación y Seguimiento. Autoridad Nacional de Licencias Ambientales. Bogotá, Colombia. svanegas@anla.gov.co 2 Laboratorio de Entomología. Unidad de Ecología y Sistemática, Unesis. Pontificia Universidad Javeriana, carrera 7 # 43-82, edificio Jesús Emilio Ramírez (54). Departamento de Biología. Bogotá, Colombia. Tel.: 57 1 320 83 20, ext. 4081. Fax 57 1 320 83 20 ext. 4057. fagua@javeriana.edu.co. 3Instituto de Ciencias Naturales. Universidad Nacional de Colombia. Bogotá, Colombia. aeflorezd@unal.edu.co. Correspondencia: Giovanny Fagua,fagua@javeriana.edu.co.
Presentado el 22 de abril de 2012, aceptado el 9 de julio de 2012, correcciones el 28 de octubre de 2012.
RESUMEN
Se estudió la distribución vertical de arañas asociadas a árboles de Quercus humboldtii y Clusia spp. con diferentes modelos arquitecturales en el Santuario de Fauna y Flora Iguaque, Colombia. Se seleccionaron árboles de cada modelo arquitectural, estratificándolos verticalmente cada tres metros desde la base hasta el dosel. Se realizaron colectas en cada estrato por 20 minutos durante el día y en la noche. También se tomaron muestras en la parcela aledaña (4 m2). Se colectaron 1261 individuos pertenecientes a 104 morfoespecies y 20 familias; las familias más frecuentes fueron Theridiidae, Salticidae, Araneidae, Linyphiidae, Anyphaenidae y Theridiosomatidae. Se encontraron diferencias en la distribución vertical de arañas en cuanto a la abundancia, la riqueza, la composición, la distribución de sexos y las épocas climáticas atribuibles a las arquitecturas vegetales y a su estratificación. Clusia presentó la comunidad de arañas más diversa, Quercus la de mayor dominancia. La composición estuvo influida por las lluvias, el período del día y la disponibilidad de soportes vegetales.
Palabras clave: Araneae, Arachnida, bosque montano, estacionalidad, estratificación, interacción planta animal, modelo arquitectural vegetal.
ABSTRACT
The vertical distribution of spiders associated to trees of Quercus humboldtii and Clusia spp. with different architectural model, was studied at Sanctuary of Fauna and Flora of Iguaque; for this, we selected trees of each architectural model, stratified them each three m in high starting at the base to the canopy of the tree. We took samples in each stratus for 20 min during the day and at night. Also, we took samples in the nearest ground plot (4 m2). We collected 1,261 specimens of 104 morphospecies and 20 families. The most frequent families were Theridiidae, Salticidae, Araneidae, Linyphiidae, Anyphaenidae, and Theridiosomatidae. We observed differences in the spiders' vertical distribution in abundance, richness, composition, time period, and sex ratio, all of them attributable to plant architectures and its stratification. Clusia spider community was the most diverse, Quercus spider community was the riechest. Rain, period of time at day, and support availability affected the spiders' composition.
Keywords: Araneae, arachnida, mountain forest, plant architectural model, seasonality, stratification, plant animal interaction.
INTRODUCCIÓN
La abundancia y diversidad de arañas y la variedad de funciones ecológicas que estas desempeñan, son dependientes del hábitat específico en donde se encuentran y de variables bióticas y abióticas como la disponibilidad de presas, los sitios de construcción de telas o la buena conducción de las señales vibratorias que puedan tener los sustratos (Uetz et al., 1978; Foelix, 1996). En este sentido, el hábitat y la arquitectura de la vegetación determinan múltiples microhábitats para las comunidades de arañas. Estas son un componente importante en las comunidades arbóreas tropicales (Erwin, 1991), sin embargo, aun cuando su papel depredador ha sido estudiado en diferentes ecosistemas (Höfer et al., 1994), su relación con la estratificación vertical de la vegetación ha sido poco explorada.
Los conceptos asociados a la distribución vertical se encuentran continuamente en discusión. Mills et al.,1993, definen el concepto de estratificación como una estructura vertical en la cual los atributos combinados de la estructura del dosel y del sotobosque representan la variabilidad de la estructura de la comunidad animal. Terborgh y Petren, 1991, sugieren que los hábitats pueden estar traslapados porque los estratos no están objetivamente determinados. Debido a esto, ellos opinan que esta estratificación debe ser asumida diferencialmente para cada grupo de estudio, por lo tanto proponen una estratificación influida por múltiples factores como el ecosistema, el tipo y grupo de estudio, la estructura de la vegetación, entre otros.
La organización de un bosque comprende dos conceptos: la arquitectura del bosque (como un conjunto) y la arquitectura y geometría de las poblaciones que lo componen (Unesco, 1980; Tomlinson, 1983). La arquitectura de las especies vegetales tropicales ha sido un campo ampliamente estudiado (Koriba, 1958). Halle et al., 1978, distinguen un cierto número de modelos arquitecturales que hacen referencia a: el crecimiento de los meristemos (monopodial y simpodial), la diferenciación de los meristemos (sexual frente a vegetativo, plagiotrópico frente a ortotrópico, episódico frente a continuo) y a la cronología en el desarrollo de la rama. En este sentido, Quercus humboldtii Bonpl. (Fagaceae), Clusia alata Triana y Planch., y Clusia multiflora Kunth (Clusia ceae) ofrecen la oportunidad de contrastar la distribución vertical de arañas en dos tipos de árboles en cuyas familias se han registrado modelos arquitecturales diferentes. Estos modelos son: modelo "Rauh" para Q. humboldtii sensu (Echeverry, 1997), caracterizado por ejes vegetativos homogéneos y tronco de crecimiento rítmico monopodial (Halle et al., 1978), y modelo "Scarrone" para Clusia , caracterizado por ejes vegetativos homogéneos, tronco de crecimiento rítmico con flores terminales y crecimiento simpodial (Halle et al., 1978). La arquitectura vegetal es uno de los factores que influye en la colonización y establecimiento de organismos (Robinson, 1981; Gunnarsson, 1990) y está directamente relacionada con la diversificación del hábitat, así como con el número de nichos potenciales en un bosque, en donde estos animales se distribuyen verticalmente a lo largo de la vegetación existente. Dicha distribución les permite coexistir con un menor grado de competencia (Enders, 1974). La distribución vertical ha sido registrada para varios grupos de insectos como hemípteros, que son más abundantes en las partes superiores del bosque. Otros ejemplos son los adultos de las moscas Phoridae, que se distribuyen principalmente en los estratos bajos del bosque, y las hormigas que están distribuidas desde el dosel hasta el suelo del bosque (Garrison y Willing, 1996). La distribución de las hojas en el dosel puede también tener un efecto importante en el establecimiento y formación de poblaciones, tanto en aspectos espaciales como en temporales (Janzen y Schoener, 1968). En el caso de las arañas, los lineamientos generales para encontrar estratificación vertical son zonas de reproducción, especialización por alimento, competencia, subdivisión de gremios y por los estados de desarrollo (Enders, 1974; Basset et al., 2003).
En atención a los factores mencionados, el presente trabajo planteó observar la influencia de dos modelos arquitecturales de especies arbóreas sobre las características de la distribución vertical de las arañas asociadas. Se asume que la distribución vertical describe el patrón de variación en abundancia, riqueza y composición de las comunidades de arañas a diferentes alturas desde el suelo hasta el dosel de los árboles. Se optó por tomar medidas por estratos de una longitud definida (3 m) para facilitar la detección de algún patrón biológicoque permita inferir la influencia de características tales como disponibilidad de presas (Greenstone, 1984), sustrato de ubicación de telas, microhábitats (Smith, 1973) y asociaciones por sexo o por estado de desarrollo, entre otras.
MÉTODOS
ÁREA DE ESTUDIO
El trabajo fue desarrollado en inmediaciones del centro de visitantes del Santuario de Fauna y Flora Iguaque (SFFI), departamento de Boyacá (Colombia), en el sitio "El Robledal", ubicado a los 5° 42' Norte y 73° 27' Oeste, a 2850 msnm de altitud (Fig. 1).
METODOLOGÍA
El estudio comprendió dos fases. En la primera se seleccionó el área de "El Robledal" por presentar caracteres semejantes entre los individuos de las especies vegetales (altura y diámetro a la altura del pecho ( DAP)). En esta fase se realizó la caracterización vegetal del robledal, se tomaron los datos de DAP y la altura de cada árbol seleccionado, se señalaron los estratos en los árboles y se montaron las estaciones de escalada.
La caracterización vegetal incluyó un inventario de la vegetación del robledal con énfasis en las especies vegetales que colindaban con los árboles muestreados. Adicionalmente se recogieron datos de DAP, altura hasta la estación de escalada y altura total de cada uno de los árboles seleccionados.
Una estación de escalada fue colocada en la última ramificación resistente de cada árbol seleccionado (horqueta). En la horqueta se colocó un anclaje que consistió en una cinta tubular de seguridad para escalada (atada a la horqueta), a la cual se sujetó un grillete del cual pendía la cuerda de escalada a través de la cual se ascendió al dosel para realizar los muestreos (Davis, 2005). Se esperó un mes después de la instalación de las estaciones de escalada para el inicio de la toma formal de datos (muestreo efectivo, segunda fase), esto para evitar las alteraciones en el comportamiento y distribución de las arañas que se pudiesen producir durante la instalación de las estaciones de escalada. Las estaciones de anclaje se retiraron al final del estudio.
Para el muestreo se seleccionaron aleatoriamente diez árboles de Quercus humboldtii y ocho de Clusia , dos de C. alata y seis de C. multiflora. Solo se seleccionaron ocho árboles de Clusia spp., porque los restantes especímenes de Clusia presentes en el sitio eran demasiado pequeños para el tipo de muestreo realizado. Cabe destacar que ambas especies de Clusia presentan el mismo modelo arquitectural. Para Q. humboldtii las alturas de acceso estuvieron entre 17-21 m, con DAP cercanos al metro (media: 95 cm; desviación estándar (d.s.): 46,14; número de individuos, n:10); mientras que para las especies de Clusia , las alturas variaron entre 9-13 m y DAP cercanos a los 50 cm (media: 41 cm, d.s.: 12,5; n: 8). El tronco de cada árbol seleccionado fue dividido en estratos para el muestreo efectivo, uno cada tres metros desde el suelo hasta la estación de anclaje. En las dos especies de Clusia se obtuvieron cuatro estratos por árbol (0-3 m, 3,1-6 m, 6,1- 9 m, 9,1-12 m), mientras que para Q. humboldtii se obtuvieron cinco (0-3 m, 3,1-6 m, 6,1-9 m, 9,1-12 m, 12,1-15 m, 15,1-18 m). Adicionalmente, se delimitaron parcelas de 4 m2 de área cercanas a cada árbol muestreado para la observación y la captura de las arañas en el estrato rasante (0 a 0,5 m).
La segunda fase comprendió los seis muestreos efectivos: tres correspondientes al período lluvioso (abril, junio, octubre) y tres correspondientes al seco (agosto, septiembre, enero). Durante los muestreos cada árbol y su parcela respectiva fueron revisados en el día y en la noche, entre las 08 h-14 h y las 17 h-23 h. Cada muestreo comprendió cerca de 15 días dependiendo de la presencia de lluvia. No se realizaron colectas durante horas lluvia dado que la actividad de las arañas es fuertemente reducida (Robinson y Robinson, 1973). Se definió como unidad de muestra la observación y la captura de los especímenes detectados durante 20 min por cada estrato o parcela. Para cada araña se tomaron los datos del sustrato donde se encontraban. Para tejedoras, cuando se encontraban en la telaraña, se tomaban mediciones de tamaño, altura, distancia y la posición de esta. Los árboles muestreados fueron siempre los mismos a lo largo de todo el estudio. Sin embargo, si el árbol era revisado en el día, no se observaba en la noche hasta que se completaran la totalidad de los árboles (al menos seis días después), lo anterior para disminuir el impacto del muestreo diurno sobre el nocturno.
Las arañas colectadas se preservaron en frascos con alcohol etílico al 70 %. Se realizó la separación por morfoespecies (tipos morfológicos diferenciables), se determinaron los ejemplares hasta el nivel de familia mediante las claves de Kaston (1978), Dipennar-Schoeman y Jocqué (1997), y cuando fue posible a nivel de género o especie mediante las claves de Levi (2000). Los especímenes se diferenciaron por sexo y por estado de desarrollo. Todos los ejemplares fueron depositados en la colección de entomología del Museo Javeriano de Historia Natural (MPUJ).
ANÁLISIS DE DATOS
Los datos de la comunidad de arañas obtenidos en cada estrato fueron comparados entre sí y entre los dos tipos arquitecturales de árboles mediante los descriptores de comunidad definidos por Magurran (1989). La eficiencia de muestreo se obtuvo mediante los estimadores de riqueza Chao 1, MMMean, ACE y Jacknife 1 (Colwell y Coddington, 1994). Se estimó la eficiencia del muestreo general, de los muestreos por períodos de colecta, de los muestreos por estrato y de los muestreos para cada modelo arquitectural. La diversidad y dominancia fueron obtenidos a partir de los índices de Brillouin y Simpson (Magurran, 1989). La composición se comparó mediante análisis de similitud cuantitativa de Bray-Curtis (Magurran, 1989). Adicionalmente, se estableció el comportamiento de cada uno de los árboles y del muestreo general por medio de análisis de correspondencia y un análisis de componentes principales (ACP) usando PC-CORD para Windows (McCune y Mefford, 1997). Además, se realizó un análisis de distribución de las varianzas de los microhábitats más frecuentemente observados en la comunidad de arañas de "El Robledal", utilizando STATISTICA versión 6.0 (StatSoft Inc., 2001).
Con base en los datos tomados en campo, se establecieron patrones de distribución de las arañas a lo largo del gradiente vertical (en cada una de las arquitecturas contrastantes), en términos de su abundancia, riqueza y composición, con el objeto de analizar la variación de estos parámetros en los patrones de distribución de las arañas. Adicionalmente, se tomaron datos de estructura de soporte, sitios de refugio, altura de la tela, posición, tamaño, comportamiento y hábito de caza
RESULTADOS Y DISCUSIÓN
CARACTERIZACIÓN FLORÍSTICA
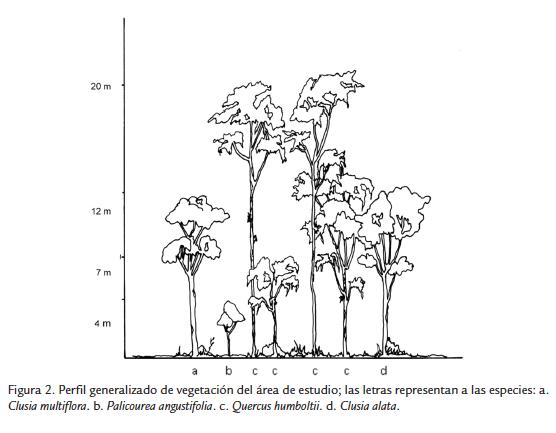
En "El Robledal" las especies arbóreas dominantes fueron Quercus humboldtii, Clusia multiflora y Clusia alata (Fig. 2), mientras que el sotobosque y estrato rasante se caracterizó por la alta frecuencia de Viburnum triphyllum Benth., Clethra fimbriata Kunt, Gaiadendron punctatum (Ruiz y Pav.) G. Don, y algunos individuos de Clidemiahirta (L.) D. Don. En las partes donde apareció Clusia spp. se observó Palicourea angustifolia Kunt, Elaphoglossum cuspidatum (Willd.) T. Moore, Tillandsia suescana L.B. Sm., Columnea aurantiaca Decne. Ex Planch., Piper sp., Oxalis sp. y Lycopodium spp.,entre otros.
ARAÑAS ASOCIADAS A Quercus humboldtii Y Clusia spp.
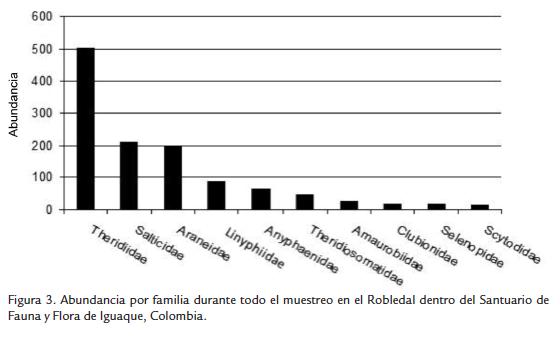
Se observaron 1261 arañas agrupadas en 19 familias y 104 morfoespecies. Se obtuvieron determinaciones taxonómicas en un 16 % a género y en un 84 % a familia. En la figura 3 se observan las familias y las abundacias encontradas. Theridiidae fue la más abundante con 39,6 % del total de individuos, seguida de Salticidae (16,7 %), Araneidae (15,5 %), Linyphiidae (7 %) y Anyphaenidae (5 %) (Fig. 3).
Las familias con un mayor número de individuos fueron Theridiidae (Theridion sp., 358), Salticidae (Salticidae sp. 2113), Araneidae (Cyclosa sp. 1,31) y Linyphiidae (Linyphiidae sp. 1,89).
Araneidae presentó la mayor riqueza con 31 morfoespecies (39 %), seguida por Theridiidae con 20 (25 %), Salticidae con 13 (16 %) y Anyphaenidae con 8 (10 %). Las familias restantes tuvieron menos de cuatro morfoespecies en total (Fig. 4). De acuerdo con los estimadores mínimos (Jacknife 1) y máximos (MMMmean), el muestreo total obtuvo entre 89 y 82 % de lo esperado, incluyendo lo observado dentro de los intervalos de confianza de los estimadores y presentó unión de las curvas de acumulación de especies singulares y duales (sensu Colwell y Coddington, 1994), por lo que fue eficiente y representativo (Fig. 5).
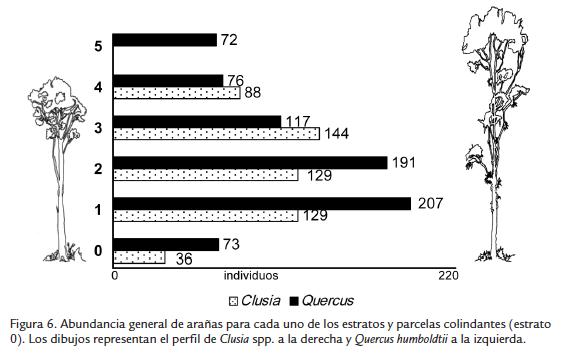
En Q. humboldtii los dos primeros estratos presentaron la mayor abundancia de arañas, el primero con mayor número de individuos (207). A partir del tercero se observó una clara disminución de la abundancia que alcanzó su mínimo valor en el estrato 5 (Fig. 6). En Clusia spp., por su parte, la mayor abundancia se observó en el estrato 3 (Fig. 6).
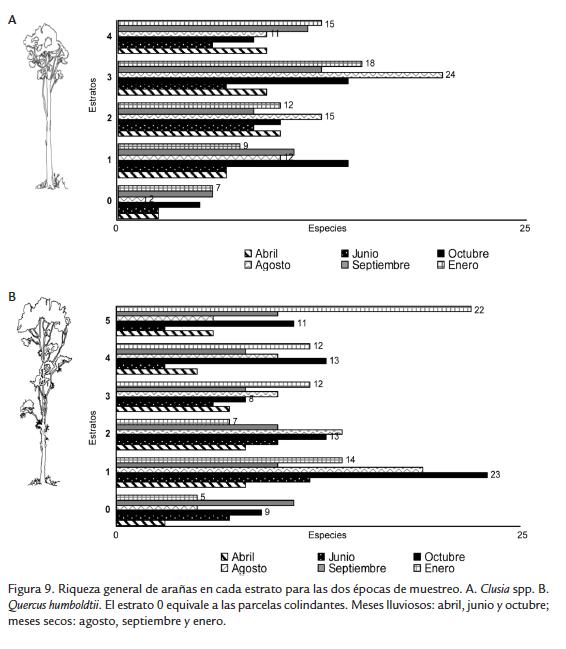
Q. humboldtii mantuvo la mayor riqueza en el primer estrato; pero a diferencia de lo observado en la abundancia, el estrato 5 fue el siguiente en número de especies (Fig. 7). Clusia spp. mantuvo la misma tendencia observada en la abundancia, registrando el mayor número de especies en el estrato 3 (Fig. 7).Se presentaron diferencias en la abundancia según el mes de muestreo entre las arañas de los árboles y de las parcelas (Fig. 8). Las arañas de las parcelas de los dos tipos de árboles presentaron dos máximos en octubre y septiembre-enero, con mínimo en agosto, mientras que las mayores abundancias de arañas en los dos tipos de árboles se presentaron en junio, octubre y agosto (Fig. 8). Los dos tipos de árbol presentaron mayor abundancia de arañas en los estratos bajos (1 a 2) durante los meses lluviosos, pero mayor abundancia en los estratos altos (3 a 6) durante los meses secos (Fig. 8). Sin embargo, durante agosto (mes seco) la mayor abundancia de arañas en Clusia spp. se observó en el estrato 3 (Fig. 8A), mientras que para Q. humboldtii se observó en el estrato 1 (Fig. 8B).
Respecto de la variación de la riqueza de especies de arañas por mes de muestreo, también se presentaron diferencias entre los árboles y las parcelas (Fig. 9). Agosto fue el mes con menor número de especies de arañas en las parcelas, pero fue el mes con mayor número de especies en los árboles (Fig. 9). La variación de la riqueza de arañas por mes de muestreo fue diferente entre los dos tipos de árboles; Clusia spp. presentó durante los meses lluviosos mayor riqueza en los estratos bajos (1 a 2) y durante los meses secos mayor riqueza en los estratos altos (3 a 4; Fig. 9A). Por su parte Q. humboldtii presentó mayor riqueza de arañas en los estratos bajos (1 a 2) durante todos los meses con excepción de enero, mes en que la mayor riqueza se observó en los estratos altos (4 a 5; Fig. 9B). Para las dos especies se destaca que la riqueza del primer estrato siempre fue mayor a la riqueza de la parcela del estrato rasante.
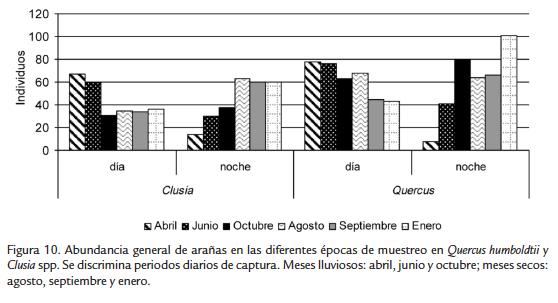
La abundancia general de arañas varió durante los periodos de colecta y las épocas de muestreo, registrándose para Q. humboldtii y Clusia spp., mayor abundancia durante el día en la época lluviosa y durante la noche en la época seca (Fig. 10).
La abundancia de las familias de arañas varió a lo largo del muestreo (Fig. 11). Theridiidae, Araneidae y Anyphaenidae presentaron mayores abundancias en la época seca en los dos tipos de árboles, mientras que Salticidae tuvo mayor abundancia en la época lluviosa. En Clusia spp. Theridiosomatidae fue más abundante durante la época de lluvias, mientras que en Q. humboldtii lo fue en época seca. Linyphiidae tuvo mayor abundancia en lluvias para Clusia spp. y en época seca para Q. humboldtii. Las mayores abundancias se presentaron en la transición de la época lluviosa y la seca.
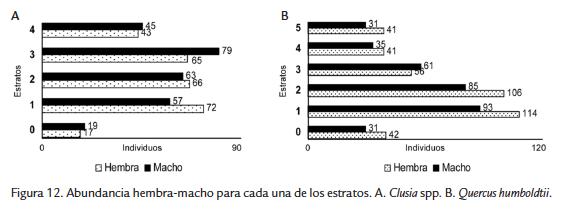
Se registró predominio de hembras en las muestras (relación hembra-macho 2,5 en promedio para Q. humboldtii y 1,5 para Clusia spp.), mientras que la proporción de sexos varió según el tipo de árbol y el estrato. Para Clusia spp. la proporción y número de machos fue mayor en los estratos 3 y 4 (Fig. 12A). En Q. humboldtii el número de hembras fue mayor en todos los estratos excepto en el estrato 3 (Fig. 12B). Para las dos especies de árboles la mayor proporción de hembras se registró en la época lluviosa y la de machos en la época seca (Fig. 13). En agosto y enero (época seca) la proporción fue igual y en estos meses se observaron eventos de cópula. Para el muestreo en total se observó que la proporción de juveniles fue menor a la de adultos en todos los estratos, salvo para la parcela en Clusia spp. y el estrato 5 de Q. humboldtii (Fig. 13).
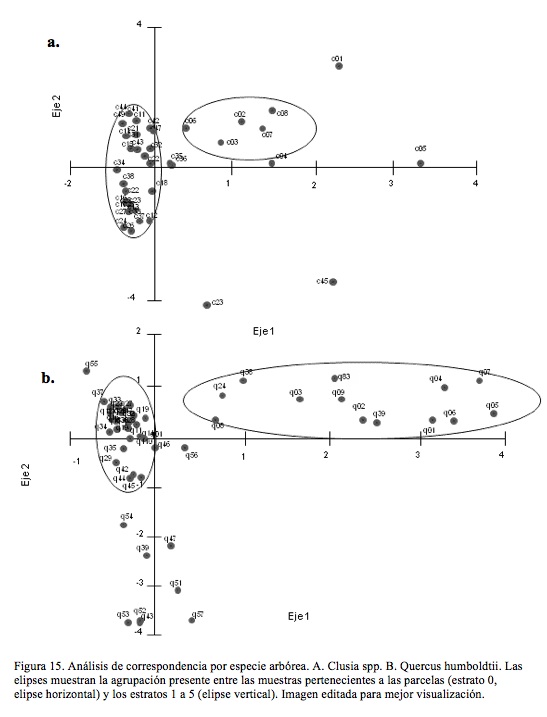
En cuanto a la similitud cuantitativa de las arañas observadas por estratos, Clusia spp. y Q. humboldtii presentaron mayor semejanza entre los tres primeros estratos, mientras que la parcela se encontró separada de los demás nodos con una baja similitud (Fig. 14), denotando su completa independencia.
El análisis de correspondencia confirmó la independencia de las parcelas y la unidad estructural de los árboles (Fig. 15). El análisis de componentes principales mostró el aporte de los estratos y modelo arquitectural (tipo de árbol) sobre la abundancia y composición de las arañas encontradas (Tabla 1).
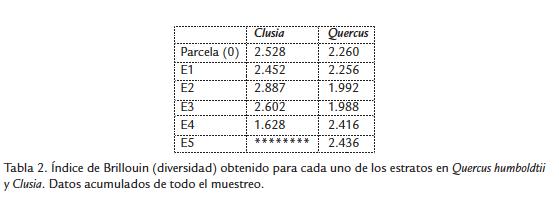
Clusia spp. presentó la muestra de arañas más diversa según el índice de Brillouin, tomando al árbol como unidad, y en los tres primeros estratos (Tabla 2); Q. humboldtii solo presentó valores superiores a Clusia spp. en los estratos 4 y 5. Los estratos 2 y 3 de Clusia , y los estratos 4 y 5 de Q. humboldtii presentaron la mayor diversidad dentro de cada tipo de árbol. En ambos casos estos estratos correspondieron a los lugares con mayor cantidad de ramas, hojas y número de soportes.
EL índice de Simpson mostró que las arañas asociadas a los dos tipos de árboles tienen muy baja dominancia (Tabla 3), observándose los valores más altos en los estratos 2 y 3 de Q. humboldtii (Tabla 3).
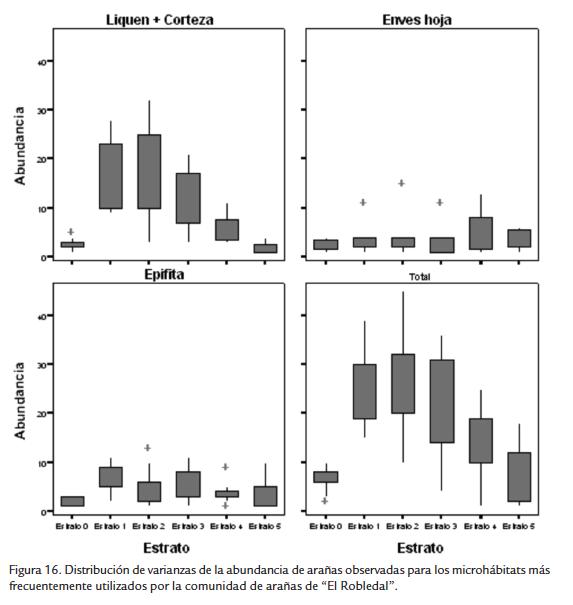
La distribución de varianzas de la abundancia de arañas observadas para los microhábitats más frecuentemente utilizados evidenció una segregación por estratos y por microhábitat, siendo los líquenes y las cortezas los más ampliamente utilizados, y los estratos 3 y 4 los más variables (Fig. 16).
PATRONES DE DISTRIBUCIÓN
De acuerdo con los resultados se pueden diferenciar tres segmentos básicos en la distribución vertical de arañas en los árboles estudiados: los seis primeros metros (estratos 1 y 2), que incluyeron la base y el tronco, los últimos 12 a 15 metros (estratos 4 y 5), que incluyeron el fuste y la copa del árbol, y la transición entre estos dos (Fig. 15 y 16). Este patrón fue semejante en las dos especies de árboles, así como la independencia de las arañas de los árboles respecto de las arañas de las parcelas del estrato rasante. En adición, el efecto de los modelos arquitecturales diferentes se asoció al menos en parte con las diferencias en abundancia, riqueza y composición que presentaron las arañas asociadas a Q. humboldtii o a Clusia spp.
La independencia en composición de la comunidad de arañas de los árboles respecto de la vegetación circundante fue evidente en la menor similitud y baja abundancia y riqueza de las parcelas, en especial las asociadas a Q. humboldtii (Fig. 15 y 16). Esto puede relacionarse con la biomasa de la hojarasca, muy homogénea al estar compuesta casi exclusivamente por hojas senescentes de Q. humboldtii, junto con la baja densidad de herbáceas y plántulas del estrato rasante vistas en el Robledal. Lo anterior se traduce en pocos sitios de refugio para las arañas.
Aunque no se midió, se observaron diferencias en la luminosidad incidente en los sitios donde crece Clusia spp., que corresponden a claros, lo que favorece el desarrollo de herbáceas y arbustos; quizás por esto sus parcelas, aunque independientes, presentaron mayor similitud con lo encontrado en los estratos (Fig. 15B y 16B), lo que respondería a los aportes de las especies vegetales colindantes con Clusia spp. que brindan soportes a alturas bajas similares a los soportes ofrecidos por los estratos 1 y 2 de la planta, coincidiendo con lo observado por Terborgh (1985) y por Ysnel y Canard (2000).
Los modelos arquitecturales de cada tipo arbóreo constituyeron alternativas diferentes para las arañas asociadas a estos. El modelo Scarrone, el de Clusia spp., ofreció un mayor número de microhábitats que el modelo Rauh de Q. humboldtii. La ramificación de Clusia , a distancias cercanas al suelo y con muchas ramificaciones desde el fuste, generaría las condiciones para albergar una mayor riqueza y diversidad de arañas a alturas bajas, que solo se equipara con las obtenidas en últimos estratos de Q. humboldtii, correspondientes a su copa. Además, las hojas grandes y suculentas de Clusia spp., en su mayoría sin herbivoría, podrían ofrecer un sitio seguro para la eclosión de huevos y la maduración de juveniles, y presentaron en su entorno una mayor asociación de especies vegetales, como Chusquea scandens, Piper sp., Elaphoglossum sp. y Viburnum sp., permitiendo el establecimiento de un mayor número de familias y morfotipos en estratos más bajos; riqueza que solo fue alcanzada por Q. humboldtii en los estratos 4 y 5, donde la mayor ramificación permitió un establecimiento de individuos comparable.
La mayor abundancia y riqueza de arañas en los dos primeros estratos fue comparable con lo encontrado por Flórez en bosque seco tropical (Flórez,1996; Flórez 1997; Flórez 1998; Flórez ,1999), quien referenció un aumento en la riqueza y abundancia de arañas cazadoras y ambulatorias en la vegetación baja y arbustiva. La distribución por familias también concordó con el estudio realizado por Sørensen (2003), en el que familias como Tetragnathidae, Theridiosomathidae y Linyphiidae hacen parte del gradiente vertical. Respecto a la estacionalidad, la menor abundancia de arañas encontrada en Q. humboldtii y Clusia spp. para el periodo lluvioso (abril-junio) fue contraria a los registros para el neotrópico, donde se evidencia un aumento de la riqueza en este periodo, incluidos trabajos realizados en bosques andinos, subandinos y tropicales (Turnbull, 1960; Höfer et al.,1994; Bello, 1995; Silva, 1996; Gilede, 1999; Cortez y Fagua, 2003). Una explicación a este contraste pudo ser la lluvia constante durante el día, un fenómeno con severa influencia en la actividad de los organismos de alta montaña, porque por la acumulación de gotas debajo de las hojas y la saturación de las epífitas, se reduce el establecimiento de las arañas.
Se debe destacar que en los meses lluviosos se incrementó el encuentro de juveniles y de adultos con ovisacos durante la noche, cuando la temperatura se estabilizó y las lluvias fueron escasas y débiles. El mayor número de ovisacos en la época lluviosa hace pensar que esta época corresponde a la temporada reproductiva de algunas de las especies estudiadas. Evento contrastante con la época seca, en la que el número juveniles disminuyó drásticamente, mientras que el número de hembras y machos adultos fue mucho mayor y con frecuentes episodios de cortejo o cópula, aunque exclusivamente en la noche. En consecuencia, se puede suponer que durante la época seca se llevan a cabo los eventos de cópula y que el inicio del ciclo de desarrollo de la mayoría de las arañas del sitio de estudio coincide con el inicio de la época de lluvias.
Aunque el mayor número de individuos pertenecientes a Araneidae fue encontrado en los estratos 3-5, la predominancia de cazadoras y constructoras de telas irregulares en los mismos fue un resultado que se diferencia de la tendencia general de que a mayor follaje, mayor probabilidad de encuentro de arañas orbitelares y disminución de cazadoras y ambulatorias, restringiéndose estas a las zonas bajas (Flórez, 1996). Esto posiblemente obedezca a la intensidad del viento y a los drásticos cambios de temperatura del dosel del bosque (Parker, 1995), evento exacerbado en un bosque andino. Además, la superficie de las ramas del dosel ofrece un refugio y una gran cantidad de área que recorrer en busca de la presa. El estudio de Silva (1996), registra también un número considerable de arañas cazadoras en el dosel, mientras que Turnbull (1960) sugiere que el microhábitat encontrado en los bosques ofrece características importantes en el establecimiento de arañas y algunos insectos.
La telaraña y su posición son factores importantes dentro de la estrategia de forrajeo de las arañas (Foelix, 1996); así, la posición de las telas orbitelares en la vegetación es determinante en el tipo y número de presas que capture. En la hojarasca predominan telas horizontales (paralelas al suelo) de Linyphiidae y Pholcidae, que permiten la captura de insectos saltadores y corredores, en contraste con telas verticales perpendiculares al suelo y más grandes, pertenecientes a Micrathena, Araneus y Cyclosa, que se encontraron a mayores alturas (entre 12-18 m), donde serían más eficientes en la captura de insectos voladores. Lo anterior sugiere que el lugar de construcción de la tela no es determinado por la distribución vertical, sino por el microhábitat generado por la estructura vegetal, esto es, las arañas construyen su tela en los lugares donde las condiciones requeridas son similares, sin importar la localización estratificada de estos. La distribución de sexos mostró un predominio de hembras y un aumento de los juveniles y adultos en estratos superiores hacia el mes de agosto. Este evento permite inferir migraciones verticales de los machos durante el forrajeo, acompañadas del establecimiento de las hembras en los estratos altos para la ubicación de ovisacos. Lo anterior también sugeriría que las hembras realizan el cuidado parental en los estratos cercanos al dosel y los machos permanecerían errantes en busca de presas o de pareja en la época seca. La mayor abundancia de arañas en estratos 4 y 5 y su baja relación con las arañas de la vegetación circundante está a favor de los estudios realizados por Basset (1992); Basset, (1999) y Basset et al., (2003), quienes reportan mayores abundancias cerca al dosel, y contrario a Valderrama (1996), quien asume una mayor abundancia de arañas en los estratos bajos del bosque.
El modelo de estratificación en tres niveles que se obtuvo en este estudio: primeros metros (independientes de la vegetación circundante), transición y fuste-copa, pone de manifiesto que la metodología tradicional de colecta (Up and Down; Coddington et al., 1991; Coddington et al.,1996), donde se colecta sobre una gran variedad de microhábitats en estrato rasante y se establecen diferencias a alturas entre 0-2 m, no toma en cuenta uno de los estratos de mayor riqueza; en nuestro caso, los asociados al fuste de los árboles. En este sentido, un adecuado método de colecta de arañas debería incluir colectas mediante la agitación de follaje o "zarandeo" de los elementos arbóreo arbustivos en donde esto fuese posible. Dicha acción incrementará el número de especies encontradas. Como se observó en el análisis de Q. humboldtii y Clusia spp., las arañas mostraron mayor diversidad en los estratos donde se presentaban ramificaciones, o asociaciones con epífitas y otras especies vegetales, independiente de la altura. Se sugiere por lo tanto que la arquitectura y estructura particular de cada modelo arquitectónico de los árboles que compone un bosque son factores importantes en el establecimiento de arañas, y que son relevantes en la dinámica de esta comunidad. Sin embargo, la asociación árbol-araña, puede estar probablemente influida por patrones anuales y diurnos, que se encuentran afectando directamente los hábitos cazadores de las arañas, así como la sincronía en los eventos de cópula y nacimiento.
AGRADECIMIENTOS
A Mauricio Diazgranados e Iván Muñoz por sus aportes en la caracterización vegetal, a Daniel y a los funcionarios y colaboradores del Santuario de Fauna y Flora Iguaque: Raquel, Carmen, Fernando, Carlos Sáenz, Felipe Rubio, por toda su colaboración. Este artículo hace parte del proyecto "Distribución vertical de arañas asociadas a Quercus humboldtii y Weinmannia tomentosa en el Santuario de Flora y Fauna Iguaque", financiado por la Vicerrectoría Académica de la Pontificia Universidad Javeriana y por el programa de becas de la Sociedad Colombiana de Entomología SOCOLEN.
BIBLIOGRAFÍA
BASSET Y. Influence of leaf traits on the spatial distribution of arboreal arthropods within an over story rainforest tree. Ecol Entomol. 1992;17(1):8-16.
BASSET Y. Diversity and abundance of insect herbivores foraging on seedlings in a rain forest in Guyana. Ecol Entomol. 1999;24(3): 245-259.
BASSET Y, NOVOTNY V, MILLER E, KITCHING L. Arthropods of tropical forest. Spatio-temporal dynamics and resource use in the canopy. Cambridge University Press. Cambridge. 2003.
BELLO SJC. Efectos de borde sobre la distribución de arañas orbitelares (Araneae: Orbicularie) en un bosque de niebla de la Reserva Natural La Planada, Nariño. Trabajo de grado. Pontificia Universidad Javeriana, Bogotá; 1995.
CORTEZ C, FAGUA G. Diversidad de arañas en transectos borde-interior de un bosque del Piedemonte Cordillerano (Medina-Cundinamarca). Rev Colomb Entomol. 2003;29(2):113-120.
CODDINGTON JA, GRISWOLD CE, SILVA D, PEÑARANDA E, LARCHER FS. Designing and testing sampling protocols to estimate biodiversity in tropical ecosystems. En: Dudley EC, editor. The Unity of Evolutionary Biology: Proceedings of the Fourth International Congress of Systematic and Evolutionary Biology, Dioscorides Press, Portland Or., 2 vols; 1991. p. 44-60.
CODDINGTON JA, YOUNG LH, COYLE FA. Estimating spider species richness in a southern Appalachian cove hardwood forest. J Arachnol. 1996;24(2):111-128.
COLWELL RK, CODDINGTON JA. Estimating terrestrial biodiversity through extrapolation. Philos T Roy Soc B. 1994;345(1311):101-118.
DAVIS D. National tree climbing field guide: 2005 edition. Tech. Rep. 0567- 2819-MTDC. Missoula, MT: U.S. Department of Agriculture, Forest Service, Missoula Technology and Development Center; 2005. p. 88.
DIPENAAR-SCHOEMAN AS, JOCQUÉ R. African spiders: An identification manual. Plant Protection Research Institute Handbook 9, Agricultural Research Council, Pretoria; 1997. p. 392.
ECHEVERRY A. Análisis arquitectónico, Quercus humboldtii, Roble. Informe de Proyecto "Campos circundados". Colciencias-Universidad de Antioquía. Medellín; 1997. p. 48.
ENDERS F. Vertical stratification in orb web spiders (Araneidae, Araneae) and consideration of other methods of coexistence. Ecology.1974;55(2):317-328.
ERWIN TL. Canopy arthropod biodiversity: A chronology of sampling techniques and results. Rev Peru Entomol.1991;32(1):71-77.
FLÓREZ E. Arañas del departamento del Valle del Cauca. Cespedesia. 1996;20(66):185-187.
FLÓREZ E. Estudio de la comunidad de arañas del bosque seco tropical de la estación biológica "El Vínculo". Cespedesia. 1997;22(69):37-57.
FLÓREZ E. Estructura de comunidades de arañas (ARANEAE) en el departamento del Valle, Suroccidente de Colombia. Caldasia. 1998;20(2):173-192.
FLÓREZ E. Comunidades de arañas de la región Pacífica del Valle del Cauca, Colombia. Rev Colomb Entomol. 1999;26(3-4):77-81.
FOELIX RF. Biology of Spiders. Second Edition. Oxford University Press. Oxford. 1996. p. 1-330.
GARCES DM, DE LA ZERDA S. Gran libro de los parques nacionales de Colombia. Intermedio Editores. Bogotá; 1994. p. 94.
GARRISON RW, WILLING MR. Arboreal invertebrates. In: Reagan DP, Waide RB. Editors. The food web of a tropical rain forest. The University of Chicago Press, Chicago; 1996. p.183-245.
GREENSTONE MH. Determinants of web spider species diversity: Vegetation structural diversity vs. prey availabity. Oecologia. 1984;62(3):299-304.
GILEDE, O. Relación entre disturbios, oferta estructural del hábitat y diversidad de arañas orbitelaresensotobosques de galería (Meta-Colombia). Trabajode grado (Biólogo) Pontificia Universidad Javeriana, Facultad de Ciencias, Departamento de Biología; 1999.
GUNNARSSON B. Vegetation structure and the abundance and size distribution of spruce-living spiders. J Anim Ecol. 1990(2);59:743-752.
HALLE F, OLDEMAN RA, TOMLINSON APB. Tropical trees and forests: An architectural analysis. Springer-Verlag. Berlin; 1978. p. 441.
HÖFER H, BRESCOVIT AD, ADIS J, PAARMAN W. The Spider Fauna of Neotropical Tree Canopies in Central Amazonia: First Results. Stud Neotrop Fauna Environ. 1994;29 (1):23-32.
JANZEN DH, SCHOENER TW. Difference in insect abundance and diversity between wetter and drier sites during a tropical dry season. Ecology.1968;49(1):96-110.
KASTON BJ. How to know the spiders. University of Chicago, Chicago press; 1978. p. 272.
KORIBA K. On the periodicity of tree growth in the tropics with reference to the model of branching. The leaf-fall and the formation of the resting bud. Gardens Bull Sing.1958;7(1):11-81.
LEVI HW. Keys to the neotropical genera of Araneidae. J Arachnol. 2000;28(1):107-114. MAGURRAN A. Diversidad ecológica y su medición. Ediciones VEDRA. Barcelona; 1989. p. 200.
McCUNE B, MEFFORD, MJ. PC-ORD. Multivariate Analysis of Ecological Data [programa de ordenador]. Version 6. MjM Software, Gleneden Beach, Oregon; 1997.
MILLS L, FREDIRCKSON J, MOORHEAD B. Characteristics of old-growth forest associated with northern spotted owls in Olympic National Park. J Wildl Manage. 1993;57(2):315-321.
PARKER G. Structure and microclimate of forest canopies. In forest canopies, MD Lowman, N Nadkarni (eds). Academic Press. San Diego. CA; 1995. p. 73-106.
ROBINSON J. The effect of architectural variation in habitat on a spider community: an experimental field study. Ecology. 198;62(1):73-80.
ROBINSON MH, ROBINSON B. Ecology and Behavior of the Giant Wood Spider Nephila maculate (Fabricius) in new Ginea. Smithsonian Contributions to Zoology. 1973;49(1):1-76.
SILVA D. Species composition and community structure of peruvian rainforest spiders: A case study from seasonally inundated forest along the Samiria River. Rev Suisse Zool. 1996;(Hors Série):597-610.
SMITH A. Stratification of temperate and tropical forest. Am Nat. 1973;107(958):671-683.
SØRENSEN L. Stratification of the spider fauna in a Tanzanian forest. En: Basset Y, Miller S, Novotny V, Kitching R, editors. Arthropods of tropical forest. Spatio-Temporal Dynamics and Resource Use in the Canopy. Cambridge University press. Cambridge; 2003. p. 92-101.
STATSOFT, INC. Statistica (data analysis software system) [programa de ordenador]. Version 6.0; 2001.
TOMLINSON, PB. Tree architecture. Am Sci.1983;71(2):141-149. TERBORGH J. The vertical component of plant species diversity in temperate and tropical forest. Am Nat. 1985;126(6):760-777.
TERBORGH J, PETREN K. Development of habitat structure through succession in an Amazonian floodplain forest. En: Bell SS, McCoy ED, Mushinsky HR, editors. Habitat structure: the physical arrangement of objects in space. Chapman & Hall. London; 1991. p. 28-46.
TURNBULL AL. The spiders population of a stand of oak (Quercus robus L.) in Witham wood berks, England. Can Entomol. 1960;92(2):110-124.
UETZ GW, JOHNSON AD, SCHEMZKE DW. Web placement, web structure and prey capture in orb-weaving spiders. Bull Brit Arachnol Soc. 1978;4(4):141-148.
UNESCO/FAO/PNUMA. Ecosistemas de los bosques tropicales. Roma; 1980. p. 683.
VALDERRAMA CA. Comparación de la distribución vertical de arañas constructoras de telas orbiculares en tres zonas de un bosque nublado. Tesis de Maestría en Ecología. Universidad de los Andes, Bogotá; 1996.
YSNEL F, CANARD A. Spider biodiversity in connection with the vegetation structure and the foliage orientation of hedges. J Arachnol. 2000;28(1):107-114.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2012 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).