DETECCIÓN Y DIFERENCIACIÓN DE Mycoplasma gallisepticum Y Mycoplasma synoviae MEDIANTE LA TÉCNICA DE PCR A PARTIR DE HISOPOS TRAQUEALES DE AVES CON SÍNTOMAS RESPIRATORIOS
DETECCIÓN Y DIFERENCIACIÓN DE Mycoplasma gallisepticum Y Mycoplasma synoviae MEDIANTE LA TÉCNICA DE PCR A PARTIR DE HISOPOS TRAQUEALES DE AVES CON SÍNTOMAS RESPIRATORIOS
Detection and Differentiation of Mycoplasma gallisepticum and Mycoplasma synoviaeby PCR from Tracheal Swabs from Birds with Respiratory Symptoms
CESAR E. VENTURA1, M.V.; GLORIA RAMÍREZ2, Ph. D.; VÍCTOR VERA3, Ph. D.
1 Estudiante de Maestría. Grupo de Microbiología y Epidemiología, Universidad Nacional de Colombia, Bogotá, Colombia. Facultad de Medicina Veterinaria, Departamento de Salud Animal, Laboratorio de Virología, Universidad Nacional de Colombia, Tel.: 316 50 00, ext. 19469. ceventurap@unal.edu.co. 2Grupo de Microbiología y Epidemiología, Universidad Nacional de Colombia, Bogotá, Colombia. gcramirezn@unal.edu.co.3Grupo de Microbiología y Epidemiología, Universidad Nacional de Colombia, Bogotá, Colombia. vjveraa@unal.edu.co Correspondencia: ceventurap@unal.edu.co
Presentado el 14 de junio de 2012, aceptado el 12 de octubre de 2012, correcciones el 26 de octubre de 2012.
RESUMEN
Los micoplasmas son importantes patógenos en las aves por ser responsables de cuadros respiratorios que ocasionan grandes pérdidas económicas a la industria avícola alrededor del mundo. Existen principalmente dos especies de micoplasmas como causantes de enfermedad en aves comerciales, el Mycoplasma gallisepticum(MG) y el Mycoplasma synoviae(MS). Teniendo en cuenta su importancia y la necesidad de conocer y diferenciar las diferentes especies de micoplasmas presentes en las explotaciones avícolas, se tomaron 91 muestras de hisopos traqueales de aves con síntomas respiratorios, provenientes de igual número de granjas de pollo de engorde, ponedoras comerciales y reproductoras pesadas ubicadas en los departamentos de Cundinamarca y Boyacá, Colombia, y se determinó la presencia de MG y MS por la técnica de PCR. La prevalencia determinada fue de 39,6 % para MG y 47,3 % para MS, encontrándose diferencias estadísticamente significativas cuando se comparó la positividad a MG y MS y el tipo de explotación (p < 0,05), siendo mayor la presentación en ponedoras y reproductoras que en explotaciones de pollo de engorde. Se encontraron diferencias cuando se compararon los resultados en diferentes grupos etáreos, siendo mayor el porcentaje de positividad para MG y MS en las aves con edades entre 20 y 60 semanas tanto en ponedoras comerciales como en reproductoras, mientras que en el grupo de pollo de engorde se encontró una mayor positividad para MG en aves de cinco semanas y para MS en aves de dos semanas.
Palabras clave: Mycoplasma gallisepticum, Mycoplasma synoviae, PCR.
ABSTRACT
Mycoplasmas are worldwide pathogens that affect the poultry industry causing respiratory illness which cause a negative economic impact. Two mycoplasmas species are the most important in the commercial poultry: Mycoplasma gallisepticum(MG) and Mycoplasma synoviae(MS). By its importance and necessity to know and differentiate between mycoplasmas species in locals poultry houses this study used the PCR technique like a diagnosis tool, using tracheal swabs from bird with respiratory symptoms. A total of 91 samples from broilers, layers and breeders farms located in the departments of Cundinamarca and Boyacá was processed. The punctual prevalence founded in this study was 39.6 % for MG and 47.3 % for MS. Statistical differences for type of production and positive samples for MG y MS (p < 0.05) were founded, a bigger number of positive samples from layers and breeder in comparison to broilers was found. In the same way, the positive samples for the layers and breeder from the age group between 20 and 60 weeks was greater, while for the broilers group most of the positive samples were from five weeks old birds for MG and two weeks old birds for MS.
Keywords: Mycoplasma gallisepticum, Mycoplasma synoviae, PCR.
INTRODUCCIÓN
Se considera a la micoplasmosis aviar ocasionada por Mycoplasma gallisepticum(MG) y/o Mycoplasma synoviae(MS) como una de las enfermedades aviares de mayor impacto económico en las explotaciones de pollos de engorde, ponedoras comerciales y reproductoras alrededor del mundo (Kleven, 2006) siendo una enfermedad de declaración obligatoria de acuerdo con la Organización Mundial de Sanidad Animal (OIE, 2004). La micoplasmosis aviar es de gran importancia por el impacto negativo que ocasiona en los parámetros productivos, caracterizándose por ocasionar una disminución en la producción de huevos y baja calidad de los mismos en aves productoras de huevo comercial o por reducir la incubabilidad y ocasionar una alta tasa de mortalidad embrionaria en reproductoras livianas y pesadas, además de llevar a una alta selección de pollitos y pollitas1 de un día de edad en las incubadoras y a un aumento de la conversión alimenticia2 en las granjas de producción (Nascimento et al., 2009). En pollos de engorde, por su parte, produce disminución en la ganancia de peso e incremento en la tasa de decomisos en las plantas de sacrificio (OIE, 2008). Igualmente se considera que la infección por micoplasma facilita la presentación de otras infecciones respiratorias de tipo viral como la enfermedad de Newcastle y la bronquitis infecciosa aviar o de tipo bacteriano, principalmente por Escherichia coli, llevando en muchas ocasiones a la presentación de la Enfermedad Respiratoria Crónica (ERC) en las aves (Bencina, 2009). Del mismo modo, la presencia de micoplasmas se ha asociado a complicaciones posvacunales por contribuir en la generación de reacciones excesivas y/o prolongadas en lotes de pollo infectados (Butcher, 2002).
Actualmente el diagnóstico de la enfermedad se basa principalmente en pruebas serológicas como la prueba de aglutinación rápida en placa, la técnica de ELISA y la prueba de inhibición de la hemaglutinación (Cerdá, 2007). El aislamiento bacteriano es otro método de diagnóstico, pero es dispendioso y costoso por lo cual su uso es limitado. En la actualidad se ha incrementado el uso de vacunas vivas y bacterinas de M. gallisepticum y de M. synoviae como método de control de los signos clínicos de la enfermedad en las granjas (Ley et al., 1997; Feberwee et al., 2006), haciéndose necesario el empleo de herramientas diagnósticas más sensibles y especificas que permitan establecer el origen de las infecciones y diferenciar entre cepas vacunales y cepas de campo, lo cual es indispensable para establecer el comportamiento de la enfermedad en las granjas y así plantear mejores medidas de control.
En este sentido, técnicas moleculares como la reacción en cadena de la polimerasas (PCR), la cual detecta la presencia de la bacteria a partir de su ácido nucleíco, es una alternativa diagnóstica que ofrece una alta sensibilidad y especificidad.
Teniendo en cuenta lo anterior, el objetivo de este trabajo de investigación fue establecer la presencia y ofrecer alternativas para la diferenciación de las dos principales especies de micoplasmas: MG y MS, mediante el uso de la técnica de PCR a partir de hisopos traqueales provenientes de lotes de aves que reportaron problemas respiratorios actuales y/o recientes en granjas de los departamentos de Cundinamarca y Boyacá.
MATERIALES Y MÉTODOS
MUESTRAS DEL ESTUDIO
En el laboratorio de Virología Veterinaria de la Universidad Nacional de Colombia se recibieron entre los meses de septiembre de 2011 y enero de 2012 un total de 91 muestras de hisopos traqueales3 de aves que presentaban historia de problemas respiratorios actuales y/o recientes, provenientes de explotaciones avícolas de diferente tipo así: 50 granjas de pollo de engorde, 35 de ponedoras comerciales y seis de reproductoras pesadas, las cuales estaban ubicadas en los departamentos de Boyacá y Cundinamarca. Las muestras de hisopos traqueales se conservaron en tubos eppendorf a -20 °C hasta su procesamiento en el laboratorio. No se uso ningún tipo de medio de transporte o preservante en las muestras.
ANÁLISIS ESTADÍSTICO
Para el análisis estadístico se realizaron pruebas de Chi-Cuadrado mediante el uso del software Statistix 8.0.
EXTRACCIÓN DE ADN
Se realizó la extracción de ADN a partir de los hisopos, mediante un procedimiento modificado de (Hernández et al., 2009), el cual consistió en tres lavados sucesivos en solución de PBS y centrifugación a 14000 rpm por diez minutos, seguido de resuspensión del pellet en 40 µl de PBS como volumen de elusión, el producto fue sometido a calentamiento a 100 °C por diez minutos y a un enfriamiento de -20 °C por diez min. Finalizando con una centrifugación a 14000 rpm por diez min y transferencia de los sobrenadantes a un tubo libre de nucleasas, conservándose a -20 °C hasta su uso. Para verificar la calidad del ADN extraído se utilizó como Housekeeping celular, (Tabla 1), una porción del gen 28S de Gallus gallus (Suzuki et al., 2009), normalizado con las siguientes condiciones: 2 µl de buffer para PCR 10 X (Invitrogen® Buffer PCR 10 X), 0,8 µl de MgCl 50 mM (Invitrogen® MgCl 50 mM), 0,4 µl de nucleótidos a 10 mM (dATP, dCTP, dGTP, dTTP Invitrogen®), 0,4 µl de primer F (50 µM Invitrogen®) y 0,4 µl de primer R (50 µM Invitrogen®), Taq Platino 0.125 µl de 5 U (Invitrogen® Taq Platino 5 u/µl), 13,88 µl de agua y 2 µl de ADN.
PROTOCOLO DE AMPLIFICACIÓN PARA M. gallisepticum
Se usaron primers previamente reportados (García et al., 2005), (Tabla 1), que amplifican una región polimórfica del gen mgc2., el cual codifica para proteínas de superficie que están relacionadas con la citoadherencia (Hnatow et al., 1998; Bencina, 2002) y permite la diferenciación de algunas cepas de MG directamente y mediante pruebas pos-PCR como la RFLP (Restriction Fragment Length Polimorphism).
El volumen final de cada reacción fue de 20 µl, y se usaron los siguientes volúmenes y concentraciones: 2 µl de buffer para PCR 10 X (Invitrogen® Buffer PCR 10 X), 0,52 µl de MgCl 50 mM (Invitrogen® MgCl 50 mM), 0,4 µl de nucleótidos a 10 mM (dATP, dCTP, dGTP, dTTP Invitrogen®), 0,16 µl de primer F (50 µM Invitrogen®) y primer R (50 µM Invitrogen®), Taq Polimerasa 0.08 µl de 5 U (Invitrogen® Taq Polimerasa 5 u/µl), 14,68 µl de agua y 2 µl de ADN.
PROTOCOLO DE AMPLIFICACIÓN PARA M. synoviae
Se utilizaron primers previamente reportados (Wetzel et al., 2010), ver Tabla 1, que anillan con el gen vlhA, el cual es altamente polimórfico y codifica para proteínas del tipo hemaglutininas (Bencina, 2002).
El volumen final de cada reacción fue de 20 µl, con los siguientes volúmenes y concentraciones: 2 µl de buffer para PCR 10 X (Invitrogen® Buffer PCR 10 X), 0,8 µl de MgCl 50 mM (Invitrogen® MgCl 50 mM), 0,4 µl de nucleótidos a 10 mM (dATP, dCTP, dGTP, dTTP Invitrogen®), 0,2 µl de primer F (50 µM Invitrogen®) y primer R (50 µM Invitrogen®), Taq Polimerasa 0.08 µl de 5 U (Invitrogen® Taq Polimerasa 5 u/µl), 14,32 µl de agua y 2 µl de ADN.
Como controles positivos de las reacciones se emplearon cepas vacunales: para el caso de MG se usó F-VAX-MG® que contiene la cepa F (Intervet-Schering Plough®) y para MS la vacuna MSBac® que contiene la cepa WVU-1853 (Fort Dodge Animal Health®). Se uso ADN de tejidos de pollo como control positivo del housekeeping celular. Los amplificados fueron obtenidos en un termociclador Eppendorf Mastercycler Gradient®, programado así: una denaturacion inicial a 94 °C por 3 min, 39 ciclos de 94 °C por 30 seg, 53 °C por 30 seg, 72 °C por 90 seg y una extensión final de 72 °C por 5 min. Para el housekeeping se uso el siguiente programa: una denaturacion inicial de 94 °C por 5 min, 35 ciclos de 94 °C por 30 seg, 58 °C por 30 seg, 72 °C por 60 seg y una extensión final de 72 °C por 10 min.
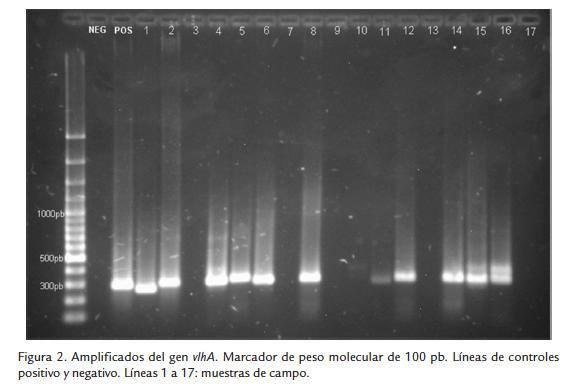
Las electroforesis para evaluar los productos de amplificación fueron corridas en agarosa al 1,5 % en buffer TAE 1 X, en un equipo PowerPac HC® (Bio-Rad Laboratories®) a 85 V por 95 min. Se usaron 5 µl de producto de PCR y 1 µl de EZ-Vision® (Amresco Life Science Research®) como buffer de carga y colorante. Como marcador de peso mo- lecular se empleó el DNA GeneRuler 100 pb Plus® (Fermentas®). La lectura se hizo en un fotodocumentador GelDoc-XR® (Bio-Rad Laboratories®) bajo luz ultravioleta.
RESULTADOS
Se normalizó la técnica de PCR para diagnóstico de MG y MS a partir de muestras de campo y se obtuvieron los amplificados esperados de 300 pb para cada uno de los agentes analizados MG (Fig.1) y MS (Fig.2). Del mismo modo, se confirmó el amplificado de 61 pb del housekeeping celular en la totalidad de las muestras procesadas. Del total de 91 muestras procesadas, 36 (39,6 %) fueron positivas para M. gallisepticum (MG) y 43 (47,3 %) fueron positivas para M. synoviae (MS).
Se observó que el mayor porcentaje de positividad tanto para MG como para MS fue encontrado en las muestras de ponedoras y reproductoras como se indica en la Tabla 2. En cuanto a la presentación de infecciones mixtas por MG y MS, solo se encontró en dos muestras (4 %) en el grupo de pollo de engorde, mientras que en el grupo de pone- doras fue del 34,3 % (12/35) y en el de reproductoras del 16,7 % (1/6).
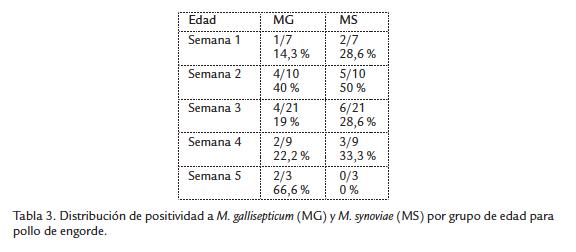
Para facilidad del análisis y ver el efecto de la edad en la presentación de MG y MS en las ponedoras y reproductoras que son aves de ciclo largo4, se consideraron cuatro grupos etáreos: I: 0-20 semanas, II: 21-40 semanas, III: 41-60 semanas y IV: mayor a 61 semanas, a diferencia del grupo de pollo de engorde donde el análisis se hizo tomando las semanas de edad de la uno a la cinco.
En relación a la distribución de positividad mixta por grupo de edad, se halló que en el grupo de pollo de engorde las dos muestras correspondían a aves de cuatro semanas de edad, una muestra del grupo de reproductoras era de aves entre 41 y 60 semanas, mientras que en el grupo de ponedoras el 75 % (9/12) de las infecciones mixtas eran aves entre 21 y 40 semanas de edad y el otro 25 % eran aves entre 41 y 60 semanas de edad. Al analizar los resultados de acuerdo con la distribución por rangos de edad de las aves frente a la presencia de MG y/o MS, se encontró que en el grupo de pollo de engorde el mayor porcentaje de positivos a MG estaba en las aves de cinco semanas y para MS en las de dos semanas de edad (Tabla 3), mientras que en el grupo de ponedoras la presentación de positivos a MG fue mayor en las aves con edades entre 21 y 40 semanas, y para MS la positividad fue del 100 % para el grupo de 41 y 60 semanas de edad (Tabla 4).
En relación al grupo de reproductoras se observó que de las cuatro granjas que fueron positivas para MG, el mayor porcentaje de positivos se presentó en el rango de edad de uno a 20 semanas, mientras que para MS el mayor porcentaje estuvo en el grupo de 41 a 60 semanas (Tabla 5).
DISCUSIÓN
Los resultados obtenidos en el presente estudio confirman una alta prevalencia de MG y MS en las muestras analizadas. Se encontraron diferencias estadísticamente significativas entre los diferentes tipos de explotación y la presentación de positividad a ambos agentes (p < 0,05), lo cual puede estar asociado directamente al tiempo que requiere la bacteria para infectar las aves en las granjas en los diferentes ciclos y tipos de producción (Kleven, 2000).
Es de resaltar que actualmente en Colombia, en las granjas avícolas no se usan vacunas vivas de MS y solo unas pocas emplean bacterinas, por lo cual los porcentajes de positividad encontrados en el presente trabajo deben corresponder a infecciones de campo. Esta situación requiere de un análisis y estudios posteriores para el grupo de pollo de engorde, buscando asociar la presentación del agente no solo a los problemas respiratorios reportados sino a la presentación de problemas articulares y locomotores (Jordan, 1975; Lockaby et al., 1999) que se podrían deber a la presencia especifica de MS en las granjas
Así mismo, es importante considerar que la presentación de infecciones por MG solo o en infecciones mixtas con MS a nivel de campo, puede representar una complicación para el manejo farmacológico de las mismas, puesto que el uso de antimicoplásmicos específicos estaría contraindicado en aquellas granjas donde la presencia de MG sea de origen vacunal debido a que uno de los objetivos del uso de vacunas vivas es el desplazamiento de las cepas de campo5 y establecimiento de las cepas vacunales en las granjas (Kleven, 2005).
En Colombia se ha reportado positividad a MG y MS a través de pruebas de aglutinación rápida en placa, inhibición de la hemaglutinación (HI) y de ELISA. En la década del 80, se reportó en lotes de reproductoras de 16 y 71 semanas de edad ubicadas en el departamento de Santander un 74 % de positividad serológica para MG y de 44,4 % para MS (Colmenares y Latorre, 1987), mientras que un trabajo en pollos de engorde de granjas del centro del país reporta seropositividad a MG mediante la prueba de aglutinación rápida en placa del 60,7 % (Bustos,1988). Un trabajo más reciente (Uribe, 2006), reporta seropositividad del 72 % a MS por la prueba de ELISA en granjas de reproductoras y del 10 % a MG en lotes de pollo de engorde. Estos resultados demuestran la presencia de la bacteria desde hace un par de décadas en el país, por lo cual, en la actualidad, los trabajos a nivel molecular son una herramienta de gran importancia en la caracterización y origen de las infecciones en las granjas.
Con relación a estudios empleando la técnica de PCR en nuestro país, recientemente se ha reportado un 17,4 % de positividad a MG en ponedoras comerciales del departamento de Antioquia (Borja et al., 2009), lo cual contrasta fuertemente con el presente trabajo en el cual se encontró un 54,3 % en el grupo de ponedoras comerciales, explicado tal vez por las diferencias en los sistemas de producción de ambas zonas y al uso o no de vacunas vivas de MG en las diferentes granjas. En este trabajo no se reporta la situación de MS, por lo cual es importante realizar estudios que involucren ambos agentes.
De acuerdo con los resultados obtenidos no se encontraron diferencias estadísticas entre la positividad a MG y los diferentes grupos de edad en los tres tipos de explotación (p > 0,05), es decir que la infección por MG se puede presentar a cualquier edad en los diferentes tipos de explotación. Sin embargo, en el presente trabajo se encontraron aves de todos tipos de explotación positivas a ambos agentes de manera individual y mixta, a edades muy tempranas por lo cual se sugiere hacer estudios verticales donde se pueda evaluar la presencia de la enfermedad a nivel de las incubadoras, para de esta manera poder determinar si la presentación de la micoplasmosis es por trasmisión vertical de las madres a la progenie o adquirida directamente en las granjas.
De otro lado, se encontraron diferencias significativas en la presentación de MS en el grupo de ponedoras para los diferentes grupos de edad (p < 0.05), observándose que la positividad aumenta con la edad de los lotes, es decir que la infección por MS al parecer se da de manera progresiva desde la etapa de levante hasta la fase de producción en las aves de postura de huevo.
Para poder conocer más sobre la dinámica de la infección por MG y MS en las granjas se deben llevar a cabo estudios que involucren todas las etapas de producción en los diversos tipos de explotación y asociarlo a los diferentes manejos, como son las densidades y el número de lotes de aves en las granjas, los planes vacunales usados, los tiempos de descanso o vacío sanitario de las mismas y los sistemas de producción (automáticos o manuales).
Del mismo modo, la detección temprana del patógeno mediante las pruebas de PCR puede ser de gran ayuda para establecer las medidas de control necesarias para evitar los efectos negativos de la micoplasmosis en las explotaciones avícolas.
Aunque se encontró positividad a ambos agentes en las granjas de ponedoras y reproductoras en el grupo de edad de una a 20 semanas, fue mucho menor que para las etapas de producción, lo cual podría estar asociado al mejor estatus sanitario de las granjas en las fases de levante de las aves, si se tiene en cuenta que es una práctica común en la industria el usar instalaciones de cría y levante separadas de las áreas de producción en el caso de ponedoras y condiciones "todo adentro todo afuera"6 en el caso de reproductoras, lo cual garantiza procesos de limpieza y bioseguridad mayores. No se conoce si en las granjas de procedencia de las muestras se usaron vacunas vivas de MG, por lo cual para determinar si la positividad encontrada corresponde a bacterias de origen vacunal o de campo, se sugiere llevar a cabo pruebas de diferenciación molecular como la RPFL a las muestras positivas de MG, con el fin de determinar si los patrones obtenidos corresponden a las cepas empleadas en la producción de las vacunas que actualmente se están usando en el país o si muestran un patrón diferente compatible con cepas de campo (Kempf, 1998).
Teniendo en cuenta los resultados aquí presentados, se recomienda hacer trabajos que involucren un mayor número de granjas de reproductoras y pollos de engorde para estudiar la posible ruta de transmisión de las gallinas a su progenie. Asimismo, es importante llevar a cabo estudios similares en otras regiones del país para poder conocer la situación de estos agentes en los diferentes sistemas de explotación comercial en el ámbito nacional.
AGRADECIMIENTOS
A Colciencias por la financiación del Proyecto 1101-405-20223 Contrato 424-2007. Al Dr. Jairo Rodríguez y a la Dra. Diana Paola Torres por su colaboración en la consecución y remisión de las muestras. A AMEVEA (Asociacion Colombiana de Médicos Veterinarios Especialistas en Avicultura).
BIBLIOGRAFÍA
BENCINA D. Haemagglutinins of pathogenic avian mycoplasmas. Avian Pathol. 2002;31(6):535-547.
BENCINA D. Mycoplasma Infections. Biotechnical Faculty. University of Ljubljana; 2009. p. 1-11.
BORJA JV, OLIVERA M, MONTOYA F, GONZALEZ C, HERRERA A.Diagnóstico por PCR de Mycoplasma gallisepticumen sistemas de producción de huevo de mesa en el departamento de Antioquia. Rev Colomb Cienc Pec. 2009;22(3):479.
BUSTOS F. Prevalencia serológica para algunas enfermedades en pollos de engorde. En: Sistemas de producción avícola. Instituto Colombiano Agropecuario; 1988. p. 246-255.
BUTCHER G. Mycoplasma gallisepticum- A Continuing Problem in Commercial Poultry. Institute of Food and Agricultural Sciences. University of Florida; 2002. p. 1-2.
CERDÁ R. Medidas de prevención y control de la micoplasmosis en Latinoamérica. XX Congreso Latinoamericano de Avicultura; 2007. p. 111-124.
COLMENARES M, LATORRE S. Determinación serológica de anticuerpos contra micoplasmas patógenos, Salmonella pollorum y presencia de anticuerpos vacunales de new castle en reproductores (Tesis). Universidad del Tolima; 1987. p. 59.
FEBERWEE A, LANDMAN W, BANNISEHT WYSMULLER T, KLINKENBERG D, VERNOOIJ JC, GIELKENS AL, STEGEMAN JA. The effect of a live vaccine on the horizontal transmission of Mycoplasma gallisepticum. Avian Pathol. 2006;35(5):359-366.
GARCÍA M, IKUTA N, LEVISOHN S, KLEVEN S. Evaluation and comparison of various PCR methods for detection of Mycoplasma gallisepticuminfection in chickens. Avian Dis. 2005;49(1):125-132.
HERNÁNDEZ Y, LOBO E, MARTÍNEZ S, ZAMORA L. Evaluación de diferentes métodos de extracción de ADN de micoplasmas para su empleo en el diagnóstico por PCR. Rev Salud Anim. 2009;31(2):108-114.
HNATOW LL, KEELER CI, TESSMER LI, CZYMMEK K, DOHMS JE. Characterization of MGC2, a Mycoplasma gallisepticumCytadhesin with homology to the Mycoplasma pneumoniae 30-Kilodalton Protein P30 and Mycoplasma genitalium P32. Infec Immun. 1998;66(7):3436-3442.
JORDAN F. Avian mycoplasma and pathogenicity - A review. Avian Pathol. 1975; 4(3):165-174.
KEMPF I. DNA amplification methods for diagnosis and epidemiological investigations of avian mycoplasmosis. Avian Pathol. 1998;27(1):7-14.
KLEVEN S. Control de Micoplasma Situación Actual. XXVII Seminario Avícola Internacional; 2006. p. 95-104.
KLEVEN S. Micoplasmosis. En: Enfermedades de las aves. Manual Moderno Editores; 2000. p. 195-239.
KLEVEN S. Prevention and control of avian mycoplasmas. Avian Insight. 2005;2(5):1-3.
LEY DH, MCLAREN JM, MILES AM, BARNES J, HEINS MILLER S, FRANZ G. Transmissibility of Live Mycoplasma gallisepticumVaccine Strains ts-11 and 6/85 from vaccinated Layer Pullets to Sentinel Poultry. Avian Dis. 1997;41(1):187-194.
LoCKABY SB, HOERR FJ, LAUERMAN LH, SMITH BF, SAMOYLOV AM, TOIVIOKINNUCAN MA, KLEVEN S. Factors Associated with Virulence of Mycoplasma synoviae. Avian Dis. 1999;43(2):251-261.
NASCIMENTO E, PEREIRA V, NASCIMENTO M, BARRETO M. Avian Mycoplasmosis Update. Braz J Poult Sci. 2009;7(1):1-9.
OIE. Micoplasmosis aviar (Mycoplasma gallisepticum, Mycoplasma synoviae). Manual OIE sobre animales terrestres; 2008. p. 1-17.
OIE. Micoplasmosis Aviar - Mycoplasma gallisepticum. Manual de la OIE sobre animales terrestres; 2004. p. 905-919.
SUZUKI K, OKADA H, ITOH T, TADA T, MASE M, NAKAMURA K, et al. Association of increased pathogenicity of Asian H5N1 highly pathogenic avian influenza virses in chickens with highly efficient viral replication accompanied by early destruction of innate immune responses. J Virol. 2009;83(15):7475-7486.
URIBE A. Diagnóstico y control de la micoplasmosis aviar. XXVII Seminario Avícola Internacional; 2006. p. 43-45
WETZEL A, LEFEVRE KM, RAVIV Z Revised Mycoplasma synoviaevlhA PCRs. Avian Dis. 2010;54(4):1292-1297.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2012 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).