Rizospheric Microbiota of Espeletia spp. from Santa Inés and Frontino-Urrao Paramos in Antioquia, Colombia
DOI:
https://doi.org/10.15446/abc.v20n1.42827Palabras clave:
Espeletia spp., microbiota, páramos, rizósfera, suelo (es)Descargas
The frailejón (Espeletia spp.) is the emblematic shrub of the paramo. This is an important ecosystem because they are sources of water and organic matter, and are inhabited by a high number of endemic biological species. Considering the importance of the microbiota in soil structure and nutrients availability to support plant growth, we assessed the cultivable microbial populations in Espeletia spp. rhizosphere in Santa Inés and Frontino-Urrao paramos, including functional groups with important role in cycling nutrients. The soil pH was strongly acid in both sites and the organic matter and nitrogen contents were highest in Frontino-Urrao soil. Nevertheless, the microbial abundance was similar in these sites except the content of endospore-forming bacteria, which was 3.8 fold large in Frontino-Urrao. Phosphate solubilizing and cellulolytic microorganisms were found in both sites. Those microorganisms would be used for soil restoration processes in paramos degraded by mining, livestock or agriculture.
MICROBIOTA RIZOSFÉRICA DE Espeletia spp. DE LOS PÁRAMOS DE SANTA INÉS Y DE FRONTINO-URRAO EN ANTIOQUIA, COLOMBIA
El frailejón cuyo nombre científico es Espeletia spp., es considerado el arbusto emblema de los páramos, un ecosistema de importancia debido a que son fuente de agua y de materia orgánica, donde se han registrado un alto número de especies biológicas endémicas. Considerando la relevancia de la microbiota en la estructuración del suelo y disponibilización de nutrientes como soporte para el crecimiento vegetal se determinaron las poblaciones microbianas cultivables de importancia funcional como dinamizadora de nutrientes en el suelo rizosférico de Espeletia spp. en el páramo de Santa Inés y en el de Frontino-Urrao en Antioquia. Los suelos se caracterizaron por ser ácidos y en el páramo de Frontino-Urrao se reportaron los mayores contenidos de materia orgánica y nitrógeno. La biomasa microbiana fue similar en los dos páramos y se registró únicamente variación en el contenido de bacterias formadoras de endospora, que superaron en Frontino-Urrao 3,8 veces el contenido respecto al de Santa Inés. En ambos páramos se reportaron bacterias y hongos solubilizadores de fosfato y degradadores de celulosa que pueden ser empleados en procesos de restauración de suelos paramunos degradados por la minería, la ganadería o la agricultura.
Artículo de investigación
MICROBIOTA RIZOSFÉRICA DE Espeletia spp. DE LOS PÁRAMOS DE SANTA INÉS Y DE FRONTINO-URRAO EN ANTIOQUIA, COLOMBIA
Rizospheric Microbiota of Espeletia spp. from Santa Inés and Frontino-Urrao Paramos in Antioquia, Colombia
Pilar Ximena LIZARAZO-MEDINA1, Diana GÓMEZ-VÁSQUEZ1.
1 Instituto de Biología, Universidad de Antioquia. Calle 67 # 53-108, oficina 7- 218. Medellín, Colombia.
For correspondence. pilarximenalizarazo.udea@gmail.com
Received 27th April 2014, Returned for revision 13th June 2014, Accepted 12th October 2014.
Citation / Citar este artículo como: Lizarazo-Medina PX, Gómez-Vásquez D. Microbiota rizosférica de Espeletia spp. de los páramos de Santa Inés y de Frontino-Urrao en Antioquia, Colombia. Acta biol. Colomb. 2015;20(1):175-182. doi: https://doi.org/10.15446/abc.v20n1.42827.
RESUMEN
El frailejón cuyo nombre científico es Espeletia spp., es considerado el arbusto emblema de los páramos, un ecosistema de importancia debido a que son fuente de agua y de materia orgánica, donde se han registrado un alto número de especies biológicas endémicas. Considerando la relevancia de la microbiota en la estructuración del suelo y en la disponibilidad de los nutrientes como soporte para el crecimiento vegetal, se determinaron las poblaciones microbianas cultivables de importancia funcional como dinamizadora de nutrientes en el suelo rizosférico de Espeletia spp. en el páramo de Santa Inés y en el de Frontino-Urrao en Antioquia. Los suelos se caracterizaron por ser ácidos y en el páramo de Frontino-Urrao se reportaron los mayores contenidos de materia orgánica y nitrógeno. La abundancia de microorganismos fue similar en los dos páramos y se registró únicamente variación en la abundancia de bacterias formadoras de endospora, que superaron en Frontino-Urrao 3,8 veces el contenido respecto al de Santa Inés. En ambos páramos se reportaron bacterias y hongos solubilizadores de fosfato y degradadores de celulosa que pueden ser empleados en procesos de restauración de suelos paramunos degradados por la minería, la ganadería o la agricultura.
Palabras clave: Espeletia spp., microbiota, páramos, rizósfera, suelo.
ABSTRACT
The frailejón (Espeletia spp.) is the emblematic shrub of the paramo. This is an important ecosystem because they are sources of water and organic matter, and are inhabited by a high number of endemic biological species. Considering the importance of the microbiota in soil structure and nutrients availability to support plant growth, we assessed the cultivable microbial populations in Espeletia spp. rhizosphere in Santa Inés and Frontino-Urrao paramos, including functional groups with important role in cycling nutrients. The soil pH was strongly acid in both sites and the organic matter and nitrogen contents were highest in Frontino-Urrao soil. Nevertheless, the microbial abundance was similar in these sites except the content of endospore-forming bacteria, which was 3.8 fold large in Frontino-Urrao. Phosphate solubilizing and cellulolytic microorganisms were found in both sites. Those microorganisms would be used for soil restoration processes in paramos degraded by mining, livestock or agriculture.
Keywords: Espeletia spp., microbiota, paramos, rhizosphere, soil.
INTRODUCCIÓN
Las comunidades microbianas del suelo se establecen de acuerdo con las características del hábitat, y son determinadas por la ubicación geográfica y los factores físico-químicos (Djukic et al., 2010; Zhang et al., 2013). La cobertura vegetal y específicamente la naturaleza química de los exudados radiculares es considerada el elemento más determinante en el ensamble de las comunidades microbianas rizosféricas, lo cual se debe a que estas secreciones generan un ambiente selectivo altamente competitivo mediado por el potencial para ser metabolizados (Yergeau et al., 2014).
El ecosistema paramuno está ubicado a elevadas altitudes, por encima de los 3000 m s.n.m. en las cumbres de las montañas tropicales (Cuatrecasas, 1958). Debido a su localización altitudinal se consideran islas biogeográficas con condiciones ambientales extremas para el desarrollo de la vida, caracterizándose por una humedad relativa que varía entre 70-85%, bajas temperaturas, valores de precipitación alrededor de 3000 mm anuales, bajas tasas de evapotranspiración y variaciones notorias de radiación solar entre los periodos de lluvia y sequía (Díaz-Granados et al., 2005). Estos aspectos han condicionado el establecimiento de formas de vida con adaptaciones morfológicas, fisiológicas y de comportamiento específicas que ha dado lugar a un alto grado de endemismo (Morales y Estévez, 2006).
Los páramos colombianos han sido ampliamente descritos en cuanto a su fauna y flora (Rangel, 2000; Pedraza-Peñalosa et al., 2004), sin embargo, el suelo, su microbiota y el papel que ésta desempeña en un ecosistema tan estratégico para la generación de agua ha sido poco investigado. Los escasos estudios microbiológicos han estado restringidos a los páramos del departamento de Cundinamarca, en la cordillera oriental, y han empleado metodologías dependientes de cultivo. En estos trabajos se determinaron tanto poblaciones de hongos rizosféricos de Espeletia killipii y del suelo, como la comunidad bacteriana en los páramos de Guasca y Cruz Verde (Chitiva et al., 2007; Arias y Piñeros 2008; Benavides y Hermida, 2008), y la presencia de bacterias diazotróficas y de hongos solubilizadores de fósforo (Moratto et al., 2005), así como la microbiota cultivable asociada a la hojarasca (Bernal et al., 2006), en el páramo de Guerrero. Recientemente, Montaña et al., (2011) establecieron empleando una aproximación metagenómica la diversidad bacteriana del suelo de bosque alto andino en el Parque Nacional Natural de los Nevados a 3464 m s.n.m., determinando los phyla Proteobacteria y Actinobacteria como los grupos más abundantes.
En el suelo, la microbiota interviene en procesos dinamizadores de nutrientes como la fijación del nitrógeno, la solubilización de fosfatos y la degradación de compuestos carbonados, influyendo en el contenido de materia orgánica, la estabilidad y fertilidad del suelo, contribuyendo al establecimiento y desarrollo de las comunidades vegetales (Kim et al., 2011; Waring et al., 2014). Con el fin de conocer la abundancia de microorganismos cultivables y determinar grupos funcionales en el suelo rizosférico paramuno, en este trabajo se determinó la concentración celular bacteriana y fúngica cultivable asociada a la rizósfera de Espeletia spp. en los páramos Santa Inés y Frontino-Urrao, en Antioquia, y se evaluó su potencial en la degradación de celulosa y solubilización de fosfatos.
MATERIALES Y MÉTODOS
Sitios de estudio
Las áreas de estudio se encuentran localizadas en el departamento de Antioquia, el complejo paramuno de Santa Inés (6°37.919' N y 75°38.669' W a 3216 m s.n.m.) ubicado en el municipio de Belmira sobre la Cordillera Central, y el complejo Frontino-Urrao (6°27.349' N y 7°5.313' W a 3580 m.s.n.m.) ubicado en el municipio de Urrao sobre la Cordillera Occidental.
Se realizaron dos muestreos en cada sitio durante el año 2012, en febrero y junio, en el páramo de Santa Inés y durante marzo y mayo en Frontino-Urrao. Se hicieron recolectas aditivas de suelo rizósferico de Espeletia spp., mediante un muestreo aditivo a partir del suelo adherido a la raíz de 30 plantas seleccionadas al azar en cada sitio. Las muestras fueron almacenadas en recipientes de plástico estériles y trasportadas bajo refrigeración al laboratorio y mantenidas en estas condiciones hasta el momento del análisis.
Caracterización del sitio de muestreo
En cada sitio se realizaron mediciones de temperatura, humedad relativa e intensidad lumínica a nivel de las hojas de los frailejones y del suelo utilizando un termohigrómetro (HANNA HI 8564) y un luxómetro (Traceable® Dual-Range Light Meter). Además, se registró la altura y envergadura de los frailejones con el fin de caracterizar los individuos del área muestreada. Los análisis fisicoquímicos del suelo consistieron en determinar la capacidad de intercambio catiónico efectiva (CICE), el pH, el porcentaje de materia orgánica, contenido de nitrógeno y fósforo, elementos menores como aluminio, azufre, boro, calcio, magnesio, potasio, sodio, hierro, cobre, manganeso, zinc y la textura.
Determinación de la abundancia microbiana
La abundancia de los grupos microbianos se estableció mediante el recuento de unidades formadoras de colonias por gramo de suelo (UFC g-1) sembradas en superficie (Koch, 1994). Se sembraron alícuotas de las diluciones para determinar el contenido de bacterias heterótrofas totales (BHT) en agar nutritivo (AN: peptona de carne 5 g, extracto de carne 3 g y agar-agar 12 g/L), bacilos Gram negativos (BGN) en agar eosina azul de metileno (EMB: peptona 10 g, K2HPO4 2 g, lactosa 5 g, sacarosa 5 g, eosina amarillenta 0,4 g, azul de metileno 0,07 g y agar-agar 13,5 g/L) y para selección de Pseudomonas spp. (P) se realizó el cultivo en agar B base según KING (proteosa peptona 20 g, MgSO4 1,5 g, K3PO4.3H2O 1,8 g, glicerina 10 g y agar-agar 10 g/L). La abundancia de bacterias aerobias formadores de endospora (BAFE) se estableció al someter las diluciones a 80 °C durante 20 min y posterior siembra para el recuento de colonias en medio tripticasa de soya (TSA: peptona de caseína 15 g, peptona de harina de soya 5 g, NaCl 5 g y agar-agar 15 g/L). Los cultivos se incubaron a temperatura ambiente y se realizó el recuento de UFC g-1 a las 48 horas.
El contenido de Actinobacterias (AB) se determinó mediante siembra de las diluciones en agar almidón caseína (almidón soluble 10 g, K2HPO4 2 g, NaCl 2 g, caseína 1 g, MgSO4 0,05 g, CaCO3 0,02 g, FeSO4.7H2O 0,01 g y agar-agar 15 g/L) y el recuento se hizo después de 12 días de incubación a temperatura ambiente. Finalmente, para realizar el recuento de hongos filamentosos (HF) y levaduras (HL) se inocularon alícuotas de las diluciones en agar papa dextrosa (PDA: infusión de papa 4 g (infusión de 200 g de papas), glucosa 20 g y agar-agar 15 g/L) suplementado con gentamicina (0,05mg/mL) para inhibir el crecimiento de bacterias, el número de UFC g-1 se determinó a los cinco días de incubación a temperatura ambiente.
Determinación de la abundancia de grupos funcionales
Se determinó la abundancia de bacterias solubilizadoras de fosfato y degradadoras de celulosa in vitro. La cuantificación de bacterias solubilizadoras de fosfato inorgánico (BSP) se hizo sembrando alícuotas de las diluciones en agar Pikovskaya (PVK: glucosa 10 g, extracto de levadura 0,5 g, Ca3(PO4)2 5 g, (NH4)2SO4 0,5 g, KCl 0,2 g, MgSO4 0,1 g, MnSO4 0,0001 g, FeSO4 0,0001 g y agar-agar 15 g/L). Después de cinco días de incubación se contaron las colonias positivas que fueron confirmadas como solubilizadoras de fosfato sembrándolas de manera individual en el mismo medio. En estas condiciones los microorganismos con capacidad de solubilizar el fosfato desarrollan un halo transparente alrededor de la colonia producto de esa acción enzimática.
El recuento de las bacterias celulolíticas (BC) se realizó en agar carboximetilcelulosa (CMC: NaNO3 2 g, K2HPO4 1 g, MgSO4 0,5 g, KCl 0,5 g, sal de CMC 2 g, Peptona 0,2 g y agar-agar 15 g/L). A los cinco días de incubación, los morfotipos obtenidos en los recuentos fueron repicados individualmente en agar nutritivo (AN) para su conservación, posterior a esto a las cajas de los recuentos se les adicionó lugol (KI 1,33%, I 0,66%). El lugol se intercala entre los enlaces de la molécula de celulosa y cuando hay ruptura de estos por acción de las celulasas microbianas se observa un halo traslucido alrededor de la colonia. Las colonias que presentaron halo fueron contadas como UFC g-1 de bacterias celulolíticas. Los aislados repicados en agar nutritivo fueron reinoculados individualmente en agar CMC para verificar y cuantificar esta actividad enzimática.
Para determinar el grado de actividad metabólica se empleó el índice de actividad indicado en la fórmula (Kumar y Narula, 1999):
Las colonias de bacterias celulolíticas, solubilizadoras y de los hongos aislados, fueron sembradas individualmente por duplicado en agar CMC y PVK según correspondiera. Después de 72 horas a temperatura ambiente, se registró el tamaño de la colonia y del halo, en el caso de los hongos el diámetro de la colonia se midió cada 24 horas estandarizándose como la medición de la actividad cuando la colonia presentó 3 cm, momento en que se adicionó lugol y se midió el halo.
Análisis de datos
La determinación de las diferencias entre y dentro de cada sitio de acuerdo con las variables ambientales, medidas en campo, se realizaron mediante pruebas de comparación de medias (U de Mann Whitney) en IBM SPSS 20 Software. La abundancia de los grupos microbianos y funcionales fue determinada haciendo tres análisis de cada muestra de suelo, con cinco réplicas de siembra por dilución cada uno, los valores reportados corresponden al valor promedio de los recuentos obtenidos para los dos muestreos.
RESULTADOS
Caracterización de los sitios de muestreo
La vegetación en los sitios muestreados está dominada por Espeletia spp., la distribución y características de estos arbustos varían en cada páramo. La cobertura fue más densa en el de Frontino-Urrao que en Santa Inés donde la altura es menor, con una media de 100 cm (28-177 cm), mientras que en Frontino-Urrao presentaron un promedio de 133 cm (27-235 cm). Además, se observaron diferencias en la vegetación acompañante, en Frontino-Urrao predominaron individuos del género Sphagnum, mientras gran parte del suelo del páramo de Santa Inés está cubierto por pastizales.
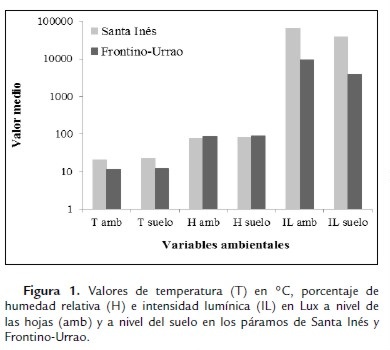
Respecto a las condiciones climáticas evaluadas, temperatura, intensidad lumínica y humedad, el test de medias indicó diferencias entre páramos (p<0,05). En ambos sitios el comportamiento de las mediciones de temperatura e intensidad lumínica en el momento del muestreo indicaron valores superiores en Santa Inés. A nivel rizosférico no hubo variación respecto a la temperatura a la altura de las hojas. En cuanto a la humedad se registraron valores menores en el páramo de Santa Inés (Fig. 1).
Características fisicoquímica del suelo
El suelo en las dos localidades se caracterizó por ser húmedo con textura franca, presentando variaciones en la coloración, siendo más oscura en el páramo de Frontino-Urrao. Los suelos de los dos páramos antioqueños se caracterizaron por ser fuertemente ácidos, el contenido de materia orgánica, nitrógeno y fósforo fue tres o cuatro veces mayor en el páramo de Frontino-Urrao. Los valores de microelementos fueron mayores en esta localidad, destacándose las concentraciones de hierro, azufre, potasio, magnesio y manganeso (Tabla 1).
Abundancia de grupos microbianos
La abundancia de los grupos microbianos cultivables evaluados presentó el mismo patrón en los dos páramos. El grupo de bacilos Gram negativos fue el más abundante, seguido por levaduras, hongos filamentosos, Pseudomonas spp., BAFE y Actinobacterias. El grupo que presentó la mayor variación fue el de BAFE cuya concentración fue 3,8 veces superior en Frontino-Urrao (Fig. 2). La relación hongo:bacteria fue 0,45 en Santa Inés y 0,30 en Frontino-Urrao.
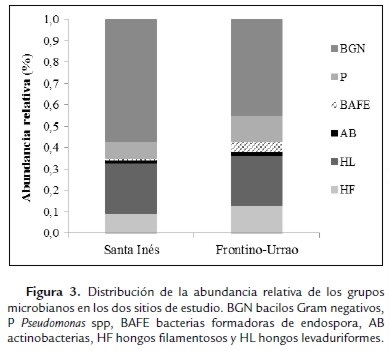
La abundancia relativa de los grupos microbianos presentó variaciones entre los páramos (Fig. 3). Los bacilos Gram negativos representaron 12 puntos porcentuales más en Santa Inés que en Frontino-Urrao. Los grupos Pseudomonas spp. y hongos filamentosos fueron menores entre tres y cuatro puntos porcentuales en Santa Inés, mientras que las Actinobacterias fueron 0,3% superiores en Frontino-Urrao. El grupo de las levaduras presentó la misma proporción en ambos páramos. Finalmente, fue notoria la diferencia en la abundancia relativa de BAFE, cinco veces mayor en Frontino-Urrao.
Abundancia de los grupos funcionales
La abundancia de microorganismos con potencial para solubilizar fosfatos y degradar la celulosa fue similar en ambos páramos: 2,51x105 UFC g-1 en Santa Inés y 2,24x105 UFC g-1 en Frontino-Urrao, valores que corresponden al 19,5% y 14,4% del recuento de bacterias heterótrofas totales, respectivamente. Las bacterias celulolíticas registraron recuentos de 1,59x105 UFC g-1 y 1,52x105 UFC g-1 en Santa Inés y Frontino-Urrao, respectivamente; el grupo de bacterias solubilizadoras de fosfatos con 9,23x104 UFC g-1 en Santa Inés y 7,13x104 UFC g-1 en Frontino-Urrao.
A partir del suelo del páramo de Santa Inés se obtuvieron 58 aislados celulolíticos, 23 bacterianos (12 bacilos Gram positivos y 11 bacilos Gram negativos) y 35 fúngicos (63,6% del total de aislados). En total, 48 aislados del páramo de Frontino-Urrao presentaron actividad celulolítica, 20 bacterianos (11 bacilos Gram positivos y 9 bacilos Gram negativos) y 28 fúngicos (68,3% del total de aislados). Los hongos presentaron índices de hidrólisis bajos, entre 1,1 y 2,2; mientras esta capacidad metabólica en los aislados bacterianos fue superior entre 1,3 y 14,5 (Fig. 4a).
En total fueron aislados 13 microorganismos solubilizadores de fosfato del páramo de Santa Inés, 12 bacterianos (11 Gram negativos y 1 Gram positivo) y un fúngico. A partir de la muestra de Frontino-Urrao fueron aislados 12 microorganismos fosfato solubilizadores, 11 bacterianos (todos Gram negativos) y 1 fúngico. El índice de solubilización de los hongos fue de 1,1 y 1,2 mientras la capacidad metabólica de los aislados bacterianos fluctúa entre 1,1 y 2,2 (Fig. 4b).
DISCUSIÓN
Se caracterizó a nivel de los ecosistemas paramunos, poco explorados microbiológicamente, las condiciones climáticas, propiedades físicoquímicas del suelo y la abundancia de la comunidad microbiana de grupos específicos y funcionales asociada a la rizósfera de Espeletia sp., en dos páramos ubicados en cordilleras diferentes. Los sitios presentaron características particulares de acuerdo a las variables climáticas y las propiedades fisicoquímicas del suelo. Los suelos de los páramos se caracterizaron por ser fuertemente ácidos, como ya había sido reportado en los páramos alto andinos (Díaz-Granados et al., 2005). En los contenidos de materia orgánica y nitrógeno se presentaron características diferenciales, los registros de suelos de páramos han indicado que los valores altos de materia orgánica se deben a que la descomposición de la hojarasca se ralentiza como consecuencia de las bajas temperaturas (Díaz-Granados et al., 2005). En el páramo de Frontino-Urrao el contenido de materia orgánica fue mayor y fue donde también se reportaron los valores de temperatura más bajos. En este estudio la temperatura a nivel de la rizósfera no presentó diferencias respecto a la temperatura registrada a la altura de las hojas.
Los phyla Acidobacteria, Proteobacteria y Actinobacteria han sido reportados como los más abundantes en suelo de alta montaña según las técnicas de secuenciación masiva (Chu et al., 2010; Montaña et al., 2011). Las Acidobacterias son un phylum difícil de aislamiento en el laboratorio, por lo que en estudios empleando metodologías dependientes de cultivo es común únicamente el reporte de individuos de los grupos Firmicutes, Proteobacteria y Actinobacteria, los cuales, por lo general son de fácil aislamiento en las condiciones de cultivo convencionales. Estos tres phyla también fueron registrados en este estudio (Lyngwi et al., 2013).
Los bacilos Gram negativos determinados aquí se seleccionaron por su capacidad de crecer en agar EMB, en el cual se desarrollan representantes del phylum Proteobacteria. La abundancia de este phylum ha sido explicada por su diversidad metabólica, fisiológica y su relevante intervención en los ciclos del carbono, nitrógeno y azufre (Spain et al., 2009). En la rizósfera de Espeletia spp. de los dos páramos estudiados, los bacilos Gram negativos fueron el grupo más abundante, con una fracción significativa de representantes del género Pseudomonas, del grupo gamma-Proteobacteria. Estas bacterias se han reportado también en suelos con cultivos agrícolas y se caracterizan por descomponer la materia orgánica, hacer disponible el fósforo y por producir compuestos que promueven el crecimiento de las plantas. Sin embargo, algunas especies se han reportado como fitopatógenas (Kim et al., 2011).
El grupo microbiano cuya contenido registró diferencias en los páramos estudiados fue el de los BAFE, cuya característica de formar endospora ha sido restringida a miembros del phylum Firmicutes, entre los cuales se destaca el género Bacillus. Este género es el más abundante en suelo, sus especies presentan un crecimiento como saprofitas o como simbiontes, comensales o mutualistas, creciendo en interacción con las raíces. Las investigaciones han reportado que la baja concentración de nutrientes es una de las condiciones que favorecen la esporulación de estas bacterias (Brandes et al., 2011). Sin embargo, los resultados obtenidos muestran que la mayor abundancia de bacterias esporulantes se encuentra en el páramo de Frontino-Urrao, donde se presentaron los mayores valores de materia orgánica. Al respecto, varios autores han indicado que esporas de Bacillus subtilis, Bacillus cereus, Bacillus thuringiensis, al ser inoculadas en suelo germinan a su estado vegetativo y la población crece hasta que se presenta una disminución en los nutrientes, momento en que forman endosporas (Ellis, 2004; Earl et al., 2008). De acuerdo con ese reporte es posible indicar que los altos valores de bacterias esporulantes reportadas en Frontino-Urrao se deben a que las células se encontraban creciendo en estado vegetativo y no estaban limitadas por el contenido de nutrientes. Es conocido que especies del género Bacillus pueden promover el crecimiento vegetal disponibilizando nutrientes (fósforo y nitrógeno) y además, al competir por su establecimiento en la rizósfera producen toxinas antibacterianas y antifúngicas que probablemente disminuyen las poblaciones fitopatógenas favoreciendo el desarrollo de las plantas a las que están asociadas (Earl et al., 2008).
El grupo Actinobacterias también es uno de los phyla más abundantes en suelo y de importancia en la mineralización de la materia orgánica y en la producción de sustancias antimicrobianas. No obstante, en este estudio representaron los menores conteos de los grupos evaluados, probablemente debido a que los miembros de esta comunidad adoptan la estrategia K, creciendo lentamente en especial en suelos muy húmedos como los presentados en los sitios de estudio (Cruz-Martínez et al., 2009).
La relación hongo-bacteria es una medida indirecta dependiente de la cantidad de nutrientes en el suelo, ya que los altos contenidos de C y N afectan negativamente la biomasa fúngica. En este estudio la relación H:B fue mayor en Santa Inés donde los valores de C y N son bastante menores, hallazgo que corresponde a lo observado por Bardgett y McAlister (1999), quienes determinaron que la relación hongo/bacteria fue mayor en áreas cultivadas con pastos en las que los contenidos de C y N fueron bajos en comparación con aquellos sitios que recibían grandes cantidades de fertilizantes.
Dentro de los grupos dinamizadores de nutrientes las bacterias solubilizadoras de fosfatos hacen disponible el fósforo para las plantas en forma de ortofosfatos mediante la producción de ácidos o la extrusión de protones (Sharma et al., 2011). Los resultados obtenidos en este estudio mostraron que la abundancia de este grupo funcional fue 1,23 mayor veces en Santa Inés, hecho que puede relacionarse con los valores de fósforo detectados en estos suelos. Al respecto Mander et al., (2012) demostraron que la incidencia de estas poblaciones es mayor en suelos con bajos contenidos de fósforo como sucedió en Santa Inés, mientras que en el páramo de Frontino-Urrao el contenido de fósforo fue mayor y se reportó un menor contenido de bacterias solubilizadoras.
El suelo paramuno de las dos localidades presentó un alto número de microorganismos con potencial para degradar la celulosa, alrededor del 65% de los aislados fúngicos y cerca del 15% de la abundancia bacteriana produjeron enzimas celulolíticas en los ensayos in vitro. Sin embargo, en el suelo este proceso puede ser afectado negativamente por las bajas temperaturas que predominan en este ecosistema, ya que la temperatura óptima de estas enzimas se encuentra por encima de los 20 #ºC (Otajevwo y Aluyi, 2011).
Este estudio es el primer reporte cuantificando la microbiota bacteriana y fúngica asociada a las raíces de Espeletia spp., de páramos ubicados en la cordillera Central y Occidental de Colombia. Los recuentos bacterianos y fúngicos registrados aquí indican que existe un potencial microbiano con capacidad de dinamizar los contenidos de materia orgánica y fósforo en estos suelos. Participando en esos procesos, la microbiota contribuye al mantenimiento de la estructura del suelo y de la diversidad vegetal de estos ecosistemas de importante conservación debido al servicio ecosistémico que prestan como reservorios de agua para las poblaciones humanas. Estudios más profundos a nivel de la función de estos aislados microbianos son relevantes para la restauración de estos suelos ya degradados por la ganadería, la agricultura o la minería.
Los resultados obtenidos en esta investigación son un gran aporte al conocimiento de la microbiota de los suelos de los páramos y hace referencia a la fracción cultivable de grupos microbianos específicos, en un futuro es importante ampliar el estudio con metodologías independientes de cultivo que permitan establecer la diversidad microbiana total en estos ambientes poco explorados y de relevancia ecosistémica.
CONCLUSIONES
Las comunidades microbianas presentaron abundancias relativas similares en los dos páramos estudiados, a pesar de las diferencias en las condiciones climáticas. La única variación se presentó en la proporción de BAFE cuyo contenido fue mayor en el páramo de Frontino-Urrao, lo que probablemente este explicado por el alto contenido de materia orgánica, nitrógeno y fósforo, respecto a las concentraciones observadas en Santa Inés. En general se encontraron representantes de los phyla Proteobacteria, Firmicutes y Actinobacteria. Se estableció la presencia de microbiota fúngica y bacteriana con capacidad de degradar materia orgánica (celulosa) y hacer disponible el fósforo a partir de fosfato inorgánico, funciones que deben contribuir mediante el reciclaje de nutrientes a la fertilidad del suelo y mantenimiento de la cobertura vegetal.
AGRADECIMIENTOS
Los autores agradecen al Comité para el Desarrollo de la Investigación (CODI) de la Universidad de Antioquia (UDEA), en su Convocatoria Temática 2010, por la financiación del proyecto de investigación: Inventario de la microbiota de suelo de dos zonas de páramos de Antioquia. A la Corporación para el Estudio de las Patologías Tropicales (CAEPT) de la UDEA por la administración de los recursos económicos y a los miembros del Grupo Ecología Microbiana y Bioprospección (EM&B).
REFERENCIAS
Arias E, Piñeros P. Aislamiento e identificación de hongos filamentosos demuestras de suelo de los Páramos de Guasca y Cruz Verde (Tesis de pregrado). Bogotá: Pontificia Universidad Javeriana; 2008. 204 p. URL http://www.javeriana.edu.co/biblos/tesis/ciencias/tesis226.pdf.
Bardgett RD, Mcalister E. The measurement of soil fungal:bacterial biomass ratios as an indicator of ecosystem self-regulation in temperate meadow grasslands. Biol Fertil Soils.1999;29(3):282–290. Doi: 10.1007/s003740050554.
Benavides GD, Hermida AM. Aislamiento e identificación de flora bacteriana nativa de los páramos Cruz Verde y Guasca (Cundinamarca) (Tesis de pregrado). Bogotá: Pontificia Universidad Javeriana; 2008. 118 p. URL http://javeriana.edu.co/biblos/tesis/ciencias/tesis145.pdf.
Bernal E, Celis S, Galindez X, Moratto CJ, Garcia D. Microflora cultivable y endomicorrizas obtenidas en hojarasca de bosque (Páramo Guerrero–Finca Puente de Tierra) Zipaquirá, Colombia. Acta biol Colomb. 2006;11(2):125-130.
Brandes-Ammann A, Kölle L, Brandl H. Detection of bacterial endospores in soil by terbium fluorescence. Int J Microbiol. 2011;2011:1-5. Doi:10.1155/2011/435281.
Chitiva A, Torrenegra R, Cabrera C, Díaz N, Pineda V. Contribución al estudio de microhongos filamentosos en los ecosistemas Páramo de Guasca y El Tablazo. Estudio preliminar de mohos de páramos colombianos. Bogotá: Pontificia Universidad Javeriana; 2007. URL http://www.javeriana.edu.co/gifuj/hongos_%20ecosistemas_%20paramo.pdf
Chu H, Fierer N, Lauber C, Caporaso J, Knight R, Grogan P. Soil bacterial diversity in the Arctic is not fundamentally different from that found in other biomes. Environ Microbiol. 2010;12(11):2998–3006. Doi:10.1111/j.1462-2920.2010.02277.x.
Cruz-Martínez K, Suttle KB, Brodie EL, Power ME, Andersen GL, Banfield JF. Despite strong seasonal responses, soil microbial consortia are more resilient to long-term changes in rainfall than overlying grassland. ISME J. 2009;3:738-744. Doi:10.1038/ismej.2009.16.
Cuatrecasas J. Aspectos de la vegetación natural de Colombia. Rev Acad Colomb Cienc. 1958;10(40):221-268.
Díaz-Granados M, Navarrete J, Suárez T. Páramos hidrosistemas sensibles. Rev Ing. 2005;22:64-75.
Djukic I, Zehetner F, Mentler A, Gerzabek M. Microbial community composition and activity in different Alpine vegetation zones. Soil Biol Biochem. 2010;42(2):155-161. Doi:10.1016/j.soilbio.2009.10.006.
Earl AM, Losick R, Kolter R. Ecology and genomics of Bacillus subtilis. Trends Microbiol. 2008;16(6):269. Doi:10.1016/j.tim.2008.03.004.
Ellis RJ. Artificial soil microcosms: a tool for studying microbial autecology under controlled conditions. J Microbiol Methods. 2004;56(2):287-290. Doi: 10.1016/j.mimet.2003.10.005.
Kim WI, Kim SN, Ryu KY, Park CS. Genetic diversity of cultivable plant growth-promoting rhizobacteria in Korea. J Microbiol Biotechn. 2011;21(8):777-790. Doi:10.4014/jmb.1101.01031.
Koch AL, editor. Growth measurement. In: Gerhardt P. Methodology for general and molecular bacteriology. Washington; 1994. p. 248.
Kumar B, Narula M. Solubilization of inorganic phosphates and growth emergente of wheat as affected by Azotobacter chroococum mutans. Biol Fertil Soils. 1999;28:301-305. Doi:10.1007/s003740050497.
Lyngwi N, Koijam K, Sharma D, Joshi R. Cultivable bacterial diversity along the altitudinal zonation and vegetation range of tropical Eastern Himalaya. Rev Biol Trop. 2013; 61(1):467-490. Doi: 10.15517/rbt.v61i1.11141.
Mander C, Wakelin S, Young S, Condron L, O'Callaghan M. Incidence and diversity of phosphate-solubilizing bacteria are linked to phosphorus status in grassland soils. Soil Biol Biochem. 2012;44(1):93-101. Doi:10.1016/j.soilbio.2011.09.009.
Montaña JS, Jimenez DJ, Hernández M, Ángel T, Baena S. Taxonomic and functional assignment of cloned sequences from high Andean forest soil metagenome. Antonie van Leeuwenhoek. 2011;101:205-215.
Morales J, Estévez J. El páramo ¿Ecosistema en vía de extinción? Revista Luna Azul. 2006;22:1-13.
Moratto C, Martínez LJ, Valencia H, Sánchez J. Efecto del uso del suelo sobre hongos solubilizadores de fosfato y bacterias diazotróficas en el páramo de Guerrero (Cundinamarca). Agronomía Colombiana. 2005;23(2):299-309.
Otajevwo FD, Aluyi H. Cultural conditions necessary for optimal cellulase yield by cellulolytic bacterial organisms as they relate to residual sugars released in broth medium. Modern Applied Science. 2011;5(3):141-151. Doi:10.5539/mas.v5n3p141.
Pedraza-Peñalosa P, Betancur J, Franco P. Chisacá, un recorrido por los páramos Andinos. Instituto de Ciencias Naturales e Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá; 2004. p. 340.
Rangel JO. La región de vida paramuna y franja aledaña en Colombia. In: Rangel JO, editor. Colombia Diversidad Biótica III. La región de vida paramuna de Colombia. Universidad Nacional de Colombia. Bogotá. Colombia; 2000. p. 1-24.
Sharma S, Kumar V, Tripathi RB. Isolation of phosphate solubilizing microorganism (PSMs) from soil. J Microbiol Biotech Res. 2011;1(2):90-95.
Spain A, Krumholz L, Elshahed M. Abundance, composition, diversity and novelty of soil Proteobacteria. ISME J. 2009;3:992-1000. Doi:10.1038/ismej.2009.43.
Waring BG, Weintraub SR, Sinsabaugh RL. Ecoenzymatic stoichiometry of microbial nutrient acquisition in tropical soils. Biogeochemistry. 2014;117(1):101-113. Doi: 10.1007/s10533-013-9849-x.
Yergeau E, Sanschagrin S, Maynard C, St-Arnaud M, Greer C. Microbial expression profiles in the rhizosphere of willows depend on soil contamination. ISME J. 2014;8:344-358. Doi:10.1038/ismej.2013.163.
Zhang B, Liang C, He H, Zhang X. Variations in soil microbial communities and residues along an altitude gradient on the northern slope of Changbai Mountain, China. PLoS ONE. 2013;8(6):e66184. Doi:10.1371/journal.pone.0066184.
Referencias
Arias E, Piñeros P. Aislamiento e identificación de hongos filamentosos demuestras de suelo de los Páramos de Guasca y Cruz Verde (Tesis de pregrado). Bogotá: Pontificia Universidad Javeriana; 2008. 204 p.
Bardgett RD, Mcalister E. The measurement of soil fungal:bacterial biomass ratios as an indicator of ecosystem self-regulation in temperate meadow grasslands. Biol Fertil Soils.1999;29(3):282–290. Doi: 10.1007/s003740050554
Benavides GD, Hermida AM. Aislamiento e identificación de flora bacteriana nativa de los páramos Cruz Verde y Guasca (Cundinamarca) (Tesis de pregrado). Bogotá: Pontificia Universidad Javeriana; 2008. 118 p.
Bernal E, Celis S, Galindez X, Moratto CJ, Garcia D. Microflora cultivable y endomicorrizas obtenidas en hojarasca de bosque (Páramo Guerrero - Finca Puente de Tierra) Zipaquirá, Colombia. Acta biol Colomb. 2006;11(2):125-130.
Brandes-Ammann A, Kölle L, Brandl H. Detection of bacterial endospores in soil by terbium fluorescence. Int J Microbiol. 2011;2011:1-5. Doi:10.1155/2011/435281.
Chitiva A, Torrenegra R, Cabrera C, Díaz N, Pineda V. Contribución al estudio de microhongos filamentosos en los ecosistemas Páramo de Guasca y El Tablazo. Estudio preliminar de mohos de páramos colombianos. Bogotá: Pontificia Universidad Javeriana; 2007.
Chu H, Fierer N, Lauber C, Caporaso J, Knight R, Grogan P. Soil bacterial diversity in the Arctic is not fundamentally different from that found in other biomes. Environ Microbiol. 2010;12(11):2998–3006. Doi:10.1111/j.1462-2920.2010.02277.x.
Cruz-Martínez K, Suttle KB, Brodie EL, Power ME, Andersen GL, Banfield JF. Despite strong seasonal responses, soil microbial consortia are more resilient to long-term changes in rainfall than overlying grassland. ISME J. 2009;3:738-744. Doi:10.1038/ismej.2009.16.
Cuatrecasas J. Aspectos de la vegetación natural de Colombia. Revista de la Academia Colombiana de Ciencias Exactas Físicas y Naturales. 1958;10(40):221-268.
Díaz-Granados M, Navarrete J, Suárez T. Páramos hidrosistemas sensibles. Revista de Ingeniería. 2005;22:64-75.
Djukic I, Zehetner F, Mentler A, Gerzabek M. Microbial community composition and activity in different Alpine vegetation zones. Soil Biol Biochem. 2010;42(2):155-161. Doi:10.1016/j.soilbio.2009.10.006.
Earl AM, Losick R, Kolter R. Ecology and genomics of Bacillus subtilis. Trends Microbiol. 2008;16(6):269. Doi:10.1016/j.tim.2008.03.004.
Ellis RJ. Artificial soil microcosms: a tool for studying microbial autecology under controlled conditions. J Microbiol Methods. 2004;56(2):287-290.
Kim WI, Kim SN, Ryu KY, Park CS. Genetic diversity of cultivable plant growth-promoting rhizobacteria in Korea. J Microbiol Biotechn. 2011;21(8):777-790.
Koch AL, editor. Growth measurement. En: Gerhardt P. Methodology for general and molecular bacteriology. Washington; 1994. p. 248.
Kumar B, Narula M. Solubilization of inorganic phosphates and growth emergente of wheat as affected by Azotobacter chroococum mutans. Biol Fertil Soils. 1999;28:301-305.
Lyngwi N, Koijam K, Sharma D, Joshi R. Cultivable bacterial diversity along the altitudinal zonation and vegetation range of tropical Eastern Himalaya. Rev Biol Trop. 2013; 61(1):467-490.
Mander C, Wakelin S, Young S, Condron L, O’Callaghan M. Incidence and diversity of phosphate-solubilizing bacteria are linked to phosphorus status in grassland soils. Soil Biol Biochem. 2012;44(1):93-101. Doi:10.1016/j.soilbio.2011.09.009.
Montaña JS, Jimenez DJ, Hernández M, Ángel T, Baena S. Taxonomic and functional assignment of cloned sequences from high Andean forest soil metagenome. Antonie van Leeuwenhoek. 2011;101:205-215.
Morales J, Estévez J. El páramo ¿Ecosistema en vía de extinción? Revista Luna Azul. 2006;22:1-13.
Moratto C, Martínez LJ, Valencia H, Sánchez J. Efecto del uso del suelo sobre hongos solubilizadores de fosfato y bacterias diazotróficas en el páramo de Guerrero (Cundinamarca). Agronomía Colombiana. 2005;23(2):299-309.
Otajevwo FD, Aluyi H. Cultural conditions necessary for optimal cellulase yield by cellulolytic bacterial organisms as they relate to residual sugars released in broth medium. Modern Applied Science. 2011;5(3):141-151. Doi:10.5539/mas.v5n3p141.
Pedraza-Peñalosa P, Betancur J, Franco P. Chisacá, un recorrido por los páramos Andinos. Instituto de Ciencias Naturales e Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá; 2004. p. 340.
Rangel JO. La región de vida paramuna y franja aledaña en Colombia. In: Rangel JO, editor. Colombia Diversidad Biótica III. La región de vida paramuna de Colombia. Universidad Nacional de Colombia. Bogotá. Colombia; 2000. p. 1-24.
Sharma S, Kumar V, Tripathi RB. Isolation of phosphate solubilizing microorganism (PSMs) from soil. J Microbiol Biotech Res. 2011;1(2):90-95.
Spain A, Krumholz L, Elshahed M. Abundance, composition, diversity and novelty of soil Proteobacteria. ISME J. 2009;3:992-1000. Doi:10.1038/ismej.2009.43.
Waring BG, Weintraub SR, Sinsabaugh RL. Ecoenzymatic stoichiometry of microbial nutrient acquisition in tropical soils. Biogeochemistry. 2014;117(1):101-113. Doi: 10.1007/s10533-013-9849-x
Yergeau E, Sanschagrin S, Maynard C, St-Arnaud M, Greer C. Microbial expression profiles in the rhizosphere of willows depend on soil contamination. ISME J. 2014;8:344-358. Doi:10.1038/ismej.2013.163.
Zhang B, Liang C, He H, Zhang X. Variations in soil microbial communities and residues along an altitude gradient on the northern slope of Changbai Mountain, China. PLoS ONE. 2013;8(6):e66184. Doi:10.1371/journal.pone.0066184.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Daniela Cristina Rey-Romero, Martha Constanza Daza-Torres, Viviana Sanchez-Torres, Edgar Ricardo Oviedo-Ocaña. (2025). Effects of green onion (Allium fistulosum) cropping on topsoil nitrogen species contents in a Páramo ecosystem. Geoderma Regional, 41, p.e00958. https://doi.org/10.1016/j.geodrs.2025.e00958.
2. Antonella Toscano, Massimo Santoro, Annarita Torino. (2025). Proceedings of LLEAHMM 2024. Lecture Notes in Bioengineering. , p.445. https://doi.org/10.1007/978-3-031-82923-9_40.
3. Carlos A. Ruiz-Pérez, Silvia Restrepo, María Mercedes Zambrano, V. Müller. (2016). Microbial and Functional Diversity within the Phyllosphere of Espeletia Species in an Andean High-Mountain Ecosystem. Applied and Environmental Microbiology, 82(6), p.1807. https://doi.org/10.1128/AEM.02781-15.
4. Natesan Sivakumar, Ramamoorthy Sathishkumar, Gopal Selvakumar, Rajaram Shyamkumar, Kalimuthu Arjunekumar. (2020). Plant Microbiomes for Sustainable Agriculture. Sustainable Development and Biodiversity. 25, p.113. https://doi.org/10.1007/978-3-030-38453-1_5.
5. Diana Beatriz Sanchez Lopez, Jazmín Vanessa Pérez Pazos, Hilda Adriana David Hinestroza. (2016). Efecto de las PGPB sobre el crecimiento Pennisetum clandestinum bajo condiciones de estrés salino. Revista Colombiana de Biotecnología, 18(1) https://doi.org/10.15446/rev.colomb.biote.v18n1.50413.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2015 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).