Registro de actividad eléctrica en la retina de una rata albina empleando una matriz de microelectrodos
Recording of Electrical Activity in the Retina of an Albino Rat Employing a Microelectrode Array
DOI:
https://doi.org/10.15446/abc.v20n3.46216Palabras clave:
células ganglionares retinales, clasificación de espigas, potenciales evocados, potenciales extracelulares (es)evoked potentials, extracellular potentials, retinal ganglion cells, spike sorting (en)
Las matrices de microelectrodos son dispositivos que permiten la detección de potenciales de acción o espigas en poblaciones de células excitables, ofreciendo varias aplicaciones en el campo de las neurociencias y la biología. Este trabajo muestra un protocolo para el registro de espigas en una población de células ganglionares retinales empleando una matriz de microelectrodos. La retina de una rata albina fue extraída y preparada para ser estimulada in vitro con luz led blanca, con el fin de registrar sus espigas evocadas ante estos estímulos. Cada microelectrodo puede registrar espigas de más de una célula ganglionar, razón por la cual se determinó a qué célula pertenece cada espiga aplicando un procedimiento conocido como “clasificación de espigas”. El trabajo permitió obtener el registro de un periodo de estimulación y otro de no estimulación, con el fin de representar los potenciales de acción evocados con luz y los espontáneos. Los registros fueron almacenados para visualizar las espigas de las células ganglionares y poder aplicar la herramienta de clasificación de espigas. De este modo, se almacenan los instantes de tiempo en los cuales cada célula ganglionar registrada generó potenciales de acción. Este trabajo conllevó al establecimiento de un protocolo de experimentación básico enfocado al uso de matrices MEA en el laboratorio de adquisición de potenciales extracelulares de la Universidad Antonio Nariño Sede Bogotá, no sólo para caracterizar los potenciales de acción de células ganglionares retinales, sino también para otro tipo de células que puedan ser estudiadas empleando matrices de microelectrodos.
Doi: https://doi.org/10.15446/abc.v20n3.46216.
Artículo de investigación/Original research paper
REGISTRO DE ACTIVIDAD ELÉCTRICA EN LA RETINA DE UNA RATA ALBINA EMPLEANDO UNA MATRIZ DE MICROELECTRODOS
Recording of Electrical Activity in the Retina of an Albino Rat Employing a Microelectrode Array
Alexander CERQUERA1, Jeimy MUÑOZ1, Joaquín ARAYA2, Olivero GÓMEZ1
1 Facultad de Ingeniería Biomédica, Electrónica y Mecatrónica; Grupo de Investigación Sistemas Complejos. Universidad Antonio Nariño. Carrera 3 Este n.° 47 A-15, Bloque 4 Piso1. Bogotá, Colombia.
2 Centro Interdisciplinario de Neurociencias de Valparaíso, Facultad de Ciencias. Universidad de Valparaíso. Gran Bretaña 1111 Valparaíso, Chile.
For correspondence. alexander.cerquera@uan.edu.co.
Received: 14th October 2014, Returned for revision: 21st November 2014, Accepted: 24th January 2015.
Associate Editor: Argel Aguilar-Valles.
Citation / Citar este artículo como: Cerquera A, Muñoz J, Araya J, Gómez O. Registro de actividad eléctrica en la retina de una rata albina empleando una matriz de microelectrodos. Acta biol. Colomb. 2015;20(3):37-46. doi: https://doi.org/10.15446/abc.v20n3.46216.
RESUMEN
Las matrices de microelectrodos (MEA) son dispositivos que permiten la detección de potenciales de acción o espigas en poblaciones de células excitables, ofreciendo varias aplicaciones en el campo de las neurociencias y la biología. Este trabajo muestra un protocolo para el registro de espigas en una población de células ganglionares retinales empleando una matriz de microelectrodos. La retina de una rata albina fue extraída y preparada para ser estimulada in vitro con luz led blanca, con el fin de registrar sus espigas evocadas ante estos estímulos. Cada microelectrodo puede registrar espigas de más de una célula ganglionar, razón por la cual se determinó a qué célula pertenece cada espiga aplicando un procedimiento conocido como "clasificación de espigas". El trabajo permitió obtener el registro de un periodo de estimulación y otro de no estimulación, con el fin de representar los potenciales de acción evocados con luz y los espontáneos. Los registros fueron almacenados para visualizar las espigas de las células ganglionares y poder aplicar la herramienta de clasificación de espigas. De este modo, se almacenan los instantes de tiempo en los cuales cada célula ganglionar registrada generó potenciales de acción. Este trabajo conllevó al establecimiento de un protocolo de experimentación básico enfocado al uso de matrices MEA en el laboratorio de adquisición de potenciales extracelulares de la Universidad Antonio Nariño Sede Bogotá, no sólo para caracterizar los potenciales de acción de células ganglionares retinales, sino también para otro tipo de células que puedan ser estudiadas empleando matrices de microelectrodos.
Palabras clave: células ganglionares retinales, clasificación de espigas, potenciales evocados, potenciales extracelulares.
ABSTRACT
The microelectrode arrays (MEA) are devices that allow the detection of action potentials or spikes in populations of excitable cells, offering a wide spectrum of applications in topics of Neurosciences and Biology. This work describes a protocol for recording of spikes in a population of retinal ganglion cells employing a microelectrode array. The retina of an albino rat was dissected and prepared to be stimulated in vitro with white led light and to record their evoked spikes. Each microelectrode can record spikes from more than a ganglion cell, for which it was necessary to determine which cell fires each spike applying a procedure known as spike sorting. The work allowed to obtain the recording of a stimulation period and another of non-stimulation, representing evoked and spontaneous action potentials. The recordings were saved, in order to visualize the action potentials of the ganglion cells detected and to apply a computational method for the spike sorting. In this way, it was saved the time stamps in which each action potential was fired by its respective cell. This work established a basic experimentation protocol focused to the use of MEA devices in the laboratory for acquisition of extracellular potentials at the Antonio Nariño University - Bogota Headquarters, not only for characterization of action potentials fired by retinal ganglion cells populations, but also for other kind of cells that can be studied employing MEA devices.
Keywords: evoked potentials, extracellular potentials, retinal ganglion cells, spike sorting.
INTRODUCCIÓN
Una de las características más importantes de las neuronas es su capacidad de generar potenciales de acción o espigas en respuesta a estímulos, cuyas propiedades y origen dependen del sistema u órgano al cual pertenecen (Matthews, 2003). Los potenciales de acción están dados por cambios en las distribuciones de las cargas eléctricas en las membranas de las neuronas, lo cual ha sido ampliamente estudiado y documentado en la literatura (Sharpee, 2013). Diversos procedimientos en experimentos in vitro permiten estudiar los potenciales de acción a nivel unicelular, siendo uno de los más conocidos la técnica de fijación de voltaje en microáreas de membrana (García-Rill, 2011). No obstante, existen preguntas en las que se hace necesario conocer los potenciales de acción que se generan en una población de neuronas (en cultivos u otro tipo de preparación histológica) de forma simultánea, para lo cual se ha desarrollado la tecnología de las matrices de microelectrodos (conocidas con la sigla MEA por su significado en inglés microelectrode array).
La literatura reporta diversas aplicaciones de las MEA. Una de ellas se orienta a los estudios de la actividad del hipocampo, donde por medio de estimulación con algunos microelectrodos de la misma MEA se ha logrado generar protocolos de LTP (long time potentiation) para el estudio detallado de la red que compone este tejido. Es así como se han respondido preguntas fisiológicas y farmacológicas en estudios in vitro del hipocampo relacionadas con enfermedad de Alzheimer y epilepsia (Van Bergen et al., 2003; Yu et al., 2009; Chong et al., 2011; Shi et al., 2014). Otras aplicaciones se han desarrollado para estudios in vitro de cardiomiocitos (Pradhapan et al., 2013), evaluación de medicamentos (Morefield et al., 2000; Natarajan et al., 2011), microelectroretinografía (Homma et al., 2009), análisis de la actividad eléctrica de la retina (Fernández et al, 2000; Chen et al., 2004; Greschner et al., 2006; Cerquera et al., 2008; Cerquera y Freund, 2011; Freund y Cerquera, 2012; Gómez et al., 2013; Palacios et al., 2014), entre otros. Los fabricantes de tecnologías MEA ofrecen una amplia gama de diseños y estructuras de acuerdo a la aplicación y experimentos en que requieran ser utilizadas, cuya información puede ser consultada en la literatura o en manuales de los fabricantes (Branner et al., 2001; Spira y Hai, 2013; Multichannel Systems, 2014).
El siguiente trabajo presenta a la comunidad científica nacional un laboratorio para la adquisición de potenciales extracelulares que se ha venido adecuando en los últimos años en la Universidad Antonio Nariño Sede Bogotá. El principal componente de este laboratorio es un sistema de matrices de microelectrodos, cuya funcionalidad se presenta describiendo el uso de un tipo de MEA estándar y los pasos básicos necesarios para detectar actividad eléctrica en células ganglionares de la retina de una rata albina. Adicionalmente, se incluye una discusión acerca de las tareas futuras que se deben realizar para complementar el laboratorio y proponer otros usos del mismo.
MATERIALES Y MÉTODOS
La retina de vertebrado puede representarse como un sistema de procesamiento de señal, donde la entrada son los fotones que transmiten la información visual que llegan a los fotorreceptores, mientras que la salida son las espigas generadas por cientos de millones de células ganglionares. Estas son neuronas cuyos axones se alargan formando el nervio óptico, con el fin de transmitir al cerebro los potenciales de acción producidos por la fototransducción y procesamiento celular de las diferentes capas de la retina (Yew et al., 2012). A continuación se presentan los elementos y métodos fundamentales de un experimento in vitro que permiten la detección de estas señales de salida en el sistema retiniano:
Matriz de microelectrodos (MEA)
La estructura de la MEA empleada en este trabajo se observa en la Fig. 1A, cuya referencia según el fabricante Multichannel Systems GmbH es 60MEA200/30iR-Ti-pr-T (Multichannel Systems, 2014). Esta MEA está compuesta por un sustrato de vidrio con dimensiones de 49 mm de ancho, 49 mm de largo y 1 mm de altura. Adherido a este se ubica un anillo de plástico con dimensiones de 26 mm de diámetro interno, 30 mm de diámetro externo, y una altura de 6 mm. Como se describirá más adelante, la función de este anillo es facilitar la perfusión de solución hidratante para nutrir las células o tejido en su interior.
En el centro de la MEA se encuentran 60 microelectrodos planares elaborados con una aleación de nitrato de titanio (TiN), distribuidos sobre un área de aproximadamente 2,5 mm2 y cuya observación sólo es posible con ayuda de un microscopio (Fig. 1B). Cada microelectrodo se une con una pista de TiN que conduce la información detectada y que aumenta su grosor a medida que se acerca a la periferia de la MEA. En este punto, los extremos de las pistas son de forma cuadrada para facilitar su conexión con el sistema de preamplificación durante el desarrollo de los experimentos. A la izquierda de las Figs. 1A y 1B se observa el electrodo de referencia de la MEA, cuyas dimensiones mayores a las de los demás lo hacen identificable a simple vista.
Generalmente, el número de células detectadas por cada microelectrodo en este tipo de MEAs varía entre uno y tres, y en muy raras ocasiones hasta cuatro. En el caso de la superficie de microelectrodos que se observa en la Fig. 1B, cada microelectrodo tiene un diámetro entre 10 y 30 micras, y los espacios entre electrodos oscilan entre 100 y 200 micras, lo que asegura que el potencial de acción de una sola célula no sea detectado por más de un microelectrodo (Gunning et al., 2005).
Solución Ringer
Durante la preparación de la retina, así como en la etapa de estimulación para el registro de su actividad eléctrica, fue necesario emular las condiciones fisiológicas de la retina. Con este fin, antes de iniciar el experimento se preparó una solución Ringer para mantener la funcionalidad de las células retinales con niveles adecuados de pH y temperatura. Se preparó 1000 mL de solución Ringer con los siguientes componentes: 1000 mL de agua destilada y purificada, 6,42 g de NaCl, 0,18 g de KCl, 0,11 g de CaCl, 0,152 g de MgCl, 1,84 g de NaHCO3 y 1,80 g de Glucosa. Estos componentes se disolvieron con un agitador magnético y la solución resultante se burbujeó durante 40 minutos con una mezcla de gas carbógeno (95 % O2 y 5 % CO2), con el objeto de mantener el pH de la solución Ringer entre 7,4 y 7,7. Así mismo, con ayuda de la placa calefactora del agitador se mantuvo la temperatura de la solución Ringer en 34 °C, mientras que la temperatura ambiente del laboratorio se conservó en 22 °C empleando un calefactor.
Extracción de la retina
Las retinas de una rata albina con edad de ocho semanas fueron extraídas y preparadas para el experimento. Este no se realizó con una rata de menor edad debido a que el tamaño de sus retinas es reducido, dificultando así su preparación histológica. Sin embargo, las retinas de esta especie contienen una concentración de células ganglionares suficiente para caracterizar su respuesta en periodos de estimulación y no estimulación lumínica, razón por la cual se consideró adecuada para desarrollar el presente trabajo. El animal con el que se realizó el experimento fue donado por el Laboratorio de Aprendizaje y Comportamiento Animal de la Universidad Nacional de Colombia Sede Bogotá.
El procedimiento se llevó a cabo conforme a las recomendaciones del Comité Institucional de Ética para Experimentación con Animales de la Universidad Antonio Nariño (Acta 01-23 de noviembre de 2011). Antes del experimento, el animal permaneció dos semanas bajo condiciones de ciclo controlado de luz/oscuridad de 12 horas con luces encendidas a las 7 am y control de humedad y temperatura.
La rata se sacrificó haciéndole inhalar los vapores de un trozo de gasa impregnado con 20 mL de isofluorano, asegurando posteriormente su muerte mediante dislocación cervical. El procedimiento para la extracción de cada ojo consistió inicialmente en hacer cortes con ayuda de unas tijeras Joseph sobre la comisura interna de cada uno, lo que permitió aumentar el espacio para retirar los tejidos alrededor del mismo y facilitar el corte del nervio óptico. Cada ojo fue extraído y sumergido inmediatamente en una caja de Petri con solución Ringer, en la cual se eliminó gran parte del tejido adiposo que aún permanecía alrededor. Este procedimiento se realizó empleando una pinza de relojero recta y unas tijeras Westcott para oftalmología, obteniendo el ojo mostrado en la Fig. 2A.
A partir de esta etapa, toda la preparación se realizó con ayuda de un microscopio estéreo. Mientras que uno de los ojos permanecía sumergido en una caja de Petri con solución Ringer, se comenzó con la preparación del otro, realizando un corte sobre su ora serrata (Fig. 2B) para extraer y desechar todos los componentes de la mitad anterior del ojo incluyendo el cristalino, obteniendo solo la mitad posterior a la que se denomina "ojo en copa" (Fig. 2C). Este último se dejó reposar en solución Ringer durante 30 minutos para facilitar posteriormente la separación de la esclera y la retina. Después de este tiempo, se removió el humor vítreo con ayuda de una pinza curva de relojero (Fig. 2D), lo cual fue necesario debido a que el humor vítreo es una sustancia aislante que dificultaría la detección de potenciales de acción por parte de los microelectrodos durante la fase de experimentación. En este paso, las habilidades manuales del experimentador exigieron un máximo de sutileza, puesto que el ejercicio mecánico de halar en exceso el humor vítreo podría haber causado daños en la retina.
Posteriormente, se sujetó con unas pinzas la esclera y con otras se levantó la retina ejerciendo presión desde afuera hacia adentro, hasta quedar totalmente separada de la esclera y evitando halarla con las puntas de las pinzas, obteniendo así la retina totalmente aislada (Fig. 2E). Se debe tener en cuenta que el ojo en copa siempre debió estar sumergido en solución Ringer, y que con ayuda de una pipeta Pasteur se hizo un recambio constante de la misma para conservar los valores de pH y temperatura adecuados.
Montaje de la retina en la MEA
En este tipo de experimentos, uno de los aspectos que influye en su éxito es el buen contacto que haga la retina sobre la superficie de microelectrodos de la MEA, específicamente de la capa de células ganglionares con los microelectrodos.
Para ello se fabricó la pieza de nylon mostrada en la Fig. 3A, la cual lleva en uno de sus extremos una porción de membrana de diálisis asegurada con un o-ring. El propósito era que la membrana quedara tan tensa como fuese posible, y con ayuda del peso de la pieza de nylon asegurar un buen contacto de la retina con los microelectrodos. De esta forma, el orificio en medio de la pieza se aprovechó para el paso de los estímulos de luz y el recambio de solución Ringer, que para este experimento se hizo de forma manual cada cinco minutos empleando una pipeta Pasteur.
Después de haber hecho la extracción completa de la retina se ubicó la pieza de nylon dentro de la misma placa de Petri donde se hizo la preparación de la retina, con la superficie que tiene la membrana de diálisis hacia arriba. Posteriormente, se succionó cuidadosamente la retina con una pipeta Pasteur y se ubicó sobre la membrana de diálisis, teniendo en cuenta que la capa de células ganglionares debía quedar hacia arriba. Esto se verificó teniendo en cuenta que la retina tiende a mantener algún nivel de concavidad en la superficie donde se encuentra la capa de células ganglionares, lo cual representó una guía visual para quien realizó el experimento. Con ayuda de las pinzas de relojero se estiró cuidadosamente los dobleces que quedaron después de ubicar la retina sobre la membrana de diálisis. Se emplearon pequeños trozos de toallas de papel para remover algunos sobrantes de solución Ringer alrededor de la retina y también facilitar el estiramiento de la misma, procurando que la retina no quedara completamente seca.En la Fig. 3B se observa la forma en que la retina quedó ubicada sobre la membrana de diálisis de la pieza de nylon.
A continuación, se sostuvo la MEA algunos centímetros sobre la retina, con la superficie que tiene los microelectrodos hacia abajo. Se bajó lentamente hasta que los microelectrodos hicieron contacto con la retina y se realizó un giro de 180 grados en sentido vertical de todo el conjunto, con el fin de obtener el montaje que se muestra en las Figs. 3C y 3D. Las Figs. 3E y 3F muestran en detalle la ubicación de la retina sobre la superficie de microelectrodos de la MEA. En este instante de la preparación, se agregaron 0,5 cm3 de solución Ringer al interior de la MEA para mantener nutrida e hidratada a retina.
Registro de espigas
El montaje mostrado en las Figs. 3C y 3D se ubicó dentro de un preamplificador MEA-Inv-System-E de 60 canales (Fig. 3G), el cual a su vez estaba sostenido por el portaobjetos de un microscopio invertido. De esta forma, el estímulo de luz se envió por la parte superior mientras se monitoreaba el desarrollo del experimento con las lentes del microscopio.
Las señales procesadas por el preamplificador se transmitieron a una tarjeta de adquisición PCI (peripheral component interconnect), la cual opera a una frecuencia de muestreo de 25000 Hz, ganancia de 1200, resolución de 14 bits para la conversión análogo-digital y un rango de voltaje de entrada de ±819 mV. La temperatura de la retina se controló mediante un módulo TC02 que se conectó al preamplificador para mantenerla en 34 °C. Todos los componentes del sistema MEA (matrices MEA, preamplificador, controlador de temperatura, tarjeta de conversión análogo/digital y software de análisis) fueron fabricados por la compañía Multichannel Systems GmbH de Alemania. La Fig. 4A presenta el esquema de interconexión de los principales elementos del montaje para este experimento, los cuales se observan en detalle en la Fig. 4B. Durante el tiempo de estimulación in vitro de la retina el laboratorio estuvo en completa oscuridad para asegurar que solo la luz led estimulara la retina. Debido al fondo oscuro del monitor en la visualización de los registros, y a la distancia entre este y el preamplificador, la luz del monitor no tuvo influencia alguna sobre la retina. Se debe aclarar que las ondas observadas en el monitor de la Fig. 4B fueron generadas con un simulador de electroretinografía provisto por el fabricante del sistema, donde cada cuadro representa cada uno de los 60 microelectrodos de la MEA.
Después de conectar todos estos elementos, la retina estuvo en reposo durante aproximadamente 15 minutos antes de comenzar la estimulación con luz. Estos estímulos fueron aplicados con una linterna led de intensidad 5,19 μW a una distancia aproximada de 20 cm de la retina, de tal modo que la cadencia de encendido y apagado de la luz fue controlada de forma manual por el experimentador. El software MC-Rack es la interfaz gráfica que permitió registrar y almacenar en el computador la información proveniente de la MEA cuando detectaba los potenciales de acción de la capa de células ganglionares de la retina. La comprobación de registros de espigas correlacionados con los estímulos de luz se hizo de forma visual, verificando en el monitor del computador la generación de ráfagas de espigas en los instantes en que el experimentador encendía la luz, así como ausencia o escasez de las mismas cuando se mantenía la luz apagada. De otro lado, el software permitió la aplicación de algunos filtros digitales para atenuación de ruido o frecuencias indeseadas. En este experimento, se configuró el software para aplicar un filtrado pasabanda en tiempo real compuesto por dos filtros Butterworth de segundo orden, un pasaaltas con frecuencia de corte de 200 Hz y un pasabajas con frecuencia de corte de 3000 Hz. Estos filtros permitieron conservar la información de las espigas y estabilizar la línea basal de los registros. Dado que fue posible registrar espigas con la primera retina que se preparó, se decidió desechar la segunda retina.
Clasificación de espigas
Como se mencionó, las espigas registradas por cada microelectrodo son generalmente la mezcla de las espigas disparadas por más de una célula. En la mayoría de aplicaciones que requieren el uso de MEAs es necesario hacer una clasificación de los potenciales de acción de acuerdo a la célula que los está generando, procedimiento conocido como "clasificación de espigas". Su fundamento radica en que cada neurona produce espigas con una forma de onda particular, de tal manera que se determina cuántas células se están registrando en cada canal (Quian, 2007). Aunque se necesita una herramienta de software para realizar este procedimiento, no es algo completamente automático, sino que requiere también la experiencia y conocimientos de la persona que lo realiza para seleccionar los parámetros que le permitan clasificar las células origen de las espigas.
Normalmente, la amplitud de las espigas es mayor a los niveles de ruido gaussiano que alcanzan a contaminar los registros en su línea basal y cuyas formas de onda pueden ser similares a las espigas. En este trabajo, el procedimiento para la clasificación de espigas se inició con la asignación de un umbral que permitiera determinar cuáles ondas correspondían a espigas y cuáles otras a ruido. Este paso se realizó con el software MC_Rack, asignando mediante inspección visual el umbral adecuado en cada canal. Un umbral muy cercano a los niveles de ruido podría tomar espigas de forma errónea, mientras uno muy alejado conllevaría a ignorar espigas evocadas de las células ganglionares. Posteriormente, el software determinó la célula a la cual correspondía cada espiga, permitiendo que el investigador definiera el instante de tiempo del pico de cada espiga para obtener la información temporal de los trenes de espigas. De ser necesario, el software permite exportar esta información en formato MS Excel, en caso que deban ser analizados con programas más especializados para el procesamiento de datos biológicos.
RESULTADOS
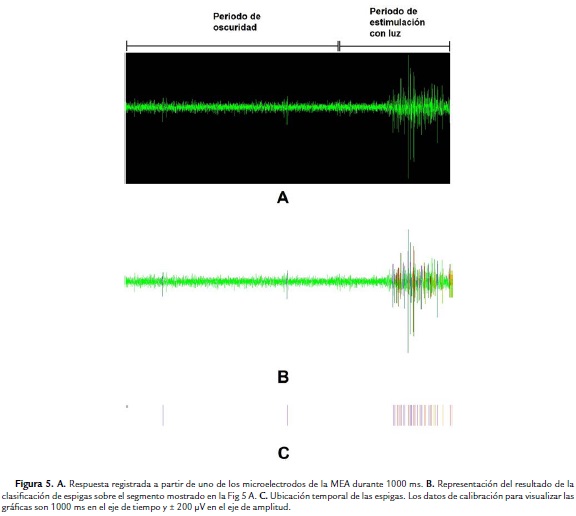
La Fig. 5A permite observar en detalle un segmento de 1000 ms de registro correspondiente al canal número 13, donde se visualizan las espigas generadas por las células ganglionares detectadas en ese microelectrodo. Los primeros 700 ms corresponden a periodo de oscuridad y los otros 300 ms a periodo de luz, observándose pocas espigas generadas en periodo de oscuridad y el aumento de estas como respuesta al estímulo con luz. La Fig. 5B representa el resultado de la clasificación de espigas, donde cada una se indica con un color que identifica la célula que la originó. En este caso, se detectaron tres células, identificadas cada una con colores violeta, rojo y amarillo, cuya ubicación temporal se presenta más claramente en la Fig. 5C. Esta asignación de colores se hace con ayuda del software MC_Rack. Se observa también que las espigas en color violeta corresponden a la única célula detectada con actividad en el periodo de oscuridad.
DISCUSIÓN
Las MEAs son desarrollos tecnológicos que permiten el análisis de poblaciones de células excitables mediante el registro de su actividad eléctrica. En este trabajo, se han registrado trenes de espigas de una población de células ganglionares en la retina de una rata albina, obtenidos mediante secuencias de luz encendida y apagada controladas manualmente. Tal como se esperaba, las ráfagas de espigas se generaron con una mayor frecuencia de disparo durante los instantes de luz encendida. El laboratorio en el que se han obtenido estos registros ha sido adecuado en el marco de un proyecto de investigación que considera a futuro la aplicación de estímulos más complejos, como por ejemplo, secuencias de diferentes intensidades de luz, ruido, escenas naturales, entre otras.
Como complemento a las funciones del laboratorio para posibilitar su uso en otras aplicaciones con MEAs, se ajustará un sistema automático de perfusión con la ayuda de bombas de jeringas para asegurar el flujo continuo de solución Ringer (o Ames) en experimentos de larga duración. De igual forma, vale la pena mencionar que actualmente los investigadores del proyecto en el cual se realizó este estudio están trabajando en adecuar un sistema que permita la emisión computarizada de los estímulos de luz. Con este fin, se está implementando dentro de la jaula de Faraday (indicada con el número 6 en la Fig. 4B) el soporte para un proyector de video que direccione su haz de luz sobre la retina y que la estimule con patrones de luz programados previamente en un computador. Dado que la tarjeta de adquisición de los registros incluye tres entradas análogas, es posible diseñar un arreglo que permita transmitir la información de los cambios de estímulos desde el computador que los controla a una de las entradas análogas, lo que permitirá detectar exactamente el tiempo de permutación de los estímulos e incluir esta información en el registro de las espigas. Posiblemente se requerirá también un juego de lentes de densidad neutra ubicados antes que los estímulos lleguen a la retina, con el fin de regular la intensidad de la luz de estímulo.
Para el desarrollo de futuros experimentos con retinas de vertebrados, se debe tener en cuenta ciertas variables que podrían incidir en el éxito de los mismos. Por ejemplo, se recomienda que el animal que se va a emplear en alguno de estos experimentos permanezca por lo menos 12 horas en total oscuridad antes de iniciar el procedimiento. Esto tiene como fin disminuir la adherencia entre capa de fotorreceptores y epitelio para facilitar la extracción de la retina en la etapa del ojo en copa. Adicionalmente, el uso de luz roja tenue durante la preparación, en lugar de luz blanca convencional, permite mantener la adaptación a la oscuridad en roedores. Esta especie no posee pigmentos visuales que perciban el espectro del color rojo, por lo que su uso no afectará las respuestas evocadas con los estímulos de luz durante los experimento. Cabe mencionar que el procedimiento más común para aplicación de los pulsos de luz es sobre la capa de fotorreceptores de la retina, mientras que la capa de células ganglionares está en contacto con los microelectrodos de la MEA (Fiscella et al., 2012).
Otro factor importante es la solución Ringer. Existen algunas variaciones en las concentraciones de los reactivos reportadas en diferentes trabajos, aunque lo más importante es mantener los valores de pH y temperatura cercanos a 7,5 y 32 °C respectivamente, con el objeto de emular tanto como sea posible las condiciones naturales de la retina dentro del ojo. No obstante, algunos trabajos en los últimos años han empleado solución de Ames como medio para mantener hidratada y nutrida la retina durante el experimento. De igual forma, la composición de esta solución hidratante se puede modificar en casos donde los experimentos estén orientados a la evaluación y prueba de medicamentos en algún tipo especial de células excitables. En cualquiera de estos casos, el control de la temperatura es fundamental cuando se experimenta con retinas de mamíferos, más no para retinas de reptiles o anfibios por su condición de "animales de sangre fría". También es un factor determinate la manipulación de la retina después que se ha separado del ojo en copa, ya que por su fragilidad se puede dañar fácilmente durante la remoción del humor vítreo y durante su ubicación sobre la membrana de diálisis (Fig. 3B). En este sentido, se debe realizar el procedimiento con suma paciencia y cuidado, usando adecuadamente las pinzas y demás elementos necesarios para la disección.
Es importante asegurar un contacto perfecto entre la retina y la superficie de microelectrodos para aumentar las probabilidades de registrar actividad en todos los canales de la MEA. Aunque en este experimento ese no fue el caso, los investigadores de este proyecto se encuentran trabajando para mejorar la técnica que asegure este contacto. Por otro lado, se proyecta explorar la experimentación en otro tipo de roedores con presencia de epitelio, debido a que en este tipo de retinas hay mayor concentración de melanina, lo que conlleva a una mayor concentración de células ganglionares que pueden proporcionar información de estímulos visuales más complejos. En este sentido, la presencia de epitelio pigmentario facilita el recambio de los segmentos externos de los fotorreceptores, mientras que en las especies albinas sin epitelio pigmentario puede haber una caída más rapida de la respuesta, lo cual representa un problema en experimentos de larga duración.
Por último, cabe resaltar la posibilidad de utilizar los recursos del laboratorio para desarrollar experimentos en otros ámbitos, como los que se indican en la sección de introducción del presente documento.
CONCLUSIONES
Se ha acondicionado un laboratorio basado en tecnología MEA que permitirá realizar procedimientos donde se requiera estudiar las respuestas extracelulares en poblaciones de células excitables. La funcionalidad del laboratorio ha sido demostrada mediante un procedimiento básico en neurofisiología como guía para futuros experimentos. Aunque es necesario aún complementar algunas condiciones del laboratorio, se tienen las condiciones iniciales para considerar la posibilidad de buscar otras aplicaciones que permitan explotar las capacidades del sistema con tecnología MEA instalado en este laboratorio.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a la International Brain Research Organization (IBRO) por otorgar recursos para la movilidad de investigadores entre la Universidad Antonio Nariño en Colombia y la Universidad de Valparaíso en Chile. Igualmente, agradecen al Dr Adrián Palacios, profesor e investigador principal del Centro Interdisciplinario de Neurociencia de Valparaíso por sus valiosos aportes en la redacción de este documento. Así mismo, los autores agradecen a la Dra Marisol Lamprea Rodríguez, directora del Laboratorio de Aprendizaje y Comportamiento Animal de la Universidad Nacional de Colombia Sede Bogotá, por la donación del animal empleado en este trabajo. Este proyecto ha sido financiado por el Servicio Alemán de Intercambio Académico (DAAD - Deutscher Akademischer Austauschdienst) y por la Vicerrectoría de Ciencia, Tecnología e Innovación de la Universidad Antonio Nariño (Proyecto 2011216).
REFERENCIAS
Branner A, Stein R, Normann R. Selective Stimulation of Cat Sciatic Nerve Using an Array of Varying-Length Microelectrodes. J Neurophysiol. 2001;85(4):1585-1594.
Cerquera A, Greschner M, Freund J. Classifying the Motion ofVisual Stimuli from the Spike Response of a Population of Retinal Ganglion Cells. Conf Proc IEEE Eng Med Biol Soc. 2008;4082-4085.
Cerquera A, Freund J. Fast Estimation of Motion from Selected Populations of Retinal Ganglion Cells. Biol Cybern. 2011;104(1-2):53-64. Doi: https://doi.org/10.1007/s00422-011-0418-x.
Chen A, Zhou Y, Gong H, Liang P. Firing Rates and Dynamic Correlated Activities of Ganglion Cells both Contribute to Retinal Information Processing. Brain Res. 2004;107(1-2):13-20. Doi: https://doi.org/10.1016/j.brainres.2004.04.081.
Chong S, Benilova I, Shaban H, De Strooper B, Devijver H, Moechars D, et al. Synaptic Dysfunction in Hippocampus of Transgenic Mouse Models of Alzheimer's Disease: a Multi-Electrode Array Study. Neurobiol Dis. 2011;44(3):284-91. Doi: https://doi.org/10.1016/j.nbd.2011.07.006.
Fernández E, Ferrández J, Ammermueller J, Normann R. Population Coding in Spike Trains of Simultaneously Recorded Retinal Ganglion Cells. Brain Res. 2000;887(1):222-229. Doi: https://doi.org/10.1016/S0006-8993(00)03072-9.
Fiscella M, Farrow K, Jones I, Jáckel D, Müller J, Frey U, et al. Recording from Defined Populations of Retinal Ganglion Cells Using a High-density CMOS-integrated Microelectrode Array with Real-time Switchable Electrode Selection. J Neurosci Methods. 2012;211(1):103-113.Doi: https://doi.org/10.1016/j.jneumeth.2012.08.017
Freund J, Cerquera A. How Spurious Correlations Affect a Correlation-based Measure of Spike Timing Reliability. Neurocomputing. 2012;81(1):97-103. Doi: https://doi.org/10.1016/j.neucom.2011.10.014.
García-Rill E. Electrophysiology in Translational Neuroscience. In: García-Rill E, editor. Translational Neuroscience: A Guide to a Successful Program. 1 ed. Hoboken, NJ, USA: Wiley-Blackwell; 2011. p. 85-86.
Gómez O, Muñoz A, Juárez L, Cerquera A. Decoding of Visual Stimuli from Extracellular Responses of a Retinal Ganglion Cells Population. Health Care Exchanges (PAHCE). Pan American; 2013. p. 1-5.
Greschner M, Thiel A, Kretzberg J, Ammermueller J. Complex Spike-event Pattern of Transient ON-OFF Retinal Ganglion Cells. J Neurophysiol. 2006;96(6):2845-56. Doi: https://doi.org/10.1152/jn.01131.2005.
Gunning D, Adams C, Cunningham W, Mathieson K, O'Shea V, Smith K, et al. 30jm Spacing 519-electrode Arrays for In Vitro Retinal Studies. Nucl Instrum Methods Phys Res A. 2005;546(1-2):148-153. Doi: https://doi.org/10.1016/j.nima.2005.03.021.
Homma K, Osakada F, Hirami Y, Jin Z, Mandai M, Takahashi M. Detection of Localized Retinal Malfunction in Retinal Degeneration Model Using a Multielectrode Array System. J Neurosci Res. 2009;87(9):2175-82. Doi: 10.1002/jnr.22024.
Matthews G. Cellular Physiology of Nerve and Muscle. 4 ed. Padstow, Cornwall, UK: Wiley-Blackwell; 2003. p. 57-83.
Morefield S, Keefer E, Chapman K, Gross G. Drug Evaluations Using Neuronal Networks Cultured on Microelectrode Arrays. Biosens Bioelectron. Doi: 2000;15(7-8):383-96.
Multichannel Systems. Microelectrode Array (MEA) Manual. [Internet]. Multi Channel Systems MCS GmbH, Reutlingen, Alemania; 2014[actualizado 5 May 2015; citado 13 oct 2014]. Disponible en http://www.multichannelsystems.com/sites/multichannelsystems.com/files/documents/manuals/MEA_Manual.pdf.
Natarajan A, Stancescu M, Dhir V, Armstrong C, Sommerhage F, Hickman J, et al. Patterned Cardiomyocytes on Microelectrode Arrays as a Functional, High Information Content Drug Screening Platform. Biomaterials. 2011;32(18):4267-74. Doi: https://doi.org/10.1016/j.biomaterials.2010.12.022.
Palacios A, Escobar M, Vielma A, Araya J, Astudillo A; Valdivia G, et al. Role of Connexin Channels in the Retinal Light Response of a Diurnal Rodent. Front Cell Neurosci. 2014; 8(1):1-13. Doi: https://doi.org/10.3389/fncel.2014.00249.
Pradhapan P, Kuusela J, Viik J, Aalto-Setálá K, Hyttinen J. Cardiomyocyte MEA Data Analysis (CardioMDA) - A Novel Field Potential Data Analysis Software for Pluripotent Stem Cell Derived Cardiomyocytes. PLoS One. 2013;8(9):e73637. Doi: https://doi.org/10.1371/journal.pone.0073637.
Quian R.: Spike sorting [Internet]. c2007 [cited 13 oct 2014]. Scholarpedia; [aprox. 10 pantallas] Disponible en http://www.scholarpedia.org/article/Spike_sorting.https://doi.org/10.4249/scholarpedia.3583.
Sharpee T. Computational Identification of Receptive Fields. Annu Rev Neurosci. 2013;36(1):103-120. Doi: http://x.doi.org/10.1146/annurev-neuro-062012-170253.
Shi Y, Gong X, Gong H, Liang P, Zhang P, Lu Q. Effect of the Entorhinal Cortex on Ictal Discharges in Low-Mg2+-induced Epileptic Hippocampal Slice Models. Neural Plast. 2014;2014(1):1-15. Doi: https://doi.org/10.1155/2014/205912.
Spira M, Hai A. Multi-electrode Array Technologies for Neuroscience and Cardiology. Nat Nanotechnol. 2013;8(1):83-94. Doi: https://doi.org/doi:10.1038/nnano.2012.265.
Van Bergen A, Papanikolaou T, Schuker A, Moeller A, Schlosshauer B. Long-term Stimulation of Mouse Hippocampal Slice Culture on Microelectrode Array. Brain Res Brain Res Protoc. 2003;11(2):123-33. Doi: https://doi.org/10.1016/S1385-299X(03)00024-2.
Yew D, Wai M, Li W. An Atlas on the Comparative Anatomy of the Retinae of Vertebrates. Hong Kong: Bentham Science Publishers; 2012. p. 3-190. Doi: https://doi.org/10.2174/97816080519461120101.
Yu Z, Graudejus O, Tsay C, Lacour SP, Wagner S, Morrison B 3rd. Monitoring Hippocampus Electrical Activity In Vitro on an Elastically Deformable Microelectrode Array. J Neurotrauma. 2009;26(7):1135-45. Doi: https://doi.org/10.1089/neu.2008.0810.
Referencias
Branner A, Stein R, Normann R. Selective Stimulation of Cat Sciatic Nerve Using an Array of Varying-Length Microelectrodes. J Neurophysiol. 2001;85(4):1585-1594.
Cerquera A, Greschner M, Freund J. Classifying the Motion ofVisual Stimuli from the Spike Response of a Population of Retinal Ganglion Cells. Conf Proc IEEE Eng Med Biol Soc. 2008;4082-4085.
Cerquera A, Freund J. Fast Estimation of Motion from Selected Populations of Retinal Ganglion Cells. Biol Cybern. 2011;104(1-2):53-64. Doi: https://doi.org/10.1007/s00422-011-0418-x.
Chen A, Zhou Y, Gong H, Liang P. Firing Rates and Dynamic Correlated Activities of Ganglion Cells both Contribute to Retinal Information Processing. Brain Res. 2004;107(1-2):13-20. Doi: https://doi.org/10.1016/j.brainres.2004.04.081.
Chong S, Benilova I, Shaban H, De Strooper B, Devijver H, Moechars D, et al. Synaptic Dysfunction in Hippocampus of Transgenic Mouse Models of Alzheimer's Disease: a Multi-Electrode Array Study. Neurobiol Dis. 2011;44(3):284-91. Doi: https://doi.org/10.1016/j.nbd.2011.07.006.
Fernández E, Ferrández J, Ammermueller J, Normann R. Population Coding in Spike Trains of Simultaneously Recorded Retinal Ganglion Cells. Brain Res. 2000;887(1):222-229. Doi: https://doi.org/10.1016/S0006-8993(00)03072-9.
Fiscella M, Farrow K, Jones I, Jáckel D, Müller J, Frey U, et al. Recording from Defined Populations of Retinal Ganglion Cells Using a High-density CMOS-integrated Microelectrode Array with Real-time Switchable Electrode Selection. J Neurosci Methods. 2012;211(1):103-113.Doi: https://doi.org/10.1016/j.jneumeth.2012.08.017
Freund J, Cerquera A. How Spurious Correlations Affect a Correlation-based Measure of Spike Timing Reliability. Neurocomputing. 2012;81(1):97-103. Doi: https://doi.org/10.1016/j.neucom.2011.10.014.
García-Rill E. Electrophysiology in Translational Neuroscience. In: García-Rill E, editor. Translational Neuroscience: A Guide to a Successful Program. 1 ed. Hoboken, NJ, USA: Wiley-Blackwell; 2011. p. 85-86.
Gómez O, Muñoz A, Juárez L, Cerquera A. Decoding of Visual Stimuli from Extracellular Responses of a Retinal Ganglion Cells Population. Health Care Exchanges (PAHCE). Pan American; 2013. p. 1-5.
Greschner M, Thiel A, Kretzberg J, Ammermueller J. Complex Spike-event Pattern of Transient ON-OFF Retinal Ganglion Cells. J Neurophysiol. 2006;96(6):2845-56. Doi: https://doi.org/10.1152/jn.01131.2005.
Gunning D, Adams C, Cunningham W, Mathieson K, O'Shea V, Smith K, et al. 30jm Spacing 519-electrode Arrays for In Vitro Retinal Studies. Nucl Instrum Methods Phys Res A. 2005;546(1-2):148-153. Doi: https://doi.org/10.1016/j.nima.2005.03.021.
Homma K, Osakada F, Hirami Y, Jin Z, Mandai M, Takahashi M. Detection of Localized Retinal Malfunction in Retinal Degeneration Model Using a Multielectrode Array System. J Neurosci Res. 2009;87(9):2175-82. Doi: 10.1002/jnr.22024.
Matthews G. Cellular Physiology of Nerve and Muscle. 4 ed. Padstow, Cornwall, UK: Wiley-Blackwell; 2003. p. 57-83.
Morefield S, Keefer E, Chapman K, Gross G. Drug Evaluations Using Neuronal Networks Cultured on Microelectrode Arrays. Biosens Bioelectron. Doi: 2000;15(7-8):383-96.
Multichannel Systems. Microelectrode Array (MEA) Manual. [Internet]. Multi Channel Systems MCS GmbH, Reutlingen, Alemania; 2014[actualizado 5 May 2015; citado 13 oct 2014]. Disponible en http://www.multichannelsystems.com/sites/multichannelsystems.com/files/documents/manuals/MEA_Manual.pdf.
Natarajan A, Stancescu M, Dhir V, Armstrong C, Sommerhage F, Hickman J, et al. Patterned Cardiomyocytes on Microelectrode Arrays as a Functional, High Information Content Drug Screening Platform. Biomaterials. 2011;32(18):4267-74. Doi: https://doi.org/10.1016/j.biomaterials.2010.12.022.
Palacios A, Escobar M, Vielma A, Araya J, Astudillo A; Valdivia G, et al. Role of Connexin Channels in the Retinal Light Response of a Diurnal Rodent. Front Cell Neurosci. 2014; 8(1):1-13. Doi: https://doi.org/10.3389/fncel.2014.00249.
Pradhapan P, Kuusela J, Viik J, Aalto-Setálá K, Hyttinen J. Cardiomyocyte MEA Data Analysis (CardioMDA) - A Novel Field Potential Data Analysis Software for Pluripotent Stem Cell Derived Cardiomyocytes. PLoS One. 2013;8(9):e73637. Doi: https://doi.org/10.1371/journal.pone.0073637.
Quian R.: Spike sorting [Internet]. c2007 [cited 13 oct 2014]. Scholarpedia; [aprox. 10 pantallas] Disponible en http://www.scholarpedia.org/article/Spike_sorting.https://doi.org/10.4249/scholarpedia.3583.
Sharpee T. Computational Identification of Receptive Fields. Annu Rev Neurosci. 2013;36(1):103-120. Doi:http://x.doi.org/10.1146/annurev-neuro-062012-170253.
Shi Y, Gong X, Gong H, Liang P, Zhang P, Lu Q. Effect of the Entorhinal Cortex on Ictal Discharges in Low-Mg2+-induced Epileptic Hippocampal Slice Models. Neural Plast. 2014;2014(1):1-15. Doi: https://doi.org/10.1155/2014/205912.
Spira M, Hai A. Multi-electrode Array Technologies for Neuroscience and Cardiology. Nat Nanotechnol. 2013;8(1):83-94. Doi: https://doi.org/doi:10.1038/nnano.2012.265.
Van Bergen A, Papanikolaou T, Schuker A, Moeller A, Schlosshauer B. Long-term Stimulation of Mouse Hippocampal Slice Culture on Microelectrode Array. Brain Res Brain Res Protoc. 2003;11(2):123-33. Doi: https://doi.org/10.1016/S1385-299X(03)00024-2.
Yew D, Wai M, Li W. An Atlas on the Comparative Anatomy of the Retinae of Vertebrates. Hong Kong: Bentham Science Publishers; 2012. p. 3-190. Doi: https://doi.org/10.2174/97816080519461120101.
Yu Z, Graudejus O, Tsay C, Lacour SP, Wagner S, Morrison B 3rd. Monitoring Hippocampus Electrical Activity In Vitro on an Elastically Deformable Microelectrode Array. J Neurotrauma. 2009;26(7):1135-45. Doi: https://doi.org/10.1089/neu.2008.0810.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2015 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).