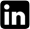Inducción de la producción de lípidos totales en microalgas sometidas a estrés nutritivo
Induction of Total Lipids Production in Microalgae Under Nutritional Stress
DOI:
https://doi.org/10.15446/abc.v21n1.47439Palabras clave:
biodiesel, biomasa, microalgas, tasa de crecimiento, biomass, growth rate, microalgae. (es)Biodiesel, biomass, growth rate, microalgae (en)
Se evaluó la producción de lípidos totales en cinco especies de microalgas inducidas por la ausencia de nitrógeno. Las microalgas empleadas fueron Ankistrodesmus sp., Ankistrodesmus nannoselene, Chlorella sp., Scenedesmus sp. y Scenedesmus quadricauda. Estas especies fueron cultivadas en medio CHU10 con y sin nitrógeno. El tiempo de evaluación fue de seis días, determinándose diariamente la densidad microalgal mediante recuento en cámara de Neubahuer. Se determinó la tasa de crecimiento, la biomasa microalgal y el porcentaje de lípidos totales. Los lípidos totales fueron extraídos con solución Cloroformo:metanol (2:1). Los resultados indicaron que las especies con mayor producción de lípidos totales fueron Ankistrodesmus sp. (263,6 mg/g biomasa seca), A. nannoselene (316 mg/g biomasa seca) y Scenedesmus sp. (243,3 mg/g biomasa seca) al ser cultivadas en medios sin nitrógeno. Scenedesmus quadricauda y Chlorella sp., fueron las especies que mostraron mayor producción de biomasa seca (159,1 mg/g biomasa seca y 221,1 mg/g biomasa seca respectivamente) en medios con nitrógeno. La tasa de crecimiento fue variable entre las especies cultivadas en ambas condiciones. En conclusión, Ankistrodesmus sp., mostró la mayor tasa de crecimiento (0,77 dia-1) en medio sin nitrógeno. Bajo las mismas condiciones de cultivo, Scenedesmus sp. obtuvo la mayor producción de biomasa en peso seco (174,7 mg/l) y Ankistrodesmus nannoselene acumuló el mayor porcentaje de lípidos totales.
The production of total lipids in five microalgal species was induced by absence of nitrogen. The microalgae Ankistrodesmus sp., Ankistrodesmus nannoselene, Chlorella sp., Scenedesmus sp. and Scenedesmus quadricauda were cultured in CHU10 medium with and without nitrogen. They were evaluated during six days. The microalgae density was daily determined by a Neubahuer chamber. The average growth, total biomass and total lipids were also determined. The total lipids were extracted with chloroform: methanol (2:1). The results indicated that species with production greater amount of total lipids were Ankistrodesmus sp. (263.6 mg/g dry biomass), Ankistrodesmus nannoselene (316 mg/g dry biomass) and Scenedesmus sp. (243.3 mg/g dry biomass) when grown in media without nitrogen. Scenedesmus quadricauda and Chlorella sp. when grown in media with nitrogen showed higher amount of dry biomass (159.1 mg/g dry biomass and 221.1 mg/g dry biomass respectively) compared to those which were grown in media without nitrogen. The growth rate was variable between species grown in both conditions. In conclusion, Ankistrodesmus sp. microalgae experienced the highest growth rate (0.77 day-1) in medium without nitrogen. Under the same culture conditions, Scenedesmus sp., had the highest biomass production in dry weight (174.7 mg/l) and Ankistrodesmus nannoselene accumulated the highest percentage of total lipids.
Doi: https://doi.org/10.15446/abc.v21n1.47439.
INDUCCIÓN DE LA PRODUCCIÓN DE LÍPIDOS TOTALES EN MICROALGAS SOMETIDAS A ESTRÉS NUTRITIVO
Induction of Total Lipids Production in Microalgae Under Nutritional Stress
Marianela COBOS RUIZ1, Jae Diana PAREDES RODRÍGUEZ1, Juan Carlos CASTRO GÓMEZ2.
1 Laboratorio de Biotecnología y Bioenergética. Universidad Científica del Perú. Av. Abelardo Quiñones Km 2,5, San Juan Bautista. Iquitos, Perú.
2 Centro de Investigaciones de Recursos Naturales-CIRNA, Universidad Nacional de la Amazonia Peruana. Psje. Los Paujiles. Nuevo San Lorenzo, Perú.
For correspondence. marianela_cobosr@yahoo.es
Received: 20th November 2014, Returned for revision: 23rd April 2015, Accepted: 29th August 2015.
Associate Editor: Sergi Sabater.
Citation / Citar este artículo como: Cobos Ruiz M, Paredes Rodríguez JD, Castro Gómez JC. Inducción de la producción de lípidos totales en microalgas sometidas a estrés nutritivo.Acta biol. Colomb. 2016;21(1):17-26. doi: https://doi.org/10.15446/abc.v21n1.47439.
RESUMEN
Se evaluó la producción de lípidos totales en cinco especies de microalgas inducidas por la ausencia de nitrógeno. Las microalgas empleadas fueron Ankistrodesmus sp., Ankistrodesmus nannoselene, Chlorella sp., Scenedesmus sp. y Scenedesmus quadricauda. Estas especies fueron cultivadas en medio CHU10 con y sin nitrógeno. El tiempo de evaluación fue de seis días, determinándose diariamente la densidad microalgal mediante recuento en cámara de Neubahuer. Se determinó la tasa de crecimiento, la biomasa microalgal y el porcentaje de lípidos totales. Los lípidos totales fueron extraídos con solución Cloroformo:metanol (2:1). Los resultados indicaron que las especies con mayor producción de lípidos totales fueron Ankistrodesmus sp. (263,6 mg/g biomasa seca), A. nannoselene (316 mg/g biomasa seca) y Scenedesmus sp. (243,3 mg/g biomasa seca) al ser cultivadas en medios sin nitrógeno. Scenedesmus quadricauda y Chlorella sp., fueron las especies que mostraron mayor producción de biomasa seca (159,1 mg/g biomasa seca y 221,1 mg/g biomasa seca respectivamente) en medios con nitrógeno. La tasa de crecimiento fue variable entre las especies cultivadas en ambas condiciones. En conclusión, Ankistrodesmus sp., mostró la mayor tasa de crecimiento (0,77 dia-1) en medio sin nitrógeno. Bajo las mismas condiciones de cultivo, Scenedesmus sp. obtuvo la mayor producción de biomasa en peso seco (174,7 mg/l) y Ankistrodesmus nannoselene acumuló el mayor porcentaje de lípidos totales.
Palabras clave: Biodiesel, biomasa, microalgas, tasa de crecimiento.
ABSTRACT
The production of total lipids in five microalgal species was induced by absence of nitrogen. The microalgae Ankistrodesmus sp., Ankistrodesmus nannoselene, Chlorella sp., Scenedesmus sp. and Scenedesmus quadricauda were cultured in CHU10 medium with and without nitrogen. They were evaluated during six days. The microalgae density was daily determined by a Neubahuer chamber. The average growth, total biomass and total lipids were also determined. The total lipids were extracted with chloroform: methanol (2:1). The results indicated that species with production greater amount of total lipids were Ankistrodesmus sp. (263.6 mg/g dry biomass), Ankistrodesmus nannoselene (316 mg/g dry biomass) and Scenedesmus sp. (243.3 mg/g dry biomass) when grown in media without nitrogen. Scenedesmus quadricauda and Chlorella sp. when grown in media with nitrogen showed higher amount of dry biomass (159.1 mg/g dry biomass and 221.1 mg/g dry biomass respectively) compared to those which were grown in media without nitrogen. The growth rate was variable between species grown in both conditions. In conclusion, Ankistrodesmus sp. microalgae experienced the highest growth rate (0.77 day-1) in medium without nitrogen. Under the same culture conditions, Scenedesmus sp., had the highest biomass production in dry weight (174.7 mg/l) and Ankistrodesmus nannoselene accumulated the highest percentage of total lipids.
Keywords: Biodiesel, biomass, growth rate, microalgae.
INTRODUCCIÓN
Actualmente, las microalgas oleaginosas son consideradas como fuente de biocombustibles de segunda generación (Loera y Olguín, 2010) porque tienen la capacidad de acumular grandes cantidades de lípidos cuando son sometidas a condiciones de estrés ambiental (Ho et al., 2011). Esta es un área de considerable interés porque es una de las fuentes alternativas de energía renovable más promisorias (Sheehan et al., 1998), debido a sus altas productividades con respecto a los cultivos existentes (Garibay et al., 2009; Loera y Olguín, 2010). Estas algas acumulan triglicéridos por su capacidad fotobiosintética, pueden secuestrar CO2 de fuentes industriales (Ho et al., 2011) y demandan menos área que los cultivos tradicionales (Smith et al., 2009). Además, las microalgas pueden producir diversas sustancias de interés comercial como nutrientes, aditivos alimenticios, fármacos y otras sustancias (Li et al., 2008;Rosenberg et al., 2008; Stephens et al., 2010). Debido a esta gran diversidad biosintética se han realizado aislamientos y existen colecciones de microalgas en varias instituciones del mundo (Duong, 2012). Asimismo, se estima que menos del 10 % han sido evaluadas por su capacidad de producción de biodiesel (Radakovits et al., 2012).
Las microalgas tienen capacidad para sobrevivir en condiciones diversas y extremas, lo cual se refleja en la enorme diversidad y muchas veces a su inusual patrón de lípidos celulares (Sharma et al., 2012). El mismo autor refiere que algunas microalgas pueden también modificar el metabolismo de los lípidos de manera eficiente en respuesta a cambios en las condiciones ambientales. En condiciones óptimas de crecimiento, se producen grandes cantidades de biomasa microalgal, pero con contenidos lipídicos relativamente bajos, en condiciones ambientales desfavorables o estrés, muchas microalgas alteran sus rutas biosintéticas de lípidos hacia la formación y acumulación de lípidos neutros, principalmente en forma de triglicéridos, lo que permite que las microalgas puedan soportar estas condiciones adversas. Los principales estímulos químicos son la deficiencia de nutrientes (nitrógeno, fósforo, azufre y silicio), la salinidad y el pH del medio de cultivo; los estímulos físicos son la temperatura y la intensidad luminosa (Rodolfi et al., 2009; Sims y Christenson, 2011). La deficiencia de nitrógeno es, con respecto a los nutrientes, el factor que más afecta el metabolismo de los lípidos (Courchesne et al., 2009).
En ese sentido, el estudio de microalgas bajo condiciones de cultivo sin nitrógeno es importante porque proporcionará conocimientos básicos sobre el comportamiento microalgal de estas especies para lograr la producción sustentable de biodiesel en la amazonía peruana. Sin embargo, los estudios de microalgas en nuestra región sólo se han limitado a identificarlas (Vela, 1984; Sánchez, 1991; López, 2009; Cobos et al., 2012). Por lo anteriormente mencionado, el objetivo de la presente investigación fue evaluar la producción de lípidos totales inducidos por la ausencia de nitrógeno en el medio de cultivo en cinco especies de microalgas aisladas de la amazonia peruana.
MATERIALES Y MÉTODOS
Área de estudio
La investigación se llevó a cabo en el Laboratorio de Biotecnología y Bioenergética de la Universidad Científica del Perú (UCP), localizada en el km 2,5 de la ciudad de Iquitos, Distrito de San Juan Bautista, Provincia de Maynas, Departamento de Loreto. La extracción de lípidos totales se realizó en la Unidad Especializada del Centro de Investigación de Recursos Naturales de la Amazonia Peruana (CIRNA) de la Universidad Nacional de la Amazonia Peruana (UNAP) Loreto, Perú, ubicado en el Pasaje Los Paujiles S/N del Distrito de San Juan Bautista, Provincia de Maynas, Departamento de Loreto.
Cultivo de microalgas
Se utilizaron cultivos unialgales de las especies de microalgas: Ankistrodesmus sp. Corda, 1838; Scenedesmus sp. Meyen, 1829; Chlorella sp. Beijerinck, 1890; Scenedesmus quadricauda Chodat y Ankistrodesmus nannoselene Skuja, 1948, proporcionadas por el Laboratorio de Biotecnología y Bioenergética de la Universidad Científica del Perú. Estas microalgas fueron aisladas del río Itaya (03°43' S y 073°14' W) (Cobos et al., 2014) el cual está ubicado en la Provincia de Maynas, Departamento de Loreto, Perú. A excepción de Chlorella sp., las especies de microalgas pertenecen a la división Chlorophyta, Clase Chlorophyceae, Orden Sphaeropleales, familias Selenastraceae y Scenedesmaceae. Correspondiendo para Chlorella sp. el orden Chlorellales y la familia Chlorellaceae (Guiry y Guiry, 2015). Estas especies fueron seleccionadas por su característica oleaginosa y por su capacidad adaptativa a las condiciones de cultivo establecidas en el laboratorio.
Los cultivos fueron iniciados con un inóculo de cada microalga (10 ml) las mismas que fueron colocados en matraces de 250 ml que contenían 100 ml de medio CHU10 preparado de acuerdo a Barclay et al. (1986) bajo condiciones controladas de temperatura 26 ± 2 °C, iluminación de 100 μE.m2.s-1, fotoperiodo 12h:12h y aireación constante por un periodo de dos semanas, luego fueron transferidos a matraces de 500 ml y 1 l de capacidad, donde se aumentaron su volumen hasta completar 1 l de cultivo y las microalgas hayan alcanzado un crecimiento celular mayor a 1,6 x 106 células/ml por un periodo de tres semanas más. Para ello, 100 μl del cultivo se homogenizó con 50 μl de lugol y se transfirió a una cámara de Neubahuer para el recuento celular con un microscopio a 40x (Carl Zeiss-AxioLab.A1). Esto se realizó con la finalidad de promover la adaptación de cada microalga a las condiciones de cultivo y alcanzar la cantidad de biomasa microalgal apropiada (∼ 15 ml) para los bioensayos experimentales.
Cultivo de las microalgas bajo condiciones de estrés nutritivo
La evaluación en cada especie de microalga se realizó a partir de la biomasa cosechada. La cosecha de las microalgas se realizó por centrifugación del cultivo a 4000 rpm x 10 minutos a 25 °C. El precipitado microalgal obtenido fue transferido a tubos de 50 ml, se añadió 15 ml de suero fisiológico (NaCl) y se centrifugó por dos veces bajo las mismas condiciones mencionadas anteriormente. Se distribuyó 1 ml de biomasa microalgal y se homogenizó en matraces de 250 ml con 200 ml de medio CHU10 conteniendo nitrógeno (medio completo) para el caso del control positivo y para el grupo experimental se colocó la misma cantidad de biomasa en matraces de 250 ml con 200 ml de medio CHU10 sin nitrógeno (medio incompleto). Estos ensayos se realizaron por triplicado y los cultivos fueron sometidos a condiciones de flujo de aire constante, a 26 °C y un fotoperiodo de (12:12) horas luz/oscuridad con una intensidad lumínica de 100 μE.m2.s-1, por un período de seis días.
Variables evaluadas
Densidad microalgal
La densidad microalgal fue determinada a la misma hora mediante recuento en cámara de Neubahuer recomendado para contar algas pequeñas (de 2 a 30 mm y cultivos de densidades entre 5 x 104 y 5 x 107 cel/ml) (Richmond, 2004) bajo un microscopio óptico (40x) (Carl Zeiss-AxioLab.A1). Para cada réplica el conteo se realizó por duplicado. Para obtener el número de células/ml fue de acuerdo a (Shen et al., 2010):
Tasa de crecimiento microalgal
La tasa de crecimiento fue calculada a partir de recuentos diarios al microscopio, utilizando la siguiente fórmula (Rioboo et al., 2003):
µ = [ln(Nt)–ln(N0)] / ln2 (t-t0)
Donde: Nt = número de células o densidad óptima al tiempo final; N0 = número de células o densidad óptima al tiempo inicial; t = tiempo final; t0 = tiempo inicial.
Producción de biomasa
Transcurrido el período de evaluación, se cosecharon las microalgas por centrifugación (4000 rpm x 10 minutos a 25 °C) y la biomasa obtenida se secó en placas petri a 50 °C por 24 h bajo condiciones de oscuridad. La biomasa se calculó teniendo en cuenta la diferencia de peso de biomasa seca contenida en la placa petri:
PB = Bf–Bi
Donde: PB = Producción de biomasa; Bf = Peso de placa vacía; Bi = Peso de placa con biomasa seca.
Extracción y análisis de lípidos totales
La extracción de lípidos totales se realizó según el método gravimétrico (Yu et al., 2012). Este método es frecuentemente empleado para la extracción de lípidos totales de microalgas oleaginosas debido a su simplicidad y efectividad. La cantidad de lípidos totales extraídos se calculó con la siguiente ecuación:
Contenido de lípidos (%) = (PL / PM) x 100
Donde PL es el peso seco de los lípidos totales y PM es el peso seco de las microalgas.
Determinación cualitativa de lípidos totales
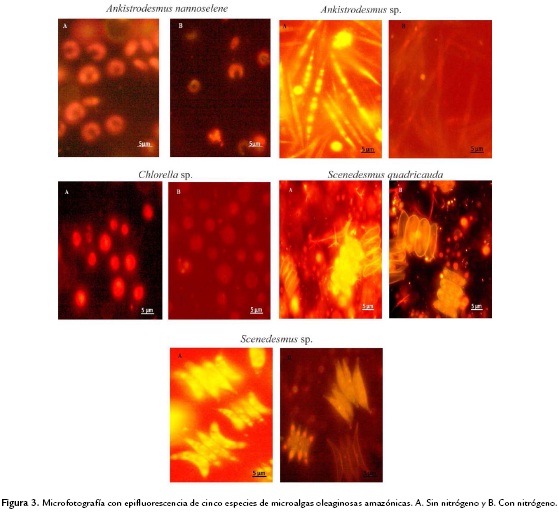
Los triglicéridos intracelulares de las microalgas evaluadas fueron detectados por la fluorescencia que emiten al interactuar con Rojo Nilo (Greenspan et al., 1985). Para ello, las células fueron teñidas con 2mg/ml de Rojo Nilo (disuelto en acetona) por 15 minutos y fotografiados empleando un microscopio trinocular de epifluorescencia Carl Zeiss-AxioLab.A1 y una cámara digital AxioCamERc 5s en tiempo real. Las imágenes fueron obtenidas con una magnificación de 1000x con luz visible y epifluorescencia (excitación: 510-560, emisión: 590).
Análisis estadístico
Se determinó el promedio, desviación estándar, para conocer si existen diferencias estadísticas significativas en la producción de lípidos totales a través del programa ANOVA con prueba de HSD de Tukey. Para la elaboración de las figuras de producción de biomasa y la tasa de crecimiento microalgal se empleó el programa Excel de Microsoft Office.
RESULTADOS
Densidad celular de microalgas
Por lo general, se evidencia un mejor crecimiento de las especies microalgales en medios de cultivo con nitrógeno (Fig.1). Asimismo, las especies Ankistrodesmus sp., A. nannoselene y Scenedesmus quadricauda fueron las que mejor se adaptaron a ambas condiciones de cultivo (con y sin nitrógeno) alcanzando densidades entre 9 x 106 cel/ml y 16 x 106 cel/ml. Además, Ankistrodesmus sp. cultivada en medio con nitrógeno fue la especie que alcanzó mayor crecimiento microalgal (15,7 x 106 cel/ml) con respecto al medio sin nitrógeno, tal como se evidencia en la Fig. 1. Similar comportamiento mostraron S. quadricauda y A. nannoselene que alcanzaron densidades celulares de 13,6 x 106 cel/ml y 9,2 x 106 cel/ml respectivamente. Las especies Chlorella sp. y Scenedesmus sp. fueron las que obtuvieron menor crecimiento microalgal (2,8 x106 cel/ml y 0,2 x 106 cel/ml) en ambas condiciones de cultivo durante el período de evaluación.
En general, las especies de microalgas evaluadas mostraron mayores tasas de crecimiento cuando fueron cultivadas en medios con nitrógeno (Figura 2A), correspondiendo los valores más altos a A. nannoselene (0,77 d-1) y S. quadricauda (0,42 d-1). Asimismo, se observó que A. nannoselene, y S. quadricauda, fueron las especies que registraron los valores más altos cuando fueron cultivadas en medios sin nitrógeno, seguido de Ankistrodesmus sp., Scenedesmus sp. y Chlorella sp.
La producción de biomasa microalgal en peso seco fue mayor en Scenedesmus sp. y Chlorella sp., al ser cultivadas en medios sin nitrógeno. Las especies microalgales A. nannoselene, Ankistrodesmus sp., y S. quadricauda mostraron una producción de biomasa mayor al ser cultivadas en medios con nitrógeno. No existiendo diferencias significativas entre los tratamientos evaluados. Sin embargo, se evidencia claras diferencias significativas entre las especies evaluadas (Fig. 2B).
Respecto al contenido de lípidos, las especies que acumularon mayor cantidad de lípidos totales (mg/g biomasa seca) fueron aquellas cultivadas en medios sin nitrógeno; A. nannoselene (316 mg/g biomasa seca), Ankistrodesmus sp. (263,6 mg/g biomasa seca), y Scenedesmus sp. (243,3 mg/g biomasa seca), con respecto a S. quadricauda y Chlorella sp. que mostraron menor contenido lipídico. Ankistrodesmus sp., A. nannoselene y Scenedesmus sp., mostraron diferencias estadísticas altamente significativas en el contenido de lípidos totales cuando fueron cultivadas en medios con y sin nitrógeno, mientras que en S. quadricauda y Chlorella sp. no se observaron diferencias significativas (Fig. 2C).
Las microalgas estudiadas al ser teñidas con Rojo Nilo nos permitieron determinar diferencias cualitativas respecto a la presencia de lípidos en el interior de ellas al ser inducidas bajo condiciones de cultivo sin nitrógeno. En general, se evidenció que entre las cinco especies e individuos de la misma especie la producción de triglicéridos fue variable (Fig. 3). Scenedesmus sp. y Ankistrodesmus sp., fueron las especies microalgales que mostraron mayores diferencias cualitativas bajo las mismas condiciones de cultivo. A diferencia de las demás especies cuyas diferencias no fueron muy notorias.
DISCUSIÓN
La capacidad de las microalgas para sobrevivir en diversas condiciones extremas se refleja en la enorme diversidad y a veces en su patrón inusual de los lípidos obtenidos a partir de estas microalgas (Sato et al., 2000). Asimismo, es un hecho que las microalgas incrementan su contenido de lípidos al ser sometidas a condiciones de estrés en particular bajo restricciones de nutrientes (Gonzales y Magallanes, 2012).
Los resultados obtenidos en la presente investigación indican que mientras la cantidad de lípidos totales puede llegar a incrementar significativamente cuando existe limitación de nitrógeno, la tasa de crecimiento o producción de biomasa es disminuida, lo cual no es rentable cuando se quiere tener una alta productividad de aceites usando microalgas oleaginosas. Estos resultados concuerdan con los obtenidos por Huntley y Redalje (2007).
Es importante indicar que en términos generales la producción de biomasa y el contenido de lípidos totales en las cinco microalgas oleaginosas evaluadas fueron variables. Así, en Ankistrodesmus sp., Ankistrodesmus nannoselene y Scenedesmus sp., cultivadas en medios sin nitrógeno se registró una menor producción de biomasa y un mayor porcentaje de lípidos totales durante el período de evaluación, observándose un comportamiento diferente en el caso de S. quadricauda y Chlorella sp, lo cual nos sugieren que algunas especies microalgales tienen la capacidad de modificar el metabolismo de lípidos como respuesta a los cambios en las condiciones ambientales, tal como lo menciona Thompson (1996) y Guschina y Harwood (2006), produciendo grandes cantidades de biomasa microalgal pero con contenidos lipídicos relativamente bajos (Khozin-Goldberg y Cohen, 2006).
En esencia, la producción de la biomasa y triglicéridos microalgales compiten por una asimilación fotosintética, requiriendo muchas veces una reprogramación de las vías fisiológicas para estimular la biosíntesis de lípidos, lo que permite a las microalgas soportar las condiciones adversas (Bigogno et al., 2002). Asimismo, los resultados obtenidos concuerdan con Shen et al. (2010) quienes indicaron que la producción de lípidos se incrementó con la limitación de nitrato en el cultivo de Scenedesmus sp. y además atribuyen que el consumo del nitrato inicial produjo limitación después de 50 horas de cultivo, este efecto pudo evitar la necesidad de la cosecha de la biomasa seguida de la limitación de nitrógeno. Además, Gonzales y Magallanes (2012) pudieron constatar que Chlorella sp. y Scenedesmus sp. tuvieron un alto potencial de generación de lípidos. La más productiva fue Chlorella sp., con un valor máximo de 37 %, seguido por Scenedesmus sp., con 18 % en el tratamiento sin Nitratos y un 15 % con el exceso de hierro.
Por lo general la tasa de crecimiento en las cinco especies microalgales evaluadas fue mayor en medios de cultivo con nitrógeno con respecto a aquellas cultivadas en medios sin nitrógeno, lo cual concuerda con Widjaja y Chien (2009), quienes atribuyen que en condiciones mínimas de nitrógeno se da una alta producción de lípidos y se complementa con bajas tasas y bajos recuentos de células, afectando a la biomasa total y la productividad de los lípidos.
De igual modo, Chlorella sp., fue la que mostró una mayor tasa de crecimiento en medio con nitrógeno. Estos resultados concuerdan con Canedo-López et al. (2011) quienes obtuvieron un mayor crecimiento de Chlorella vulgaris de 22 x 106 células/ ml con 30 mg/l, disminuyendo la densidad celular a 17,8 x 106 cel/ml con una concentración de nitrógeno de 15 y 10 mg/l; alcanzando tasas de crecimiento 0,183 d-1, 0,170 d-1 y 0,157 d-1, respectivamente, a los seis días de cultivo. Lo anterior sugiere que, la mayor concentración de nitrógeno causa un mejor crecimiento de la microalga. Asimismo, Ruiz et al. (2010) reportaron para C. vulgaris una menor densidad celular de 6,4 x 106 cél.mL-1 y una tasa de crecimiento mayor de 0,377 d-1 cultivada en medio artificial con concentraciones de 30 mg N L-1 como NH4Cl después de dos días de cultivo. Esta diferencia probablemente se atribuye a la diferente temperatura a la que fue cultivada la microalga C. vulgaris.
De igual manera, Millan y Fernández (2011) manifestaron que en Scenedesmus sp., tanto el crecimiento como los lípidos incrementaron durante los primeros tres días de cultivo, alcanzando un máximo al tercer día. Sin embargo, no se alcanzó una limitación de nitrógeno importante, debido a que la concentración inicial fue mayor y en el medio aún había concentraciones altas de nitratos. Además, Arias y Cañizares (2011) al cultivar Chlorella sp. con nitrógeno obtuvieron un alto consumo de nutrientes y un rápido crecimiento, alcanzando un incremento total de biomasa del 44 %, 47 % y 13 % los días seis y 20 % con respecto al contenido de biomasa en el medio sin nitrógeno, lo que favoreció una alta productividad de 24,04 mg/l. a los 11 días en el cultivo con nitrógeno, valor que resulta superior a los reportados por Lee et al. (2009) para Botryococcus sp. (77 %), Chlorella vulgaris (11,1 %) y Scenedesmus sp. (9,5 %).
El cambio de coloración en el medio de cultivo sin nitrógeno fue notorio a partir del segundo día de iniciado el cultivo, tal como lo menciona Millan y Fernández (2011) quienes observaron un cambio de coloración en el medio de cultivo en los sistemas y un aumento en el tamaño celular en medios con pocos nitratos. Al respecto, la acumulación de carotenoides secundarios es otra característica principal de algunas microalgas cuando son cultivadas en medios con limitación del nitrógeno, el cual va acompañado de una disminución en el contenido de clorofila de las células (Richmond y Hu, 2013). Por lo que, Ben-Amotz et al. (1982) mostraron que el aumento de la producción de β-caroteno se produjo en cultivos de Dunaliella bajo condiciones de limitación de nitrógeno. Además, Zhekisheva et al. (2002) reportaron que bajo condiciones de deficiencia de nitrógeno, Haematococcus pluvialis produjo mayor cantidad de astaxantina. Finalmente, en el presente estudio se empleó el Rojo Nilo para tinción intracelular de las microalgas, permitiéndonos determinar de manera cualitativa la presencia de lípidos en las especies evaluadas sin ningún inconveniente, incluso en Chlorella sp.
Sin embargo, Gonzales y Magallanes (2012) emplearon BODIPY para identificar cualitativamente la producción lipídica en las células de Scenedesmus sp. y en Chlorella sp., resultando un buen indicador para la primera especie, mas no para la siguiente, tal vez porque la pared celular no es permeable, lo cual dificultó el proceso de tinción. Considerando que, las diferentes especies microalgales responden a las condiciones de limitación de nitrógeno mediante la producción de ácidos grasos o alterando la composición de los mismos y que las técnicas para lograr la inducción de lípidos en microalgas dependen de las condiciones ambientales en los sistemas de cultivo controlados, es de suma importancia lograr la combinación exacta de la inducción por estrés a fin de obtener una óptima productividad de lípidos para replicarlo en un sistema de cultivo comercial a gran escala para la producción de biodiesel.
En Perú, la producción de biodiesel depende fundamentalmente del cultivo de grandes extensiones de plantas oleaginosas como la palma aceitera, el piñón blanco y de otras especies (Calvo, 2006; Matthwes y O'Connor, 2006; Arévalo et al., 2009; Maltsoglou et al., 2013). Pero este cambio en el uso de la tierra, por la extensiva deforestación de bosques primarios, pone en riesgo la seguridad alimentaria (Thompson y Meyer, 2013) y la disposición de agua (De Fraiture et al., 2008). Existen estudios donde se ha demostrado que las microalgas son una excelente alternativa para la producción de biocombustibles por varias razones. Primero, por su rápido crecimiento y gran eficiencia fotobiosintética de triglicéridos (Georgianna y Mayfield, 2012; Sharma et al., 2012), que son la materia prima para obtener el biodiesel. Segundo, porque pueden proporcionar productividades mayores de 10 a 100 veces que los cultivos de plantas oleaginosas (Loera y Olguin, 2010). Tercero, debido a que actúan como sumideros de CO2 pueden contribuir a disminuir el calentamiento global (Ho et al., 2011; Kumar et al., 2011; Sahoo et al., 2012). Cuarto, porque demandan menos área que los cultivos de oleaginosas (Smith et al., 2010) y pueden usar aguas servidas para generar biocombustibles como biodiesel, bioetanol y biometanol (Wu et al., 2010; Zhou et al., 2011).
CONCLUSIONES
Se evidenció un mejor crecimiento de las especies microalgales en medios de cultivo con nitrógeno con respecto a aquellas cultivadas en medios sin nitrógeno. Asimismo, las especies Ankistrodesmus sp., A. nannoselene y Scenedesmus sp., fueron las que mejor se adaptaron a las condiciones de cultivo (con y sin nitrógeno) ya que alcanzaron densidades mayores. Además, Ankistrodesmus sp. cultivada en medio con nitrógeno fue la especie que alcanzó mayor densidad microalgal (15,7 x 106 células/ml) con respecto al medio sin nitrógeno. Asimismo, en términos generales la producción de biomasa y el contenido de lípidos totales en las cinco especies de microalgas oleaginosas evaluadas fue variable. Así, en Ankistrodesmus nannoselene, Ankistrodesmus sp. y Scenedesmus sp., cultivadas en medios sin nitrógeno se registró una menor producción de biomasa y un mayor contenido de lípidos totales durante el período de evaluación, observándose un comportamiento diferente en el caso de S. quadricauda y Chlorella sp.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia Tecnología e Innovación Tecnológica (CONCYTEC) por el financiamiento mediante el Contrato Nro. 364 y a la Universidad Científica del Perú (UCP) por el soporte financiero mediante Resolución Rectoral-487-2012-CD-UCP. Un especial agradecimiento al Dr. J. Dylan Maddox por la revisión crítica del Abstract.
REFERENCIAS
Arévalo LF, Nalvarte J, Torres J, Ramírez Y. Impactos socio-económicos de la producción de biocombustibles en la Amazonía Peruana. Primera. Lima, Perú: SNV-WWF; 2009. p. 100.
Arias MT, Cañizares RO. Evaluación de la microalga Scenedesmus incrassatulus como posible fuente de lípidos para la obtención de biodiesel [Internet]. XIV Congreso Nacional de Biotecnología y Bioingeniería, Queretaro, México; 2011. Available from: http://www.smbb.com.mx/congresos%20smbb/queretaro11/TRABAJOS/ trabajos/IX/carteles/CIX-20.pdf.
Barclay W, Jhonsen J, Chelf P, Nagle N, Roessler R. Microalgae culture collection 1986 – 1987 [Internet]. Golden, Colorado: SERI Microalgal Technology Research Group, Solar Energy Research Institute; 1986. Dec. Report No.: SERI/SP–232–3079. UC Category: 61c. Available from: http://www.nrel.gov/docs/legosti/old/3079.pdf.
Ben-Amotz A, Katz A, Avron M. Accumulation of B-carotene in halotolerant algae: Purification and characterization of β-carotene-rich globules from Dunaliella bardawil (Chlorophyceae). J Phycol. 1982;18(4):529-537. Doi: 10.1111/j.1529-8817.1982.tb03219.x.
Bigogno C, Khozin-Goldberg I, Cohen Z. Accumulation of arachidonic acid-rich triacylglycerols in the microalga Parietochloris incise (trebuxiophyceae, chlorophyta). Phytochemistry. 2002;60(2):153-143.
Canedo-López Y, Campos-Garcia SC, Cerón-Bretón JG, Cordova-Quiroz AV, Elvira-Antonio N, García-Zarracino R, et al. Densidad celular y acumulación de lípidos en cultivos libres de Chlorella vulgaris y Neochloris oleoabundans a diferentes concentraciones de nitrógeno y carbonato de sodio. U Tecnociencia. 2011;5(1):56-71.
Calvo BE. Biocombustibles de plantas para producción de biodiesel. Rev Soc Quím Perú. 2006;72(1):44-48.
Cobos M, Castro JC, Cerdeira LA. Potencial biotecnológico para la producción sustentable de biodiesel de microalgas oleaginosas aisladas del Río Itaya, Loreto, Perú. Ecol Apl. 2014;13(2):169-175.
Cobos M, Castro J, Del Águila J, Soplín H. Identificación de microalgas oleaginosas en el área de concesión para conservación cuenca alta del Río Itaya, Loreto-Perú. Rev Cien Amaz (Iquitos). 2012;2(2):162-168.
Courchesne M, Parisien A, Wang B, Lan Q. Enhancement of lipid production using biochemical, genetic and transcription factor engineering approaches. J Biotechnol. 2009;141(1-2):31-41. Doi: 10.1016/j.jbiotec.2009.02.018.
De Fraiture C, Giordano M, Liao Y. Biofuels and implications for agricultural water use: blue impacts of green energy. Water Policy. 2008;10(Supplement 1):67-81. Doi: 10.2166/wp.2008.054.
Duong VT, Li y, Nowak E, Schenk M. Microalgae isolation and selection for prospective biodiesel production. Energies. 2012;5:1835-1849. Doi: 10.3390/en5061835.
Garibay A, Vásquez R, Sánchez M, Serrano L, Martínez A. Biodiesel a partir de Microalgas. Biotec. 2009;13(3):38-61.
Georgianna DR, Mayfield SP. Exploiting diversity and synthetic biology for the production of algal biofuels. Nature. 2012;488(7411):329-335. Doi:10.1038/nature11479.
Gonzales A, Magallanes J. Efecto del estrés nutritivo (Nitrógeno y Fierro) sobre la producción de lípidos en tres cepas de microalgas clorófitas. México D.F.: 1er Encuentro de Jóvenes Investigadores-CONACYT; 2012. p- 23-25.
Guschina IA, Harwood JL. Lipids and lipid metabolism algae. Prog Lipid Res. 2006;45:160-186.
Greenspan P, Mayer EP, Fowler SD. Nile red: a selective fluorescent stain for intracellular lipid droplets. J Cell Biol. 1985;100(3):965-973.
Guiry MD, Guiry GM. AlgaeBase [Internet]. Galway: World-wide electronic publication, National University of Ireland; c 1996-2015 [cited 2015 Apr 29]. Available from: http://www.algaebase.org.
Ho SH, Chen CH, Lee DJ, Chang JS. Perspectives on microalgal CO2-emission mitigation systems -A review. Biotech Adv. 2011;29(2):189-198. Doi:10.1016/j.biotechadv.2010.11.001.
Huntley ME, Redalje DG. CO2 mitigation and renewable oil from photosynthetic microbes: a new appraisal. Mitig Adapt Strategies Glob Chang. 2007;12(4):573-608. Doi: 10.1007/s11027-006-7304-1.
Khozin-Goldberg I, Cohen Z. The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyte Monodus subterraneus. Phytochemistry. 2006;67(7):696-701. Doi:10.1016/j.phytochem.2006.01.010.
Kumar K, Dasgupta CN, Nayak B, Lindblad P, Das D. Development of suitable photobioreactors for CO2 sequestration addressing global warming using green algae and cyanobacteria. Bioresour Technol. 2011;102(8):4945-4953. Doi:10.1016/j.biortech.2011.01.054.
Lee AK, Lewis DM, Ashman P. Microbial flocculation, a potentially lowcost harvesting technique for marine microalgae for the production of biodiesel. J Appl Phycol. 2009;21(5):559-567. Doi:10.1007/s10811-008-9391-8.
Li Y, Horsman M, Wu N, Lan C, Dubois N. Articles: Biocatalysts and Bioreactor Design, Biofuels from Microalgae. Biotechnol Prog. 2008;24(4):815-820. Doi:10.1021/bp.070371k.
Loera M, Olguín E. Las Microalgas oleaginosas como fuente de biodiesel: retos y oportunidades. Rev. Latinoam Biotecnol Amb Algal. 2010;1(1):91-116.
López R. Caracterización fitoplanctónica física y química de la Cocha Llanchama en los períodos hidrológicos de creciente y media vaciante Loreto Perú (Tesis de pregrado). Perú: Facultad de Ciencias Biológicas, Universidad Nacional de la Amazonia Peruana; 2009. p. 56-86.
Matthwes WG, O'Connor D. Analizar la aplicabilidad de los biocombustibles en el Perú [Internet]. In: Peru Hydrocarbon Assistance Project. Dirección General de Hidrocarburos; 2006 feb. WBS Activity No. 142. Available from: http://minagri.gob.pe/portal/download/pdf/especiales/bioenergia/Biodiesel/Documentos_principales/MEM_DGH_-_Matthews_n_Connor_-_Aplicabilidad_biocombustibles_Peru.pdf.
Maltsoglou I, Koizumi T, Felix E. The status of bioenergy development in developing countries. Glob Food Secur. 2013;2(2):104-109. Doi: 0.1016/j.gfs.2013.04.002.
Millan A, Fernández L. Efecto de la limitación de nitrógeno en la producción de lípidos en Neochloris oleoabundans y Scenedesmus sp [Internet]. México: Unidad Profesional Interdisciplinaria de Biotecnología –IPN, Resúmen presentado en Muestra de Proyectos Ambientales.; 2011. Available from: http://www.informatica.sip.ipn.mx/ColMex/Congresos/ixtapa/AutoPlay/Docs/TRABAJOS/AGROPECUARIA%20Y%20DESARROLLO%20SUSTENTABLE/ADS57AAR20120102.pdf
Radakovits R, Jinkerson RE, Fuerstenberg SI, Tae H, Settlage RE, Boore JL, et al. Draft genome sequence and genetic transformation of the oleaginous alga Nannochloropsis gaditana. Nat Commun. 2012;3:686. Doi: 10.1038/ncomms1688.
Richmond A. Handbook of microalgal culture: Biotechnology and Applied Phycology. 2 ed. NJ, USA: Editorial Wiley-Blackwell Ltd; 2004. p. 85-98.
Richmond A, Hu Q. Handbook of Microalgae Culture Applied Phycology and Biotechnology. 2 ed. USA: Editorial Wiley-Blackwell; 2013. p. 116-117.
Rioboo C, Herrera C, Gonzales A. Análisis del crecimiento de Chlorella vulgaris en cultivos expuestos al herbicida isoproturon [Internet]. La Coruña: IX Conferencia Española de Biometría; 2003. p. 1-4. Available from: http://www.udc.gal/dep/mate/biometria2003/Archivos/ma47.pdf.
Rodolfi L, Zitelli C, Bassi N, Padovani G, Biondi N, Bonini G, et al. Microalgae for oil: Strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor. Biotechnol Bioeng. 2009;102(1):100-112. Doi:10.1002/bit.22033.
Rosenberg JN, Oyler GA, Wilkinson L, Betenbaugh MJ. A green light for engineered algae: redirecting metabolism to fuel a biotechnology revolution. Biotechnology. 2008;19(5):430-436. Doi:10.1016/j.copbio.2008.07.008.
Ruiz M, Mendoza E, Stephenson TG. Growth and nutrient removal in free and immobilized green algae in batch and semi-continuos cultures treating real wastewater. Bioresource Tech. 2010;101(1):58-64. Doi:10.1016/j.biortech.2009.02.076.
Sánchez R. Estudio del fitoplancton en la Cuenca del Bajo Marañón y algunos tributarios menores (Departamento de Loreto) en los Períodos de vaciante y creciente (Tesis de pregrado). Perú: Facultad de Ciencias Biológicas, Universidad Nacional de la Amazonia Peruana; 1991. p. 75-95.
Sahoo D, Elangbam G, Devi S. Using algae for carbon dioxide capture and biofuel production to combat climate change. Phykos. 2012;42(1):32-38.
Sato N, Hagio M, Wada H, Tsuzuki AM. Environmental effects on acidic lipids of thylakoid membranes. Biochem Soc Trans. 2000;28(6):912-914. Doi:10.1042/0300-5127:0280912
Sharma K, Schuhmann H, Schenk P. High lipid induction in microalgae for biodiesel production. Energies. 2012;5(5):1532-1553. Doi:10.3390/en5051532.
Sheehan J, Dunahay T, Benemann J, Roessler P. A look back to the US Department of Energy's Aquatic Species Program – Biodiesel from Algae [Internet]. Golden, Colorado: The National Renewable Energy Laboratory, U.S. Department of Energy; 1998 Jul. Report No.: NREL/TP-580-24190. Contract No. DE-AC36-83CH10093. p. 328. Available from: http://www.freestateprojects.org/files/biodiesel+algae/Biodiesel%20from%20algae%20-%20USDOD%20report.pdf.
Shen Y, Yuan W, Pei Z, Mao E. Heterotrophic culture of Chlorella protothecoides in various nitrogen sources for lipid production. Appl Biochem Biotechnol. 2010;160(6):1674-1684. Doi:10.1007/s12010-009-8659-z.
Sims R, Christenson L. Production and harvesting of microalgae for wastewater treatment, biofuels and subproducts. Biotechnol Adv. 2011;29(6):686-702. Doi:10.1016/j.biotechadv.2011.05.015.
Smith VH, Sturm BSM, Denoyelles FJ, Billings SA. The ecology of algal biodiesel production. Trends Ecol Evol. 2010;25(5):301-309. Doi:10.1016/j.tree.2009.11.007.
Stephens E, Ross I, Mussgnug JH, Wagner LD, Borowitzka MA, Posten C, et al. Future prospects of microalgal biofuel production systems. Trends in Plant Science. 2010;15(10):554-564. Doi:10.1016/j.tplants.2010.06.003.
Thompson GA. Lipids and membrane function in green algae. Biochem Biophys. 1996; 1302(1):17-45. Doi:10.1016/0005-2760(96)00045-8.
Thompson W, Meyer S. Second generation biofuels and food crops: Co-products or competitors? Glob Food Secur. 2013;2(2):89-96. Doi:10.1016/j.gfs.2013.03.001.
Vela LE. Variación Cualitativa y Cuantitativa de Plancton de Cuatro Estanques Seminaturales de la Piscigranja Quistococha (Tesis de pregrado). Perú: Facultad de Ciencias Biológicas, Universidad Nacional de la Amazonia Peruana; 1984. p. 84-123.
Widjaja A, Chien C. Study of increasing lipid production from fresh water microalgae Chlorella vulgaris. J Taiwan Inst Chem Eng. 2009;40(1):13-20. Doi:10.1016/j.jtice.2008.07.007.
Wu LF, Chen P, Huang AP, Lee CHM. The feasibility of biodiesel production by microalgaeusing industrial wastewater. Bioresour Technol. 2010;113:14-18. Doi:10.1016/j.biortech.2011.12.128.
Yu X, Zhao P, He C, Li C, Zhou J, Huang Z. Isolation of a novel strain of Monoraphidium sp. and characterization of its potential application as biodiesel feedstock. Bioresour Technol. 2012;121:256-262. Doi:10.1016/j.biortech.2012.07.002.
Zhekisheva M, Boussiba S, Khozin I, Zarka A, Cohen Z. Accumulation of oleic acid in Haematococcus pluvialis (Chlorophyceae) under nitrogen starvation or high is correlated with that of astaxanthin esters. J Phycol. 2002;38(2):325-331. Doi:10.1046/j.1529-8817.2002.01107.x.
Zhou W, Li Y, Min M, Hu B, Chen P, Ruan R. Local bioprospecting for high-lipid producing microalgal strains to be grown on concentrated municipal wastewater for biofuel production. Bioresour Technol. 2011;102(13):6909-6919. Doi:10.1016/j.biortech.2011.04.038.
Referencias
Arévalo LF, Nalvarte J, Torres J, Ramírez Y. Impactos socio-económicos de la producción de biocombustibles en la Amazonía Peruana. Primera. Lima, Perú: SNV-WWF; 2009. p. 100.
Arias MT, Cañizares RO. Evaluación de la microalga Scenedesmus incrassatulus como posible fuente de lípidos para la obtención de biodiesel [Internet]. XIV Congreso Nacional de Biotecnología y Bioingeniería, Queretaro, México; 2011. Available from: http://www.smbb.com.mx/congresos%20smbb/queretaro11/TRABAJOS/ trabajos/IX/carteles/CIX-20.pdf.
Barclay W, Jhonsen J, Chelf P, Nagle N, Roessler R. Microalgae culture collection 1986 – 1987 [Internet]. Golden, Colorado: SERI Microalgal Technology Research Group, Solar Energy Research Institute; 1986. Dec. Report No.: SERI/SP–232–3079. UC Category: 61c. Available from: http://www.nrel.gov/docs/legosti/old/3079.pdf.
Ben-Amotz A, Katz A, Avron M. Accumulation of B-carotene in halotolerant algae: Purification and characterization of β-carotene-rich globules from Dunaliella bardawil (Chlorophyceae). J Phycol. 1982;18(4):529-537. Doi: 10.1111/j.1529-8817.1982.tb03219.x.
Bigogno C, Khozin-Goldberg I, Cohen Z. Accumulation of arachidonic acid-rich triacylglycerols in the microalga Parietochloris incise (trebuxiophyceae, chlorophyta). Phytochemistry. 2002;60(2):153-143.
Canedo-López Y, Campos-Garcia SC, Cerón-Bretón JG, Cordova-Quiroz AV, Elvira-Antonio N, García-Zarracino R, et al. Densidad celular y acumulación de lípidos en cultivos libres de Chlorella vulgaris y Neochloris oleoabundans a diferentes concentraciones de nitrógeno y carbonato de sodio. U Tecnociencia. 2011;5(1):56-71.
Calvo BE. Biocombustibles de plantas para producción de biodiesel. Rev Soc Quím Perú. 2006;72(1):44-48.
Cobos M, Castro JC, Cerdeira LA. Potencial biotecnológico para la producción sustentable de biodiesel de microalgas oleaginosas aisladas del Río Itaya, Loreto, Perú. Ecol Apl. 2014;13(2):169-175.
Cobos M, Castro J, Del Águila J, Soplín H. Identificación de microalgas oleaginosas en el área de concesión para conservación cuenca alta del Río Itaya, Loreto-Perú. Rev Cien Amaz (Iquitos). 2012;2(2):162-168.
Courchesne M, Parisien A, Wang B, Lan Q. Enhancement of lipid production using biochemical, genetic and transcription factor engineering approaches. J Biotechnol. 2009;141(1-2):31-41. Doi: 10.1016/j.jbiotec.2009.02.018.
De Fraiture C, Giordano M, Liao Y. Biofuels and implications for agricultural water use: blue impacts of green energy. Water Policy. 2008;10(Supplement 1):67-81. Doi: 10.2166/wp.2008.054.
Duong VT, Li y, Nowak E, Schenk M. Microalgae isolation and selection for prospective biodiesel production. Energies.2012;5:1835-1849. Doi: 10.3390/en5061835.
Garibay A, Vásquez R, Sánchez M, Serrano L, Martínez A. Biodiesel a partir de Microalgas. Biotec. 2009;13(3):38-61.
Georgianna DR, Mayfield SP. Exploiting diversity and synthetic biology for the production of algal biofuels. Nature. 2012;488(7411):329-335. Doi:10.1038/nature11479.
Gonzales A, Magallanes J. Efecto del estrés nutritivo (Nitrógeno y Fierro) sobre la producción de lípidos en tres cepas de microalgas clorófitas. México D.F.: 1er Encuentro de Jóvenes Investigadores-CONACYT; 2012. p- 23-25.
Guschina IA, Harwood JL. Lipids and lipid metabolism algae. Prog Lipid Res. 2006;45:160-186.
Greenspan P, Mayer EP, Fowler SD. Nile red: a selective fluorescent stain for intracellular lipid droplets. J Cell Biol. 1985;100(3):965-973.
Guiry MD, Guiry GM. AlgaeBase [Internet]. Galway: World-wide electronic publication, National University of Ireland; c 1996-2015 [cited 2015 Apr 29]. Available from: http://www.algaebase.org.
Ho SH, Chen CH, Lee DJ, Chang JS. Perspectives on microalgal CO2-emission mitigation systems -A review. Biotech Adv. 2011;29(2):189-198. Doi:10.1016/j.biotechadv.2010.11.001.
Huntley ME, Redalje DG. CO2 mitigation and renewable oil from photosynthetic microbes: a new appraisal. Mitig Adapt Strategies Glob Chang. 2007;12(4):573-608. Doi: 10.1007/s11027-006-7304-1.
Khozin-Goldberg I, Cohen Z. The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyte Monodus subterraneus. Phytochemistry. 2006;67(7):696-701. Doi:10.1016/j.phytochem.2006.01.010.
Kumar K, Dasgupta CN, Nayak B, Lindblad P, Das D. Development of suitable photobioreactors for CO2 sequestration addressing global warming using green algae and cyanobacteria. Bioresour Technol. 2011;102(8):4945-4953. Doi:10.1016/j.biortech.2011.01.054.
Lee AK, Lewis DM, Ashman P. Microbial flocculation, a potentially lowcost harvesting technique for marine microalgae for the production of biodiesel. J Appl Phycol. 2009;21(5):559-567. Doi:10.1007/s10811-008-9391-8.
Li Y, Horsman M, Wu N, Lan C, Dubois N. Articles: Biocatalysts and Bioreactor Design, Biofuels from Microalgae. Biotechnol Prog. 2008;24(4):815-820. Doi:10.1021/bp.070371k.
Loera M, Olguín E. Las Microalgas oleaginosas como fuente de biodiesel: retos y oportunidades. Rev. Latinoam Biotecnol Amb Algal. 2010;1(1):91-116.
López R. Caracterización fitoplanctónica física y química de la Cocha Llanchama en los períodos hidrológicos de creciente y media vaciante Loreto Perú (Tesis de pregrado). Perú: Facultad de Ciencias Biológicas, Universidad Nacional de la Amazonia Peruana; 2009. p. 56-86.
Matthwes WG, O'Connor D. Analizar la aplicabilidad de los biocombustibles en el Perú [Internet]. In: Peru Hydrocarbon Assistance Project. Dirección General de Hidrocarburos; 2006 feb. WBS Activity No. 142. Available from: http://minagri.gob.pe/portal/download/pdf/especiales/bioenergia/Biodiesel/Documentos_principales/MEM_DGH_-_Matthews_n_Connor_-_Aplicabilidad_biocombustibles_Peru.pdf.
Maltsoglou I, Koizumi T, Felix E. The status of bioenergy development in developing countries. Glob Food Secur. 2013;2(2):104-109. Doi: 0.1016/j.gfs.2013.04.002.
Millan A, Fernández L. Efecto de la limitación de nitrógeno en la producción de lípidos en Neochloris oleoabundans yScenedesmus sp [Internet]. México: Unidad Profesional Interdisciplinaria de Biotecnología –IPN, Resúmen presentado en Muestra de Proyectos Ambientales.; 2011. Available from: http://www.informatica.sip.ipn.mx/ColMex/Congresos/ixtapa/AutoPlay/Docs/TRABAJOS/AGROPECUARIA%20Y%20DESARROLLO%20SUSTENTABLE/ADS57AAR20120102.pdf
Radakovits R, Jinkerson RE, Fuerstenberg SI, Tae H, Settlage RE, Boore JL, et al. Draft genome sequence and genetic transformation of the oleaginous alga Nannochloropsis gaditana. Nat Commun. 2012;3:686. Doi: 10.1038/ncomms1688.
Richmond A. Handbook of microalgal culture: Biotechnology and Applied Phycology. 2 ed. NJ, USA: Editorial Wiley-Blackwell Ltd; 2004. p. 85-98.
Richmond A, Hu Q. Handbook of Microalgae Culture Applied Phycology and Biotechnology. 2 ed. USA: Editorial Wiley-Blackwell; 2013. p. 116-117.
Rioboo C, Herrera C, Gonzales A. Análisis del crecimiento de Chlorella vulgaris en cultivos expuestos al herbicida isoproturon [Internet]. La Coruña: IX Conferencia Española de Biometría; 2003. p. 1-4. Available from: http://www.udc.gal/dep/mate/biometria2003/Archivos/ma47.pdf.
Rodolfi L, Zitelli C, Bassi N, Padovani G, Biondi N, Bonini G, et al. Microalgae for oil: Strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor. Biotechnol Bioeng. 2009;102(1):100-112. Doi:10.1002/bit.22033.
Rosenberg JN, Oyler GA, Wilkinson L, Betenbaugh MJ. A green light for engineered algae: redirecting metabolism to fuel a biotechnology revolution. Biotechnology. 2008;19(5):430-436. Doi:10.1016/j.copbio.2008.07.008.
Ruiz M, Mendoza E, Stephenson TG. Growth and nutrient removal in free and immobilized green algae in batch and semi-continuos cultures treating real wastewater. Bioresource Tech. 2010;101(1):58-64. Doi:10.1016/j.biortech.2009.02.076.
Sánchez R. Estudio del fitoplancton en la Cuenca del Bajo Marañón y algunos tributarios menores (Departamento de Loreto) en los Períodos de vaciante y creciente (Tesis de pregrado). Perú: Facultad de Ciencias Biológicas, Universidad Nacional de la Amazonia Peruana; 1991. p. 75-95.
Sahoo D, Elangbam G, Devi S. Using algae for carbon dioxide capture and biofuel production to combat climate change. Phykos. 2012;42(1):32-38.
Sato N, Hagio M, Wada H, Tsuzuki AM. Environmental effects on acidic lipids of thylakoid membranes. Biochem Soc Trans. 2000;28(6):912-914. Doi:10.1042/0300-5127:0280912
Sharma K, Schuhmann H, Schenk P. High lipid induction in microalgae for biodiesel production. Energies. 2012;5(5):1532-1553. Doi:10.3390/en5051532.
Sheehan J, Dunahay T, Benemann J, Roessler P. A look back to the US Department of Energy's Aquatic Species Program – Biodiesel from Algae [Internet]. Golden, Colorado: The National Renewable Energy Laboratory, U.S. Department of Energy; 1998 Jul. Report No.: NREL/TP-580-24190. Contract No. DE-AC36-83CH10093. p. 328. Available from: http://www.freestateprojects.org/files/biodiesel+algae/Biodiesel%20from%20algae%20-%20USDOD%20report.pdf.
Shen Y, Yuan W, Pei Z, Mao E. Heterotrophic culture of Chlorella protothecoides in various nitrogen sources for lipid production. Appl Biochem Biotechnol. 2010;160(6):1674-1684. Doi:10.1007/s12010-009-8659-z.
Sims R, Christenson L. Production and harvesting of microalgae for wastewater treatment, biofuels and subproducts. Biotechnol Adv. 2011;29(6):686-702. Doi:10.1016/j.biotechadv.2011.05.015.
Smith VH, Sturm BSM, Denoyelles FJ, Billings SA. The ecology of algal biodiesel production. Trends Ecol Evol. 2010;25(5):301-309. Doi:10.1016/j.tree.2009.11.007.
Stephens E, Ross I, Mussgnug JH, Wagner LD, Borowitzka MA, Posten C, et al. Future prospects of microalgal biofuel production systems. Trends in Plant Science. 2010;15(10):554-564. Doi:10.1016/j.tplants.2010.06.003.
Thompson GA. Lipids and membrane function in green algae. Biochem Biophys. 1996; 1302(1):17-45. Doi:10.1016/0005-2760(96)00045-8.
Thompson W, Meyer S. Second generation biofuels and food crops: Co-products or competitors? Glob Food Secur. 2013;2(2):89-96. Doi:10.1016/j.gfs.2013.03.001.
Vela LE. Variación Cualitativa y Cuantitativa de Plancton de Cuatro Estanques Seminaturales de la Piscigranja Quistococha (Tesis de pregrado). Perú: Facultad de Ciencias Biológicas, Universidad Nacional de la Amazonia Peruana; 1984. p. 84-123.
Widjaja A, Chien C. Study of increasing lipid production from fresh water microalgae Chlorella vulgaris. J Taiwan Inst Chem Eng. 2009;40(1):13-20. Doi:10.1016/j.jtice.2008.07.007.
Wu LF, Chen P, Huang AP, Lee CHM. The feasibility of biodiesel production by microalgaeusing industrial wastewater. Bioresour Technol. 2010;113:14-18. Doi:10.1016/j.biortech.2011.12.128.
Yu X, Zhao P, He C, Li C, Zhou J, Huang Z. Isolation of a novel strain of Monoraphidium sp. and characterization of its potential application as biodiesel feedstock. Bioresour Technol. 2012;121:256-262. Doi:10.1016/j.biortech.2012.07.002.
Zhekisheva M, Boussiba S, Khozin I, Zarka A, Cohen Z. Accumulation of oleic acid in Haematococcus pluvialis(Chlorophyceae) under nitrogen starvation or high is correlated with that of astaxanthin esters. J Phycol. 2002;38(2):325-331. Doi:10.1046/j.1529-8817.2002.01107.x.
Zhou W, Li Y, Min M, Hu B, Chen P, Ruan R. Local bioprospecting for high-lipid producing microalgal strains to be grown on concentrated municipal wastewater for biofuel production. Bioresour Technol. 2011;102(13):6909-6919. Doi:10.1016/j.biortech.2011.04.038.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Marianela Cobos, Juan C. Castro, Jae D. Paredes, Sheyla Pérez, J. Dylan Maddox, Segundo L. Estela, Hicler N. Rodríguez, Alvaro B. Tresierra, Juan R. Saldaña, Jorge L. Marapara, Pedro M. Adrianzén, Rosana Gonzales. (2020). Microalgae - From Physiology to Application. https://doi.org/10.5772/intechopen.89515.
2. Sheila Genoveva Pérez-Bravo, Ana María Mendoza-Martínez, Maria del Refugio Castañeda-Chávez, Luciano Aguilera-Vázquez. (2019). Bioenergía a partir de microalgas en México. Revista de Energías Renovables, , p.23. https://doi.org/10.35429/JRE.2019.8.3.23.34.
3. Harold DJ Oviedo-Montiel, Edwin E. Herrera-Cruz, Jenny K. Hoya-Florez, Martha J Prieto-Guevara, Ana L. Estrada-Posada, Jonny A. Yepes-Blandón. (2019). Crecimiento poblacional de Macrothrix spinosa alimentada con Chlorella sp.. Orinoquia, 23(2) https://doi.org/10.22579/20112629.571.
4. N. Dani, D. Zare, M. M. Assadi, S. Irani, N. Soltani. (2021). Isolation, screening and medium optimization of native microalgae for lipid production using nutritional starvation strategy and statistical design. International Journal of Environmental Science and Technology, 18(10), p.2997. https://doi.org/10.1007/s13762-020-03037-9.
5. Harold Oviedo-Montiel, Edwin Herrera-Cruz, Jenny Hoya-Florez, Martha Prieto-Guevara, Ana Estrada-Posada, Jonny Andrés Yepes Blandón. (2020). Crecimiento y viabilidad celular de microalgas: efecto del medio de cultivo. Intropica, 15(2), p.126. https://doi.org/10.21676/23897864.3633.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2016 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).