Niveles sanguíneos de biomarcadores de daño genético en eritrocitos de Lepidochelys olivacea (Cheloniidae) en Colombia.
Genotoxic Biomarkers in Erythrocytes of Lepidochelys olivacea (Cheloniidae) from Colombia
DOI:
https://doi.org/10.15446/abc.v22n3.58688Palabras clave:
biomonitoreo, ecotoxicología, genotoxicidad, micronúcleos, tortuga golfina. (es)biomonitoring, ecotoxicology, genotoxicity, micronucleus, olive ridley sea turtle. (en)
Descargas
Esta investigación se realizó en el municipio de Bahía Solano, Colombia y tuvo como objetivos: 1) detectar la circulación de eritrocitos con lesiones nucleares en 55 hembras adultas de tortuga golfina (Lepidochelys olivacea), empleando la inmunotinción de naranja de acridina y 2) correlacionar sus frecuencias con aspectos biométricos y fisiológicos. Se determinó una frecuencia de eritrocitos con micronúcleos (EMN) de 0,6 ± 0,6 y de protuberancias nucleares (EPN) de 2,1 ± 1,9. Mediante un análisis multivariado a través de la correlación de Pearson y de Kruskal-Wallis (p<0,05), no se encontró ninguna correlación positiva entre el nivel de frecuencia de EPN ni de EMN con los parámetros biométricos y fisiológicos evaluados. Se estableció una diferencia estadísticamente significativa (p= 0,035) entre las frecuencias de EPN y de EMN. Los resultados hallados indican que esta especie presenta eritrocitos circulantes con los daños nucleares mencionados y reporta por primera vez la presencia de estrés genotóxico para la especie en Colombia. Así mismo, brinda información clave para investigaciones posteriores en el área de la ecotoxicología de especies marinas amenazadas.
This research was conducted in the municipality of Bahia Solano, Colombia, and had as a goal to detect damage erythrocytes circulating with nuclear lesions in fifty-five Olive Ridley adult females using acridine orange immunostain, and correlate its frequencies with some physiological and biometric parameters. We determine a micronucleated erythrocytes (MNE) frequency of 0.6 ± 0.6 and nuclear buds (NBE) of 2.1 ± 1.9. We not found any relationship between the nuclear lesions with physiological or biometric parameters evaluated (Pearson and Kruskal-Wallis, p<0.05). We define a significative statistical difference (p=0.035) between both nuclear lesions frequencies. This results show nuclear damages in erythrocytes of Olive Ridley sea turtle for the first time in Colombia as an outcome of genotoxic stress. Also contributes key information for future research in the ecotoxicology area for endangered marine species.
Recibido: 28 de junio de 2016; Revisión recibida: 17 de noviembre de 2016; Aceptado: 1 de agosto de 2017
RESUMEN
Esta investigación se realizó en el municipio de Bahía Solano, Colombia y tuvo como objetivos: 1) detectar la circulación de eritrocitos con lesiones nucleares en 55 hembras adultas de tortuga golfina (Lepidochelys olivácea), empleando la inmunotinción de naranja de acridina y 2) correlacionar sus frecuencias con aspectos biométricos y fisiológicos. Se determinó una frecuencia de eritrocitos con micronúcleos (EMN) de 0,6 ± 0,6 y de protuberancias nucleares (EPN) de 2,1 ± 1,9. Mediante un análisis multivariado a través de la correlación de Pearson y de Kruskal-Wallis (p<0,05), no se encontró ninguna correlación positiva entre el nivel de frecuencia de EPN ni de EMN con los parámetros biométricos y fisiológicos evaluados. Se estableció una diferencia estadísticamente significativa (p= 0,035) entre las frecuencias de EPN y de EMN. Los resultados hallados indican que esta especie presenta eritrocitos circulantes con los daños nucleares mencionados y reporta por primera vez la presencia de estrés genotóxico para la especie en Colombia. Así mismo, brinda información clave para investigaciones posteriores en el área de la ecotoxicología de especies marinas amenazadas.
Palabras clave:
biomonitoreo, ecotoxicología, genotoxicidad, micronúcleos, tortuga golfina.ABSTRACT
This research was conducted in the municipality of Bahia Solano, Colombia, and had as a goal to detect damage erythrocytes circulating with nuclear lesions in fifty-five Olive Ridley adult females using acridine orange immunostain, and correlate its frequencies with some physiological and biometric parameters. We determine a micronucleated erythrocytes (MNE) frequency of 0.6 ± 0.6 and nuclear buds (NBE) of 2.1 ± 1.9. We not found any relationship between the nuclear lesions with physiological or biometric parameters evaluated (Pearson and Kruskal-Wallis, p<0.05). We define a significative statistical difference (p=0.035) between both nuclear lesions frequencies. This results show nuclear damages in erythrocytes of Olive Ridley sea turtle for the first time in Colombia as an outcome of genotoxic stress. Also contributes key information for future research in the ecotoxicology area for endangered marine species.
Keywords:
biomonitoring, ecotoxicology, genotoxicity, micronucleus, olive, ridley sea turtle.INTRODUCCIÓN
La contaminación de los mares y de los ecosistemas costeros es una de las amenazas más importantes para las tortugas marinas, influenciando negativamente a sus poblaciones (Sakai et al., 2000; Maffucci et al., 2005). Existe una preocupación creciente sobre los posibles efectos nocivos que tienen los contaminantes persistentes sobre la fauna de estos ecosistemas, principalmente en especies marinas de vida longeva como mamíferos, algunas aves y tortugas, por la gran capacidad de acumular y biomagnificar algunos elementos como metales pesados y pesticidas organoclorados (Anan et al., 2001; Gauthier et al., 2003).
Con excepción de algunas especies, las investigaciones ecotoxicológicas en reptiles son escasas (Hopkins, 2000). En el caso de las tortugas marinas, la información es aún muy limitada (Storelli y Marcotrigiano, 2003; Maffucci et al., 2005), aun cuando se ha determinado que los reptiles son buenos bioindicadores de contaminación química debido a su amplia distribución ecológica, longevidad y fidelidad a los sitios en donde viven (Bishop et al., 1995; Crain y Guillette, 1998; Clark et al., 2000; Golet y Haines, 2001).
Actualmente, la declinación de las poblaciones de las diferentes especies de tortugas marinas como resultado de la contaminación química y de otros factores de origen antrópico (p. e. pesquerías, destrucción de puestas y cambio climático), ha sido estudiada con el fin de desarrollar planes de conservación realistas y eficaces (Hopkins, 2000). Siendo el océano el destino final de numerosas sustancias químicas persistentes transportadas por los ríos desde el interior de los continentes, se ha recalcado la necesidad de dilucidar las diferentes asociaciones existentes entre dichos elementos y los organismos vivos con los que interactúan (Hopkins, 2000). Muchas de estas sustancias son potenciales moléculas mutagénicas y disruptores endocrinos que tienen la capacidad de bioacumularse y biomagnificarse a través de las redes tróficas (Crain y Guillette, 1998; Irwin e Irwin, 2005). Recientemente, la presencia de microplásticos en los ecosistemas marinos está recibiendo un intenso debate sobre los posibles daños a la fauna marina (Ivar do Sul y Costa, 2014). En este sentido, las tortugas marinas, por su posición trófica, conducta migratoria y amplia distribución, deben ser organismos diana de estos microplásticos.
Existen numerosas herramientas metodológicas para evaluar el impacto de la contaminación química sobre los organismos silvestres. Entre ellas, el uso de biomarcadores de daño genético brindan una oportunidad única de evaluar la exposición de los organismos a contaminantes genotóxicos así como condiciones de estrés oxidativo, máxime cuando tal evaluación puede obtenerse por métodos no letales (Serrano y Montero, 2001). Hasta el momento, los autores solo conocen de dos investigaciones sobre el uso de la técnica de micronúcleos en tortugas marinas para establecer su relación con genotoxicidad (Borrat et al., 2011; Borrat et al., 2013).
Dentro de los ensayos citogenéticos, el estudio cuantitativo de los micronúcleos y de las protuberancias nucleares son dos biomarcadores genotóxicos que nos aportan varias ventajas a considerar como son la velocidad, simplicidad y bajo coste del análisis, así como el no requerimiento de células en metafase, lo cual facilita su cuantificación en diferentes tipos de células, especialmente aquellas del sistema hematopoyético (linfocitos y eritrocitos periféricos) debido a su gran disponibilidad orgánica en cualquier momento (Tucker y Preston, 1996; Gómez et al., 2006).
En la actualidad existe un creciente interés en los estudios ecotoxicológicos con reptiles debido a que sus características fisiológicas y ecológicas los hace buenos candidatos como especies biomonitoras del estado de contaminación del ambiente (Novillo et al., 2005). En el caso de las tortugas marinas, se han realizado mediciones tisulares de varios contaminantes químicos pero poco se ha investigado sobre su respuesta celular a través de pruebas citogenéticas que identifican lesiones nucleares como respuesta a sustancias genotóxicas (estrés genotóxico).
Considerando que Lepidochelysolivacea (Eschscholtz, 1829) es una especie vulnerable según la Unión Internacional para la Conservación de la Naturaleza (Abreu y Plotkin 2008; UICN, 2013), y a la falta de información sobre biomarcadores genotóxicos que puedan ser utilizado en este quelónido de forma no letal, nos propusimos en este estudio determinar los niveles circulantes de dos anormalidades nucleares en los eritrocitos (micronúcleos y protuberancias nucleares) de ejemplares de L. olivacea capturados en la costa pacífica de Colombia, así como indagar sobre el impacto de variables biológicas en estos dos biomarcadores genotóxicos.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se realizó en el Pacífico colombiano, en el departamento de Chocó, municipio de Bahía Solano, en una playa de anidación de L. olivacea denominada La Cuevita (06° 04' N, y 77° 20' W). Esta área costera representa uno de los sitios más importantes para esta especie en el país (Amorocho et al., 1992; Martínez y Páez, 2000), con una temperatura anual promedio de 25°C (mín. 21°C y máx. 31°C), una humedad relativa entre el 80 % y el 100 % y una pluviosidad promedio de 7.000 mm/año (Amorocho, 1993). Para su ejecución se siguieron los lineamientos de la ley 84 de 1989 de protección animal y se contó con el aval del Comité de Ética de Experimentación Animal de la Universidad de Antioquia (CEEA) como consta en el acta No 52 de 2009.
Recolección de los datos biométricos y de las muestras
Las muestras de sangre se colectaron a 55 hembras adultas por punción en el seno venoso dorsal del cuello ubicado a ambos lados, de 1 a 3 cm de la línea media en la mitad del recorrido entre la parte posterior de la cabeza y la anterior del caparazón, utilizando aguja de Vacutainer® calibre 21 de una pulgada en tubos capilares estériles de 5 cm con heparina sódica. Se optó por este anticoagulante puesto que el EDTA provoca hemólisis en la sangre de las tortugas marinas (Owens, 2000).
La toma de muestras de sangre y parámetros biométricos se realizó una vez las hembras terminaron el proceso de desove completamente, evitando interferir con el mismo. Las muestras fueron almacenadas y transportadas hasta el laboratorio para su procesamiento.
A cada individuo se le tomó el peso total, largo curvo del caparazón (LCC), ancho curvo del caparazón (ACC), largo curvo del plastrón (LCP), ancho curvo del plastrón (ACP), circunferencia media del caparazón (CIRC) con la ayuda de una cinta métrica graduada en centímetros, así como el número de huevos que definieron las posturas de aquellas hembras con una postura exitosa. Los ejemplares fueron finalmente marcados colocándoles una placa de aluminio en la aleta anterior izquierda, e identificados con un número consecutivo. Durante el transcurso de esta investigación, ningún individuo fue recapturado.
Preparación de las muestras
De cada tubo se extrajo una gota de sangre con la ayuda de una pipeta de plástico estéril para realizar un frotis de sangre colocando la gota en un portaobjetos y realizando el extendido en una sola dirección. Para cada muestra individual, se realizaron tres frotis de sangre. Luego, los portaobjetos se dejaron secar al aire libre durante un máximo de dos horas. A continuación, los frotis de sangre fueron fijados con metanol absoluto por diez minutos y se dejaron secar de nuevo al aire libre. Cada muestra fue preservada hasta su posterior tinción con naranja de acridina por diez minutos (una de ellas se preservó como contramuestra para estandarizar la tinción). El manejo de los residuos de cada tinción fue realizado de acuerdo a las normas internacionales de seguridad en el laboratorio (Ley 1252 de 2008). La tinción con naranja de acridina se realizó siguiendo el procedimiento descrito en Gómez et al. (2006), utilizando una concentración del colorante de 0,02 mg/ml en un tampón fosfato (pH 7,4).
Análisis de las muestras
Las muestras fueron analizadas utilizando un microscopio equipado con epifluorescencia con aumento de 100X. La identificación de micronúcleos (MN) y de protuberancias nucleares (PN) se realizó de acuerdo a los criterios establecidos por Majone et al. (1987), Carrasco et al. (1990) y Koppe (2002). La cuantificación de la frecuencia de eritrocitos micronucleados (EMN) se realizó considerando únicamente las estructuras redondeadas, no refringentes y separadas del núcleo principal que emiten una fluorescencia verde brillante. Por su parte, la cuantificación de los eritrocitos con protuberancias nucleares (EPN), se realizó de acuerdo a los criterios establecidos por Gómez et al. (2006), considerando solo aquellas estructuras redondeadas, no refringentes, y unidas aún al núcleo celular que emiten una fluorescencia verde brillante.
Se registró la frecuencia de EMN y de EPN para cada individuo sobre un total de 1000 eritrocitos por placa, para un total de 2.000 eritrocitos analizados por individuo. Se analizaron un total de 110.000 eritrocitos, y la frecuencia de anormalidad nuclear se obtuvo según la fórmula:
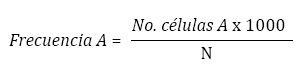
Donde A representa la anormalidad nuclear (micronúcleo o protuberancia nuclear) y N es el número total de células examinadas.
Análisis estadístico de los datos
Los resultados fueron sometidos a un análisis estadístico descriptivo a partir de las medidas de tendencia central (mínimo, máximo, media y desviación típica). Se evaluó la distribución normal de los datos con la prueba de Kolmogorov-Smirnov, tomando un valor de p<0,05 como estadísticamente significativo. Así mismo, se aplicó un análisis multivariado con el coeficiente de correlación lineal de Pearson y con la prueba de Kruskal-Wallis (K-W) para establecer la relación entre la frecuencia de micronúcleos y protuberancias nucleares con las medidas biométricas y el nivel de postura de cada hembra al igual que para determinar si existían diferencias entre las frecuencias de los dos biomarcadores genotóxicos con una p<0,05.
RESULTADOS
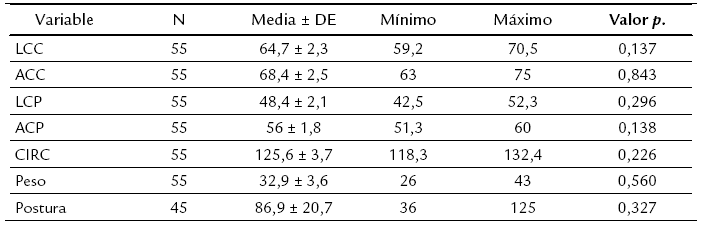
La Tabla 1 recoge las medidas de tendencia central para los datos biométricos y la postura, si bien solo se obtuvieron datos de postura de 45 hembras las cuales tuvieron una postura exitosa al arribar a la playa.
Los hallazgos biométricos de este estudio son similares a los reportados para la población de tortugas marinas del Pacífico Oriental (Hinestroza y Páez, 2001; Vega y Robles, 2005). Esta observación fue corroborada cuando se realizó la distribución normal de los datos, excepto para el nivel de postura, ya que cada hembra puede ir a desovar en la misma temporada entre una y tres veces depositando un número de huevos muy diferente en cada visita a la playa, con tendencia a ser menor en cada postura (Plotkin et al., 1994; Márquez et al., 1996). Se encontró una media de EMN de 0,6 ± 0,6 y de EPN de 2,1 ± 1,9. Ninguna de las variables biométricas fue estadísticamente significativa (Tabla 1).
LCC: Largo curvo de caparazón; ACC: Ancho curvo de caparazón; LCP: Largo curvo de plastrón; ACP: Ancho curvo de plastrón; CIRC: Circunferencia media del caparazón. *LCC, ACC, LCP, ACP y CIRC dados en cm, peso en kg y postura en n°. de huevos.Tabla 1: Medidas de tendencia central de los datos biométricos expresadas en promedio ± desviación estándar (DE).
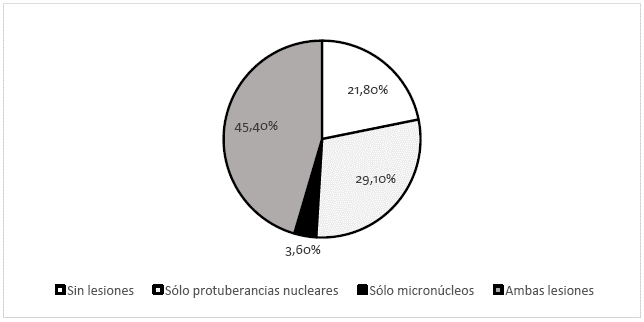
Con respecto al porcentaje de individuos con anormalidades nucleares (Fig. 1), el 78,2 % de los individuos presentó alguna lesión nuclear, aunque la frecuencia de protuberancias nucleares fue mayor que la de micronúcleos cuando constituyeron la única lesión en cada individuo (29,1 % vs. 3,6 %). El 45,4 % de los individuos presentaron ambos tipos de lesiones nucleares. Así mismo, se hallaron algunos eritrocitos binucleados y uno trinucleado, aunque no se incluyeron en el análisis de los datos. Se encontró una diferencia estadísticamente significativa (Kruskal-Wallis, p= 0,035) entre las anormalidades nucleares halladas en el estudio.
Figura 1: Porcentaje de hembras de Lepidochelys olivacea con anormalidades nucleares.
Cabe resaltar que a la contramuestrato mada de cada individuo se le realizó la tinción con Giemsa, tal y como lo reportan diferentes estudios (Bombail et al., 2001; Grisolia, 2002; Bolognesi et al., 2006) para otros vertebrados (peces y mamíferos). Sin embargo, cerca del 50 % de las placas procesadas con esta tinción evidenciaron una gran cantidad de artefactos que impedían realizar la lectura de forma adecuada sin sobreestimar los daños. Esto fue corroborado con otros autores (Borrat, comunicación personal, 26 de abril de 2013), quienes utilizaron exitosamente otra inmunotinción epifluorescente (Ioduro de propidio) en tortuga verde (Borrat et al., 2011). Es necesario reiterar que pese a esto, ambas tinciones, Giemsa y naranja de acridina, se utilizaron exitosamente para leer varios controles positivos de pacientes caninos sometidos a diversas moléculas de quimioterapia. Aun no existe una explicación para determinar los motivos por los cuales no fue posible leer las placas con Giemsa en nuestro caso.
DISCUSIÓN
Pocos estudios han determinado la presencia y frecuencia de micronúcleos y protuberancias nucleares en reptiles. A pesar de que los ejemplares fueron capturados en un litoral de Colombia con un mínimo impacto antrópico, los resultados muestran un nivel de respuesta de estos dos biomarcadores genotóxicos mayor que los reportados para la frecuencia de EMN en otros reptiles (0,13 ± 0,07-0,3 ± 0,88) y menores para la frecuencia de EPN (0,13 ± 0,66-4,23 ± 1,74) (Hayretdag et al., 2014).
El hallazgo de una frecuencia de EPN mayor que la de EMN aún no está muy entendido debido a que la mayor parte de los estudios experimentales y de frecuencias basales se ha realizado con MN. Sin embargo, algunas investigaciones recientes han evidenciado que los mecanismos por los cuales se generan uno u otro daño parecen ser diferentes (Lindberg et al., 2007; Fenech et al., 2011) y se cree que es parte de respuestas celulares particulares, lo cual no está descrito para las especies de tortugas marinas. Además, la respuesta del sistema inmune de algunos vertebrados adultos es más efectiva en la eliminación de estas anomalías, lo cual explica la mayor frecuencia de estas aberraciones en animales jóvenes (Tucker y Preston, 1996; Zuñiga et al., 2000). En nuestro estudio no fue posible determinar la edad exacta de las hembras que arribaron a la playa para incluirla como una posible variable que corroborara esta observación.
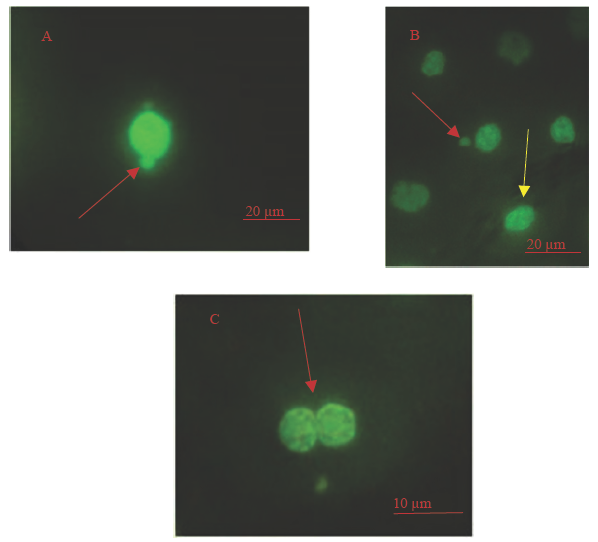
Si bien no se encontró ninguna correlación entre la frecuencia de EMN y la de EPN con los datos biométricos ni con el nivel de postura de huevos, la investigación logró determinar que existen eritrocitos circulantes con evidencia de daño genético, especialmente de MN y PN (Figura 2A-2C). No es clara esta falta de correlación, aunque se sabe que los cambios en la estructura nuclear y la composición son muy relevantes para el desarrollo normal y las diferentes funciones fisiológicas, y pueden contribuir a muchas enfermedades en humanos y animales, como la distrofia muscular, la cardiomiopatía dilatada, el envejecimiento prematuro y el cáncer (van der Oost et al., 2003; Zwerger et al., 2011).
Figura 2: Microfotografías en 100X de eritrocitos normales y anormalidades nucleares observadas en sangre periférica de L. olivacea. A. Eritrocito con puente nuclear; B. Eritrocito con micronúcleo (Flecha roja) y Eritrocito normal (Flecha amarilla); C. Eritrocito binucleado (Flecha roja). Tinción con naranja de acridina.
Sin embargo, sí se han encontrado correlaciones positivas entre las concentraciones de algunos contaminantes químicos y la edad (Lake et al., 1994) o el peso (Storelli et al., 1998). Considerando que estos contaminantes tienen un potencial importante como sustancias genotóxicas, y que pueden elevar el valor de las frecuencias de tales anormalidades, es plausible sospechar que existan correlaciones positivas entre las concentraciones tisulares de sustancias químicas, la frecuencia de dichas anormalidades y ciertos caracteres morfométricos y reproductivos en las especies afectadas, como se ha registrado en caimanes de La Florida (Pickford et al., 2000; Milnes et al., 2001; Milnes et al., 2004). Estos daños deberían afectar principalmente dichas medidas biométricas en etapas tempranas de crecimiento y su falta de correlación en los individuos estudiados en nuestro estudio puede deberse a que estos ya eran adultos completamente desarrollados.
Es posible que en L. olivacea exista una mayor presencia de EPN en respuesta a la exposición de agentes genotóxicos que la respuesta celular a través de EMN. Aunque la explicación para tal hallazgo aún es desconocida, quizás el sistema reticuloendotelial encargado de eliminar estas células defectuosas tenga algún grado de selectividad o que algunas de estas anormalidades genéticas pueden escapar a los mecanismos de control homeostático y evadir el sistema inmune (Negrini et al., 2010). Gómez et al. (2006) determinaron que EMN fue un biomarcador más sensible que EPN en la cotorra Aratinga canicularis en respuesta a la exposición controlada de mitomicina C.
En nuestro estudio se encontró que una de las tres tortugas que presentaron lesiones cutáneas sugestivas de fibropapilomatosis, tuvo la mayor frecuencia de EPN (siete) de todo el estudio. Algunas investigaciones atribuyen la presencia de aberraciones cromosómicas a la secreción de ciertas sustancias de parásitos como Taenia solium en el humano (Serrano y Montero, 2001) y en células embrionarias de hámster dorado (Herrera et al., 1994). Estos últimos estudios reportaron que la frecuencia de MN fue significativamente más elevada en linfocitos cultivados en presencia de un factor secretado por esta tenia (Herrera et al., 2003).
Si bien se conoce que la presencia de papilomavirus y otros como herpesvirus y retrovirus en tortugas marinas ha sido relacionada con fibropapilomatosis (Herbst 1994; Casey et al., 1997; Lu et al., 2000; Aguirre y Lutz, 2004), no se tienen datos que demuestren la relación causa-efecto entre estas enfermedades infecto-contagiosas y daño en el material genético evidenciable en las células sanguíneas. Pese a esta falta de estudios, este tipo de agentes infecciosos puede llegar a generar alteraciones nucleares sobre el ADN celular como se ha comprobado para el papilomavirus humano (Jo y Kim, 2005; Yoshida et al., 2008).
Borrat et al. (2011) encontraron un número de EMN significativamente mayor en individuos de tortuga verde (Chelonia mydas) que presentaron tumores que aquellos que no los tenían. En este aspecto, es necesario resaltar que se ha encontrado en C. mydas una correlación positiva entre la cercanía a un canal de desagüe de contaminantes químicos (talio particularmente) y el nivel de EMN (Borrat et al., 2013). Estos autores determinaron que la cercanía de los animales muestreados al canal, se correlacionaba con una frecuencia mayor de micronúcleos y que los niveles del daño estudiado también fueron significativamente mayores a los presentados por los animales mantenidos en cautiverio en proceso de rehabilitación, los cuales utilizaron como controles. También se han detectado diferencias significativas en los niveles de micronúcleos y puentes nucleares en serpientes (Hayretdag et al., 2014) y en una especie de rana (Aymak, 2010), encontrando niveles más altos en individuos que habitaban zonas agrícolas con mayor grado de contaminación por metales pesados.
Es necesario aclarar que en nuestro trabajo no era posible establecer dicha relación con las zonas de descarga de agua dulce del área de estudio debido a que a diferencia de la población de tortugas estudiada en Uruguay, la de L. olivacea en Colombia utiliza la playa donde realizamos el muestreo solo para anidar.
En el presente estudio no se estableció ninguna relación de causalidad con respecto a la presencia de las anormalidades nucleares en los eritrocitos, solo se buscaba establecer su presencia y su posible asociación con algunos parámetros biométricos y reproductivos (nivel de postura) en la población estudiada. En este aspecto, hay que mencionar que es necesario estudiar las posibles asociaciones entre la presencia y nivel de algunos contaminantes en la zona de estudio (como metales pesados y agroquímicos) con dichas anormalidades. Esto podría servir para determinar sí L. olivacea sea una buena candidata como especie biomonitora de contaminación ambiental a nivel local o tal vez regional.
A pesar de las anteriores condiciones, consideramos que desde el punto de vista de la conservación de la especie, es importante establecer la presencia de estrés genotóxico sin que necesariamente se tenga en consideración las áreas de exposición a estas sustancias químicas, especialmente sí se tiene en cuenta que estas hembras anidadoras aisladas (como las estudiadas en el presente trabajo) juegan un papel ecológico esencial en la dinámica de las poblaciones por cuanto poseen mayores tasas de eclosión (Rueda, 2002).
CONCLUSIONES
Nuestro trabajo pudo determinar por primera vez que existen niveles circulantes de EPN y de EMN en la población anidante de L. olivacea de la costa norte del Pacífico colombiano.
Los resultados no permiten concluir que L. olivacea sea una especie adecuada para monitorear los efectos genotóxicos de la contaminación química en áreas marinas. Sin embargo, el hallazgo de daño genético en sus eritrocitos, podría estar indicando que esta especie responde positivamente a la presencia de este tipo de sustancias en el ambiente. Para esto, es necesario realizar estudios bajo diferentes niveles de exposición con sustancias consideradas controles positivos. Los biomarcadores genotóxicos estudiados en este trabajo podrán servir para establecer criterios de salud de las poblaciones de L. olivacea, de manera que puedan emplearse para valorar el estado de salud de individuos mantenidos en cautividad en centros de rehabilitación antes de su puesta en libertad. Por otro lado, la metodología y los resultados de nuestro estudio servirán en los programas desarrollados para la conservación de esta especie en Colombia.
AGRADECIMIENTOS
Este estudio se llevó a cabo gracias al apoyo de la Universidad de Antioquia, a su Corporación Académica Ambiental y a los grupos de investigación GISMAC y GAIA de la institución. Igualmente, un especial agradecimiento a la Fundación Natura por prestar de forma desinteresada sus instalaciones durante la investigación de campo; al Consejo Comunitario del Cedro y a la comunidad del Corregimiento del Valle por el apoyo incondicional que tuvieron para el buen desarrollo del trabajo, así como a todos los miembros del grupo Caguama que ayudaron con el monitoreo diario durante la temporada de anidación. Por último, agradecemos a las personas que colaboraron en la corrección del manuscrito final, cuyo apoyo resultó vital para la elaboración del mismo.
REFERENCIAS
Referencias
Abreu-Grobois F, Plotkin P. Red List Assessment of Lepidochelys olivacea. Marine Turtle Specialist Group. IUCN. [Serial online] 2008. Available at: http://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T11534A3292503. Cited 20 Dic 2015.
Aguirre A, Lutz P. Marine turtles as sentinels of ecosystem health: is fibropapillomatosis an indicator? Ecohealth. 2004;1(3):275-283.
Amorocho D.F, Rubio H, Diaz P. Observaciones sobre el estado actual de las tortugas marinas en el Pacífico Colombiano. In: Rodriguez-M J.V., Sanchez-P H., editors. Contribución al Conocimiento de las Tortugas Marinas de Colombia. Bogotá: INDERENA1992:155-179.
Amorocho D.F. Biología reproductiva de la tortuga golfina en la playa larga, El Valle, Chocó. Informe Técnico 91-92. Bogotá: Fundación Natura; 1993. 72 p.
Anan Y, Kunito T, Watanabe I, Sakai H, Tanabe S. Trace element accumulation in hawksbill turtles (Eretmochelys imbricata) and green turtles (Chelonia mydas) from Yaeyama islands, Japan. Environ Toxicol Chem 2001;20(12):2802-2814. Doi:10.1002/etc.5620201220.
Aymak C. Determination of heavy metal pollution and its genotoxic effects by using micronucleus test in Rana ridibunda Pallas, 1771 (Ranidae, Amphibia) living in Mersin (Phd. Thesis). Mersin University. 2010; 88p.
Bishop C.A, Lean D.R, Brooks R.J. Chlorinated hydrocarbons in early life stages of the common snapping turtle (Chelydra serpentina serpentina) from a coastal wetland on Lake Ontario, Canada. Enviro Toxicol Chem.1995; 14(3):421-426. Doi:10.1002/etc.5620201220
Bolognesi C, Perrone E, Roggieri P, Pampanin D, Sciutto A. Assessment of micronuclei induction in peripheral erythrocytes of fish exposed to xenobiotics under controlled conditions. Aquat Toxicol. 2006; 78 (Supp 1):93-98. Doi:10.1016/j.aquatox.2006.02.015
Bombail V, Aw D, Gordon E, Batty J. Application of the comet and micronucleus assays to butterfish (Pholis gunnellus) erythrocytes from the Firth of Forth. Chemosphere. 2001;(44):383-392. Doi:10.1016/S0045-6535(00)00300-3.
Borrat V, Villar S, Márquez A, Martínez G, Fallabrino A, Novello A. Marcadores moleculares de daño genético en Tortuga verde (Chelonia mydas) del area marino-costera protegida Cerro Verde e Islas de la Coronilla, Rocha. Bol Inst Invest Pesq. 2011;(28):15-19.
Borrat V, Villar S, Martínez G, Fallabrino A. The micronucleus test: a reliable tool for health screening of green turtles. In: Proceedings of the Thirty-third Annual Symposium on Sea Turtle Biology and Conservation. Maryland: National Oceanic and Atmospheric Administration; 2013. p. 3.
Carrasco K, Tilbury K, Myers M. Assessment of the piscine micronucleus test as an in situ biological indicator of chemical effects. Can J Fish Aquat Sci. 1990;27(11):2123-2136. Doi:10.1139/f90-237
Casey R, Quackenbush S, Work T, Balazs G, Bowser P, Casey J. Evidence for retrovirus infections in green turtles Chelonia mydas from the Hawaiian Islands. Dis Aquat Org. 1997;(31):1-7.
Clark D, Bickham J, Baker D, Cowman D. Environmental contaminants in Texas, USA. Wetland reptiles: evaluation using blood samples. Environ Toxicol Chem. 2000;19(9):2259-2265.
Crain D, Guillette Jr. L. Reptiles as models of contaminant-induced endocrine disruption. Anim Repro Sci. 1998; 53:77-86.
Fenech M, Kirsch M, Natarajan A, Surralles J, Crott J, Parry J, et al. Molecular mechanisms of micronucleus, nucleoplasmic bridge and nuclear bud formation in mammalian and human cells. Mutagenesis. 2011;26(1):125-132. Doi:10.1093/mutage/geq052.
Gauthier J, Dubeau H, Rassart E. Evaluation of genotoxic effects of environmental contaminants in cells of marine mammals with particular emphasis on beluga whales. In: Toxicology of marine mammals. New York: CRC Press. 2003. p. 417-441.
Golet W, Haines T. Snapping turtles (Chelydra serpentina) as monitors for mercury contamination of aquatic environments. Environ Monit Assess . 2001;71:211-220.
Gómez B, Zamora A, Luna J, González A, Ramos M, Torres O, et al. Nuclear abnormalities in erythrocytes of parrots (Aratinga canicularis) related with genotoxic damage. Avian Pathol. 2006;35(3):206-210. Doi:10.1080/03079450600711003.
Grisolia CK. A comparison between mouse and fish micronucleus test using cyclophosphamide, mitomycin C and various pesticides. Mutat Res. 2002;518(2):145-150. Doi:10.1016/S1383-5718(02)00086-4.
Hayretdağ S, Gürkan M, Yakin B, Tok C. A preliminary study on micronuclei and nuclear abnormalities in the erythrocytes of some Colubrid snakes from Turkey. Biharean Biologist. 2014;8(1):53-55.
Herbst LH. Fibropapillomatosis of marine turtles. Annu Rev Fish Dis. 1994;(4):389-425. Doi:10.1016/0959-8030(94)90037-X.
Herrera L, Santiago P, Rojas G, Salazar P, Tato P, Molinari J, et al. Immune response impairment, genotoxicity and morphological transformation induced by Taenia solium metacestode. Mutat Res. 1994;305(1):223-228.
Herrera L, Tato P, Molinari J, Pérez E, Dominguez H, Ostrosky-Wegman P. Induction of DNA damage in human lymphocytes treated with a soluble factor secreted by Taenia solium metacestodes. Teratog Carcinog Mutagen. 2003;23(1):79-83. Doi:10.1002/tcm.10063.
Hinestroza L, Páez V. Anidación y manejo de la tortuga golfina (Lepidochelys olivacea) en la playa la Cuevita, Bahia Solano, Choco, Colombia. Cuad Herpetol. 2001;14:131-144.
Hopkins WA. Reptile toxicology: challenges and opportunities on the last frontier in vertebrate ecotoxicology. Environ Toxicol Chem. 2000;(19):2391-2393. Doi:10.1002/etc.5620191001.
Irwin L, Irwin K. Global threats affecting the status of reptile populations. In: Toxicology of reptiles. Gardner S, Oberdörster E, editors. Boca Raton, Florida: Taylor & Francis eds; 2005. p. 10-27.
IUCN. Red List Threatened Species. Lepidochelys olivacea. Available at: http://www.iucnredlist.org/amazing-species. 2013. Cited 20 Dic 2015.
Ivar do Sul J., Costa M. The present and future of microplastic pollution in the marine environment. Environ Pollut. 2014;(185):352–364. Doi:10.1016/j.envpol.2013.10.036
Jo H, Kim J. Implications of HPV infection in uterine cervical cancer. Cancer Therapy. 2005;(3):419-434. Doi:10.3892/ol.2015.3295.
Koppe C. A comparison between mouse and fish micronucleus test using cyclophophamide, mitomicina C and various pesticides. Mutat Res. 2002;(518):145-150. Doi:10.1016/S1383-5718(02)00086-4.
Lake J, Romona H, Mckinney R, Lake C, Sadove S. Pcbs and other chlorinated organic contaminants in tissues of Juvenile Kemp's Ridley Turtles (Lepidochelys kempi). Mar Envir Res. 1994;(38):313-327. Doi:10.1016/0141-1136(94)90031-0.
Lindberg H, Wang X, Jarventaus H, Falck G, Norppa H, Fenech M. Origin of nuclear buds and micronuclei in normal and folate-deprived human lymphocytes. Mutat Res. 2007;617:33-45. Doi:10.1016/j.mrfmmm.2006.12.002.
Lu Y, Aguirre A, Work T, Balazs G, Nerurkar V, Yanagihara R. Identification of a small, naked virus in tumorlike aggregates in cell lines derived from a green turtle, Chelonia mydas, with fibropapillomas. J Virol Methods. 2000;(86):25-33. Doi:10.1016/S0166-0934(99)00175-5.
Maffucci F, Caurant F, Bustamante P, Bentivegna F. Trace element (Cd, Cu, Hg, Se, Zn) accumulation and tissue distribution in loggerhead turtles (Caretta caretta) from the Western Mediterranean Sea (southern Italy). Chemosphere. 2005;58:535-542. Doi:10.1016/j.chemosphere.2004.09.032.
Majone F, Brunetti R, Gola I, Levis A. Persistence of micronuclei in the marine mussel, Mytilus galloprovincialis, after treatment with mitomycin C. Mutat Res. 1987;191:157-161. Doi:10.1016/0165-7992(87)90147-3.
Márquez MR. Las tortugas marinas y nuestro tiempo. México D.F.: Impresora y Encuadernadora Progreso; 1996. 197 p.
Martínez L, Páez V. Ecología de anidación de la tortuga golfina (Lepidochelys olivacea) en la playa de la cuevita, Costa Pacífica Chocoana, Colombia, en 1998. Actual Biol. 2000;22 (73):131-143.
Milnes M, Woodward A, Guillette, L. Morphological variation in hatchling American alligator (Alligator mississippiensis) from three Florida lakes. J Herpetol. 2001;(35):264-271. Doi:10.2307/1566117.
Milnes M, Allen D, Bryan T, Sedacca C, Guillette, L. Developmental effects of embryonic exposure to toxaphene in the American alligator (Alligator mississippiensis). Comp Biochem Phys C. 2004;(138):81-87. Doi:10.1016/j.cca.2004.05.006.
Negrini S, Gorgoulis V, Halazonetis T. Genomic instability—an evolving hallmark of cancer. Nat Rev Mol Cell Biol. 2010;(11):220-228. Doi:10.1038/nrm2858.
Novillo A, Noppadon K, Márquez E, Callard I. Reptilian genotoxicity. In: Toxicology of reptiles. Gardner S. & E. Oberdörster (eds). Boca Ratón, Florida: Taylor & Francis eds; 2005. p. 241-266.
Owens D. Ciclos reproductivos y endocrinología. In: Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. Eckert K. L., Bjorndal K. A., Abreu-Grobois F. A., Donnelly M., editors. UICN/CSE Grupo Especialista en Tortugas Marinas. 2000:137-143.
Pickford D, Guillette L, Crain D, Rooney A, Woodward A. Phallus size and plasma dihydrotestosterone concentrations in juvenile American alligators (Alligator mississippiensis) from contaminated and reference populations. J Herpetol. 2000;(34): 233-239.
Plotkin, P, Byles R, Owens D. Migratory and reproductive behavior of Lepidochelys olivacea in the eastern Pacific Ocean. In: Schroeder B.A., Witherington B. E., compilers. Proceedings of the Thirteenth Annual Symposium on Sea Turtle Biology and Conservation. U.S. Dep. Of Comm., NOAA Tech. Memo. 1994;(341):281 p.
Rueda AV. Lepidochelys olivacea. In: Castaño-Mora O. V., editor. Libro Rojo de Reptiles de Colombia. Bogotá: Instituto de Ciencias Naturales-Universidad Nacional de Colombia, Ministerio del Medio Ambiente, Conservación Internacional; 2002. p. 88-91.
Sakai H, Saeki K, Ichihashi H, Kamezaki N, Tanabe S, Tatsukawa R. Growth-related changes in heavy metal accumulation in green turtle (Chelonia mydas) from Yaeyama Islands, Okinawa, Japan. Arch Environ Contam Toxicol. 2000;(39):378–385. Doi:10.1007/s002440010118.
Serrano L, Montero R. Micronuclei and chromatid buds are the result of related genotoxic events. Environ Mol Mutagen. 2001;(38):38-45. Doi:10.1002/em.1048
Storelli M, Ceci E, Marcotrigiano G. Distribution of heavy metal residues in some tissues of Caretta caretta (Linnaeus) Specimen Beached Along the Adriatic Sea (Italy). Bull. Environ Contam Toxicol. 1998;60:546-552.
Storelli M, Marcotrigiano G. Heavy metal residues in tissues of marine turtles. Mar Pollut Bull. 2003;46:397-400. Doi:10.1016/S0025-326X (02)00230-8.
Tucker JD, Preston RJ. Chromosome aberrations, micronuclei, aneuploidy, sister chromatid exchanges, and cancer risk assessment. Mutat Res. 1996;365:147-159. Doi:10.1016/S0165-1110 (96)90018-4.
van der Oost R, Beyer J, Vermeulen N. Fish bioaccumulation and biomarkers in environmental risk assessment: a review. Environ Toxicol Phar. 2003;13(2):57-149. Doi:10.1016/S1382-6689(02)00126-6.
Vega A, Robles Y. Descripción del proceso de anidación y biometría de hembras, huevos y nidos en tortuga golfina Lepidochelys olivacea (Eschscholtz, 1829) en la isla de Cañas, pacifico panameño. Tecnociencia. 2005;(7):43-55.
Yoshida T, Sano T, Kanuma T, Owada N, Sakurai S, Fukuda T, et al. Quantitative real-time polymerase chain reaction analysis of the type distribution, viral load, and physical status of human papillomavirus in liquid-based cytology samples from cervical lesions. Int J Gynecol Cancer. 2008;18:121-127. Doi:10.1111/j.1525-1438.2007.00979.x.
Zúñiga G, Torres O, Luna J, González A, Zamora A, Gómez B, et al. Spontaneous micronuclei in peripheral blood erythrocytes from 54 animal species (mammals, reptiles and birds): Part two. Mutat Res. 2000;467:99-103. Doi:10.1016/S1383-5718(00)00021-8.
Zwerger M, Ho CY, Lammerding J. Nuclear mechanics in disease. Annu Rev Biomed Eng. 2011;13:397-428. Doi:10.1146/annurev-bioeng-071910-124736.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. G. V. Castaño, M. Cabagna Zenklusen, Y. Prieto, A. S. Manzano. (2020). ANALYSIS OF GENOTOXICITY IN ERITHROCYTES OF TURTLES (Phrynops hilarii) FROM ANTHROPIZED AND NATURAL SITES OF ENTRE RÍOS, ARGENTINA. Journal of Basic and Applied Genetics, 31(1), p.15. https://doi.org/10.35407/bag.2020.31.01.02.
2. Alexandra Frossard, Luiza Valli Vieira, Maria Tereza Weitzel Dias Carneiro, Levy Carvalho Gomes, Adriana Regina Chippari-Gomes. (2020). Accumulation of trace metals in eggs and hatchlings of Chelonia mydas. Journal of Trace Elements in Medicine and Biology, 62, p.126654. https://doi.org/10.1016/j.jtemb.2020.126654.
3. Vera Helena Vidal Dias, Jacó Joaquim Mattos, Patricia Pereira Serafini, Karim Hahn Lüchmann, Afonso Celso Dias Bainy. (2024). A systematic review of the impact of chemical pollution on sea turtles: Insights from biomarkers of aquatic contamination. Journal of Hazardous Materials, 480, p.135813. https://doi.org/10.1016/j.jhazmat.2024.135813.
4. Gabriela Antošová, Mauricio Sabogal Salamanca, Mauricio Peralta Mejía. (2021). Advances in Tourism, Technology and Systems. Smart Innovation, Systems and Technologies. 209, p.76. https://doi.org/10.1007/978-981-33-4260-6_7.
5. Danielle Tavares da Silva, Thays de Andrade Guedes, Raqueli Teresinha França, Camila de Martinez Gaspar Martins, Daniel Loebmann. (2024). Hematological and genotoxic biomarkers in a natural population of freshwater turtles Trachemys dorbigni (Duméril & Bibron, 1835) (Testudines: Emydidae) living in an urban area in Southern Brazil. Environmental Science and Pollution Research, 31(25), p.37215. https://doi.org/10.1007/s11356-024-33515-3.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).