Evaluación de la respuesta de cultivos celulares de (Fouquieria splendens ssp. breviflora) Fouquieriaceae bajo estrés hídrico.
Assessment of (Fouquieria splendens ssp. breviflora) Cell Cultures Response Under to Water Stress
DOI:
https://doi.org/10.15446/abc.v22n2.60320Palabras clave:
cultivos in vitro, electroforesis, proteínas inducibles. (es)electrophoresis, in vitro cell cultures, induced proteins. (en)
Descargas
Los cultivos de células vegetales son sistemas experimentales homogéneos altamente controlables que permiten el estudio de adaptaciones bajo condiciones de estrés hídrico, sin la interferencia de los diferentes tejidos y estados del desarrollo vegetal. Una aproximación para comprender esas adaptaciones, es la aparición de proteínas inducidas, resultado de la alteración en la expresión génica. El presente trabajo analizó la respuesta de cultivos de células de Fouquieria splendens ssp. breviflora, expuestos a ácido abscísico (ABA), mediante la caracterización electroforética en cantidad y calidad de las proteínas inducibles de estrés. Se registraron polipéptidos de bajo peso molecular (< 35KDa), comunes bajo la exposición a 10 mM, seguida la asociación con 20 y 30 mM de ABA, quedando aislada la respuesta de la condición de células en cultivo sin la presencia de éste.
Plant cell cultures are homogenous experimental systems, highly controllable that allow the study of short and large water stress adaptations without the interference of the different tissues and development of plants. An approach to understand these adaptations is through the presence of induced proteins; as a result of changes in genetic expression. This work analyze the response of Fouquieria splendens ssp. breviflora cell cultures exposed to abscisic acid (ABA), through the electrophoretic characterization of quantity and quality of stress induced proteins. There were recorded low molecular weight polypeptides (< 35kDa), common in experiments under ABA 10mM, followed by the association with 20 and 30mM ABA conditions, with a particularly response of cell cultures without the stress agent.
DOI: https://doi.org/10.15446/abc.v22n2.56809
EVALUACIÓN DE LA RESPUESTA DE CULTIVOS CELULARES DE (Fouquieria splendens ssp. breviflora) fouquieriaceae BAJO ESTRES HÍDRICO
Assessment of (Fouquieria splendens ssp. breviflora) Cell Cultures Response Under Water Stress
Leonor Angélica GUERRERO ZÚÑIGA1, Angélica RODRÍGUEZ DORANTES2.
1 Instituto Mexicano Del Petróleo, Eje Central Lázaro Cárdenas 152, San Bartolo Atepehuacan, 07730 Ciudad de México, CDMX. México
2 Laboratorio de Fisiologia Vegetal, Departamento de Botánica, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Prolongación de Carpio y Plan de Ayala s/n, Ciudad de México, CDMX. México
For correspondence. rodorantes@yahoo.com.mx
Received: 27nd September 2016, Returned for revision: 3rd February 2017, Accepted: 23rd February 2017.
Associate Editor: John Donato Rondón.
Citation/Citar este artículo como: Guerrero Zúñiga LA, Rodríguez Dorantes A. Evaluación de la respuesta de cultivos celulares de (Fouquieria splendens ssp. breviflora) Fouquieriaceae bajo estrés hídrico. Acta biol. Colomb. 2017;22(2):165-174. DOI: https://doi.org/10.15446/abc.v22n2.60320
RESUMEN
Los cultivos de células vegetales son sistemas experimentales homogéneos altamente controlables que permiten el estudio de adaptaciones bajo condiciones de estrés hídrico, sin la interferencia de los diferentes tejidos y estados del desarrollo vegetal. Una aproximación para comprender esas adaptaciones, es la aparición de proteínas inducidas, resultado de la alteración en la expresión génica. El presente trabajo analizó la respuesta de cultivos de células de Fouquieria splendens ssp. breviflora, expuestos a ácido abscísico (ABA), mediante la caracterización electroforética en cantidad y calidad de las proteínas inducibles de estrés. Se registraron polipéptidos de bajo peso molecular (< 35kDa), comunes bajo la exposición a 10 mM, seguida la asociación con 20 y 30 mM de ABA, quedando aislada la respuesta de la condición de células en cultivo sin la presencia de éste.
Palabras clave: cultivos in vitro, electroforesis, proteínas inducibles.
ABSTRACT
Plant cell cultures are homogenous experimental systems, highly controllable that allow the study of short and large water stress adaptations without the interference of the different tissues and development ofplants. An approach to understand these adaptations is through the presence of induced proteins; as a result of changes in genetic expression. This work analyze the response of Fouquieria splendens ssp. breviflora cell cultures exposed to abscisic acid (ABA), through the electrophoretic characterization of quantity and quality of stress induced proteins. There were recorded low molecular weight polypeptides (< 35kDa), common in experiments under ABA 10mM, followed by the association with 20 and 30mM ABA conditions, with a particularly response of cell cultures without the stress agent.
Keywords: electrophoresis, in vitro cell cultures, induced proteins.
INTRODUCCIÓN
La familia Fouquieriaceae DC. se distribuye en las zonas áridas de México y el suroeste de Estados Unidos, está compuesta por pequeños árboles, arbustos leñosos y especies suculentas con reservorios de agua en el xilema esparcidos ampliamente; se distingue por una serie de adaptaciones xeromórficas, dentro de las cuales el desarrollo foliar se ve influenciado por la presencia y cantidad de agua disponible (Henrickson, 1969). Los tallos de Fouquieria, permanecen sin hojas la mayor parte del tiempo, pero después de una lluvia abundante, aparecen hojas inmaduras en las yemas axilares las cuales se desarrollan rápidamente, formando una pequeña roseta foliar en cada nodo. Es sabido que Fouquieria splendens Engelm. ("ocotillo"), se encuentra bien adaptada no sólo en edad madura, sino también en estado de plántula, para mantenerse bajo condiciones de sequía, aparentemente más extrema y florece en habitats bajo las mismas condiciones (Henrickson, 1972).
Los estudios detallados del patrón de crecimiento celular y la formación de cúmulos o agregados celulares, son de un enorme potencial, ya que permiten analizar a los organismos fisiológica, bioquímica y morfogenéticamente. Los cultivos de células en suspensión se consideran como una simplificación de los mecanismos complejos involucrados en la respuesta de las plantas a cambios ambientales, entre ellos al estrés hídrico y representan un sistema experimental homogéneo altamente controlable, que permite el estudio de adaptaciones a períodos cortos y largos al estrés ambiental a nivel celular, sin la interferencia de los diferentes tejidos y estados de desarrollo vegetal (Rodríguez, 2006). Se ha observado con frecuencia que en condiciones de estrés hídrico, las plantas y los cultivos celulares presentan una activación simultánea en la síntesis de proteínas específicas y una inhibición general del crecimiento celular; así como la represión en la síntesis de algunas proteínas celulares constitutivas; no obstante el resultado final de estos mecanismos puede dirigirse en forma preferencial a la síntesis de las llamadas proteínas de estrés ( Singh et al., 1987; Skriver y Mundy, 1990; Vilardell et al., 1990; Jiang y Huang, 2002; Wang et al., 2003; Lee et al., 2005; Al-Khayri et al., 2012) y con ello, el perfil electroforético de proteínas tanto cualitativos como cuantitativos se puede detectar durante el estrés hídrico (Riccardi et al., 1998). El empleo de los cultivos in vitro para estudiar las respuestas al estrés se basa en el hecho de que los cultivos de células se comportan de manera similar a las células de las plantas intactas sujetas a tales condiciones (Newton et al., 1989; Attree et al., 1991). Más aún, especies que difieren en la tolerancia a la sequía a nivel de la planta completa también muestran usualmente diferencias en la tolerancia a la sequía en los cultivos celulares (Santos-Díaz y Ochoa-Alejo, 1994). La aplicación exógena de ácido abscísico induce un buen número de proteínas similares a las dehidrinas: familia de proteínas que se acumulan en una amplia variedad de especies vegetales bajo condiciones de estrés de deshidratación, cuyo intervalo de pesos moleculares va de 9 KDa a 200KDa (Close, 1996; Han et al., 1997; Pelah et al., 1997). Investigaciones sobre el efecto del ácido abscísico y la respuesta al estrés hídrico, empleando cultivos de células en suspensión, analizan la respuesta al estrés hídrico y la adaptación rápida o lenta de las células (Skriver y Mundy, 1990; Leone et al., 1994). Así mismo, se han realizado algunos estudios fisiológicos encaminados al estudio de la respuesta de F. splendens ssp. breviflora Engelm. in toto, para evaluar la producción de elementos traqueales y condición foliar sometida a condiciones también particulares de estrés hídrico, no solamente con ácido abscísico (ABA); sino también con polietilenglicol, los que han servido de marco antecedente y comparativo (Rodriguez et al., 2003; Rodríguez-Dorantes y Muñoz-Sánchez, 2006).
El objetivo de este trabajo fue comparar la respuesta de cultivos in vitro de Fouquieria splendens ssp. breviflora expuestos a ácido abscísico a través del análisis electroforético de proteínas inducidas, que sugieren la modulación de su expresión, bajo este agente de estrés hídrico.
MATERIALES Y MÉTODOS
Colecta del material biológico y obtención del tejido calloso
El sitio de colecta, se ubica a 3 Km al sur de la localidad de Peña Blanca, Municipio de Peña Miller, en el Estado de Querétaro (21°00'47" N y 99°44'33" W, con una altitud de 1300-1350 m s.n.m.). Se realizó una colecta del material vegetal de Fouquieria splendens ssp. breviflora en el mes de marzo del 2015, en temporada de sequía. Se realizaron las mediciones in situ de humedad relativa atmosférica (28,5 %) y de temperatura (31 °C, y la colecta de los tallos de esta especie, se realizó tomando muestras de diferentes ejemplares, seleccionados carentes de material foliar. Se colectaron 25 varas de 1m de longitud, que se cortaron de la planta madre, transportaron al laboratorio en seco envueltas en papel, y ya en el invernadero se colocaron éstas con aporte de agua directo y bajo condiciones controladas, (temperatura +/-, 28 °C/15 °C y una humedad relativa de 35 %, con fotoperíodo de 12:12), para su hidratación, hasta el desarrollo de los brotes axilares para la obtención de los explantes foliares.
La obtención de tejido calloso a partir de los explantes foliares obtenidos se realizó bajo condiciones de esterilidad, tomando fracciones foliares que se lavaron con agua corriente y jabón, este material se desinfestó con hipoclorito de sodio al 10 % estéril por diez minutos. Se enjuagó el material con agua destilada estéril con tres cambios de cinco minutos cada uno y este material se seccionó en fracciones de 1 cm2, depositando de tres a cuatro fracciones foliares por frasco de cultivo con tapas Magenta (Sigma, Chemical Co.) que contenía 30 mL de medio sólido MS (Murashige y Skoog, 1962) modificado por Franco y García (1995), con 1/2 de sales con 1 mg /L de ácido naftalen acético (ANA) y 10 mg /L de bencil-amino purina (BAP).
Los cultivos se dejaron bajo condiciones de iluminación con fotoperíodo de 16: 8, a 28 °C por 30 días.
Establecimiento de cultivos de tejido calloso y células en suspensión de Fouquieria splendens ssp. breviflora
Una de las condiciones in vitro que se establecieron para evaluar el efecto de un agente condicionante de estrés hídrico, fue el cultivo de tejido calloso en medio sólido, para ello, se tomó 1 mL de inóculo de un cultivo de células en suspensión en fase exponencial, se depositó en frascos de vidrio con tapa de baquelita de 15 mL de capacidad y conteniendo 5 mL de medio sólido MS 25 % de sales y la adición de ácido abscísico (ABA) (SIGMA, Chemical Co.) en las concentraciones de 10 mM, 20 mM y 30 mM y como condición testigo el medio de cultivo sin el agente de estrés; se incubaron a 36 °C, con fotoperíodo de 12:12, mantenidos bajo estas condiciones por 40 días. Los experimentos se realizaron por cuadruplicado.
La primera fase del establecimiento de la segunda condición de crecimiento in vitro, para el cultivo de células en suspensión de la especie vegetal, consistió en la obtención de un cultivo de células a partir de los callos obtenidos; de estos se tomó 0,5 g de biomasa que se disgregó en fracciones transferidas a matraces Erlenmeyer de 50 mL con 25 mL de medio líquido MS con 25 % de sales con ANA (1 mg/L) y BAP (10 mg/L); se mantuvieron en agitación a 3,8 rpm a 36 °C y oscuridad, por 15 días, realizando subcultivos cada ocho días para el mantenimiento de las líneas celulares. Así mismo, se realizó la determinación de la curva de crecimiento de las células en suspensión empleando matraces nefelométricos, con 15 mL de inóculo celular que contenían 30 mL de medio líquido MS 25 % de sales más fitohormonas; la determinación de la curva de crecimiento se realizó por 27 días, con mediciones cada tercer día evaluando la turbidez de los cultivos en un Fotocolorímetro Klett-Summerson con filtro azul No. 42 y tomando alícuotas de 5 mL del cultivo, para la determinación de peso fresco (g) y la cuantificación de proteína total, a través del método convencional de Lowry et al. (1954).
La exposición al agente estresante sobre las células en cultivo de F. splendens ssp. breviflora, se realizó en matraces Erlenmeyer de 50 mL, que contenían 25 mL de medio MS 25 % de sales con ANA y BAP en las concentraciones antes mencionadas, con la adición de ABA a las concentraciones de 3 mM, 7 mM y 15 mM y como condición testigo el medio de cultivo sin el agente de estrés. Se adicionaron a cada matraz 10 mL de inóculo celular de los cultivos de células en suspensión en fase exponencial; los experimentos se realizaron por cuadruplicado y se mantuvieron durante un mes, bajo condiciones de oscuridad a 36 °C y en agitación continua a 3,8 rpm.
Evaluación del efecto del agente estresante sobre las células de Fouquieria splendens ssp. breviflora
Después del tiempo de exposición ante el ABA en ambas condiciones de cultivo in vitro, se obtuvo la biomasa celular de cada experimento y se extrajeron las proteínas totales homogenizando la biomasa en homogenizador de tejidos (Potter), con regulador HEPES-NaCl 30 mM pH 7,5, + 0,1 mL de PVP + 0,1 mL de P-mercaptoetanol. El material homogenizado se centrifugó a 6,400 g a 4 °C por 15 minutos; eliminándose el precipitado celular y se guardó el sobrenadante que contenía las proteínas totales celulares para su cuantificación, por el método convencional de Lowry et al. (1954). Se realizaron también observaciones de los cultivos de células con su tinción directa con azul de metileno, empleando un Microscopio Nikon, Labophot-2.
A los resultados obtenidos de cuantificación de proteína total, se les aplicó un análisis de varianza (ANOVA), empleando el paquete estadístico GraphPad Instat Ver. 3,10.
Análisis electroforético de las proteínas totales extraídas del material celular de Fouquieria splendens ssp. brevilfora
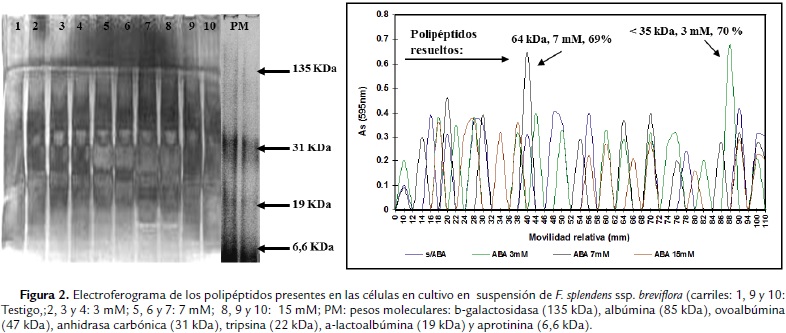
Para el análisis electroforético de las proteínas extraídas; se tomó una alícuota de 1 mL de éstas y se precipitaron con la adición de cinco gotas de ácido tricloroacético frío al 20 %, se centrifugó la muestra y el precipitado se resuspendió en regulador de corrimiento electroforético. La electroforesis se realizó en un sistema discontinuo de poliacrilamida-SDS al 4 y 12 % (Hames, 1987). El corrimiento se realizó utilizando regulador Tris-Glicina (Tris 0,6 g y Glicina 2,88 g /L) pH 8,3, a 120 Volts, durante dos horas. Al término, los geles se sumergieron en ácido tricloroacético frío al 10 % por diez minutos para fijar las proteínas al gel y éstas se tiñeron con Azul de Coomassie G-250. Se determinó la movilidad relativa de las proteínas resueltas de cada patrón obtenido, con base en la tasa de migración de los estándares; y los pesos moleculares se estimaron a partir de una curva de calibración con los marcadores de pesos moleculares empleados (SIGMA, Chemical Co.), los cuales fueron: β-galactosidasa (135 kDa), albúmina (85 kDa), ovoalbúmina (47 kDa), anhidrasa carbónica (31 kDa), tripsina (22 kDa), β-lactoalbúmina (19 kDa) y aprotinina (6,6 kDa). Se analizaron los perfiles electroforéticos en un densitómetro (Chromatogram Densitometer D50 Heidelberg) leyendo la absorbancia a 595 nm, que corresponde al pico característico de la tinción convencional con azul de Coomassie G-250, para la caracterización de los polipéptidos resueltos con base en el porcentaje de proteína de cada uno.
Análisis de los resultados
Se realizó el análisis numérico comparativo de las dos condiciones de cultivo in vitro, empleando los datos obtenidos de los electroferogramas analizados con el densitómetro, y basados en la cuantificación de las bandas; datos relacionados con la presencia de polipétidos en los diferentes tratamientos de las dos condiciones; se utilizó el programa NTSyS-PC versión 2,11 T (Numerical Taxonomy and Multivariate Analysis System), para la aplicación del índice de distancia. Una vez obtenidos los valores de distancia de los coeficientes aplicados en ambos casos, se construyó el fenograma respectivo utilizando el método de agrupamiento UPGMA (Unweighted Pair Group Method of Arithmetic Averages) para los casos analizados. También se estableció la veracidad y confianza de los fenogramas obtenidos a través de la obtención del coeficiente de correlación producto-momento de Pearson.
RESULTADOS
Respuesta y análisis de los cultivos in vitro de Fouquieria splendens ssp. breviflora, expuestos a ácido abscísico
Los cultivos de células de Fouquieria splendens ssp. breviflora, mostraron un conjunto celular muy homogéneo en esta condición de estrés (Figs. 1a, 1b, 1c y 1d), característico de la curva de crecimiento de un cultivo: células alargadas o tubulares, isodiamétricas y gigantes, repartidas en cada fase; primero células tubulares (o elongadas) en la fase inicial, a partir de las cuales se inician los subcultivos celulares; hacia el final de la fase lag, se encuentran células muy grandes isodiamétricas y en la fase temprana de la exponencial, se comienzan a formar agregados celulares (Street, 1977; Herrera-García et al., 2008).
La cantidad de proteína celular obtenida fue mayor en la condición de los cultivos de callo sometidos a las concentraciones más altas de ABA: testigo, ABA 10mM, 20 mM y 30 mM con 0,117 ± 0,005; 1,73 ± 0,002; 0,372 ± 0,002 y 0,279 ± 0,002, respectivamente; comparados con los resultados de las células en suspensión con concentraciones mayores: testigo, ABA 3, 5 y 7 mM con 0,024 ± 0,0005; 0,024 ± 0, 0005; 0,71 ± 0, 005 y 0,47 ± 0, 005, respectivamente; sin diferencias significativas entre las condiciones experimentales (p < 0,05).
Respuesta molecular al estrés hídrico en Fouquieria splendens ssp. breviflora: caracterización electroforética de las proteínas presentes en los cultivos in vitro expuestos a ácido abscísico
En la condición de cultivo de tejido calloso de Fouquieria splendens ssp. breviflora en medio sólido, el número de polipéptidos evidenciados en los electroferogramas analizados con el densitómetro (Fig. 2), fueron: testigo con 28 (polipéptidos principales de 82 y 48 kDa con 34 y 30,6% de proteína, respectivamente), ABA 10 mM con 10 (polipéptidos principales de 58 y 110 kDa, con 25 y 54,16 % de proteína, respectivamente), ABA 20 mM con 20 (con tres polipéptidos menores a 35 kDa, con 50, 79 y 38, 09 % de proteína) y ABA 30mM con 22 (con tres polipéptidos presentes, uno de 80 kDa y dos menores a los 35 kDa cada uno con 25, 27, 10, 98 y 12, 08 % de proteína, respectivamente). En la condición de cultivo de células en suspensión, el número de polipéptidos evidenciados fue el siguiente: testigo con 14 (con tres polipéptidos principales de 40, 90 y un polipéptido menor a 35 kDa, con 20, 68, 20, 68 y 24,13 % de proteína, respectivamente), ABA 3 mM con 15 (con dos polipéptidos de 43 y uno menor a 35 kDa, con 10,15 y 70, 31 % de proteína, respectivamente), ABA 7 mM con 13 (con dos polipéptidos uno de 64 y otro menor a 35 kDa, con 69, 63 y 19, 89 % de proteína) y finalmente ABA 15 mM con 13 (con tres polipéptidos presentes, uno de 64 kDa y dos menores a los 35 kDa, con 16, 22 y 32 % de proteína, respectivamente).
Análisis numérico y comparación de los polipéptidos presentes en las dos condiciones de cultivo in vitro de Fouquieria splendens ssp. breviflora
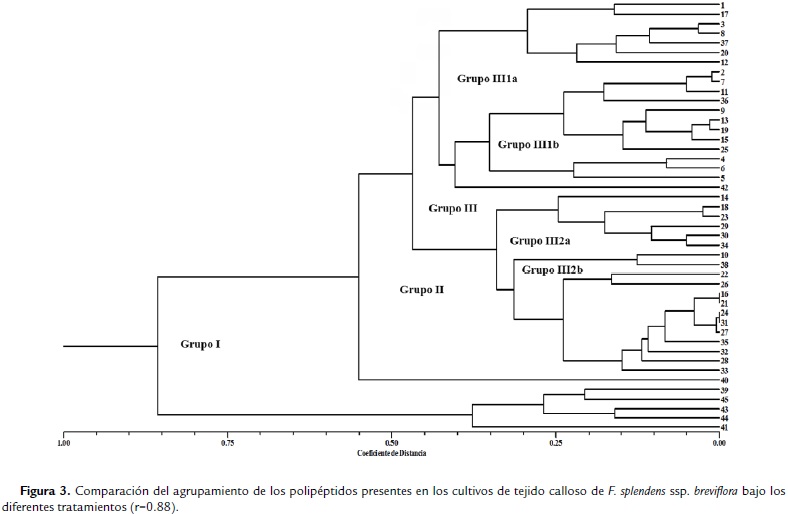
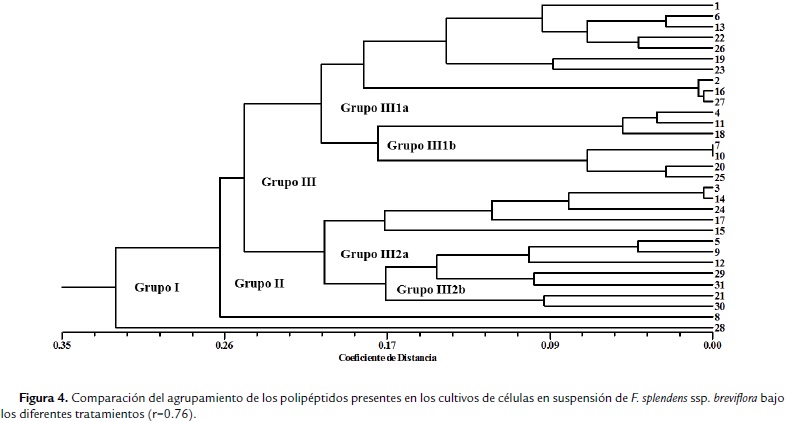
Las dos condiciones de cultivo se analizaron a través de un índice numérico que asociara los polipéptidos presentes con relación a su concentración (como una medida directa de la expresión de cada uno de ellos), dadas las diferentes condiciones, lo anterior permitió ver las similitudes entre los tratamientos con ABA y su condición de cultivo. Se presentan los resultados de dos agrupaciones, los polipéptidos asociados a los tratamientos con ABA en los cultivos de callo (Fig. 3) y los polipéptidos asociados a los tratamientos con ABA en los cultivos de células en suspensión (Fig. 4).
El fenograma de las condiciones de cultivo de callo, muestra dos grupos bien definidos de manera inicial (Grupo I), donde se tiene un polipéptido abundante solamente en los tratamientos testigo y ABA 20 mM, el segundo grupo (Grupo II) que incluye al resto de los polipéptidos analizados, también está constituido a su vez por dos; uno de ellos único por presentarse este polipéptido solamente en el tratamiento con ABA 20 mM, y un Grupo III que agrupa al resto de los polipéptidos con los grupos III 1a y III 1b, que asocia los polipétidos comunes de los tratamientos Testigo y ABA 30 mM y de Testigo y 10 mM, respectivamente. Los Grupos III 2a solamente está constituido por los polipéptidos característicos en los tratamientos ABA 10 y 20 mM y el III 2b con los polipéptidos presentes en el tratamiento con ABA 30 mM. Para los cultivos de células en suspensión, se conformó inicialmente en el fenograma, la distribución de los grupos como sigue: Grupo I, con polipéptidos asociados al tratamiento de las células expuestas a ABA 3 mM, con la mayor concentración de proteína, seguido del Grupo II, que concentra al resto de los polipéptidos evidenciados. Este a su vez tiene un solo grupo constituido por los polipéptidos comunes en los tratamientos Testigo y ABA 3 y 15 mM; y un Grupo III que se asocia en el Grupo III 1a con los polipéptidos presentes en los tratamientos de ABA 3 mM y 7 mM. El Grupo III 1b asocia los polipéptidos comunes en el tratamiento de ABA 15 mM y el Grupo III 2 conformado por III 2a con los polipéptidos comunes de los tratamientos Testigo, ABA 3 y 15 mM, y el Grupo III 2b con los tratamientos Testigo, ABA 7 y 15 mM.
DISCUSIÓN
Naturaleza de los cultivos in vitro de Fouquieria splendens ssp. breviflora
Gibson (2002), menciona que en los representantes de la familia Fouquieriaceae, durante los períodos de sequía se caen las hojas pequeñas y debajo de ellas se forma una serie de hojas inmaduras de más de 1,5 mm de longitud, conformando un brote cónico sobre el meristemo lateral. Después de una lluvia, las hojas internas reducidas, rápidamente se elongan y forman un fascículo de hojas maduras, dentro de las primeras 48 horas.
Rodriguez y Muñoz (2006) estudiaron la respuesta bioquímica del desarrollo de los brotes foliares de F. splendens ssp. breviflora y concluyeron que esta especie presenta respuestas fisiológicas adaptativas consideradas evidencia de los primeros mecanismos que se dan como respuesta a las condiciones de estrés hídrico, considerándola una especie poikilohídrica. En este estudio, la obtención de material foliar bajo condiciones de invernadero, fue abundante, lo que se atribuye a una respuesta de disponibilidad de agua, lo que indujo la producción de brotes. Lo que se corrobora con lo reportado por Lloyd (1905), quién menciona que los tallos de ocotillo se cubren de hojas rápidamente sin el beneficio del transporte de agua desde las raíces. Los estudios de segmentos de tallos reportados por Killingbeck (1990) indicaron de forma clara que este género Fouquieria no requiere de nutrientes o fitohormonas y la disponibilidad de agua en los tallos, limita la producción foliar. El manejo de plantas leñosas en cultivo de tejidos vegetales, resulta difícil dado el crecimiento secundario que presentan. En esta especie, el tejido parenquimatoso foliar, con el aporte adecuado de hormonas vegetales: BAP y ANA, desarrolló el crecimiento de tejido calloso, de acuerdo también con lo reportado por Franco (1997).
La respuesta morfológica de las células crecidas en medio sólido para los experimentos testigo, así como en los experimentos con tratamientos de ABA, generaron la formación de tejido calloso después del tiempo de exposición. Este tejido calloso, solo bajo las condiciones de adición de ABA determinó un proceso de diferenciación con la formación de brotes; muy similar a las condiciones que se tenían en otras experiencias para la obtención de embriones somáticos (Angoshtari et al., 2009).
En este caso, se puede considerar que las condiciones impuestas por el ABA, fueron las inductoras para que se desencadenaran los procesos de diferenciación del brote, y con ello, asociar que el aporte de agua y/o la presencia de las fitohormonas desempeñan un papel importante en el desarrollo in vitro de las plantas de esta especie, como parte de la respuesta a las condiciones de estrés hídrico en las que se encuentra en forma natural esta especie vegetal.
Respuesta molecular al estrés hídrico en Fouquieria splendens ssp. breviflora: inducción de proteínas en condiciones de cultivo in vitro
Las condiciones de estrés de cualquier índole, pueden provocar cambios en el metabolismo y respuesta de las plantas. El estrés hídrico, entre otras condiciones, es uno de los eventos que promueven la inducción de proteínas que se sugiere, participan en el desarrollo de mecanismos adaptativos a la baja provisión de agua (Rodríguez et al., 2003; Rodríguez et al., 2006). No se conoce nada acerca de la respuesta molecular de Fouquieria a las condiciones de baja provisión de agua, tanto in toto como in vitro.
En este estudio, en los sistemas de cultivos de células en medio sólido y líquido tratado con ABA, se reportan polipéptidos comunes entre los tratamientos; dentro de ellos se tienen los de: 68, 72 y 90 kDa, que pueden considerarse como constitutivos y no inducibles; según Bray (1990) clasificados dentro de la categoría de los no alterados por déficit de agua, con pesos moleculares relativamente mayores (entre 60 y 200 kDa).
Comparando los resultados obtenidos en los cultivos de células con los reportados por Rodríguez-Dorantes y Muñoz-Sánchez (2006) en los brotes foliares de esta especie, se tienen los siguientes polipéptidos de 41, 43, 48, 54, 64, 82, 100 y 120 kDa; resaltando como particular el de 120 kDa que se presentó en el cultivo de células en medio sólido con ABA 20 mM así como también en los tratamientos de brotes foliares con ABA 0,1 mM y polietilenglicol (PEG 8000) al 3 % , y el de 135 kDa, presente en los cultivos de células en medio sólido con ABA 30 mM y reportado también en el tratamiento de los brotes de Fouquieria splendens ssp. breviflora tratados con ABA 0,1 mM.
La aplicación de la técnica electroforética, revela la presencia de heterogeneidad en los perfiles de las bandas de proteínas; ya que los patrones electroforéticos difieren con respecto al número, movilidad e intensidad de las bandas, con lo que esta técnica se ha empleado para caracterizar la respuesta de las plantas bajo diversas condiciones (Leone et al., 1994; Sarker et al., 1996; Abas y Latif, 2005; Beltagi, 2005; Ehsanpour y Razavizadeh, 2005).
Se tiene como evidencia que se presentan cambios en la expresión de genes como respuesta al estrés de desecación y que se sintetizan polipéptidos únicos durante este tipo de estrés (Bray, 1988; Mundy y Chua, 1988). Los cambios en la expresión de genes durante el estrés de sequía, pueden generar cambios significativos en procesos metabólicos de la planta, que promueven la sobrevivencia al estrés hídrico o puede representar un daño como respuesta al estrés. La tasa de polipéptidos acumulados inducidos por la desecación y la pérdida de éstos durante la recuperación de las plantas, pueden ser indicadores importantes de la función de proteínas; conjuntamente con esto, la abundancia de estos polipéptidos puede proveer también de información importante sobre su función. Uno de los papeles que posee el ABA es la modulación de productos génicos específicos (Guerrero y Mullet, 1986; Bray et al., 1997) y en suma la coordinación de la respuesta al estrés (Hanson y Hitz, 1982).
Las proteínas separadas electroforéticamente de los cultivos en suspensión de F. splendens ssp. breviflora tratados con ABA, comparados con testigos, revelaron lo siguiente: una disminución cuantitativa de ciertas proteínas, un incremento en los niveles de otras proteínas, algunas proteínas permanecieron sin cambios y la inducción de novo de proteínas específicas. Los tratamientos con ABA para esta especie fueron particulares en el caso de polipéptidos de 82 kDa y 48 kDa para 15 mM, lo mismo que para 3 mM con los de 68 kDa, 43 kDa y tres de menos de 35 kDa.
Estos resultados comparados con los obtenidos en el estudio realizado por Jiang y Huang (2002) con cultivos de Festuca arundinacea L. (Southeast 6 Rebel Jr.), donde se reporta que se acumularon varios polipéptidos de 20, 29 y 35 kDa y que la intensidad de sus bandas se incrementó durante el estrés de sequía en ambos cultivares de manera específica; el polipéptido de 35 kDa se acumuló solamente en las plantas sometidas al estrés de sequía con o sin la adición de ABA en los tratamientos de ambos cultivares. Así mismo, estudios con Sesbania sesban var. bicolor, reportan que se presentó un polipéptido de 66 kDa que se indujo bajo condiciones de estrés de desecación y con la aplicación exógena de ABA 1 mM (Purty et al., 2005).
Se ha reportado que los mecanismos por los cuales el estrés hídrico y la adición exógena de ABA afectan la tolerancia a la desecación son numerosos y complejos; estos pueden incluir la inducción de algunos polipéptidos y proteínas similares a las dehidrinas (Han et al., 1997), y que se asume que juegan un papel importante en la tolerancia al estrés hídrico. Jiang y Huang (2002) encontraron la acumulación de un polipéptido de 35kDa que se presentó bajo condiciones de desecación y otros dos polipéptidos de 20 y 29 kDa que se presentaron con mayor concentración en las plantas con estrés a la desecación para ambos cultivares. Estos autores mencionan que el estrés de desecación induce cambios en la síntesis de proteínas de F. arundinacea L., de tal forma que los efectos de promoción del ABA sobre el potenciamiento de las actividades fisiológicas bajo estrés de sequía paralelamente fallaron en la inducción de la síntesis de proteínas en esta especie.
Sin embargo, el incremento en la tolerancia a la desecación, resultado de la aplicación de ABA puede no estar relacionado de manera directa con la acumulación de un alto contenido o tipo específico de dehidrinas; finalmente la respuesta entre los dos cultivares no difirió en su respuesta al ABA. En este estudio, no obstante que no se caracterizó de manera particular la masa relativa de los polipéptidos encontrados de < de 35 kDa; se obtuvo la presencia de polipéptidos inducidos bajo condiciones de estrés con ABA de manera independiente. De estos, de manera particular como respuesta, el polipéptido de 68 kDa se presentó en el tratamiento con ABA 3mM, lo mismo que dos polipéptidos de menos de 35 kDa, uno en ABA 3mM y el otro en ABA 7mM.
La demostración de la ambigüedad en los cambios observados en la expresión de proteínas, podría contribuir a la sobrevivencia de las plantas; donde solo algunas de estas proteínas están involucradas en la tolerancia al estrés y es posible que en algunos casos la síntesis de proteínas indique la sensibilidad a un agente estresante más que estar formando parte de un mecanismo de tolerancia. Se presentaron algunos polipéptidos cuyo porcentaje de proteína fue mayor; tal es el caso de los polipéptidos de 64 kDa, ABA 7 mM, con 69, 6 % y uno de < de 35 kDa, ABA 3 mM, con 70, 3%. Si se compara esta respuesta con los estudios realizados con cultivos de células en suspensión de algunos autores (Leone et al., 1994), los polipéptidos inducidos por la presencia de ABA, fueron 16.
En este trabajo, se registró la presencia de polipéptidos inducidos bajo condiciones de estrés, de manera independiente. Lo que sugiere la presencia de proteínas cuya expresión fue análoga a la obtenida en los experimentos con células de Solanum tuberosum. En este estudio, los resultados obtenidos reflejaron que los polipéptidos presentes en ambas condiciones de cultivo fueron en su mayoría menores a 35 kDa (casi el 50 % del total de ambas condiciones y sus tratamientos); lo que se sugiere que éstos pueden ser considerados polipéptidos inducidos por la presencia de ABA, como los reportados por Leone et al. (1994), Singh et al. (1987) y Kuwabara et al. (1999), en cultivos celulares de Solanum tuberosum y Nicotiana tabacum, donde las proteínas obtenidas de 18 a 24 kDa se reportan inducidas bajo condiciones de estrés hídrico, algunas de estas relacionadas con la deshidratación (Close, 1996; Close, 1997).
De acuerdo con la organización de los polipéptidos presentes en las condiciones experimentales analizadas y representados en el análisis numérico; se tiene que los polipéptidos comunes que se presentaron en los cultivos de tejido calloso en sus cuatro tratamientos, se asociaron directamente con la condición de células en suspensión expuestas a ABA 10 mM, seguida la asociación con ABA 20 y 30 mM, quedando aislada la respuesta de la condición de células en suspensión sin la presencia de ABA (Testigo).
CONCLUSIONES
Las condiciones de estrés de cualquier índole, provocan cambios en el metabolismo y respuesta de las plantas; el estrés hídrico, entre otras condiciones, es uno de los eventos que promueven la inducción de proteínas, las cuáles se sugiere, participan en el desarrollo de mecanismos adaptativos a la baja disponibilidad de agua. El desarrollo foliar de esta especie, es un proceso que puede analizarse muy fácilmente, sin necesidad de tener a la planta con su sistema radical, ya que se favorece el transporte de agua y sales a través del tallo, dando el aporte suficiente para desencadenar una respuesta de diferenciación en la zona de las yemas axilares. No se conoce nada acerca de la respuesta molecular del género Fouquieria bajo condiciones de estrés en cultivos in vitro. En este estudio, el manejo de cultivos celulares, evidenció la presencia de polipéptidos inducidos bajo déficit hídrico; esta respuesta manifestó la posibilidad del manejo de sistemas in vitro, como referencia de una simplificación de los mecanismos complejos que deben estar involucrados en la respuesta de las plantas a la sequía; ya que son sistemas controlables y homogéneos que permiten el análisis bajo condiciones ambientales a nivel celular; dentro de estos cambios se observó la expresión diferencial de algunos polipéptidos.
AGRADECIMIENTOS
Los autores agradecen el apoyo financiero otorgado por la Secretaría de Investigación y Posgrado del Instituto Politécnico Nacional al Proyecto de Investigación SIP-IPN: 20151927, para la realización de este trabajo y también a la Comisión de Operación y Fomento de Actividades Académicas (COFAA, I.P.N.), EDI (Estímulo al Desempeño de los Investigadores, I.P.N.) y al Sistema Nacional de Investigadores (SNI-CONACYT).
CONFLICT OF INTEREST
The authors declare that they have no conflict of interest.
REFERENCIAS
Abass SM, Latif HH. Germination and protein patterns of some genotypes of two species ofJute as affected by NaCl stress. Pak J Biol Sci. 2005;8:227-234. Doi:10.3923/pjbs.2005.227.234.
Al-Khayri JM, Al-Bahrany AM. Effect of abscisic acid and polyethylene glycol on the synchronization of somatic embryo development in date palm (Phoenix dactylifera L.). Biotechnology. 2012; 11: 318-325. Doi: 10.3923/biotech.2012.318.325.
Angoshtari R, Tavakkol-Afshari R, Kalantari S, Omidi M. Effects of abscisic acid on somatic embryogenesis and induction of desiccation tolerance in Brassica napus. Asian J Plant Sci. 2009;8:276-284. Doi:10.3923/ajps.2009.276.284.
Attree SH, Moore D, Sawhney VK, Fowke LC. Enhanced maturation and desiccation tolerance of white spruce (Picea glauca (Moench) Voss) somatic embryos: effects of a non-plasmolysing water stress and abscisic acid. Ann Bot. 1991;68:519-552. Doi:10.1093/oxfordjournals.aob.a088291.
Beltagi MS. Phytotoxicity of lead (Pb) to SDS-PAGE protein profile in root nodules of Faba bean (Vicia faba L.) plants. Pak J Biol Sci. 2005;8:687-690. Doi:10.3923/pjbs.2005.687.690.
Bray EA. Drought- and ABA-induced changes in polypeptide and mRNA accumulation in tomato leaves. Plant Physiol. 1988;88:1210-1214. Doi:10.1104/pp.88.4.1210.
Bray EA. Drought-stress-induced polypeptide accumulation in tomato leaves. Plant Cell Environ. 1990;13:531-538. Doi:10.1111/j.1365-3040.1990.tb01069.x.
Bray EA, Cohen A, Plant AL, Moses MS, Imai R, Griffiths A. Regulation of gene expression by endogenous ABA in tomato plants. Acta Physiol Plant. 1997;19:405-418. Doi:10.1007/s11738-997-0037-2.
Close TJ. Debydrins: Emergence ofa biochemical role of a family of plant dehydration proteins. Physiol Plant. 1996;97:795-803. Doi:10.1111/j.1399-3054.1996.tb00546.x.
Close TJ. Dehydrins: A commonalty in the response of plants to dehydration and low temperature. Physiol Plant. 1997;100:291-296. Doi:10.1111/j.1399-3054.1997.tb04785.x.
Ehsanpour AA, Razavizadeh R. Effect of UV-C on drought tolerance of alfalfa (Medicago sativa) callus. Am J Biochem Biotech. 2005;1:107-110. Doi:10.3844/ajbbsp.2005.107.110.
Franco RJ, García CMT. Ensayo demostrativo sobre la propagación de violeta africana Saintpaulia ionantha Wendl. por cultivo de tejidos. Ann Esc Nac Sci Biol. 1995;40:107-115.
Franco RJ. Informe Técnico Final del Proyecto de Investigación: "Cultivo in vitro de Fouquieria splendens ssp. breviflora", 1997; DEPI 963712. I.P.N., México, D.F.
Gibson CA. Ocotillo and the bojum tree. Mildred Mathias Botanical Garden (MEMBG). 2002;3:491-500.
Guerrero F, Mullet JE. Increased ABA biosynthesis during plant dehydration requires transcription. Plant Physiol. 1986;80:588-591. Doi:10.1104/pp.80.2.588.
Hames DB. Peptide mapping by milted proteolysis using SDS-Polyacrylamide Gel Electrophoresis. In: Hames BD and Rickwood D, eds. Gel electrophoresis of proteins (a practical approach) 6° reprinting. IRL Press, Oxford, Washington. 1987.
Han B, Hughes DW, Galau GA, Bewley JD, Kermode AR. Changes in late-embryogenesis-abundant (LEA) messenger RNAs and dehydrins during maturation and premature drying of Ricinus communis L. seeds. Planta. 1997;201:27-35. Doi:10.1007/BF01258677.
Hanson AD, Hitz WD. Metabolic responses of mesophytes to plant water deficits. Ann Rev Plant Physio. 1982;33:163-203. Doi:10.1146/annurev. pp.33.060182.001115.
Henrickson J. Anatomy of periderm and cortex of Fouquieriaceae. Aliso. 1969; 7:97-126.
Henrickson J. A taxonomic revision of the Fouquieriaceae. Aliso. 1972;7:439-537.
Herrera García M, Rodríguez Dorantes AM, Guerrero Zúñiga LA. Evaluación del crecimiento, actividad de hemoperoxidasas y remoción de fenantreno de los cultivos celulares de Fouquieria splendens y Fouquieria fasciculata. Polibotánica. 2008; 25: 101-119.
Jiang Y, Huang B. Protein alterations in tall fescue in response to drought stress and abscisic acid. Crop Sci. 2002;42:202-207. Doi:10.2135/cropsci2002.0202.
Killingbeck KT. Leaf production can be decoupled from root activity in the desert shrub ocotillo (Fouquieria splendens Engelm.). Am Midl Nat. 1990; 124: 124-129. Doi: 10.2307/2426085.
Kuwabara Ch, Arakawa K, Yoshida Sh. Abscisic acid-induced secretory proteins in suspension-cultured cells of winter wheat. Plant Cell Physiol. 1999;40:184-191. Doi:10.1093/oxfordjournals.pcp.a029526.
Lee SC, Lee MY, Kim SJ, Jun SH, An G, Kim SR. Characterization of an abiotic stress-inducible dehydrin gene, OsDhn1, in rice (Oryza sativa L.). Mol. Cells. 2005; 19: 212-218.
Leone A, Costa A, Tucci M, Grillo S. Comparative analysis of short- and long term changes in gene expression causes by low water potential in potato (Solanum tuberosum) cell-suspension cultures. Plant Physiol. 1994;106:703-712. Doi:10.1104/pp.106.2.703.
Lloyd FE. The artificial induction of leaf formation in the ocotillo. Plant World. 1905; 8:56-59.
Lowry OH, Rosenbrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol phenol reagent. J Biol Chem. 1954;193:265-275.
Mundy J, Chua NH. Abscisic acid and water-stress induce the expression of a novel rice gene. EMBO J. 1988; 7: 2279-2286.
Murashige T, Skoog A. A revised medium of rapid growth and bioassays with tobacco tissue. Physiol Plantarum. 1962;15:473-497. Doi:10.1111/j.1399-3054.1962.tb08052.x.
Newton RJ, Sen S, Puryear JD. Solute contribution to osmotic potential loblolly pine (Pinus taeda L.) callus. J Plant Physiol. 1989;134:746-750. Doi:10.1016/S0176-1617(89)80038-0.
Pelah D, Wang W, Altman A, Shoseyov O, Bartels D. Differential accumulation of water stress-related proteins, sucrose synthase and soluble sugars in Populus species that differ in their water stress response. Physiol Plantarum. 1997;99:153-159. Doi:10.1111/j.1399-3054.1997.tb03443.x.
Purty RS, Agrawal V, Gupta SC. Induction of a novel boiling stable protein in response to desiccation and ABA treatments in Sesbania sesban var. bicolor leaves. Biol Plantarum. 2005;49:137-140. Doi:10.1007/s00000-005-7140-1.
Riccardi F, Gazeau P, de Vienne D, Zivy M. Protein changes in response to progressive water deficit in maize. Plant Physiol.1998;117:1253-1263. Doi:10.1104/pp.117.4.1253.
Rodríguez DA. Análisis molecular y fisiológico de la respuesta al estrés hídrico de Fouquieria splendens ssp. breviflora. Tesis de Doctorado. Escuela Nacional de Ciencias Biológicas, I.P.N., México, D.F. 2006.
Rodríguez-Dorantes A, Muñoz-Sánchez JL. Biochemical changes and development of leaf tracheary elements of a desert plant Fouquieria splendens ssp. breviflora exposed to water stress. Physiol Plantarum. 2006;127:650-657. Doi:10.1111/j.1399-3054.2006.00694.x.
Rodríguez-Dorantes AM, García-Castañeda MT, Muñoz-Sánchez JL. Análisis bioquímico y fisiológico de Fouquieria splendens ssp. breviflora bajo la acción de agentes de estrés hídrico. Polibotánica. 2003;16:49-62.
Santos-Díaz MS, Ochoa-Alejo N. PEG-tolerant cell clones of chillipepper: growth, osmotic potentials and solute accumulation. Plant Biol Plantarum. 1994;48:105-108.
Sarker RH, Haque AKMK, Hoque MI. Study of isozyme markers in characterizing Jute germplasm. Bangladesh J Bot. 1996;25:139-145.
Singh NK, La Rosa PC, Handa AK, Hasegawa PM, Bressan RA. Hormonal regulation of protein synthesis associated with salt tolerance in plant cells. Proc Natl Acad Sci U.S.A. 1987;84:739-743. Doi:10.1073/pnas.84.3.739.
Skriver K, Mundy J. Gene expression in response to abscisic acid and osmotic stress. Plant Cell. 1990;2:503-512. Doi:10.1105/tpc.2.6.503
Street HE. Cell suspension cultures techniques. In: H.E. Street (ed.) Plant tissue and cell culture. 2° edition. Botanical Monographs. Chapter 4, Vol. 11. Blackwell Scientific. 1977. 614 p.
Vilardell J, Goday A, Freire MA, Torrent M, Martinez MC, Torné JM, Pagés M. Gene sequence, developmental expression, and protein phosphorylation of RAB-17 in maize. Plant Mol Biol. 1990;14:423-432. Doi:10.1007/BF00028778.
Wang Z, Huang B, Xu Q. Effects of abscisic acid on drought responses of Kentucky bluegrass. J Amer Soc Hort Sci. 2003;128:36-41.
Referencias
Abass SM, Latif HH. Germination and protein patterns of some genotypes of two species of Jute as affected by NaCl stress. Pak J Biol Sci. 2005;8:227-234. Doi:10.3923/pjbs.2005.227.234
Al-Khayri JM, Al-Bahrany AM. Effect of abscisic acid and polyethylene glycol on the synchronization of somatic embryo development in date palm (Phoenix dactylifera L.). Biotechnology. 2012; 11: 318-325. Doi: 10.3923/biotech.2012.318.325
Angoshtari R, Tavakkol-Afshari R, Kalantari S, Omidi M. Effects of abscisic acid on somatic embryogenesis and induction of desiccation tolerance in Brassica napus. Asian J Plant Sci. 2009;8:276-284. Doi:10.3923/ajps.2009.276.284
Attree SH, Moore D, Sawhney VK, Fowke LC. Enhanced maturation and desiccation tolerance of white spruce (Picea glauca (Moench) Voss) somatic embryos: effects of a non-plasmolysing water stress and abscisic acid. Ann Bot. 1991;68:519-552. Doi:10.1093/oxfordjournals.aob.a088291
Beltagi MS. Phytotoxicity of lead (Pb) to SDS-PAGE protein profile in root nodules of Faba bean (Vicia faba L.) plants. Pak J Biol Sci. 2005;8:687-690. Doi:10.3923/pjbs.2005.687.690
Bray EA. Drought- and ABA-induced changes in polypeptide and mRNA accumulation in tomato leaves. Plant Physiol. 1988;88:1210-1214. Doi:10.1104/pp.88.4.1210
Bray EA. Drought-stress-induced polypeptide accumulation in tomato leaves. Plant Cell Environ. 1990;13:531-538. Doi:10.1111/j.1365-3040.1990.tb01069.x
Bray EA, Cohen A, Plant AL, Moses MS, Imai R, Griffiths A. Regulation of gene expression by endogenous ABA in tomato plants. Acta Physiol Plant. 1997;19:405-418. Doi:10.1007/s11738-997-0037-2
Close TJ. Debydrins: Emergence of a biochemical role of a family of plant dehydration proteins. Physiol Plant. 1996;97:795-803. Doi:10.1111/j.1399-3054.1996.tb00546.x
Ehsanpour AA, Razavizadeh R. Effect of UV-C on drought tolerance of alfalfa (Medicago sativa) callus. Am J Biochem Biotech. 2005;1:107-110. Doi:10.3844/ajbbsp.2005.107.110
Franco RJ, García CMT. Ensayo demostrativo sobre la propagación de violeta africana Saintpaulia ionantha Wendl. por cultivo de tejidos. Ann Esc Nac Sci Biol. 1995;40:107-115.
Franco RJ. Informe Técnico Final del Proyecto de Investigación: "Cultivo in vitro de Fouquieria splendens ssp. breviflora", 1997; DEPI 963712. I.P.N., México, D.F.
Gibson CA. Ocotillo and the bojum tree. Mildred Mathias Botanical Garden (MEMBG). 2002;3:491-500.
Guerrero F, Mullet JE. Increased ABA biosynthesis during plant dehydration requires transcription. Plant Physiol.1986;80:588-591. Doi:10.1104/pp.80.2.588
Hames DB. Peptide mapping by milted proteolysis using SDS-Polyacrylamide Gel Electrophoresis. In: Hames BD and Rickwood D, eds. Gel electrophoresis of proteins (a practical approach) 6º reprinting. IRL Press, Oxford, Washington. 1987.
Han B, Hughes DW, Galau GA, Bewley JD, Kermode AR. Changes in late-embryogenesis-abundant (LEA) messenger RNAs and dehydrins during maturation and premature drying of Ricinus communis L. seeds. Planta. 1997;201:27-35. Doi:10.1007/BF01258677
Hanson AD, Hitz WD. Metabolic responses of mesophytes to plant water deficits. Ann Rev Plant Physio.1982;33:163-203. Doi:10.1146/annurev.pp.33.060182.001115
Henrickson J. Anatomy of periderm and cortex of Fouquieriaceae. Aliso. 1969; 7:97-126.
Henrickson J. A taxonomic revision of the Fouquieriaceae. Aliso. 1972;7:439-537.
Jiang Y, Huang B. Protein alterations in tall fescue in response to drought stress and abscisic acid. Crop Sci. 2002;42:202-207. Doi:10.2135/cropsci2002.0202
Kuwabara Ch, Arakawa K, Yoshida Sh. Abscisic acid-induced secretory proteins in suspension-cultured cells of winter wheat. Plant Cell Physiol. 1999;40:184-191. Doi:10.1093/oxfordjournals.pcp.a029526
Lee SC, Lee MY, Kim SJ, Jun SH, An G, Kim SR. Characterization of an abiotic stress-inducible dehydrin gene, OsDhn1, in rice (Oryza sativa L.). Mol. Cells. 2005; 19: 212-218.
Leone A, Costa A, Tucci M, Grillo S. Comparative analysis of short- and long term changes in gene expression causes by low water potential in potato (Solanum tuberosum) cell-suspension cultures. Plant Physiol. 1994;106:703-712. Doi:10.1104/pp.106.2.703
Lowry OH, Rosenbrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol phenol reagent. J Biol Chem. 1954;193:265-275.
Murashige T, Skoog A. A revised medium of rapid growth and bioassays with tobacco tissue. Physiol Plantarum. 1962;15:473-497. Doi:10.1111/j.1399-3054.1962.tb08052.x
Newton RJ, Sen S, Puryear JD. Solute contribution to osmotic potential loblolly pine (Pinus taeda L.) callus. J Plant Physiol. 1989;134:746-750. Doi:10.1016/S0176-1617(89)80038-0
Pelah D, Wang W, Altman A, Shoseyov O, Bartels D. Differential accumulation of water stress-related proteins, sucrose synthase and soluble sugars in Populus species that differ in their water stress response. Physiol Plantarum. 1997;99:153-159. Doi:10.1111/j.1399-3054.1997.tb03443.x
Purty RS, Agrawal V, Gupta SC. Induction of a novel boiling stable protein in response to desiccation and ABA treatments in Sesbania sesban var. bicolor leaves. Biol Plantarum. 2005;49:137-140. Doi:10.1007/s00000-005-7140-1
Riccardi F, Gazeau P, de Vienne D, Zivy M. Protein changes in response to progressive water deficit in maize. Plant Physiol.1998;117:1253–1263. Doi:10.1104/pp.117.4.1253
Rodríguez DA. Análisis molecular y fisiológico de la respuesta al estrés hídrico de Fouquieria splendens ssp. breviflora. Tesis de Doctorado. Escuela Nacional de Ciencias Biológicas, I.P.N., México, D.F. 2006.
Rodríguez-Dorantes A, Muñoz-Sánchez JL. Biochemical changes and development of leaf tracheary elements of a desert plant Fouquieria splendens ssp. breviflora exposed to water stress. Physiol Plantarum. 2006;127:650-657. Doi:10.1111/j.1399-3054.2006.00694.x
Rodríguez-Dorantes AM, García-Castañeda MT, Muñoz-Sánchez JL. Análisis bioquímico y fisiológico de Fouquieria splendens ssp. breviflora bajo la acción de agentes de estrés hídrico. Polibotánica. 2003;16:49-62.
Santos-Díaz MS, Ochoa-Alejo N. PEG-tolerant cell clones of chillipepper: growth, osmotic potentials and solute accumulation. Plant Biol Plantarum. 1994;48:105-108.
Sarker RH, Haque AKMK, Hoque MI. Study of isozyme markers in characterizing Jute germplasm. Bangladesh J Bot. 1996;25:139-145.
Singh NK, La Rosa PC, Handa AK, Hasegawa PM, Bressan RA. Hormonal regulation of protein synthesis associated with salt tolerance in plant cells. Proc Natl Acad Sci U.S.A. 1987;84:739-743. Doi:10.1073/pnas.84.3.739
Skriver K, Mundy J. Gene expression in response to abscisic acid and osmotic stress. Plant Cell. 1990;2:503-512. Doi:10.1105/tpc.2.6.503
Street HE. Cell suspension cultures techniques. In: H.E. Street (ed.) Plant tissue and cell culture. 2º edition. Botanical Monographs. Chapter 4, Vol. 11. Blackwell Scientific. 1977. 614 p.
Vilardell J, Goday A, Freire MA, Torrent M, Martinez MC, Torné JM, Pagés M. Gene sequence, developmental expression, and protein phosphorylation of RAB-17 in maize. Plant Mol Biol. 1990;14:423-432. Doi:10.1007/BF00028778
Wang Z, Huang B, Xu Q. Effects of abscisic acid on drought responses of Kentucky bluegrass. J Amer Soc Hort Sci. 2003;128:36-41.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Leon Raul Hernandez Ochoa, Lenín Omar Nevárez Prado, Beatriz A. Rocha Gutiérrez, David Néder Suárez , María Teresa Córdova Lozoya, Juan Guillermo Ayala Soto, Mayra Isabel Salazar Balderrama, Teresita de Jesús Ruiz Anchondo. (2021). El género Fouquieria: una revisión de aspectos etnobotánicos, fitoquímica y actividad biológica. TECNOCIENCIA Chihuahua, 15(3), p.76. https://doi.org/10.54167/tecnociencia.v15i3.840.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).