Murciélagos dispersores de semillas en gradientes sucesionales de la Orinoquia (San Martín, Meta, Colombia).
Seed Dispersal by Bats Over Successional Gradients in the Colombian Orinoquia (San Martin, Meta, Colombia)
DOI:
https://doi.org/10.15446/abc.v22n3.63561Palabras clave:
gremios tróficos, quiróptera, restauración ecológica, sucesión. (es)Chiroptera, ecological restoration, succession, trophic guilds. (en)
Descargas
La dispersión de semillas por fauna juega un papel fundamental en la reproducción vegetal. Los murciélagos son unos de los dispersores de semillas más importantes en los ecosistemas neotropicales. El objetivo en esta investigación fue describir la comunidad de murciélagos y las semillas que potencialmente dispersan, en el gradiente sucesional (sabana, arbustal, borde de bosque y bosque ripario), de una localidad de la altillanura colombiana. Se midió abundancia, riqueza, diversidad de murciélagos y las semillas de sus heces. Se capturaron 534 individuos pertenecientes a cuatro familias y 39 especies. Las especies más abundantes fueron Carollia perspicillata, Artibeus obscurus y Molossus molossus. C. perspicillata y A. obscurus presentaron los mayores valores en el índice de dispersión de semillas (DII). Los registros pertenecen a seis gremios, siendo más abundantes los frugívoros (sedentarios y nómadas). El hábitat con mayor abundancia y riqueza de especies de murciélagos fue el borde de bosque. Se recolectaron un total de 11808 semillas, siendo Cecropia engleriana la especie más abundante. Los estados sucesionales difieren significativamente en abundancia de semillas, mas no en riqueza; mostrando dominancia de determinados géneros de semillas. Se resalta el arbustal como dinamizador de la sucesión, con un flujo potencial de semillas diversas, donde los murciélagos juegan un papel clave para su dispersión, pues aquellos que vuelan sobre las áreas abiertas tienen la misma carga de semillas para dispersar que los hallados en el bosque, evidenciando un potencial de regeneración coadyuvado por una comunidad de murciélagos con una estructura diversa en grupos tróficos y especies.
Faunal seed dispersal plays a fundamental role in plant reproduction. Bats are one of the most important seed dispersers in Neotropical ecosystems. The objective of this research was to describe the bat community and seeds that are potentially dispersed in a successional gradient (savanna, woods, forest edge and riparian forest) in a locality of the Colombian Altillanura. We measured abundance, richness, and diversity of bats and the seeds found in their feces. 534 individuals belonging to four families and 39 species were captured. The most abundant species were Carollia perspicillata, Artibeus obscurus and Molossus molossus. C. perspicillata and A. obscurus presented the highest values in the seed dispersion index (DII). The records belong to six guilds, the most abundant being frugivores (sedentary and nomadic). The habitat with the greatest bat abundance and richness of species was the forest edge. A total of 11808 seeds with Cecropia engleriana were collected as the most abundant species. Successional states differed significantly in seed abundance but not in wealth, and certain genera showed dominance. Shrubs were highlighted for their dynamic succession and a potential flow of diverse seeds. Here bats play a fundamental role in seed dispersal since those flying over open areas have the same seed load for dispersal as those found in forest, exhibiting a regeneration potential that is contributed to by a bat community having a diverse structure in trophic groups and species.
Recibido: 26 de marzo de 2017; Revisión recibida: 20 de mayo de 2017; Aceptado: 31 de mayo de 2017
RESUMEN
La dispersión de semillas por fauna juega un papel fundamental en la reproducción vegetal. Los murciélagos son unos de los dispersores de semillas más importantes en los ecosistemas neotropicales. El objetivo en esta investigación fue describir la comunidad de murciélagos y las semillas que potencialmente dispersan, en el gradiente sucesional (sabana, arbustal, borde de bosque y bosque ripario), de una localidad de la altillanura colombiana. Se midió abundancia, riqueza, diversidad de murciélagos y las semillas de sus heces. Se capturaron 534 individuos pertenecientes a cuatro familias y 39 especies. Las especies más abundantes fueron Carollia perspicillata, Artibeus obscurus y Molossus molossus. C. perspicillata y A. obscurus presentaron los mayores valores en el índice de dispersión de semillas (DII). Los registros pertenecen a seis gremios, siendo más abundantes los frugívoros (sedentarios y nómadas). El hábitat con mayor abundancia y riqueza de especies de murciélagos fue el borde de bosque. Se recolectaron un total de 11808 semillas, siendo Cecropia engleriana la especie más abundante. Los estados sucesionales difieren significativamente en abundancia de semillas, mas no en riqueza; mostrando dominancia de determinados géneros de semillas. Se resalta el arbustal como dinamizador de la sucesión, con un flujo potencial de semillas diversas, donde los murciélagos juegan un papel clave para su dispersión, pues aquellos que vuelan sobre las áreas abiertas tienen la misma carga de semillas para dispersar que los hallados en el bosque, evidenciando un potencial de regeneración coadyuvado por una comunidad de murciélagos con una estructura diversa en grupos tróficos y especies.
Palabras clave:
gremios tróficos, quiróptera, restauración ecológica, sucesión.ABSTRACT
Faunal seed dispersal plays a fundamental role in plant reproduction. Bats are one of the most important seed dispersers in Neotropical ecosystems. The objective of this research was to describe the bat community and seeds that are potentially dispersed in a successional gradient (savanna, woods, forest edge and riparian forest) in a locality of the Colombian Altillanura. We measured abundance, richness, and diversity of bats and the seeds found in their feces. 534 individuals belonging to four families and 39 species were captured. The most abundant species were Carollia perspicillata, Artibeus obscurus and Molossus molossus. C. perspicillata and A. obscurus presented the highest values in the seed dispersion index (DII). The records belong to six guilds, the most abundant being frugivores (sedentary and nomadic). The habitat with the greatest bat abundance and richness of species was the forest edge. A total of 11808 seeds with Cecropia engleriana were collected as the most abundant species. Successional states differed significantly in seed abundance but not in wealth, and certain genera showed dominance. Shrubs were highlighted for their dynamic succession and a potential flow of diverse seeds. Here bats play a fundamental role in seed dispersal since those flying over open areas have the same seed load for dispersal as those found in forest, exhibiting a regeneration potential that is contributed to by a bat community having a diverse structure in trophic groups and species.
Keywords:
Chiroptera, ecological restoration, succession, trophic guilds.INTRODUCCIÓN
Los murciélagos son abundantes en los ecosistemas neotropicales y poseen una nutrida gama de variaciones morfológicas, conforman un grupo diverso que integra una gran variedad de gremios tróficos, tipos de refugio y hábitats (Kalko, 1998), dentro de estos, la familia Phyllostomidae (murciélagos de hoja nasal), es la más diversa. Colombia es el segundo país con mayor riqueza de murciélagos con 207 especies, que corresponden a cerca del 40 % de las especies de mamíferos registradas para el país (Solari et al., 2013; Mantilla-Meluk y Montenegro, 2016; Ramírez-Chávez et al., 2016; Molinari et al., 2017). Sólo en la región de la Orinoquia colombiana se encuentran 114 especies, 55 % de los murciélagos del país (Pardo y Rangel-Ch, 2014).
Entre 70 - 98 % de las especies de árboles de los bosques de las tierras bajas tropicales producen semillas y frutos con adaptaciones para ser dispersadas por zoocoria, muchas de ellas distribuidas dentro y fuera de los bosques, favorecidas por los movimientos de los animales (Howe, 1984; Terborgh et al., 2002). Los murciélagos han generado importantes mutualismos para la biología reproductiva de algunas plantas neotropicales (Fleming y Heithaus, 1981). Los frutos consumidos por los murciélagos tienen variadas adaptaciones morfológicas para atraerlos (Fleming, 2005), se caracterizan por tener colores poco llamativos, como verde o café, y olores fuertes (Kalko et al., 1996). Por su parte, se reconoce que los murciélagos utilizan tanto el olfato como la ecolocación para detectar los frutos maduros (Thies et al., 1998). El paso de las semillas por el tracto digestivo de los murciélagos y la eliminación de la pulpa, aumenta su probabilidad de germinación y disminuye la probabilidad de que sean depredados o infectados por hongos (Lobova et al., 2009), convirtiéndose en un componente clave en la regeneración de los bosques y la preservación de la diversidad de la flora en el Neotrópico (Kalko, 1997).
Los murciélagos frugívoros neotropicales pueden ser percibidos como muy tolerantes a la fragmentación del bosque y excelentes modelos de dispersión de semillas a larga distancia, en áreas abiertas donde otros dispersores no llegan; ya que muchos de ellos dispersan regularmente frutos de plantas características de los primeros estadios sucesionales, que crecen en los bordes del bosque y en parches con vegetación en regeneración (Ludica y Bonaccorso, 1997). Las plantas más abundantes dispersadas por murciélagos en el Neotrópico son de los géneros Cecropia, Ficus, Piper, Solanum y Vismia (Fleming, 1988). Otros murciélagos con mayor grado de especialización de recursos, suelen alimentarse en el dosel, y se encuentran fuertemente asociados con bosques maduros. No obstante, con frecuencia dichas especies penetran en las zonas perturbadas (Casallas-Pabón, 2009), permitiendo el flujo de semillas y el avance de la sucesión, lo que implica un importante papel ecológico en los claros, donde la dispersión de semillas por murciélagos suele ser mayor que la de las aves, los primates y otros mamíferos (Charles-Dominique, 1986; Medellín y Gaona, 1999).
Considerando que cada estado sucesional del ecosistema brinda recursos diferentes para los murciélagos, se esperaría que la comunidad de murciélagos presente un comportamiento característico de acuerdo al estado sucesional en el que se encuentre la vegetación. El objetivo en esta investigación fue describir la composición de la comunidad de murciélagos y las semillas potencialmente dispersadas por ellos, en el gradiente sucesional entre sabanas disectadas y bosques riparios de una localidad del piedemonte llanero colombiano.
MATERIALES Y MÉTODOS
Área de estudio
La Orinoquia se sitúa entre los Andes y el Escudo Guyanés. La unidad paisajística predominante es la de tierras planas u onduladas con formaciones de sabanas herbáceas y mixtas (Rudas, 2009). Posee tres subregiones, definidas por su fisiografía y composición florística: llanura aluvial, altillanura y piedemonte (Pardo y Rangel-Ch, 2014). La formación de sabanas se debe a factores edáficos y climáticos, así como una dinámica de fuegos naturales. La sucesión avanza de sabana pastizal (ausencia de elementos leñosos) hasta sabana cerrada (donde los árboles constituyen un elemento importante), incluso hasta arbustal y finalmente bosque en sitios específicos (Monasterio, 1970). En el presente trabajo se asumen los pastizales (sabanas y potreros), como un estado basal en la trayectoria sucesional de este ecosistema, que posee características ecológicas y de recursos equiparables para los murciélagos; en especial las sabanas intervenidas para la generación de potreros cultivados.
Esta investigación se desarrolló en los bosques de piedemonte y sabanas disectadas de las Reservas Naturales "Las Unamas/Rey Zamuro", municipio de San Martín (Meta), en la cuenca del río Camoa, a 130 km de Villavicencio, entre los 3° 31' y los 3° 35' N y los 73° 23' y los 73° 29' W con una elevación entre 260 y 300 m s.n.m., temperatura media de 25,6 °C y una precipitación anual promedio de 2513 mm (IDEAM 2016). El río Metica, uno de los principales de la zona, recibe aguas de diferentes tributarios del interior de las reservas, entre ellos los ríos Camoa, Chunaipo y Cumaral, estos últimos delimitan el área de estudio, que cuenta con una extensión aproximada de 7000 ha, ideal para un trabajo a escala de paisaje. El 60 % del área de estudio está cubierta por sabanas naturales y pastos introducidos, el 40 % restante por bosque de galería y pequeños núcleos de bosque aislados en la sabana como matas de monte y arbustales.
Métodos de campo
Se muestrearon cuatro diferentes estados sucesionales: pastizales, arbustales, borde de bosque y bosque ripario, realizando 16 salidas de campo entre noviembre de 2011 hasta septiembre de 2014, aproximadamente cada dos meses, para un total de 68 noches de muestreo. Se instalaron diez redes de niebla (12 x 3 m, con ojo de malla de 1,5 x 1,5 cm) entre las 17:30 y las 23:00 horas. A todos los individuos capturados se les registraron las dimensiones morfométricas siguiendo a Nagorsen y Peterson (1980). Se ha reportado que el tiempo promedio de tránsito intestinal de los murciélagos frugívoros es de 15-30 minutos (Fleming, 1988), por lo tanto, cada murciélago se dejó por un lapso de 30-60 minutos en una bolsa de tela, para recuperar las semillas del guano. Posteriormente se liberaron en el sitio de captura luego de ser marcados en el plagiopatagio derecho utilizando un tatuador. Se usó un plástico de 2 x 12 m bajo las redes, para evitar la pérdida de las excretas que caían al momento de liberar cada individuo de la red; del plástico sólo se recuperaron las excretas asociadas a los individuos manipulados en el momento. Para la determinación de los especímenes, se siguió la taxonomía y la clave de Gardner (2008). El arreglo sistemático siguió la más reciente revisión de los mamíferos de Colombia de Solari et al. (2013), y para los gremios tróficos se siguió la propuesta de Soriano (2000).
Análisis de datos
Se calculó el esfuerzo de muestreo Em=m2h y el éxito de captura Ec=Ni/Em*100 donde: Ni= Número de capturas (Straube y Bianconi, 2002). Se estandarizaron los esfuerzos de muestreo, trabajando 17 noches en promedio por cada estado sucesional evaluado, en toda la extensión del área de estudio. Se realizó una curva de acumulación de especies, evaluando los datos observados S(est) y los estimadores de riqueza Bootstrap, Chao 1 y Jacknife 1, así como las especies únicas (Singletons). Se evaluó la diversidad con el índice de equidad (Shannon H') y el número de Hill 1 (Hill, 1973; Heip et al, 1998), calculados como 1H = exp(H'), donde H' es el valor de la función de Shannon-Wiener. Este último cuenta con una ventaja frente a otros índices, al expresar la diversidad mediante una comparación directa entre comunidades (Pereyra y Moreno, 2013). Se analizaron las curvas de rango-abundancia para comparar la composición, abundancia y la uniformidad de especies en los diferentes estados sucesionales (Feinsinger, 2001), comparando con Kolmogorov-Smirnov la distribución entre estados sucesionales, con Val -p y Val-D, como estadísticos de contraste (Magurran, 2004). Se estimó el coeficiente de similitud de Sorensen entre los estados sucesionales, con agrupamiento jerárquico acorde al método de la varianza mínima sensu Ward (1963). Todo lo anterior usando los programas EstimateS 9.1.0 (Colwell, 2013) y R (R Development Core Team, 2010).
El registrar una especie de semilla en las excretas de los murciélagos capturados en un determinado estado sucesional, no es indicativo per se de dispersión, pero evidencia una carga de semillas potencial para ser depositada en dicho ecosistema. Para identificar la especie de murciélago con mayor potencial de dispersión de semillas, se calculó el Indice de dispersión, DII=(S*B)/1000; donde S es el porcentaje de semillas encontradas en las muestras para cada especie de murciélago y B es la abundancia relativa de las especies capturadas. El rango de valores del DII es entre 0 y 10, donde 0 se interpreta como ninguna de las semillas en las muestras fecales de alguna especie en particular y 10 representa que dicha especie es la única que dispersa todas las semillas (Galindo-González et al., 2000).
Se evaluó la diferencia de la riqueza de las especies de semillas entre estados sucesionales, para esto se calculó la homogeneidad de varianza a través de la prueba de Levene. Al no presentar normalidad, se realizó la prueba de Kruskal Wallis. Así mismo, se buscaron diferencias significativas en términos de abundancia de semillas entre los estados sucesionales, mediante la prueba de Levene (previa transformación , con la corrección de Welch (1951) para un ANOVA en presencia de heterogeneidad); y la prueba de comparaciones múltiples de Games-Howell (Toothaker, 1993), (con corrección por presencia de heterocedasticidad), evaluando todas las posibles combinaciones para encontrar diferencias significativas entre los estados sucesionales. Por último, mediante la prueba de independencia ji-cuadrado se evaluó la dependencia de la abundancia de semillas, entre la cobertura vegetal y el género de la planta.
, con la corrección de Welch (1951) para un ANOVA en presencia de heterogeneidad); y la prueba de comparaciones múltiples de Games-Howell (Toothaker, 1993), (con corrección por presencia de heterocedasticidad), evaluando todas las posibles combinaciones para encontrar diferencias significativas entre los estados sucesionales. Por último, mediante la prueba de independencia ji-cuadrado se evaluó la dependencia de la abundancia de semillas, entre la cobertura vegetal y el género de la planta.
RESULTADOS
Diversidad de murciélagos
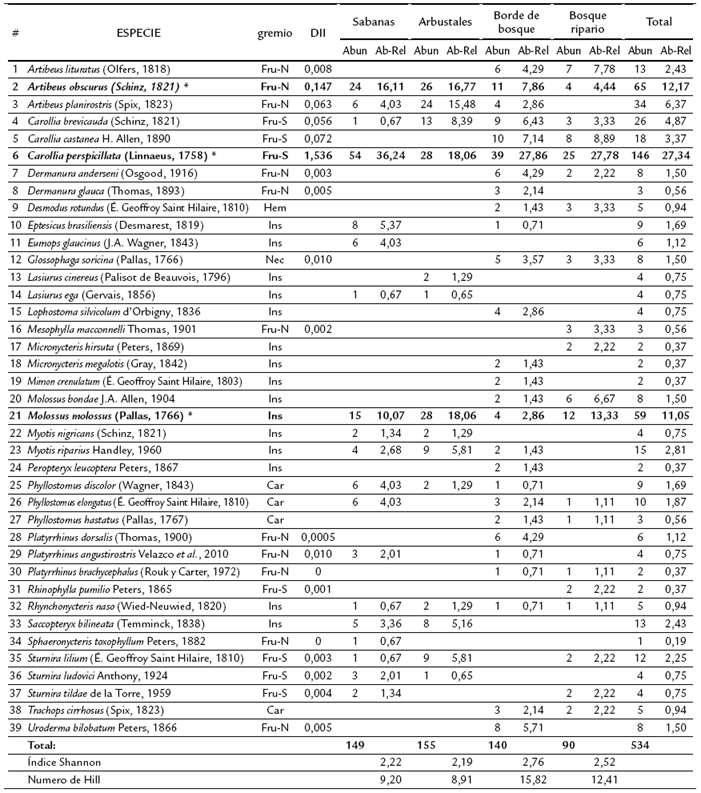
El esfuerzo total de muestreo fue de 159120 m2red*h y se obtuvo un éxito de captura de 0,336 individuos/m2red*h. En total se capturaron 534 murciélagos pertenecientes a cuatro familias, 24 géneros y 39 especies (Tabla 1). La especie más frecuente en el muestreo fue Carollia perspicillata (Linnaeus, 1758) (27 % de las capturas), seguida por Artibeus obscurus (Schinz, 1821) (12 %) y Molossus molossus (Pallas, 1766) (11 %). Las tres especies fueron registradas en los cuatro hábitats muestreados. Vale la pena resaltar la presencia de Sphaeronycteris toxophyllum Peters, 1882, capturado en la sabana. Este murciélago frugívoro suele encontrarse en zonas de bosques amazónicos densos conservados, así como en sabanas naturales y bosques riparios orinocences, entre otros (Tavares y Lewis, 2008). Es una especie frugívora especialista (Angulo et al., 2008), poco común, con bajas abundancias dadas las restricciones de su dieta, que dependen de la disponibilidad de los frutos que consumen, al igual que la de otros murciélagos frugívoros pequeños (Kalko, 1998) como Mesophylla macconnelli Thomas, 1901, Dermanura sp., Uroderma bilobatum Peters, 1866 y Platyrrhinus angustirostris Velazco, Gardner y Paterson, 2010, también reportados es este estudio.
Abun: Abundancia General. Ab-Rel: Abundancia Relativa. Fru-N: frugivoros nómadas, Fru-S: Frugívoros sedentários. Car: Carnívoros. Ins: Insectívoros. Nec: Nectarívoros. Hem: Hematófagos.Tabla 1: Abundancia absoluta y abundancia relativa de murciélagos en cuatro estados sucesionales en los Llanos orientales Colombianos.
Los individuos capturados se agruparon en seis gremios, más de la mitad (67,23 %) corresponden a frugívoros ya sean sedentarios (39,70 %) o nómadas (27,53 %) y los demás se agruparon dentro de las categorías de insectívoros (25,28 %), carnívoros (5,06 %), nectarívoros (1,50 %) y hematófagos (0,94 %). Los frugívoros sedentarios se registraron mayoritariamente en los estados sucesionales de sabana (40,9 %), borde de bosque (41,4 %) y bosque ripario (46,7 %) donde fueron el grupo mejor representado, mientras que en los arbustales la distribución de gremios estuvo pareja entre frugívoros sedentarios, nómadas e insectívoros. En los arbustales aun cuando predominaron los insectívoros (33,5 %), éstos se encontraron casi en igual proporción que los frugívoros sedentarios (32,9 %) y los frugívoros nómadas (32,3 %).
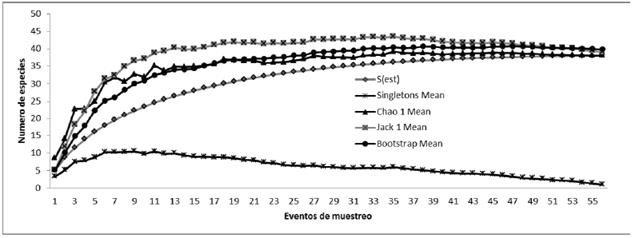
La curva de acumulación de especies para todo el estudio alcanzó la asíntota, lo cual indica que se realizó un muestreo completo. Este resultado se confirmó ya que se capturaron 39 especies de las 39-40 esperadas según los estimadores de riqueza (Fig. 1). La diversidad y equidad más alta fue hallada en el borde de bosque, según los índices de dominancia y equidad de Shannon y el número de Hill 1, (H' = 2,76, Hill = 15,82) (Tabla 1). El bosque ripario le siguió en diversidad y equidad al borde del bosque (Fig. 1).
Figura 1: Curva de acumulación de especies de murciélagos y su respectiva representatividad para todos los estados sucesionales.
Al comparar las curvas de rango abundancia entre los cuatro estados sucesionales, estos exhibieron una alta uniformidad (Tabla 2), donde la prueba de Kolmogorov-Smirnov, indicó que ninguna de las distribuciones presenta diferencias significativas entre sí (p < 0,05). El estadístico de contraste D, corroboró el análisis en el mismo sentido (Fig. 2). Por su parte los análisis de similitud entre curvas de rango abundancia de murciélagos indican asociaciones entre los estados sucesionales de áreas abiertas con una menor complejidad vegetal, las sabanas y los arbustales (Is = 0,813) a diferencia de los estados sucesionales de borde de bosque y bosque ripario (Is = 0,638).
Kormogorov-Smirnov: Con estadísticos Valor D, Dα= 0,31-0,36. Games-Howell: con estadísticos valor t. Valor p con α=0,05. 3 g.lTabla 2: Evaluación del comportamiento de rango abundancia, mediante Kormogorov-Smirnov, y Prueba de Games-Howell buscando diferencias significativas, para cuatro estados sucesionales en los Llanos orientales Colombianos.

Figura 2: Curvas de rango-abundancia. La numeración de las especies se puede consultar en la Tabla 1.
SEMILLAS EN HECES DE MURCIÉLAGOS
Se recolectaron 318 muestras fecales de los murciélagos capturados, de las cuales 234 (73,5 %) pertenecían a murciélagos frugívoros. En 150 (64,1 %) de las muestras se encontraron semillas consumidas por estos animales. Las especies de murciélagos que más muestras proporcionaron fueron C. perspicillata con 61 (40,7 % de las plantas reportadas en este estudio) y A. obscurus con 20 (13,3 %). Estas dos últimas presentaron los mayores valores en el índice de dispersión (DII) con 1,536 y 0,147 respectivamente (Tabla 1). Así mismo las especies de murciélagos que mayor abundancia de semillas presentaron fueron C. persicillata con 4685 (39,7 %) A. obscurus 1366 (11,6 %), Artibeus planirostris (Spix, 1823), 1 123 (9,5 %) y Carollia brevicauda (Schinz, 1821), 1100 (9,6 %).
Los estados sucesionales con mayor riqueza de semillas son el bosque ripario y el borde bosque con 22 (75,9 %) y 21 (72,4 %) especies, seguido por los arbustos con 14 (48,3 %) especies y finalmente las sabanas con 13 (44,8 %) especies. Por su parte el estado sucesional con mayor abundancia de semillas fueron los arbustales y el borde de bosque con 5027 (42,6 %) y 2802 (23,7 %) respectivamente, seguido de sabanas y bosque ripario con 2180 (15,2 %) y 1799 (18,5 %) (Tabla 3).
*Las especies de murciélagos corresponden a la numeración de la Tabla 1.Tabla 3: Semillas encontradas en las muestras fecales de murciélagos y sus abundancias relativas en cuatro estados sucesionales en los Llanos orientales colombianos.

Las especies de plantas preferidas por los murciélagos en este estudio fueron Cecropia engleriana Snethl., Philodendron sp., Piper marginatum Jacq. y Vismia japurensis Rchb.. En general el género de planta con mayor frecuencia de aparición en las heces de los murciélagos fue Cecropia (32.79 %), seguido por Piper (26.69 %) y Vismia (20,75 %) (Tabla 3). No obstante, de acuerdo al estado sucesional se encontró una dominancia de determinados géneros de semillas en las heces. El 46,3 % de las muestras de Cecropia, fueron reportadas de murciélagos al interior del arbustal donde se presentó el 85,7 % de la abundancia de este género. Mientras que un 34,2 % de las muestras del género Piper se reportaron en el borde de bosque aportando un 48,9 % de la abundancia de semillas de este género. Por su parte el 26,1 % de las muestras en las sabanas correspondieron al género Vismia que aportó un 58,3 % de la abundancia en este estado sucesional. Finalmente, en el bosque ripario dominaron los géneros Piper y Ficus con 16,2 % y 54,2 % respectivamente. La prueba de independencia ji-cuadrado entre género de planta y el estado sucesional, rechazó la hipótesis nula de independencia (X2 = 9252,4; p = 2.2*e^[-16]. 15 g.l). Por tanto, indica que en términos de abundancia existe cierta dependencia entre el género de planta y el estado sucesional.
Con respecto a la diferencia en riqueza de especies de semillas entre estados sucesionales, la prueba de Levene para la homogeneidad de varianza, no rechazó la hipótesis nula de homogeneidad (0,1935, p = 0,9001, 3 g.l), mostrando que no hay normalidad en datos. La prueba de Kruskal Wallis no rechazó Ho, (4,0087, p = 0,2605, 3 g.l), concluyendo así que en términos de riqueza de semillas colectadas, no existen diferencias significativas entre los estados sucesionales.
Por su parte, la diferencia en abundancia de semillas entre los estados sucesionales que arroja la prueba de Levene, rechazó Ho de homogeneidad de varianzas (6,3569, p = 0,0005, 3 g.l). La ANOVA con corrección sensu Welch (1951) rechazó Ho (4,2507 p= 0,0093, 3 g.l), concluyendo así que existen diferencias significativas entre los estados sucesionales en términos de abundancia. Por ello se aplicó la prueba de Games-Howell (Tabla 2), la cual rechazó Ho al comparar arbustales con borde de bosque (p = 0,033) y arbustales con bosque ripario (p = 0,011), siendo estos los estados sucesionales estadísticamente diferentes en términos de abundancia de semillas.
DISCUSIÓN
En los estados sucesionales de las R.N. "Las Unamas / Rey Zamuro", se presentaron dos tendencias de comportamiento en la comunidad de murciélagos, por un lado, las sabanas y arbustales, y por otro el bosque ripario y el borde de bosque. La diversidad de murciélagos se relaciona con la complejidad, estructura y composición vegetal, aumentando a medida que la sucesión progresa (de pastizal a arbustal, de allí a borde de bosque y finalmente hacia bosque ripario), y ofrece mayores nichos para los murciélagos con una mayor disponibilidad de recursos (Estrada-Villegas et al., 2007).
En los arbustales, se reportó una comunidad con altas abundancias de murciélagos; mientras que en el borde de bosque los frugívoros presentaron las mayores abundancias, riquezas y diversidades. Los estados sucesionales con coberturas boscosas mostraron mayor diversidad funcional de murciélagos. Si bien, la complejidad vegetal no es el único patrón determinante en las variaciones de las comunidades al interior de los estados sucesionales (Flores-Saldaña, 2008), si dirige el comportamiento de las mismas moldeando las tendencias en función de la disponibilidad de recursos, la movilidad vertical y horizontal, la capacidad de vuelo de los animales y las distancias entre tipos de cobertura (McCulloch, 2013), entre otros. Existe una predilección de los murciélagos frugívoros, tanto nómadas como sedentarios, a forrajear con preferencia hacia los estratos subarbóreos, pero algunos como Sturnira lilium (É. Geoffroy Saint Hilaire, 1810) y Sturnira magna de la Torre, 1959, tienen una marcada tendencia a evitar los estratos bajos y otros como los de la subfamilia Carolliinae forrajean tanto en estratos altos como bajos (Casallas-Pabón, 2009).
La abundancia relativa de algunas especies numéricamente dominantes y muchas especies poco frecuentes y raras en la comunidad de murciélagos (Fig. 2), así como la dominancia de frugívoros (67,2 %); son un patrón consistente con otros ecosistemas tropicales, (Castro-Luna et al., 2007; Avila-Cabadilla et al., 2009; Aguilar-Garavito et al., 2014) debido a la alta disponibilidad de hábitat y recursos para este gremio. En general, la biomasa total anual de frutos es mayor a la de otros recursos como néctar o insectos (Kalko y Handley, 2001) (el 1,5 % de las capturas correspondieron a nectarívoros y el 25,3 % a insectívoros). Dentro de este grupo, los frugívoros sedentarios fueron más abundantes (39,7 %), lo que se podría atribuir a una mayor disponibilidad de especies de sucesión temprana en el área de estudio (e.g. Piper, Solanum, Vismia, Cecropia). Estos resultados son consistentes con lo que han encontrado otros autores dentro de los ítems alimentarios consumidos por murciélagos de estrategia sedentaria (Kalko et al., 1996; Soriano 2000; Lindner y Morawetz, 2006).
Conforme avanza el estado sucesional, aumenta la complejidad ecosistémica, cambiando la proporción de rango y abundancia de especies, de esta manera comunidades más equitativas implican mayor estabilidad ecosistémica, diversidad funcional y aseguran los servicios ecosistémicos (Cadotte etal., 2011), como se evidenció en los estados sucesionales de borde de bosque y bosque ripario. La configuración de la comunidad de murciélagos y su ubicación temporal en la dinámica sucesional, evidenciadas por curvas de rango abundancia con pendientes similares, poco pronunciadas, indican comportamientos acordes a ambientes conservados, con pocas especies dominantes y raras, ya que las especies más abundantes no difirieron mucho de aquellas con abundancias intermedias; sin mostrar una tendencia a manera de serie geométrica, que implicaría una diversidad y riquezas bajas, propias de ecosistemas degradados.
El arbustal es el único que posee una curva con saltos entre especies de abundancias intermedias, dicha tendencia se suele relacionar con estados de sucesión secundaria, ello podría interpretarse como una comunidad en un proceso de transito sucesional, bien sea por una perturbación reciente o en proceso de recuperación.
Cada uno de los estados sucesionales mostraron un género de planta altamente abundante en las heces de los murciélagos, ello implica que cada estado sucesional tiene un ensamble de murciélagos que aprovechan sus recursos y potencialmente se moverá en el paisaje con su carga de semillas por dispersar. Si bien los estados sucesionales no muestran diferencias significativas en número de especies de semillas, los murciélagos capturados en las coberturas boscosas, tienen la mayor riqueza de semillas. Las mayores abundancias de semillas se reportaron en los arbustales, respondiendo a su carácter ecotonal, con varias especies dominantes y sólo un par raras, evidenciando gran cantidad de flujo potencial de semillas diversas a lo largo del paisaje y de la sucesión.
La composición del ensamblaje de murciélagos fue dominada por las especies frugívoras C. perspicillata (sedentario), A. obscurus (nómada). Las cuales suelen ser abundantes en ambientes sucesionales primarios (Tschapka, 2005). Su elevada abundancia y alta frecuencia de consumo de plantas pioneras en este estudio, sugiere que existe un potencial regenerativo en estos ecosistemas. Se considera que la disponibilidad alimenticia de frutos promueve la presencia y abundancia de murciélagos generalistas con capacidad de atravesar áreas abiertas y disturbadas (Medellín et al., 2000; Estrada y Coates-Estrada, 2002).
El que la abundancia de semillas en los pastizales no se diferencie estadísticamente de las unidades boscosas, evidencia que los murciélagos que vuelan sobre las áreas abiertas tienen la misma carga de semillas para dispersar que los que vuelan al interior del bosque, implicando un potencial de dispersión sobre las áreas abiertas. Se debe resaltar las altas abundancias de semillas de especies como C. engleriana, que por ser un árbol pionero, implica un salto sucesional potencial en el proceso de regeneración del bosque sobre áreas abiertas y de borde.
Los arbustales presentaron la mayor abundancia tanto de murciélagos como de semillas; éstos corresponden a un estado de transición del ecosistema, cargado de propiedades emergentes que repercuten sobre la presencia de los murciélagos y las semillas que ellos dispersan; se trata de potenciadores que incentivan el avance hacia la complejidad vegetal (Casallas-Pabón, 2016), cuyo equilibrio también está supeditando y estabilizando por variables climáticas, edáficas y microambientales que determinan el establecimiento de las plántulas.
CONCLUSIONES
La existencia y conservación de una heterogeneidad estructural en la vegetación a lo largo del paisaje (arbustales y matas de monte), permite el potencial desarrollo sucesional del ecosistema, y en última instancia se refleja en comunidades saludables de fauna dispersora que aportan al mantenimiento del mismo. En los arbustales, se reportó una comunidad de murciélagos en transición, con altas abundancias. Pero las mayores abundancias, riquezas y diversidades de murciélagos frugívoros, se encontraron en el borde de bosque. C. perspicillata fue la especie con mayor IID seguida por A. obscurus.
Se encontró dependencia entre abundancia de los géneros de plantas y el estado sucesional. Los géneros más abundantes en las heces de murciélagos fueron Cecropia, Piper, y Vismia. Las mayores riquezas de semillas se reportaron en las coberturas boscosas, siendo C. engleriana, P. marginatum, V. japurenesis y Philodendron sp., las especies de plantas mas frecuentemente consumidas por los murciélagos.
Las semillas obtenidas de los murciélagos en arbustal fueron significativamente más abundantes que los demás estados sucesionales. Los pastizales no se diferenciaron de las unidades boscosas. Es decir que los murciélagos que vuelan sobre las áreas abiertas tienen la misma carga de semillas para dispersar que los que vuelan al interior del bosque, evidenciando un potencial de dispersión.
AGRADECIMIENTOS
Agradecemos a: ABF Colombia-Applied Biodiversity Foundation. Universidad Nacional de Colombia, sede Bogotá y Orinoquia. Idea Wild. Red Latinoamericana de Conservación de Murciélagos (RELCOM), Bat Conservation International (BCI), Programa para la conservación de los murciélagos de Colombia (PCMCo). M. Hoyos, Y. Muñoz-S, E. Linares, J. Rozo, D. Hernández, A. Pinto, V. Rocha, J. Avendaño, V. Castro-H, F. Gómez, D. León, S. Guiza, V. Castillo, A. Martínez, G. Pinilla, M. García-Mora, J. Franco, F. Moreno, D. David, M. Segura, T. Defler, V. Sosa, A. Torres, A. Suárez (Fun. ATTAS), C. Barrera (R.Rey Zamuro), M. Suárez (R. El Caduceo), E. Enciso (R.Las Unamas), V. Plata, S. Estrada, W. Yela, D. Morales, R. Saldaña, M. Sagot.
REFERENCIAS
Referencias
Aguilar-Garavito M, Renjifo LM, Pérez-Torres J. Seed dispersal by bats across four successional stages of a subandean landscape. Biota Col. 2014;15(2):85-101.
Angulo SR, Ríos JA, Díaz MM. Sphaeronycteris toxophyllum (Chiroptera: Phyllostomidae). Mamm Species. 2008;814:1-6. Doi:10.1644/814.1
Avila-Cabadilla L, Stoner K, Henry M, Añorve M. Composition, structure and diversity of Phyllostomid bat assemblages in different successional stages of a tropical dry forest. For Ecol Manage. 2009;258(6):986-996. Doi:10.1016/j.foreco.2008.12.011
Cadotte M, Carscadden K, Mirotchnick N. Beyond species: functional diversity and the maintenance of ecological processes and services. J Appl Ecol. 2011;48:1079-1087. Doi:10.1111/j.1365-2664.2011.02048.x
Casallas-Pabón D. Estrategias para la restauración ecológica de bosques tropicales mediante la dispersión de semillas por murciélagos frugívoros (tesis doctoral). Bogotá: Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia; 2016. 192 p.
Casallas-Pabón D. Estratificación vertical y horario de actividad del ensamble de murciélagos en un bosque primario del trapecio Amazónico Colombiano (trabajo de grado). Bogotá: Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia; 2009. 47 p.
Castro-Luna A, Sosa V, Castillo-Campos G. Bat diversity and abundance associated with the degree of secondary succession in a tropical forest mosaic in south-eastern Mexico. Anim Conserv. 2007;10:219-228. Doi:10.1111/j.1469-1795.2007.00097.x
Charles-Dominique P. Inter-relations between frugivorous vertebrates and pioneer plants: Cecropia, birds and bats in French Guyana. In: Estrada A, Fleming TH, editor(s). Frugivores and Seed Dispersal. Dordrecht: Dr W Junk Publishers; 1986. p.119–135.
Colwell RK. EstimateS: Statistical estimation of species richness and shared species from samples Version 9.1. User’s Guide and aplication [on line] 2013. Available at: http://www.viceroy. eeb.uconn.edu/estimates. Cited 10 Feb 2016.
Estrada A, Coates-Estrada R. Bats in continuous forest, forest fragments and in an agricultural mosaic habitat-island at Los Tuxtlas, Mexico. Biol Conserv. 2002;103:237-245. Doi:10.1016/S0006-3207(01)00135-5
Estrada-Villegas S, Pérez-Torres J, Stevenson P. Dispersión de semillas por murciélagos en un borde de bosque montano. Ecotropicos. 2007;20(1):1-14.
Feinsinger P. Designing field studies for biodiversity conservation. Washington: Island Press; 2001. 216 p.
Fleming TH. The relationship between species richness of vertebrate mutualists and their food plants in tropical and subtropical communities differs among hemispheres. Oikos. 2005;111:556-562. Doi:10.1111/j.1600-0706.2005.14272.x
Fleming TH. The short-tailed fruit bat: A study in plant-animal interactions. Chicago: University of Chicago Press; 1988. 365 p.
Fleming TH, Heithaus ER. Frugivorous bats, seed shadows, and the structure of tropical forests. Biotropica. 1981;13:45-53. Doi:10.2307/2388069
Flores-Saldaña MG. Estructura de las comunidades de murciélagos en un gradiente ambiental en la Reserva de la Biosfera y Tierra Comunitaria de Origen Pilon Lajas, Bolivia. Mastozool neotrop. 2008;15(2):309-322.
Galindo-González J, Guevara S, Sosa VJ. Bat- and bird-generated seed rains at isolated trees in pastures in a tropical rainforest. Conserv Biol. 2000;14:1693-1703. Doi:10.1111/j.1523-1739.2000.99072.x
Gardner AL, editor. Mammals of South America: Marsupials, Xenarthrans, Shrews, and Bats. Chicago: University of Chicago Press; 2008. 690 p.
Heip CHR, Herman PMJ, Soetaert K. Indices of diversity and evenness. Oceanis. 1998;24(4):61-87.
Hill MO. Diversity and evenness: a unifying notation and its consequences. Ecology. 1973;54:427-432. Doi:10.2307/1934352
Howe HF. Constraints on the Evolution of Mutualisms. Am Nat. 1984;123(6):764-777.
Ideam. Boletín de precipitación y temperatura en Colombia. Bogotá, Colombia. 2016. Available at: https://www.datos.gov.co/Ambiente-y-Desarrollo-Sostenible/Prom-Precipitaci-n-y-Temperatura-media-1971-2000. Cited 29 Marzo 2016.
Kalko EK. Diversity in tropical bats. In: Ulrich H, editor. Tropical biodiversity and systematics: Proceedings of the International Symposium on Biodiversity and Systematics in Tropical Ecosystems. Bonn: Zoologisches Forschungs Institute und Museum Alexander Koenig; 1997. p. 13-43.
Kalko EK. Organization and diversity of tropical bat communities through space and time. Zoology. 1998;101(4):281-297.
Kalko EK, Handley CO. Neotropical bats in the canopy: diversity, community structure, and implications for conservation. Plant Ecol. 2001;153:319-333. Doi:10.1023/A:1017590007861
Kalko EK, Handley CO, Handley D. Organization, diversity, and long–term dynamics of a Neotropical bat community. In: Cody ML, Smallwood JA, editors. Long–term studies of Vertebrate Communities. San Diego: Academic Press; 1996. p. 503-553. Doi:10.1016/B978-012178075-3/50017-9
Lindner A, Morawetz W. Seed dispersal by frugivorous bats on landslides in a montane rain forest in Southern Ecuador. Chiropt Neotrop. 2006;12(1):232-237.
Lobova TA, Geiselman CK, Mori SA. Seed dispersal by bats in the neotropics. New York: The New York Botanical Garden Press; 2009. 471 p.
Ludica C.A., Bonaccorso F.J.. Feeding of the bat, Sturnira lilium, on fruits of Solanum riparium influences dispersal of this pioneer tree in forests of northwestern Argentina. Stud Neotrop Fauna Environ.1997;32:4-6.
Magurran AE. Measuring biological diversity. Oxford: Blackwell; 2004. p 177-181.
Mantilla-Meluk H, Montenegro O. Nueva especie de Lonchorhina (Chiroptera: Phyllostomidae) de Chiribiquete, Guayana colombiana. Rev Biodivers Neotrop. 2016;6(2):171-187. Doi:10.18636/bioneotropical.v6i2%20Jul-Dic.576.g570
McCulloch ES, Tello J, Whitehead A, Rolón‐Mendoza CM, Maldonado‐Rodríguez MC, Stevens RD. Fragmentation of Atlantic Forest has not affected gene flow of a widespread seed‐dispersing bat. Mol Ecol. 2013;22(18):4619-4633. Doi:10.1111/mec.12418
Medellín RA, Equihua M, Amin A. Bat diversity and abundance as indicators of disturbance in neotropical rainforests. Conserv Biol. 2000;6:1666-1675. Doi:10.1111/j.1523-1739.2000.99068.x
Medellín RA, Gaona O. Seed dispersal by bats and Birds in Forest and Disturbed Habitats of Chiapas, Mexico. Biotropica. 1999;31:478-485. Doi:10.1111/j.1744-7429.1999.tb00390.x
Molinari J, Bustos XE, Burneo SF, Camacho MA, Moreno SA, Fermin G. A new polytypic species of yellow-shouldered bats, genus Sturnira (Mammalia: Chiroptera: Phyllostomidae), from the Andean and coastal mountain systems of Venezuela and Colombia. Zootaxa. 2017;4243(1):75-96. Doi:10.11646/zootaxa.4243.1.3
Monasterio M. Ecología de las sabanas de América Tropical II. Caracterización ecológica del clima en los Llanos de Calabozo, Venezuela. Rev Geogr. 1970;21:5-38.
Nagorsen DW, Peterson RL. Mammal collector's manual. Toronto: Royal Ontario Museum of Zoology; 1980. 79 p. Doi:10.5962/bhl.title.60776
Pardo A, Rangel-Ch JO. Mamíferos de la Orinoquia. In: Rangel-Ch JO, editor. Colombia Diversidad Biótica XIV. Bogotá: Instituto de Ciencias Naturales, Facultad de Ciencias, Universidad Nacional de Colombia; 2014. p. 751-784.
Pereyra LC, Moreno CE. Divide y vencerás: revisión de métodos para la partición de la diversidad regional de especies en sus componentes alfa y beta. Rev Chil Hist Nat. 2013;86(3):231-240. Doi:10.4067/S0716-078X2013000300001
R Development Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria; 2011. Available from: http://www.R-project.org/
Ramírez-Chaves HE, Suárez-Castro AF, González-Maya JF. Cambios recientes a la lista de los mamíferos de Colombia. Mammal Notes. 2016;3(1):1-9.
Rudas,A. Unidades ecogeográficas y su relación con la diversidad vegetal de la amazonia colombiana. Tesis Doctorado, Ciencias Biológicas. Universidad Nacional de Colombia, Bogotá, 2009; p 147.
Solari S, Muñoz-Saba Y, Rodríguez-Mahecha JV, Defler TR, Ramírez-Chaves HE, Trujillo F. Riqueza, endemismo y conservación de los mamíferos de Colombia. Mastozool Neotrop. 2013;20(2):301-365.
Soriano P. Functional structure of bat communities in tropical rainforests and andean cloud forests. Ecotrópicos. 2001;13(1):1-20.
Straube F, Bianconi G. Sobre a grandeza e a unidade utilizada para estimar esforço de captura com utilização de redes de neblina. Chiropt Neotrop. 2002;8(1-2):150-152.
Tavares V, Lewis D. Sphaeronycteris toxophyllum. The IUCN Red List of Threatened Species 2008: Available in: http:10.2305/IUCN.UK.2008.RLTS.T20599A9213038.en. Cited 24 Nov 2015.
Terborgh J, Pitman N, Silman M, Schichter H, Núñez P. Maintenance of tree diversity in tropical forests. In: Levey DJ, Silva WR, Galetti M, editors. Seed Dispersal and Frugivory: Ecology, Evolution and Conservation. Oxford and New York: CABI Publishing; 2002. p. 1-17.
Thies W, Kalko EK, Schnitzler HU. The roles of echolocation and olfaction in two Neotropical fruit-eating bats, Carollia perspicillata and C. castanea, feeding on Piper. Behav Ecol Sociobiol. 1998;42:397-409. Doi:10.1007/s002650050454
Toothaker L. Multiple Comparison Procedures. No. 89. California: Sage Publications; 1993. 96 p.
Tschapka M. Reproduction of the bat Glossophaga commissarisi (Phyllostomidae: Glossophaginae) in the Costa Rican rain forest during frugivorous and nectarivorous periods. Biotropica. 2005;37:409-415. Doi:10.1111/j.1744-7429.2005.00054.x
Ward Jr. JH. Hierarchical grouping to optimize an objective function. J Am Stat Assoc. 1963;58:236–244. Doi:10.1080/01621459.1963.10500845
Welch B. On the comparison of several mean values: an alternative approach. Biometrika. 1951;38:330-336. Doi:10.2307/2332579
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Juan J. Pellón, Jorge L. Mendoza, Oscar Quispe-Hure, Florangel Condo, Marta Williams. (2021). Exotic Cultivated Plants in the Diet of the Nectar-Feeding Bat Glossophaga soricina (Phyllostomidae: Glossophaginae) in the City of Lima, Peru. Acta Chiropterologica, 23(1) https://doi.org/10.3161/15081109ACC2021.23.1.009.
2. Orlando Fabián Hernández-Leal, Francisco Sánchez. (2023). Black pepper’s essential oils affect the foraging behavior of Seba’s fruit-eating bat. International Journal of Pest Management, 69(4), p.299. https://doi.org/10.1080/09670874.2021.1918355.
3. Sebastián Montoya-Bustamante, Natalya Zapata-Mesa, Oscar E. Murillo-García. (2026). On the diet of Rhinophylla alethina (Chiroptera: Phyllostomidae) and congenerics. Mammalia, 90(1), p.66. https://doi.org/10.1515/mammalia-2025-0039.
4. Valentina Giraldo Gutiérrez, Laura Nathaly Pachón Pontón, Daniela Trujillo Cortés, Juliana Andrea Peñaranda Carrillo, Jordan Steven Ruiz Toquica. (2020). Registro preliminar de la herpetofauna asociada a bosque de galería y a la subcuenca del río Camoa de la Reserva El Caduceo, San Martín, Meta, Colombia. Revista Mutis, 10(2), p.70. https://doi.org/10.21789/22561498.1708.
5. Sebastián García-Restrepo, Diego A. Gómez-Sánchez. (2021). Registros ocasionales de Alouatta seniculus (Primates: Atelidae) en sabanas de la Orinoquia colombiana, San Martín de los Llanos, Meta, Colombia. Mammalogy Notes, 7(1), p.212. https://doi.org/10.47603/mano.v7n1.212.
6. Luis Alejandro Yañez-Dukon, Nixon Fernando Vargas Hernández, Isabela Forero Espinosa, Pablo Locano Montoya, Jordan Steven Ruiz Toquica. (2021). Evaluación rápida de las familias y grupos trófico de aves asociadas a sabanas y bosques de galería en la Reserva El Caduceo, La María (San Martín, Meta, Colombia). Revista Mutis, 11(2), p.132. https://doi.org/10.21789/22561498.1705.
7. Sara Salazar Arias, Nelly del Carmen Jiménez Pérez, Rodrigo García Morales, Eduardo Javier Moguel Ordóñez. (2022). CARACTERIZACIÓN MORFOLÓGICA DE SEMILLAS DISPERSADAS POR MURCIÉLAGOS FRUGÍVOROS EN SELVAS DEL TRÓPICO HÚMEDO MEXICANO. Kuxulkab', 28(62), p.e4892. https://doi.org/10.19136/kuxulkab.a28n62.4892.
8. Lilian Ferrufino‐Acosta, Vivian Cabrera-Escoto, Nereyda Estrada-Andino, German Sandoval, Armando Aguirre-Jaimes, Mauricio Quesada, Jorge Cortés-Flores. (2025). Beyond Species Richness: Conserving Species and Reproductive Functions of Honduran Flora in Protected Natural Areas. Tropical Conservation Science, 18 https://doi.org/10.1177/19400829251363214.
9. Martin Hinojosa, Nataly Méndez-Romero, Maria Cristina Peñuela. (2021). Diet and trophic structure of frugivorous bats (Phyllostomidae) in forests and chagras of the Andean–Amazon piedmont, Ecuador. Mammalian Biology, 101(4), p.481. https://doi.org/10.1007/s42991-021-00144-z.
10. Daniel Alexis Nieto Mora, Leonardo Duque-Muñoz, Juan David Martínez Vargas. (2025). Enhancing Soundscape Characterization and Pattern Analysis Using Low-Dimensional Deep Embeddings on a Large-Scale Dataset. Machine Learning and Knowledge Extraction, 7(4), p.109. https://doi.org/10.3390/make7040109.
11. Mariana Gómez-Muñoz, Mónica A. Ramírez, Jairo Pérez-Torres, Pablo R. Stevenson. (2025). The presence of experienced individuals enhance the behavior and survival of reintroduced woolly monkeys in Colombia. Primates, 66(1), p.103. https://doi.org/10.1007/s10329-024-01156-2.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).