Caracterización temporo-espacial del patrón de marcha en roedores como modelo animal de lesión cerebral cerebrovascular
Temporal and Spatial Characterization of Gait Pattern in Rodents as an Animal model of Cerebrovascular Lesion
DOI:
https://doi.org/10.15446/abc.v22n3.65244Palabras clave:
accidente cerebrovascular, actividad motora, análisis de la marcha, pruebas funcionales, roedores. (es)functional testing, gait analysis, motor activity, rodents, stroke. (en)
Descargas
En la investigación sobre movimiento, la experimentación animal ha proporcionado fundamentación científica para la investigación clínica, mejorando procedimientos diagnósticos y de rehabilitación. Lesiones cerebrales en roedores pueden ser usadas para modelar síntomas locomotores, sensoriales y/o cognitivos. Con el propósito de determinar la funcionalidad locomotriz y sensorial en roedores, se han propuesto varios métodos de evaluación y pronóstico clínico para identificar y evaluar adaptaciones estructurales y mecanismos de neuro-recuperación. Esto ha permitido que métodos de intervención terapéutica, como el ejercicio físico, sean utilizados para restaurar funciones sensitivo-motoras y cognitivas en roedores y humanos. La extrapolación (translación) de los resultados de investigaciones en ciencias básicas a áreas clínicas supone la continua cooperación y retroalimentación entre investigadores y profesionales de la salud, favoreciendo la formulación de intervenciones terapéuticas más eficaces basadas en resultados obtenidos de la experimentación animal. El objetivo de esta revisión es exponer las principales deficiencias motoras y los métodos empleados para determinar la dificultad motriz en la marcha en roedores con lesión cerebrovascular, para lo cual se realizó una revisión de literatura, sobre términos definidos (MeSH), en las bases de datos PsychINFO, Medline y Web of Science, entre enero de 2000 y enero de 2017. Se excluyeron artículos de carácter cualitativo o narrativo, sin revisión por pares, disertaciones, tesis o trabajos de grado y resúmenes de conferencias. Se revisan algunas manifestaciones clínicas, su efecto en la locomotricidad en roedores, algunas metodologías usadas para generar lesiones y para estudiar la función motriz, los principales métodos de medición y algunos aspectos translacionales.
Animal experimentation is crucial for the advance in the understanding of pathophysiological mechanisms and their application on both clinical diagnosis and neuro-rehabilitation. Particularly, rodent brain lesion is commonly used in the modeling of locomotor, somatosensory and cognitive symptoms. The automated rodent gait analysis has been proposed as a tool for studying locomotor and sensory abilities and its use includes the identification of functional alterations, structural adaptations as well as neuro-rehabilitation mechanisms. From that standpoint, the effectiveness of many therapeutic intervention (i.e. physical exercises) has been documented in rodents and humans. The translation from experimental data to clinical conditions requires the continuous collaboration and feedback between researchers and health clinicians looking for the selection of the best rehabilitation protocols obtained from animal research. Here we will show some locomotor alterations, the traditional methods used to assess motor dysfunction and gait abnormalities in rodent models with stroke. The aim of this review is to show some motor deficiencies and some methods used to establish gait disturbances in rodents with cerebrovascular lesion. The review included the search of defined terms (MeSH) in PychINFO, Medline and Web of Science, between January 2000 and January 2017. Qualitative and narrative reports, dissertations, end course works and conference resumes were discarded. The review focuses on some clinical signs, their effects on rodent locomotor activity, some methodologies used to create lesion and to study motor function, some assessment methods and some translational aspects.
Recibido: 6 de junio de 2017; Revisión recibida: 29 de julio de 2017; Aceptado: 15 de agosto de 2017
RESUMEN
En la investigación sobre movimiento, la experimentación animal ha proporcionado fundamentación científica para la investigación clínica, mejorando procedimientos diagnósticos y de rehabilitación. Lesiones cerebrales en roedores pueden ser usadas para modelar síntomas locomotores, sensoriales y/o cognitivos. Con el propósito de determinar la funcionalidad locomotriz y sensorial en roedores, se han propuesto varios métodos de evaluación y pronóstico clínico para identificar y evaluar adaptaciones estructurales y mecanismos de neuro-recuperación. Esto ha permitido que métodos de intervención terapéutica, como el ejercicio físico, sean utilizados para restaurar funciones sensitivo-motoras y cognitivas en roedores y humanos. La extrapolación (translación) de los resultados de investigaciones en ciencias básicas a áreas clínicas, supone la continua cooperación y retroalimentación entre investigadores y profesionales de la salud, favoreciendo la formulación de intervenciones terapéuticas más eficaces basadas en resultados obtenidos de la experimentación animal. El objetivo de esta revisión es exponer las principales deficiencias motoras y los métodos empleados para determinar la dificultad motriz en la marcha en roedores con lesión cerebrovascular, para lo cual se realizó una revisión de literatura, sobre términos definidos (MeSH), en las bases de datos PsychINFO, Medline y Web of Science, entre enero de 2000 y enero de 2017. Se excluyeron artículos de carácter cualitativo o narrativo, sin revisión por pares, disertaciones, tesis o trabajos de grado y resúmenes de conferencias. Se revisan algunas manifestaciones clínicas, su efecto en la locomotricidad en roedores, algunas metodologías usadas para generar lesiones y para estudiar la función motriz, los principales métodos de medición y algunos aspectos translacionales.
Palabras clave:
accidente cerebrovascular, actividad motora, análisis de la marcha, pruebas funcionales, roedores.ABSTRACT
Animal experimentation is crucial for the advance in the understanding of pathophysiological mechanisms and their application on both clinical diagnosis and neuro-rehabilitation. Particularly, rodent brain lesion is commonly used in the modeling of locomotor, somatosensory and cognitive symptoms. The automated rodent gait analysis has been proposed as a tool for studying locomotor and sensory abilities and its use includes the identification of functional alterations, structural adaptations as well as neuro-rehabilitation mechanisms. From that standpoint, the effectiveness of many therapeutic interventions (i.e. physical exercises) has been documented in rodents and humans. The translation from experimental data to clinical conditions requires the continuous collaboration and feedback between researchers and health clinicians looking for the selection of the best rehabilitation protocols obtained from animal research. Here we will show some locomotor alterations, the traditional methods used to assess motor dysfunction and gait abnormalities in rodent models with stroke. The aim of this review is to show some motor deficiencies and some methods used to establish gait disturbances in rodents with cerebrovascular lesion. The review included the search of defined terms (MeSH) in PychINFO, Medline and Web of Science, between January 2000 and January 2017. Qualitative and narrative reports, dissertations, end course works and conference resumes were discarded. The review focuses on some clinical signs, their effects on rodent locomotor activity, some methodologies used to create lesion and to study motor function, some assessment methods and some translational aspects.
Keywords:
functional testing, gait analysis, motor activity, rodents, stroke.RESUMO
No estudo do movimento, a experimentação animal tem proporcionado sólida fundamentação científica para a pesquisa clínica, permitindo melhorar procedimentos diagnósticos e de reabilitação. Lesões cerebrais em roedores são utilizadas para modelar sintomas locomotores, sensoriais e cognitivos. Para determinar a funcionalidade locomotora e sensorial em roedores, têm sido desenvolvidas várias metodologias para avaliar o prognóstico clínico e identificar adaptações estruturais e mecanismos da recuperação. Todos esses achados têm favorecido que alguns métodos de intervenção terapêutica sejam utilizados para restaurar funções sensitivo-motoras e cognitivas em roedores e pacientes. A extrapolação (translação) de resultados de pesquisas em ciências básicas para as áreas clínicas, supõe a contínua cooperação e retroalimentação entre pesquisadores e profissionais da saúde, desenhando intervenções terapêuticas mais eficazes, baseadas em resultados obtidos na experimentação animal. Nesta revisão se expõem metodologias utilizadas para criar e avaliar alterações motoras, em modelos animais com acidente cerebral vascular. O objetivo é apresentar deficiências motoras e métodos utilizados para determinar a dificuldade na marcha em roedores com lesão cerebrovascular. Para isso foi feita uma revisão da literatura, usando termos definidos (MeSH), nas bases de dados PsychINFO, Medline e Web of Science, entre janeiro de 2000 e janeiro de 2017. Foram excluídos artigos qualitativos, narrativas, sem revisão por pares, dissertações, teses ou trabalhos de grado e resumos de palestras. Se revisam manifestações clínicas, seus efeitos na locomoção de roedores, algumas metodologias usadas para gerar lesões e para estudar a função motora, os principais métodos de medição e alguns aspectos translacionais.
Palavras-chave:
acidente cerebrovascular, atividade motora, análise da marcha, roedores, testes funcionais.INTRODUCCIÓN
La enfermedad cerebro vascular (ECV) involucra una serie de deficiencias inducidas por la disminución o interrupción del flujo sanguíneo cerebral por mecanismos tromboembólicos o hemodinámicos que generan un desequilibrio entre el aporte y la demanda de oxígeno y glucosa al tejido cerebral (Sierra et al., 2011), llevando a deficiencias en los procesos psicológicos básicos, en la integridad refleja y sensorial, en la función motriz, la locomoción y el balance. Esta gran variabilidad clínica hace que el modelamiento de condiciones neurológicas sea un proceso complejo. El uso de animales de laboratorio ha aumentado con múltiples propósitos (Baumans, 2005; Russell y Proctor, 2006; Dehoux y Gianello, 2007); áreas como la ciencia básica, la investigación farmacológica, el estudio comportamental, la neuropsiquiatría y la rehabilitación experimental, son ejemplos de disciplinas en las que con mayor frecuencia se emplean modelos animales (Martino et al., 2006; Livingston-Thomas y Tasker, 2013; Goutianos et al., 2015) y que abren la posibilidad a la exploración de nuevas estrategias para el modelamiento de fenómenos complejos de la naturaleza.
Alteraciones del sistema motriz también pueden ser observadas en muchas patologías, tales como traumatismos craneoencefálicos (Gardner y Zafonte, 2016; Ozolins et al., 2016), lesiones medulares (Kucharikova et al., 2014), enfermedades desmielinizantes (Esposito y Longo ,2016; Rinalduzzi et al., 2016), trastornos neurodegenerativos como Parkinson (Beck et al., 2016), Alzheimer (Mohs, 2002; Scherder et al., 2007; Agca et al., 2008), Corea de Huntington (Spires y Hannan, 2005) y otras demencias (Fritz et al., 2016) o alteraciones por exposición a tóxicos (Jett et al., 2001; Minami et al., 2004; Faherty et al., 2005), a bacterias, virus (Malva et al., 2007), hongos y parásitos (Bales, 2000).
Con el propósito de que la experimentación animal sea válida, reproductible y fiable, es necesario el control de muchos factores intrínsecos y extrínsecos para crear protocolos estandarizados, minimizando fuentes de variabilidad y reduciendo, en lo posible, fuentes de sufrimiento innecesarias. Roedores y otros mamíferos (incluyendo primates no humanos) han sido ampliamente utilizados en investigación debido a la semejanza con el ser humano tanto genética como fisiológica, comportamental y hormonalmente (Barros y Tomaz, 2002). Debido a la relativa facilidad para el control de las variables en el ambiente experimental, sobre todo por características como el tamaño corporal, las características metabólicas de la especie, su alto nivel de reproductividad y su sencillo mantenimiento, han permitido que los roedores sean los animales de experimentación preferidos en la investigación biomédica (Cenci etal., 2002; Casals etal., 2011; Vandamme, 2014).
Desde el punto de vista clínico, los estudios que se han adelantado a partir del uso de roedores privilegian la investigación en lesión medular, en enfermedades neurodegenerativas, vasculares y traumáticas, caracterizando déficits motores y sensitivos relacionados con la locomoción, la coordinación, el balance y el soporte de peso; sin dejar de lado las alteraciones cognitivas (Richter, 2005; Siegmund y Wotjak, 2007; Agca et al., 2008; Casals et al., 2011). A pesar de las múltiples investigaciones realizadas en el campo de la rehabilitación experimental empleando roedores con lesión cerebral, se hace necesario consolidar investigaciones clínico-terapéuticas que no sólo caractericen las implicaciones comportamentales y/o motoras en los parámetros temporo-espaciales de la marcha, sino que incluyan la verificación de efectos funcionales obtenidos a partir de intervenciones terapéuticas (Scheidtmann et al., 2001; Kleim et al., 2007).
Este artículo es una revisión de literatura cuyo objetivo es exponer la reciente (2000-2017) evidencia científica disponible sobre las alteraciones en las características temporo-espaciales del patrón de marcha y los métodos que han sido desarrollados para el análisis de estas condiciones en roedores con lesión cerebral, así como la identificación de hallazgos que han contribuido al estudio de mecanismos de neurorehabilitación en seres humanos.
MATERIALES Y MÉTODOS
Estrategias de búsqueda y criterios de inclusión
Se realizó una operacionalización de los términos y las definiciones a usar, utilizando los tesauros de términos médicos (MeSH). Estos fueron utilizados para realizar la búsqueda en bases de datos electrónicas relevantes para las ciencias de la salud: PsychINFO, Medline y Web of Science, entre enero de 2000 y enero de 2017. Fueron excluidos artículos de carácter cualitativo o narrativo, sin revisión por pares, disertaciones, tesis o trabajos de grado y resúmenes de conferencias. Se incluyeron artículos que utilizan modelos murinos en el estudio de síntomas motores en diversas patologías, incluidas, pero no limitadas, a las mencionadas arriba. Todos los trabajos incluidos, en los cuales se circunscribieran medidas de tipo cognoscitivo, habrían de presentar también reportes del estado motriz del animal.
Los artículos fueron adquiridos en formato pdf (en su mayoría), gracias al acceso brindado por las universidades participantes y en algunos casos gracias a la colaboración de la Dra. Alexandra Elbakyan. Se utilizó como software principal de procesamiento de la base de datos el software Mendeley 1.16.3. La revisión presenta inicialmente algunas generalidades sobre las manifestaciones clínicas de la ECV y su efecto en la locomotricidad en roedores, posteriormente se consideran algunas de las principales metodologías usadas tanto para la generación de lesiones cerebrales, como para el estudio de la función motriz en modelos murinos, subsiguientemente se mencionan los principales métodos encontrados para la medición de las alteraciones motrices. Finalmente se esboza una conclusión frente al uso de los datos obtenidos a partir de la experimentación animal en la clínica humana (aspectos translacionales).
RESULTADOS
Manifestaciones clínicas de la enfermedad cerebrovascular en ratas
En los últimos años se ha incrementado la investigación en torno a la generación de modelos biológicos de isquemia cerebral en laboratorio que permiten una mayor comprensión acerca de los procesos celulares y fisiopatológicos implicados, buscando un mejor entendimiento de la clínica. Se han identificado múltiples respuestas sistémicas involucradas en la neuroprotección, las cuales son transcendentales en la recuperación funcional (Cenci et al., 2002; Casals et al., 2011). La ECV es un déficit neurológico generado a partir de una interrupción en el flujo sanguíneo al encéfalo y es una de las patologías más frecuentes que afectan el sistema nervioso central en seres humanos; el 88 % de los eventos son de tipo isquémico, seguido del hemorrágico intracerebral y subaracnoideo con un 9 % y 3 % respectivamente (Witt et al., 2007; Marini et al., 2010; Casals et al., 2011).
Las alteraciones secundarias a este proceso patológico incluyen manifestaciones sensitivas y motrices dentro de las cuales se pueden resaltar las anomalías hemisensoriales, alteraciones viso-espaciales y/o conductuales, hemiparesia o hemiplejias, deficiencias en el balance, fluctuaciones en el tono muscular, disartria e insuficiencia en la coordinación de los patrones de movimiento. La disminución en la velocidad, la inestabilidad y alteraciones de la sincronía de los pasos, son también características patológicas dependientes de parámetros temporo-espaciales en la marcha, entre los cuales se incluyen longitud de zancada, longitud de paso, velocidad, cadencia, aceleración lineal, ángulo y ancho de paso (Hollman et al., 2011; Balaban y Tok, 2014).
Al igual que en seres humanos, algunos signos clínicos que se pueden evidenciar en roedores luego de un evento cerebro vascular, están directamente relacionados con el tipo de lesión generada y el área total afectada, e incluyen un patrón respiratorio anormal, letargo posiblemente asociado a la presencia de dolor o a cambios emocionales ligados con ansiedad, irritabilidad o agresividad. Igualmente se reconoce que este tipo de déficit genera alteraciones en la memoria, la función cognitiva, la atención, el lenguaje y el procesamiento perceptual visual, auditivo, cinestésico, háptico, entre otras (Cordova et al., 2014).
Locomoción en roedores
Para entender las alteraciones en el desarrollo del patrón de marcha como resultado de ECV en roedores, es necesario comprender la secuencia de procesos que se llevan a cabo y que son indispensables para la ejecución de un adecuado patrón de movimiento. La locomoción inicia a partir de una entrada sensorial seguida de un proceso interneuronal y de procesamiento motor, finalizando el ciclo con la activación muscular (salida motriz). La marcha cuadrúpeda está divida en dos fases, la primera de ellas -denominada de oscilación-involucra inicialmente la flexión de complejos articulares como cadera, rodilla y tobillo seguida de una extensión de estas dos últimas con conservación del patrón flexor de cadera. La segunda fase -llamada de apoyo- consiste en el contacto de la pata con la superficie a partir de la extensión activa de la rodilla y el tobillo seguido de una leve flexión generada por la fuerza de reacción de la superficie y el soporte de peso, finalizando con la extensión de las articulaciones que conforman el miembro inferior (Parker y Clarke, 1990; Westerga y Gramsbergen, 1990; Hamers et al., 2001), permitiendo de esta forma el desplazamiento (Fig. 1A-B), datos que pueden ser obtenidos por el registro de la locomoción en el hall o corredor de marcha (Fig. 2).
Figura 1: (A) Ilustración de principales parámetros temporo-espaciales de la marcha. (E.A.I) Extremidad anterior izquierda; (E.A.D) Extremidad anterior derecha; (E.P.I) Extremidad posterior izquierda; (E.P.D) Extremidad posterior derecha; (A.H) Ancho de huella; (L.H) Longitud de huella; (B) Vista lateral de las fases de la marcha. (A.T) Ángulo del tobillo.
Estos patrones de movimiento están controlados a partir de un grupo de neuronas denominadas generadores de patrones centrales, las cuales son responsables de la activación e inhibición de grupos musculares específicos. De acuerdo con lo anterior, cuando se generan lesiones a nivel central (mesencéfalo, cerebelo y corteza motora) se harán evidentes deficiencias motoras relacionadas con cambios en la velocidad, el balance y la coordinación, así como modificaciones en los patrones de movimiento y desplazamiento. Todas estas alteraciones son el resultado de procesos relacionados con el edema, inflamación y, en últimas, con la excitotoxicidad generada por la liberación excesiva de glutamato que lleva a altas concentraciones de calcio intracelular, presencia de radicales libres y finalmente muerte celular (Hossmann, 2006; Durukan y Tatlisumak, 2007). La severidad en la sintomatología depende de factores como la circulación colateral, la microcirculación, el área de la zona de penumbra y a factores de neuroprotección que intervienen en la disminución de procesos inflamatorios, minimizando el daño tisular. Entre los factores de neuroprotección se incluye la interleucina 6 (IL-6), factores asociados a la microglía y la sintasa endotelial del óxido nítrico (eNOS), entre otros (Jung et al., 2011; Majid, 2014).
La marcha depende de una gran variedad de factores, que incluyen la coordinación motriz, la estabilidad, el patrón postural y la velocidad. Estos parámetros se encuentran alterados en roedores con enfermedad de Parkinson, Distrofia Muscular y Trauma Medular, modelos que han sido ampliamente utilizados para el estudio no sólo del déficit motor, sino también de déficits sensitivo-motores, de aprendizaje y de memoria (Schaar et al., 2010; Hampton et al., 2011; Wang et al., 2012; Parkkinen et al., 2013; Zhou et al., 2015). La dificultad en los patrones de marcha en roedores con lesión isquémica encefálica se caracteriza por cambios en la trayectoria y alteraciones en los periodos de tiempo de las fases de apoyo y oscilación.
Variaciones en la velocidad de la marcha, la coordinación del movimiento, la espasticidad en extremidades, la dificultad en la adopción de la bipedestación, fluctuaciones en el mantenimiento del balance, modificaciones en el centro de gravedad y la asimetría en la distribución del peso corporal, son también claros signos de daño cerebral que de forma simultánea interfieren con el patrón de movimiento esperado, tal como se resume en la tabla 1 (Drew et al., 2002; Wang-Fischer et al., 2008; Schaar et al., 2010; Vandeputte et al., 2010; Nielsen et al., 2013; Parkkinen et al., 2013).
Tabla 1: Principales déficits motores en roedores con lesión cerebral vascular.
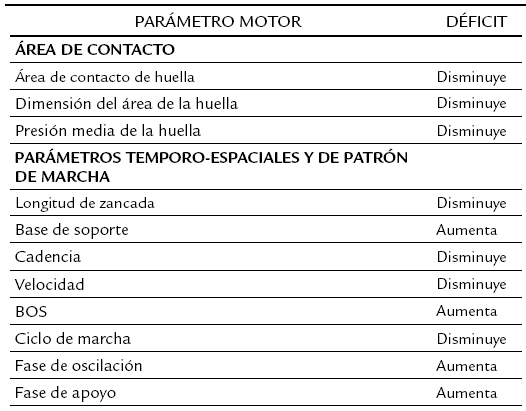
Figura 2: (A) Ilustración del hall de marcha, mostrando detalles de su construcción. (B) Fotografía de un sujeto realizando el recorrido en el hall de marcha. (Fotografía cedida por el Laboratorio de Neurociencia y Comportamiento de la Universidad de los Andes).
Estudios experimentales han identificado que los déficits en la velocidad de la marcha se encuentran relacionados a la falta de balance, reducción en la cadencia de los pasos y al incremento en el tiempo de la fase de soporte en roedores con lesión cerebral; siendo el ángulo del tobillo (ángulo formado entre el miembro posterior y su pata) uno de los parámetros esenciales en la evaluación del patrón de marcha. En casos de lesión cerebral, este ángulo se incrementa, causando un mayor tiempo de contacto de la extremidad con la superficie, que, de acuerdo con la severidad de la lesión, puede estar acompañada o no de compensaciones y/o ajustes posturales (ver Fig. 1) (Gillis y Biewener, 2001; Metz y Whishaw, 2002; Scherder et al., 2007; Koopmans et al., 2007; Titianova et al., 2008; Wang et al., 2008; Li et al., 2013a; Liu et al., 2013b; Parkkinen et al., 2013). Por otro lado, se ha logrado determinar que factores tales como el peso corporal y la ubicación o el posicionamiento de las patas no tienen implicaciones directas en características temporo-espaciales como la longitud de zancada, la velocidad y el tiempo de ejecución del patrón de marcha (Li et al., 2013b).
Modelos de lesión cerebrovascular
El desarrollo de un modelo ideal de lesión cerebral en roedores debe presentar características clínicas relevantes, ser sencillo en su ejecución quirúrgica, tener un rango mínimo de mortalidad y evitar efectos colaterales que no se encuentren relacionados al proceso de isquemia subsecuente. Han sido varios los métodos empleados para el desarrollo de modelos de ECV, que van desde la oclusión de vasos sanguíneos a la generación de embolismo arterial. Uno de los más comunes implica la oclusión de la arteria cerebral media (ACM), el cual sería un modelo de una lesión extensa de los ganglios basales (infarto grande) en los seres humanos (Casals et al., 2011). Una de las metodologías más usadas es la obstrucción mecánica mediante sutura en la arteria carótida interna. La severidad de la lesión es dependiente del tiempo, siendo comúnmente utilizados rangos entre 30 a 120 minutos seguidos de reperfusión normal. En ocasiones se prefiere realizar una oclusión permanente, generando isquemia mantenida (Bacigaluppi et al., 2010). En cualquiera de los dos casos se produce muerte celular en estructuras cerebrales como el cuerpo estriado, el tálamo, el hipotálamo, la substancia nigra y la corteza de los lóbulos parietal y temporal, generando extensos déficits en diferentes áreas funcionales (motrices, sensoriales y cognitivas).
Una de las desventajas de este método de lesión es la alta tasa de mortalidad debida al incremento en la presión intracraneana ocasionada por el edema generado llegando a alcanzar el tronco cerebral (Carmichael, 2005; Engel et al., 2011; Lipsanen yJolkkonen, 2011). También se ha utilizado la metodología de embolismo arterial, que puede ser realizada mediante el uso intraarterial de microtrombos inducidos por fibrina o trombina, la administración de microémbolos comerciales (p.ej. esferas de plástico negras de estireno y di vinil benceno, con diámetros entre 75 y 90 um), mediante la introducción de un catéter de obstrucción a través de la arteria carótida, desplazándolo hasta la arteria deseada, o a través del uso de resinas fotosensibles. Por lo general estas aproximaciones son más utilizadas para la realización de lesiones un poco menos extensas y principalmente corticales (Ostrovskaya et al., 1999; Rasmussen et al., 2006). Otras técnicas de oclusión de la arteria cerebral media incluyen su oclusión unilateral en la base del cráneo, propuesta por primera vez por Tamura y colaboradores en 1981 y usada profusamente desde entonces (Sironi, et al., 2003; Gelosa et al., 2014) y la oclusión bilateral desde el origen aórtico de las arterias carótidas internas y de la entrada occipital de las arterias vertebrales, desarrollada por Pulsinelli y Bierley en 1979 (Gottlieb et al., 2006).
Finalmente vale la pena mencionar la utilización de técnicas -clásicas- de lesión cerebral aplicadas específicamente a regiones motoras tanto corticales como subcorticales. Debido a la gran precisión de estas técnicas, prácticamente se encuentran reportes de sus usos en la totalidad de áreas relacionadas con el funcionamiento motriz. Dentro de este tipo de abordajes se incluyen tanto las lesiones electrolíticas como las químicas. En el caso de las electrolíticas, se emplea la difusión de una corriente anodal en el área que se desea lesionar. En ellas, factores como el tipo de corriente empleada, el tiempo y el tamaño del electrodo pueden ser modificados para variar la extensión del daño deseado. Para las lesiones químicas, se utilizan substancias neurotóxicas de diversos tipos que bien sea por excitotoxicidad o por otros mecanismos de interferencia metabólica intracelular son capaces de producir muerte celular. Sin embargo, estos dos tipos de técnicas no son modelos -particulares-de lesiones cerebrovasculares, a pesar de que la alteración tisular lograda pueda llegar a ser similar a la encontrada en algunos tipos de eventos vasculares. Por esta razón, no son abordadas en el presente trabajo.
Medición de la marcha
Múltiples escalas y pruebas han sido desarrolladas evaluar tanto procesos fisiopatológicos como efectos terapéuticos. La variabilidad de métodos de análisis funcional responde a la diversidad en la sintomatología clínica evidenciada en los modelos murinos de ECV. Aspectos tales como especificidad en la detección de alteraciones funcionales, nivel de experticia del investigador y consideraciones éticas para su uso deben ser tenidos en cuenta para la selección de la adecuada evaluación funcional. En la figura 2 se muestra el hall de marcha que es una de las pruebas utilizadas para la observación y el registro manual de las características de la marcha en modelos murinos motores. Baterías o métodos de valoración como la marcha en malla (gridwalking-foot-fault test), la prueba de la manipulación del spaghetti (pasta test), la prueba de la escalera (staircase test), la prueba de la barra horizontal (horizontal bar walking test), la prueba de bajar por la viga (pole test) y la prueba de bajar por la pendiente (ladder test) han sido creados para estimar alteraciones de carácter motor incluyendo análisis de los patrones de marcha y funcionalidad en motricidad gruesa y fina de extremidades.
La prueba de caminata sobre la rejilla (grid walking - footfault test) consiste en una rejilla de 45 x 45 cm, elevada a una altura de 50 cm del suelo. La rejilla es dividida virtualmente en cuadrados de 15 cm de lado. A los animales se les permite la exploración libre durante 5 minutos. Existe una cámara colocada debajo del aparato, con la que se digitaliza el movimiento del animal para su posterior análisis. Ese análisis se realiza mediante la utilización de software especializado. Muchos softwares son ofrecidos de forma gratuita, tal como es el caso del X-Plo-Rat, ofrecido por el Laboratorio de Comportamiento Exploratorio del Programa de Psicobiología de la Universidad de São Paulo (Barbosa et al., 2016). Dentro de los parámetros que comúnmente se analizan se incluyen: latencia de inicio de movimiento, distancia total recorrida, cantidad de pasos dados, número de errores cometidos con las patas delanteras y traseras, y porcentaje de pasos con error cometidos. Esos datos son suficientes para permitir una evaluación bastante detallada de las alteraciones de la marcha resultantes de la lesión cerebral practicada, así como de la recuperación inducida por determinado tratamiento (Chao et al., 2012; Barbosa et al., 2016; Schuch et al., 2016).
La prueba de la manipulación del spaghetti (pasta test) consiste en la cuantificación de la forma en que el animal manipula y come un spaghetti o un vermicelli (Tennant et al., 2010). En algunas ocasiones ciertos movimientos gruesos pueden estar conservados y haber una pérdida más selectiva de los movimientos finos. Este test permite la evaluación de esas alteraciones en la motricidad más fina (Ballermann et al., 2001; Allred et al., 2008). Por su parte, la prueba de escalera (staircase test) consiste en una reja que es colocada con una inclinación de máximo 45° por la cual el animal debe subir. Esta prueba se basa en la respuesta instintiva de geotaxia negativa, que induce al animal a orientar su hocico hacia un plano superior al de las patas. En este test se puede evaluar la latencia de inicio del movimiento y la velocidad de subida. Existen muchas variaciones, pero todas permiten la evaluación del movimiento grueso y la marcha (Lake et al., 2015; Vaysse et al., 2015; Rattka et al., 2016; Schuch et al., 2016).
Atributos sensitivo-motores pueden ser evaluados mediante procedimientos como la prueba en la esquina (corner test), la prueba de ubicación de las patas delanteras (forelimb placing) y la prueba de retirar el adhesivo (adhesive removal test). En estas pruebas se evalúa la correcta integración somatosensorial ya que cada movimiento realizado por el animal requiere de la integridad perceptual y del uso de esta información para dirigir el movimiento a realizar. De ellos, quizá sea la prueba de la remoción del adhesivo la más utilizada. Esta prueba consiste en colocar cinta adhesiva en las porciones distales de las patas anteriores. La rata rápidamente aprende los movimientos requeridos para retirar la cinta. Por lo general las ratas son entrenadas en esta situación antes de que entren en los protocolos experimentales (cirugía para lesión) y solamente aquellos animales que aprenden a retirar la cinta adhesiva en menos de diez segundos son empleados. Existen variaciones sobre este protocolo, pero siempre se busca evaluar la coordinación requerida para realizar la tarea en el mismo (o menor) tiempo que en los ensayos iniciales (Sughrue et al., 2006; Bouet et al., 2009; Coelho y Giraldi-Guimarães, 2014; Hill y Nemoto, 2014; Yu et al., 2016).
Existe otra categoría de análisis que incluye aquellos diseñados para la evaluación de déficits cognitivos y de memoria, tales como el Laberinto Acuático de Morris, el test de Reconocimiento de Objetos y pruebas de Evitación Pasiva y Activa (Montoya et al., 1991; Hua et al., 2002; Sughrue et al., 2006; Vorhees y Williams, 2006; Reger et al., 2009; Tennant et al., 2010; Chao et al., 2012; Sarkaki et al., 2013). También se tiene registro de algunas escalas de evaluación neurológica, tales como la Neurological Scoring Scale y los Neurological Severity Scores (NSS), cuantifican conjuntos de factores funcionales y son ampliamente utilizadas en modelos de experimentación (Hattori et al., 2000; Schaar et al., 2010; Linden et al., 2016).
Los avances en la tecnología han sido un elemento de apoyo fundamental en las investigaciones y estudios que se han adelantado en este campo. Muchos métodos de análisis locomotor como la cinematografía y la utilización de software, han permitido el desarrollo de sistemas computacionales como el CatWalk, el DigiGait y el TreadScan System, con los cuales se ha logrado obtener información mucho más objetiva, valida, precisa, replicable y detallada, transformándose en testes comportamentales de elección para la evaluación de las características temporo-espaciales, incluyendo variables de medición como el área y la distribución de la presión plantar.
El Catwalk es el método automatizado de análisis motor y funcional más empleado en investigación. Permite la cuantificación de parámetros estáticos y dinámicos de la marcha. Fue diseñado inicialmente para el estudio de características motrices en modelos de lesión medular y dolor neuropático, sin embargo, su uso es también difundido en modelos animales con condiciones patológicas como lesión de nervio periférico, ataxia, artritis, enfermedad de Parkinson y ECV. Vandeputte y colaboradores emplearon este sistema en el análisis de ratas con patologías de origen neurológico (ECV, Parkinson y enfermedad de Huntington) demostrando que este método ofrece información más detallada y en ciertos casos más sensible que otras pruebas de análisis motor. Además, su uso puede ayudar en la evaluación del grado de recuperación obtenido a partir de intervenciones terapéuticas experimentales (Vandeputte et al., 2010).
El sistema consiste en una plataforma con un corredor de plexiglass que en sus extremos contiene sensores de infrarrojo que detectan la dirección, el comienzo y la terminación del patrón motor. Posee una superficie inferior en cristal transparente con un dispositivo de luz fluorescente y una cámara de video que permite el registro de las huellas dejadas por el roedor. Igualmente cuenta con un software que analiza tiempo, velocidad promedio, dirección y posicionamiento de cada extremidad anterior y posterior con respecto al patrón locomotor ejecutado. Parámetros como base de soporte, área de contacto máximo, longitud de zancada, fase de dispersión (relación temporo-espacial en la ubicación de la huella de la pata derecha con respecto a la izquierda), cadencia y secuencia de los pasos son también medidas cuantificadas a partir de este método de estudio (Hamers et al., 2001; Wang et al., 2008; Schaar et al., 2010; Liu et al., 2013; Parkkinen et al., 2013; Johnson et al., 2015).
Sistemas como el DigiGait y el TreadScan han sido más utilizados en investigaciones relacionadas al estudio de locomoción en roedores con deficiencias de origen traumático y musculoesquelético como la lesión medular y la artritis (Simjee et al., 2007; Beare et al., 2009; Berryman et al., 2009; Eftaxiopoulou et al., 2014). Dorman y colaboradores demostraron que ambos sistemas pueden llegar a ser útiles en la identificación de alteraciones ocasionadas por este tipo de patologías, sin embargo, ningún sistema fue capaz de determinar cambios en el patrón locomotor luego de generar intervenciones analgésicas (Dorman et al., 2014), lo que ratifica la necesidad de generar sistemas de medición locomotriz más sensibles y de fácil replicabilidad.
A pesar de las ventajas que ofrece este tipo de sistemas automatizados de medición, es necesario tener en cuenta que factores como calibración, configuración en la iluminación, calidad del video (en los casos en que el análisis de hace a posteriori) y medida de los parámetros, llegan a ser determinantes en el proceso de recolecta de datos e interpretación de los resultados. Características como discrepancias en el tamaño de los roedores, motivación, estrés, grado de insuficiencia motora debido a la lesión y plasticidad cerebral pueden llegar a generar diferencias en los resultados obtenidos (Li et al., 2013b; Dorman et al., 2014).
Investigación translacional y ejercicio físico en la enfermedad cerebrovascular
En la actualidad existe una amplia variedad de intervenciones terapéuticas que se han desarrollado con el propósito de disminuir la incapacidad asociada a este proceso patológico y facilitar mecanismos de restitución de la funcionalidad neuronal, reorganización estructural y compensación entre déficits y habilidades funcionales. Factores relevantes dentro del proceso de recuperación funcional han sido probados por igual en seres humanos y modelos animales, revelando que la intervención terapéutica oportuna, la edad, la cronicidad y la severidad de la lesión son determinantes para el pronóstico funcional (Koositamongkol et al., 2013; Coelho y Giraldi-Guimarães, 2014; Dalise et al., 2015).
Estudios en roedores han identificado modificaciones estructurales a nivel cerebral que son similares en seres humanos con ECV, estas incluyen incrementos en la sinaptogénesis, cambios en la conformación estructural dendrítica y reorganización axonal en áreas ipsi y contra laterales a la lesión. Estas modificaciones podrían ser parte de procesos de recuperación espontanea, resultante de la neuroplasticidad que puede ser funcional o disfuncional (Brown et al., 2009; Font et al., 2010). El desarrollo de intervenciones basadas en entrenamientos específicos genera una mayor diversificación de estas adaptaciones funcionales siendo necesario el desarrollo de estrategias terapéuticas que las promuevan (Dimyan y Cohen, 2011). Una de las estrategias terapéuticas más ampliamente utilizadas en seres humanos y roedores con lesión cerebral -debido a los beneficios obtenidos en déficits incluyendo la simetría en la ejecución del patrón de marcha- ha sido el ejercicio físico, sin embargo existen desacuerdos entre la eficiencia de esta intervención con respecto a intensidad y modalidad de ejecución, es decir, voluntaria, forzada o involuntaria, incluso existiendo reportes de efectos deletéreos del ejercicio en varias medidas motrices (Ke et al., 2011; Acevedo-Triana et al., 2014).
Investigaciones en modelos animales (roedores) han identificado que el ejercicio físico está asociado con una mejoría de la función cognitiva y motora debido a la liberación de factor neurotrófico derivado del cerebro (BDNF). Otro efecto relevante reportado consiste en la disminución del área cerebral afectada (reducción del volumen del infarto). No obstante, Marin y colaboradores concluyeron que no existe una relación directa entre el volumen del infarto cerebral y la recuperación motora posterior a un entrenamiento físico (Marin et al., 2003). Con respecto a las modalidades e intensidad del ejercicio físico en roedores con lesión cerebral, se llevó a cabo un estudio en el cual se compararon los métodos en estera, rueda de actividad y la aplicación de electroestimulación funcional (FES) como tipos de ejercicio forzado, voluntario e involuntario respectivamente. Se identificó que el ejercicio voluntario con intensidad moderada tenia resultados superiores sobre la recuperación funcional caracterizada por mayores concentraciones de BDNF hipocampal asociado directamente con mejoría en el aprendizaje, la memoria y los niveles de conservación neuronal. Adicionalmente fue demostrado que, al contrario que lo que ocurre en el caso del ejercicio forzado, este método de entrenamiento no induce liberación de corticosterona, la cual está asociada con stress crónico y reducción del BDNF hipocampal (Ke et al., 2011).
Hallazgos similares en la función cognitiva y motora han sido identificados en humanos, asociados al incremento en la expresión del gen para BDNF en hipocampo, cerebelo y medula espinal, como consecuencia de la práctica de ejercicio aeróbico con intensidad moderada (Mang et al., 2013). Otros estudios han demostrado que este tipo de entrenamiento favorece la recuperación del equilibrio y la movilidad, adicionalmente está relacionado con la potenciación en el aprendizaje motor (Kluding et al., 2011). Cardenas y colaboradores evaluaron los efectos del ejercicio forzado acompañado o no de estimulación eléctrica percutánea en la recuperación de la función motriz, luego de un protocolo de compresión del ciático en ratas, encontraron que no existe asociación entre los dos tipos de abordaje, pues en los dos casos hubo recuperación funcional motriz. Resulta interesante que los resultados demuestran que los roedores que más rápidamente recuperaron la funcionalidad motriz, fueron aquellos que no recibieron ningún tipo de tratamiento, dejando claro así, que una gran variedad de mecanismos endógenos pueden estar involucrados en los procesos de regeneración axonal (Cardenas et al., 2014).
Figura 3: Algunas pruebas utilizadas en la evaluación motriz: (A) Prueba de recorrido por la barra horizontal; (B) Prueba de subir por la escalera; (C) Prueba de bajar por la barra. (Fotografías cedidas por el Laboratorio de Neurociencia y Comportamiento de la Universidad de los Andes).
Luft y colaboradores determinaron que el método de banda caminadora, como modalidad aeróbica de entrenamiento, mejora el patrón de marcha de pacientes con secuelas de lesión cerebral e incrementa la activación de circuitos neuronales a nivel de cerebelo y áreas corticales frontales, temporales y parietales convirtiéndose en un posible mecanismo que potencie la plasticidad cerebral (Luft et al., 2008). Este fue el primer estudio en identificar este tipo de respuesta funcional en seres humanos basados en hallazgos establecidos a partir de estudios experimentales en modelos animales.
Los incrementos en la angiogénesis debidos al aumento en la demanda metabólica y la neurovascularización favorecida por el incremento de óxido nítrico sintasa endotelial junto a la proteína ácida fibrilar glial (GFAP, proteína asociada a procesos de plasticidad cerebral vascular) son también resultados del ejercicio físico basado en un entrenamiento de resistencia. Estrategias terapéuticas que fomenten patrones finos de movimiento han demostrado como resultado mayor sinaptogénesis y potenciación sináptica (Biernaskie y Corbett, 2001; Brevetti et al., 2003). En humanos se han identificado adicionalmente liberación de factores tróficos tales como el factor de crecimiento endotelial (VEGF) que está relacionado con formación vascular y aumento en el flujo sanguíneo cerebral favoreciendo la plasticidad sináptica. El factor de crecimiento insulínico tipo 1 (IGF-1), es una relevante proteína que participa en el incremento de la neurogénesis y genera efectos neuro-protectores, programas de entrenamiento físico basados en resistencia han reportado incrementos en dicha proteína (Cassilhas et al., 2012). Estudios en modelos animales y humanos han demostrado que esta modalidad de entrenamiento está asociada con mejoras en el aprendizaje (Pin-Barre y Laurin, 2015).
CONCLUSIÓN
Las lesiones cerebrales generan un sinnúmero de alteraciones motoras y cognitivas siendo un reto la evaluación de déficits funcionales tanto en seres humanos como en modelos animales, por tanto, se ha desarrollado una gran variedad de métodos para la valoración de estas deficiencias. El estudio de la marcha en la lesión cerebral es esencial desde el área clínica y de investigación. Su relevancia radica en el hecho que múltiples estructuras encefálicas, tanto de procesamiento primario como aquellas de asociación, interactúan en formas diversas y complejas entre sí y con circuitos espinales, lo que no solamente influye en la locomoción y las adaptaciones motoras al ambiente; sino que también involucra funciones de tipo ejecutivo relevantes como lo son atención, orientación temporo-espacial y memoria. Es así como la evaluación clínico-funcional de la marcha se ha empleado como herramienta, que de forma conjunta con otras pruebas de evaluación cognitivo-comportamental permiten determinar el grado de severidad de la lesión y corroborar la eficacia de potenciales tratamientos basados en resultados terapéuticos.
El avance tecnológico ha sido un factor relevante en el desarrollo de estudios de investigación más sensibles a la medición de déficits en características temporo-espaciales de la marcha de roedores con ECV, proporcionando evidencia sobre mecanismos fisiopatológicos y de recuperación tales como la inducción de neuroplasticidad estructural y funcional a partir del ejercicio físico aeróbico. Los sistemas de evaluación de patrón locomotor en humanos (GAITMAT o GAITRite) poseen un desarrollo tecnológico mayor, sin embargo, a nivel conceptual estos sistemas se pueden comparar con los empleados para el análisis de marcha en roedores (CatWalk). Caracteristicas como el déficit en la velocidad, cadencia, asimetrías en la longitud de zancada y en la base de soporte son característicos tanto en humanos como en roedores con lesión cerebral (Goldie et al., 2001; Eng y Tang, 2007; Wang et al., 2008; Allen et al., 2011).
El estudio del ECV en modelos animales ha permitido comprender procesos fisiopatológicos, de adaptación funcional y neuroplasticidad proporcionando avances en el área de la neurorehabilitación, sin embargo, un aspecto critico en la extrapolación de estos resultados a seres humanos consiste en la adecuada translación del conocimiento científico de estas áreas al ámbito clínico. Es por esta razón que la investigación debe tener un carácter bidireccional, que permita la continua interacción de investigadores de ciencias básicas y profesionales clínicos, orientando parámetros de modelamiento en animales que permitan una mayor aproximación clínica a la condición patológica humana, abriendo el camino a la toma de decisiones terapéuticas basadas en la evidencia.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento a los miembros del laboratorio de Neurociencia y Comportamiento de la Universidad de los Andes, cuyo soporte y apoyo fue de utilidad para la conclusión de este trabajo y por la cesión de las fotografías que aparecen en las figuras 2 y 3.
REFERENCIAS
Referencias
Acevedo-Triana CA, Ávila-Campos JE, Cardenas FP. Effects of exercise and motor activity on both functions and brain structure. Rev Mex Neurocience. 2014;15(1):36–53.
Agca C, Fritz JJ, Walker LC, Levey AI, Chan AW, Lah JJ, et al. Development of transgenic rats producing human beta-amyloid precursor protein as a model for Alzheimer’s disease: transgene and endogenous APP genes are regulated tissue-specifically. BMC Neurosci. 2008;9:28. Doi:10.1186/1471-2202-9-28
Allen JL, Kautz SA, Neptune RR. Step length asymmetry is representative of compensatory mechanisms used in post-stroke hemiparetic walking. Gait Posture. 2011;33(4):538-543. Doi:10.1016/j.gaitpost.2011.01.004
Allred RP, Adkins DL, Woodlee MT, Husbands LC, Maldonado MA, Kane JR, et al. The Vermicelli Handling Test: A simple quantitative measure of dexterous forepaw function in rats. J Neurosci Methods. 2008;170(2):229-244.
Bacigaluppi M, Comi G, Hermann DM. Animal models of ischemic stroke. Part two: modeling cerebral ischemia. Open Neurol J. 2010;4:34-38. Doi:10.2174/1874205X01004020034
Balaban B, Tok F. Gait disturbances in patients with stroke. PM R. 2014;6(7):635-642.
Bales HW. Neurocysticercosis: migration of a parasite. J Am Acad Nurse Pract. 2000;12(6):240-248.
Ballermann M, Metz GA, McKenna JE, Klassen F, Whishaw IQ. The pasta matrix reaching task: a simple test for measuring skilled reaching distance, direction, and dexterity in rats. J Neurosci Methods. 2001;106(1):39-45.
Barbosa EH, Vallim JH, Lachat J-J, de Castro VLSS. Assessments of motor abnormalities on the grid-walking and foot-fault tests from undernutrition in wistar rats. J Mot Behav. 2016;48(1):5-12.
Barros M, Tomaz C. Non-human primate models for investigating fear and anxiety. Neurosci Biobehav Rev. 2002;26(2):187-201.
Baumans V. Science-based assessment of animal welfare: laboratory animals. Rev Sci Tech. 2005;24(2):503-513.
Beare JE, Morehouse JR, DeVries WH, Enzmann GU, Burke DA, Magnuson DSK, et al. Gait Analysis in normal and spinal contused mice using the treadscan system. J Neurotrauma. 2009;26(11):2045-2056.
Beck MH, Haumesser JK, Kuhn J, Altschuler J, Kuhn AA, van Riesen C. Short- and long-term dopamine depletion causes enhanced beta oscillations in the cortico-basal ganglia loop of parkinsonian rats. Exp
Neurol. United States. 2016;286:124-136. Doi:10.1016/j.expneurol.2016.10.005
Berryman ER, Harris RL, Moalli M, Bagi CM. Digigait??? quantitation of gait dynamics in rat rheumatoid arthritis model. J Musculoskelet Neuronal Interact. 2009;9(2):89-98.
Biernaskie J, Corbett D. Enriched rehabilitative training promotes improved forelimb motor function and enhanced dendritic growth after focal ischemic injury. J Neurosci. 2001;21(14):5272-5280.
Bouet V, Boulouard M, Toutain J, Divoux D, Bernaudin M, Schumann-Bard P, et al. The adhesive removal test: a sensitive method to assess sensorimotor deficits in mice. Nat Protoc. 2009;4(10):1560-1564.
Brevetti LS, Chang DS, Tang GL, Sarkar R, Messina LM. Overexpression of endothelial nitric oxide synthase increases skeletal muscle blood flow and oxygenation in severe rat hind limb ischemia. J Vasc Surg. 2003;38(4):820-826. Doi:10.1016/S0741-5214(03)00555-X
Brown CE, Aminoltejari K, Erb H, Winship IR, Murphy TH. In Vivo Voltage-Sensitive Dye Imaging in Adult Mice Reveals That Somatosensory Maps Lost to Stroke Are Replaced over Weeks by New Structural and Functional Circuits with Prolonged Modes of Activation within Both the Peri-Infarct Zone and Distant Sites. J Neurosci. 2009;29(6):1719-1734.
Cardenas FP, De Muñoz M, Hernandez JM, Cárdenas MAN. Estimulación eléctrica nerviosa percutánea y entrenamiento aeróbico para rehabilitación de la marcha en ratas con compresión del nervio ciático. Rev Asoc Colomb Fisioter. 2014;55:11-15.
Carmichael ST. Rodent models of focal stroke: size, mechanism, and purpose. NeuroRx. 2005;2(3):396-409.
Casals JB, Pieri NCG, Feitosa MLT, Ercolin ACM, Roballo KCS, Barreto RSN, et al. The use of animal models for stroke research: A review. Comp Med. 2011;61(4):305-313.
Cassilhas RC, Lee KS, Venâncio DP, Oliveira MGM, Tufik S, de Mello MT. Resistance exercise improves hippocampus-dependent memory. Brazilian J Med Biol Res = Rev Bras Pesqui medicas e Biol. Associação Brasileira de Divulgação Científica; 2012;45(12):1215-1220.
Doi:10.1590/s0100-879x2012007500138
Cenci MA, Whishaw IQ, Schallert T. Animal models of neurological deficits: how relevant is the rat? Nat Rev Neurosci. 2002;3(7):574-579. Doi:10.1038/nrn877
Chao OY, Pum ME, Li JS, Huston JP. The grid-walking test: Assessment of sensorimotor deficits after moderate or severe dopamine depletion by 6-hydroxydopamine lesions in the dorsal striatum and medial forebrain bundle. Neuroscience. 2012;202:318-325. Doi:10.1016/j.neuroscience.2011.11.016
Coelho BP, Giraldi-Guimarães A. Effect of age and gender on recovery after stroke in rats treated with bone marrow mononuclear cells. Neurosci Res. 2014;88(C):67-73. Doi:10.1016/j.neures.2014.08.007
Cordova CA, Jackson D, Langdon KD, Hewlett KA, Corbett D. Impaired executive function following ischemic stroke in the rat medial prefrontal cortex. Behav Brain Res. 2014;258:106-111. Doi:10.1016/j.bbr.2013.10.022
Dalise S, Ambrosio F, Modo M. Adaptive plasticity and recovery in preclinical models of stroke. Arch Ital Biol. 2015;152(4):190-215. Doi:10.4449/AIB.V152I4.1851
Dehoux J, Gianello P. The importance of large animal models in transplantation. Front Biosci. 2007;12:4864-4880. Doi:10.2741/2434
Dimyan M a, Cohen LG. Neuroplasticity in the context of motor rehabilitation after stroke. Nat Rev Neurol. 2011;7(2):76-85.
Dorman CW, Krug HE, Frizelle SP, Funkenbusch S, Mahowald ML. A comparison of DigigaitTM and TreadscanTM imaging systems: assessment of pain using gait analysis in murine monoarthritis. J Pain Res. 2014;7:25-35.
Drew T, Jiang W, Widajewicz W. Contributions of the motor cortex to the control of the hindlimbs during locomotion in the cat. Brain Res Rev. 2002;40(1–3):178-191. Doi:10.1016/S0165-0173(02)00200-X
Durukan A, Tatlisumak T. Acute ischemic stroke: Overview of major experimental rodent models, pathophysiology, and therapy of focal cerebral ischemia. Pharmacol Biochem Behav. 2007;87(1):179-197. Doi:10.1016/j.pbb.2007.04.015
Eftaxiopoulou T, Macdonald W, Britzman D, Bull AMJ. Gait compensations in rats after a temporary nerve palsy quantified using temporo-spatial and kinematic parameters. J Neurosci Methods. 2014;232:16-23. Doi:10.1016/j.jneumeth.2014.04.011
Eng JJ, Tang PF. Gait training strategies to optimize walking ability in people with stroke: A synthesis of the evidence. Expert Rev Neurother. 2007;7(10):1417-1436. Doi:10.1586/14737175.7.10.1417
Engel O, Kolodziej S, Dirnagl U, Prinz V. Modeling stroke in mice - middle cerebral artery occlusion with the filament model. J Vis Exp. 2011;47(47):e2423.
Esposito S, Longo MR. Guillain-Barre syndrome. Autoimmun Rev Netherlands; 2016. Doi:10.1016/j.autrev.2016.09.022
Faherty CJ, Raviie Shepherd K, Herasimtschuk A, Smeyne RJ. Environmental enrichment in adulthood eliminates neuronal death in experimental Parkinsonism. Brain Res Mol Brain Res. 2005;134(1):170-179.
Font MA, Arboix A, Krupinski J. Angiogenesis, neurogenesis and neuroplasticity in ischemic stroke. Curr Cardiol Rev. 2010;6(3):238-244.
Fritz NE, Kegelmeyer DA, Kloos AD, Linder S, Park A, Kataki M, et al. Motor performance differentiates individuals with Lewy body dementia, Parkinson’s and Alzheimer’s disease. Gait Posture. 2016;50:1-7. Doi:10.1016/j.gaitpost.2016.08.009
Gardner AJ, Zafonte R. Neuroepidemiology of traumatic brain injury. Handb Clin Neurol. 2016;138:207-223. Doi:10.1016/B978-0-12-802973-2.00012-4
Gillis GB, Biewener AA. Hindlimb muscle function in relation to speed and gait: in vivo patterns of strain and activation in a hip and knee extensor of the rat (Rattus norvegicus). J Exp Biol. 2001;204(Pt 15):2717-2731.
Goldie PA, Matyas TA, Evans OM. Gait after stroke: Initial deficit and changes in temporal patterns for each gait phase. Arch Phys Med Rehabil. 2001;82(8):1057-1065. Doi:10.1053/apmr.2001.25085
Gottlieb, M., Leal-Campanario, R., Campos-Esparza, M. R., Sánchez-Gómez, M. V., Alberdi, E., Arranz, A. et al. Neuroprotection by two polyphenols following excitotoxicity and experimental ischemia. Neurobiol Dis. 2006;23(2):374-386.
Goutianos G, Tzioura A, Kyparos A, Paschalis V, Margaritelis N V, Veskoukis AS, et al. The rat adequately reflects human responses to exercise in blood biochemical profile: a comparative study. Physiol Rep. 2015;3(2):e12293.
Hamers FP, Lankhorst A J, van Laar TJ, Veldhuis WB, Gispen WH. Automated quantitative gait analysis during overground locomotion in the rat: its application to spinal cord contusion and transection injuries. J Neurotrauma. 2001;18(2):187-201. Doi:10.1089/08977150150502613
Hampton TG, Kale A, Amende I, Tang W, McCue S, Bhagavan HN, et al. Gait Disturbances in Dystrophic Hamsters, Gait Disturbances in Dystrophic Hamsters. BioMed Res Int BioMed Res Int. 2011; 2011:e235354.
Hattori K, Lee H, Hurn PD, Crain BJ, Traystman RJ, DeVries AC. Cognitive deficits after focal cerebral ischemia in mice. Stroke. 2000;31(8):1939-1944.
Hill JW, Nemoto EM. Transient middle cerebral artery occlusion with complete reperfusion in spontaneously hypertensive rats. MethodsX. 2014;1:283-291. Doi:10.1016/j.mex.2014.11.001
Hollman JH, McDade EM, Petersen RC. Normative spatiotemporal gait parameters in older adults. Gait Posture. 2011;34(1):111-118. Doi:10.1016/j.gaitpost.2011.03.024
Hossmann K-A. Pathophysiology and therapy of experimental stroke. Cell Mol Neurobiol. 2006;26(7-8):1057-1083. Doi:10.1007/s10571-006-9008-1
Hua Y, Schallert T, Keep RF, Wu J, Hoff JT, Xi G. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 2002;33(10):2478-2484. Doi:10.1161/01.STR.0000032302.91894.0F
Jett D A, Kuhlmann A C, Farmer SJ, Guilarte TR. Age-dependent effects of developmental lead exposure on performance in the Morris water maze. Pharmacol Biochem Behav. 2001;57(1-2):271–279.
Johnson VE, Meaney DF, Cullen DK, Smith DH. Animal models of traumatic brain injury. Handb Clin Neurol. 2015;127(2):115-128. Doi:10.1016/B978-0-444-52892-6.00008-8
Jung JE, Kim GS, Chan PH. Neuroprotection by interleukin-6 is mediated by signal transducer and activator of transcription 3 and antioxidative signaling in ischemic stroke. Stroke. 2011;42(12):3574-359. Doi:10.1161/STROKEAHA.111.626648
Ke Z, Yip SP, Li L, Zheng XX, Tong KY. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery: A rat brain ischemia model. PLoS One. 2011;6(2):e16643. Doi:10.1371/journal.pone.0016643
Kleim JA, Boychuk JA, Adkins DL. Rat models of upper extremity impairment in stroke. ILAR J. 2007;48(4):374–384.
Kluding M, Tseng Y, Billinger A. Exercise and Executive Function in Individuals With Chronic Stroke: A Pilot Study. J Neurol Phys Ther. 2011;35(1):11-18.
Koopmans GC, Deumens R, Brook G, Gerver J, Honig WMM, Hamers FPT, et al. Strain and locomotor speed affect over-ground locomotion in intact rats. Physiol Behav. 2007;92(5):993-1001. Doi:10.1016/j.physbeh.2007.07.018
Koositamongkol S, Sindhu S, Pinyopasakul W, Nilanont Y, Redman RW. Factors influencing functional recovery in patients with acute ischemic stroke. Collegian. 2013;20(4):207-213. Doi:10.1016/j.colegn.2012.09.002
Kucharikova A, Schreiberova A, Zavodska M, Gedrova S, Hricova L, Pavel J, et al. Repeated Baclofen treatment ameliorates motor dysfunction, suppresses reflex activity and decreases the expression of signaling proteins in reticular nuclei and lumbar motoneurons after spinal trauma in rats. Acta Histochem. Germany; 2014;116(2):344-
Doi:10.1016/j.acthis.2013.08.012
Lake EM, Chaudhuri J, Thomason L, Janik R, Ganguly M, Brown M, et al. The Effects of Delayed Reduction of Tonic Inhibition on Ischemic Lesion and Sensorimotor Function. J Cereb Blood Flow Metab. 2015;35(10):1601-1609.
Li L, Rong W, Ke Z, Hu X, Tong K-Y. The effects of training intensities on motor recovery and gait symmetry in a rat model of ischemia. Brain Inj. 2013a;27(4):408-416.
Li S, Shi Z, Zhang H, Liu X, Chen S, Jin J, et al. Assessing gait impairment after permanent middle cerebral artery occlusion in rats using an automated computer-aided control system. Behav Brain Res. 2013b;250:174-191. Doi:10.1016/j.bbr.2013.04.044
Linden J, Van de Beeck L, Plumier J-C, Ferrara A. Procedural learning as a measure of functional impairment in a mouse model of ischemic stroke. Behav Brain Res. 2016;307:35-45.
Lipsanen A, Jolkkonen J. Experimental approaches to study functional recovery following cerebral ischemia. Cell Mol Life Sci. 2011;68(18):3007-3017. Doi:10.1007/s00018-011-0733-3
Liu Y, Ao LJ, Lu G, Leong E, Liu Q, Wang XH, et al. Quantitative gait analysis of long-term locomotion deficits in classical unilateral striatal intracerebral hemorrhage rat model. Behav Brain Res. 2013;257:166-177. Doi:10.1016/j.bbr.2013.10.007
Livingston-Thomas JM, Tasker RA. Animal models of post-ischemic forced use rehabilitation: methods, considerations, and limitations. Exp Transl Stroke Med. 2013;5(1):2.
Luft AR, MacKo RF, Forrester LW, Villagra F, Ivey F, Sorkin JD, et al. Treadmill exercise activates subcortical neural networks and improves walking after stroke: A randomized controlled trial. Stroke. 2008;39(12):3341-3350. Doi:10.1161/STROKEAHA.108.527531
Majid A. Neuroprotection in Stroke: Past, Present, and Future. ISRN Neurol. 2014;2014:1-17.
Malva JO, Rego AC, Cunha RA, Oliveira CR. Interaction between neurons and glia in aging and disease. Interact. Between Neurons Glia Aging Dis. 2007. Doi:10.1007/978-0-387-70830-0
Mang CS, Campbell KL, Ross CJD, Boyd L A. Perspective Promoting Neuroplasticity for Motor Rehabilitation After Stroke: Considering the Effects of Aerobic Brain-Derived Neurotrophic Factor. Phys Ther. 2013;93(12):1707-1716. Doi:10.2522/ptj.20130053
Marin R, Williams A, Hale S, Burge B, Mense M, Bauman R, et al. The effect of voluntary exercise exposure on histological and neurobehavioral outcomes after ischemic brain injury in the rat. Physiol Behav. 2003;80(2-3):167-175. Doi:10.1016/j.physbeh.2003.06.001
Marini C, Russo T, Felzani G. Incidence of stroke in young adults: a review. Stroke Res Treat. 2010;2011:535672.
Martino G, Martino G, Pluchino S, Pluchino S. The therapeutic potential of neural stem cells. Nat Rev Neurosci. 2006;7(May):395-406.
Metz GA, Whishaw IQ. Cortical and subcortical lesions impair skilled walking in the ladder rung walking test: A new task to evaluate fore- and hindlimb stepping, placing, and co-ordination. J Neurosci Methods. 2002;115(2):169-179. Doi:10.1016/S0165-0270(02)00012-2
Metz GAS, Dietz V, Schwab ME, Van de Meent H. The effects of unilateral pyramidal tract section on hindlimb motor performance in the rat. Behav Brain Res. 1998;96(1-2):37-46. Doi:10.1016/S0166-4328(97)00195-21
Minami T, Matsumura S, Nishizawa M, Sasaguri Y, Hamanaka N, Ito S. Acute and late effects on induction of allodynia by acromelic acid, a mushroom poison related structurally to kainic acid. Br J Pharmacol. 2004;142(4):679-688.
Mohs C. R., Haroutunian V. Alzheimer disease: From earliest symptoms to end stage. In: Davis KL., Charney D, Coyle JT., Nemeroff C, editors. Neuropsychopharmacology: The Fifth Generation of Progress. American College of Neuropsychopharmacology; 2002. p. 1188-1197.
Montoya CP, Campbell-Hope LJ, Pemberton KD, Dunnett SB. The “staircase test”: a measure of independent forelimb reaching and grasping abilities in rats. J Neurosci Methods. 1991;36(2-3):219-328. Doi:10.1016/0165-0270(91)90048-5
Nielsen RK, Samson KL, Simonsen D, Jensen W. Effect of early and late rehabilitation onset in a chronic rat model of ischemic stroke-assessment of motor cortex signaling and gait functionality over time. IEEE Trans Neural Syst Rehabil Eng. 2013;21(6):1006-1015. Doi:10.1109/TNSRE.2013.2279375
Ostrovskaya RU, Romanova GA, Barskov I V, Shanina E V, Gudasheva TA, Victorov I V, et al. Memory restoring and neuroprotective effects of the proline-containing dipeptide, GVS-111, in a photochemical stroke model. Behav Pharmacol. 1999;10(5):549-553.
Ozolins B, Aimers N, Parrington L, Pearce AJ. Movement disorders and motor impairments following repeated head trauma: A systematic review of the literature 1990-2015. Brain Inj. England; 2016;30(8):937-947. Doi:10.3109/02699052.2016.1147080
Parker AJ, Clarke KA. Gait topography in rat locomotion. Physiol Behav. 1990;48(1):41-47. Doi:10.1016/0031-9384(90)90258-6
Parkkinen S, Ortega FJ, Kuptsova K, Huttunen J, Tarkka I, Jolkkonen J. Gait impairment in a rat model of focal cerebral ischemia. Stroke Res Treat. 2013;2013:e410972. Doi:10.1155/2013/410972
Pin-Barre C, Laurin J. Physical Exercise as a Diagnostic, Rehabilitation, and Preventive Tool: Influence on Neuroplasticity and Motor Recovery after Stroke. Neural Plast. 2015;2015:e608581. Doi:10.1155/2015/608581
Pulsinelli, W.A., Brierley, J.B. A new model of bilateral hemispheric ischemia in the unanesthetized rat. Stroke 1979;10:267-272
Rasmussen RS, Overgaard K, Hildebrandt-Eriksen ES, Boysen G. d-Amphetamine improves cognitive deficits and physical therapy promotes fine motor rehabilitation in a rat embolic stroke model. Acta Neurol Scand. 2006;113(3):189-198.
Rattka M, Fluri F, Krstić M, Asan E, Volkmann J. A Novel Approach to Assess Motor Outcome of Deep Brain Stimulation Effects in the Hemiparkinsonian Rat: Staircase and Cylinder Test. J Vis Exp. 2016.
Reger ML, Hovda DA, Giza CC. Ontogeny of rat recognition memory measured by the novel object recognition task. Dev Psychobiol. 2009;51(8):672-678. Doi:10.1002/dev.20402
Richter A. The Genetically Dystonic Hamster: An Animal Model of Paroxysmal Dystonia. J Child Neurol. 2005.
Rinalduzzi S, Serafini M, Capozza M, Accornero N, Missori P, Trompetto C, et al. Stance Postural Strategies in Patients with Chronic Inflammatory Demyelinating Polyradiculoneuropathy. PLoS One. 2016;11(3):e0151629. Doi:10.1371/journal.pone.0151629
Russell JC, Proctor SD. Small animal models of cardiovascular disease: tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovasc Pathol. 2006;15(6):318-330. Doi:10.1016/j.carpath.2006.09.001
Sarkaki A, Rezaiei M, Gharibnaseri MK, Rafieirad M. Improving active and passive avoidance memories deficits due to permanent cerebral ischemia by pomegranate seed extract in female rats. Malaysian J Med Sci. 2013;20(2):26-35.
Schaar KL, Brenneman MM, Savitz SI. Functional assessments in the rodent stroke model. Exp Transl Stroke Med. 2010;2(1):13.
Scheidtmann K, Fries W, Müller F, Koenig E. Effect of levodopa in combination with physiotherapy on functional motor recovery after stroke: A prospective, randomised, double-blind study. Lancet. 2001;358(9284):787-790. Doi:10.1016/S0140-6736(01)05966-9
Scherder E, Eggermont L, Sergeant J, Boersma F. Physical activity and cognition in Alzheimer’s disease: relationship to vascular risk factors, executive functions and gait. Rev Neurosci. 2007;18(2):149-158.
Schuch CP, Jeffers MS, Antonescu S, Nguemeni C, Gomez-Smith M, Pereira LO, et al. Enriched rehabilitation promotes motor recovery in rats exposed to neonatal hypoxia-ischemia. Behav Brain Res. 2016; 304:42-50.
Siegmund A, Wotjak CT. Hyperarousal does not depend on trauma-related contextual memory in an animal model of Posttraumatic Stress Disorder. Physiol Behav. 2007;90(1):103-107.
Sierra C, Coca A, Schiffrin EL. Vascular mechanisms in the pathogenesis of stroke. Curr Hypertens Rep. 2011;13(3):200-207. Doi:10.1007/s11906-011-0195-x
Simjee SU, Jawed H, Quadri J, Saeed SA. Quantitative gait analysis as a method to assess mechanical hyperalgesia modulated by disease-modifying antirheumatoid drugs in the adjuvant-induced arthritic rat. Arthritis Res Ther. 2007;9(5):R91.
Sironi, L., Cimino, M., Guerrini, U., Calvio, A. M., Lodetti, B., Asdente, M., et al. Treatment with statins after induction of focal ischemia in rats reduces the extent of brain damage. Arterioscler Thromb Vasc Biol. 2003;23(2):322-327.
Spires TL, Hannan AJ. Nature, nurture and neurology: gene-environment interactions in neurodegenerative disease. FEBS Anniversary Prize Lecture delivered on 27 June 2004 at the 29th FEBS Congress in Warsaw. FEBS J . 2005;272(10):2347-2361.
Sughrue ME, Mocco J, Komotar RJ, Mehra A, D’Ambrosio AL, Grobelny BT, et al. An improved test of neurological dysfunction following transient focal cerebral ischemia in rats. J Neurosci Methods. 2006;151(2):83-89. Doi:10.1016/j.jneumeth.2005.04.023
Tamura, A., Graham, D.I., McCullogh, J., Teasdale, M.G. Focal cerebral schemia in the rat: 1: description of technique and early neuropathological consequences following middle cerebral artery occlusion. J Cereb Blood Flow Metab. 1981;1:53-60.
Tennant K, Asay AL, Allred RP, Ozburn AR, Kleim J, Jones T. The vermicelli and capellini handling tests: simple quantitative measures of dexterous forepaw function in rats and mice. J Vis Exp. 2010(41):1-6. Doi:10.3791/2076
Titianova EB, Peurala SH, Pitkänen K, Tarkka IM. Gait reveals bilateral adaptation of motor control in patients with chronic unilateral stroke. Aging Clin Exp Res. 2008;20(2):131-138.
Vandamme TF. Use of rodents as models of human diseases. J Pharm Bioallied Sci. 2014;6(1):2-9.
Vandeputte C, Taymans J-M, Casteels C, Coun F, Ni Y, Van Laere K, et al. Automated quantitative gait analysis in animal models of movement disorders. BMC Neurosci. 2010;11:92.
Vaysse L, Conchou F, Demain B, Davoust C, Plas B, Ruggieri C, et al. Strength and fine dexterity recovery profiles after a primary motor cortex insult and effect of a neuronal cell graft. Behav Neurosci. 2015;129(4):423–434.
Vorhees C V, Williams MT. Morris water maze: procedures for assessing spatial and related forms of learning and memory. Nat Protoc. 2006;1(2):848-858.
Wang XH, Lu G, Hu X, Tsang KS, Kwong WH, Wu FX, et al. Quantitative assessment of gait and neurochemical correlation in a classical murine model of Parkinson’s disease. BMC Neurosci. 2012;13:142.
Wang Y, Bontempi B, Hong SM, Mehta K, Weinstein PR, Abrams GM, et al. A comprehensive analysis of gait impairment after experimental stroke and the therapeutic effect of environmental enrichment in rats. J Cereb Blood Flow Metab. 2008;28(12):1936-1950.
Wang-Fischer Y, Prado R, Koetzner L. Manual of Stroke Models in Rats. Anat. Cereb. Circ. Rat. CRC Press; 2008. Doi:10.1201/9781420009521
Westerga J, Gramsbergen A. The development of locomotion in the rat. Brain Res Dev Brain Res. 1990;57(2):163-174.
Witt BJ, Gami AS, Ballman K V., Brown RD, Meverden RA, Jacobsen SJ, et al. The Incidence of Ischemic Stroke in Chronic Heart Failure: A Meta-Analysis. J Card Fail. 2007;13(6):489-496. Doi:10.1016/j.cardfail.2007.01.009
Yu J, Zhu H, Gattoni-Celli S, Taheri S, Kindy MS. Dietary supplementation of GrandFusion ® mitigates cerebral ischemia-induced neuronal damage and attenuates inflammation. Nutr Neurosci. 2016;19(7):290-300.
Zhou M, Zhang W, Chang J, Wang J, Zheng W, Yang Y, et al. Gait analysis in three different 6-hydroxydopamine rat models of Parkinson’s disease. Neurosci Lett. 2015;584:184-189. Doi:10.1016/j.neulet.2014.10.032
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. F. J. Gonzalez-Lujan, L. P. Osuna-Carrasco, B. De la Torre-Valdovinos, I. G. Aguilar-García, C. Toro-Castillo, M. Treviño. (2023). Evaluation of Pharmacological Treatment in Acute Osteo Arthrosis Model by Means of Kinematic Analysis and Pain Threshold. 2023 IEEE EMBS R9 Conference. , p.1. https://doi.org/10.1109/IEEECONF60929.2023.10525380.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2017 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
























