Publicado
PSEUDORECOMBINACIÓN DEL VIRUS DEL MOSAICO AMARILLO DE LA PAPA QUE INFECTA TOMATE CON BEGOMOVIRUS AISLADOS DE ARVENSES
Pseudorecombination of Potato Yellow Mosaic Virus with Begomoviruses Isolated from Weeds
DOI:
https://doi.org/10.15446/abc.v28n3.98952Palabras clave:
Biobalística, geminivirus, CLEs, iterones (es)biolistics, CLEs, geminivirus, iterons (en)
Descargas
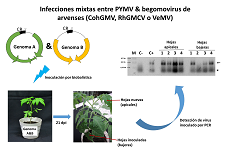
En las infecciones mixtas entre begomovirus, comunes en regiones tropicales y subtropicales, eventos como transcomplementación y transreplicación pueden ocurrir. El objetivo de esta investigación fue evaluar la posibilidad de eventos asimétricos de transreplicación y transcomplementación entre el Virus del mosaico amarillo de la papa (PYMV) y tres begomovirus previamente aislados de arvenses asociadas al cultivo de tomate: Virus del mosaico dorado de croton (CohGMV), Virus del mosaico dorado de rhynchosia de Colombia (RhGMCV) y el Virus moteado de verbena (VeMV). Para alcanzar este objetivo, se inocularon hojas de tomate con mezclas artificiales de componentes genómicos begomovirales pertenecientes a PYMV, CohGMV, RhGMCV o VeMV usando biobalística. Se analizaron las posibles interacciones entre los virus a nivel de replicación, movimiento y expresión de síntomas. Nuestros resultados mostraron complementación simétrica a nivel de movimiento y replicación, además de eventos de transactivación heteróloga en infecciones mixtas entre PYMV con CohGMV, RhGMCV o VeMV. Para explicar la posible complementación asimétrica a nivel de movimiento y replicación entre estos begomovirus, se realizó un análisis bioinformático de los promotores virales de PYMV, CohGMV, RhGMCV y VeMV. Se identificaron similitudes en los elementos cis-regulatorios de las regiones analizadas entre los begomovirus estudiados en nuestro análisis. Los eventos de complementación asimétrica y transactivación observados bajo condiciones experimentales sugieren que, de presentarse infecciones mixtas bajo condiciones naturales en el campo, podrían potencialmente emerger nuevos pseudorecombinantes.
In mixed infections between begomoviruses, common in tropical and subtropical regions, events such as transcomplementation and transreplication can occur. The aim of this research was to evaluate the possibility of asymmetric transreplication and transcomplementation events between Potato yellow mosaic virus (PYMV) and three begomoviruses previously isolated from tomato crop-associated weeds: Croton golden mosaic virus (CohGMV), Rhynchosia golden mosaic Colombia virus (RhGMCV) and Verbena mottle virus (VeMV). To achieve this goal, tomato leaves were inoculated with artificial mixtures of genomic components from PYMV, CohGMV, RhGMCV, or VeMV by using biolistic. The possible interactions between the viruses at the level of replication, movement and symptom expression were analyzed. Our results showed asymmetric complementation at the level of movement and replication, as well as heterologous transactivation events in mixed infections between PYMV with CohGMV, RhGMCV, or VeMV. To explain the possible asymmetrical complementation at the level of movement and replication between these begomoviruses, a bioinformatic analysis of the viral promoters of PYMV, CohGMV, RhGMCV and VeMV was performed. Similarities in cis-regulatory elements of the analyzed regions in the begomovirus studied were identified in our analysis. Asymmetrical complementation and transactivation events observed under experimental conditions suggest that if mixed infections occur under natural field conditions, new pseudorecombinats could emerge.
Referencias
Adams, M. J., Antoniw, J. F., y Kreuze, J. (2009). Virgaviridae: A new family of rod-shaped plant viruses. Archives of Virology, 154(12), 1967–1972. https://doi.org/10.1007/s00705-009-0506-6
Aguilar, E., Garnelo, B.,y Lozano-Duran, R. (2020). Recent advances on the plant manipulation by geminiviruses. Current opinion in plant biology, 56, 56–64. https://doi.org/10.1016/j.pbi.2020.03.009
Agronet. (s.f.). Estadísticas: Reporte: Área, Producción y Rendimiento Nacional por Cultivo. https://www.agronet.gov.co/estadistica/Paginas/home.aspx?cod=1
Álvarez-Viveros, M. F., Inostroza-Blancheteau, C., Timmermann, T., González, M., y Arce-Johnson, P. (2013). Overexpression of GlyI and GlyII genes in transgenic tomato (Solanum lycopersicum Mill.) plants confers salt tolerance by decreasing oxidative stress. Molecular Biology Reports, 40(4), 3281–3290. https://doi.org/10.1007/s11033-012-2403-4
Avalos-Calleros, J. A., Pastor-Palacios, G., Bolaños-Martínez, O. C., Mauricio-Castillo, A., Gregorio-Jorge, J., Martínez-Marrero, N., Bañuelos-Hernández, B., Méndez-Lozano, J., y Arguello-Astorga, G. R. (2021). Two strains of a novel begomovirus encoding Rep proteins with identical β1 strands but different β5 strands are not compatible in replication. Archives of virology, 166(6), 1691–1709. https://doi.org/10.1007/s00705-021-05066-2
Argüello-Astorga, G. R., Guevara-González, R. G., Herrera-Estrella, L. R., y Rivera-Bustamante, R. F. (1994). Geminivirus Replication Origins Have a Group-Specific Organization of Iterative Elements: A Model for Replication. Virology, 203(1), 90–100. https://doi.org/10.1006/viro.1994.1458
Argüello-Astorga, G. R., y Ruiz-Medrano, R. (2001). An iteron-related domain is associated to Motif 1 in the replication proteins of geminiviruses: Identification of potential interacting amino acid-base pairs by a comparative approach. Archives of Virology, 146(8), 1465–1485. https://doi.org/10.1007/s007050170072
Arnaud, L. S., Santos, C. D. G., Lima, J. A. A., y Feitosa, F. A. A. (2007). Predominância de begomovírus em tomateiros na região produtora da Ibiapaba, Ceará, e sua detecção natural em plantas daninhas. Fitopatologia Brasileira, 32(3), 241–246. https://doi.org/10.1590/s0100-41582007000300009
Beam, K., y Ascencio-Ibáñez, J. T. (2020). Geminivirus Resistance: A Minireview. Frontiers in plant science, 11, 1131. https://doi.org/10.3389/fpls.2020.01131
Berger, M. R., y Sunter, G. (2013). Identification of sequences required for AL2-mediated activation of the tomato golden mosaic virus-yellow vein BR1 promoter. The Journal of general virology, 94(6), 1398–1406. https://doi.org/10.1099/vir.0.050161-0
Betancour-Pérez, J. (2012). Identificación y caracterización molecular de virus transmitidos por mosca blanca bemisia tabaci que infectan tomate en la región andina de Colombia [Tesis de Doctorado, Universidad Nacional de Colombia]. https://repositorio.unal.edu.co/handle/unal/11656
Borah, B. K., Zarreen, F., Baruah, G., y Dasgupta, I. (2016). Insights into the control of geminiviral promoters. Virology, 495, 101–111. https://doi.org/10.1016/j.virol.2016.04.033
Butkovic, A., y Gonzalez, R. (2022). A brief view of factors that affect plant virus evolution. Front. Virol. 2. https://doi.org/10.3389/fviro.2022.994057
Cantú-Iris, M., Pastor-Palacios, G., Mauricio-Castillo, J. A., Bañuelos-Hernández, B., Avalos-Calleros, J. A., Juárez-Reyes, A., Rivera-Bustamante, R., y Argüello-Astorga, G. R. (2019). Analysis of a new begomovirus unveils a composite element conserved in the CP gene promoters of several Geminiviridae genera: Clues to comprehend the complex regulation of late genes. PloS one, 14(1). https://doi.org/10.1371/journal.pone.0210485
Da Silva, S. J. C., Castillo-Urquiza, G. P., Hora Júnior, B. T., Assunção, I. P., Lima, G. S. A., Pio-Ribeiro, G., Mizubuti, E. S., y Zerbini, F. M. (2011). High genetic variability and recombination in a begomovirus population infecting the ubiquitous weed Cleome affinis in northeastern Brazil. Archives of virology, 156(12), 2205–2213. https://doi.org/10.1007/s00705-011-1119-4
Dellaporta, S. L., Wood, J., y Hicks, J. B. (1983). A Plant DNA Minipreparation: Version II. Plant Molecular Biology Reporter, 1(4), 19–21. https://doi.org/10.1007/BF02712670
Fargette, D., Konaté, G., Fauquet, C., Muller, E., Peterschmitt, M., y Thresh, J. M. (2006). Molecular ecology and emergence of tropical plant viruses. Annual review of phytopathology, 44, 235–260. https://doi.org/10.1146/annurev.phyto.44.120705.104644
Fiallo-Olivé, E., Lett, J. M., Martin, D. P., Roumagnac, P., Varsani, A., Zerbini, F. M., y Navas-Castillo, J. (2021). ICTV Virus Taxonomy Profile: Geminiviridae 2021. The Journal of general virology, 102(12). https://doi.org/10.1099/jgv.0.001696
Frey, P. M., Schärer-Hernández, N. G., Fütterer, J., Potrykus, I., y Puonti-Kaerlas, J. (2001). Simultaneous analysis of the bidirectional African cassava mosaic virus promoter activity using two different luciferase genes. Virus genes, 22(2), 231–242. https://doi.org/10.1023/a:1008183827072
Frischmuth, T., Roberts, S., von Arnim, A., y Stanley, J. (1993). Specificity of bipartite geminivirus movement proteins. Virology, 196(2), 666–673. https://doi.org/10.1006/viro.1993.1523
Fondong V. N. (2013). Geminivirus protein structure and function. Molecular plant pathology, 14(6), 635–649. https://doi.org/10.1111/mpp.12032
Guerrero, J., Regedanz, E., Lu, L., Ruan, J., Bisaro, D. M., y Sunter, G. (2020). Manipulation of the Plant Host by the Geminivirus AC2/C2 Protein, a Central Player in the Infection Cycle. Frontiers in plant science, 11, 591. https://doi.org/10.3389/fpls.2020.00591
Hanley-Bowdoin, L., Bejarano, E. R., Robertson, D., y Mansoor, S. (2013). Geminiviruses: masters at redirecting and reprogramming plant processes. Nature reviews. Microbiology, 11(11), 777–788. https://doi.org/10.1038/nrmicro3117
Hanssen, I. M., Lapidot, M., y Thomma, B. P. H. J. (2010). Emerging viral diseases of tomato crops. Molecular plant-microbe interactions, 23(5), 539–548. https://doi.org/10.1094/MPMI-23-5-0539
Harrison, B. D., y Robinson, D. J. (1999). Natural genomic and antigenic variation in whitefly-transmitted geminiviruses (begomoviruses). Annual review of phytopathology, 37, 369–398. https://doi.org/10.1146/annurev.phyto.37.1.369
Hernández-Espinal, L. A., Enríquez-Verdugo, I., Melgoza-Villagómez, C. M., Retes-Manjarrez, J. E., Velarde-Félix, S., Linares-Flores, P. J., y Garzón-Tiznado, J. A. (2018). Phylogenetic analysis and distribution of Begomovirus in pepper (Capsicum annuum L.) crop in Sinaloa, Mexico. Revista Fitotecnia Mexicana, 41(2), 149–157. https://doi.org/10.35196/rfm.2018.2.149-157
Hou, Y. M., y Gilbertson, R. L. (1996). Increased pathogenicity in a pseudorecombinant bipartite geminivirus correlates with intermolecular recombination. Journal of Virology, 70(8), 5430–5436. https://doi.org/10.1128/jvi.70.8.5430-5436.1996
Jara-Tejada, F. (2016). Diversidad de Begomovirus presentes en arvenses asociados a cultivos de Tomate (Solanum lycopersicum L.) en el Suroriente del Valle del Cauca. Universidad Nacional de Colombia Sede Palmira. [Tesis de Maestría, Universidad Nacional de Colombia]. https://repositorio.unal.edu.co/handle/unal/56178
Jaramillo, J. E. y Tamayo, P. J. (2013). Enfermedades del tomate, pimentón, ají y berenjena en Colombia: guía para su diagnóstico y manejo. http://hdl.handle.net/20.500.12324/13267.
Kanakala, S., Jyothsna, P., Shukla, R., Tiwari, N., Veer, B. S., Swarnalatha, P., Krishnareddy, M., y Malathi, V. G. (2013). Asymmetric synergism and heteroencapsidation between two bipartite begomoviruses, tomato leaf curl New Delhi virus and tomato leaf curl Palampur virus. Virus Research, 174(1–2), 126–136. https://doi.org/10.1016/j.virusres.2013.03.011
Khan, A. J., Mansoor, S., y Briddon, R. W. (2014). Oman: a case for a sink of begomoviruses of geographically diverse origins. Trends in plant science, 19(2), 67–70. https://doi.org/10.1016/j.tplants.2013.11.004
Lefkowitz, E. J., Dempsey, D. M., Hendrickson, R. C., Orton, R. J., Siddell, S. G., y Smith, D. B. (2018). Virus taxonomy: The database of the International Committee on Taxonomy of Viruses (ICTV). Nucleic Acids Research, 46(D1), D708–D717. https://doi.org/10.1093/nar/gkx932
Lacatus, G., y Sunter, G. (2008). Functional analysis of bipartite begomovirus coat protein promoter sequences. Virology, 376(1), 79–89. https://doi.org/10.1016/j.virol.2008.03.012
López-López, K., Corredor-Rodríguez, A., Correa-Forero, A. M., Álvarez-Rubiano, L. P., Suárez-Rodríguez, A., y Vaca-Vaca, J. C. (2022). Detección molecular de begomovirus aislados de arvenses asociadas al cultivo de ají (Capsicum spp.) en el Valle del Cauca, Colombia. Acta Biológica Colombiana, 27(3), 336-346. https://doi.org/10.15446/abc.v27n3.89802
López-López, K., Jara-Tejada, F., y Vaca-Vaca, J. C. (2014). Nuevos hospederos alternativos de Begomovirus identificados en Valle del Cauca. Revista Fitopatología Colombiana, 38(9), 19–23.
López-López, K., Jara-Tejada, F., y Vaca-Vaca, J. C. (2019). Caracterización molecular de un nuevo begomovirus aislado de cinco especies de arvenses colectadas en cultivos de tomate en Valle del Cauca. Acta Biológica Colombiana, 24(3), 528–537. https://doi.org/10.15446/abc.v24n3.79366
López-López, K., Otavo-Fiscal, D., y Vaca-Vaca, J. C. (2012). Búsqueda de hospederos alternativos del virus del mosaico amarillo de la papa, un begomovirus que afecta cultivos de tomate en el Valle del Cauca. Acta Agronomica, 61(SPL.ISS.), 24–25.
López-López, K., Rodríguez-Mora, D. M., y Vaca-Vaca, J. C. (2013). Optimización de las condiciones de inoculación por biobalística de un Begomovirus en tomate y tabaco. Revista Colombiana de Biotecnología, 15(2), 8–17. https://doi.org/10.15446/rev.colomb.biote.v15n2.41261
Navas-Castillo, J., Fiallo-Olivé, E., y Sánchez-Campos, S. (2011). Emerging virus diseases transmitted by whiteflies. Annual review of phytopathology, 49, 219–248. https://doi.org/10.1146/annurev-phyto-072910-095235
Maliano, M. R., Rojas, M. R., Macedo, M. A., Barboza, N., y Gilbertson, R. L. (2022). The invasion biology of tomato begomoviruses in Costa Rica reveals neutral synergism that may lead to increased disease pressure and economic loss. Virus research, 317. https://doi.org/10.1016/j.virusres.2022.198793
Morales, F., y Olaya, C. (2009). Enfermedades del tomate (Solanum lycopersicum L) Fitopatologia Colombiana, 33(1), 23–27.
Ramos, P. L., Fuentes, A. D., Quintana, Q., Castrillo, G., Guevara-González, R. G., Peral, R., Rivera-Bustamante, R. F., y Pujol, M. (2004). Identification of the minimal sequence required for vascular-specific activity of Tomato mottle Taino virus Replication-associated protein promoter in transgenic plants. Virus research, 102(2), 125–132. https://doi.org/10.1016/j.virusres.2004.01.027
Rojas, M. R., Macedo, M. A., Maliano, M. R., Soto-Aguilar, M., Souza, J. O., Briddon, R. W., Kenyon, L., Rivera, R. F., Zerbini, F. M., Adkins, S., Legg, J. P., Kvarnheden, A., Wintermantel, W. M., Sudarshana, M. R., Peterschmitt, M., Lapidot, M., Martin, D. P., Moriones, E., Inoue-Nagata, A. K., y Gilbertson, R. L. (2018). World Management of Geminiviruses. Annual review of phytopathology, 56, 637–677. https://doi.org/10.1146/annurev-phyto-080615-100327
Rosen, R., Kanakala, S., Kliot, A., Pakkianathan, B. C., Farich, B. A., Santana-Magal, N., Elimelech, M., Kontsedalov, S., Lebedev, G., Cilia, M., y Ghanim, M. (2015). Persistent, circulative transmission of begomoviruses by whitefly vectors. Current opinion in virology, 15, 1–8. https://doi.org/10.1016/j.coviro.2015.06.008
Ruiz-Medrano, R., Guevara-González, R. G., Argüello-Astorga, G. R., Monsalve-Fonnegra, Z., Herrera-Estrella, L. R., y Rivera-Bustamante, R. F. (1999). Identification of a sequence element involved in AC2-mediated transactivation of the pepper huasteco virus coat protein gene. Virology, 253(2), 162–169. https://doi.org/10.1006/viro.1998.9484
Padidam, M., Sawyer, S., y Fauquet, C. M. (1999). Possible emergence of new geminiviruses by frequent recombination. Virology, 265(2), 218–225. https://doi.org/10.1006/viro.1999.0056
Sunter, G., y Bisaro, D. M. (2003). Identification of a minimal sequence required for activation of the tomato golden mosaic virus coat protein promoter in protoplasts. Virology, 305(2), 452–462. https://doi.org/10.1006/viro.2002.1757
Sunter, G., Stenger, D. C., y Bisaro, D. M. (1994). Heterologous complementation by geminivirus AL2 and AL3 genes. Virology, 203(2), 203–210. https://doi.org/10.1006/viro.1994.1477
Umaharan, P., Padidam, M., Phelps, R. H., Beachy, R. N., y Fauquet, C. M. (1998). Distribution and diversity of geminiviruses in Trinidad and Tobago. Phytopathology, 88(12), 1262–1268. https://doi.org/10.1094/PHYTO.1998.88.12.1262
Vaca-Vaca, J. C., Betancur-Pérez, J. F., y López-López, K. (2012). Distribución y diversidad genética de Begomovirus que infectan tomate (Solanum lycopersicum L) en Colombia. Revista Colombiana de Biotecnología, 14(1), 60–76.
Vaca-Vaca, J. C., Corredor-Saenz, V., Jara-Tejada, F., Betancourt-Andrade, D., y Lopez-Lopez, K. (2019). Nuevos hospederos alternativos de begomovirus asociados al cultivo de ají en el Valle del Cauca. Acta Agronómica, 68(1), 56–60. https://doi.org/10.15446/acag.v68n1.77487
Vaca-Vaca, J. C., Jara-Tejada, F., y López-López, K. (2018). Croton golden mosaic virus: a new bipartite begomovirus isolated from Croton hirtus in Colombia. Archives of Virology, 163(11), 3199–3202. https://doi.org/10.1007/s00705-018-3989-1
Vaca-Vaca, J. C., Jara-Tejada, F., y López-López, K. (2020). Caracterización molecular parcial de Begomovirus aislados de arvenses colectadas en cultivos de tomate en el sureste del Valle del Cauca, Colombia. Revista Colombiana de Ciencias Hortícolas, 14(1). https://doi.org/10.17584/rcch.2020v14i1.10434
Vaca-Vaca, J. C., Otavo-Fiscal, D., y López-lópez, K. (2011). Identificación de arvenses como hospederos naturales de Begomovirus en el Valle del Cauca, Colombia. Revista Fitopatología Colombiana, 35(2), 69–72.
Verbeek, M., y Dullemans, A. M. (2012). First Report of Tomato torrado virus Infecting Tomato in Colombia. Plant disease, 96(4), 592. https://doi.org/10.1094/PDIS-11-11-1000
Vinoth-Kumar, R., y Shivaprasad, P. V. (2020). Plant-virus-insect tritrophic interactions: insights into the functions of geminivirus virion-sense strand genes. Proceedings. Biological sciences, 287(1936). https://doi.org/10.1098/rspb.2020.1846
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).



















