CARIOTIPO Y BANDEO C EN EL LAGARTO Tropidurus hispidus (Sauria: Tropiduridae) EN EL ORIENTE DE VENEZUELA
Downloads
CARIOTIPO DEL LAGARTO Tropidurus hispidus(SAURIA: TROPIDURIDAE) EN EL ORIENTE DE VENEZUELA
Lizard Karyotipe Tropidurus hispidus (Sauria: Tropiduridae) in the East of Venezuela
LUIS ALEJANDRO GONZÁLEZ S.1, Biólogo; ANA BONILLA,1 Bióloga; JENNIFFER VELÁSQUEZ1, Bióloga. 1 Postgrado en Zoología y Laboratorio de Genética y Morfología Evolutiva de Peces, Instituto de Zoología y Ecología Tropical, Facultad de Ciencias, Universidad Central de Venezuela. Caracas, Venezuela. plica4@yahoo.com
Presentado 31 de octubre de 2010, aceptado 15 de marzo de 2011, correcciones 29 de junio de 2011.
RESUMEN
El estudio citogenético mediante tinción con Giemsa, en tres regiones xerofíticas (continental, peninsular e insular) del oriente de Venezuela, demostró un número diploide 2n=36, compuesto por seis pares de macrocromosomas metacéntricos y submetacéntricos y 12 pares de microcromosomas acrocéntricos manteniéndose esta característica en machos y hembras en las tres poblaciones estudiadas. Se determinó que el primer par de macrocromosomas es metacéntrico y en la región continental representa 13% de longitud relativa total (LRT), siendo el cromosoma de mayor tamaño con respecto a la población peninsular con un 9,4 % y a la población insular con 7,1 %, conteniendo esta última población los cromosomas más pequeños. Considerando las diferencias cromosómicas y el aislamiento geográfico existente, estos lagartos podrían presentar un proceso de especiación alopátrica de tipo vicariante.
Palabras clave: Tropidurus hispidus, cromosomas, cariotipo.
ABSTRACT
A cytogenetic study by Giemsa staining in three xerophytic regions (continental, peninsular and insular) in eastern Venezuela, showed a diploid number 2n=36, consisting of 6 pairs of metacentric and submetacentric macrochromosomes and 12 pairs of acrocentric microchromosomes maintained, this feature in males and females in the three populations studied. It was determined that the first pair of macrochromosomes is metacentric and the continental region represents 13% of total relative length (LRT) as the larger chromosome, with respect to the peninsular population with 9.4% and the insular population 7.1%, the latter population containing the smallest chromosomes. Whereas chromosomal differences and geographic isolation exists, these lizards have a process of vicariant allopatric speciation.
Key words: Tropidurus hispidus, chromosomes, karyotype.
INTRODUCCIÓN
La familia Tropiduridae está representada en Venezuela por cuatro géneros: Plica, Tropidurus, Uracentron y Uranoscodon. El género Tropidurus se encuentra representado por tres especies: Tropidurus bogerti, Tropidurus panstictus y Tropidurus hispidus (La Marca, 1997; Myers y Donnelly, 2001). Esta última especie, objeto del presente estudio, se distribuye al noreste de Sudamérica (Ávila-Pires, 2005) y en Venezuela puede ser ubicado en los estados: Sucre, Nueva Esparta, Anzoátegui (Cornejo y Prieto, 2001), Barinas, Portuguesa (Markezich, 2002), Monagas, Bolívar y la región de los llanos centrales y orientales (Staton y Dixon, 1977). El güaripete, llamado así popularmente, prefiere ambientes secos o húmedos, ubica sus cuevas bajo las piedras en grietas formadas por agrupamiento de rocas, en las laderas de los cerros y bordes secos de riachuelos y quebradas (González et al., 2004). Su actividad es diurna y comienza aproximadamente entre las 6:30 y 7:00 a.m. Se alimenta principalmente de insectos del orden Hymenoptera, Lepidoptera y Diptera (Velásquez et al., 2007; Castillo et al., 2009). Mantienen una temperatura corporal promedio de 35,68 ºC en sequía y 35,27 ºC en lluvia (Velásquez y González, 2010) y una longitud hocico-cloaca de 119,56 mm para el macho y 91,10 mm para la hembra (Velásquezet al., 2007). El ciclo reproductivo del güaricongo en el oriente de Venezuela abarca desde el mes de abril hasta mediados de septiembre, observándose en la naturaleza gran cantidad de juveniles en ese último mes (Prieto et al., 1976). En Venezuela, T. hispidus ha sido estudiada citogenéticamente por García, 1979, utilizando ejemplares de la Llamada de San Juan en Cumaná en el estado Sucre, inyectándole colchicina y coloración con Giemsa, a partir de tejidos de testículo y gónadas siendo un aporte importante en el conocimiento del cariotipo de la especie y no analizan aspectos de variación intra e inter poblacional. Sin embargo, en Sudamérica se ha determinado diferenciación citogenética en el cariotipo de T. hispidus y en varias especies del género Tropidurus (Paull et al., 1976; Kasahara et al., 1987a; Kasahara et al., 1987b; Navarro et al., 1981; Navarro et al., 1990; Pellegrino et al., 1994; Kasahara et al., 1996).
El análisis de los cromosomas resulta de gran valor en la identificación básica de especies o de aquellas que están muy relacionadas, debido a que los individuos casi siempre difieren en número, forma y bandeo de sus cromosomas. Esas diferencias se presentan en individuos de una misma especie (intrapoblacional) y entre sus poblaciones (interpoblacional). Son varios los métodos desarrollados para el análisis de cariotipo y observación de cromosomas en células germinales. Las preparaciones cromosómicas pueden ser obtenidas mediante técnicas directas, cultivos cortos o cultivos de células. Cabe destacar que las diferentes preparaciones ofrecen condiciones y tiempos variables y deben ser adecuadas al material a estudiar. Las variables como número diploide (2n), número fundamental (NF), posición del centrómero y longitud relativa de los cromosomas (LR), son las más importantes para conocer los cambios cromosómicos al comparar cariotipos (Lacadena, 1996).
El objetivo del presente estudio fue caracterizar los patrones de variación cariológica de diferentes poblaciones locales del lagarto Tropidurus hispidus de los estados Sucre y Nueva Esparta; y establecer su posible relación causal con los cambios geográficos ocurridos, según la bibliografía geomorfológica de la región y plantear una hipótesis de los procesos evolutivos que pueden explicar los patrones cariológicos obtenidos.
MATERIALES Y MÉTODOS
EJEMPLARES
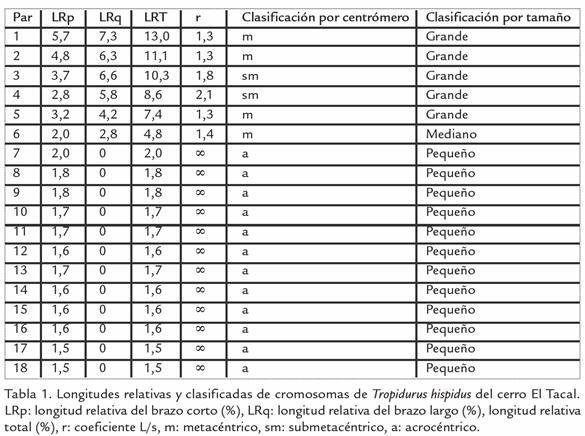
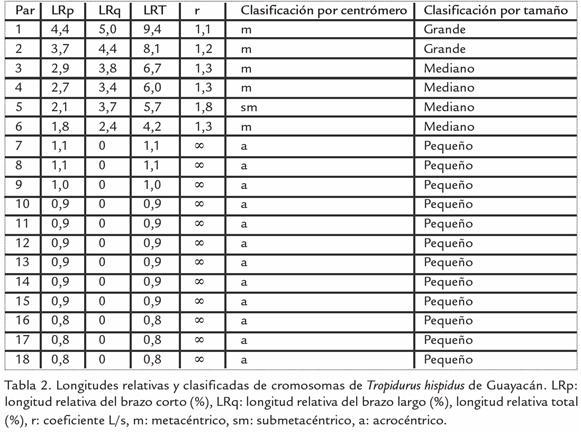
Los ejemplares fueron recolectados manualmente o en trampas Sherman y transportados vivos hasta el Laboratorio de Genética y Morfología Evolutiva de Peces del Instituto de Zoología y Ecología Tropical de la Universidad Central de Venezuela. Las localidades de muestreo fueron: 1) cerro El Tacal (10°23’N, 64°15’O; región continental), ubicada en la costa sur del golfo de Cariaco en el estado Sucre, caracterizado por un matorral xerófito macrotérmico, 2) alrededores de Guayacán (10°38’N, 63°49’O; región peninsular), situada al este de la península de Araya en el estado Sucre, presenta un espinar xerofítico macrotérmico y riachuelos de lechos secos y colinas de poca altitud (entre 20 y 30 msnm) y 3) isla coche (10°44’N, 63°54’O; región insular) estado Nueva Esparta, situada a 12 km de la península de Araya, con una superficie aproximada de 55 km² y una longitud de 11 km de este a oeste y seis de norte a sur, su relieve es poco accidentado con una altura no mayor de 60 msnm, un clima considerado árido y con un bosque tipo espinar xerofítico macrotérmico (Fig. 1; M.A.R.N.R., 1994; Cumana, 1999). El número de individuos estudiados fue de seis lagartos (tres machos y tres hembras) por cada localidad estudiada.

OBTENCIÓN DE METAFASES
Preparación de tejido. A cada individuo se le inyectó intraperitonealmente una solución acuosa del alcaloide colchicina a 0,05% en proporción de 0,004 mL/1gr de peso del animal. Este reactivo detiene el proceso de división celular durante la metafase, rompiendo fibras del huso y liberando los cromosomas, observables al microscopio óptico. Transcurridas seis horas, se sacrificaron los animales induciéndoles hipotermia. A cada lagarto se le realizó una disección en la región ventral y se extrajo una porción de aproximadamente 1 cm de intestino delgado y este fue cortado longitudinalmente y lavado con abundante agua destilada, con el fin de eliminar los restos de desecho orgánico. Cada muestra de tejido fue colocado en KCl a 4% por 30 min a temperatura ambiente para producir un choque hipotónico y liberar los núcleos de las células. Para fijarlo, se dejó reposar en Carnoy (3 partes de metanol en 1 parte de ácido acético) por 15 min, repitiéndose el procedimiento tres veces. Luego, este material era guardado en un refrigerador hasta su posterior procesamiento (Kligerman y Bloom, 1977; Taylor y Boloño, 1975).
Preparación de láminas. Se colocó una porción de aproximadamente 5 x 5 mm de tejido antes procesado sobre una lámina escavada por un minuto, la misma contenía una gota de ácido acético al 50%, todo esto con el fin de disgregar las células (Lacadena, 1996). Luego con una pipeta Pasteur, se agregó una gota de esta suspensión sobre un portaobjeto identificado y apoyado sobre una plancha térmica a 50 ºC, repitiéndose la técnica en dos o tres campos diferentes del portaobjeto. Este procedimiento facilitó la ubicación de metafases, porque las células se rompen por la poca cantidad de líquido en la periferia de los anillos formados y a la alta temperatura. A continuación los porta-objetos se colorearon con Giemsa a 4% en buffer fosfato pH 6,8 por un tiempo de cinco a seis minutos; de esta manera se coloreaban núcleos y cromosomas, estos fueron observados en un microscopio Zeiss AxioLab con el objetivo de 100x (Nirchio y Oliveira, 2006). Para el estudio mitótico se elaboraron 40 láminas de tejido somático por cada localidad, para un total de 120 láminas y cinco metafases por individuo.
Montaje de cariotipos. Se eligieron metafases aisladas, evitando de esta manera confundir los cromosomas de otras células y se tuvo cuidado de evitar cromosomas sobrepuestos a fin de lograr una individualización de los mismos. Las metafases fueron fotografiadas con una cámara digital hp Photosmart M627 y la imagen digital fue procesada mediante el programa Adobe Photoshop 7.0, de esta manera se estableció su cariotipo e idiograma. El criterio tomado para determinar el número diploide (2n), fue el siguiente: si las primeras cinco metafases de un individuo producían un número idéntico de cromosomas, este era considerado significativo (Rodríguez, 1995).
Medidas cromosómicas. La morfología del cromosoma se encuentra determinada por la ubicación del centrómero, el cual se puede ubicar en cualquier parte a lo largo del cromosoma. Dependiendo de esta posición los cromosomas se pueden clasificar en cuatro categorías principales: metacéntrico presenta el centrómero en el centro del cromo-soma, submetacéntrico presenta el centrómero hacia un extremo y se pueden observar en el cromosoma un brazo largo (q) y uno corto (p). Los cromosomas con brazos muy cortos son denominados subtelocéntrico y aquellos en los que es visible solo un brazo con el centrómero en el extremo terminal se denominan acrocéntrico (Nirchio y Oliveira, 2006). En cada una de las 30 fotomicrografías digitalizadas de metafases tomadas por localidad, se midieron en el programa computarizado Sigma Scan Pro 5, 1997, las longitudes de los brazos pequeños (Xp) y largos (Xq) de los macrocromosomas, mientras que los microcromosomas solo se le midieron el largo total. Luego se realizó sumatoria de promedios ∑Xp y ∑Xq y así poder tener una media del tamaño total del cariotipo (TTC), este valor representa el 100% del cariotipo y a partir de este se calcularon las longitudes relativas (LR) para cada brazo (LRp y LRq) de cada par cromosómico.
A fin de reducir la subjetividad a la hora de clasificar los cromosomas por la posición del centrómero, se ha extendido el uso de la nomenclatura propuesta por Levan et al., 1964, que consiste en calcular el índice centromérico (r), obtenido dividiendo el tamaño del brazo largo entre el tamaño del brazo corto (r=1/s). Dependiendo del valor del índice centromérico los cromosomas se clasifican en metacéntrico (r de 1,00 a 1,70), submetacéntrico (r de 1,71 a 3,00), subtelocéntrico (r de 3,01 a 7,00) y acrocéntrico (r mayor que 7,01). Finalmente, una clasificación por tamaño, considerándose grande cuando la longitud total (%) es mayor a 7, mediano entre 4 - 7 y pequeño menor a 4 (Reig et al., 1980).
RESULTADOS
Todos los individuos de T. hispidus, de cada una de las tres poblaciones estudiadas, presentan un número diploide determinado de 36 cromosomas (2n = 36), con seis pares de macrocromosomas metacéntricos y submetacéntricos y 12 pares de microcromosomas acrocéntricos. El mecanismo de determinación sexual es del tipo XX:XY, siendo Y un microcromosoma acrocéntrico presente sólo en machos y el X otro microcromosoma, posiblemente, acrocéntrico (Fig. 2). El número de brazos cromosómicos o número fundamental de la especie es NF=48, considerando la existencia de un solo brazo en los cromosomas acrocéntricos y dos para el resto. El hecho de haber agrupado, los cromosomas de acuerdo a su tamaño, se debe a que se pudo establecer grupos de cromosomas de diferentes tamaños, determinándose mayor longitud relativa total en los cromosomas de cerro El Tacal, con respecto a los de Guayacán e isla Coche (Tabla 1; Tabla 2; Tabla 3). Los cromosomas van aumentando su longitud a medida que el área de estudio se encuentra unida al continente. Actuando la península de Araya como una zona de transición o intermedia entre la región continental e insular. Los macrocromosomas de los individuos de isla Coche son de morfología metacéntricos; en tanto que en los continentales se incrementa el número de submetacéntricos en los pares 3, 4 y 5. Sin embargo, para una mejor visualización en la diferenciación del tamaño de los cromosomas de cada población en estudio, se realizaron idiogramas haploides, ordenados de acuerdo al tamaño decreciente, de los seis pares de macrocromosomas (Fig. 3).


DISCUSIÓN
De acuerdo al análisis del cariotipo obtenido en cada una de las tres localidades estudiadas (cerro El Tacal, Guayacán e isla Coche) se determinó que T. hispidus presenta el cariotipo básico típico del género Tropidurus:2n=36 cromosomas, con seis pares de macrocromosomas metacéntricos o submetacéntricos y 12 pares de microcromosomas acrocéntricos (6M+12m; Becak et al., 1972; Navarro et al., 1990; Kasahara et al., 1996). Este tipo de cariotipo se considera primitivo por presentar un 2n=36 (Paull et al., 1976).
Los resultados obtenidos en el presente estudio coinciden con los señalados en lagartos del grupo torquatus. Nueve de las doce especies (T. cocorobensis, T. erythrocephalus, T. etheridgei, T. hispidus, T. hygomi, T. montanus, T. mucujensis, T. oreadicus y T. torquatus) que conforman el grupo presentan un número cromosómico 2n=36 (García, 1979; Kasahara et al., 1987a; Pellegrino et al., 1994; Kasahara et al., 1996). Sin embargo, en ochos poblaciones del grupo peruvianus de la vertiente occidental de los Andes, todas presentan un 2n=38; esta diferencia de cromosomas se debe a la presencia de un par adicional de macrocromosomas (14M+24m; Navarro et al., 1981). En el grupo nanuzae se presentan diferencias numéricas en los sexos, las hembras de cada especie presentan un 2n=36, con 12 macrocromosomas metacéntricos o submetacéntricos y 24 microcromosomas y los machos poseen un 2n=35, con 12 macrocromosomas metacéntricos o submetacéntricos y 23 microcromosomas, debido a una fusión centromérica entre dos microcromosomas (Kasahara et al., 1987b). Paull et al., 1976, estudiaron el cariotipo de tres especies Tropidurus de las Galápagos: T. albemarlensis, T. delanonis y T. duncanensis y todas ellas presentaron un número de 2n=36 (12M, 24m), donde los 12 macrocromosomas eran todos metacéntricos como en isla Coche. Los autores no especifican la morfología de los 24 microcromosomas y no indican diferencias cariotípicas entre sexos. Sin embargo, Kasaharaet al., 1987a, describieron tres tipos de cariotipos diferentes para T. hispidus de seis poblaciones de Brasil, de acuerdo a la intensidad de una contrición secundaria en la región distal del brazo largo en el par 2, pudiendo ser intensa (cariotipo A), ligera (cariotipo B) o ausente (cariotipo C). Posteriormente, Kasahara et al., 1987b, relacionaron la variación geográfica del cariotipo de T. hispidus de Brasil con sus características morfológicas, asociadas con el hábitat ocupado, donde el cariotipo A está relacionado con áreas arenosas, B y C sobre rocas en zonas de montaña hasta los 900 m de altitud. González, 2011, realizó un análisis morfométrico interpoblacional de la región dorsal de la cabeza de T. hispidus en el oriente de Venezuela y evidenció una cabeza larga en los lagartos del cerro El Tacal y ancha en la península de Araya y señala la posible existencia de dos morfotipos: uno de cabeza larga ocupando habitáculos rocosos y otro de cabeza ancha ocupando hábitats de vegetación.
Con respecto a la distribución de T. hispidus, Vitt, 1993, señala que se encuentra en toda la costa Atlántica de Brasil. Posiblemente la especie se extendió hacia Venezuela por el estado de Roraima en Brasil y Guyana, dispersándose por sabanas costeras hacia el este durante periodos de bajo nivel del mar (Vitt, 1996). Esta hipótesis se afianza debido a que al sureste y noreste de Venezuela, es donde se distribuyen los únicos representantes de la familia Tropiduridae, como son: Plica plica (pudiendo esta llegar hasta la región central), Plica umbra, Plica lumaria, Uranoscodon superciliosus, T. bogerti, T. panstictus (Donnelly y Myers, 1991). Extendiéndose T. hispidus hasta el oriente venezolano y colonizando islas al norte de los estados Sucre y Anzoátegui, llegando hasta el occidente a través de los Llanos.
Se sabe que el origen de algunas poblaciones de especies continentales está dentro del modelo “invasión-radiación”, en el cual un área continental es colonizada por uno o varios linajes ancestrales, que han sufrido “radiación adaptativa” dentro de zonas adaptativas vacías, lo que lleva a la sustitución de una biota adaptativamente inferior por otra superior (Cracraft, 1986). La biota continental presenta ciclos de vicarianza en especies ampliamente distribuidas, seguida por endemismos locales, con una posterior dispersión de las poblaciones de especies descendientes (Roig, 1994). Esto implica la aparición de formas nuevas con una amplia distribución, seguidas de nuevas vicarianza (Lomolino et al., 2006). Lo dicho anteriormente pudiera ser aplicado a la distribución de la familia Tropiduridae. La diferencia cariológica entre algunas de las subpoblaciones de T. hispidus en el presente trabajo, podría estar asociada a una serie de eventos vicariantes debido a la separación y formación de áreas geográficas. Como resultado de esa disyunción, puede ser factible el inicio de un proceso de especiación vicariante, generada por la fragmentación de las poblaciones ancestrales en poblaciones descendientes que divergen, porque están incapacitadas para intercambiar información genética (Futuyma, 1986). Kasahara et al., 1987b señalan que los resultados citogenéticos en lagartos Tropidurus amathites y Tropidurus divaricatus está en concordancia con un proceso de especiación alopátrica, cada especie ocupa un hábitat en particular a cada lado del río San Francisco en Brasil y sugieren que la diferenciación cromosómica fue establecida después de un aislamiento geográfico, acelerando el proceso de especiación de estas dos especies.
En el presente trabajo, se plantea un caso en particular de aislamiento de poblaciones por una barrera geográfica, como es la separación y formación del golfo de Cariaco, la cual debe ser ubicada en el tope del Pleistoceno Inferior, porque durante esa época se corrobora la existencia de un canal de poca profundidad de agua salada que parece seguir la alineación este-oeste y que ocupa el área deprimida de la falla geológica El Pilar. Por lo tanto, el origen del golfo de Cariaco está relacionado con la actividad tectónica de dicha falla, la cual se extiende en dirección este-oeste por unos 350 km, entre la fosa de Cariaco al oeste y el golfo de Paria al este (Caraballo, 1982).
La falla del Pilar contribuyó con la migración hacia el este de la placa Caribe con respecto a la placa Suramericana. Durante los períodos glaciales, cuando el mar descendió hasta unos 100 y 120 m, el golfo de Cariaco ha debido de quedar aislado del mar, pudiendo haber funcionado como un cuerpo de agua dulce en forma de lago o como una zona cenagosa, semejante a las lagunas de Campoma y Buena Vista, en la margen oriental del golfo de Cariaco (Audemard et al.,2007). En conclusión, se puede señalar entre 800.000 y 1’000.000 de años la edad aproximada en que se originó la incipiente cuenca de sedimentación que conformó posteriormente el golfo de Cariaco, hace 8.000 años antes del presente (Caraballo, 1982).
Manteniendo el mismo orden de ideas con respecto a los eventos de separación y formación de áreas geográficas, también se podría mencionar la formación de la depresión de Coche, ubicada frente a la costa noreste de la península de Araya. Según De Miro-Orell, 1974, la isla de Coche estaba unida a la península de Araya por el morro de Chacopata, formando un solo territorio unido a Venezuela hace aproximadamente 8.000 años. Se podía observar dos golfos: Cariaco y otro, ya desaparecido, ubicado en la actual depresión de Coche (Fig. 4). Posteriormente, isla Coche se desligó del estado Sucre, gracias a un efecto tectónico y su área de desprendimiento más cercana es el morro de Chacopata.

CONCLUSIONES
Los lagartos T. hispidus estudiados presentaron el cariotipo básico típico del género Tropidurus con seis pares de macrocromosomas metacéntricos y submetacéntricos y 12 pares de microcromosomas acrocéntricos, considerándose este tipo de cariotipo primitivo por presentar un 2n=36.
El conjunto de cromosomas de los lagartos de cerro El Tacal, tienen mayor longitud relativa total que los de Guayacán e isla Coche y los macrocromosomas de los lagartos de isla Coche presenta más pares con morfología metacéntrica, confirmándose esta característica del género Tropidurus de ambiente insular. Las mediciones de los cromosomas y la comparación morfológica de los cromosomas entre poblaciones contribuyó al entendimiento de las relaciones evolutivas o filogenéticas y al esclarecimiento de los mecanismos de la evolución de la especie en estudio.
Los resultados del número y forma de los cromosomas en diferentes poblaciones del lagarto T. hispidus, en el oriente de Venezuela, podría indicar un modelo de especiación alopátrica del tipo vicariante: las poblaciones insulares se encuentran aisladas geográficamente, debido a la formación de la depresión de Coche, mientras que las poblaciones continentales y peninsulares, están aisladas parcialmente debido a la formación del golfo de Cariaco; estas condiciones han determinado el aislamiento reproductivo de las poblaciones.
AGRADECIMIENTOS
Deseamos expresar nuestro más sincero agradecimiento al Instituto de Zoología y Ecología Tropical de la Universidad Central de Venezuela a su Postgrado de Zoología, al Laboratorio de Genética y Morfología Evolutiva de Peces, al Centro de Investigaciones Ecológicas de Guayacán de la Universidad de Oriente por permitir a los investigadores utilizar sus instalaciones y al señor Jesús Antonio Narváez (Chala) por su asistencia en el campo.
BIBLIOGRAFÍA
AUDEMARD F, BECK C, MOERNAUT J, RYCKER K, BATIST M, SÁNCHEZ J, et al., La depresión submarina de Guaracayal, estado Sucre, Venezuela: una barrera para la propagación de la ruptura cosísmica a lo largo de la falla de El pilar. Interciencia. 2007;32(11):735-741.
ÁVILA-PIRES T. Reptiles. En: Hollowell T. Reynolds R, Editors. Checklist of the terrestrial vertebrates of the Guiana shield. Bull Biol Soc Washington. 2005;13:24-40.
BECAK M, BECAK W, DENARO L. Chromosome polymorphism, geographical variation and karyotypes in sauria. Caryologia. 1972;25:313-326.
CASTILLO Z, PRIETO A, ANGULO C, GONZALEZ L. Hábitos alimentarios del lagarto Tropidurus hispidus (Spix 1825) (Sauria: Tropiduridae) en Araya, estado Sucre e isla de Coche, estado Nueva Esparta, Venezuela. Saber. 2009;21(3):229-234.
CARABALLO L. El golfo de Cariaco. Parte IV. Los cambios del nivel del mar. La actividad tectónica y el origen del golfo. Tipos de costas. Perspectivas de hidrocarburos. Bol Inst Oceanogr. Venezuela.1982;21(1-2):85-99.
CORNEJO P, PRIETO A. Inventario de reptiles en dos zonas semiáridas del noreste de la península de Araya. Estado Sucre, Venezuela. Acta Cient Venez. 2001;52(4):265-271.
CUMANA L. Caracterización de las formaciones vegetales de la península de Araya, estado Sucre, Venezuela. Saber. 1999;11(1):7-16.
CRACRAFT J. Origin and evolution of continental biotas: speciation and historical congruence within the Australian avifauna. Evolution. 1986;40: 977-996.
DE MIRÓ-ORELL M. Morfología submarina y sedimentos marinos recientes del margen continental del nororiente de Venezuela. Publicaciones de la Comisión Organizadora de la III Conferencia de las Naciones Unidas sobre Derechos del Mar. Caracas; 1974.
DONNELLY M, MYERS C. Herpetological results of the 1990 expedition to the summit of Cerro Guaiquinima, with descriptions of new tepui reptiles. Am Mus Novit. 1991. n.º 3107.
FUTUYMA D. Evolutionary Biology. Ed. Sinauer Associates, Inc. Massachusetts. Segunda edición; 1986.
GARCÍA M. Estudio citogenético de la población de Tropidurus hispidus (Spix), (Sauria: Iguanidae) del estado Sucre. [Tesis de pregrado]. Cumaná: Departamento de Biología, Escuela de Ciencias, Universidad de Oriente; 1979.
GONZÁLEZ L, PRIETO A, MOLINA C, VELÁSQUEZ J. Los reptiles de la península de Araya, estado Sucre, Venezuela. Interciencia. 2004;29(8):428-434.
GONZÁLEZ L. Variación morfométrica y genética en poblaciones del lagarto Tropidurus hispidus (Spix 1825) (Sauria: Tropiduridae) en regiones xerofíticas del estado Sucre, islas Coche y Cubagua, Venezuela y sus implicaciones biogeográficas. [Tesis doctoral]. Caracas, Facultad de Ciencias. Instituto de Zoología y Ecología Tropical. Universidad Central de Venezuela; 2011.
KASAHARA S, YONENAGA-YASSUDA Y, RODRIGUES M. Geographical karyotypic variations and chromosome banding patterns in Tropidurus hispidus (Sauria, Iguanidae) from Brazil. Caryologia. 1987a;40(1-2):43-57.
KASAHARA S, YONENAGA-YASSUDA Y, RODRIGUES M. Karyotype and evolution of the Tropidurus nanuzae species group (Sauria, Iguanidae). Rev Brasil Genet. 1987b;10(2):185-197.
KASAHARA S, MACHADO K, RODRIGUES M, YONENAGA-YASSUDA Y. Comparative cytogenetic studies of eleven species of the Tropidurus torquatus group (Sauria, Tropiduridae), with banding patterns. Hereditas. 1996;125(1):37-46.
KLIGERMAN A, BLOOM S. Rapid chromosome preparations from solid tissues of fishes. J Fish Res Board Can. 1977;43:266-269.
LACADENA J. Citogenética. Madrid, Editorial Complutense; 1996.
LA MARCA E. Lista actualizada de los reptiles de Venezuela. En: La Marca E. editor. Vertebrados actuales y fósiles de Venezuela. Mérida, Venezuela: Museo de Ciencia y Tecnología, Universidad de los Andes; 1997. p. 103-120.
LEVAN A, FREDGA K, SANDBERG A. Nomenclature for centromeric position on chromosomes. Hereditas. 1964;52:201-220.
LOMOLINO M, RIDDLE B, BROWN J. Biogeography. Massachusetts, Sinauer Associates, Inc; 2006.
M.A.R.N.R. Atlas del estado Nueva Esparta. Graficas Internacional, Porlamar; 1994.
MARKEZICH A. New Distribution Records of Reptiles from Western Venezuela. Herpetol Rev. 2002;33(1):69-74.
MYERS C, DONNELLY M. Herpetofauna of the Yutajé-Corocoro Massif, Venezuela: Second report from the Robert G. Goelet American Museum-Terramar expedition to the northwestern tepuis. Bull Amer Mus Nat Hist. 2001;261:1-85.
NAVARRO J, SALLABERRY M, VELOSO V, VALENCIA J. Diversidad cromosómica en lagartos (Squamata: Sauria). 1- Avances citotaxonómicos. Perspectivas de estudios evolutivos en Iguanidae. Medio Ambiente. 1981;5(1-2):28-38.
NAVARRO J, ITURRA P, HERNANDO A. Estudios cromosómicos en una población de Tropidurus torquatus (Sauria, Iguanidae) de la provincia de Corrientes, Argentina. Acta Zool Lilloana. 1990;41:231-234
NIRCHIO M, OLIVEIRA C. Citogenética de peces. Rectorado de la Universidad de Oriente, Porlamar; 2006.
PAULL D, WILLIAMS E, HALL W. Lizard karyotypes from the Galapagos Islands: Chromosomes in phylogeny and evolution. Breviora. 1976;441:1-31
PELLEGRINO K, YONENAGA-YASSUDA Y, RODRÍGUEZ M. Cytogenetic studies in six species of Tropiduridae (Sauria). Rev Brasil Genet. 1994;17:401-408.
PRIETO A, LEÓN J, LARA O. Reproduction in the tropical lizards, Tropidurus hispidus (Sauria: Iguanidae). Herpetologica. 1976;32(3):318-323.
REIG O, AGUILERA M, BARROS A, USECHE M. Chromosomal speciation in a ressenkreis of venezuelan spiny rats (Genus Proechimys, Rodentia, Echimydae). Genetica. 1980;52/53:291-312.
RODRÍGUEZ M. Cariotipo y patrones de bandas C en Bufo spinulosus arequipensis (Amphibia: Anura). Rev Ecol Lat Am. 1995;2(1-3):5-11.
ROIG S. Historia biogeográfica de América del Sur Austral. Multequina. 1994;3:167-203.
STATON M, DIXON J. The herpetofauna of the central Llanos of Venezuela: Noteworthy records, a tentative checklist and ecological notes. J Herpetol. 1977;11(1):17-24.
SIGMA SCAN PRO 5. Image analysis software. Sigma Scan Pro. SYSTAT Sofware Inc; 1997.
TAYLOR R, BOLOÑO R. Descripción de un método simple y económico para el estudio de cariotipos en serpientes. Rev Biol Trop. 1975;23:177-183.
VELÁSQUEZ D, GONZÁLEZ L, PRIETO A, VELÁSQUEZ J. Hábitos alimentarios del lagarto Tropidurus hispidus (Spix 1825), (Sauria: Teiidae) en cerro el Tacal, Parque Nacional Mochima, estado Sucre, Venezuela. Acta Biol Venez. 2007;27(2):9-18.
VELÁSQUEZ J, GONZÁLEZ L. Ecología térmica del lagarto Tropidurus hispidus (Spix 1825) (Sauria: Tropiduridae) en el oriente de Venezuela. Acta Biol Colomb. 2010;15(2):25-36.
VITT L. Ecology of isolated open-formation Tropidurus (Reptilia: Tropiduridae) in Amazonian lowland rain forest. Can Zool J. 1993;71:2370-2390.
VITT L. Biodiversity of Amazonian lizards. En: Gibson A, editor. Neotropical biodiversity and conservation. Mildred E. Mathias Botanical Garden, Los Angeles, University of California; 1996. p. 89-108.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Article abstract page views
Downloads
License
Copyright (c) 2011 Acta Biológica Colombiana

This work is licensed under a Creative Commons Attribution 4.0 International License.
The acceptance of manuscripts by the Journal implies its electronic edition of open Access under Creative Commons Attribution License 4.0, and the inclusion and diffusion of the complete text through the institutional repository of the Universidad Nacional de Colombia and in all the specialized data bases that the editor considers adequate for its indexation to increase Journal visibility.
Acta Biológica Colombiana allows authors to archive, download and distribute the final published version, as well as pre-print and post-print versions including a header with the bibliographic reference of published article. The journal encourages the authors to distribute the final versión through Internet, for example in their personal or institutional web pages, and scientific social networks.