Craneoplastía con implante de polimetilmetacrilato (PMMA) para corregir secuela de trauma. Reporte de caso
Craneoplasty with a polymethylmethacrylate (PMMA) Implant to correct trauma sequel. A case report
DOI:
https://doi.org/10.15446/aoc.v10n2.87341Palabras clave:
Fractura, implante, polimetilmetacrilato (PMMA), traumatismo craneoencefálico, trauma (es)Fracture, Implant, Polymethylmethacrylate (PMMA), Traumatic brain injury, Trauma (en)
Introducción: los defectos del cráneo y las anomalías del hueso craneofacial que requieren reconstrucción son comunes en una variedad de procedimientos neuroquirúrgicos. Después de una craniectomía o de fracturas craneofaciales posteriores a traumatismos cráneoencefálicos, los pacientes pueden desarrollar defectos cosméticos importantes. Algunos de estos son la depresión de la piel y un defecto de hundimiento que lleva a una apariencia asimétrica de la cabeza, sin dejar de lado las repercusiones físicas, neurológicas y psicológicas que estas lesiones conllevan. La reconstrucción craneofacial y la craneoplastía tienen una larga historia, pero las nuevas técnicas quirúrgicas y una multitud de opciones de materiales han impulsado recientemente el avance en esta área. Los implantes de polimetilmetacrilato (PMMA) han demostrado ser estables, biocompatibles, no conductores, radiotransparentes y de bajo costo. Es así que se pueden colocar y modificar fácilmente, con lo que se elimina la morbilidad del sitio donante. Presentación del caso: en este artículo presentamos un caso de craneoplastía de defecto frontal, posterior a traumatismo, cuya reconstrucción fue realizada mediante una prótesis de polimetilmetacrilato (PMMA) en el Hospital General Xoco de la Cuidad de México. Conclusión: se reporta la reducción del tiempo quirúrgico, además de un costo de la prótesis accesible para el paciente; de esta manera, se obtuvieron resultados satisfactorios y mejoras en el contorno estético facial, en tanto se permitió cobertura y protección para el tejido encefálico.
La reconstrucción craneofacial y la craneoplastía tienen una larga historia, pero las nuevas técnicas quirúrgicas y una multitud de opciones de materiales han impulsado recientemente el avance en esta área.1 Los implantes de polimetilmetacrilato (PMMA) han demostrado ser estables, biocompatibles, no conductores, radiotransparentes y de bajo costo.6 Se pueden colocar y modificar fácilmente y se elimina la morbilidad del sitio donante. En este artículo presentamos un caso de craneoplastía de defecto frontal posterior a traumatismo realizada mediante una prótesis de polimetilmetacrilato (PMMA) en el Hospital General Xoco de la Cuidad de México, con la cual se logró reducir el tiempo quirúrgico, además el costo de la prótesis fue accesible para el paciente y se obtuvieron resultados satisfactorios.
Introduction: Skull defects and craniofacial bone abnormalities that require reconstruction are common in a variety of neurosurgical procedures. After craniectomy or craniofacial fractures following cranioencephalic trauma, patients can develop important cosmetic defects, such as depression of the skin and a sunken flap that can lead to an asymmetrical appearance of the head, without neglecting the physical and psychological repercussions. neurological that these injuries carry. Craniofacial reconstruction and cranioplasty have a long history, but new surgical techniques and a multitude of material options have recently fueled progress in this area. Polymethylmethacrylate (PMMA) implants have proven to be stable, biocompatible, non-conductive, radiolucent, and inexpensive. They can be easily placed and modified and the morbidity of the donor site is eliminated. Clinical case: In this article, we present a case of frontal defect cranioplasty after trauma performed using a polymethylmethacrylate (PMMA) prosthesis at the General Hospital Xoco in Mexico City. Conslusion: The surgical time could be reduced, in addition to the cost of the prosthesis. It was accessible to the patient and obtained satisfactory results such as improvements in the facial aesthetic contour and obtained coverage and protection for the brain tissue.
Craniofacial reconstruction and cranioplasty have a long history, but new surgical techniques and a multitude of material options have recently pushed forward in this area.1 Polymethyl methacrylate (PMMA) implants have been shown to be stable, biocompatible, non-conductive, radiolucent and inexpensive.6 They can be easily placed and modified and the morbidity of a donor is eliminated. In this article we present a case of cranioplasty of frontal defect following trauma caused by a PMMA prosthesis in the Hospital General Xoco of the Mexico City, with which the surgical time was reduced, also the cost of the prosthesis was accessible to the patient and satisfactory results were obtained.
Craneoplastía con implante de polimetilmetacrilato (PMMA) para corregir secuela de trauma. Reporte de caso
Craneoplasty with a polymethylmethacrylate (PMMA) Implant to correct trauma sequel. A case report
Craneoplastía con PMMA en secuela de trauma
Jorge Omar Ramírez García, Lidia Araceli Campos Ramírez, José Leandro Ernesto Lucio Leonel, Alfonso Uribe Campos, Alejandro Benavides Ríos, José Ernesto Miranda Villasana
|
Recibido |
Aprobado |
Publicado |
|
16/04/2020 |
30/06/2020 |
15/07/2020 |
Citación sugerida: Ramírez García JO, Campos Ramírez LA, Lucio Leonel JLE, Uribe Campos A, Benavides Ríos A, Miranda Villasana JE. Craneoplastía con implante de polimetilmetacrilato (PMMA) para corregir secuela de trauma. Reporte de un caso. Acta Odonto Col. 2020; 10(2): xx-xx. Disponible en: https://revistas.unal.edu.co/index.php/actaodontocol/article/view/87341
Resumen
Introducción: los defectos del cráneo y las anomalías del hueso craneofacial que requieren reconstrucción son comunes en una variedad de procedimientos neuroquirúrgicos. Después de una craniectomía o de fracturas craneofaciales posteriores a traumatismos cráneoencefálicos, los pacientes pueden desarrollar defectos cosméticos importantes. Algunos de estos son la depresión de la piel y un defecto de hundimiento que lleva a una apariencia asimétrica de la cabeza, sin dejar de lado las repercusiones físicas, neurológicas y psicológicas que estas lesiones conllevan. La reconstrucción craneofacial y la craneoplastía tienen una larga historia, pero las nuevas técnicas quirúrgicas y una multitud de opciones de materiales han impulsado recientemente el avance en esta área. Los implantes de polimetilmetacrilato (PMMA) han demostrado ser estables, biocompatibles, no conductores, radiotransparentes y de bajo costo. Es así que se pueden colocar y modificar fácilmente, con lo que se elimina la morbilidad del sitio donante. Presentación del caso: en este artículo presentamos un caso de craneoplastía de defecto frontal, posterior a traumatismo, cuya reconstrucción fue realizada mediante una prótesis de polimetilmetacrilato (PMMA) en el Hospital General Xoco de la Cuidad de México. Conclusión: se reporta la reducción del tiempo quirúrgico, además de un costo de la prótesis accesible para el paciente; de esta manera, se obtuvieron resultados satisfactorios y mejoras en el contorno estético facial, en tanto se permitió cobertura y protección para el tejido encefálico.
Palabras clave: fractura; implante; polimetilmetacrilato (PMMA); traumatismo craneoencefálico; trauma.
Abstract
Introduction: Skull defects and craniofacial bone abnormalities that require reconstruction are common in a variety of neurosurgical procedures. After craniectomy or craniofacial fractures following cranioencephalic trauma, patients can develop important cosmetic defects, such as depression of the skin and a sunken flap that can lead to an asymmetrical appearance of the head, without neglecting the physical and psychological repercussions. neurological that these injuries carry. Craniofacial reconstruction and cranioplasty have a long history, but new surgical techniques and a multitude of material options have recently fueled progress in this area. Polymethylmethacrylate (PMMA) implants have proven to be stable, biocompatible, non-conductive, radiolucent, and inexpensive. They can be easily placed and modified and the morbidity of the donor site is eliminated. Clinical case: In this article, we present a case of frontal defect cranioplasty after trauma performed using a polymethylmethacrylate (PMMA) prosthesis at the General Hospital Xoco in Mexico City. Conslusion: The surgical time could be reduced, in addition to the cost of the prosthesis. It was accessible to the patient and obtained satisfactory results such as improvements in the facial aesthetic contour and obtained coverage and protection for the brain tissue.
Key words: Fracture; Implant; Polymethylmethacrylate (PMMA); Traumatic brain injury; Trauma.
Introducción
La craneoplastía es uno de los procedimientos quirúrgicos más antiguos que se conocen gracias a la evidencia arqueológica. Los antiguos incas utilizaban oro para reconstruir los hoyos de trepanación alrededor del año 3000 a. C. (1). Desde entonces, diferentes autoinjertos y materiales aloplásticos han sido utilizados con diversos resultados, siendo el hueso autólogo el injerto de material ideal para la reconstrucción primaria (2). Sin embargo, su disponibilidad es limitada, por lo que es difícil poder darle la forma del defecto durante la cirugía, así como colocar suficiente hueso en la calota. Cuando los defectos son muy grandes debe considerarse, además, un segundo sitio donador, así como la morbilidad asociada.
Sobre los impactos de la restauración de la arquitectura normal del cráneo en el paciente es relevante destacar que estos puede tener importantes beneficios psicosociales, así como físicos, al restablecer la barrera protectora del cráneo. Dentro de los beneficios de realizar craneoplastías se incluyen: mejoría neurológica, principalmente en la función motora; mejora en el flujo sanguíneo cerebral y prevención de trastornos en la dinámica del líquido cefaloraquídeo (2). Empero, una de las indicaciones principales de la craneoplastía es el llamado “síndrome del trepanado”, el cual se caracteriza por cefalea, mareos, irritabilidad, pérdida de la concentración, depresión, ansiedad, intolerancia al ruido y al movimiento vibratorio (3).
Un estudio retrospectivo realizado por el Departamento de Cirugía Cráneo Maxilofacial del Centro Médico Universitario de Maastricht, publicado en 2016 en el que evaluaron la mejora en la calidad de vida de 29 pacientes después de una craneoplastía, reportó que antes de la operación el 48.0% de los pacientes se quejaban de cefaleas. La craneoplastía resolvió el dolor en el 50.0% de estos pacientes y mejoró la situación del dolor en otros tres casos (4). Si bien existen informes de mejoría cognitiva después de la craneoplastía, en la actualidad, los beneficios cosméticos y protectores de la reconstrucción del cráneo son los que motivan la realización de este tipo de cirugía (1).
El momento de la craneoplastía debe adaptarse a cada caso en particular y a cada paciente. Además, para un tratamiento adecuado y la eliminación de la infección craneal, si llegase a existir, (así como cualquier infección sistémica) (2) es prioritario que transcurra el tiempo suficiente. Asimismo, la elección del tipo de material de un implante es fundamental dentro del procedimiento. Esta elección depende del tamaño y de la forma del defecto que ha de ser reconstruido, así como de las condiciones del sitio receptor. Así pues, defectos de hasta 25 cm2 en sitios de fracturas conminutas pueden ser fácilmente cubiertos con mallas. Para defectos mayores de 25 cm2 la reconstrucción con hueso autólogo es el tratamiento de elección (3). El sustituto ideal debe ser compatible, fuerte, liviano, maleable, no magnético, estar asegurado firmemente y tener estabilidad a largo plazo (3).
A partir del año 2000, uno de los materiales más usados para la reconstrucción del cráneo es el polimetilmetacrilato (PMMA) (5). El metacrilato de metilo es un éster polimerizado de ácido acrílico que existe en forma de polvo y se mezcla con un monómero líquido, el peróxido de benzoilo. En una reacción exotérmica, el metacrilato de metilo se enfría lentamente y pasa a ser un material translúcido con una resistencia comparable a la del hueso. Durante esta fase de enfriamiento, el metacrilato de metilo puede moldearse para adaptarse a cualquier defecto del cráneo, así como a áreas complejas del mismo. Estos son implantes estables, biocompatibles, químicamente inertes, no conductores, radiotransparentes y de costo accesible. Se pueden colocar y modificar fácilmente y eliminan la morbilidad del donante (6). Igualmente, con la implementación de las tecnologías actuales, el uso de la tomografía y la ayuda de la esteriolitografía se puede realizar la prótesis de (PMMA) a la medida. Con ello se evita que la reacción térmica afecte los tejidos y disminuyen, significativamente, los tiempos quirúrgicos.
En este trabajo presentamos un caso clínico de corrección de defecto frontal posterior a traumatismo craneoencefálico mediante el uso de una prótesis de PMMA, con la cual se obtuvieron buenos resultados.
Caso clínico
Se presenta paciente masculino de 45 años de edad, quien acude al Hospital General de Xoco para valoración y tratamiento reconstructivo. Su diagnóstico arroja la presencia de secuelas de craniectomía por traumatismo craneoencefálico y drenado de hematoma epidural previo en la región frontal. El paciente presenta antecedentes personales y heredofamiliares sin importancia para el padecimiento actual, sin deterioro neurológico con un Glasgow de 15 puntos. Expone, además, asimetría del tercio superior craneal correspondiente a la región frontal del lado derecho, de aproximadamente 6 cm de diámetro, con hundimiento de los tejidos blandos en dicha zona (Imagénes 1 y 2).

Posterior a su diagnóstico, se inicia protocolo de estudio y reconstrucción, que comprende TAC simple con cortes de 1mm para reconstrucción 3D del macizo facial, estudios de laboratorio preoperatorios y fotografía clínica facial. Del estudio de TAC se realiza estereolitografía como medio complementario para la planeación de la reconstrucción del defecto óseo, la cual es enviada al servicio de Prótesis Maxilofacial de la Universidad Nacional Autónoma de México para la elaboración de implante de PMMA, no hecho por computadora. Para ello, se utiliza un modelo de estereolitografía del paciente que contemple los límites de la reconstrucción y por lo tanto, el grosor para la adecuada proyección de los tejidos blandos. Posteriormente, se modifican los diferentes prototipos para la elaboración final del implante, así como la colocación del material de osteosíntesis, el cual, como se puede observar, fue sumergido y confeccionado en el material de PMMA (Imágenes 3 – 6).
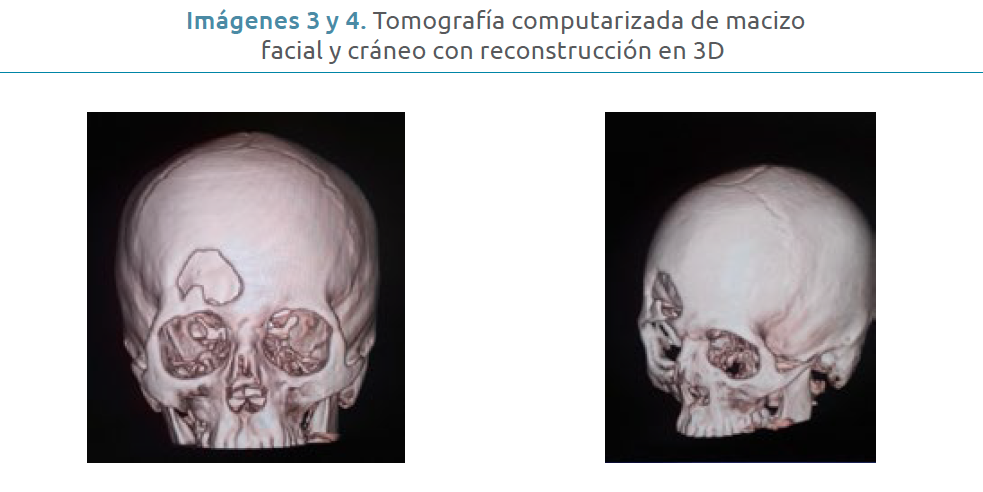

Imágenes 3 y 4. Tomografía computarizada de macizo facial y cráneo con reconstrucción en 3D
Una vez terminado y aceptado el implante, el paciente es programado. Se realiza, entonces, bajo anestesia general e intubación orotraqueal el procedimiento planeado, a través de un abordaje bicoronal subgaleal para aprovechar la cicatriz por el abordaje previo con disección de la duramadre, hasta obtener el espacio correspondiente a la colocación del implante en la región frontal (Imagen 7). Luego, se coloca el implante y se fija mediante tornillos autoperforantes de 1.2 x 6 mm de longitud de titanio (Imagénes 8 y 9).

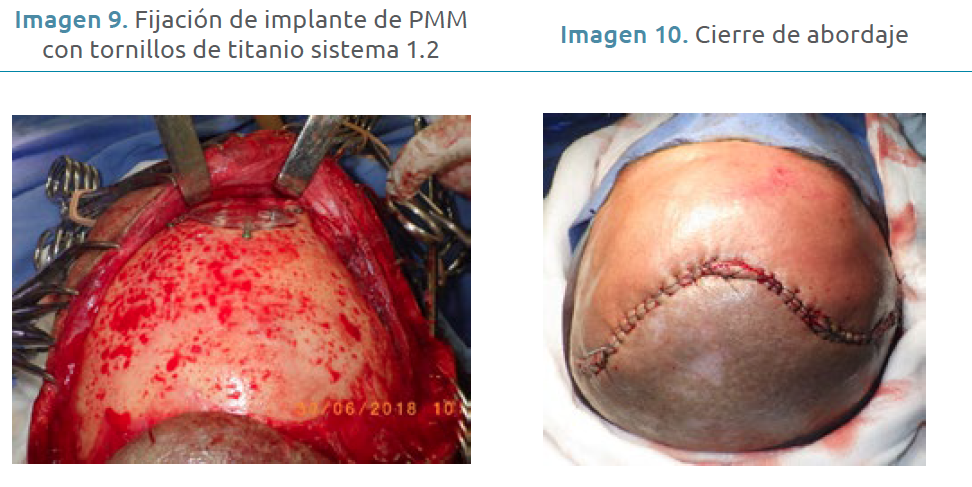
Finalmente, se reposiciona el colgajo bicoronal con puntos continuos de nylon 3-0 dejando drenoback de 1/8, se coloca vendaje cefálico y se dan indicaciones postoperatorias correspondientes hasta su alta hospitalaria. En paralelo, se continuaron con los controles en la consulta externa (Fig. 10). Se destaca la evolución del paciente sin complicaciones, en la que se observó la obtención de un contorno simétrico, una adecuada proyección de los tejidos blandos que restituyen el volumen de la región frontal, así como una adecuada biocompatibilidad del material de reconstrucción, con lo que se resolvió el defecto óseo y estético del paciente (Imágenes 11 y 12).
En el control postoperatorio, a los 9 meses, no se observaron complicaciones, entre las que podrían estar procesos infecciosos, fístula, deformidad en la zona del implante o reacciones tisulares al PMMA (Imagen 13).


Consideraciones éticas
El caso presentado corresponde a un paciente adulto cuyo diagnóstico y tratamiento posterior a traumatismo craneoencefálico, fue realizado en el Hospital General Xoco. El paciente brindó el consentimiento informado para la presentación del caso. De igual forma, se obtuvó la autorización del jefe del departamento de Cirugía Oral y Maxilofacial del mismo hospital para la revisión del protocolo del tratamiento y publicación del caso, esto con el objetivo de procurar la aplicación de una Medicina Basada en la Ética.
Discusión
La reconstrucción de la bóveda craneal no solo se realiza por razones estéticas y de protección, sino que también se requiere para el mantenimiento y restauración del sistema circulatorio - fisiológico del cerebro, en lo que refiere a la regulación de la presión. Este procedimiento reconstructivo, conocido como craneoplastía, se puede llevar a cabo de acuerdo con diversas técnicas y utilización de diferentes materiales (4). Aquí es importante precisar que no existe una técnica ideal, dado que cada método tiene sus limitaciones. Por ejemplo, cuando se utilizan autoinjertos se encuentran problemas respecto a la obtención del contorno del injerto satisfactorio, la estabilidad a largo plazo y particularmente, la reabsorción, junto con la posible morbilidad del sitio donante. De igual modo, se han reportado altas tasas de infección y fallas materiales con biomateriales como el titanio y la hidroxiapatita (1).
La craneoplastía con PMMA que presentamos en este trabajo tiene muchas ventajas. La primera es la capacidad de reconstruir defectos grandes o complicados con un resultado aceptable, estéticamente hablando. La segunda tiene que ver con el uso de un material económico (PMMA), con propiedades físicas y biológicas bien conocidas. La tercera consiste en evitar el contacto entre el implante y el tejido nervioso durante el proceso de polimerización exotérmica; al realizarse como en este caso previamente a la medida con ayuda de un modelo de esteriolitografia, y con una técnica de encerado previo. La cuarta y quinta ventaja aquí destacadas están relacionadas con la reducción de costos, asociados con la disponibilidad de la tecnología de modelo de estereolitografía, y el acortamiento del tiempo quirúrgico al hacer el implante a la medida de manera previa (6).
Los materiales de la craneoplastía distintos de PMMA modelados hasta ahora con la ayuda de las técnicas CAD / CAM incluyen titanio, polímero reforzado con fibra de carbono e hidroxiapatita porosa (6). Estos implantes tienen la desventaja de ser costosos pero efectivos para los defectos complejos del cráneo. Los implantes de titanio pueden producir efecto “artefacto” en exploraciones tomográficas computarizadas postoperatorias e imágenes de resonancia magnética, además de que presentan elevada conductividad térmica, así como el adelgazamiento de los tejidos blandos (7). La hidroxiapatita tiene una buena osteoconductividad, pero es frágil y se agrieta fácilmente. Ducic en el 2002 reveló que estos implantes presentan mayor número de complicaciones en comparación a los implantes con acrílico o aloinjerto, principalmente debido a la infección y la exposición del material. En contraste, el polimetilmetacrilato es fácil de moldear y es más resistente, pero tiene una osteoconductividad relativamente pobre (5,2).
El PMMA es una resina acrílica termopolimerizable de alta viscosidad y un material rentable y probado para craneoplastía. Tiene buenas propiedades de biocompatibilidad, ofrece una rigidez sustancial y se ha demostrado que es un buen sustituto del hueso normal en términos de resistencia al impacto (8). La polimerización de PMMA acompaña a una reacción química exotérmica, y la cantidad de calor liberado se correlaciona positivamente con el volumen y el espesor del implante. El calor liberado puede dañar el tejido adyacente al implante, (por eso en este caso se fabricó de manera previa) por lo que es necesario tomar medidas de protección, incluida la cobertura multicapa y el riego con solución salina fría. En un estudio in vitro realizado por Stelnicki y Ousterhout en 1996, se encontró que sin irrigación, la temperatura del implante alcanza los 81.4 ° C en su centro durante aproximadamente 45 segundos del proceso de la polimerización y sugirió que era insuficiente para irrigar los implantes de PMMA de más de 7 mm de espesor, ya que se registraron> 60 ° C para más de 20 segundos. Esto indica necrosis térmica del tejido circundante8, por lo anterior, se han desarrollado nuevas técnicas para evitar estos problemas, las cuales separan la fabricación de los implantes de PMMA del propio procedimiento quirúrgico y permiten lograr la creación de implantes hechos a la medida tal y como lo presentamos en este caso (8,4).
En la craneoplastía con PMMA, el grosor del implante debe ser lo más correcto posible para una resistencia optimizada, la transmisión de carga y la simetría del cráneo, lo que también permite el cierre de la herida sin tensión (8). Las técnicas para la elaboración de implantes de PMMA son variadas. En este caso se utilizó la técnica de placa preelaborada, en la cual se practicó una tomografía simple de cráneo al paciente. Posteriormente, esta se analizó con estereolitógrafo, elemento con el que a su vez se elaboró (con carbonato de calcio) un modelo tridimensional de tamaño real del cráneo del paciente con el defecto craneal a reparar; sobre este modelo se desarrolló la placa de metilmetacrilato con la que se llevó a cabo la craneoplastía. Luego, esta placa fue esterilizada en gas. Durante la cirugía, en el momento en el que se descubrió por completo el defecto craneal y los bordes fueron plenamente identificados, se procedió a abrir la bolsa contenedora de la placa y a colocarla en la posición exacta del defecto (11). Respecto a los abordajes usados para la exposición del cráneo existen distintas perspectivas. En este caso se decidió realizar un colgajo bicoronal, el cual permitió una exposición óptima y dejó una cicatriz apenas visible en la línea del cabello del paciente (9).
La tasa global de complicaciones posteriores a craneoplastías con PMMA se encuentra en un rango de 17,4% −21,1%, dentro de las cuales se encuentra la infección postoperatoria y la ruptura o fractura de la placa (2). En un estudio realizado por Walcott et al. se demostró que las tasas de infección por craneoplastía se predijeron por la aparición de reoperaciones y la infección profunda previa después de una craniectomía descompresiva (7). Mientras tanto, en otros estudios se ha reportado que los implantes de PMMA prefabricados redujeron significativamente el tiempo de operación (190 ± 11 vs. 149 ± 7 min) y la pérdida de sangre (250 ± 22 contra 194 ± 27 ml, no significativa) en comparación con los implantes de PMMA moldeados intraoperatoriamente (8).
Generalmente, los resultados a largo plazo de las craneoplastías con PMMA han sido aceptables (5). Se han desarrollado nuevas técnicas para evitar los problemas de necrosis de los tejidos por la reacción exotérmica y para separar la fabricación de los implantes de PMMA del propio procedimiento quirúrgico. Adicionalmente, se cuenta con las técnicas de fabricación asistida (CAD / CAM) y las técnicas de creación rápida de prototipos (estereolitografía) para construir modelos en 3-D. Estos últimos han simplificado la fabricación prequirúrgica de implantes precisos y correctamente contorneados, lo que ha determinado el acortamiento del tiempo quirúrgico al hacer el implante a la medida previamente (10,12).
Conclusión
La técnica aquí presentada mostró una buena satisfacción general del paciente, considerando el resultado estético y funcional sin complicaciones generales en el rango de otros métodos de craneoplastía aloplástica (8). Además, el PMMA es barato, de fácil disponibilidad y uso. La experiencia del uso del PMMA en este caso ha sido favorable, así mismo se considera que una de las claves para su uso exitoso consiste en evitar el contacto sinusal y lograr una fijación rígida, para con ello prevenir complicaciones de tipo infecciosas (14,15).
Agradecimientos
Agradecemos a las instituciones que apoyaron la creación de este artículo, en especial al Hospital General Xoco de la Ciudad de México, por aportar los datos en los cuales se apoyó este artículo, así como a la Universidad Nacional Autónoma de México.
Contribución de los autores
Dr. Jorge Omar Ramírez García: redacción del artículo. Dra. Lidia Araceli Campos Ramírez: revisión de la literatura y redacción del artículo. Dr. Alfonso Uribe Campos: revisión del artículo y correciones. Dr. José Leandro Ernesto Lucio Leonel: revisión del articulo y correcciones. Dr. Alejandro Benavides Ríos: realización del implante de PMMA. Dr. José Ernesto Miranda Villasana: revisión del artículo y correciones.
Conflictos de interés
Los autores refieren no tener conflictos de interés.
Referencias
1. Williams LR, Fan KF, Bentley RP. Custom-made titanium cranioplasty: early and late complications of 151 cranioplasties and review of the literature. Int. J. Oral Maxillofac. Surg. 2015; 44(5): 599–608. https://doi.org/10.1016/j.ijom.2014.09.006
2. Piazza M, Grady MS. Cranioplasty. Neurosurg Clin N Am. 2017; 28(2): 257–265. https://doi.org/10.1016/j.nec.2016.11.008
3. González de Santiago MA, Chaurand Lara J, Sandoval B. Reconstrucción craneal con implante personalizado. Rev Esp Cirug Oral y Maxilofac. 2011; 33(1): 40–44. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1130-05582011000100007
4. Zegers T, Laak-Poort M, Koper D, Lethaus B, Kessler P. The therapeutic effect of patient-specific implants in cranioplasty. Journal of Cranio-Maxillo-Facial Surgery. 2017; 45(1): 82–86. http://doi.org/10.1016/j.jcms.2016.10.016
5. Khader BA, Towler MR. Materials and techniques used in cranioplasty fixation: A review. Materials Science and Engineering. 2016; 66(1) 315–322. https://doi.org/10.1016/j.msec.2016.04.101
6. Unterhofer C, Wipplinger C, Verius M, Recheis W, Thomé C, Ortler M. Reconstruction of large cranial defects with poly-methyl-methacrylate (PMMA) using a rapid prototyping model and a new technique for intraoperative implant modeling. Neurol Neurochir Pol. 2017; 51(3): 214–220. http://doi.org/10.1016/j.pjnns.2017.02.007
7. Thien A, King NKK, Ti Ang B, Wang E, Ng I. Comparison of Polyetheretherketone and Titanium Cranioplasty after Decompressive Craniectomy. World Neurosurg. 2015; 83(2): 176–180. https://doi.org/10.1016/j.wneu.2014.06.003
8. Moser M, Schmid R, Schindel R, Hildebrandt G, Patient-specific polymethylmethacrylate prostheses for secondary reconstruction of large calvarial defects: A retrospective feasibility study of a new intraoperative moulding device for cranioplasty. J Craniomaxillofac Surg. 2016; 45(2): 295–303. https://doi.org/10.1016/j.jcms.2016.11.016
9. Fanchette J, Faucon B, Cartry F, Ratajczak M. Reconstruction of the anterior wall of the frontal sinus by a custom-made titanium prosthesis after resection of a giant osteoma of the frontal sinus. European Annals of Otorhinolaryngology, Head and Neck diseases. 2018; 136(1): 33–36 https://doi.org/10.1016/j.anorl.2018.07.003
10. Young CC, Hanak BW, Patel AP, Sekhar LN. Rapid Intraoperative in situ Synthetic Cranioplasty. World Neurosurg. 2018; 112: 161–165. http://doi.org/10.1016/j.wneu.2018.01.126
11. Samano OJ. Estudio restrospectivo, comparativo del uso de placas de metilmetacrilato preelaboradas o elaboradas durante la cirugía de craneoplastía y su asociación con la incidencia de infecciones postoperatorias. México: UNAM; 2011. 34 p. Disponible en: https://repositorio.unam.mx/
12. Marlier B, Kleiber JC, Bannwarth M, Theret E, Eap C, Litre CF. Reconstruction of cranioplasty using medpor porouspolyethylene implant. Neurochirurgie. 2017; 63(6): 468–472.https://doi.org/10.1016/j.neuchi.2017.07.001
13. Honeybul S, Janzen C, Kruger K, Ho KM. The impact of cranioplasty on neurological function. Br J Neurosurg. 2013; 27(5): 636–641.https://doi.org/10.3109/02688697.2013.817532
14. Blum KS, Schneider SJ, Rosenthal AD. Methyl methacrylate cranioplasty in children: long-term results. Pediatr Neurosurg. 1997; 26(1): 33–35. https://doi.org/10.1159/000121158
15. Marchac D, Greensmith A. Long-term experience with methylmethacrylate cranioplasty in craniofacial surgery. J Plast Reconstr Aesthet Surg. 2008; 61(7): 744–752. https://doi.org/10.1016/j.bjps.2007.10.055
Referencias
Williams LR, Fan KF, Bentley RP. Custom-made titanium cranioplasty: early and late complications of 151 cranioplasties and review of the literature. Int. J. Oral Maxillofac. Surg. 2015; 44(5): 599–608. https://doi.org/10.1016/j.ijom.2014.09.006
Piazza M, Grady MS. Cranioplasty. Neurosurg Clin N Am. 2017; 28(2): 257–265. https://doi.org/10.1016/j.nec.2016.11.008
González de Santiago MA, Chaurand Lara J, Sandoval B. Reconstrucción craneal con implante personalizado. Rev Esp Cirug Oral y Maxilofac. 2011; 33(1): 40–44. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1130-05582011000100007
Zegers T, Laak-Poort M, Koper D, Lethaus B, Kessler P. The therapeutic effect of patient-specific implants in cranioplasty. Journal of Cranio-Maxillo-Facial Surgery. 2017; 45(1): 82–86. http://doi.org/10.1016/j.jcms.2016.10.016
Khader BA, Towler MR. Materials and techniques used in cranioplasty fixation: A review. Materials Science and Engineering. 2016; 66(1) 315–322. https://doi.org/10.1016/j.msec.2016.04.101
Unterhofer C, Wipplinger C, Verius M, Recheis W, Thomé C, Ortler M. Reconstruction of large cranial defects with poly-methyl-methacrylate (PMMA) using a rapid prototyping model and a new technique for intraoperative implant modeling. Neurol Neurochir Pol. 2017; 51(3): 214–220. http://doi.org/10.1016/j.pjnns.2017.02.007
Thien A, King NKK, Ti Ang B, Wang E, Ng I. Comparison of Polyetheretherketone and Titanium Cranioplasty after Decompressive Craniectomy. World Neurosurg. 2015; 83(2): 176–180. http://dx.doi.org/10.1016/j.wneu.2014.06.003
Moser M, Schmid R, Schindel R, Hildebrandt G, Patient-specific polymethylmethacrylate prostheses for secondary reconstruction of large calvarial defects: A retrospective feasibility study of a new intraoperative moulding device for cranioplasty. J Craniomaxillofac Surg. 2016; 45(2): 295–303. https://doi.org/10.1016/j.jcms.2016.11.016
Fanchette J, Faucon B, Cartry F, Ratajczak M. Reconstruction of the anterior wall of the frontal sinus by a custom-made titanium prosthesis after resection of a giant osteoma of the frontal sinus. European Annals of Otorhinolaryngology, Head and Neck diseases. 2018; 136(1): 33–36 https://doi.org/10.1016/j.anorl.2018.07.003
Young CC, Hanak BW, Patel AP, Sekhar LN. Rapid Intraoperative in situ Synthetic Cranioplasty. World Neurosurg. 2018; 112: 161–165.
http://doi.org/10.1016/j.wneu.2018.01.126
Samano OJ. Estudio restrospectivo, comparativo del uso de placas de metilmetacrilato preelaboradas o elaboradas durante la cirugía de craneoplastía y su asociación con la incidencia de infecciones postoperatorias. México: UNAM; 2011. 34 p. Disponible en: repositorio.unam.mx
Marlier B, Kleiber JC, Bannwarth M, Theret E, Eap C, Litre CF. Reconstruction of cranioplasty using medpor porouspolyethylene implant. Neurochirurgie. 2017; 63(6): 468–472. https://doi.org/10.1016/j.neuchi.2017.07.001
Honeybul S, Janzen C, Kruger K, Ho KM. The impact of cranioplasty on neurological function. Br J Neurosurg. 2013; 27(5): 636–641. https://doi.org/10.3109/02688697.2013.817532
Blum KS, Schneider SJ, Rosenthal AD. Methyl methacrylate cranioplasty in children: long-term results. Pediatr Neurosurg. 1997; 26(1): 33–35. https://doi.org/10.1159/000121158
Marchac D, Greensmith A. Long-term experience with methylmethacrylate cranioplasty in craniofacial surgery. J Plast Reconstr Aesthet Surg. 2008; 61(7): 744–752. https://doi.org/10.1016/j.bjps.2007.10.055
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Lazaro Gael Cortez Moncada, Mariana Elvira Palomares Gonzalez, Karime Cristal Cardona Salazar, Gerardo Adrian De La Rosa Hernandez, Jesus Alberto Morales Gomez, Oscar Eduardo Cervantes Garcia. (2025). XLVII Mexican Conference on Biomedical Engineering. IFMBE Proceedings. 117, p.279. https://doi.org/10.1007/978-3-031-82126-4_27.
2. David A. Hernandez-Paez. (2024). Impacto de la prótesis craneal polimérica con ventana acústica y la imagen de ultrasonido funcional en la atención del trauma craneoencefálico. Acta Neurológica Colombiana, 40(3) https://doi.org/10.22379/anc.v40i3.1869.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2020 Lidia Araceli Campos Ramírez

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la licencia Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
- Una vez sometido el artículo no se aceptaran cambios respecto a la incorporación o retiro de autores.






















