Concentración mínima inhibitoria de Kanamicina para callos de cuatro variedades colombiana de arroz
Palabras clave:
Variedades colombianas de arroz, callogénesis, regeneración, agente de selección. (es)La kanamicina (Km) es un antibiótico que se ha utilizado en la producción de plantas transgénicas de arroz como agente selectivo. En este trabajo, se evaluó la sensibilidad al antibiótico para callos derivados de semillas sexuales en cuatro variedades colombianas de arroz (FEDEARROZ 2000, FEDEARROZ 50, FEDEARROZ 369 y CICA 8). Inicialmente, se indujo la formación de callo en un medio específico a partir de semilla madura, obteniéndose porcentajes de callogénesis mayores al 90%. Posteriormente los callos son llevados a un medio de regeneración, en el que se presentan variaciones importantes en el porcentaje de regeneración, entre 62% (F 2000) y 11% (F 369). Se ensayaron 7 concentraciones diferentes de kanamicina, adicionados al medio de regeneración: 0 mg/l, 100 mg/l, 200 mg/l, 300 mg/l, 400 mg/l, 500 mg/l y 600 mg/l. Se observó respuesta diferencial al antibiótico. Para F2000 y F369 a partir de 500 mg/L no registraron regenerantes, mientras para F50 y CICA 8 fue desde 300 mg/L. En todos los casos se observaron regenerantes albinos.
ARTÍCULO CORTO
Concentración mínima inhibitoria de Kanamicina para callos de cuatro variedades colombianas de arroz
Minimum inhibitory concentration of kanamycin of four varieties of Colombian rice calli
Cristina Diaz-Granados D.1 , Alejandro Chaparro-Giraldo2
1Microbióloga industrial, M.Sc., estudiante del doctorado en Biotecnología de la Universidad Nacional de Colombia, sede Bogotá, FEDEA-
RROZ, Grupo de Ingeniería Genética de Plantas. ecdiazg@unal.edu.co
2Ingeniero agrónomo, M.Sc.,Ph.D. Grupo de Ingeniería Genética de Plantas, Departamento de Biología & Instituto de Genética - Universidad
Nacional de Colombia, sede Bogotá. achaparrog@unal.edu.cog
Resumen
La Kanamicina (Km) es un antibiótico que se ha utilizado en la producción de plantas transgénicas de arroz como agen- te selectivo. En este trabajo se evaluó la sensibilidad al antibiótico para callos derivados de semillas sexuales en cuatro variedades colombianas de arroz (FEDEARROZ 2000, FEDEARROZ 50, FEDEARROZ 369 y CICA 8). Inicialmente se indujo la formación de callo en un medio específico a partir de semilla madura, obteniéndose porcentajes de callogénesis mayores al 90%. Posteriormente los callos son llevados a un medio de regeneración en el que se presentan variaciones importantes en el porcentaje de regeneración, entre 62% (F2000) y 11% (F369). Se ensayaron 7 concentraciones diferentes de Kanamicina, adicionadas al medio de regeneración: 0 mg/L, 100 mg/L, 200 mg/L, 300 mg/L, 400 mg/L, 500 mg/L y 600 mg/L. Se observó una respuesta diferencial al antibiótico. Para F2000 y F369 a partir de 500 mg/L no registraron regenerantes, mientras para F50 y CICA 8 fue desde 300 mg/L. En todos los casos se observaron regenerantes albinos.
Palabras clave: variedades colombianas de arroz, callogénesis, regeneración, agente de selección.
Abstract
Kanamycin (Km) is an antibiotic that has been used in the production of transgenic rice plants as a selective agent. In this study, we evaluated the antibiotic sensitivity of seed derived callus in four varieties of colombian rice (FEDEARROZ 2000, FEDEARROZ 50, 369 and CICA FEDEARROZ 8). It was induced callus formation from mature sedd in a specific medium, it were resulting in percentages of callus formation greater than 90%. Later callus were subsequently taken to a regeneration medium, which are important variations in the rate of regeneration, between 62% (F2000) and 11% (F369). Seven different concentrations of kanamycin (0 mg/L, 100 mg/L, 200 mg/L, 300 mg/L, 400 mg/L, 500 mg/L and 600 mg/L) were tested added to the regeneration medium. It was observed differential response to the antibiotic. F369 to F2000 and from 500 mg/L showed no regenerating, while for F50 and CICA 8 was from 300 mg/L.
Key words: colombian rice varieties, callus formation, regeneration, selection agent.
Introducción
El arroz (Oryza sativa) es cultivado en 113 países de todos los continentes y es considerado como uno de los cultivos de mayor importancia para la alimentación mundial, ya que es el alimento básico de más de la mitad de la población mundial, el 40% depende de este para el 80% de su dieta (ONU, 2004; SMIA, 2006). En Colombia en el 2010 se cultivaron 437.481 hectáreas de arroz en las 5 zonas arroceras (Centro, Llanos, Bajo Cauca, Costa Norte, Santanderes) que produjeron 2.099.193 toneladas de arroz paddy seco. Los rendimientos reportados para 2009 variaron entre 5,61 Tm / ha para la zona centro y 1,70 Tm / ha para la zona del Bajo Cauca. Para el año 2009 se registraron importaciones por 96.561 toneladas de arroz blanco (FEDEARROZ, 2011). Entre las técnicas biotecnológicas que se proyectan aplicar para el mejoramiento del arroz en Colombia, se encuentra la ingeniería genética de plantas. Por medio de esta es posible introducir características deseables al cultivo. (Diago, 2005).
En la obtención de plantas modificadas genéticamente existen varias etapas en el proceso de producción, entre estas etapas se encuentra la selección de plantas transgénicas. Como la transformación ocurre a nivel celular, puede suceder que los regenerantes estén constituidos por una mezcla de células transformadas y no transformadas. Se requiere de un sistema de selección que permita distinguir los individuos que han sido transformados del total de regenerantes obtenidos. La adición de agentes selectivos en esta etapa es decisiva para la identificación de plantas potencialmente transgénicas (Penna et al., 2002; Miki & McHugh, 2004).
Para este propósito han sido introducidos, junto al gen de interés, un número considerable de genes que son denominados marcadores de selección. Estos genes marcadores deben encontrarse ausentes en el genoma de las plantas que se busca transformar y presentar un efecto neutro sobre el metabolismo de estas. La expresión de estos genes permite que las células transformadas metabolicen el agente selectivo (Brasileiro & Aragão, 2001; Sundar & Sakthivel, 2008; Manimaran et al., 2011). De acuerdo con el modo de acción del producto génico respecto a la regeneración de plántulas es posible establecer esta clasificación: marcadores de selección negativa y marcadores de selección positiva (Goldstein et al., 2005; Joersbo, 2001; Manimaran et al., 2011).
Dentro de los marcadores de selección negativa se incluyen los genes que confieren resistencia a antibióticos y herbicidas. Los genes marcadores de selección negativa permiten la sobrevivencia de las células vegetales transformadas en presencia de un agente de selección, que inhibe el crecimiento de las células no transformadas (Brasileiro & Aragão, 2001; Jaiwal et al., 2002; Miki & McHugh, 2004). Entre los genes usados para conferir resistencia a antibióticos se encuentran el nptII que confiere resistencia a la kanamicina, cat que confiere resistencia al cloranfenicol, hph tque confiere resistencia a la higromicina (Joersbo, 2001; Ramesh et al., 2006; Sundar & Sakthivel, 2008).
El marcador de selección para antibióticos más utilizado es el gen nptII que confiere resistencia a aminoglicósidos análogos como Paromomicina, Geniticina y Butirosina, los cuales no son usados a nivel clínico (Mella et al., 2004; Sundar & Sakthivel, 2008). Fue aislado del transposon Tn5 de E. coli y codificada la enzima neomicina fosfotransferasa II (nptII ) que actúa sobre estos antibióticos, transfiriendo el grupo fosfato del ATP a un grupo 3-hidroxilo de la porción aminohexoxa de los antibióticos aminoglicosilados, que son detoxificados por fosforilación. Así mismo las plantas transgénicas que expresan nptII pueden tolerar dosis tóxicas de aminoglicosilados que en plantas no transformadas son letales (Goldstein et al., 2005). Los aminoglicósidos son antibióticos que interfieren en la síntesis proteica de mitocondrias y cloroplastos, que resulta en la clorosis e inhibición del crecimiento del tejido vegetal (Goldstein et al., 2005; Sundar & Sakthivel, 2008).
El marcador de selección para antibióticos más utilizado es el gen nptII que confiere resistencia a aminoglicósidos análogos como Paromomicina, Geniticina y Butirosina, los cuales no son usados a nivel clínico (Mella et al., 2004; Sundar & Sakthivel, 2008). Fue aislado del transposon Tn5 de E. coli y codificada la enzima neomicina fosfotransferasa II (nptII) que actúa sobre estos antibióticos, transfiriendo el grupo fosfato del ATP a un grupo 3-hidroxilo de la porción aminohexoxa de los antibióticos aminoglicosilados, que son detoxificados por fosforilación. Así mismo las plantas transgénicas que expresan nptII pueden tolerar dosis tóxicas de aminoglicosilados que en plantas no transformadas son letales (Goldstein et al., 2005). Los aminoglicósidos son antibióticos que interfieren en la síntesis proteica de mitocondrias y cloroplastos, que resulta en la clorosis e inhibición del crecimiento del tejido vegetal (Goldstein et al., 2005; Sundar & Sakthivel, 2008).
Ya que la selección de plantas potencialmente transgénicas es una etapa esencial en la obtención de plantas modificadas genéticamente, el objetivo principal de este trabajo es la obtención de las concentraciones mínimas inhibitorias del antibiótico Kanamicina en la regeneración de callos derivados de semillas de las variedades colombianas de arroz FEDEARROZ 50, FEDEARROZ 2000, FEDEARROZ 369 y CICA 8.
Materiales y métodos
Material vegetal
El material de partida que se empleó fueron semillas maduras de excelente calidad fitosanitaria. Las semillas fueron descascaradas manualmente y se desinfectaron en etanol al 70%, hipoclorito de sodio al 2% y Tween 80 (Saharan et al., 2004b; Meneses et al., 2005).
Callogénesis y regeneración
Se indujo la formación de callo a partir de semilla madura. En un medio MS se adicionó ácido 2,4-dichlorofenoxiacético (2,4-D) 2,5 mg/L, prolina 500 mg/L, ácidos casaminos 500 mg/L, sacarosa 30 g/l y GELRITE 2,5 g/l. Las semillas se mantuvieron a temperatura de 28 °C +/- 2 < sup >ºC y humedad relativa del 70% durante tres semanas. Luego los callos formados fueron sometidos a un periodo de desecación de 48 horas y llevados a un medio de regeneración (MS básico, Kinetina 2 mg/L, ANA 0,5 mg/L, prolina 500 mg/L, ácidos casaminos 500 mg/L, sacarosa 30 g/l y GELRITE 6 g/l), y mantenidos a una temperatura de 28 °C +/- 2 ºC, humedad relativa del 70% y un fotoperiodo de 16 horas de luz y 8 de oscuridad. (Saharan et al., 2004a; Saharan et al., 2004b).
Determinación de la concentración mínima inhibitoria
Los callos obtenidos son transferidos a un medio de regeneración suplementado con diferentes concentraciones de Kanamicina: 0 mg/L, 100 mg/L, 200 mg/L, 300 mg/L, 400 mg/L, 500 mg/L y 600 mg/L. Para cada concentración se usaron 10 réplicas, cada una con 10 callos o unidades experimentales, para las cuatro variedades de interés: CICA 8, F2000, F50 y F369.
Semanalmente se realizaron lecturas del estado y avance de los callos, tanto en la etapa de callogénesis como en la de regeneración donde los callos ya se encontraban bajo condiciones de selección. La toma de datos se hizo por un periodo total de 7 semanas, 3 semanas de callogénesis y 4 semanas de regeneración del material. Las variables consideradas fueron: porcentaje de callogénesis, porcentaje de regeneración, porcentaje de regenerantes albinos, peso fresco y peso seco de los regenerantes. El diseño experimental fue completamente al azar.
Análisis estadístico
A los datos primero se les realizó un análisis descriptivo para determinar su comportamiento. Este análisis permitió determinar porcentajes de callogénesis, porcentajes de regeneración y proporciones de albinismo. También se realizaron gráficos Box-Plot, el cual es un gráfico descriptivo, que permitió ver la dispersión de los datos.
Adicional a esto se realizó un análisis de varianza de una sola vía de clasificación y se bloqueo por variedad, previa revisión de la normalidad de los datos; para esto se procedió a correr una prueba Jarque-Bera, la cual concluyó que no existe suficiente evidencia estadística para rechazar la hipótesis de normalidad. Por último se calculó el coeficiente de correlación para las variables de peso fresco y peso seco de cada una de las variedades.
Los datos fueron analizados empleando el paquete estadístico R y la herramienta de hoja de cálculo Excel 2007.
Resultados y discusión
Callogénesis y regeneración
Los porcentajes de callogénesis fueron calculados a partir de los datos obtenidos de la lectura a las tres semanas de mantener las semillas maduras en medio de inducción de callo.
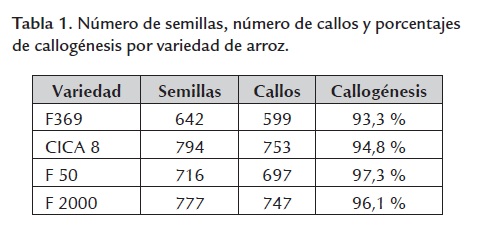
Mediante el sistema de callogénesis empleado se obtuvieron porcentajes altos de formación de callo a partir de semilla madura para las cuatro variedades. En la tabla 1 se presentan los resultados obtenidos. Los porcentajes de callogénesis fueron superiores al 90% en todas las variedades, F50 fue la que presentó mejor porcentaje de formación de callo con un 97% seguida de F2000 con un 96%, CICA 8 con 94% y F369 con 93%. Se obtuvieron callos en un solo paso y en corto tiempo comparado con otros sistemas de inducción de callo (Meneses et al., 2005; Hoque et al., 2007; Ikram-ul-Haqa et al., 2009).
Los porcentajes de callogénesis observados varíaron de acuerdo con el genotipo. Estos resultados fueron acordes con lo que se ha presentado en otros estudios, donde se evidencia las diferencias en la respuesta al proceso de callogénesis en arroz, en variedades de la misma subespecie y entre subespecies (Pipatpanukul et al., 2004; Xiaojia et al., 2006; Rachmawati & Anzai, 2006; Yan et al., 2010; Aditya et al., 2004). La callogénesis es, entonces, un proceso dependiente del genotipo. Para las cuatro variedades se observó que la formación del callo, a partir del embrión de las semillas maduras, se presenta entre el tercer y cuarto día de ser colocadas en medio de inducción de callo.
Los callos obtenidos en este estudio son derivados del escutelo de las semillas y son embriogénicos, características deducibles de las características físicas como color amarillo claro o crema, de textura granulosa, poco friables de contextura compacta y de apariencia seca; estos resultados han sido reportados por otros autores (Pipatpanukul et al., 2004; Xiaojia et al., 2006; Rachmawati & Anzai, 2006; Yan et al., 2010; Aditya et al., 2004). Este tipo de callo es el más apropiado para los procesos de regeneración (Qian et al., 2004 Grewal et al., 2005; Yan et al., 2010).
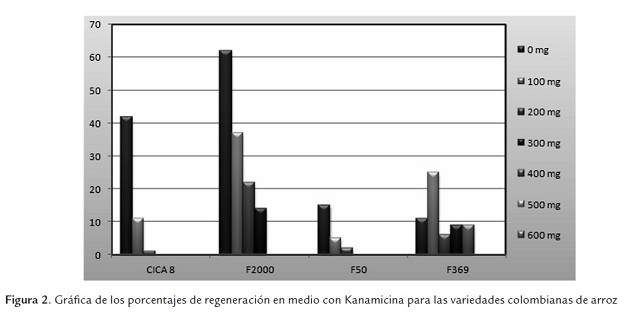
Los callos fueron trasladados a un medio de regeneración y mantenidos en esas condiciones por tres semanas, al término de las cuales se tomaron los datos para determinar los porcentajes de regeneración. Los porcentajes de regeneración observados en las cuatro variedades fueron variables, como se observa en la figura 1. F2000 presentó el mejor porcentaje de regeneración con 62%, seguida de CICA 8 con 42%, F50 con 15% y finalmente F369 con un 11%. Estos resultados muestran que la respuesta a la regeneración de plantas de arroz índica está fuertemente relacionada a las diferencias existentes entre genotipos, y que son materiales que presentan serias dificultades en el momento de la regeneración, como lo han demostrado otros autores (Hoque et al., 2007; Rachmawati & Anzai, 2006; Khalequzzaman et al., 2005; Afolabi et al., 2008; Yan et al., 2010; Ikram-ul-Haqa et al., 2009).
Determinación de la concentración mínima inhibitoria
Para el análisis de la respuesta a la regeneración a partir de callos sometidos a la presencia del antibiótico en las concentraciones de estudio, se emplearon las siguientes variables: número de callos con regenerantes, número de regenerantes, número de regenerantes albinos, peso fresco y peso seco.
La respuesta al proceso de regeneración fue completamente diferente en las cuatro variedades evaluadas. De acuerdo con esta respuesta se determinó la concentración mínima de inhibición. El porcentaje de re-generación se calculó con base en el número de callos que presentaron regenerantes y el número total de callos utilizados en cada tratamiento.
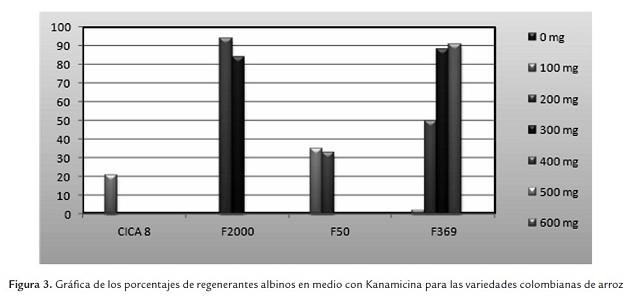
En la variedad CICA 8 se observó un porcentaje de regeneración del 42% en la concentración de 0 mg de antibiótico, este porcentaje disminuyó según iba aumentando la concentración del agente de selección hasta que en la concentración de 200 mg fue la última concentración en la cual se observó regeneración con un porcentaje del 1% (figura 2). Es claro que la concentración mínima inhibitoria de la regeneración para esta variedad es de 300 mg/L de Kanamicina. Se observó la presencia de regenerantes albinos en la concentración de 100 mg en un 21% (figura 3). La regeneración se ve fuertemente afectada por la presencia del antibiótico en el medio y en las cuatro últimas concentraciones es inhibida por completo.
La variedad F2000 presenta el porcentaje de regeneración más alto que es de 62% en la concentración de 0 mg, en general esta variedad presenta los porcentajes de regeneración más altos en comparación con las otras variedades (figura 2). En esta variedad se observó regeneración hasta en 300 mg (14%). La concentración mínima inhibitoria fue de 400 mg/L (figura 2). Se encontró presencia de regenerantes albinos en las concentraciones de 200 mg y 300 mg con porcentajes del 94% y 84% respectivamente (figura 3).
En la variedad F50 se observaron los porcentajes de regeneración más bajos (figura 2) y la mayor afectación en el proceso de regeneración. En la concentración de 0 mg el porcentaje de regeneración fue del 15% y en la concentración de 200 mg fue del 2%. La concentra-ción mínima inhibitoria fue de 300 mg/L. Se observó la presencia de regenerantes albinos en las concentraciones de 100 mg y 200 mg con porcentajes del 37% y 33% respectivamente (figura 3).
F369 fue la variedad que más tolerancia presentó al antibiótico, pues se observaron regenerantes hasta en 400 mg de Kanamicina (figura 2). La concentración mínima inhibitoria fue de 500 mg del antibiótico. Al igual que en las demás variedades se observó la presencia de regenerantes albinos, desde 100 mg hasta los 400 mg, con porcentajes desde 3% hasta 91% (figura 3).
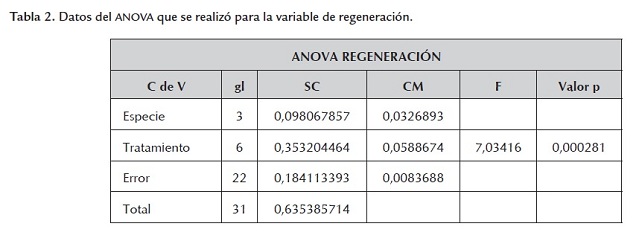
Con los datos anteriores se pudo demostrar que individualmente las variedades de arroz sí se veían afectadas en su capacidad de regeneración de plántulas completas por la presencia del antibiótico Kanamicina en el medio de regeneración. Adicionalmente, para determinar si estadísticamente se podía encontrar evidencia fuerte de que la presencia de antibiótico sí afectaba la regeneración de plantas en las cuatro variedades de arroz, se realizó una ANOVA y se encontró, con base en los resultados presentados en la tabla 2 , que con un nivel de significancia del 5%, el valor F tabulado es F(6,22;0.05) = 2.549061 y además como el valor F calculado Fc = 7.03416 es mayor que el tabulado, se concluyó que la cantidad de antibiótico suministrado afecta el porcentaje de regeneración de las plantas. Además, las variedades (bloques) difieren de manera significativa debido a que el cuadrado medio es grande en relación con el cuadrado medio del error.
Según los datos anteriores la Kanamicina es un buen agente de selección que inhibe la regeneración en las variedades CICA 8, F2000, F50 y F369. El antibiótico se puede emplear para selección en estas variedades de arroz si se usa en el momento justo, en el tiempo de exposición y la concentración adecuadas (Stark-Lorenzen et al., 1997; Huang et al., 2001; Ramessar et al., 2007). La selección de regenerantes potencialmente transgénicos de las variedades necesitará concentraciones bastante altas, CICA 8 (300mg/L), F2000 (400 mg/L, F50 (300 mg/L) y F369 (500 mg/L), pero estos resultados concuerdan con los reportes de Stark- Lorenzen et al. (1997), Pipatpanukul et al. (2004) y Ziemienowicz (2001). Este comportamiento se puede explicar porque algunas plantas, entre ellas el arroz, presentan una familia de genes que les confieren tolerancia a la Kanamicina (Rommens, 2006; Ziemienowicz , 2001; Aragão & Brasileiro, 2002).
Para las cuatro variedades la presencia de regenerantes albinos fue una constante como consecuencia de presencia del agente de selección en el medio (figura 3). En el tratamiento control sin Kanamicina no se registraron regenerantes albinos. Estos resultados concuerdan con el reporte de Stark-Lorenzen et al. (1997) que muestra la presencia de regenerantes albinos en arroz, y en altos porcentajes, después de periodos de selección con Kanamicina. El albinismo en las plantas puede ser el resultado del modo de acción del antibiótico, que ataca los procesos de traducción principalmente en mitocondria y cloroplastos, afectando la síntesis de proteínas (Brasileiro & Aragão, 2001; Aragão & Brasileiro, 2002).
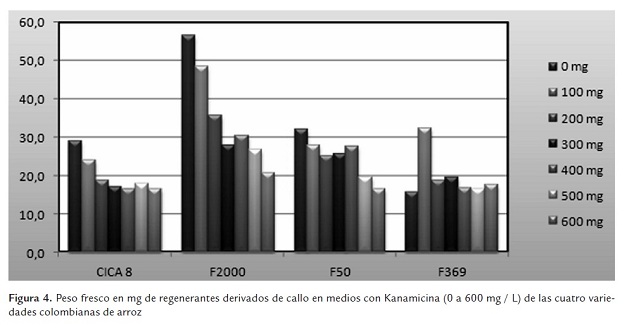
Las variables que se emplearon para estimar el crecimiento y el desarrollo de las plantas regeneradas en las diferentes concentraciones del antibiótico Kanamicina fueron peso fresco y peso seco. Al aumentar la concentración de antibiótico en el medio, tanto uno como otro disminuyen (figuras 4 y 6), mostrando que el desarrollo de las plantas es afectado por la presencia del agente de selección en el medio. Este fue un comportamiento que se presentó para las cuatro variedades (CICA 8, F2000, F50 y F369).
En relación con la variable peso fresco, el mejor comportamiento fue para la variedad F2000, que muestró los mayores valores para todas las concentraciones del antibiótico, seguido de la variedad F50. Las variedades F369 y CICA 8 presentaron los menores valores y comportamiento similares. Esta respuesta debe ser analizada con cuidado, porque puede estar mostrando tanto niveles de tolerancia a Kanamicina como una simple respuesta al cultivo de tejidos. Así, la variedad F2000, que tuvo la mejor respuesta tanto en callogénesis como en regeneración, es la variedad que mejor respuesta tuvo frente al antibiótico si se consideran los datos de peso fresco (figura 4).
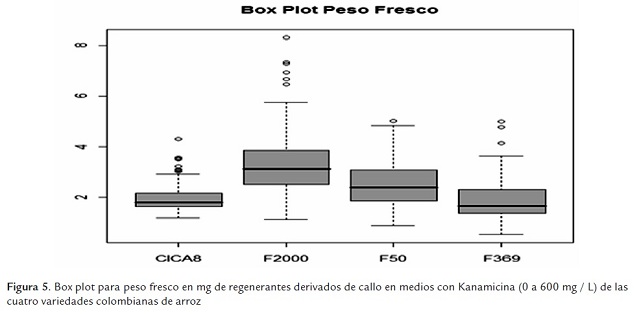
El material que exhibió una mayor tolerancia al antibiótico es F2000, pues presentó mayor dispersión en los valores de respuesta, como un valor mayor de la mediana, representada por la línea negra dentro de las cajas del "box plot" (figura 5). El comportamiento de F50 fue intermedio, mientras que los comportamientos de F369 y CICA 8 fueron los más bajos y similares. Para todos los genotipos estudiados se registraron valores atípicos que podrían ser explicados como efectos de la variación somaclonal en medios de selección o como efecto de la variación tisular intrínseca. Este análisis confirmó la tendencia mostrada por las variedades en relación con las otras variables analizadas.
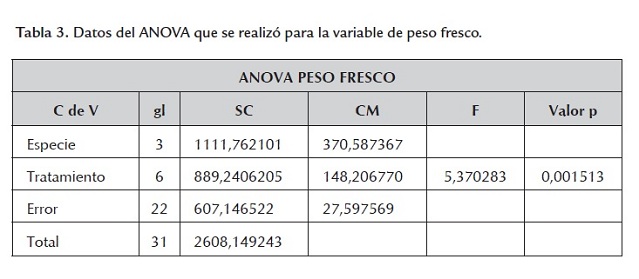
Adicionalmente se realizó una ANOVA en busca de evidencia estadística más fuerte que permitiera afirmar con toda certeza que la presencia del antibiótico y la concentración en la que este se encuentre en el medio sí afectan de manera significativa el desarrollo de las plántulas regeneradas. Se encontró que tomando un nivel de significancia del 5%, el valor F tabulado es F(6,22;0.05) = 2.549061, mientras que el valor F calculado es Fc = 5.370283, y debido a que este último es mayor que el tabulado, se puede afirmar que existe suficiente evidencia estadística para decir que la cantidad de antibiótico suministrado sí afecta el peso fresco de las plantas (tabla 3 ).
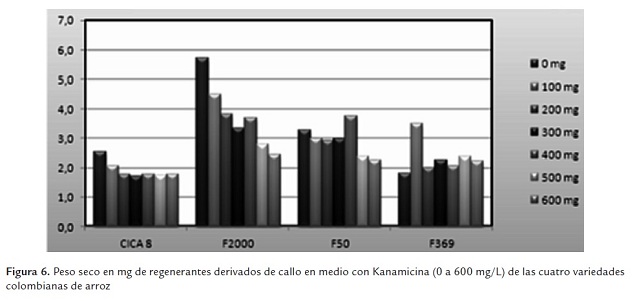
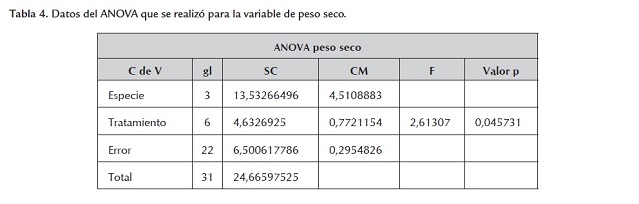
Los datos que muestran el comportamiento de la variable peso seco revelan el efecto de la Kanamicina para todos los genotipos y en todas las concentraciones (figura 6 y figura 7). El efecto de la depresión inducida por el antibiótico en el crecimiento de los callos, medible en la materia seca producida, se mantiene más o menos estable en todos los tratamientos con Kanamicina. En F369 y en CICA 8 el efecto es similar en todas las concentraciones, en tanto que en F2000 y F50 se presentan diferencias importantes entre los tratamientos. El mejor comportamiento, en términos de mayores valores de peso seco, es el de F2000, seguido de F50 (figura 6).
El análisis del "Box Plot" muestra que la mayor mediana es para F2000, genotipo que presenta la mayor dispersión en sus datos (figura 7). Esto parece indicar que la mejor respuesta sigue siendo la de F2000, lo cual podría indicar mayores niveles de tolerancia a la Kanamicina para esta variedad. Le sigue F50 con un menor grado de dispersión y finalmente CICA 8 y F369 con valores de mediana similares y con el menor comportamiento dentro del grupo de genotipos. Se registraron valores atípicos para todos los genotipos, aunque de manera marcadamente mayor para F2000. Probablemente este hecho indica rangos de tolerancia más amplia dentro del mismo genotipo.
Igualmente se realizó una ANOVA en busca de evidencia estadística más fuerte, y se encontró que tomando un nivel de significancia del 5%, el valor F tabulado es F(6,22;0.05)< = 2.549061, y como el valor F calculado es Fc = 2.61307 y al ser este mayor que el tabulado, se puede afirmar que existe suficiente evidencia estadística para decir que la cantidad de antibiótico presente en el medio sí afecta el peso seco de las plantas (tabla 4 ). Con la evidencia anterior se puede afirmar que la presencia del antibiótico y la con-centración en la que este se encuentre en el medio afectan de igual manera el peso seco como el peso fresco de las plantas.
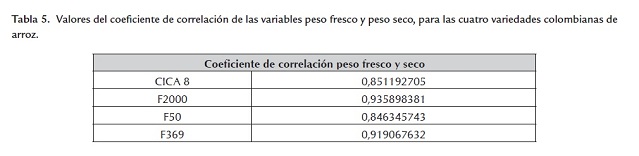
Adicionalmente si se calcula la correlación entre las variables peso fresco y peso seco para cada una de las variedades, se encuentra que para las cuatro variedades los coeficientes de correlación son valores positivos cercanos a 1, lo que indica que la correlación entre las variables peso seco y peso fresco es alta, es decir, que a mayor peso fresco el peso seco será mayor (tabla 5 ).
Conclusiones
De acuerdo con la respuesta que se observó en cada una de las variedades de arroz, es claro que en la regeneración frente a las diferentes concentraciones de antibiótico la respuesta es dependiente del genotipo, ya que el comportamiento de la regeneración fue diferencial entre las cuatro variedades.
Se establecieron las concentraciones mínimas inhibitorias de la regeneración para callos derivados de semilla, de las variedades colombianas de arroz CICA 8, F2000, F50 y F369. Pero debido al alto porcentaje de presencia de regenerantes albinos en todas las variedades, como consecuencia del antibiótico en el medio, no se recomienda el uso de Kanamicina como agente selectivo en procesos de producción de plantas transgénicas de arroz en las variedades CICA 8, F2000, F50 y F369.
De acuerdo con el comportamiento in vitro que presentaron las variedades colombianas de arroz frente a la presencia o no del antibiótico Kanamicina, se encontró que el mejor genotipo fue F2000, seguido por F50. Las variedades CICA 8 y F369 registraron comportamientos similares que fueron los más bajos dentro de los genotipos analizados.
Agradecimientos
Los autores agradecen el apoyo de la Federación Nacional de Arroceros - FEDEARROZ y de la Universidad Nacional de Colombia por la financiación proporcionada para la realización de este trabajo.
Referencias bibliográficas
1 Aditya, T., Hoque, M. and Khalequzzaman, M. 2004. Response to high frequency callus induction ability from root regions of germinated embryo in Indica rice. Pakistan Journal of Biological Sciences 7 (5): 861-864.
2 Afolabi, A., Oyebanji1, O., Odusanya, O., Abo, M., Misra, M. and Ogbadu, G. 2008. Regeneration of plants from rice caryopsis derived callus culture of Nigerian local cv. Suakoko 8 and a NERICA cv. FARO 55. African Journal of Plant Science 2 (9): 109-112.
3 Aragão, F. and Brasileiro, A. 2002. Positive, negative and marker-free strategies for transgenic plant selection. Braz. J. Plant Physiology 14 (1): 1-10.
4 Brasileiro, A. and Aragão, F. 2001. Marker genes for in vitro selection of transgenic plants. Plant Biotechnology 3 (3): 113-121.
5 Diago, M. 2003. Compendio de resultados de investigación 2001- 2002. Fedearroz - Fondo Nacional del Arroz. Colombia. pp. 37-114.
6 Diago, M. 2005. Compendio de resultados de investigación 2003- 2005. Fedearroz - Fondo Nacional del Arroz. Colombia. pp. 11-23.
7 FEDEARROZ 2011. Área, producción y rendimientos. Disponible en http://www.fedearroz.com.co/apr_public.php [Fecha de consulta: 12 de octubre de 2011].
8 Grewal, D., Gill, R. and Gosal, S. 2005. Factors enhancing induction of high frequency plant regeneration from somatic embryos of indica rice (Oriza sativa L.). Biological Sciences 5 (6): 697-702.
9 Goldstein, D., Tinland, B., Gilbertson, A., Staub, J., Bannon, G., Goodman, R., McCoy, R. and Silvanovich, A. 2005. Human safety and genetically modified plants: a review of antibiotic resistance markers and future transformation selection technologies. Applied Microbiology s10: 1365-2672.
10 Hoque, M., Ali, M. and Karim, N. 2007. Embryogenic callus induction and regeneration of elite Bangladeshi Indica rice cultivars. Plant Tissue Culture & Biotechnology 17 (1): 65-70.
11 Huang, J., Wei, Z., An, H. and Zhu, Y. 2001. Agrobacterium tumefaciens-mediated transformation of rice with the spider insecti- cidal gene conferring resistance to leaffolder and striped stem borer. Cell Research 11 (2): 149-155.
12 Ikram-ul-Haqa, Chang-Xingb, Z., Mukhtarf, Z., AbdulJaleelc, C. and Azoozd, M. 2009. Effect of physical desiccation on plant regeneration efficiency in rice ( Oryza sativa L. ) variety super basmati. Plant Physiology 166: 1568-1575.
13 Jaiwal, P., Sahoo, L., Singh, D. and Singh, R. 2002. Strategies to deal with the concern about marker genes in transgenic plants: Some environment friendly approaches. Current Science 83 (2): 128-136.
14 Joersbo, M. 2001. Advances in the selection of transgenic plants using non-antibiotic marker genes. Physiologica Plantarum 111: 269-272.
15 Khalequzzaman, M., Haq, N., Hoque, M. and Aditya, T. 2005. Regeneration efficiency and genotypic effect of 15 Indica type Bangladeshi rice ( Oryza sativa L. ) Landraces. Plant Tissue Culture & Biotechnology 15 (1): 33-42.
16 Manimaran, P., Ramkumar, G., Sakthivel, K., Sundaram, R., Madhav, M. and Balachandran, M. 2011. Suitability of non-lethal marker and marker-free systems for development of transgenic crop plants: Present status and future prospects. Biotechnology Advances 29 (6): 703-714.
17 Mella, S., Sepúlveda, M., González, G., Bello, H., Domínguez, M., Zemelman, R. y Ramírez, C. 2004. Antimicrobianos Aminoglucósidos-aminociclitoles: Características estructurales y nuevos aspectos sobre su resistencia. Revista Chilena de Infectología 21 (4): 330-338.
18 Meneses, A., Flores, D., Muñoz, M., Arrieta, G. and Espinoza A. 2005. Effect of 2,4-D, hydric stress and light on indica rice (Oryza sativa) somatic embryogenesis. Revista de Biología Tropical 53 (3-4): 361-368.
19 Miki, B. and McHugh, S. 2004. Selectable marker genes in transgenic plants: applications, alternatives and biosafety. Journal of Biotechnology 107: 193-232.
20 ONU. 2004. 28.ª Conferencia regional de la FAO para América Latina y el Caribe. Año internacional del arroz. FAO. Guatemala. p. 1-26. Disponible en http://www.fao.org/DOCREP/MEETING/007/J1225s/J1225s00.HTM.[Fecha de consulta 18 de octubre de 2011].
21 Penna, S., Sage, L. and Swennen, R. 2002. Positive selectable marker genes for routine plant transformation. In vitro Cell Developmental Biology 38: 125-128.
22 Pipatpanukul, T., Bunnag, S., Theerakulpisut, P. and Kosittrakul, M. 2004. Transformation of indica rice (Oryza sativa L. )) cv. RD6 mediated by Agrobacterium tumefaciens. Songklanakarin Journal of Science and Technology26 (1): 1-13.
23 Qian, H., Zhang, X. and Xue, Q. 2004. Factors affecting the callus induction and Gus transient expression in Indica rice Pei`ai64s. Pakistan Journal of Biological Sciences 7 (4): 615-619.
24 Rachmawati, D. and Anzai, H. 2006. Studies on callus inductio plant regeneration and transformation of Javanica rice cultiva Plant Biotechnology 23: 521-524.
25 Ramesh, S., Kaiser, B., Tricia, F., Grajan, C. and Sedgley, M. 2006. Improve methods -mediated transformation of almond using positive (mannose/PMI) or negative (kanamycin resistance) selection basic protocols. Plant Cell Reports 25: 821-828.
26 Ramessar, K., Peremarti, A., Gómez-Galera, S., Naqvi S., Moralejo, M., Muñoz, P., Capell, T. and Christou, P. 2007. Biosafety and risk assessment framework for selectable marker genes in transgenic crop plants: a case of the science not supporting the politics. Transgenic Research 16: 261-280.
27 Rommens, C. 2006. Kanamycin resistance in plants: an unexpected trait controlled by a potentially multifaceted gene. Trends in Plant Science 11 (7): 317-319.
28 Saharan, V., Yadav, R., Yadav, N. and Ram, K. 2004a. Studies on improved Agrobacterium-mediated trasnformation in two Indica rice (Oryza sativa l.) African Journal of Biotechnology 3 (11): 572-575.
29 Saharan, V., Yadav, R., Yadav, N. and Chapagain, B. 2004b. High frequency plant regeneration from desiccated calli of indica rice (Oryza sativa). African Journal of Biotechnology 3 (5): 256-259.
30 SMIA. 2006. Perspectivas alimentarias: Análisis de mercados. Sistema mundial de información y alerta sobre la agricultura y alimentación. Argentina. pp. 35-39.
31 Stark-Lorenzen, P., Nelke, B., Hänßler, G., Mühlbach, H. and Thomzik, J. 1997. Transfer of a grapevine stilbene synthase gene to rice ( Oryza sativa L.). Plant Cell Reports 16: 668-673.
32 Sundar, I. and Sakthivel, N. 2008. Advances inselectable marker genes for plant transformation. Plant Physiology 165: 1698-1716.
33 Xiaojia, G., Zhaohui, C., Yongjun, L. and Shiping, W. 2006. A tissue culture system for different germplasms of indica rice. Plant Cell Reports 25: 392-402.
34 Yan, L., Li, X. and Wu, D. 2010. The comparison in tissue culture ability of mature embryo in different cultivars of rice. Agricultural Sciences in China 9 (6): 840-846.
35 Ziemienowicz, A. 2001. Plant selectable markers and reporter genes. Acta Physiologiae Plantarum 23 (3): 363-374.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2011 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).