Influencia de la época del año en la respuesta in vitro del cafeto Coffea canephora P. var Robusta
Palabras clave:
época del año, callos, actividad peroxidasa, oxidación, contaminación, time of year, callus, peroxidase activity, oxidation, contamination. (es)Plants generally respond in different ways to in vitro cultivation techniques, depending on the crop's initial response and the embryogenic capacity of its genotype, the physiological state of the plant and the explant, the age of the donor plant, physical factors, growth regulators, nutritional conditions and seasonal change. The present study was thus aimed at evaluating the influence of the time of year during which the source of explants was taken on the in vitro response of Robusta genotypes. Samples were taken during each month of the year, foliar explants were cultured in a medium containing Murashige and Skoog mineral salts (1962) and 0,5 and 2,0 mg.L-1 2,4-D and kinetine, respectively. It was observed that the time of the year when a sample was taken exercised as marked effect on the response of the explants from the genotypes evaluated. Taking foliar samples during May-June, January-February and November-December proved favourable in the conditions studied here given the low indices of peroxidase enzymatic activity, phenol oxidation and fungal contamination, as well as the high percentage of callus formation and their greater total protein content. It was determined that peroxidase enzymatic activity could constitute an important marker during the initial stage of selecting samples.
|
__________________________REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL .VII No. 1 Julio 2005 5-14
Influencia de la época del año en la respuesta in vitro del cafeto Coffea canephora P. Var. Robusta
Influence of the time of year on the in vitro response of Coffea canephora P. Var. Robusta coffee trees
María Esther González*, María Margarita Hernández*, Luis Miguel Mazorra*, Nancy Santana**, Yohana Rodríguez***, Mireya Cabrera*
RESUMEN
Generalmente, las plantas responden de manera diferenciada a las técnicas de cultivo in vitro, dependiendo de la respuesta inicial del cultivo y su capacidad embriogénica del genotipo, el estado fisiológico de la planta y el explante, la edad de la planta donante, los factores físicos, los reguladores del crecimiento y las condiciones nutricionales, así como el cambio estacional. De aquí que el presente estudio se realizó con el objetivo de evaluar la influencia de la época del año en que fue tomada la fuente de los explantes en la respuesta in vitro de genotipos de Robusta. Se realizaron muestreos durante todos los meses del año, los explantes foliares fueron cultivados en un medio contentivo de las sales minerales de Murashige y Skoog (1962) y 0,5 y 2,0 mg.L-1 de 2,4-D y kinetina, respectivamente. Se observó que la época del año en que se tomó la muestra ejerció un marcado efecto en la respuesta de los explantes de los genotipos evaluados. Para las condiciones estudiadas resultó favorable la toma de las muestras foliares en los períodos mayo-junio, enero-febrero y noviembre-diciembre, dados los bajos índices de actividad enzimática peroxidasa, oxidación fenólica y contaminación fúngica, así como un elevado porcentaje de formación de callos y mayor contenido de proteínas totales presentes en los mismos. Se determinó que la actividad enzimática peroxidasa pudiera constituir un importante marcador en la etapa inicial de selección de las muestras.
Palabras clave: época del año, callos, actividad peroxidasa, oxidación, contaminación.
ABSTRACT
Plants generally respond in different ways to in vitro cultivation techniques, depending on the crop's initial response and the embryogenic capacity of its genotype, the physiological state of the plant and the explant, the age of the donor plant, physical factors, growth regulators, nutritional conditions and seasonal change. The present study was thus aimed at evaluating the influence of the time of year during which the source of explants was taken on the in vitro response of Robusta genotypes. Samples were taken during each month of the year, foliar explants were cultured in a medium containing Murashige and Skoog mineral salts (1962) and 0,5 and 2,0 mg.L-1 2,4-D and kinetine, respectively. It was observed that the time of the year when a sample was taken exercised as marked effect on the response of the explants from the genotypes evaluated. Taking foliar samples during May-June, January-February and November-December proved favourable in the conditions studied here given the low indices of peroxidase enzymatic activity, phenol oxidation and fungal contamination, as well as the high percentage of callus formation and their greater total protein content. It was determined that peroxidase enzymatic activity could constitute an important marker during the initial stage of selecting samples. Key words: time of year, callus, peroxidase activity, oxidation, contamination.
|
|
* Investigadores. Instituto Nacional de Ciencias Agrícolas (INCA), Gaveta Postal 1, San José de las Layas, La Habana, Cuba. Recibido: abril 20 de 2004 Aceptado: junio 17 de 2005 |
|
5
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL .VII No. 1 Julio 2005 5-14
|
|
|
INTRODUCCIÓN Al valorar la necesidad práctica de mantener colecciones de variedades, regionalizar genotipos promisorios, acortar ciclos de selección y garantizar la producción a gran escala de individuos deseados, se ha comprobado la importancia de la embriogénesis somática, lo que abre nuevas posibilidades en el cultivo de la variedad Robusta, caracterizada por su autoin-compatibilidad; este método de propagación sin el empleo de la semilla ofrece ventajas para esta variedad de alogamia estricta, ya que permite la reproducción uniforme de genotipos seleccionados, de aquí la necesidad de optimizar este proceso en el cafeto Robusta.
Desde los primeros estudios sobre la morfogénesis in vitro y aún en la actualidad se reconoce la capacidad que tienen ciertos grupos de plantas para responder con mayor rapidez a la formación de nuevas estructuras u órganos in vitro. En este sentido, la respuesta inicial del cultivo y la capacidad embriogénica del mismo van a depender del genotipo, el estado fisiológico de la planta y del explante, así como de la edad de la planta donante (Berros et al., 1997). Dodds (1983) destacó que la propagación in vitro de la mayoría de las plantas leñosas requiere la utilización de explantes jóvenes.
Generalmente, todas las células de un organismo se consideran de un mismo genotipo, sin embargo, existen diferencias significativas de célula a célula y de órgano a órgano de una misma planta, con relación a su capacidad para regenerar en cultivo; aunque todos los tejidos tienen la capacidad de formar callos in vitro, no todos resultan embriogénicos (Berthouly y Michaux-Ferriere, 1996).
Se ha comprobado que los requerimientos nutricionales y hormonales difieren cuando los tejidos cultivados provienen de plantas en diferentes edades fisiológicas (Styer y Chin, 1983) y que el potencial organogenético de un explante es inversamente proporcional a su edad fisiológica, debido a alteraciones morfológicas que llevan a la pérdida de vigor (Díaz et al., 1995).
Santana (1993), al estudiar la influencia de la edad fisiológica de la hoja de cafeto, como fuente de explante, en tres variedades: Robusta, Caturra y Catimor 9722, en la formación de callos embriogénicos, observó que las hojas del tercero y el cuarto nudos,
|
en Caturra y Catimor 9722, mostraron mayor capacidad de respuesta, mientras que la Robusta respondió a la inducción de este tipo de callo, en explantes de hojas ubicadas desde el segundo al cuarto nudo de ramas ortotrópicas. El tamaño del explante es un factor que también puede determinar la respuesta in vitro (Castro et al., 1998). Explantes muy pequeños requieren el empleo de medios de cultivo mucho más complejos y la vitalidad y la capacidad regenerativa tienden a ser bajas. Explantes grandes son más difíciles de desinfectar (Surga y Guevara, 1994), pero generalmente poseen un potencial regenerador considerablemente mayor. En varios trabajos se han demostrado las ventajas que ocasiona el pretratamiento de las plantas donantes con reguladores del crecimiento para reactivar el desarrollo de las plantas donantes (De Winnaar, 1997; Castillo etal., 1997). Otro factor a considerar en la respuesta a la embriogénesis somática es el cambio estacional, ya que las variaciones de temperatura, humedad y precipitaciones provocan fluctuaciones en los árboles que influyen en el comportamiento in vitro de los explantes (Pírela y Mogollón, 1996). Por ello el presente estudio se realizó con el objetivo de evaluar a través de diferentes indicadores la influencia de la época del año en el comportamiento de explantes de cafeto sometidos al proceso de cultivo in vitro.
MATERIALES Y MÉTODOS Material vegetal. La especie estudiada fue Coffea canephora Pierre ex Froehner variedad Robusta. Se utilizaron 3 genotipos promisorios: M-229, K-234 y M-28 del banco de germoplasma de la Estación Central de Investigaciones de Café y Cacao (ECICC). Se utilizaron hojas de plantas (fuente de los explantes) establecidas en campo de 2 años de edad, sembradas a una distancia de 3 m x 2 m, para una densidad de plantación de 1667 plantas/ha, bajo sombra de Piñón florido (Gliricidia sepium J.) y pretratadas con el fungicida benomyl (1,5 g.L-1) periódicamente durante 15 días antes del muestreo. Las muestras se seleccionaron desde el segundo al cuarto nudo, atendiendo a la parte media y superior de la planta. Para la desinfección, la disección de las
|
|
6
|
|
|
INFLUENCIA DE LA ÉPOCA DEL AÑO EN LA RESPUESTA IN VITRO DEL CAFETO Coffea canephora
|
|
hojas y el tamaño de los explantes se tuvo en cuenta lo recomendado en la metodología propuesta por Santana (1993) al evaluar estos aspectos en C. canephora variedad Robusta.
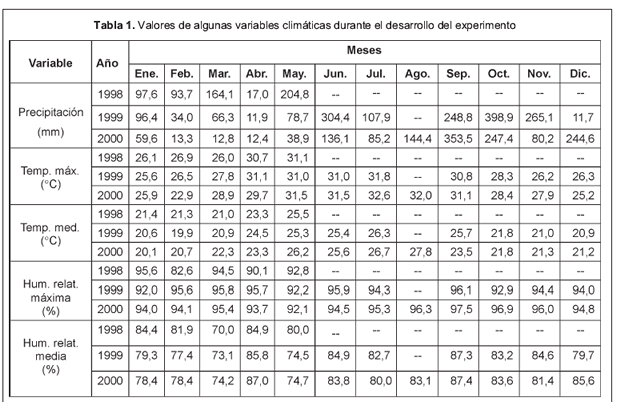
Condiciones climatológicas. Las condiciones del clima para el período evaluado y para algunas de las principales variables climáticas se reflejan en la tabla 1.
Condiciones experimentales generales. En
los bioensayos se utilizaron como medio basal las sales minerales del medio de cultivo de Murashige y Skoog (1962), a una concentración de 10 mL.L-1, su-plementado con mioinositol (100 mg.L-1), vitaminas de Morell (4 mg.L-1), cisteína-HCl (25 mg.L-1) y sacarosa (30 g.L-1). Se utilizó como agente gelificante gelrite (2 g.L-1). Como reguladores del crecimiento se utilizaron la kinetina (2 mg.L-1) y el 2,4-D (0,5 mg.L-1). El pH se ajustó a 5,7 y la esterilización se realizó en autoclave a 121 °C, durante 15 minutos y 1,2 kg.cm-2. Se utilizaron tubos de cultivo de 15 cm de largo por 2,5 cm de ancho, con tapones de goma, contentivos de 15 mL del medio de cultivo.
|
Los explantes se inocularon en el medio de formación de callos descrito anteriormente por un período de 12 semanas. Se utilizó un diseño Completamente Aleatorizado, se sembraron 100 explantes por tratamiento y se incubaron en la oscuridad a temperatura de 27 ± 1 °C. Se realizaron 5 repeticiones por tratamiento y 3 repeticiones del experimento en el tiempo.
Evaluación de la influencia de la época del año en la respuesta de los explantes. Con la finalidad de evaluar el efecto de la época del año en la respuesta de los explantes cultivados se realizaron muestreos en los 3 genotipos estudiados durante todos los meses del año.
En el momento de la colecta se seleccionaron muestras foliares para determinar la actividad enzi-mática peroxidasa, para lo cual se tomaron discos de hojas de aproximadamente 0,25 g, se congelaron en nitrógeno líquido y se homogenizaron en 2 mL de tampón fosfato 50 mM pH 7,8 que contenía 0,1 mM de Na2EDTA, 1,5% (p/v) de PVPP y 0,1% (v/v) de Triton x 100. El homogenato se centrifugó a 10 000 g- 4 °C durante 10 minutos. Se recolectó el
|
 |
|
|
7
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL .VII No. 1 Julio 2005 5-14
|
||
|
|
||
|
sobrenadante y se guardó a -20 °C hasta el momento del análisis. La actividad peroxidasa se determinó por el método de Bergmeyer (1974) citado por Mazorra et al. (2002). La unidad de actividad enzimática peroxidasa se definió como la cantidad de enzima que causa un incremento de 0,1 en la absorbancia por cada minuto de reacción a 25 °C.
A los 60 días de cultivo se determinó la formación de callos (%) y el contenido de proteínas totales (mg.g-1). Para el estudio de este último indicador, se tomaron 25 callos por cada tratamiento. Se maceraron en un mortero con sílice a °C, luego se le añadió 1 mL de buffer tris-125 mM, pH 6,8, Na Cl-50 mM. Se centrifugó a 3000 rpm durante 30 minutos, se tomó el sobrenadante y se guardó a -20 °C en tubos Eppendorf hasta el momento del análisis. La cuantificación del contenido de proteínas totales se realizó por el método de Bradford (1976). La lectura de absorbancia de las muestras se realizó a 595 nm en un fotocolorímetro Spekoll 11, para lo cual se realizó una curva patrón de albúmina bovina (BSA) a partir de una solución de 1 mg.mL-1.
A los 90 días de cultivo se evaluó la contaminación fúngica (%) y el porcentaje de oxidación; se consideraron callos oxidados los que mostraron en mayor o menor grado una coloración carmelita, debido al oscurecimiento del tejido.
En el caso de las determinaciones bioquímicas se conformaron 3 muestras por tratamiento y a cada muestra se le hicieron las determinaciones por triplicado. El resto de los indicadores se evaluó en 50 explantes por tratamiento.
|
la prueba de Rangos Múltiples de Duncan al 5%, para la comparación de las medias, utilizando el programa Statgraphics (1996).
RESULTADOS Y DISCUSIÓN
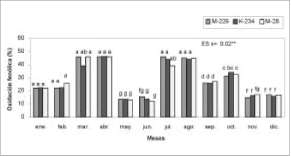
La evaluación del posible efecto de los factores genotipo y época del año sobre la actividad enzimática peroxidasa en muestras foliares, mediante un análisis bifactorial, arrojó la existencia de diferencias significativas en su interacción (figura 1), loque permitió la comparación entre las variantes estudiadas.
Los mayores valores de actividad peroxidasa en el primer semestre se obtuvieron en el mes de marzo en el genotipo M-229, con valores que difirieron estadísticamente de los obtenidos en K-234 y M-28 para este momento; el genotipo K-234 en los meses de marzo y abril mostró valores que no difirieron entre sí, pero que se diferenciaron significativamente de lo alcanzado en M-28 para ambos meses y de M-229 para abril. A la vez, es de destacar que los genotipos M-229 y M-28 durante estos 2 meses mostraron un comportamiento similar ante la variable evaluada. Este comportamiento de los máximos valores de actividad enzimática coincidió con la época de floración y fructificación temprana de las plantas; al parecer, los procesos fisiológicos que tienen lugar durante estas fases del cultivo hacen que se incremente el grado de activación de esta enzima que desempeña un papel fundamental en los procesos relacionados con el crecimiento (Paterson et al., 1990) y la lignificación de los frutos (Alba, 1998). De aquí que para este semestre los meses de enero, febrero, mayo y junio favorecieron la selección de las
|
|
|
|
||
|
A todas las variables se les comprobó su normalidad por el método de Shapiro y Wilk, mediante la versión simplificada por Shapiro y Francia (1972). Para el análisis estadístico, los datos originales de las variables expresadas en % se transformaron mediante la fórmula arcsen %. A los valores de las diferentes variables se les realizó un análisis de varianza bifactorial, utilizando el procesador estadístico Start (Ver 4.10); se consideraron los factores genotipo y mes.
|
 |
|
|
En los casos en que se observaron diferencias significativas, se aplicó
|
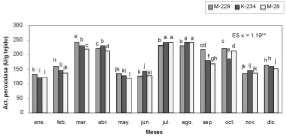
Figura 1. Actividad peroxidasa en muestras foliares de C. canephora var. Robusta.
|
|
|
8 |
||
|
INFLUENCIA DE LA ÉPOCA DEL AÑO EN LA RESPUESTA IN VITRO DEL CAFETO Coffea canephora
|
|
|
fuentes de los explantes, al caracterizarse por los valores más bajos de actividad peroxidasa, que oscilaron entre 121,9 y 159,7 U/g de tejido y se diferenciaron de los anteriormente mencionados.
Estas variaciones observadas en los niveles de la actividad enzimática se corresponden con las obtenidas por Marinescu et al. (2000), que encontraron diferencias significativas entre los valores de actividad peroxidasa en muestras foliares de chirimoya (Annona cherimola Mill.), procedentes de plantas en diferentes fases de cultivo. Por otra parte, Penel et al. (2001) al realizar la caracterización bioquímica del proceso de inducción floral en espinaca (Spinacia oleracea) obtuvieron un incremento significativo de la actividad peroxidasa, dada la activación de este sistema en dicho proceso, el cual se relacionó directamente con las variaciones observadas para el sistema peroxidasa en hojas.
Durante el segundo semestre se obtuvieron diferencias significativas entre los tratamientos, para p<0,01. Los mayores niveles de actividad enzimática se presentaron en los meses de julio y agosto para los genotipos K-234 y M-28, valores que difirieron de los alcanzados durante estos meses en el genotipo M-229 y similares a los alcanzados para este mismo material en el mes de marzo; se observó una considerable variación en el comportamiento de los genotipos evaluados, con relación a la época del año. El incremento de la actividad de esta enzima en este período, pudiera estar asociado al desarrollo de otros estados fisiológicos de la planta, como la senescencia y maduración de los frutos. Algunos autores han informado acerca del papel de las peroxidasas en estos procesos (Hua-Zhi y Guang-Qing, 1993; Quiroga et al., 2000) y destacan la existencia de fluctuaciones en los valores de su actividad. Así, Thakur y Pandey (1999), al evaluar la actividad peroxidasa en frutos de diferentes cultivares de tomate (Licopersicon esculentum Mill.) encontraron variaciones significativas. Se observó que para el resto de los meses y los 3 genotipos los valores de actividad enzimática resultaron inferiores; en noviembre y diciembre fueron de 137,5 y 164,3 U/g de tejido, que se diferenciaron de los obtenidos en julio y |
agosto y favorecieron, a su vez, la calidad de los explantes. Los resultados permitieron establecer la interrelación entre componentes genéticos y ambientales y su influencia en la fisiología y modificaciones que muestran las plantas en su desarrollo, en este caso expresado a través de la actividad peroxidasa (Brownleader et al., 1994). Es de destacar que este pudiera constituir un importante indicador para definir la época de selección de las muestras, a fin de garantizar una mejor respuesta en los explantes, conociendo el papel de las enzimas peroxidasas en las reacciones de oscurecimiento. Con relación a la contaminación fúngica, se obtuvieron los valores más bajos (5,3-7,9%) en los meses de enero, febrero, mayo, junio, octubre, noviembre y diciembre, para los 3 genotipos, los que se diferenciaron estadísticamente (p<0,01) del resto de los porcentajes y resultaron los más favorables en el establecimiento de los explantes in vitro. Los índices de contaminación más elevados, para los 3 genotipos, se presentaron en el mes de abril, seguido por agosto en el cual, aunque presentó diferencias significativas con respecto a los valores alcanzados en abril para los genotipos M-229 y K-234, los valores mostrados difirieron de los encontrados en los meses restantes. La contaminación en los meses de abril y agosto osciló entre 17,2 y 20,9% (figura 2); la presencia de estas afectaciones en el material vegetal, durante los meses señalados, pudiera deberse a la influencia de las condiciones ambientales, asociada a incrementos de la humedad relativa y la temperatura, respectivamente, lo que pudo haber acentuado y favorecido la proliferación de microorganismos |
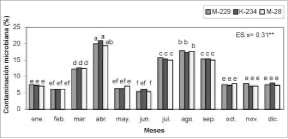 Figura 2. Contaminación fúngica en el establecimiento in vitro de explantes de C. canephora var. Robusta |
|
| 9
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL .VII No. 1 Julio 2005 5-14
|
||
|
contaminantes e incidido negativamente en la respuesta in vitro del material cultivado.
De forma general, los niveles de contaminación resultaron bajos en comparación con los informados por González et al. (1998) al trabajar con el híbrido de cafeto Velasco-5, en el cual se alcanzaron porcentajes de contaminación bacteriana y fúngica del 60 y 83 %, respectivamente. Resultados similares se han obtenido en estudios en guayabo (Viloria, 1993) y otras especies con altos porcentajes de este indicador, como: 85% en chayote (Somarribas et al., 1991) y 75% en yerba mate (Rey et al., 1991); esto provoca pérdidas significativas en la fase de establecimiento in vitro del material vegetal.
Los menores índices de contaminación en este estudio pudieran atribuirse al tratamiento de las plantas donantes con el fungicida benomyl antes de la toma de las muestras. Con relación a este aspecto, algunos autores han destacado la importancia de esta práctica dada la alta concentración de microorganismos contaminantes en especies leñosas y semileñosas (De Winnaar, 1997), así como la dificultad, que en ocasiones se presenta, para su control con el empleo de protocolos convencionales de desinfección. La oxidación fenólica es otro de los inconvenientes que se presenta durante el cultivo de tejidos de cafeto, ya que los compuestos fenólicos se enlazan a las proteínas, las inactivan e inhiben el crecimiento de los tejidos del explante (Vaugh, 1984). En este caso, hubo diferencias significativas para los factores analizados y la interacción. Los índices más bajos se presentaron para los genotipos M-229, K-234 y M-28 y los meses de mayo y junio; con valores que oscilaron entre 12 y 15,3% y difirieron significativamente (p<0,01) de los alcanzados en el resto de las combinaciones (figura 3), exceptuando el genotipo M-28 en el mes de noviembre, que mostró porcentajes de oxidación que no difirieron del comportamiento descrito anteriormente; estos resultados facilitaron la obtención de explantes de mayor calidad. Los valores de oxidación obtenidos en los meses de noviembre y diciembre y los genotipos M-229 y K-234 se diferenciaron de los antes |
mencionados, pero se consideraron favorables. Durante enero y febrero, M-229 y K-234 mostraron un comportamiento similar, con porcentajes que no superaron el 23%; mientras que el genotipo M-28 difirió de lo observado, con valores de oxidación superiores.
Los porcentajes más altos de oxidación fenólica se observaron en los meses de marzo y abril y en los 3 genotipos (38,9-46,2%) durante el primer semestre, así como en julio y agosto (39,1-45,9%) y en los diferentes genotipos para el segundo semestre del año. A la vez, hubo correspondencia entre estos resultados y los del análisis para la actividad peroxidasa en igual época del año, indicativo de que para las condiciones estudiadas estos meses no resultaron adecuados para la selección de las fuentes de los explantes, dadas las afectaciones observadas en los mismos.
Los índices de oxidación fenólica obtenidos pudieran deberse a que el cultivo del cafeto se caracteriza por presentar alto contenido de compuestos fenólicos, como ácido cafeico y ácido clorogénico, que al oxidarse por acción de las peroxidasas originan la producción de quinonas, polimerizaciones que a su vez dan lugar a compuestos oscuros conocidos como melanodionas e influyen en la proliferación del material cultivado (Comptom y Perece, 1986), provocando una necrosis irreversible en los tejidos vegetales. En este sentido, Takahama et al. (2002) encontraron que en hojas de tabaco (Nicotiana tabacum) los compuestos fenólicos son formados en el apoplasto por el sistema ácido clorogénico-enzima peroxidasa; esto comprueba que el H2O2 requerido para la reacción es garantizado por el propio sistema y por la autooxidación de los compuestos
|
|
|
10 |
||
|
INFLUENCIA DE LA ÉPOCA DEL AÑO EN LA RESPUESTA IN VITRO DEL CAFETO Coffea canephora |
||
|
fenólicos, lo que facilita la reacciones de oscurecimiento.
Otros autores han informado similares afectaciones por oxidación fenólica en el cafeto; Van Boxtel y Berthouly (1996), en trabajos con C. canephora genotipo 202, señalaron una disminución considerable en el porcentaje de callos de alta frecuencia de formación de embriones, debido a la oxidación del material, y además indicaron que el grado de oxidación fenólica puede llegar a ser determinante en el proceso de embriogénesis somática. Por su parte, García y Rafael (1990) destacaron la marcada presencia de oxidación fenólica (90% a los 30 días de cultivo) durante el establecimiento de microesquejes de cafeto Catimor, la que fue disminuida al colocar las plantas donantes a baja intensidad lumínica y realizar pretratamiento a los explantes con una mezcla antioxidante de ácido ascórbico y ácido cítrico, previo a su cultivo en medio con cisteína. En este sentido, resultaría ventajoso definir la época más favorable para la toma de las muestras, evitando tratamientos secundarios al material vegetal, así como el empleo de productos químicos que hacen más costoso el proceso de multiplicación.
Con relación al comportamiento del contenido de proteínas totales a los 60 días de cultivo en las muestras de callos procedentes de los genotipos M-229, K-234 y M-28, se detectaron diferencias significativas para la interacción de los factores analizados (figura 4); los máximos valores (3,60-3,71 mg.g-1) se alcanzaron en el período de mayo-junio en los 3 genotipos, con niveles que no difirieron entre sí; estos valores se diferenciaron de los obtenidos en el resto de las combinaciones, los que oscilaron entre 1,11 y 2,99 mg.g-1, exceptuando el genotipo |
K-234 en el mes de febrero que no mostró diferencias.
Los niveles de proteínas alcanzados en los diferentes genotipos en los meses de agosto, septiembre y octubre se caracterizaron por ser los más bajos, oscilando entre 1,11 y 2,75 mg.g-1. Es de destacar que el genotipo M-28 mostró un comportamiento variado en el mes de octubre, con valores de proteínas similares a los alcanzados en las combinaciones que mostraron un comportamiento intermedio; difirió de lo observado en los restantes genotipos en los meses analizados. Sin embargo, para el mes de julio se observaron, en este mismo genotipo, valores de proteínas inferiores, diferenciándose de M-229 y K-234 para el período mencionado.
Los mayores valores de proteínas, en los meses y genotipos señalados, pudieran ser atribuidos a que se lograron explantes que, por las características fisiológicas de la fuente de procedencia, expresaron un mayor nivel proteico ante determinadas condiciones nutritivas in vitro, lo cual a la vez se correspondió con la elevada multiplicación y división celular que tuvo lugar en la etapa de cultivo señalada. Al respecto, Smith (1992) afirma que de esta forma se asegura el mantenimiento y ensamblaje de las nuevas estructuras celulares, condiciones que garantizarían índices aceptables de regeneración de embriones somáticos, en etapas posteriores.
Los resultados obtenidos fueron similares a los alcanzados por Cevallos (2000) al evaluar este indicador en callos de igual tiempo de cultivo en las especies C. arabica var. 9723 y C. canephora var. Robusta, donde se alcanzaron valores promedio de 3,57 y 3,82 mg.g-1, respectivamente.
|
|
 Figura 4. Concentración de proteínas totales en callos C. canephoravar. Robusta. |
Estos resultados sugieren que para la selección de las muestras deben considerarse varios aspectos a fin de lograr una respuesta adecuada en los explantes, que garantice una elevada multiplicación celular, con sus efectos positivos sobre el desarrollo del cultivo; en este sentido, se conoce que el contenido de proteínas de las células está estrechamente relacionado con la viabilidad celular.
Con relación a la formación de callos, se detectó interacción significativa
|
|
|
11
|
||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL .VII No. 1 Julio 2005 5-14
|
|
|
entre los meses del año y los genotipos (tabla 2); se obtuvieron valores que oscilaron entre 40 y 97,9%. Los porcentajes de este indicador resultaron superiores en el genotipo M-229 y los meses de mayo-junio, con valores que difirieron de lo alcanzado en el resto de las combinaciones, seguido por el K-234 para estos mismos meses. Sin embargo, para la formación de callos, en los meses de enero y febrero no se encontraron diferencias significativas entre los genotipos anteriormente mencionados, alcanzándose valores favorables para esta variable. Durante noviembre y diciembre, un comportamiento similar se observó entre M-229 y K-234, pero con valores que oscilaron del 88 al 89%, detectándose una disminución en la respuesta de los explantes.
Se encontró que, con valores que difirieron de los obtenidos en las combinaciones anteriores, el genotipo M-28 y los meses de mayo, junio, enero, febrero, noviembre y diciembre presentaron porcentajes entre 76 y 80%, evidenciándose una menor respuesta de este genotipo, que también resultó favorecido con estos meses.
Para los meses de abril, julio y agosto y los genotipos estudiados la formación de callos resultó inferior al 43%, difiriendo estadísticamente de las variantes anteriores; se infiere que estos meses no resultaron favorables para la selección de las muestras procedentes de los genotipos estudiados, aspecto corroborado por el comportamiento observado en los explantes. Las combinaciones restantes mostraron valores que superaron el 57% de formación de callos y se diferenciaron de las descritas anteriormente.
Aunque pocos trabajos relacionados con esta temática se han publicado en los últimos años, estos aspectos deben tenerse presentes en los trabajos de
|
micropropagación, ya que al considerar estos factores desde las etapas tempranas del proceso, se contribuiría a garantizar una mayor eficiencia en la multiplicación.
Al analizar los resultados de forma integral se evidenció que para los genotipos evaluados, la época del año influyó en la respuesta de los explantes cultivados in vitro. Al respecto, Murashige y Skoog (1974) destacaron que el estado de la planta madre y la estación del año en la cual el explante es tomado podrían influir en el potencial morfogenético del material cultivado.
Con todo lo expuesto se demostró que para las condiciones estudiadas resultó favorable la toma de las muestras foliares en los períodos mayo-junio, enero-febrero y noviembre-diciembre, dados los bajos índices de actividad enzimática peroxidasa, oxidación fenólica y contaminación fúngica, así como un elevado porcentaje de formación de callos y mayor contenido de proteínas totales presentes en los mismos. Este comportamiento fue corroborado por las características de los callos con relación al color y la consistencia; para los períodos señalados predominó la tonalidad blanco-cremoso y amarillo, así como una textura friable, aspectos que facilitan la selección de explantes de mayor calidad y, por tanto, el potencial de obtener callos de alta capacidad em-briogénica. Otros autores, al emplear callos con características semejantes, han logrado establecer eficientes protocolos de regeneración de embriones somáticos en varios genotipos de C. canephora y C. arabica (Van Boxtel y Berthouly, 1996; Santana, 1999).
Lograr optimizar la fase inicial de callogénesis en las especies sometidas al proceso de embriogé-nesis somática, a través del estudio de la influencia
|
|
|
|
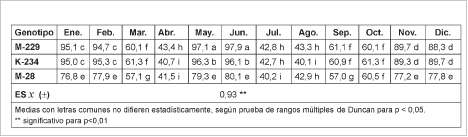 Tabla 2. Formación de callos en los genotipos de C. canephora var. Robusta (%)
|
|
|
12
|
|
|
INFLUENCIA DE LA ÉPOCA DEL AÑO EN LA RESPUESTA IN VITRO DEL CAFETO Coffea canephora
|
|
|
|
|
|
de la época del año, resulta de gran interés ya que ello contribuye a obtener callos de mayor calidad y alto potencial embriogénico; esta es la base principal para la obtención de los embriones somáticos que posteriormente se convertirán en plantas, lo que constituye un indicador de la eficiencia del cultivo in vitro.
CONCLUSIONES
La época del año en que se tomó la muestra ejerció un marcado efecto en la respuesta de los explantes de los genotipos evaluados.
Para las condiciones estudiadas resultó favorable la toma de las muestras foliares en los períodos mayo-junio, enero-febrero y noviembre-diciembre, dados los bajos índices de actividad enzimática peroxidasa, oxidación fenólica y contaminación fúngica, así como un elevado porcentaje de formación de callos y mayor contenido de proteínas totales presentes en los mismos.
La actividad enzimática peroxidasa pudiera constituir un importante marcador de selección en la etapa inicial de selección de las muestras.
BIBLIOGRAFÍA
Alba, C. M. 1998. Isoperosidases and laccase like enzymes related with indole-acetic oxidation activity and lignifica-tion on peach fruits (Prunus persica L. Batsch cv. Red-haven). Plant Perox Newslett. 11: 47.
Berros, B.; Álvarez, C.; Rodríguez, R. 1997. Effect of putreci-ne-synthesis inhibitors on somatic embryogenesis in hazelnut. Journal of Experimental Botany. 71: 85-90.
Berthouly, M.; Michaux-Ferriere, M. 1996. High frecuency somatic embryogenesis in Coffea canephora. Induction conditions and histological evolution. Plant Cell Org. Cult. 44: 169-176.
Braddford, M. M. 1976. A rapid and sensitive method for the quantition of protein utilizing the principle of protein Dye Binding. Analitical Biochemestry. 12: 248-254.
Brownleader, M. D., Ahmed, N.; Trevan, M.; Chaplin, M.; Dey, P. M. 1994. Astudy of extensin and extensin peroxida-se. Plant Perox Newslett. 4: 3-15.
Castillo, B.; Smith, M. A.; Madhari, D. 1997. Interactions of irradiance level and iron chelate source during scot tip culture of Carica papaya L. Hort Science. 32 (6): 1120-1123.
Castro, V.; Carner, R.; Ruiz, G. 1998. Micropropagación de Olivo (Olea europaca L.). En: III Encuentro Latinoamericano de Biotecnología Vegetal, REDBIO-98. La Habana, 1-5 junio, 516 p.
|
Cevallos, M. 2000. Establecimiento de una metodología eficiente en el proceso de embriogénesis somática del cafeto. Tesis de grado (doctor en Ciencias Agrícolas). INCA, San José de las Lajas. 186 p.
Comptom, M. E.; Perece, J. E. 1986. Exudation and explant establishment. News Letter. International Association for Plant Tissue Culture, No. 50. Feature Article 1.
De Winnaar, W. 1997. Micropropagation of Carica papaya L. J. Ame. Soc. Hort. Science. 156: 735-738.
Díaz-Sala, C.; Besford, R. T., Rey, M.; Rodríguez, R. 1995. Variations in the DNA-methylation and polipeptide pat-terns of adult hazel associated with sequential in vitro subcultures. Plant Cell Reports. 15: 218-221.
Dodds, J. H. 1983. Tisue culture of trees. AUI. Publishing. west port. Connecticut (EE.UU.).
García, E.; Rafael, M. 1990. Control de la oxidación y contaminación en microesquejes de café (Coffea arabica "Cati-mor") cultivados in vitro. Agronomía Tropical. 40 (4-6): 281-290.
González, M. E.; Cabrera M.; López, C. 1998. Contaminación y oxidación fenólica en la micropropagación del cafeto Velasco-5 (Coffea arabica L. x Coffea canephora P.). Fondo Nacional de Manuscritos, Cuba. 11 p.
Hua, Zhi; Guang-Qing, W. 1993. Changes in activities of pero-xidase and esterase in wheat heads infected by Fusa-rium graminearum. Abstracts of Congress of Phytopat-hology. 1(48).
INCA. Start: Sistema automático para análisis estadístico (versión 4.10, 1998). INCA (disquete).
Marinescu, G.; Badea, E.; Babeanu, C.; Glodeanu, W. 2000. Peroxidase system activity in leaves of Annona cheri-mola as marker of growth stimulant treatment. Disponible en http://www.ecom5.slu.se./ABSTRACTS/abs-tract.htm. Revisado: 21/09/02.
Mazorra, L. M.; Núñez, M.; Hechavarría, M.; Coll, F.; Sánchez-Blanco, M. J. 2002. Influence of brassinosteroids on antioxidant enzymes activity in tomato under diffe-renttemperatures. Biologia Plantarum. 45 (4): 593-596.
Murashige, T.; Skoog, F. 1962. A revised medium for rapid growth and bioassoys whith tobbaco tissue cultures. Physiol Plants. 15: 473-497.
Murashige, T.; Skoog, F. 1974. Plant propagation through tissue cultures. Ann. Plant Physiol. 25: 135-166.
Paterson , A. H.; Bouthyette, P. Y.; Sorrells, M. E. 1990. Varia-tion in peroxidase isozymes during grain maturation in wheat genotypes near-isogenic for grain dormancy fac-tors. Cereal Res Commun. 18: 209-215.
Penel, C.; Diogon, T.; Simon, P.; Greppin, H. 2001. Characte-rization of peroxidase genes in Spinacia oleracea. http://www.gene.co.ge. Revisado: 11/03/03.
Pírela, M.; Mogollón, N. 1996. In vitro propagation of guava (Psidium guajava L.) cv. Mara-7 from stem shoots of cv. Mara-7. Acta Horticulturea: 452: 47-52.
Quiroga, M.; Guerrero, C.; Botella, M.; Barcelo, A.; Amayi, I.; Medina, M.; Alonso, F.; Forchetti, S.; Tigier, H.; Val-puesta, V.; Forchetti, S. M. 2000. A tomato peroxidase
|
|
13
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL .VII No. 1 Julio 2005 5-14
|
|
|
|
|
|
involved in the syntesis of lignin and suberin.
Plant-Physiology. 122 (4): 1119-1127. Rey, M.; Díaz Sala, C.; Rodríguez, R. 1994. Comparison of
endogenous polyamine content in hazel leaves and
buds between the annual dormancy and flowering pha-
ses of growth. Physiologia Plantarum. 91: 45-50. Santana, N. 1993. Embriogénesis somática en el cultivo del
cafeto (Coffea sp.) Tesis de Grado (doctor en Ciencias
Agrícolas). INCA, San José de las Lajas. 124 p. Santana, N. 1999. Avances y perspectivas en la obtención de
la semilla artificial de café. En: I Simposio Internacional
de Café y Cacao Cubacafé' 99, Santiago de Cuba
(25-27 noviembre). 94 p. Shapiro, S. S.; Francia, R. S. 1972. An approximate analysis
of variance test for normality. Journal of the American
Statistical Association. 67: 215-216. Smith, R. H. 1992. Planttissue culture, techniques and experi-
ments. Academic Press. 170 p. Somarribas, G., Sandoval, J.; Müller, L. 1991. Propagación
vegetativa del chayote (Sechium edule (Jacq) Sw).
Fase de establecimiento. Turrialba. 41: 538-544. Styer, D. J.; Chin, C. K. 1983. Meristem and shoot tip culture
for propagation, patogen elimination and germoplasm
preservation. In: Horticultural. Reviews. Volume 5 (J.
|
Janick, ed.) west por Connecticut. AUI Publishing Co. 221-277.
Surga, J. G.; Guevara, Y. 1994. Pruebas de desinfección para controlar la contaminación bacteriana en el cultivo in vi-tro de ápices caulinares de banano (Musa AAA). Fitopatología Venez. 7 (1): 14-17.
Takahama, U.; Hirotsu, M.; Oniki, T. 2002. Mechanism of the oxidation of chlorogenic acid in the apoplast on aging of Tobacco leaves. http://www.phisiol.se./abstract.htm. Revisado: 11/03/03
Thakur, A.; Pandey, M. 1999. Changes in oxidativ estress enz-ymes in fruits of different cultivars of tomato (Licopersi-com esculentum Mill) during ripenning. Indian Journal of Plant Phisiology. 4 (4): 293-296.
Van Boxtel, J.; Berthouly, M. 1996. High frequency somatic embryogenesis from Coffee leaves factors influencing embryogenesis and subsequent proliferation and rege-neration in liquid medium. Plant Cell Tiss. Org. Cul. 44: 7-17.
Vaugh, K. C. 1984. Function of polyphenol oxidate in higher plants. Physiol. Plant. 60: 106-112.
Viloria, V. 1993. Cultivo in vitrode nudos de guayabo (Psidium guajava L.). Fase I. Trabajo de ascenso. La Universidad del Zulia, Facultad de Agronomía. Maracaibo, Venezuela. 35 p.
|
|
14
|
|
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2005 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).